Кислород в воде находится в виде гидратированных молекул О2. Содержание растворённого кислорода (РК) зависит от температуры, атмосферного давления, степени турбулизации воды, количества осадков, минерализации воды и т.п. Растворимость кислорода возрастает с уменьшением температуры и минерализации и с увеличением атмосферного давления.
В поверхностных водах содержание РК может колебаться от практического отсутствия до 14 мг/л и подвержено значительным сезонным и суточным колебаниям. В эвтрофированных и сильно загрязнённых органическими соединениями водных объектах может иметь место значительный дефицит кислорода. Уменьшение концентрации РК до 2 мг/л вызывает массовую гибель рыб и других гидробионтов.
Растворённый кислород является неустойчивым компонентом химического состава вод. При его определении особо тщательно следует проводить отбор проб: необходимо избегать контакта воды с воздухом до фиксации кислорода (связывания его в нерастворимое соединение).
Измерение концентрации растворённого кислорода в воде очень важно при эксплуатации котлового оборудования, когда при высоких температурах парового цикла даже малые концентрации кислорода могут привести к серьёзным проблемам вследствие процессов коррозии. Многие факторы в работе теплоэнергетического оборудования могут привести к изменению концентрации кислорода в рабочих средах. К таким факторам относятся колебания давления пара и конденсата, состояние форсунок, изменение расхода подачи воды, попадание воздуха. Это вызывает необходимость текущего (оперативного) контроля именно малых концентраций кислорода (до 100 мкг/л) в соответствующих потоках котлового оборудования.
Процессы очистки сточных вод, протекающие с использованием активного ила, или технологии выращивания рыбы и т.п., требуют непрерывной подачи кислорода. Недостаточное снабжение кислородом замедляет деятельность бактерий и ухудшает эффективность очистки по нескольким показателям, а также приводит к значительному увеличению энергозатрат очистных сооружений. Аналогично, при ухудшении обеспеченности кислородом воды замкнутых ёмкостей при разведении малька и молоди рыб может наблюдаться снижение продуктивности процессов выращивания, накопление в воде гнилостных продуктов, заморы рыбы и т.п.
В воде водоёмов в любой период года до 12 часов дня концентрация РК должна быть не менее 4 мг/л. ПДК растворённого в воде кислорода для рыбохозяйственных водоёмов установлена 6 мг/л (для ценных пород рыбы), либо 4 мг/л (для остальных пород).
В процессе биохимического окисления органических веществ в воде происходит снижение концентрации растворённого кислорода (РК), и эта убыль косвенно является мерой содержания в воде органических веществ. Соответствующий показатель качества воды называется биохимическим потреблением кислорода (БПК).
БПК — количество кислорода в миллиграммах, требуемое для окисления находящихся в 1 л воды органических веществ в аэробных условиях, без доступа света, при 20°С, за определённый период в результате протекающих в воде биохимических процессов.
Обычно определяют БПК за 5 суток инкубации (БПК5), однако содержание некоторых соединений более информативно характеризуется величиной БПК за 10 суток или за период полного окисления (БПК10 или БПКПОЛН. соответственно).
В поверхностных водах величина БПК5 колеблется в пределах от 0,5 до 5 мг/л; она подвержена сезонным и суточным изменениям, которые, в основном, зависят от изменения температуры и от физиологической и биохимической активности микроорганизмов. Весьма значительны изменения БПК5 природных водоёмов при загрязнении сточными водами.
Предельно-допустимое значение для БПКПОЛН. составляет:
- для водоёмов хозяйственно-питьевого водопользования — 3 мг/л;
- для водоёмов культурно-бытового водопользования — 6 мг/л.
Соответственно те же значения БПК5 составляют примерно 2 мг/л и 4 мг/л.
В настоящей статье мы предлагаем Вам на примере тест-комплекта РК-БПК (артикул 6.081) познакомиться с методом определения массовой концентрации растворенного кислорода (РК) и биохимического потребления кислорода (БПК), реализованным ГК «Крисмас» в ряде производимых компанией лабораторий для анализа воды.




Рабочие условия применения тест-комплекта РК-БПК:
- температура анализируемой воды – от 10 до 30 °С;
- температура воздуха – от 10 до 30 °С;
- относительная влажность воздуха – от 30 до 98%;
- атмосферное давление – не регламентируется.
На изделия ГК «Крисмас» имеются сертификаты соответствия, в частности на
тест-комплект РК-БПК
(см. ниже), его серийный выпуск осуществляется по ТУ 26.51.53-600-82182574-18.

Используемый в основе тест-комплекта РК-БПК метод определения (метод Винклера) широко используется и является общепринятым при санитарно-химическом и экологическом контроле (ПНД Ф 14.1:2:3.101, РД 52.24.419, ИСО 5813).
Определение концентрации РК основано на способности гидроксида марганца (2) окисляться в щелочной среде до гидроксида марганца (4), количественно связывая при этом кислород. В кислой среде гидроксид марганца (4) снова переходит в двухвалентное состояние, окисляя при этом эквивалентное связанному кислороду количество йода. Выделившийся йод оттитровывают раствором тиосульфата натрия в присутствии крахмала в качестве индикатора.
Используемый вариант метода Винклера предполагает определение в аликвотной части фиксированной пробы (50 мл); при расчёте результата определения пренебрегается потери небольшой части пробы при добавлении растворов реагентов в кислородную склянку на этапе фиксации. Тем самым уменьшается расход аналитических растворов и упрощается получение результата анализа, т.к. в расчётной формуле не используется фактический объём кислородной склянки, что создаёт удобства при анализе.
В
тест-комплекте РК-БПК
используется раствор тиосульфата, что соответствует вышеуказанным действующим руководящим документам. Определение РК проводится в несколько этапов. На первом этапе в анализируемую воду добавляют соль Mn (2) и щелочной раствор иодида калия. Mn (2) в щелочной среде реагирует с растворенным кислородом с образованием нерастворимого дегидратированного гидроксида Mn (4) по уравнению:
2Mn2+ + O2 + 4OH– = 2MnO(OH)2 ↓.
Таким образом производится фиксация, т.е. количественное связывание, кислорода в пробе. Фиксация РК, являющегося неустойчивым компонентом в составе воды, должна быть проведена сразу после отбора пробы.
Далее при подкислении пробы раствором серной кислоты протекает химическая реакция с образованием свободного йода в эквивалентных кислороду количествах по уравнению:
MnO(OH)2 + 2I– + 4H+ = Mn2+ + I2 + 3H2O
Затем выделившийся свободный йод титруют раствором тиосульфата натрия в присутствии крахмала, который добавляют для лучшего определения момента окончания титрования. Реакция описывается уравнением:
I2 + 2S2O32– = 2I– + S4O62–
I2 + крахмал → синее окрашивание
О завершении титрования судят по исчезновению синей окраски (обесцвечиванию) раствора в точке эквивалентности. Количество раствора тиосульфата натрия, израсходованное на титрование, является мерой концентрации растворённого кислорода.
В данной модификации метода Винклера определяется содержание фиксированного кислорода в части пробы (50 мл), и объём кислородной склянки при расчёте не используется.
В ходе анализа воды определяют концентрацию РК (в мг/л) и степень насыщения им воды (в %) по отношению к равновесному содержанию при данных температуре и атмосферном давлении.
Мешающее влияние на аналитическое определение РК могут оказывать вещества (взвешенные и окрашенные, биологически активные, восстановители, реагирующие с выделившимся йодом, окислители, выделяющие йод из йодида калия) в концентрациях, встречающихся только в сточных и загрязнённых поверхностных водах.
Влияние нитритов, которые встречаются в природных и сточных водах, устраняют добавлением раствора сульфаминовой кислоты. Определение РК является частью анализа при определении другого важнейшего показателя качества воды — биохимического потребления кислорода (БПК).
Метод определения БПК5 как и в случае определения РК основан на измерении концентрации растворённого кислорода (РК) методом йодометрического титрования по Винклеру в пробе воды до инкубации пробы, а также после неё.
Инкубацию пробы проводят без доступа воздуха в кислородной склянке (т.е. в той же посуде, где определяется значение РК) в течение времени, необходимого для протекания реакции биохимического окисления под воздействием микроорганизмов. Так как скорость биохимической реакции зависит от температуры, инкубацию проводят в режиме постоянной температуры 20±1 °С, причём от точности поддержания значения температуры зависит точность определения БПК.
При исследовании промышленных сточных вод, которые трудно подвергаются биохимическому окислению, используемый метод может применяться в варианте определения полного БПК (БПКПОЛН.).
Поскольку анализ на БПК связан с определением РК, мешающее влияние на результат анализа могут оказывать те же примеси, которые влияют на определение РК (взвешенные и окрашенные вещества, биологически активные взвешенные вещества, восстановители и окислители). Мешающее влияние указанные компоненты оказывают, как правило, в концентрациях, встречающихся только в сточных и загрязнённых поверхностных водах.
Приведённая методика анализа является унифицированным вариантом методик согласно РД 52.24.420, ПНДФ 14.1:2:3:4.123 и ИСО 5815-2 и применима для анализа относительно незагрязнённых природных поверхностных вод, поэтому добавление разбавляющей воды и введение ингибиторов нитрификации не проводится. Поскольку во время инкубационного периода происходит снижение концентрации кислорода в склянках, проводят предварительное аэрирование пробы для насыщения кислородом воздуха.
Для выполнения одного определения концентрации РК необходимо около 150 мл пробы воды, для определения БПК5(3 кислородных склянки) – около 500 мл. Продолжительность выполнения анализа одной пробы на содержание РК БПК (без продолжительности аэрирования и инкубации проб) составляет не более 20 мин.
Диапазон определяемых значений:
- концентраций РК составляет от 1 мг/л до 15 мг/л.;
- БПК5 составляет 1 до 11 мг/л (оптимально — до 6 мг/л).
Особенности операций при работе с кислородными склянками
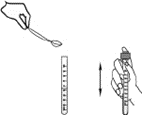
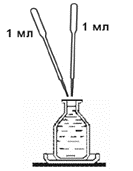
Погружение в кислородную склянку пипетки с фиксирующим раствором осуществляйте на глубину 2–3 см, как показано на рисунке. По мере выливания раствора поднимайте пипетку вверх, фиксируя вводимый объём по изменению уровня заполнения пипетки. Излишек жидкости из склянки при этом стекает через край на подставленную чашку Петри.
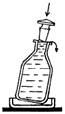
После введения раствора из пипетки склянку слегка наклоните и быстро закройте пробкой. Излишек жидкости стекает через край. В склянке не должно остаться пузырьков воздуха. Склянка не должна оставаться открытой.
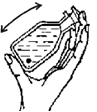
Содержимое склянки перемешивайте встряхиванием помещённой внутрь мешалки.
Оборудование и реагенты
Тест-комплект РК-БПК
представляет собой удобный для переноски, транспортирования и хранения жесткий корпус-укладку, в который компактно размещены необходимые средства измерения, готовые растворы и реагенты, посуда и оборудование, документация.
В основной состав тест-комплекта РК-БПК входят следующие необходимые для выполнения определения компоненты:
Для определения РК
– лабораторная посуда и инструментарий (воронка лабораторная, колба коническая на 100 мл, колба мерная на 50 мл, ложка мерная, мешалка стеклянная (4 шт.), пипетка градуированная на 5 мл и на 10 мл, шприц-дозатор с соединительной трубкой, пипетка полимерная на 1 мл (6 шт.) и на 3 мл, пробирка градуированная с пробкой (2 шт.), склянка кислородная с пробкой вместимостью около 140 мл (3 шт.), термометр с ценой деления не более 0,5°С, трубка гибкая полимерная (сифон), флакон для рабочего раствора тиосульфата натрия, цилиндр мерный с пластмассовым основанием, чашка Петри, перчатки защитные);
– готовые реагенты и растворы.
Примечание. Раствор крахмала стабилизированный имеет срок годности не более 1 месяца при хранении при комнатной температуре. По истечении этого срока необходимо приготовить свежий раствор.
Для определения БПК
– лабораторная посуда (кислородные склянки для инкубирования проб (3 шт.), чашки Петри).
Для расчёта параметров при анализе также необходимы барометр (РК и БПК), мерная колба вместимостью 1 л и термостат-инкубатор, обеспечивающий поддержание температуры 20±1 °С (БПК), а также плитка электрическая (приготовление раствора крахмала), в основной состав тест-комплекта РК-БПК не входят.

Примечание. Не входящие в основной состав изделий оборудование, приборы и инструментарий ГК «Крисмас» поставляет по дополнительным заказам.
Отбор проб и подготовка к анализу
Для отбора проб на РК используются ёмкости из полимерного материала или стекла вместимостью не менее 1 л. Отбор проб с заданной глубины проводят с использованием батометра. Из поверхностных горизонтов допускается отбор проб непосредственно в кислородные склянки.
Примечание. ГК «Крисмас» поставляет проботборные устройства в ассортименте.
Если отбирается общая проба воды для анализов по разным компонентам, то проба для определения РК должна быть первой, взятой для дальнейшей обработки. Водой из отобранной пробы ополаскивают 2–3 раза чистые склянки из состава изделия или (если требуется специальная подготовка проб, например, отстаивание) стеклянные бутыли.
Наполнение кислородных склянок из батометра или бутыли осуществляйте сифоном через полимерную трубку, опущенную до дна склянки. После заполнения кислородной склянки до горлышка продолжайте её наполнение до тех пор, пока не выльется вода, соприкасавшаяся с находившимся в склянке воздухом, и ещё один объём склянки. Трубку вынимайте из склянки, не прекращая тока воды из батометра. Аналогично проводите заполнение склянки из бутыли с анализируемой водой.
Примечание. При наполнении кислородной склянки водой на стенках не должно оставаться пузырьков воздуха.
Отбор пробы непосредственно на водоёме выполняйте следующим образом: измерьте и зафиксируйте значение температуры и атмосферного давления.
Точное измерение температуры и атмосферного давления необходимы для расчёта степени насыщения пробы кислородом (при необходимости).
Отберите пробу воды в кислородную склянку, предварительно поместив туда стеклянную мешалку из состава
тест-комплекта РК-БПК
, заполняя водой весь объём склянки. Закройте склянку пробкой.
Примечание. При наполнении кислородной склянки водой на стенках не должно оставаться пузырьков воздуха.
Сразу после заполнения склянки проведите фиксацию кислорода, как описано ниже в разделе «Выполнение определения растворенного кислорода».
Отбор и подготовка проб при анализе БПК включает несколько этапов.
1.
Предварительный отбор анализируемой воды для проведения аэрации. Отбор воды с поверхностных горизонтов проводят в ёмкости (флаконы, бутыли) из полимерного материала или стекла достаточной вместимости (3–5 л и более). Это позволяет удобно транспортировать анализируемую воду с места отбора на место, где выполняется анализ (базовый лагерь, лаборатория).
При отборе воды с глубинных горизонтов необходимо использовать специальные пробоотборники (батометры) достаточной вместимости.
Примечание. ГК «Крисмас» поставляет емкости для предварительного отбора проб и
проботборные устройства в ассортименте
.
2.
Аэрация анализируемой воды. Проводится для насыщения кислородом воздуха не более чем за 15 мин перед анализом. Перед аэрацией доводят температуру воды до 20±1 °С (нагревают или охлаждают). Для аэрации воду помещают в полимерный или стеклянный сосуд (бутыль, колбу, делительную воронку и т.п.) вместимостью не менее 2 л (аэрируемая вода должна занимать не более 1/3 объёма сосуда), и встряхивают в течение 10 мин.
Примечание. При наличии достаточного количества бутылей для аэрации их можно наполнять на месте отбора проб.
3.
Отбор пробы аэрированной воды в кислородные склянки, в которых далее проводится определение концентрации РК до и после инкубации проводится аналогично описанному выше для определения РК.
Допускается хранение проб в течение не более 1 суток.
Определение РК
Подготовка
Подготовка к определению включает приготовление растворов при истечении срока годности или израсходовании — растворов крахмала и тиосульфата натрия, а также раствора сульфаминовой кислоты.
Приготовление раствора крахмала
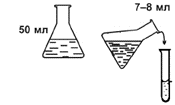
1.
В коническую колбу поместите 50 мл дистиллированной воды. Из колбы перелейте 7–8 мл воды в пробирку.
2.
В пробирку добавьте 3 мерных ложки (без горки) крахмала. Пробирку закройте пробкой, содержимое взболтайте для образования суспензии крахмала.
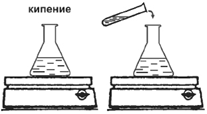
3.
Коническую колбу с оставшимся объёмом воды поставьте на плитку с закрытой спиралью и доведите воду до кипения. В кипящую воду полностью перенесите суспензию из пробирки. Смесь доведите до кипения.
Раствор крахмала охладите и храните во флаконе из-под того же раствора, отметив дату его приготовления на этикетке. Раствор устойчив в течение 4–5 дней. Раствор крахмала после его охлаждения можно стабилизировать добавлением 2–3 капель хлороформа.
Срок годности стабилизированного раствора крахмала — 1 месяц при хранении при комнатной температуре и 4 месяца — при хранении в холодильнике при 2–5 °С.
Примечание. Рекомендуется приготовление свежего раствора крахмала накануне выполнения определений.
Приготовление раствора тиосульфата натрия 0,1 моль/л экв.
При расходовании раствора тиосульфата натрия 0,1 моль/л экв. приготовьте свежий раствор из имеющейся в составе тест-комплекта РК-БПК ампулы стандарт-титра тиосульфата натрия.
Для приготовления раствора с концентрацией 0,1 моль/л экв. содержимое ампулы (флакона) количественно перенесите в мерную колбу вместимостью 1 л (в состав изделия не входит, см. выше), добавьте 300–400 мл дистиллированной воды, перемешайте и затем доведите объём раствора дистиллированной водой до метки.
Отметьте дату приготовления раствора на этикетке.
Срок годности раствора составляет 2 месяца при условии хранения при температуре не выше 25 °С.
Для увеличения срока годности данного раствора, а также приготавливаемого из него рабочего раствора тиосульфата раствор рекомендуется стабилизировать добавлением на 1 л готового раствора нескольких капель хлороформа или около 0,1 г карбоната натрия.
Примечание. Хранение растворов тиосульфата рекомендуется в герметично закрытой посуде с минимальным количеством воздуха, в затемнённом месте, при температуре 2–5 °С.
Приготовление раствора тиосульфата натрия 0,02 моль/л экв. либо 0,05 мол/л экв.
Перенесите в мерную колбу на 50 мл из состава тест-комплекта РК-БПК градуированной пипеткой или мерным цилиндром раствор тиосульфата натрия 0,1 моль/л экв. в объёме:
- для приготовления рабочего раствора тиосульфата 0,02 моль/л экв. — 10 мл;
- для приготовления рабочего раствора тиосульфата 0,05 моль/л экв. — 25 мл.
Доведите объём раствора до метки дистиллированной водой, перемешайте раствор. Отметьте дату приготовления раствора на этикетке. Срок годности раствора — 15 дней.
Приготовление раствора сульфаминовой кислоты
Поместите в пробирку 7,5 мл дистиллированной воды и содержимое 1 капсулы с сульфаминовой кислотой из состава тест-комплекта РК-БПК. Закройте пробирку пробкой, содержимое перемешайте до полного растворения реактива. Для лучшего растворения реактива раствор рекомендуется нагреть до 40–50 °С.
Примечание. Раствор храните в соответствующем флаконе в холодильнике при температуре 2–5 °С не более 3 месяцев.
Выполнение определения РК
При введении растворов в кислородную склянку соблюдайте правила, изложенные в рубрике «Особенности операций при работе с кислородными склянками» (см.выше).
1.
В кислородной склянке со стеклянной мешалкой, заполненной пробой воды, проведите фиксацию кислорода в пробе. Для этого введите в склянку разными пипетками 1 мл раствора соли марганца, затем 1 мл раствора йодида калия щелочного, погружая пипетку с раствором в склянку на глубину 2–3 см. По мере выливания раствора поднимайте пипетку вверх.
2.
Слегка наклоните склянку, закройте пробкой. Излишек жидкости стечёт через край. Следите, чтобы в склянке не осталось пузырьков воздуха. Склянка не должна оставаться открытой.
Перемешайте содержимое склянки с помощью имеющейся внутри стеклянной мешалки, держа склянку в руке. Поместите склянку с зафиксированной пробой в тёмное место для отстаивания (не менее 10 мин и не более 24 ч).
Примечание. Склянку с фиксированной пробой можно хранить в затемнённом месте не более 1 суток.
3.
Для устранения возможного влияния нитритов (при концентрации более 0,05 мг/л) добавьте в пробу полимерной пипеткой 1 мл раствора сульфаминовой кислоты. Далее проведите растворение осадка. Для этого, погружая пипетку в склянку, введите 2 мл раствора серной кислоты (осадок не взмучивать!). Пипетку вынимайте медленно по мере её опорожнения.
4.
Перемешайте содержимое склянки имеющейся внутри мешалкой, удерживая склянку рукой, до полного растворения осадка.
5.
Налейте в коническую колбу до метки «50 мл» часть обработанной пробы из кислородной склянки.
Примечание. Для точности при выполнении данной операции рекомендуется использовать мерный цилиндр из состава тест-комплекта РК-БПК.
6.
Заполните градуированную пипетку рабочим раствором тиосульфата натрия с концентрацией 0,02 моль/л экв. либо 0,05 моль/л экв. и титруйте пробу до слабо-жёлтой окраски.
Затем добавьте пипеткой 1 мл раствора крахмала (раствор в колбе синеет) и продолжайте титровать до полного обесцвечивания раствора.
7.
Определите общий объём раствора тиосульфата натрия, израсходованного на титрование (как до, так и после добавления раствора крахмала).
Массовую концентрацию РК в воде (СРК в мг/л) рассчитайте по формуле:
где Vтс — объём раствора тиосульфата натрия, израсходованного на титрование, мл;
СТС — концентрация рабочего раствора тиосульфата натрия, (0,02 моль/л экв.);
8 — молярная масса эквивалента кислорода, мг/ммоль;
1000 — коэффициент пересчёта единиц измерения (из граммов в миллиграммы);
50 — объём фиксированной пробы, взятый для титрования, мл.
Степень насыщения воды кислородом (R, %) рассчитайте по формуле:
где 100 — коэффициент пересчёта единиц измерения из мг/л в %;
760 — нормальное атмосферное давление, мм рт. ст.;
СР — величина равновесной концентрации кислорода в воде при температуре отбора пробы, определённая по таблице, приведенной ниже;
Р — фактическая величина атмосферного давления в момент отбора пробы, мм рт. ст.
Примечание. При отсутствии данных об атмосферном давлении в момент отбора допускается его принимать равным нормальному (т. е. 760 мм рт. ст.).
Пример расчёта содержания кислорода в воде
При титровании 50 мл пробы израсходовано 0,9 мл раствора тиосульфата натрия концентрацией 0,05 моль/л эквивалента.
Концентрация растворённого кислорода в воде составит:
СРК = 160 × 0,9 × 0,05 = 7,2 мг/л.
Зависимость равновесной концентрации кислорода в воде от температуры при атмосферном давлении 760 мм рт. ст.
|
Температура °С |
Равновесная концентрация растворённого кислорода (в мг/л) при изменении температуры на десятые доли °С (СР) |
|||||||||
| 0 | 0,1 | 0,2 | 0,3 | 0,4 | 0,5 | 0,6 | 0,7 | 0,8 | 0,9 | |
| 0 | 14,65 | 14,61 | 14,57 | 14,53 | 14,49 | 14,45 | 14,41 | 14,37 | 14,33 | 14,29 |
| 1 | 14,25 | 14,21 | 14,17 | 14,13 | 14,09 | 14,05 | 14,02 | 13,98 | 13,94 | 13,90 |
| 2 | 13,86 | 13,82 | 13,79 | 13,75 | 13,71 | 13,68 | 13,64 | 13,60 | 13,56 | 13,53 |
| 3 | 13,49 | 13,46 | 13,42 | 13,38 | 13,35 | 13,31 | 13,28 | 13,24 | 13,20 | 13,17 |
| 4 | 13,13 | 13,10 | 13,06 | 13,03 | 13,00 | 12,96 | 12,93 | 12,89 | 12,86 | 12,82 |
| 5 | 12,79 | 12,76 | 12,72 | 12,69 | 12,69 | 12,52 | 12,59 | 12,56 | 12,53 | 12,49 |
| 6 | 12,46 | 12,43 | 12,40 | 12,36 | 12,33 | 12,30 | 12,27 | 12,24 | 12,21 | 12,18 |
| 7 | 12,14 | 12,11 | 12,08 | 12,05 | 12,02 | 11,99 | 11,96 | 11,93 | 11,90 | 11,87 |
| 8 | 11,84 | 11,81 | 11,78 | 11,75 | 11,72 | 11,70 | 11,67 | 11,64 | 11,61 | 11,58 |
| 9 | 11,55 | 11,52 | 11,49 | 11,47 | 11,44 | 11,41 | 11,38 | 11,35 | 11,33 | 11,30 |
| 10 | 11,27 | 11,24 | 11,22 | 11,19 | 11,16 | 11,14 | 11,11 | 11,08 | 11,06 | 11,03 |
| 11 | 11,00 | 10,98 | 10,95 | 10,93 | 10,90 | 10,87 | 10,85 | 11,82 | 10,80 | 10,77 |
| 12 | 10,75 | 10,72 | 10,70 | 10,67 | 10,65 | 10,62 | 10,60 | 10,57 | 10,55 | 10,52 |
| 13 | 10,50 | 10,48 | 10,45 | 10,43 | 10,40 | 10,38 | 10,36 | 10,33 | 10,31 | 10,28 |
| 14 | 10,26 | 10,24 | 10,22 | 10,19 | 10,17 | 10,15 | 10,12 | 10,10 | 10,08 | 10,06 |
| 15 | 10,03 | 10,01 | 9,99 | 9,97 | 9,95 | 9,92 | 9,90 | 9,88 | 9,86 | 9,84 |
| 16 | 9,82 | 9,79 | 9,77 | 9,75 | 9,73 | 9,71 | 9,69 | 9,67 | 9,65 | 9,63 |
| 17 | 9,61 | 9,58 | 9,56 | 9,54 | 9,52 | 9,50 | 9,48 | 9,46 | 9,44 | 9,42 |
| 18 | 9,40 | 9,38 | 9,36 | 9,34 | 9,32 | 9,30 | 9,29 | 9,27 | 9,25 | 9,23 |
| 19 | 9,21 | 9,19 | 9,17 | 9,15 | 9,13 | 9,12 | 9,10 | 9,08 | 9,06 | 9,04 |
| 20 | 9,02 | 9,00 | 8,98 | 8,97 | 8,95 | 8,93 | 8,91 | 9,90 | 8,88 | 8,86 |
| 21 | 8,84 | 8,82 | 8,81 | 8,79 | 8,77 | 8,75 | 8,74 | 8,72 | 8,70 | 8,68 |
| 22 | 8,67 | 8,65 | 8,63 | 8,62 | 8,60 | 8,58 | 8,56 | 8,55 | 8,53 | 8,52 |
| 23 | 8,50 | 8,48 | 8,46 | 8,45 | 8,43 | 8,42 | 8,40 | 8,38 | 8,37 | 8,35 |
| 24 | 8,33 | 8,32 | 8,30 | 8,29 | 8,27 | 8,25 | 8,24 | 8,22 | 8,21 | 8,19 |
| 25 | 8,18 | 8,16 | 8,14 | 8,13 | 8,11 | 8,11 | 8,08 | 8,07 | 8,05 | 8,04 |
| 26 | 8,02 | 8,01 | 7,99 | 7,98 | 7,96 | 7,95 | 7,93 | 7,92 | 7,90 | 7,89 |
| 27 | 7,87 | 7,86 | 7,84 | 7,83 | 7,81 | 7,80 | 7,78 | 7,77 | 7,75 | 7,74 |
| 28 | 7,72 | 7,71 | 7,69 | 7,68 | 7,66 | 7,65 | 7,64 | 7,62 | 7,61 | 7,59 |
| 29 | 7,58 | 7,56 | 7,55 | 7,54 | 7,52 | 7,51 | 7,49 | 7,48 | 7,47 | 7,45 |
| 30 | 7,44 | 7,42 | 7,41 | 7,40 | 7,38 | 7,37 | 7,35 | 7,34 | 7,32 | 7,31 |
Пример расчёта степени насыщения воды кислородом
Для анализа была отобрана проба воды при температуре 16 °С и атмосферном давлении Р = 735 мм рт. ст.
Определили концентрацию кислорода в воде:
СРК = 7,2 мг/л.
По таблице (см. выше) нашли значение равновесной концентрации кислорода
при t = 16 °С: СР = 9,82 мг/л.
Контроль точности при определении кислорода можно проводить путём анализа пробы, концентрация РК в которой определена с использованием образцового оксиметра.
Примечание. Не входящие в основной состав изделий оборудование, приборы и инструментарий ГК «Крисмас» поставляет по дополнительным заказам.
Выполнение определения БПК
1.
Заполните анализируемой водой, прошедшей аэрирование, 3 кислородные склянки.
2.
В одной из кислородных склянок (контрольной) сразу же определите и рассчитайте исходное (контрольное) содержание кислорода (СК).
Примечание. Промежуток времени между аэрированием пробы и последующей фиксацией кислорода не должен превышать 15 мин.
3.
Две другие склянки (или более, но уже дополнительных к основному составу тест-комплекта РК-БПК) с анализируемой водой (инкубационные) поместите в темноте в кювету термостата пробкой вниз, под водяной затвор.
Примечание. Инкубации подвергается проба в нескольких склянках, т.к. в случае получения ошибочных результатов выполнить анализ повторно окажется невозможно.
4.
Выполните инкубирование проб, непрерывно термостатируя их при температуре 20±1 °С в течение 5 суток (120 ч).
Через 5 суток (в случае определения БПК5) в инкубационных/кислородных склянках определите и рассчитайте содержание растворенного кислорода (Си см. выше). Значение Си рассчитайте как среднее арифметическое значений, полученных для склянок с инкубированной пробой.
5.
Значение БПК5 в мг/л определите по формуле:
где СК — концентрация РК в контрольной склянке, мг/л;
CИ — концентрация РК по истечении периода инкубации, мг/л.
Пример расчёта БПК5
Концентрация РК в контрольной склянке (Ск ) составила 8,8 мг/л. По истечении 5 суток инкубации среднее арифметическое значение концентрации РК (СИ) составило 7,2 мг/л.
Значение БПК5 составляет:
БПК5 = CК – CИ = 8,8 – 7,2 = 1,6 мг/л
Тест-комплект РК-БПК максимально прост и удобен в использовании, позволяет при минимальных затратах осуществлять экспресс-определение массовой концентрации растворенного кислорода (РК) и биохимического потребления кислорода (БПК) в поверхностной воде суши, питьевой и нормативно-очищенной сточной воде.
Большинство анализов с применением тест-комплектов ГК «Крисмас» могут выполнять операторы (инженеры, лаборанты, техники), не имеющие специального химико-аналитического образования, но ознакомленные с правилами техники безопасности, освоившие приведенные методики, имеющие навыки выполнения основных операций (отбора и подготовки проб, приготовления растворов из готовых компонентов, проведения титрования, использования шкал для визуального колориметрирования и др.).
С изделиями, разработанными и производимыми ГК «Крисмас», может работать и менее квалифицированный персонал при условии обязательного практического обучения методикам и технологиям такой работы.
При необходимости в учебном центре ГК «Крисмас» можно пройти краткосрочные курсы по работе с разработанным и производимым компанией оборудованием. По результатам обучения выдается специальный сертификат.
Тест-комплект РК-БПК, как и многие другие производимые компанией
тест-комплекты
, успешно используется при выполнении проектных и учебно-исследовательских работ в курсах химии, биологии, факультативно в экологии, а также в специализированных образовательных организациях при изучении методов и средств водно-химического анализа.
По материалам издания:
Под редакцией к.х.н. Муравьёва А.Г. /Руководство по анализу воды. Питьевая и природная вода, почвенные вытяжки/— Изд. 5-е, перераб. и дополн. — СПб.: «Крисмас+», 2021. — 360 с., илл. ISBN 978-5-89495-268-0
Подробная информация:
Общая информация
Оборудование для анализа воды
Тест-комплекты для анализа воды
Тест-комплект РК-БПК
Для консультации и по вопросам приобретения просьба обращаться:
voda@christmas-plus.ru
8 (800) 302-92-25 (звонок по РФ бесплатный)
8 (812) 575-54-07, 575-55-43
Подписывайтесь на наш канал в Ютюбе!
Вы всегда будете в курсе наших последних новостей и сможете наглядно познакомиться с нашей продукцией.
Растворённый кислород (DO) – это международный термин, обычно используемый при аналитической работе с водой и другими жидкостями для измерения количества кислорода, растворённого в единице объёма жидкого образца (пробы). Это важный показатель степени пригодности пробы воды для того или иного конкретного технологического применения в промышленности, лабораторной деятельности и т. д. В каждой из этих сфер существуют определённые требования к допустимому уровню DO. Расскажем, от чего зависит уровень растворённого кислорода в жидкой среде и каковы методы определения этого важного параметра.
Для чего нужно измерять количество растворённого кислорода
Возьмём простой пример – контроль качества пресной воды для рекреационных целей, таких как плавание и рыбалка. В этом случае мы должны поддерживать в воде высокое содержание DO. Если уровень растворённого кислорода упадет слишком низко, то рыба задохнется, кроме того, условия в воде станут благоприятными для роста вредных бактерий.
При очистке сточных вод твёрдые частицы, находящиеся в воде, могут оседать в больших резервуарах. Чтобы ускорить разложение этих частиц, в резервуары добавляют растворы, богатые бактериями. Для нормального протекания процесса разложения требуется определённый оптимальный уровень DO, он поддерживается за счет механической аэрации так называемого «активного ила» – пропитанного бактериями содержимого бассейнов. Если уровень растворённого кислорода в воде падает слишком низко, бактерии погибают и разложение прекращается, в свою очередь, если уровень DO является чрезмерным, то затрачивается гораздо больше энергии, чем необходимо для аэрации, и процесс становится слишком дорогостоящим.
Фото: Gerd Altmann, источник: pixabay.com
Еще один яркий пример важности роли DO – контроль качества подпиточной воды котла. Поскольку присутствие кислорода в воде усиливает коррозию и вызывает образование накипи в котле, препятствующей передаче тепла, в этом случае очень желательно поддерживать концентрацию DO на минимальном уровне.
Количество кислорода, которое может удерживаться в определённом объёме воды, зависит от давления атмосферного кислорода на границе раздела воздух-вода, температуры жидкости и степени концентрации других веществ, растворённых в воде.
Влияние парциального давления кислорода на содержание растворённого кислорода
Со всей очевидностью, объём воды, «контактирующий» с воздухом, будет поглощать воздушные массы и, следовательно, находящийся в них кислород, до тех пор, пока давление, оказываемое поглощённым кислородом на границе раздела воздух-вода, не сравняется с давлением, оказываемым кислородом воздуха на той же границе раздела. В этот момент вода считается насыщенной кислородом. Фактически поглощённое количество кислорода довольно невелико и составляет порядка пяти или десяти частей кислорода на один миллион частей воды.
Влияние температуры на содержание растворённого кислорода
Как известно каждому, кто когда-либо видел кипение воды в кастрюле, на её стенках и дне в процессе кипения образуются пузыри. Количество и размер пузырьков увеличиваются с ростом температуры. Это пузырьки воздуха, растворенные в воде. Представим стакан с водой, насыщенной кислородом, при комнатной температуре. Показатели парциального давления кислорода над и под поверхностью воды будут равными. Если же систему нагреть, по сути, вливая в неё энергию, то молекулы кислорода, которые имеют низкую растворимость, легко возбуждаются за счет такого вливания. При этом менее расторопные молекулы воды увеличивают свою молекулярную активность в более медленном темпе. В результате молекулы кислорода проникают через границу раздела воздух-вода в пространство над поверхностью воды в гораздо большем количестве, нежели молекулы воды, оставляя меньше молекул кислорода, растворенных в воде. Когда вода закипает, то все молекулы кислорода вытесняются из воды, и теперь молекулы воды выходят из стакана так быстро, что образуют слой водяного пара непосредственно над поверхностью воды. Этот слой эффективно изолирует воду от атмосферного кислорода, а содержание DO в воде становится равным нулю.
Фото: Pixabay, источник: pexels.com
Мы можем представить себе объём воды как однородную среду со множеством отверстий, разбросанных по всему объему. Давление воздуха непосредственно над поверхностью воды заставит эти отверстия заполниться воздухом. Если теперь такое вещество, как соль, растворяется в воде, то оно будет занимать некоторые из отверстий, используемых молекулами кислорода, поскольку они постоянно переходят из воздуха в воду и из воды в воздух. Количество кислорода, которое вода может удерживать при данной температуре, теперь уменьшилось, но парциальное давление растворённого кислорода, остающегося в растворе, должно по-прежнему равняться парциальному давлению атмосферного кислорода над поверхностью воды.
Методы измерения растворённого в воде кислорода
В основном есть два общих метода измерения DO. В каждом из них используется электродная система, в которой растворённый кислород «проявляется» на катоде, производя измеримый электрохимический эффект. Этот эффект может быть гальваническим, полярографическим или потенциометрическим.
В одном из методов измерения кислорода, растворённого в воде, используется ячейка типа Кларка, которая представляет собой систему электродов, отделенную от потока пробы полупроницаемой мембраной. Эта мембрана позволяет кислороду, растворённому в образце, проходить через него к системе измерительных электродов. Катод представляет собой водородный электрод и несет отрицательный приложенный потенциал по отношению к аноду. Электролит окружает электродную пару и удерживается мембраной. В отсутствие реагента катод поляризуется водородом, и сопротивление току становится бесконечным. Когда присутствует реагент, такой как кислород, прошедший через мембрану, катод деполяризуется и электроны расходуются.
Анод электродной пары должен реагировать с продуктом реакции деполяризации с соответствующим высвобождением электронов. В результате пара электродов позволяет току течь прямо пропорционально количеству кислорода или реагента, поступающего в систему. Таким образом, величина тока прямо указывает нам на количество кислорода, поступающего в систему.
Что влияет на работу датчика DO
Надо сказать, что мембранные зонды легко поддаются высокой межфазной турбулентности. Такие рабочие условия могут существенно сократить срок службы датчика, содержащего таллий, поскольку высокая турбулентность сметает ионы таллия, вызывая, тем самым, истощение электрода.
Между тем, известно, что растворённые органические материалы не взаимодействуют с выходным сигналом датчиков растворённого кислорода, а неорганические соли, в свою очередь, являются фактором, влияющим на работу электродов. Как мы уже говорили, при использовании датчиков с мембранами в солевых растворах мы должны применить поправочный коэффициент к выходному сигналу. Зонд с таллием требует наличия солей в концентрациях, обеспечивающих минимальную проводимость около 200 микрометров.
Двумя основными газами, препятствующими процессу измерения количества растворённого кислорода с помощью мембранного зонда, являются хлор и сероводород. Соединения серы, такие как сероводород, диоксид серы и меркаптаны, вызывают ошибочные результаты, демонстрируемые таллиевым датчиком. Галогены не мешают нормальной работе таллиевого зонда.
При низких концентрациях растворенного кислорода изменения pH ниже 5 и выше 9 единиц оказывают влияние на работу датчика с таллием. Это вмешательство составляет около ±0,5 мг/л DO на единицу pH. На характеристики мембранных зондов изменения pH не влияют.
Также следует знать, что серьёзным ограничением в использовании таллиевого зонда является тот факт, что таллий довольно токсичен, и вы должны проявлять осторожность. Мембранные зонды лишены этого недостатка. Поскольку весь кислород, который проходит через мембрану, вступает в реакцию, и поскольку количество кислорода, проходящего через мембрану, является функцией парциального давления кислорода в растворе, этот метод фактически измеряет парциальное давление кислорода в растворе. Он не измеряет фактическую концентрацию кислорода в растворе. По этой причине мы должны корректировать показания концентрации DO, полученные с помощью этого метода, когда какое-либо вещество, например соль, растворяется в воде. Как мы упоминали выше, растворённая соль уменьшит количество отверстий, доступных для переноса кислорода, и, следовательно, снизит фактическую концентрацию кислорода без изменения его парциального давления в растворе. Если материалы электродов выбраны так, что разность потенциалов на катоде составляет -0,5 В или больше, внешний потенциал не требуется, и мы получаем то, что называется гальванической системой.
Важность поддержания постоянной температуры для измерений DO
Некоторые специалисты вместо того, чтобы полагаться на собственный выбор материалов электродов для обеспечения необходимой разности потенциалов на катоде -0,5 В, используют для этого внешний источник потенциала. Этот способ известен как полярографическая система. В любом случае, мы должны либо поддерживать температуру образца постоянной, либо компенсировать изменение температуры образца. Как правило, первый вариант непрактичен, таким образом, более популярным является второй подход. Правильно подобранный термистор или термометр сопротивления в грамотно спроектированной электрической цепи справляется с температурной компенсацией на отлично.
Базовый метод определения концентрации растворённого кислорода в воде
Разберём второй метод измерения DO, который считается базовым. В нём используется система электродов, состоящая из электрода сравнения и измерительного электрода с таллием. Полупроницаемая мембрана здесь не используется, электродную систему погружают непосредственно в образец и концентрацию кислорода определяют путём измерения потенциала напряжения, возникающего по отношению к электроду сравнения, когда растворённый кислород вступает в контакт с таллиевым электродом.
На поверхности электрода концентрация талловых ионов пропорциональна растворенному кислороду. Потенциал напряжения, развиваемый ячейкой, зависит от концентрации талловых ионов в этом слое и изменяется по мере изменения концентрации растворённого кислорода. В этой технике используется потенциометрическая система. Измерение концентрации кислорода осуществляется непосредственно в образце. Как и в первом методе, температурная компенсация является обязательной. В обоих методах межфазная динамика на границе раздела зонд-образец является фактором отклика зонда. Необходима значительная межфазная турбулентность, и для обеспечения точности она должна быть постоянной. Впрочем, пока рабочая точка остаётся выше изгиба кривой, можно допустить небольшие изменения турбулентности.
Адаптированный и дополненный перевод с сайта omega.com
Используемые изображения:
1. Автор: Alexa, источник: pixabay.com
2. Автор: Gerd Altmann, источник: pixabay.com
3. Автор: Pixabay, источник: pexels.com
Большинство химических и биологических процессов влияют на уровень растворенного в воде кислорода. Поэтому в обработке промышленных, муниципальных вод и в области аквакультуры важной задачей является непрерывное и точное измерение концентрации растворенного кислорода.
В данной статье описаны три стандартных метода определения концентрации растворенного кислорода. Приведены принцип работы этих методов, их преимущества и недостатки, а также результаты сравнения точности и надежности измерений в различных условиях среды.
Методы определения растворенного кислорода в воде
Титрование по Винклеру (Winkler). Титриметрический метод
Процедура титрования исторически является первым методом определения концентрации кислорода в воде.
Образец воды обрабатывают сульфатом марганца, гидроксидом калия и йодидом калия с образованием гидроксида марганца, Mn(OH)2. Кислород в воде реагирует с Mn(II), переводя его в Mn(III). Нестабильный Mn(III) затем реагирует с другой молекулой O2, переходя в Mn(IV). Для фиксации реакции в раствор добавляют сильную кислоту (серную или соляную), переводят осадок MnO(OH)2 в сульфат марганца, при этом MnO(OH)2 действует как окисляющий агент на йод, I2. Этот йод — стехиометрический эквивалент к растворенному кислороду в образце, его титруют тиосульфатом натрия или фениларсиноксидом с крахмалом. Крахмал нужен для более точного определения окончания реакции.
2Mn2+ + O2 + 4OH— = 2MnO(OH)2↓
MnO(OH)2 + 2J— + 4H+ = Mn2 + J2 + 3H2O.
J2 + 2S2O32- = 2J—+S4O62-
J2 + крахмал -> синее окрашивание
Метод имеет многочисленные помехи, которые вносят ионы нитрита, двух и трехвалентные ионы железа, взвешенные частицы и органика. Он показывает завышенные значения растворенного кислорода в аноксической среде и заниженные значения в гипероксичной среде, потому что проба воды и сами реагенты испаряются во время работы.
Электрод Кларка. Электрохимический или полярографический метод
Для измерения кислорода в воде обычно используют датчик, состоящий из мембраны, которая покрывает амперометрический сенсор. В ноябре 1959 года изобретатель Кларк (H. A. Clark) получил патент (US Patent 2913386), «Электрохимическое устройство для химического анализа».
В пластмассовом цилиндрическом корпусе 1 имеются сквозные отверстия для проводников, в которых находятся индикаторный (рабочий) электрод 2 из платины и электрод сравнения 3 из серебряных проволок, концы которых покрыты пастой из хлорида серебра. Нижний конец корпуса обтягивают газопроницаемой полимерной мембраной 4 из полипропилена (тефлона, полиэтилена, фторопласта, целлофана и т.п.), которую механически фиксируют на корпусе с помощью резинового кольца 5. В пространство между электродами и мембраной залит водный раствор хлорида кальция 6. Извне мембрана 4 контактирует с контролируемой средой 7. Это может быть как жидкость, так и газ.
Если в контролируемой среде кислорода нет, то при подаче напряжения между электродом сравнения (анод) и рабочим электродом установившийся стационарный ток очень слаб. При наличии в контролируемой среде кислорода его молекулы диффундируют сквозь мембрану 4 и через раствор 6. Когда они достигают индикаторного электрода 2, то благодаря каталитическим свойствам платины здесь происходит реакция восстановления:
O2 + 4e- + 4H+ = 2H2O, вследствие которой ток через электрохимический элемент значительно возрастает.
Стационарный ток линейно зависит от концентрации кислорода в контролируемой среде.
Специально подбирая материал электродов, состав внутреннего электролита, электродное напряжение, удается построить амперометрические сенсоры подобной конструкции также для определения концентраций таких газов, как хлор, сероводород, серный газ, водород, угарный газ, окислы азота и т.д.
Вследствие потребления кислорода катодом и необходимостью диффузии кислорода через мембрану, для точности измерений следует поддерживать достаточный поток свежей воды. Загрязнение воды маслами и другими полимерами снижает диффузию и искажает результаты. С течением времени, мембрана разрушается, электролит становится грязным, а электроды расходуются до такой степени, что дают ограниченный ответ на присутствие кислорода.
Оптический метод. Люминесцентные оптоды
Тушение люминофоров кислородом описано в далеком 1939 году (Kautsky, 1939), но в области анализа воды технология, основанная на этом феномене, является относительно новой (Klimant et al., 1995; Glud et al., 1999; Wenzhöffer et al., 2001). Много позже, получили развитие оптические устройства, детекторы, устройства обработки информации. Значительного прогресса в 1990-х годах достигли технологии регистрации растворенного кислорода в жидкости с использование люминофоров, оптод (оптические датчики) и портативных компьютеров. Успехи в области создания диодов с синим спектром свечения и маломощной высокоскоростной электроники позволили миниатюризировать чувствительные к кислороду оптоды до размера портативных устройств. Датчики не потребляют кислород и стабильны длительное время. Они имеют быстрое время отклика, обычно τ63% менее 60 секунд, часто менее 30 секунд для изменений концентрации кислорода ниже 8 мг/л. Оптоды имеют температурную зависимость, их значения корректируются с помощью локального температурного датчика.
Приложение технологии тушения люминофоров кислородом для оценки качества воды активно изучается. Обнаружено, что технология чрезвычайно хорошо подходит для анализа качества воды, и для коммерческого внедрения необходимо преодолеть два препятствия:
— защитить люминофор от фотовыгорания, чтобы датчик мог работать длительный срок в полевых условиях;
— обеспечить воспроизводимость процесса печати, чтобы последовательно и недорого интегрировать люминофор в колпачок датчика.
Кислородная оптода обеспечивает более удобный и надежный способ измерения растворенного кислорода, чем титрование и электрохимические датчики . Фундаментальный принцип основан на способности некоторых веществ действовать как динамические гасители флюоресценции. В случае определения концентрации кислорода, если рутениевый комплекс освещают синим светом, он возбуждается и испускает красную люминесценцию с интенсивностью и сроком жизни, которые зависят от концентрации кислорода в образце воды.
Важно отметить три параметра, на которых строятся измерения: интенсивность (насколько возвратное излучение сильное), срок жизни (как быстро возвратная люминесценция прекращается) и смещение фаз.
Измерения, базирующиеся на интенсивности, легче провести, но полученные значения меняются с течением времени. Различные технологии определения сигнала и области их приложения обобщены в работах Wolfbeis (1991), Demas et al. (1999) и Glud et al. (2000).
Схема оптического датчика для определения кислорода
Сенсорная пленка состоит из чувствительного к кислороду люминесцентного вещества (люминофор), который погружен в полимерный слой, который, в свою очередь, тонким слоем покрывает полиэстеровую подложку.
Чаще всего в качестве люминофора используют рутениевые комплексы, но иногда платиновые комплексы порфиринов [полициклические ароматические углеводорода, Ru(II), Os(II), Rh(II), фосфоресцентные порфирины]. В последнем случае датчик имеет в пять раз больший срок жизни сигнала, поэтому сигнал проще считывать, и показания более стабильные. Кроме того, платиновые комплексы порфиринов менее чувствительны к фотовыгоранию.
Газопроницаемый защитный черный силиконовый слой работает как оптический изолятор, защищает от возможных люминесцентных/флюоресцентных материалов в воде, от солнечного излучения.
Пленку освещают синим/зеленым светодиодом с частотой 5 кГц. Возвратное красное флюоресцентное свечение от пленки принимает фотодиод. Красный оптический фильтр снижает отраженный свет, поступающий в фотодиод непосредственно от синего/зеленого излучателя.
Хотя детектор измеряет интенсивность флюоресцентного свечения, эта интенсивность восприимчива к оптическим связям и фотовыгоранию люминофора. Для измерения уровня тушения люминесценции кислородом гораздо лучше определять время жизни излучения от возбужденных люминофоров в пленке по отношению к возбуждающему сигналу. Время жизни измеряют опосредованно, через фазовое смещение между возбуждающим синим/зеленым сигналом и испускаемым от люминофора красным сигналом. Дополнительный красный светодиод включен в качестве невозбуждаемого сигнала сравнения как средство компенсации потенциального дрейфа в электронных схемах передатчика и приемника.
Использование техники фазовой модуляции означает, что флуктуации интенсивности излучения от синего/зеленого светодиода и излучения от люминофора не вносят помехи в измерения на протяжении всего срока службы оптического датчика. Кроме того, так как между концентрацией растворенного кислорода и фазовым смещением возвратной красной флюоресценции отмечается обратная зависимость, «отношение сигнал шум» имеет особое значение для измерения очень низкой концентрации растворенного кислорода. Наконец, между циклами измерения поочередно включаются синий и красный светодиоды, что обеспечивает внутреннее сравнение для оптического и электронного прохождения сигнала. Этот внутренний контроль обеспечивает стабильность в условиях корректировки температуры.
- Оптический датчик проводит измерения, последовательно включая синий и красный светодиоды.
- Синий свет возбуждает молекулы красителя люминофора на чувствительной пленке.
- Испускаемый светодиодом красный свет обеспечивает нулевое сравнительное значение; он не возбуждает молекулы люминофора.
- Возбужденные молекулы люминофора испускают красный свет в обратную сторону.
- Фотодиод обнаруживает возвратный красный свет от возбужденных молекул люминофора и красный свет от светодиода.
Калибровка и температурная зависимость оптического датчика
Оптическое тушение люминофора сильно зависит от температуры. Важно с высокой точностью измерять температуру (с множеством повторений), при этом датчик температуры и оптода должны располагаться близко друг к другу. Во время калибровки необходимо равенство температур образца воды, колпачка оптоды и температурного датчика.
Например, когда для калибровки значения 100% насыщения используется водонасыщенный воздух, колпачок оптоды и температурный датчик должны находиться на воздухе в температурном равновесии. Аналогично, когда для калибровки значения 100% насыщения используется насыщенная воздухом вода, колпачок оптоды и температурный датчик должны погружаться в воду и находится в температурном равновесии друг с другом и с водой.
Во время калибровки в полевых условиях рекомендуют защищать колпачок от термического нагревания при помощи солнечного щита.
Сравнение показаний различных методов определения концентрации кислорода
Для создания уравновешенных образцов воды с известными значениями температуры и давления использовали поверочную газовую O2/N2 смесь Национального института стандартов и технологий (NIST, США). Измерения концентрации растворенного кислорода титрованием, электродом Кларка и оптическим датчиком Hach LDO сравнивали с теоретическими значениями растворенного кислорода (Hitchman, 1978).
Используя автоматический титратор по методике Виклера, измерения модели зонда Hydrolab Series 5 от компании Hach LDO показали высокую степень корреляции со значениями титратора. Каждая группа данных включала два образца, и эти данные перекрывались.
В контролируемых лабораторных условиях с помощью коммерческой морской соли корректировали соленость воды до желаемого уровня. Емкость продували азотом, снижая концентрацию кислорода, а затем растворяли кислород, продувая емкость кислородом. Сравнения оптоды Hach LDO с электрохимическим мембранным датчиком при средней (6.9 млрд-1) и высокой солености (45.5 млрд-1) показали аналогичные значения, с ошибками ±0.2 мг/л для мембранного датчика и ±0.1 мг/л для Hach LDO датчика (значения ниже 8 мг/л) и ±0.2 мг/л для Hach LDO датчика (значения выше 8 мг/л).
В контролируемых лабораторных условиях корректировали концентрацию растворенного кислорода при помощи продувки азотом и кислородом. Емкость продували азотом, снижая концентрацию кислорода, а затем растворяли кислород, продувая емкость кислородом. Брали несколько сотен значений на кривой концентрации кислорода для датчика Hach LDO. Значения насыщения для датчика Hach LDO и электрохимического датчика аналогичные. Процент насыщения, рассчитанный через измерения в абсолютных значениях (мг/л) одинаков для двух методов регистрации.
Время отклика оптического датчика изменялось поэтапно, менее 30 секунд, достигая τ95%, когда концентрация снижалась с 8 мг/л до 0 мг/л и когда она возрастала от 0 мг/л до 8 мг/л.
Сбор данных в полевых условиях
Сравнения измерений Hach LDO и титрования по Виклеру в условиях низкой концентрации кислорода и температур показали аналогичные результаты. Это говорит о способности оптического датчика достигать нуля и работать при низких температурах.
Сравнение измерений оптического датчика Hydrolab Series 5 с датчиком Hach LDO и электрода Кларка в течение недели проводилось в естественном водоеме города Найвот, Колорадо. Регистрация проводилась каждые 15 минут, и результаты измерений показали четкий суточный ритм в зеленом пруду.
Заключение
| Параметр | Титрование по Виклеру | Оптический датчик | Электрохимический электрод | Гальванический электрод | |
| Средняя исходная ошибка, net bias, мг/л | — | 0.19 | 0.55 | 0.22 | Насколько датчик точен в начале |
| Частота исходных ошибок 0.2 мг/л или меньше, % | — | 50 | 40 | 10 | |
| Частота исходных ошибок 0.2 мг/л или больше, % | — | 0 | 10 | 60 | |
| Расброс значений в начале измерений, мг/л | 0.9 | 3.1 | 9.5 | ||
| Индивидуальная точность, % | 0.22 | 0.11 | 0.11 | 0.18 | Насколько идентичны одинаковые модели датчиков |
| Обычное отклонение за первую неделю, мг/л | — | 0.39 | 0.77 | 1.01 | Насколько высокие отклонения измерений |
| Вариабельность отклонений (завышает или занижает), мг/л | — | 0.58 | 3.94 | 0.74 | |
| Ранний срок начала отклонений более 2.0 мг/л, дни | — | 14 | 3 | 8 | |
| Mooney R., Arnerich T., Performance of optical dissolved oxygen sensors in seven site, mix matrix study |
Рассмотрены три стандартных метода определения концентрации растворенного кислорода в воде.
Титрование по Винклеру подходит для точного измерения кислорода в природных водоемах, но имеет ограничения, касающиеся токсичной природы химических реактивов и трудозатрат на выполнение процедуры. Кроме того, сложно анализировать образцы, далекие от равновесного состояния (слишком аноксические и гипероксические).
В электродах Кларка мембрана покрывает амперометрический сенсор. Полвека назад этот датчик стал шагом вперед в реал-тайм мониторинге уровня растворенного кислорода. Электроду присущи ограничения, так как он потребляет кислород и требует частого обслуживания.
Оптические датчики, работающие на технологии фазового смещения сигнала и принципе гашения люминесценции кислородом, имеют существенные преимущества. Они наиболее точные и имеют самый долгий срок службы среди других датчиков, включая оптоды, использующие оценку интенсивности сигнала. В условии нормальных концентраций веществ, они лишены каких-либо помех, и в этом плане превосходят электрохимический метод измерения и титрование.
Таким образом, метод не имеет таких ограничений, какие имеет химический мембранный метод. Мембрана не взаимодействует с кислородом, поэтому нет необходимости помешивания датчика. Кроме того, прочная конструкция датчика обеспечивает калибровку на долгие годы.
В качестве рабочего варианта приведу характеристики модели In-Situ ®Inc.’s Rugged Dissolved Oxygen (RDO) Titan Probe. Далее следуют выдержки из руководства по эксплуатации.
Прочность конструкции
Датчик устойчив к стиранию и потери флуоресценции в ходе фотовыгорания. Выдерживает высокую соленость раствора, состоит из устойчивых к коррозии материалов. Нечувствителен к помехам, которые обычно возникают у датчиков с мембраной (сероводород, хлор, аммоний и другие).
Простота обслуживания
Датчик не требует частой калибровки. Включает средства диагностики состояния датчика. Работает с очень малыми отклонениями в течение длительного периода времени. Быстро реагирует на изменения концентрации кислорода и температуры. Обеспечивает стабильные, воспроизводимые результаты (<0.05 мг/л).
Характеристики
Тип датчика: Оптический DO датчик с классическим колпачком.
Диапазон измерений: 0 – 50 мг/л.
Точность: ±0.1 мг/л от 0 до 8 мг/л; ±0.2 мг/л от 8 до 20 мг/л; ±10% от 20 до 50 мг/л.
Разрешение: 0.01 мг/л.
Время ответа, колпачок: T90 <45 сек. T95 <60 сек. Температура 25°C.
Диапазон измерений температуры: 0 — 50°C.
Точность измерения температуры: ±0.1°C обычно.
Разрешение измерения температуры: 0.01°C.
Условия среды
Давление: 150 psi от 0 до 50°C; 300 psi до 25°C.
Глубина: 210 метров до 25°C.
Рабочая температура: Для колпачка датчика 1 — 60°C в заводском контейнере; датчика -5 — 60°C.
Помехи от химических веществ: спирты >5%, перекись водорода >3%, раствор гипохлорита (белизна) >3%, газообразный диоксид серы, газообразный хлор.
——
www.intuit.ru/studies/courses/590/446/lecture/9934?page=3
www.eco.nw.ru/lib/data/09/4/030409.htm
masters.donntu.org/2011/fkita/prokof%27eva/library/article9.htm
www.coastalwiki.org/wiki/Oxygen_sensors
archimer.ifremer.fr/doc/2006/publication-1413.pdf
onlinelibrary.wiley.com/doi/10.4319/lom.2014.12.139/pdf
in-situ.com
www.slideserve.com/khoi/optics-for-dissolved-oxygen
ГОСУДАРСТВЕННЫЙ КОМИТЕТ
РОССИЙСКОЙ
ФЕДЕРАЦИИ ПО ОХРАНЕ ОКРУЖАЮЩЕЙ СРЕДЫ
УТВЕРЖДАЮ
Заместитель Председателя
Государственного комитета РФ
по охране окружающей среды
________ А.А. Соловьянов
«21» марта 1997 г.
КОЛИЧЕСТВЕННЫЙ ХИМИЧЕСКИЙ
АНАЛИЗ ВОД
МЕТОДИКА ВЫПОЛНЕНИЯ ИЗМЕРЕНИЙ МАССОВОЙ
КОНЦЕНТРАЦИИ РАСТВОРЕННОГО КИСЛОРОДА
В ПРОБАХ ПРИРОДНЫХ И ОЧИЩЕННЫХ СТОЧНЫХ ВОД
ЙОДОМЕТРИЧЕСКИМ МЕТОДОМ
ПНД Ф 14.1:2.101-97
Методика допущена для целей
государственного
экологического контроля
МОСКВА 1997 г.
1. ВВЕДЕНИЕ
Настоящий документ устанавливает методику
количественного химического анализа проб природных и очищенных сточных вод для
определения в них массовой концентрации растворенного кислорода в диапазоне от
1,0 до 15,0 мг/дм3 титриметрическим методом без разбавления и
концентрирования пробы.
На определение кислорода оказывают влияние окислители,
восстановители, окрашенные и взвешенные вещества.
Устранение мешающих влияний осуществляется в
соответствии с п. 10.
2.
ПРИНЦИП МЕТОДА
Титриметрический метод определения массовой
концентрации растворенного кислорода основан на его реакции с гидроксидом
марганца (II) в щелочной среде. Последний количественно связывает
кислород, переходя при этом в соединение марганца (IV). При
подкислении пробы в присутствии избытка иодида калия образуется йод, количество
которого эквивалентно содержанию растворенного кислорода и определяется
титрованием раствором тиосульфата натрия.
3.
ПРИПИСАННЫЕ ХАРАКТЕРИСТИКИ ПОГРЕШНОСТИ ИЗМЕРЕНИЙ И ЕЕ СОСТАВЛЯЮЩИХ
Настоящая методика обеспечивает получение результатов
анализа с погрешностью, не превышающей значений, приведённых в таблице 1.
Таблица 1
Диапазон измерений, значения показателей точности,
повторяемости, воспроизводимости
|
Диапазон |
Показатель |
Показатель повторяемости |
Показатель |
|
от 1,0 до 15,0 вкл. |
10 |
3 |
5 |
Значения показателя точности методики используют при:
— оформлении результатов анализа, выдаваемых
лабораторией;
— оценке деятельности лабораторий на качество
проведения испытаний;
— оценке возможности использования результатов анализа
при реализации методики в конкретной лаборатории.
4.
СРЕДСТВА ИЗМЕРЕНИЙ, ВСПОМОГАТЕЛЬНЫЕ УСТРОЙСТВА, РЕАКТИВЫ И МАТЕРИАЛЫ
4.1. Средства измерений
|
Весы лабораторные общего назначения с наибольшим |
ГОСТ 24104-2001 |
|
Весы |
ГОСТ 24104-2001 |
|
Колбы |
ГОСТ 1770 |
|
2-100-2 |
|
|
2-500-2 |
|
|
Пипетки |
ГОСТ 29227 |
|
1-1-2-1 |
|
|
1-1-2-2 |
|
|
1-1-2-5 |
|
|
Пипетки |
ГОСТ 29169 |
|
2-2-5 |
|
|
2-2-10 |
|
|
2-2-50 |
|
|
Бюретки |
ГОСТ 29251 |
|
1-4-2-2-0,01 |
|
|
1-4-2-25-0,1 |
|
|
Цилиндры |
ГОСТ 1770 |
|
1(3)-10 |
|
|
1(3)-50 |
|
|
1(3)-100 |
|
|
1(3)-500 |
4.2.
Вспомогательные устройства
|
Плитка электрические с закрытой спиралью и |
ГОСТ 14919 |
|
Шкаф |
|
|
Холодильник |
|
|
Насос |
|
|
Стаканчики |
ГОСТ 25336 |
|
СВ-14/8 |
|
|
СВ-34/12 |
|
|
Стаканы |
ГОСТ 25336 |
|
В-1-50 |
|
|
В-1-100 |
|
|
В-1-250 |
|
|
В-1-1000 |
|
|
Колбы |
ГОСТ 25336 |
|
Кн-2-250-34 |
|
|
Колба |
ГОСТ 25336 |
|
1-500 |
|
|
Воронки |
ГОСТ 25336 |
|
В-75-110 |
|
|
В-100-150 |
|
|
Воронка |
ГОСТ 9147 |
|
Склянки |
ТУ 6-19-6 |
|
Трубки |
ГОСТ 25336 |
|
Шпатель |
|
|
Палочка |
|
|
Отрезок |
Средства измерений должны быть поверены в
установленные сроки.
Допускается использование других, в том числе
импортных, средств измерений и вспомогательных устройств с характеристиками не
хуже, чем у приведенных в п.п. 4.1 и 4.2.
4.3.
Реактивы и материалы
|
Хлорид марганца (II), |
ГОСТ 612 |
|
сульфат |
ГОСТ 435 |
|
Иодид |
ГОСТ |
|
иодид |
ГОСТ 8422 |
|
Бихромат |
ГОСТ 4220 |
|
калий |
ТУ 6-09-2540 |
|
Тиосульфат |
ГОСТ 27068 |
|
натрий |
ТУ 6-09-2540 |
|
Гидроксид |
ГОСТ |
|
гидроксид |
ГОСТ 24363 |
|
Карбонат |
ГОСТ |
|
Сульфат |
ГОСТ 4166 |
|
Раствор |
ГОСТ |
|
Фторид |
ГОСТ 20849 |
|
Роданид |
ГОСТ |
|
Сульфат |
ГОСТ 3758 |
|
Соляная |
ГОСТ 3118 |
|
серная |
ГОСТ |
|
Сульфаминовая |
ТУ 6-09-2437 |
|
Сульфат |
ГОСТ 4165 |
|
Аммиак |
ГОСТ |
|
Хлороформ |
ГОСТ |
|
Крахмал |
ГОСТ 10163 |
|
Спирт |
ГОСТ 18300 |
|
Бумага |
ТУ 6-09-1181 |
|
Фильтры |
ТУ 6-09-1678 |
|
Вода |
ГОСТ 6709 |
Все реактивы, используемые для анализа, должны быть
квалификации ч.д.а. или х.ч.
Допускается использование солей марганца квалификации
ч., а также реактивов, изготовленных по другой нормативно-технической
документации, в том числе импортных, с квалификацией не ниже ч.д.а.
5.
ТРЕБОВАНИЯ БЕЗОПАСНОСТИ
5.1. При выполнении анализов необходимо соблюдать
требования техники безопасности при работе с химическими реактивами по ГОСТ 12.1.007.
5.2. Электробезопасность при работе с электроустановками
обеспечивается по ГОСТ 12.1.019.
5.3. Организация обучения работающих безопасности труда
проводится по ГОСТ 12.0.004.
5.4. Помещение лаборатории должно соответствовать
требованиям пожарной безопасности по ГОСТ 12.1.004 и иметь
средства пожаротушения по ГОСТ 12.4.009.
6.
ТРЕБОВАНИЯ К КВАЛИФИКАЦИИ ОПЕРАТОРОВ
Выполнение измерений может производить химик-аналитик,
владеющий техникой титриметрического метода анализа.
7.
УСЛОВИЯ ИЗМЕРЕНИЙ
При выполнении измерений в лаборатории должны быть
соблюдены следующие условия:
• температура окружающего воздуха (22 ± 6) °С;
• атмосферное давление (84 — 106) кПа;
• относительная влажность не
более 80 % при температуре 25 °С;
• частота переменного тока (50 ± 1) Гц;
• напряжение в сети (220 ± 22) В.
8.
ОТБОР И ХРАНЕНИЕ ПРОБ
8.1. Отбор проб производится в соответствии с
требованиями ГОСТ
Р 51592-2000 «Вода. Общие требования
к отбору проб».
8.2. Посуду, предназначенную для отбора и хранения проб,
промывают раствором соляной кислоты 1:1, затем тщательно промывают
водопроводной и ополаскивают дистиллированной водой.
8.3. Пробы воды отбирают с помощью батометра, к крану
которого прикреплена резиновая трубка длиной 20 — 25 см. Из поверхностных
горизонтов допускается отбор проб эмалированной посудой. Проба для определения
кислорода должна быть первой, взятой для дальнейшей обработки. Объем отбираемой
пробы определяется вместимостью кислородных склянок.
При переливе отобранной пробы воды в кислородную
склянку из батометра резиновую трубку опускают до дна кислородной склянки и
открывают кран, при переливе из другого пробоотборника пользуются сифоном,
погруженным примерно до половины высоты водного столба. После заполнения
склянки до горлышка ее наполнение продолжают до тех пор, пока не вытеснится
вода, соприкасавшаяся с воздухом, находившимся в склянке. Трубку вынимают, не
прекращая тока воды из батометра или сифона. Склянка должна быть заполнена
пробой до краев и не иметь внутри на стенках пузырьков воздуха.
8.4. Сразу после заполнения склянки производят фиксацию
кислорода в соответствии с п. 11. При
необходимости предварительно проводят устранение мешающих влияний в
соответствии с п. 10.
Срок хранения зафиксированных проб не более 24 ч.
8.5. При отборе проб составляется сопроводительный
документ по утвержденной форме, в котором указывается:
— цель анализа, предполагаемые загрязнители;
— место, время отбора;
— номер пробы;
— должность, фамилия отбирающего пробу, дата.
9.
ПОДГОТОВКА К ВЫПОЛНЕНИЮ ИЗМЕРЕНИЙ
9.1. Приготовление растворов и
реактивов
9.1.1. Раствор хлорида (сульфата) марганца (II).
210 г MnCl2 · 4Н2O или
260 г MnSO4 · 5H2O или
290 г MnSO4 · 7H2O
растворяют в 300 — 350 см3 дистиллированной воды, фильтруют в мерную
колбу вместимостью 500 см3 и доливают дистиллированной водой до
метки на колбе. Хранят в плотно закрытой склянке не более 3 мес.
9.1.2. Щелочной раствор иодида калия (или натрия).
15 г KI (или 18 г NaI · H2O)
растворяют в 20 см3, а 50 г NaOH — в 50 см3
дистиллированной воды. Полученные растворы смешивают в мерной колбе
вместимостью 100 см3 и доводят объем дистиллированной водой до метки
на колбе. При наличии мути раствор фильтруют. Хранят в склянке из темного
стекла с плотной резиновой пробкой не более 6 мес.
9.1.3. Раствор соляной кислоты 2:1.
340 см3 концентрированной соляной кислоты
добавляют к 170 см3 дистиллированной воды.
Вместо раствора соляной кислоты можно использовать
раствор серной кислоты 1:4. Для его приготовления 100 см3
концентрированной серной кислоты смешивают с 400 см3
дистиллированной воды. Растворы кислот устойчивы при хранении в плотно закрытой
посуде в течение 6 мес.
Проверку чистоты растворов соли марганца, йодида калия
(или натрия), соляной (или серной) кислоты и их очистку осуществляют, как
описано в п. 9.2.
9.1.4. Раствор крахмала, 0,5 %.
0,5 г крахмала взбалтывают с 15 — 20 см3
дистиллированной воды. Суспензию постепенно приливают к 80 — 85 см3
кипящей дистиллированной воды и кипятят еще 2 — 3 мин. После охлаждения
консервируют добавлением 2 — 3 капель хлороформа. Хранят не более 1 мес.
9.1.5. Стандартный раствор дихромата калия с концентрацией
0,0200 моль/дм3 эквивалента.
При использовании стандарт-титра последний растворяют
в дистиллированной воде в мерной колбе вместимостью 500 см3, затем
отбирают 50 см3 полученного раствора, переносят в мерную колбу
вместимостью 500 см3 и доводят объем дистиллированной водой до
метки.
Для приготовления стандартного раствора из навески
0,4904 г K2Сr2O7, предварительно высушенного в сушильном шкафу при 105
°С в течение 1 — 2 ч, переносят количественно в мерную колбу вместимостью 500
см3, растворяют в дистиллированной воде и доводят объем раствора до
метки на колбе. Хранят в склянке с притертой пробкой в темном месте не более 6
мес.
9.1.6. Стандартный раствор тиосульфата натрия с
концентрацией 0,020 моль/дм3 эквивалента.
При использовании стандарт-титра последний растворяют
в дистиллированной воде в мерной колбе вместимостью 500 см3, затем
отбирают 50 см3 полученного раствора, переносят в мерную колбу
вместимостью 500 см3 и доводят объем дистиллированной водой до
метки.
Для приготовления стандартного раствора из навески 2,5
г Na2S2O3 · 5H2O переносят в мерную колбу
вместимостью 500 см3, растворяют в дистиллированной воде и доводят
объем раствора до метки на колбе.
В качестве консерванта к полученному раствору
добавляют 3 см3 хлороформа. Перед определением точной концентрации
раствор выдерживают не менее 5 суток. Хранят в склянке из темного стекла,
закрытой пробкой с вставленными в нее сифоном с бюреткой и хлоркальциевой
трубкой, заполненной гранулированным КОН или NaOH не более 4
мес.
Точную концентрацию стандартного раствора тиосульфата
натрия определяют, как описано в п. 9.3 не реже 1 раза в неделю.
9.1.7. Смешанный раствор сульфаминовой кислоты и сульфата
меди.
63 г CuSO4 · 5H2O и
40 г сульфаминовой кислоты растворяют в 500 см3 дистиллированной
воды. Хранят в склянке из темного стекла не более 4 мес.
9.1.8. Раствор фторида калия, 40 %.
40 г фторида калия растворяют в 60 см3
дистиллированной воды. Хранят в полиэтиленовой посуде. Раствор устойчив в
течение 6 мес.
9.1.9. Смешанный раствор сульфата и гипохлорита натрия.
50 г сульфата натрия растворяют в 160 см3
дистиллированной воды и добавляют такое количество раствора гипохлорита натрия,
чтобы смешанный раствор содержал около 0,3 % активного хлора. Раствор хранят в
темной склянке в холодильнике не более 1 мес.
При отсутствии готового раствора гипохлорита натрия
его готовят из хлорной извести и карбоната натрия в соответствии с Приложением Б
.
9.1.10. Смешанный раствор сульфата натрия и
роданида калия.
50 г сульфата натрия и 2 г роданида калия растворяют в 200 см3
дистиллированной воды. Раствор устойчив в течение 4 мес.
9.1.11. Раствор сульфата алюминия, 20 %.
35 г Al2(SO4)3 ·
18H2O растворяют в 55 см3 дистиллированной воды.
Раствор устойчив в течение 3 мес.
9.1.12. Раствор сульфаминовой кислоты, 40 %.
4 г сульфаминовой кислоты растворяют в 10 см3 дистиллированной
воды. Раствор устойчив при хранении в холодильнике в течение 3 мес.
9.2. Проверка чистоты и очистка используемых реактивов и растворов
9.2.1. Йодид калия (натрия).
Для проверки чистоты йодида калия
1 г KI растворяют в 100 см3 свежепрокипяченной
и охлажденной до комнатной температуры дистиллированной воды, приливают 10 см3
раствора соляной кислоты и 1 см3 раствора крахмала.
Если в течение 5 мин голубая
окраска не появляется, реактив пригоден для использования. В противном случае
йодид калия должен быть очищен от свободного йода. Для этого 30 — 40 г KI помещают в воронку Бюхнера и
промывают при перемешивании охлажденным до 3 — 5 °С этиловым спиртом до
появления бесцветной порции последнего. Промытый KI сушат в темноте между листами фильтровальной бумаги в
течение суток. Хранят в плотно закрытой склянке из темного стекла.
Проверку чистоты и очистку NaI проводят аналогичным образом.
9.2.2. Раствор хлорида (сульфата) марганца.
К 100 см3
свежепрокипяченной и охлажденной дистиллированной воды добавляют 1 см3
раствора соли марганца, 0,2 г сухого йодида калия, прошедшего проверку на
чистоту, 5 см3 раствора соляной кислоты и 1 см3 раствора
крахмала. Отсутствие через 10 мин синей окраски указывает на чистоту реактива.
В противном случае для очистки раствора на каждые 100 см3 его
добавляют около 1 г безводного карбоната натрия, хорошо перемешивают,
отстаивают в течение суток, а затем фильтруют.
9.2.3. Раствор кислоты.
К 50 см3
дистиллированной воды добавляют 1 см3 раствора крахмала, 1 г сухого
чистого йодида калия и 10 см3 раствора соляной (или серной) кислоты.
Если в течение 5 мин не появится синяя окраска, кислота может быть использована
в анализе, в противном случае следует заменить исходный реактив.
9.3. Установление точной концентрации стандартного раствора тиосульфата
натрия
В колбу для титрования вносят 80
— 90 см3 дистиллированной воды, 10,0 см3 стандартного
раствора бихромата калия, добавляют 1 г сухого KI и 10 см3 раствора соляной кислоты. Раствор
перемешивают, выдерживают 5 мин в темном месте и титруют пробу раствором
тиосульфата натрия до появления слабо-желтой окраски. Затем добавляют 1 см3
раствора крахмала и продолжают титрование до исчезновения синей окраски.
Повторяют титрование и, если
расхождение между величинами объемов титранта не превышает 0,05 см3,
за результат принимают их среднее значение. В противном случае повторяют
титрование до получения результатов, отличающихся не более, чем на 0,05 см3.
Точную концентрацию раствора
тиосульфата натрия находят по формуле:
где Ст — концентрация раствора тиосульфата
натрия, моль/дм3 эквивалента;
Сб — концентрация
раствора бихромата калия, моль/дм3 эквивалента;
Vт — объем
раствора тиосульфата натрия, израсходованный на титрование, см3;
Vб — объем
раствора бихромата калия, взятый для титрования, см3.
10. УСТРАНЕНИЕ МЕШАЮЩИХ ВЛИЯНИЙ
Влияние взвешенных и окрашенных
веществ устраняют предварительным соосаждением их с гидроксидом алюминия. Для
этого воду из пробоотборника сифоном переносят в склянку с притертой пробкой вместимостью
около 500 см3, опуская сифон до дна склянки. После заполнения
склянки продолжают ее наполнение до тех пор, пока не вытеснится вода,
соприкасавшаяся с находившимся в склянке воздухом. Склянка должна быть
заполнена пробой воды до краев и не иметь внутри на стенках пузырьков воздуха.
Добавляют в пробу 4 см3 раствора сульфата алюминия, 2 см3
раствора аммиака, закрывают склянку и перемешивают содержимое. После
отстаивания жидкость над осадком переливают сифоном в кислородную склянку,
производят фиксацию и определение кислорода в соответствии с п. 11.
Если вода содержит трудно
осаждаемые взвешенные вещества, которые могут вызвать снижение концентрации
кислорода вследствие деятельности микроорганизмов, к ней перед добавлением
растворов сульфата алюминия и аммиака добавляют 2 см3 смешанного
раствора сульфаминовой кислоты и сульфата меди (п. 9.1.7).
При содержании в воде более 0,05
мг/дм3 нитритов перед растворением осадка гидроксида марганца в
пробу следует внести несколько капель 40 % раствора сульфаминовой кислоты (п. 9.1.12). Эта операция не выполняется,
если в ходе осаждения взвесей в пробу уже добавляли смешанный раствор,
содержащий сульфаминовую кислоту.
В присутствии восстановителей
последовательность анализа изменяется. В этом случае после заполнения
кислородной склянки пробой воды в нее добавляют 0,5 см3 раствора
соляной кислоты и 0,5 см3 смешанного раствора гипохлорита и сульфата
натрия (п. 9.1.9). Склянку закрывают пробкой, перемешивают и оставляют в
темном месте. Через 30 мин для удаления избытка не прореагировавшего
гипохлорита добавляют 1 см3 смешанного раствора роданида калия и
сульфата натрия. Пробу перемешивают и через 10 мин выполняют фиксацию и
определение кислорода в соответствии с п. 11.
При содержании в анализируемой
воде более 1 мг/дм3 железа в пробу перед добавлением раствора
кислоты следует внести 1 см3 раствора фторида калия.
Добавление всех растворов в
склянку с пробой осуществляют, погружая пипетку примерно до половины склянки и
поднимая ее вверх по мере выливания раствора.
11. ВЫПОЛНЕНИЕ
ИЗМЕРЕНИЙ
При отсутствии в анализируемой
воде мешающих определению веществ (либо после устранения их в соответствии с п.
10) сразу же после заполнения кислородной склянки фиксируют
растворенный кислород. Для этого в склянку с пробой воды вводят отдельными
пипетками 1 см3 (при вместимости склянки до 150 см3) или
2 см3 (при вместимости более 150 см3) раствора хлорида
(сульфата) марганца и 1 или 2 см3 щелочного раствора йодида калия
(при вместимости склянки до 150 см3 и более 150 см3
соответственно). Пипетку погружают каждый раз до половины склянки и по мере
выливания раствора поднимают вверх. Затем быстро закрывают склянку стеклянной
пробкой таким образом, чтобы в ней не оставалось пузырьков воздуха, и
содержимое тщательно перемешивают 15 — 20-кратным переворачиванием склянки до
равномерного распределения осадка в воде. Склянки с зафиксированными пробами
помещают в темное место для отстаивания (не менее 10 мин и не более 24 ч).
После того, как отстоявшийся
осадок будет занимать менее половины высоты склянки, к пробе приливают 5 см3
или 10 см3 (в зависимости от вместимости склянки) раствора соляной
кислоты, погружая при этом пипетку до осадка (не взмучивать!) и медленно
поднимая ее вверх по мере опорожнения. Вытеснение из склянки части прозрачной
жидкости для анализа значения не имеет.
Склянку закрывают пробкой и
содержимое тщательно перемешивают. Отбирают 50 см3 раствора (пипетку
предварительно ополаскивают этим раствором), переносят его в колбу для
титрования и титруют стандартным раствором тиосульфата натрия (если
предполагается, что содержание кислорода менее 3 мг/дм3 — из
микробюретки) до тех пор, пока он не станет светло-желтым. Затем прибавляют 1
см3 свежеприготовленного раствора крахмала и продолжают титрование
до исчезновения синей окраски.
12. ОБРАБОТКА
РЕЗУЛЬТАТОВ ИЗМЕРЕНИЙ
12.1. Массовую
концентрацию растворенного кислорода в анализируемой пробе воды находят по
формуле:
где X — массовая концентрация растворенного кислорода в анализируемой пробе
воды, мг/дм3;
Ст — концентрация
раствора тиосульфата натрия, моль/дм3 эквивалента;
Vт — объем
раствора тиосульфата натрия, израсходованный на титрование, см3;
V — вместимость
кислородной склянки, см3;
V1 — суммарный
объем растворов хлорида марганца и йодида калия, добавленных в склянку при
фиксации растворенного кислорода, см3;
8,0 — масса миллиграмм-эквивалента
кислорода, мг.
12.2. Расхождение
между результатами анализа, полученными в двух лабораториях, не должно
превышать предела воспроизводимости. При выполнении этого условия приемлемы оба
результата анализа, и в качестве окончательного может быть использовано их
среднее арифметическое значение.
Значение предела
воспроизводимости R при Р = 0,95
для всего регламентированного диапазона массовой концентрации растворенного
кислорода составляет 14 %.
При превышении предела
воспроизводимости могут быть использованы методы оценки приемлемости
результатов анализа согласно раздела 5 ГОСТ Р ИСО 5725-6.
13. ОФОРМЛЕНИЕ РЕЗУЛЬТАТОВ АНАЛИЗА
Результат анализа X в документах, предусматривающих
его использование, может быть представлен в виде:
Х ± D, мг/дм3, Р = 0,95,
где D — показатель точности методики.
Значение D рассчитывают по формуле:
D ‰,‰· ·
Значение δ приведено в таблице
1.
Допустимо результат анализа в
документах, выдаваемых лабораторией, представлять в виде:
Х ± Dл, мг/дм3,
Р = 0,95,
при условии Dл < D,
где X — результат анализа, полученный в
соответствии с прописью методики;
± Dл — значение характеристики
погрешности результатов анализа, установленное при реализации методики в
лаборатории, и обеспечиваемое контролем стабильности результатов анализа.
Численные значения результата
измерения должны оканчиваться цифрой того же разряда, что и значения
характеристики погрешности.
14. КОНТРОЛЬ
КАЧЕСТВА РЕЗУЛЬТАТОВ АНАЛИЗА ПРИ РЕАЛИЗАЦИИ МЕТОДИКИ В ЛАБОРАТОРИИ
Контроль качества результатов
анализа при реализации методики в лаборатории предусматривает контроль
стабильности результатов анализа (на основе контроля стабильности
среднеквадратического отклонения повторяемости, среднеквадратического
отклонения внутрилабораторной прецизионности).
Реализуемые процедуры контроля
стабильности результатов анализа регламентируют в Руководстве по качеству
лаборатории.
Приложение А
(обязательное)
Определение точной вместимости
кислородных склянок
Чтобы определить точную
вместимость склянки для фиксации кислорода, ее тщательно моют, высушивают
(снаружи и изнутри) и взвешивают вместе с пробкой на технических весах с
точностью до 0,01 г. Затем наполняют ее дистиллированной водой до краев и
закрывают стеклянной пробкой так, чтобы под пробкой не оставалось пузырьков
воздуха. Обтирают склянку досуха и снова взвешивают с точностью до 0,01 г.
Разность в весе даст массу воды в
объеме склянки, которую для перевода в объем следует разделить при температуре
воды 15 °С на 0,998, при 20 °С — на 0,997 и при 25 °С — на 0,996.
Приложение Б
(обязательное)
Приготовление раствора гипохлорита
натрия
35 г Na2СО3
растворяют в 85 см3 дистиллированной воды. К 50 г хлорной извести
добавляют 85 см3 дистиллированной воды, тщательно размешивают,
добавляют весь раствор карбоната натрия и вновь перемешивают. При этом
реакционная масса вначале загустевает, затем начинает разжижаться. Массу
фильтруют через фильтр «синяя лента» на воронке Бюхнера. Полученный раствор
гипохлорита натрия хранят в склянке из темного стекла в холодильнике.
Для определения содержания
активного хлора в растворе гипохлорита натрия в коническую колбу вместимостью
250 см3 вносят 50 см3 дистиллированной воды, 1 см3
раствора гипохлорита, 1 г сухого KI, 10 см3 раствора соляной кислоты 2:1, тщательно перемешивают,
выдерживают 5 мин в темном месте и титруют стандартным раствором тиосульфата
натрия до светло-желтого цвета, а затем после добавления 1 см3
раствора крахмала — до полного обесцвечивания. Концентрацию активного хлора
находят по формуле:
Cах = 3,45 · Ст
· Vт,
где Сах — концентрация активного хлора, %;
Ст — концентрация
раствора тиосульфата натрия, моль/дм3 эквивалента
Vт — объем
раствора тиосульфата натрия, израсходованный на титрование, см3.
Приложение В
(справочное)
Равновесная концентрация
растворенного кислорода (мг/дм3) в зависимости от температуры воды
(атмосферное давление 760 мм рт. ст., парциальное давление О2 0,209 атм)
|
Температура, °С |
Доля °С |
||||
|
0,0 |
0,2 |
0,4 |
0,6 |
0,8 |
|
|
0 |
14,65 |
14,57 |
14,49 |
14,41 |
14,33 |
|
1 |
14,25 |
14,17 |
14,09 |
14,02 |
13,94 |
|
2 |
13,86 |
13,79 |
13,71 |
13,64 |
13,56 |
|
3 |
13,49 |
13,42 |
13,35 |
13,28 |
13,20 |
|
4 |
13,13 |
13,06 |
13,00 |
12,93 |
12,86 |
|
5 |
12,79 |
12,72 |
12,66 |
12,59 |
12,53 |
|
6 |
12,48 |
12,40 |
12,33 |
12,27 |
12,21 |
|
7 |
12,14 |
12,08 |
12,02 |
11,96 |
11,90 |
|
8 |
11,84 |
11,78 |
11,72 |
11,67 |
11,61 |
|
9 |
11,55 |
11,49 |
11,44 |
11,38 |
11,33 |
|
10 |
11,27 |
11,22 |
11,16 |
11,11 |
11,06 |
|
11 |
11,00 |
10,95 |
10,90 |
10,85 |
10,80 |
|
12 |
10,75 |
10,70 |
10,65 |
10,60 |
10,55 |
|
13 |
10,50 |
10,45 |
10,40 |
10,36 |
10,31 |
|
14 |
10,26 |
10,22 |
10,17 |
10,12 |
10,08 |
|
15 |
10,03 |
9,99 |
9,95 |
9,90 |
9,86 |
|
16 |
9,82 |
9,77 |
9,73 |
9,69 |
9,65 |
|
17 |
9,61 |
9,56 |
9,52 |
9,48 |
9,44 |
|
18 |
9,40 |
9,36 |
9,32 |
9,29 |
9,25 |
|
19 |
9,21 |
9,17 |
9,13 |
9,10 |
9,06 |
|
20 |
9,02 |
8,98 |
8,95 |
8,91 |
8,88 |
|
21 |
8,84 |
8,81 |
8,77 |
8,74 |
8,70 |
|
22 |
8,67 |
8,63 |
8,60 |
8,56 |
8,53 |
|
23 |
8,50 |
8,46 |
8,43 |
8,40 |
8,37 |
|
24 |
8,33 |
8,30 |
8,27 |
8,24 |
8,21 |
|
25 |
8,18 |
8,14 |
8,11 |
8,08 |
8,06 |
|
26 |
8,02 |
7,99 |
7,96 |
7,93 |
7,90 |
|
27 |
7,87 |
7,84 |
7,81 |
7,78 |
7,75 |
|
28 |
7,72 |
7,69 |
7,66 |
7,64 |
7,61 |
|
29 |
7,58 |
7,55 |
7,52 |
7,49 |
7,47 |
|
30 |
7,44 |
7,41 |
7,38 |
7,35 |
7,32 |
государственный
комитет российской федерации по стандартизации и метрологии
|
ФГУП «УРАЛЬСКИЙ НАУЧНО-ИССЛЕДОВАТЕЛЬСКИЙ ИНСТИТУТ |
«THE URALS RESEARCH INSTITUTE FOR METROLOGY» — STATE SCIENTIFIC |
||
|
620219, |
Факс: Телефон: E-mail: paneva@uniim.ru |
Dept. 224, 4, Krasnoarmeyskaya |
Fax: (3432) 502-117 Phone: (3432) E-mail: |
СОДЕРЖАНИЕ
1. Введение. 1
2. Принцип метода. 1
3. Приписанные
характеристики погрешности измерений и ее составляющих. 1
4. Средства измерений,
вспомогательные устройства, реактивы и материалы.. 2
4.1. Средства измерений. 2
4.2. Вспомогательные
устройства. 2
4.3. Реактивы и материалы.. 3
5. Требования безопасности. 4
6. Требования к
квалификации операторов. 4
7. Условия измерений. 4
8. Отбор и хранение проб. 4
9. Подготовка к выполнению
измерений. 5
9.1. Приготовление
растворов и реактивов. 5
9.2. Проверка чистоты и
очистка используемых реактивов и растворов. 6
9.3. Установление точной
концентрации стандартного раствора тиосульфата натрия. 7
10. Устранение мешающих
влияний. 7
11. Выполнение измерений. 8
12. Обработка результатов
измерений. 8
13. Оформление результатов
анализа. 9
14. Контроль качества
результатов анализа при реализации методики в лаборатории. 9
Приложение А. Определение
точной вместимости кислородных склянок. 9
Приложение б. Приготовление раствора гипохлорита
натрия. 10
Приложение в. Равновесная концентрация
растворенного кислорода (мг/дм3) в зависимости от температуры воды
(атмосферное давление 760 мм рт. ст., парциальное давление о2 0,209 атм) 10
Download Article
Download Article
In order for water to support life, there must be oxygen dissolved into the liquid. This oxygen is not part of the water molecule, H2O, but is oxygen gas, O2, dissolved in the water. There are a few ways to measure this dissolved oxygen content. One is by titration, another is with a meter, and you can also measure it using colorimetric methods, where a reactive substance responds to the oxygen levels.
-
1
Gather your materials. For this measurement, you need 2 flasks with stoppers, a calibrated pipette, a graduated pipette, manganese sulfate, water, alkali-iodide-azide, sulfuric acid, sodium thiosulfate, and a starch solution.[1]
-
2
Collect a sample. Take a 300 mL sample of water. This can be from a tap, a stream, a pond, or any other water source. Collect the sample in a flask with a stoppered top.[2]
Advertisement
-
3
Mix manganese sulfate with the water. Use a calibrated pipette to add 2 milliliters (0.068 fl oz) of manganese sulfate into the sample. Put the tip of the pipette just beneath the surface of the water before releasing the contents. Stopper your bottle and mix the manganese sulfate by inverting the bottle several times slowly.[3]
- If you drop the contents into the water they will come in contact with the air and this will introduce oxygen into the sample and alter results.
- If any air bubbles occur, then the sample is contaminated and you will need to start over.
-
4
Add alkali-iodide-azide to the sample. Next, add 2 milliliters (0.068 fl oz) of alkali-iodide-azide to the sample using a calibrated pipette. The tip of the pipette should be just below the surface of the water before ejecting the contents. Stopper the bottle and mix the alkali-iodide-azide by inverting the bottle slowly several times.[4]
- If oxygen is present you will observe the formation of floc. This is an orange-ish solid that will settle in the bottom of the flask.
-
5
Fix with sulfuric acid. Use a pipette to measure 2 milliliters (0.068 fl oz) of concentrated sulfuric acid. Drop the sulfuric acid into the solution. Do not place the tip of the pipette into the water. Mix the acid by inverting the flask several times. The floc should redissolve.[5]
- Wear gloves and goggles for safety when working with sulfuring acid. Avoid contact with skin and eyes. Do not ingest. Do not inhale.
-
6
Titrate 201 mL of sample. Measure exactly 201 mL of sample into a new flask. Place this sample beneath a graduated pipet filled with sodium thiosulfate. Add sodium thiosulfate until the sample turns a pale yellow color.[6]
- Write down the initial amount of sodium thiosulfate in the pipet.
- Stir the solution continually as you titrate.
-
7
Introduce starch solution. A starch solution will react with the iodine present in the sample to form a blue color. You only need to add 2 milliliters (0.068 fl oz) of starch solution. Stir or swirl the solution well.[7]
- Starch solution can be made by mixing water with corn or potato starch, or you can buy one premade.
-
8
Continue to titrate. Once the sample turns blue, continue titrating with sodium thiosulfate. Add the titrant slowly, as one drop will make a difference at the end of the titration. You should stop titrating when the blue color is gone from the sample.[8]
- Hold the sample up against a white background in order to look for blue color.
-
9
Understand the results. When the titration is complete, write down the amount of sodium thiosulfate left in the pipet. Subtract this amount from the initial amount of sodium thiosulfate to find how many mL of sodium thiosulfate you used to titrate the sample. The amount of sodium thiosulfate in mL is equal to the dissolved oxygen content in mg/L.[9]
- For example, if you used 8 mL of sodium thiosulfate, that would correspond to a dissolved oxygen content of 8 mg/L.
Advertisement
-
1
Calibrate the meter. Manually adjust the meter to read zero by turning the screw in the middle of the meter. Next, connect the probe and turn the meter on for fifteen minutes for optimum performance. Adjust the redline with the control knob to align with the 31 °C (87.8 °F) line and set the central line to 0.[10]
- All meters are calibrated differently. See the manufacturer’s instructions for variations that are specific to your meter.
- Meters are calibrated in Celsius not Fahrenheit.
-
2
Measure a sample of water. Place the probe into a sample of water that you wish to measure. Allow the meter to stabilize. Write down your reading. Check the sample a few times to make sure the meter is calibrated.[11]
-
3
Analyze the measurement. Understand that running water will have a higher dissolved oxygen content than still water. Higher altitudes mean less dissolved oxygen. Consider these things when you look at your measurement to be sure that the measurement makes sense given the sample you are taking.[12]
Advertisement
-
1
Choose your reagent. There are two reagents used to do colorimetric analysis of dissolved oxygen. One is indigo carmine and the other is rhodazine D. If you expect low levels of dissolved oxygen, rhodazine D is a good choice. Use indigo carmine for higher levels of dissolved oxygen.[13]
-
2
Introduce the reagent to your sample. Once you have chosen a reagent, introduce it to a sample of water. Drop the reagent into the sample of water and watch for a color change. The deeper the color, the more dissolved oxygen present.[14]
- Indigo carmine will produce a deep blue color.
- Rhodazine D will produce a deep pink color.
-
3
Measure the oxygen levels by matching the colors of the solution to the key. If you are using rhodazine D, record the dissolved oxygen range promptly at 30 seconds after adding the reagent. The same holds true for measuring small ranges of dissolved oxygen with indigo carmine. If you are measuring a sample with higher levels of dissolved oxygen, wait 2 minutes and record the result.[15]
Advertisement
Add New Question
-
Question
How do I determine if there is a low or high level of dissolved oxygen?
Bess Ruff is a Geography PhD student at Florida State University. She received her MA in Environmental Science and Management from the University of California, Santa Barbara in 2016. She has conducted survey work for marine spatial planning projects in the Caribbean and provided research support as a graduate fellow for the Sustainable Fisheries Group.
Environmental Scientist
Expert Answer
Each of the methods above provides a means of determining the level of dissolved oxygen in water. The first two will provide a numerical calculation of the level from which you can discern exactly whether it’s high or low. The colorimetric approach will give you a general sense of the level of dissolved oxygen depending on the color produced by the reagent.
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
Video
-
Make sure all containers are marked with metric system measurements.
Advertisement
-
Dispose of all chemicals ethically and safely.
-
All of these chemicals are extremely dangerous to human and animal well being. Use a lab coat, goggles, and latex gloves when performing the operation.
-
Sulfuric acid is a corrosive substance. Store in glass bottles and use extra caution.
Advertisement
References
About This Article
Article SummaryX
To measure the dissolved oxygen level of water with a meter, first manually adjust the meter to read zero. Next, connect the probe and turn the meter on for 15 minutes. Then, use the control knob to align the red line with the 31 degree Celsius line and set the central line to 0. Once you’ve finished calibrating the meter, place the probe into some water and write down the measurements on the meter. To learn how to estimate the oxygen level with colorimetric methods, keep reading!
Did this summary help you?
Thanks to all authors for creating a page that has been read 97,299 times.
Reader Success Stories
-
Murekye Vince
Mar 8, 2020
«This article has helped me to be smart when I research in the lab to test for DO as a parameter.»