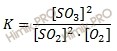Определение
концентрации сернистого ангидрида
основано на реакции окисления его йодом:
SO2
+ I2
+ 2H2O
= H2SO4
+ 2HI.
Для
определения концентрации SO2
в газе после контактирования в дрексель
14 наливают 2 мл 0,1 н раствора йода,
разбавляют его до половины водой и
прибавляют 5–10 капель крахмала. Газовая
смесь после контактного аппарата путем
переключения трехходового крана 13
пропускается последовательно через
дрексель 14 до полного обесцвечивания
йода, далее направляется в аспиратор
15. Продолжительность обесцвечивания
раствора йода фиксируется по секундомеру.
Объем газа, прошедшего через дрексель
за это время, равен объему воды, вытекшей
из аспиратора 15 в мерный цилиндр 16 плюс
объем сернистого газа, поглощенного 2
мл 0,1
н раствора йода (приведенного к условиям
опыта). Просасывание газа через аспиратор
ведут таким образом, чтобы давление в
аспираторе равнялось атмосферному, что
контролируется по положению уровня
жидкости в U-образной
трубке водяного манометра, установленного
на крышке аспиратора и регулируется
путем изменения скорости вытекания
воды из аспиратора. При этом 1 мл 0,1 н
раствора йода соответствует 0,003 203 г
SO2,
который при 0С
и 760 мм рт. ст. занимает объем, равный
1,095 мл.
Для
определения объемной доли SO2
в газе в условиях проведения анализа
необходимо его объем привести к нормальным
условиям.
Объем
SO2,
поглощенный 0,1 н раствором йода и
приведенный к нормальным условиям,
вычисляется по формуле
V0
= V
V
[T
P0
/ (273,15
(Ратм
– Рв)],
(61)
где
V
объем
0,1 н раствора йода, израсходованный во
время опыта, мл, V = 1,095
мл; T
температура
газа в аспираторе, С;
Р0
стандартное давление, 760 мм рт. ст.; Ратм
атмосферное давление во время опыта,
мм рт. ст.; Рв
давление водяного пара при температуре
опыта, мм рт. ст.
Температура
газа в аспираторе принимается равной
температуре окружающего воздуха.
Объемная
доля SO2
в газе, выходящем из контактного аппарата
без учета объема SO3
в процентах, рассчитывается по уравнению
=
V0
100 /(V0
+ Vв),
(62)
где
Vв
объем вошедшего в аспиратор газа,
соответствующий объему вытекшей из
аспиратора за это время воды, мл.
5.2.3. Расчет показателей процесса каталитического окисления диоксида серы
Основными
показателями, которые необходимо
рассчитать по результатам эксперимента,
являются фактическая степень превращения
XФ
и удельная производительность катализатора
Пк,
а также фиктивное время контактирования
.
Степень
превращения (контактирования), выраженная
в долях единицы, рассчитывают по формуле
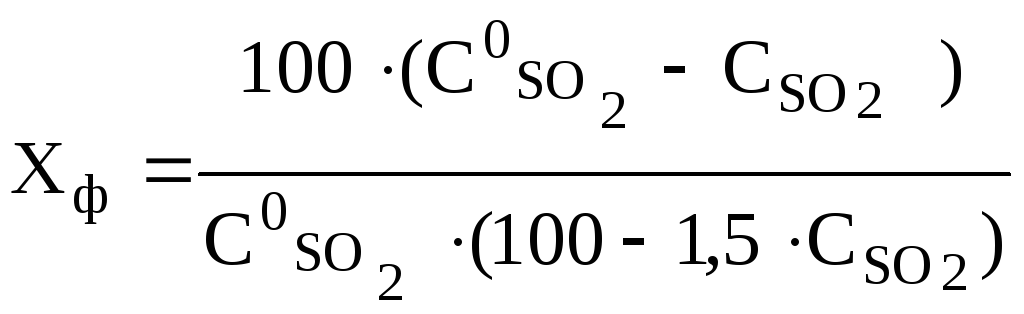
(63)
где
объемная доля SO2
на входе в контактный аппарат, %;
объемная доля SO2
в газе, выходящем из контактного аппарата
без учета объема SO3,
%.
Удельную
производительность катализатора, кг /
(м3
с), вычисляют по формуле
Пк
= G
/ Vк,
(64)
где
G
массовый расход SO3,
кг/с; Vк
объем контактной массы в аппарате, м3.
Условное время контактирования определяют по формуле
=
Vк
/V, (65)
где
Vкобъем катализатора,
м3;Vобъем газа, проходящий через катализатор
в единицу времени при нормальных
условиях, м3/с.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Вычислите константу равновесия
Равновесные концентрации в системе 2SO2 + O2 = 2SO3, составили [SO2] = 0,04 моль/л, [O2] = 0,06 моль/л, [SO3] = 0,02 моль/л. Вычислите константу равновесия и исходные концентрации оксида серы (IV) (SO2) и кислорода (O2).
Решение задачи
Рассмотрим обратимую химическую реакцию:
Вычислите константу равновесия. Константа равновесия данной реакции выражается уравнением:
Подставляя в формулу данные из условия задачи, вычислите константу равновесия:
K = (0,02)2 /(0,04)2 ⋅ 0,06 = 0,0004 /0,0016 ⋅ 0,06 = 4,17
Для нахождения исходных концентраций SO2 и О2 учтем, что, согласно уравнению реакции, из 2 моль SO2 и 1 моль О2 образуется 2 моль SO3. Поскольку по условию задачи в каждом литре системы образовалось 0,02 моль вещества SO3, то при этом было израсходовано 0,02 моль SO2 и 0,01 моль О2. Таким образом, искомые исходные концентрации равны:
C(SO2) = 0,04 + 0,02 = 0,06 (моль/л);
C(О2) = 0,06 + 0,01 = 0,07 (моль/л).
Вычислите константу равновесия.
Ответ:
константа равновесия 4,17;
исходная концентрация SO2 0,06 моль/л;
исходная концентрация О2 0,07 моль/л.
Похожие задачи
Найдите правильный ответ на вопрос ✅ «Найти массовую долю каждого элемента SO2 …» по предмету 📘 Химия, а если вы сомневаетесь в правильности ответов или ответ отсутствует, то попробуйте воспользоваться умным поиском на сайте и найти ответы на похожие вопросы.
Смотреть другие ответы
Главная » Химия » Найти массовую долю каждого элемента SO2
Куприянчик
Г.Г.
Учитель
химии ГУО «Гимназия № 2 г. Пинска»
Задачи на БИС
(табличный метод: было – израсходовано – стало)
Умение
решать расчётные задачи — это важная составляющая для успешной сдачи ЦТ. И
каждому учащему для того, чтобы научиться быстро и качественно решать задачи,
необходимо их решить немалое количество. Со временем у учащихся появляется
навык решения задач несколькими способами, и чем более простой способ решения
задачи они выберут, тем быстрее решиться задача. Учителю необходимо научить,
показать различные способы решения тех или иных задач. В данной статье я
предлагаю рассмотреть табличный метод решения задач на равновесие. Такого рода
задачи я называю – задачи на БИС (было – израсходовано – стало). Данный метод
не является новым, его используют уже давно многие учителя. Однако в литературе
он не часто встречаем. Сам метод является очень удобным. Я полагаю, он будет
полезен для молодых учителей.
Задача
1. Некоторое количество азота и водорода
смешали в сосуде емкостью 3дм3 и нагрели в присутствии железного
катализатора до установления химического равновесия. Определите исходные
концентрации (моль/дм3) веществ в сосуде,
если известно, что равновесная смесь содержала 1,0 моль азота , 2,4 моль
водорода и 0,7 моль аммиака.
Решение:
1)Записываем уравнение
реакции N2+3H2=2NH3.
Решение очень удобно оформлять в виде таблицы (сначала
вносятся известные данные, затем по ходу решения заполняется таблица): стало —
это равновесные количества веществ или концентрации веществ, израсходовано —
это сколько прореагировало, было – исходные количества или концентрации.
|
N2 |
H2 |
NH3 |
|
|
Было |
1,35 |
3,45 |
— |
|
Израсходовано |
0,35 |
1,05 |
— |
|
Стало |
1,0 |
2,4 |
0,7 |
2)По уравнению реакции
находим химическое количество прореагировавшего азота: n(N2)=0,35
моль (вносим в таблицу).
3)Находим
прореагировавшее химическое количество водорода: n(H2)
= 0,35*3= 1,05 моль (вносим в таблицу).
4)Затем находим nисх(N2)=1,0+0,35=1,35
моль.
5)Находим концентрацию
исходного азота: сисх
(N2)=n/V=1,35/3=0,45моль/дм3
6)Находим сисх(H2)=3,45/3=1,15
моль/дм3 .
Ответ:
сисх
(N2)=0,45моль/дм3,
сисх(H2)=1,15
моль/дм3 .
Задача 2.В
гомогенной системе установилось равновесие:
2SO2+O2
↔ 2SO3
Равновесные химические
количества (моль) SO2,
O2
и SO3
соответственно равны 0,1, 0,2 , 0,6.
Определите исходные
химические количества SO2
и O2.
Решение
1)Записываем уравнение
реакции 2SO2+O2=2SO3.
Вносим известные значения
в таблицу и заполняем по мере решения.
|
SO2 |
O2 |
SO3 |
|
|
Было |
0,7 |
0,5 |
— |
|
Израсходовано |
0,6 |
0,3 |
— |
|
Стало |
0,1 |
0,2 |
0,6 |
2)Если SO3
образовалось n(SO3)=
0,6 моль, то значит, прореагировало n(SO2)=
0,6 моль (по уравнению реакции), а химическое количество прореагировавшего O2
по уравнению будет в 2 раза меньше nпрор(O2)=0,6/2=0,3моль.
3)Находим химическое
количество исходного SO2:
nисх(SO2)=0,1+0,6=0,7(моль),
nисхO2=0,2+0,3=0,5(моль).
Ответ: nисх(SO2)=0,7(моль),
nисхO2=0,5(моль).
Задача
3.В замкнутый сосуд поместили 6 моль H2
и 3 моль O2.
Через некоторое время установилось равновесие 2H2(г)
+ O2(г)
=2H2O
(г) и образовалась вода химическим количеством 1,5 моль. Как изменилось
давление в сосуде к моменту установления равновесия?
Решение
1)Записываем уравнение 2H2(г)
+ O2(г)
=2H2O.
Вносим в таблицу значение
количества воды и по мере решения заполняем эту таблицу.
|
H2 |
O2 |
H2O |
|
|
Было |
6 |
3 |
— |
|
Израсходовано |
1,5 |
0,75 |
— |
|
Стало |
4,5 |
2,25 |
1,5 |
2)Находим химическое
количество прореагировавшего водорода: nпрор(H2)=n(H2O);
nпрор(H2)=1,5
моль.
2)Находим химическое
количество прореагировавшего (израсходовано) кислорода: nпрор
(O2)=1,5/2=0,75
моль
3)Находим равновесные
химические количества (стало) H2
и O2;
nравн(H2)=4,5
моль
nравн(O2)=3-0,75=2,25
моль.
4) Находим исходное
количество водорода и кислорода: nисх
(смеси H2+O2)=9
моль
5)Находим
количество равновесной смеси: n2
(смеси)=4,5+2,25+1,5=8,25(моль)
6)Находим изменение
давление по количествам: ∆р = nисх(смеси)
/ n2
(смеси)= 9/8,25=1,091 (давление уменьшится), так как уменьшилось химическое
количество.
Ответ: уменьшилось
в 1,091 раза.
Задача
4.Равновесные
молярные концентрации СO, O2 и CO2 после
установления равновесия 2CO(г) + O2(г) = 2CO2(г) равны
0,3; 0,2 и 0,1 (моль/дм3) соответственно. Рассчитайте объемную долю кислорода в
исходной газовой смеси (исходная молярная концентрация CO2 равна
нулю).
Решение
1)Записываем
уравнение 2СО(г) + O2(г)
=2СO2(Г)
2)Вносим
в таблицу значение равновесных молярных концентраций веществ.
|
СО |
O2 |
СО2 |
|
|
Было |
0,4 |
0,25 |
— |
|
Израсходовано |
0,1 |
0,05 |
— |
|
Стало |
0,3 |
0,2 |
0,1 |
3)По уравнению находим молярные
концентрации прореагировавших угарного газа СО и кислорода: cпрор(CO)=c(CO2)=0,1моль/дм3,
спрор(О2)==
=0,05 (моль/дм3).
4)Затем находим
исходные молярные концентрации угарного газа и кислорода:
сисх(CO)=
cпрор(CO)
+ cравн
(СО) =0,3+0,1=0,4 (моль/дм3); сисх(О2)=
спрор(О2)+ сравн(О2)=0,2+0,05=0,25 (моль/дм3).
5) Находим мольную
долю кислорода в смеси, которая будет равна объёмной доле: если
предположить, что объём смеси равен 1 дм3, то n(O2)=0,25
моль, n(CO)=0,4
моль, мольная доля равна
ᵡ(О2)
= ᵠ = =
=
0,385.
Ответ: ᵡ (О2)=0,385.
Задача 5.В
гомогенной системе установилось равновесие:
2SO2(г)+O2(г)
↔ 2SO3(г)
Равновесная молярная
концентрация SO3
равна 0,3 моль/дм3.Рассчитай равновесную молярную концентрацию
оксида серы(II), если известно, что к
моменту установления равновесия прореагировало 60 % от начального химического
количества оксида серы(II).
Решение
1)Записываем уравнение реакции2SO2(г)+O2(г)
↔ 2SO3(г).
Вносим известные значения
в таблицу и заполняем по мере решения.
|
SO2 |
SO3 |
|
|
Было |
0,5 |
— |
|
Израсходовано |
0,3 |
— |
|
Стало |
0,2 |
0,3 |
2) Находим по уравнению
молярную концентрацию израсходованного оксида SO2:
c(SO2)=c(SO3)=0,3моль/дм3.
3)Так как SO2
к моменту установления равновесия прореагировало 60 % от начального
химического количества, находим исходную молярную концентрацию SO2:
сисх(SO2)=0,3/0,6=0,5
моль/дм3.
4) Находим равновесную
молярную концентрацию SO2:
сравн(SO2)=сисх—
сизр=0,5-0,3=0,2 моль/дм3.
Ответ: сравн(SO2)=0,2
моль/дм3.
Константа равновесия данной реакции выражается уравнением:
K = [SO3]^2/[SO2]^2*[O2]
Подставляя в него данные, получаем:
K = 0,01/0,8*0,03 = 0,417
Для нахождения исходных концентраций веществ SO2 и O2 учтем, что, согласно
уравнению реакции, из 2 моля SO2 и 1 молей O2 образуется 2 моль SO3. Поскольку по
условию задачи образовалось 0,01 моля SO3, то при этом было израсходовано 0,01 моля SO2 и 0,01/2 = 0,005 моля O2. Таким образом, искомые исходные концентрации равны:
[SO3]0 = 0,01 + 0,8 = 0,81 моль/л;
[O2]0 = 0,005 + 0,003 = 0,008 моль/л.