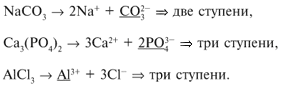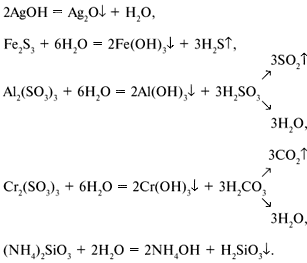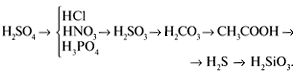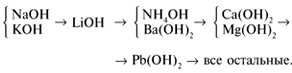Гидролиз –
обменная реакция вещества с водой.
Гидролиз солей – реакция соли с водой,
приводящая к образованию слабой кислоты
или слабого основания. Схема гидролиза:
Км++НОН↔КОН(м-1)++Н+
Ан-+НОН↔НА(н-1)-+ОН—
Гидролиз обусловлен
образованием слабой кислоты НА(н-1)-
или слабого основания КОН(м-1)+.
Соли, образованные
анионом сильной кислоты и катионом
слабого основания, гидролизу не
подвергаются.
Возможны три
варианта гидролиза солей: по катиону,
по аниону и по катиону и аниону
одновременно.
1.
Гидролиз по
аниону –
ему подвергаются соли, образованные
катионом сильного основания и анионом
слабой кислоты (К2СО3,
Na2S,
Na2SО3,
CH3COONa
и т.д.).
В данном случае
при гидролизе – щелочная среда (рН>7).
Пример:
CH3COONa
+ НОН↔ CH3COOН+
NaOH
CH3COO—+
НОН↔CH3COOН+ОН—
Для многозарядного
аниона – протекает ступенчато.
1 ступень Na2SО3+
НОН ↔ NaНSО3+
NaOH
SО32-+
НОН ↔ НSО3—+
ОН—
2 ступень NaНSО3+
НОН ↔ Н2SО3+
NaOH
НSО3—+
НОН ↔ Н2SО3+
ОН—
2. Гидролиз
по катиону.
Ему подвергаются соли, образованные
катионом слабого основания и анионом
сильной кислоты (ZnCl2,
Cu(NO3)2
и др.).
Среда при гидролизе
кислая (рН<7). Например:(для многоосновных
— ступенчато).
1 Ступень Cu(NO3)2+
НОН ↔ CuОНNO3+
НNO3
Cu2++
НОН ↔CuОН++
Н+
2 Ступень CuОНNO3+
НОН ↔Cu(ОН)2+НNO3
CuОН++НОН↔
Cu(ОН)2+Н+
(хотя в данном случае 2-ой ступенью
принебрегают).
3. Гидролиз
по катиону и аниону
– гидролиз солей образованных катионом
слабого основания и анеоном слабой
кислоты. (CuF2,
Al2S3
и т.д.)
CuF2+НОН↔CuОНF+НF
Cu2++НОН↔CuОН++Н+
CuОНF+
НОН ↔ Cu(ОН)2+
НF
CuОН++
НОН ↔ Cu(ОН)2+
Н+
В данном случае
гидролиз протекает довольно интенсивно.
Образующиеся при гидролизе ОН—
и Н+
связываются в молекулу НОН, что усиливает
гидролиз и по катиону и по аниону. Реакция
среды зависит от соотношения констант
диссоциации образующихся кислоты и
основания. В данном случае КНF
>КCuОН+,
рН <7.
Если кислота и
основание не только слабые электролиты,
но и малорастворимые или неустойчивые
вещества, то гидролиз в ряде случаев
идет до конца и протекает практически
необратимо:
Al2S3+6H2O→2Al(OH)3↓+3H2S↑
(Необратимо гидролизующиеся соли
невозможно получить в результате реакции
обмена в водном растворе).
Количественные
характеристики гидролиза: это степень
гидролиза (h) и константа гидролиза (Kг).
h=Сг/Со,
где Сг
– концентрация гидролизованой части
соли, Со
– общая концентрация соли в растворе.
В общем виде
гидролиз по аниону: An—+
НОН↔HAn+
ОН—
Kг=CHAn∙CОН-/Cсоли
Гидролиз по катиону:
Kat++
НОН↔ KatОН+ Н+,
Kг=CKatOH∙CН+/Cсоли
Для гидролиза и
по катиону и по аниону Kг=
CKatOH∙CHAn
/ CН+∙
CОН-
Каждая ступень
многозарядных ионов – имеет свою
константу гидролиза.
Kг=с∙h2
или же h=
Литература:
-
Ахметов,
Н.С. Общая и неорганическая химия /
Н.С.Ахметов. – 3-е изд. – М.: Высшая
школа, 2000. – 743с. -
Карапетьянц
М.Х. Общая и неорганическая химия / М.Х.
Карапетьянц, С.И.Дракин. – М.: Высшая
школа, 2002. -
Коровин
Н.В. Общая химия / Н.В.Коровин. – М.: Высшая
школа, 2006. – 557 с. -
Кузьменко
Н.Е. Краткий курс химии / Н.Е. Кузьменко,
В.В Еремин, В.А. Попков. – М.: Высшая
школа , 2002. – 415 с.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
…
В общем случае, гидролиз солей – это процесс обменного разложения воды и растворенной в ней соли – электролита, приводящий к образованию малодиссоциирующего вещества.
Гидролиз является частным случаем сольволиза – обменного разложения растворенного вещества и растворителя.
Характеризовать гидролиз количественно позволяют такие величины, как Степень гидролиза и константа гидролиза.
Степень гидролиза
Степень гидролиза — это соотношение количества подвергающейся гидролизу соли nгидр и общего количества растворенной соли nобщ.
Обычно, ее обозначают через hгидр (или α ):
hгидр = (nгидр/nобщ)·100 %
Величина hгидр увеличивается с уменьшением силы образующих соль кислоты или основания.
Константа гидролиза
Представим в общем виде процесс гидролиза соли, в котором в роли соли выступает – МА, а НА и МОН — соответственно, кислота и основание, которые образуют данную соль:
MA + H2O ↔ HA + MOH
Применив закон действующих масс, запишем константу, соответствующую этому равновесию:
K = [HA]·[MOH]/[MA]·[H2O]
Известно, что концентрация воды в разбавленных растворах, имеет практически постоянное значение, поэтому ее можно включить в константу
K·[H2O]= Kг,
тогда соотношение для константы гидролиза соли Kгбудет иметь такой вид:
Kг = [HA]·[MOH]/[MA]
По величине константы гидролиза можно судить о полноте гидролиза:
чем больше значение константы гидролиза Kг, тем в большей мере протекает гидролиз.
Константа и степень гидролиза связаны соотношением:
Kг = С·h2/(1- h), моль/л
Где С – концентрация соли в растворе,
h- степень гидролиза.
Это выражение можно упростить, т.к. обычно h˂˂1, тогда
Kг = С·h2
Зная, константу гидролиза, можно определить pH среды:
Kг = [HA]·[MOH]/[MA]
Концентрация образовавшейся кислоты равна концентрации гидроксид ионов, тогда
Kг = [OH—]2/[MA]
Используя это выражение можно вычислить pH раствора
[OH—] = (Kг·[MA])1/2 моль/л
[H+] = 10-14/[OH—] моль/л
pH = -lg[H+]
Гидролиз солей можно представить, как поляризационное взаимодействие ионов и их гидратной оболочки.
Гидролиз протекает тем полнее, сильнее поляризующее действие ионов.
Возможны 4 случая протекания гидролиза:
1. Соли, образованные сильным основанием и сильной кислотой (гидролиз не протекает)
Соли, образованные сильным основанием и сильной кислотой не подвергаются гидролизу.
В этом случае, гидролиз практически не происходит, т.к. катионы и анионы, образующиеся в растворе при диссоциации соли, слабо поляризуют гидратную оболочку. pH среды не изменяется (рН ≈ 7):
NaCl ↔ Na+ + Cl—
Na+ + HOH ↔ реакция практически не протекает
Cl— + HOH ↔ реакция практически не протекает
2. Соли, образованные слабым основанием и сильной кислотой (гидролиз по катиону)
Такое соединение, при ионизации, образует катионы, способные к поляризации гидратной оболочки и анионы, которые их поляризуют слабо. Тогда гидролиз проходит по катиону, при этом среда носит кислый характер, т.е. рН ˂ 7:
NH4Cl ↔ NH4+ + Cl—
NH4+ + HOH ↔ NH4OH + H+
Cl—+ HOH ↔ реакция практически не идет
NH4Cl+ HOH ↔ NH4OH + HCl
Для солей, образованных слабым основанием и сильной кислотой, константа гидролиза и константа диссоциации основания связаны соотношением:
Kг = KH2O/Kосн
Понятно, что чем меньше сила основания, тем в большей степени протекает гидролиз.
Если соль образованна слабым основанием многовалентного металла и сильной кислотой, то ее гидролиз будет протекать ступенчато:
FeCl2 ↔ Fe2+ + 2Cl—
| I ступень | Fe2++ HOH ↔ (FeOH)+ + H+ FeCl2 + HOH ↔ (FeOH)Cl + HCl |
| II ступень | (FeOH)+ + HOH ↔ Fe(OH)2 + H+ (FeOH)Cl + HOH↔ Fe(OH)2 + HCl |
Константа гидролиза по первой ступени связана с константой диссоциации основания по второй ступени, а константа гидролиза по второй ступени — с константой диссоциации основания по первой ступени:
Kг1 = KH2O/Kосн2
Kг2 = KH2O/Kосн1
Поскольку первая константа диссоциации кислоты всегда больше второй, то первая константа гидролиза всегда больше, чем константа вторая гидролиза, так как первая константа диссоциации основания всегда больше второй
Kг1 > Kг2
Отсюда следует, что по первой ступени, гидролиз всегда будет протекать в большей степени, чем по второй. Этому также способствуют ионы, которые образуются при гидролизе по первой ступени, они приводят подавлению гидролиза по второй ступени, смещая равновесие влево.
Сравнивая величины Kг и Kосн можно качественно определить pH среды.
Так, если Kгнамного больше Kосн, то среда сильнокислая, при Kгнамного меньшей Kосн — среда слабокислая, а если Kги Kосн сопоставимы, то — среднекислая.
3. Соль, образованная сильным основанием и слабой кислотой (гидролиз по аниону)
Такое соединение в растворе образует слабополяризующие катионы и среднеполяризующие анионы. Гидролиз протекает по аниону, и в его результате создается щелочная среда, pH > 7:
NaCN ↔ Na+ + CN—
CN— + HOH ↔ HCN + OH—
Na+ + HOH ↔ реакция практически не идет
NaCN + HOH ↔ HCN + NaOH
Константа гидролиза и константа диссоциации кислоты связаны зависимостью:
Kг = KH2O/Kк-ты
Т.е. гидролиз соли протекает тем полнее, чем слабее образующая эту соль, кислота.
Возможен гидролиз соли, образованной слабой многоосновной кислотой и сильным основанием. В этом случае гидролиз протекает по ступеням:
Na2SO3 ↔ 2Na+ + SO32-
| I ступень | SO32- + HOH ↔ HSO3— + OH— Na2SO3 + HOH ↔ NaHSO3 + NaOH |
| II ступень | HSO3— + HOH ↔ H2SO3 + OH— NaHSO3 + HOH ↔ H2SO3 + NaOH |
В этом случае, константа гидролиза по первой и второй ступеням определяется соотношениями:
Kг1 = KH2O/Kк-ты2
Kг2 = KH2O/Kк-ты1
Следует помнить, что гидролиз по второй ступени протекает в ничтожно малой степени.
Сравнивая величины Kг и Kк-ты, можно качественно определить pH среды. Так, если Kгнамного больше Kк-ты, то среда сильнощелочная, при Kгнамного меньшей Kк-ты — среда слабощелочная, а если Kги Kосн сопоставимы, то — среднещелочная.
4. Соли, образованные слабым основанием и слабой кислотой (гидролиз и по катиону и по аниону)
Такие соли, при ионизации образуют среднеполяризующие катионы и анионы, поэтому гидролиз возможен как по катиону, так и по аниону.
При этом относительная сила образовавшихся кислоты и основания, будут влиять на характер среды (слабокислая или слабощелочная, pH ≈ 7). Такого типа гидролиз протекает особо полно, обычно с образованием малорастворимого вещества:
Al2S3 + 6HOH ↔ 2Al(OH)3↓+ 3H2S↑
Константу гидролиза можно рассчитать, зная константы диссоциации кислоты и основания с помощью следующего соотношения:
Kг = KH2O/(Kк-ты·Kосн)
Совместный гидролиз солей
Совместный гидролиз протекает при взаимодействии растворов двух солей, одна из которых образована слабым основанием и сильной кислотой, а вторая напротив сильным основанием и слабой кислотой. Т.е. одна соль гидролизуется по катиону, а другая – по аниону.
В таких случаях гидролиз взаимно усиливается.
Например, рассмотрим совместный гидролиз растворов солей хлорида алюминия и сульфида натрия:
При гидролизе хлорида алюминия соль гидролизуется по катиону:
AlCl3 ↔ Al3+ + 3Cl—
Al3+ + 3HOH ↔ Al(OH)3 + 3H+
При гидролизе сульфида натрия соль гидролизуется по аниону:
Na2S ↔ 2Na+ + S2-
S2- + 2HOH ↔ H2S + 2OH—
Суммарная реакция гидролиза:
2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3↓ + 3H2S↑ + 6NaCl
Влияние различных факторов на протекание гидролиза
- Природа соли. Это видно из выражения для константы гидролиза.
- Концентрация соли и продуктов реакции. В соответствии с принципом Ле-Шателье, равновесие должно смещаться вправо, при этом увеличивается концентрация ионов водорода (или гидроксид-ионов), что приводит к уменьшению степени гидролиза.
- Температура. Известно, что гидролиз притекает с поглощением теплоты (эндотермическая реакция), поэтому согласно принципу Ле Шателье, при увеличении температуры равновесие сдвигается вправо, что ведет к росту степени гидролиза.
В разделе Задачи к разделу Гидролиз солей приведены задачи на определение степени и константы гидролиза, составление уравнений гидролиза, определение рН среды и др.
Темы кодификатора ЕГЭ: Гидролиз солей. Среда водных растворов: кислая, основная и щелочная.
Гидролиз – взаимодействие веществ с водой. Гидролизу подвергаются разные классы неорганических и органических веществ: соли, бинарные соединения, углеводы, жиры, белки, эфиры и другие вещества. Гидролиз солей происходит, когда ионы соли способны образовывать с Н+ и ОН— ионами воды малодиссоциированные электролиты.
Гидролиз солей может протекать:
→ обратимо: только небольшая часть частиц исходного вещества гидролизуется.
→ необратимо: практически все частицы исходного вещества гидролизуются.
Для оценки типа гидролиза необходимо рассмотреть соль, как продукт взаимодействия основания и кислоты. Любая соль состоит из металла и кислотного остатка. Металлы соответствует основание или амфотерный гидроксид (с той же степенью окисления, что и в соли), а кислотному остатку — кислота. Например, карбонату натрия Na2CO3 соответствует основание — щелочь NaOH и угольная кислота H2CO3.
Обратимый гидролиз солей
Механизм обратимого гидролиза будет зависеть от состава исходной соли. Можно выделить 4 основных варианта, которые мы рассмотрим на примерах:
1. Соли, образованные сильным основанием и слабой кислотой, гидролизуются ПО АНИОНУ.
Примеры таких солей — CH3COONa, Na2CO3, Na2S, KCN.
Реакция гидролиза:
CH3COONa + HOH ↔ CH3COOH + NaOH
в ионной форме:
CH3COO— + Na+ + HOH ↔ CH3COOH + Na+ + OH—
сокращенное ионное уравнение:
CH3COO— + HOH ↔ CH3COOH + OH—
Таким образом, при гидролизе таких солей в растворе образуется небольшой избыток гидроксид-ионов OH—. Водородный показатель такого раствора рН>7.
Гидролиз солей многоосновных кислот (H2CO3, H3PO4 и т.п.) протекает ступенчато, с образованием кислых солей:
CO32- + HOH ↔ HCO32- + OH—
или в молекулярной форме:
Na2CO3 + HOH ↔ NaHCO3 + NaOH
2 ступень:
HCO3— + HOH ↔ H2CO3 + OH—
или в молекулярной форме:
NaHCO3 + HOH ↔ H2CO3 + NaOH
Продукты гидролиза по первой ступени подавляют вторую ступень гидролиза, в результате вторая ступень гидролиза протекает незначительно.
2. Соли, образованные слабым основанием и сильной кислотой, гидролизуются ПО КАТИОНУ. Пример такой соли: NH4Cl, FeCl3, Al2(SO4)3 Уравнение гидролиза:
NH4+ + HOH ↔ NH3·H2O + H+
или в молекулярной форме:
NH4Cl + HOH ↔ NH3·H2O + HCl
При этом катион слабого основания притягивает гидроксид-ионы из воды, а в растворе возникает избыток ионов Н+. Водородный показатель такого раствора рН<7.
Соли, образованные многокислотными основаниями, гидролизуются ступенчато, образуя катионы основных солей. Например:
I ступень:
Fe3+ + HOH ↔ FeOH2+ + H+
FeCl3 + HOH ↔ FeOHCl2 + HCl
II ступень:
FeOH2+ + HOH ↔ Fe(OH)2+ + H+
FeOHCl2 + HOH ↔ Fe(OH)2Cl+ HCl
III ступень:
Fe(OH)2+ + HOH ↔ Fe(OH)3 + H+
Fe(OH)2Cl + HOH ↔ Fe(OH)3 + HCl
Гидролиз по второй и, в особенности, по третьей ступени практически не протекает при комнатной температуре.
3. Соли, образованные слабым основанием и слабой кислотой, гидролизуются И ПО КАТИОНУ, И ПО АНИОНУ.
Примеры таких солей: CH3COONH4, (NH4)2CO3, HCOONH4,
Уравнение гидролиза:
CH3COO— + NH4+ + HOH ↔ CH3COOH + NH3·H2O
CH3COONH4 + HOH ↔ CH3COOH + NH3·H2O
В этом случае реакция раствора зависит от соотношения констант диссоциации образующихся кислот и оснований. В большинстве случаев реакция раствора будет примерно нейтральной, рН ≅ 7. Точное значение рН зависит от относительной силы основания и кислоты.
4. Гидролиз солей, образованных сильным основанием и сильной кислотой, в водных растворах НЕ ИДЕТ.
Сведем вышеописанную информацию в общую таблицу:
Необратимый гидролиз
Необратимый гидролиз происходит, если при гидролизе выделяется газ, осадок или вода, т.е. вещества, которые при данных условиях не могут взаимодействовать между собой. Необратимый гидролиз является химической реакцией, т.к. реагирующие вещества взаимодействуют практически полностью.
Варианты необратимого гидролиза:
- Гидролиз, в который вступают растворимые соли 2х-валентных металлов (Be2+, Co2+, Ni2+, Zn2+, Pb2+, Cu2+ и др.) с сильным ионизирующим полем (слабые основания) и растворимые карбонаты/гидрокарбонаты. При этом образуются нерастворимые основные соли (гидроксокарбонаты):
2MgCl2 + 2Na2CO3 + H2O = Mg2(OH)2CO3 + 4NaCl + CO2
2МеCl2 + 2Na2CO3 + Н2О = (МеОН)2CO3 + 4NaCl + СО2 (МеII, кроме Fe, Ca,Sr,Ba).
! Исключения: (соли Ca, Sr, Ba и Fe2+) – в этом случае получим обычный обменный процесс:
CaCl2 + Na2CO3 = CaCO3 + 2NaCl,
МеCl2 + Na2CO3 = МеCO3 + 2NaCl (Ме – Fe, Ca, Sr, Ba).
- Взаимный гидролиз, протекающий при смешивании двух солей, гидролизованных по катиону и по аниону. Продукты гидролиза по второй ступени усиливают гидролиз по первой ступени и наоборот. Поэтому в таких процессах образуются не просто продукты обменной реакции, а продукты гидролиза (совместный или взаимный гидролиз).Соли металлов со степенью окисления +3 (Al3+, Cr3+) и соли летучих кислот (карбонаты, сульфиды, сульфиты) при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ (H2S, SO2, CO2):
2AlCl3 + 3K2S +6H2O = 2Al(OH)3 + 3H2S↑ + 6KCl,
2CrCl3 + 3K2CO3 + 3H2O = 2Сr(ОН)3 + 3СO2 + 6KCl,
2МеCl3 + 3Na2CO3 + 3Н2О=2Ме(ОН)3 + 6NaCl + 3СО2 (МеIII),
2МеCl3 + 3Na2SO3 + 3Н2О=2Ме(ОН)3 + 6NaCl + 3SО2 (МеIII),
2МеCl3 + 3Na2S + 3Н2О=2Ме(ОН)3 + 6NaCl + 3H2S (МеIII).
Соли Fe3+ при взаимодействии с карбонатами также при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ:
2FeCl3 + 3K2CO3 + 3H2O = 2Fe(ОН)3 + 3СO2 + 6KCl
! Исключения: при взаимодействии солей трехвалентного железа с сульфидами реализуется окислительно-восстановительная реакция:
2FeCl3 + 3K2S(изб) = 2FeS + S↓ + 6KCl (при избытке сульфида калия)
При взаимодействии солей трехвалентного железа с сульфитами также реализуется окислительно-восстановительная реакция.
Полные уравнения таких реакций выглядят довольно сложно. Поначалу я рекомендую составлять такие уравнения в 2 этапа: сначала составляем обменную реацию без участия воды, затем разлагаем полученный продукт обменной реакции водой. Сложив эти две реакции и сократив одинаковые вещества, мы получаем полное уравнение необратимого гидролиза.
3. Гидролиз галогенангидридов и тиоангидридов происходит также необратимо. Галогенангидриды разлагаются водой по схеме ионного обмена (H+OH—) до соответствующих кислот (в случае водного гидролиза) и солей (в случае щелочного гидролиза). Степень окисления центрального элемента и остальных при этом не изменяется!
SO2Cl2 + 2 H2O = H2SO4 + 2 HCl,
SOCl2 + 2 H2O = H2SO3 + 2HCl,
PCl5 + 4 H2O = H3PO4 + 5HCl,
CrO2Cl2 + 2H2O = H2CrO4 + 2HCl,
PCl5 + 8NaOH = Na3PO4 + 5NaCl + 4H2O,
Галогенангидрид – это соединение, которое получается, если в кислоте ОН-группу заменить на галоген. При гидролизе галогенангидридов кислот образуются соответствующие данным элементам и степеням окисления кислоты и галогеноводородные кислоты.
POCl3 + 3H2O = H3PO4 + 3HCl
Галогенангидриды некоторых кислот:
| Кислота | Галогенангидриды |
| H2SO4 | SO2Cl2 |
| H2SO3 | SOCl2 |
| H2CO3 | COCl2 |
| H3PO4 | POCl3, PCl5 |
Тиоангидриды (сульфангидриды) — так называются, по аналогии с безводными окислами (ангидридами), сернистые соединения элементов (например, Sb2S3, As2S5, SnS2, CS2 и т. п.).
- Необратимый гидролиз бинарных соединений, образованных металлом и неметаллом:
- сульфиды трехвалентных металлов вводе необратимо гидролизуются до сероводорода и и гидроксида металла:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
при этом возможен кислотный гидролиз, в таком случае образуются соль металла и сероводород:
Al2S3 + 6HCl = 2AlCl3 + 3H2S
- гидролиз карбидов приводит к образованию гидроксида металла в водной среде, соли металла в кислой де и соответствующего углеводорода — метана, ацетилена или пропина:
Ca+2C-12 + H2O = Ca+2(OH)2 + C-12H2
Al+34C-43 + 12H2O = 4Al+3(OH)3 + 3C-4H4,
Ca3N2 + H2O =
Ca3P2 + H2O =
Mg2Si + H2O =
- Некоторые соли необратимо гидролизуются с образованием оксосолей:
BiCl3 + H2O = BiOCl + 2HCl,
SbCl3 + H2O = SbOCl + 2HCl.
Алюмокалиевые квасцы:
KAl(SO4)2 + K2S + H2O =
MgCl2 + NaНCO3 + H2O =
ZnSO4 + CsНCO3 + H2O =
CdSO4 + RbНCO3 + H2O =
CaSO4 + Rb2CO3 + H2O =
FeCl2 + Rb2CO3 + H2O =
Количественно гидролиз характеризуется величиной, называемой степенью гидролиза.
Степень гидролиза (α) — отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. В случае необратимого гидролиза α≅1.
Факторы, влияющие на степень гидролиза:
1. Температура
Гидролиз — эндотермическая реакция! Нагревание раствора приводит к интенсификации процесса.
Пример: изменение степени гидролиза 0,01 М CrCl3 в зависимости от температуры:
2. Концентрация соли
Чем меньше концентрация соли, тем выше степень ее гидролиза.
Пример: изменение степени гидролиза Na2CO3 в зависимости от температуры:
По этой причине для предотвращения нежелательного гидролиза хранить соли рекомендуется в концентрированном виде.
3. Добавление к реакционной смеси кислоты или щелочи
Изменяя концентрация одного из продуктов, можно смещать равновесие реакции гидролиза в ту или иную сторону.
Пройти тест по теме Гидролиз:
Здесь вы можете потренироваться в решении тестовых заданий в формате ЕГЭ по теме Гидролиз.
Тренировочные тесты по теме «Гидролиз»( с ответами)
268
Создан на
16 января, 2022 От Admin
Тренажер задания 21
Тренажер задания 21 ЕГЭ по химии
1 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) KHCO3
2) Ba(NO3)2
3) ZnSO4
4) HCIO3
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация (моль/л) всех растворов одинаковая.
2 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) сероводород
2) аммиак
3) бромоводород
4) нитрат бария
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
3 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) FeCl2
2) HNO3
3) K3PO4
4) LiOH
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация (моль/л) всех растворов одинаковая.
4 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) сероводород
2) иодоводород
3) сульфат лития
4) карбонат рубидия
Запишите номера веществ в порядке возрастания значения pН их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
5 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) KF
2) LiNO3
3) (NH4)2SО4
4) H2SО4
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация (моль/л) всех растворов одинаковая.
6 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) Na2CO3
2) Н3РО4
3) Ва(NO3)2
4) Са(ОН)2
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
7 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) Na2CO3
2) ZnCl2
3) K2SO4
4) HBr
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация (моль/л) всех растворов одинаковая.
8 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) NH4NO3
2) HNO3
3) Na2S
4) K2SO4
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
9 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) уксусная кислота
2) метиламин
3) азотная кислота
4) гидроксид кальция
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
10 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) CH3COOK
2) SrCl2
3) FeCl2
4) HNO3
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация (моль/л) всех растворов одинаковая.
Ваша оценка
The average score is 31%
Гидролиз
Гидролиз (греч. hydor — вода и lysis — разрушение) — процесс расщепления молекул сложных химических веществ за счет реакции с молекулами воды.
В химии, как и в жизни, разрушается чаще всего нестойкое и слабое (стойкое и сильное выдерживает удар). Запомните, что гидролиз (вода) разрушает «слабое» — это правило вам очень пригодится.
Любая соль состоит из остатка основания и кислоты. Абсолютно любая:
- NaCl — производное основания NaOH и кислоты HCl
- KNO3 — производное основания KOH и кислоты HNO3
- CuSO4 — производное основания Cu(OH)2 и кислоты H2SO4
- Al3PO4 — производное основания Al(OH)3 и кислоты H3PO4
- Ca(NO2)2 — производное основания Ca(OH)2 и кислоты HNO2
Чтобы успешно решать задания по теме гидролиза и писать реакции, вам следует запомнить, какие основания и кислоты являются слабыми, а какие — сильными.
При изучении гидролиза я рекомендую ученикам сохранить на гаджет схему, которую вы видите ниже. Для того, чтобы приобрести нужный опыт — она незаменима. Пользуйтесь ей как можно чаще, подглядывайте в нее и она незаметно окажется в вашем интеллектуальном составляющем 
По катиону, по аниону или нет гидролиза?
Итак, если в состав соли входит остаток сильного основания и остаток сильной кислоты — гидролиза не происходит. Примеры: NaCl, KBr, CaSO4. Также гидролиза не происходит, если соль нерастворима (вне зависимости от того, чем она образована): AlPO4, FeSO3, CaSO3.
Если в состав соли входит остаток слабого основания и остаток сильной кислоты, то гидролиз идет по катиону. Помните, что гидролиз разрушает слабое, в данном случае — катион. Примеры: AlCl3, MgBr2, Cr2SO4, NH4NO3.
Катион NH4 + и его основание NH4OH , несмотря на растворимость, является слабым, поэтому гидролиз будет идти по катиону в соли NH4Cl. Замечу также, что Ca(OH)2 считается растворимым основанием, поэтому гидролиза соли CaCl2 не происходит.
Если в состав соли входит остаток сильного основания и остаток слабой кислоты, то гидролиз идет по аниону. Примеры: K3PO4, NaNO2, Ca(OCl)2, Ba(CH3COO)2, Li2SiO3.
Если соль образована остатком слабого основания и слабой кислоты, то гидролиз идет и по катиону, и по аниону. Примеры: Mg(NO2)2, Al2S3, Cr2(SO3)3, CH3COONH4.
Среда раствора
Среда раствора может быть нейтральной, кислой или щелочной. Определяется типом гидролиза. Некоторые задания могут быть построены так, что, увидев соль, вы должны будете определить ее тип раствора.
Обрадую вас: если вы усвоили тему гидролиза, сделать это проще простого. В случае, когда гидролиз не идет или идет и по катиону, и по аниону среда раствора — нейтральная.
Если гидролиз идет по катиону (разрушается остаток основания) среда — кислая, если гидролиз идет по аниону (разрушается остаток кислоты), то среда раствора будет щелочная. Изучите примеры.
Однако замечу, что в дигидрофосфатах, гидросульфитах и гидросульфатах среда всегда кислая из-за особенностей диссоциации. Примеры: NH4H2PO4, LiHSO4. В гидрофосфатах среда щелочная из-за того, что константа диссоциации по третьей ступени меньше, чем константа гидролиза. Примеры: K2HPO4, Na2HPO4.
Попробуйте определить среду раствора для соединений из самостоятельного задания, которое вы только что решили. Ниже будет располагаться решение.
С целью запутать в заданиях часто бывают даны синонимы. Так «среду раствора» могут заменить водородным показателем pH.
Запомните, что кислая среда характеризуется pH 7.
Например, в соли CaCl2 среда раствора будет нейтральной (pH=7), а в растворе AlCl3 — кислой (pH
Гидролиз солей
В общем случае, гидролиз солей – это процесс обменного разложения воды и растворенной в ней соли – электролита, приводящий к образованию малодиссоциирующего вещества.
Гидролиз является частным случаем сольволиза – обменного разложения растворенного вещества и растворителя.
Характеризовать гидролиз количественно позволяют такие величины, как Степень гидролиза и константа гидролиза.
Степень гидролиза
Степень гидролиза — это соотношение количества подвергающейся гидролизу соли nгидр и общего количества растворенной соли nобщ.
Обычно, ее обозначают через hгидр (или α ):
Величина hгидр увеличивается с уменьшением силы образующих соль кислоты или основания.
Константа гидролиза
Представим в общем виде процесс гидролиза соли, в котором в роли соли выступает – МА, а НА и МОН — соответственно, кислота и основание, которые образуют данную соль:
MA + H2O ↔ HA + MOH
Применив закон действующих масс, запишем константу, соответствующую этому равновесию:
Известно, что концентрация воды в разбавленных растворах, имеет практически постоянное значение, поэтому ее можно включить в константу
тогда соотношение для константы гидролиза соли Kг будет иметь такой вид:
По величине константы гидролиза можно судить о полноте гидролиза:
чем больше значение константы гидролиза Kг, тем в большей мере протекает гидролиз.
Константа и степень гидролиза связаны соотношением:
Где С – концентрация соли в растворе,
h- степень гидролиза.
Это выражение можно упростить, т.к. обычно h˂˂1, тогда
Зная, константу гидролиза, можно определить pH среды:
Концентрация образовавшейся кислоты равна концентрации гидроксид ионов, тогда
Kг = [OH — ] 2 /[MA]
Используя это выражение можно вычислить pH раствора
[OH — ] = (Kг·[MA]) 1/2 моль/л
[H + ] = 10 -14 /[OH — ] моль/л
pH = -lg[H + ]
Гидролиз солей можно представить, как поляризационное взаимодействие ионов и их гидратной оболочки.
Гидролиз протекает тем полнее, сильнее поляризующее действие ионов.
Возможны 4 случая протекания гидролиза:
1. Соли, образованные сильным основанием и сильной кислотой (гидролиз не протекает)
Соли, образованные сильным основанием и сильной кислотой не подвергаются гидролизу.
В этом случае, гидролиз практически не происходит, т.к. катионы и анионы, образующиеся в растворе при диссоциации соли, слабо поляризуют гидратную оболочку. pH среды не изменяется (рН ≈ 7):
NaCl ↔ Na + + Cl —
Na + + HOH ↔ реакция практически не протекает
Cl — + HOH ↔ реакция практически не протекает
2. Соли, образованные слабым основанием и сильной кислотой (гидролиз по катиону)
Такое соединение, при ионизации, образует катионы, способные к поляризации гидратной оболочки и анионы, которые их поляризуют слабо. Тогда гидролиз проходит по катиону, при этом среда носит кислый характер, т.е. рН ˂ 7:
NH4Cl ↔ NH4 + + Cl —
NH4 + + HOH ↔ NH4OH + H +
Cl — + HOH ↔ реакция практически не идет
NH4Cl+ HOH ↔ NH4OH + HCl
Для солей, образованных слабым основанием и сильной кислотой, константа гидролиза и константа диссоциации основания связаны соотношением:
Понятно, что чем меньше сила основания, тем в большей степени протекает гидролиз.
Если соль образованна слабым основанием многовалентного металла и сильной кислотой, то ее гидролиз будет протекать ступенчато:
FeCl2 ↔ Fe 2+ + 2Cl —
| I ступень | Fe 2+ + HOH ↔ (FeOH) + + H + FeCl2 + HOH ↔ (FeOH)Cl + HCl |
| II ступень | (FeOH) + + HOH ↔ Fe(OH)2 + H + (FeOH)Cl + HOH↔ Fe(OH)2 + HCl |
Константа гидролиза по первой ступени связана с константой диссоциации основания по второй ступени, а константа гидролиза по второй ступени — с константой диссоциации основания по первой ступени:
Поскольку первая константа диссоциации кислоты всегда больше второй, то первая константа гидролиза всегда больше, чем константа вторая гидролиза, так как первая константа диссоциации основания всегда больше второй
Отсюда следует, что по первой ступени, гидролиз всегда будет протекать в большей степени, чем по второй. Этому также способствуют ионы, которые образуются при гидролизе по первой ступени, они приводят подавлению гидролиза по второй ступени, смещая равновесие влево.
Сравнивая величины Kг и Kосн можно качественно определить pH среды.
Так, если Kг намного больше Kосн, то среда сильнокислая, при Kг намного меньшей Kосн — среда слабокислая, а если Kг и Kосн сопоставимы, то — среднекислая.
3. Соль, образованная сильным основанием и слабой кислотой (гидролиз по аниону)
Такое соединение в растворе образует слабополяризующие катионы и среднеполяризующие анионы. Гидролиз протекает по аниону, и в его результате создается щелочная среда, pH > 7:
NaCN ↔ Na + + CN —
CN — + HOH ↔ HCN + OH —
Na + + HOH ↔ реакция практически не идет
NaCN + HOH ↔ HCN + NaOH
Константа гидролиза и константа диссоциации кислоты связаны зависимостью:
Т.е. гидролиз соли протекает тем полнее, чем слабее образующая эту соль, кислота.
Возможен гидролиз соли, образованной слабой многоосновной кислотой и сильным основанием. В этом случае гидролиз протекает по ступеням:
| I ступень | SO3 2- + HOH ↔ HSO3 — + OH — Na2SO3 + HOH ↔ NaHSO3 + NaOH |
| II ступень | HSO3 — + HOH ↔ H2SO3 + OH — NaHSO3 + HOH ↔ H2SO3 + NaOH |
В этом случае, константа гидролиза по первой и второй ступеням определяется соотношениями:
Следует помнить, что гидролиз по второй ступени протекает в ничтожно малой степени.
Сравнивая величины Kг и Kк-ты, можно качественно определить pH среды. Так, если Kг намного больше Kк-ты, то среда сильнощелочная, при Kг намного меньшей Kк-ты — среда слабощелочная, а если Kг и Kосн сопоставимы, то — среднещелочная.
4. Соли, образованные слабым основанием и слабой кислотой (гидролиз и по катиону и по аниону)
Такие соли, при ионизации образуют среднеполяризующие катионы и анионы, поэтому гидролиз возможен как по катиону, так и по аниону.
При этом относительная сила образовавшихся кислоты и основания, будут влиять на характер среды (слабокислая или слабощелочная, pH ≈ 7). Такого типа гидролиз протекает особо полно, обычно с образованием малорастворимого вещества:
Константу гидролиза можно рассчитать, зная константы диссоциации кислоты и основания с помощью следующего соотношения:
Совместный гидролиз солей
Совместный гидролиз протекает при взаимодействии растворов двух солей, одна из которых образована слабым основанием и сильной кислотой, а вторая напротив сильным основанием и слабой кислотой. Т.е. одна соль гидролизуется по катиону, а другая – по аниону.
В таких случаях гидролиз взаимно усиливается.
Например, рассмотрим совместный гидролиз растворов солей хлорида алюминия и сульфида натрия:
При гидролизе хлорида алюминия соль гидролизуется по катиону:
AlCl3 ↔ Al 3+ + 3Cl —
Al 3+ + 3HOH ↔ Al(OH)3 + 3H +
При гидролизе сульфида натрия соль гидролизуется по аниону:
Na2S ↔ 2Na + + S 2-
S 2- + 2HOH ↔ H2S + 2OH —
Суммарная реакция гидролиза:
Влияние различных факторов на протекание гидролиза
- Природа соли. Это видно из выражения для константы гидролиза.
- Концентрация соли и продуктов реакции. В соответствии с принципом Ле-Шателье, равновесие должно смещаться вправо, при этом увеличивается концентрация ионов водорода (или гидроксид-ионов), что приводит к уменьшению степени гидролиза.
- Температура. Известно, что гидролиз притекает с поглощением теплоты (эндотермическая реакция), поэтому согласно принципу Ле Шателье, при увеличении температуры равновесие сдвигается вправо, что ведет к росту степени гидролиза.
В разделе Задачи к разделу Гидролиз солей приведены задачи на определение степени и константы гидролиза, составление уравнений гидролиза, определение рН среды и др.
Гидролиз
О чем эта статья:
11 класс, ЕГЭ/ОГЭ
Определение гидролиза
Гидролиз — это процесс взаимодействия сложного химического вещества с водой, итогом которого становится разложение молекул этого вещества. Сам термин происходит от двух греческих слов: hydor, что значит «вода», и lysis, то есть «распад».
Гидролизации подвержены как органические, так и неорганические вещества: углеводы, белки, оксиды, карбиды, соли и т. д. Например, гидролиз органических соединений напрямую связан с пищеварением — с его помощью происходит распад и усвоение клетками организма жиров, белков, углеводов. Но сейчас мы займемся неорганической химией и рассмотрим гидролизацию на примере солей.
Гидролиз солей — это реакция взаимодействия ионов соли с Н + и ОН − ионами воды, которая ведет к распаду исходного соединения. В результате такого ионного обмена образуется слабый электролит — кислотный, щелочной или нейтральный.
Условия гидролиза
Далеко не все соединения распадаются, вступая в реакцию с молекулами воды. Сейчас мы на примере солей рассмотрим, какие вещества подвергаются гидролизу, а какие нет, и от чего это зависит.
Начнем с того, что любая соль включает основание — амфотерный гидроксид, и кислотный остаток.
сульфат меди CuSO4состоит из основания Cu(ОН)2и кислоты H2SO4;
хлорид натрия NaCl состоит из основания NaOH и кислоты HCl;
хлорид цинка ZnCl2состоит из основания Zn(ОН)2 и кислоты HCI;
карбонат натрия Na2CO3состоит из основания NaOH и кислоты H2CO3.
В жизни первым разрушается самое слабое, и гидролиз в химии действует по тому же принципу. В ходе этой реакции распадаются более слабые соединения (основания или кислотные остатки). Слабый катион или слабый анион вступают во взаимодействие с ионами воды и связывают один из них или оба. В растворе образуется избыток ионов H + или гидроксильная группа OH − .
В зависимости от того, какие соли подвергаются гидролизу — со слабым основанием или слабой кислотой, в итоге может получиться кислая, щелочная или нейтральная среда водного раствора.
А что происходит, если соль состоит из сильного основания и сильного кислотного остатка? Ничего. 🙂 В этом случае ее сильные катионы и анионы не взаимодействуют с ионами воды. Такая соль не распадается, то есть не подвержена гидролизу.
Схема химической реакции гидролиза выглядит так:
XY + HOH ↔ XH + HOY
В данном случае:
XY — формула соли;
XH — кислотный остаток;
Индикаторы среды раствора
Для определения среды раствора за считанные секунды используются специальные индикаторы. Самый распространенный из них — лакмусовая бумага, но также популярны фенолфталеин и метиловый оранжевый. В нейтральной среде они не меняют свой цвет, а в кислотной или щелочной — приобретают другую окраску.
Изменение цвета индикатора однозначно говорит о том, что произошла гидролизация. Однако если цвет остался тем же — это не всегда означает отсутствие гидролиза. Среда будет почти нейтральной и в том случае, когда гидролизу подвергается соль со слабым основанием и слабой кислотой. Но об этом поговорим дальше, а пока посмотрите таблицу.
Виды гидролиза
Мы выяснили, что в составе соли может быть слабый ион, который и отвечает за гидролизацию. Он находится в основании, в кислотном остатке или в обоих компонентах, и от этого зависит тип гидролиза.
Соль с сильным основанием и сильной кислотой
Гидролиз отсутствует. Как вы уже знаете, при наличии сильного основания и сильного кислотного остатка соль не распадается при взаимодействии с водой. Так, например, невозможен гидролиз хлорида натрия (NaCl), поскольку в составе этого вещества нет слабых ионов. К таким же не подверженным гидролизации солям относят KClO4, Ba(NO3)2 и т. д.
Среда водного раствора — нейтральная, т. е. pH = 7.
Реакция индикаторов: не меняют свой цвет (лакмус остается фиолетовым, а фенолфталеин — бесцветным).
Соль со слабым основанием и сильной кислотой
Гидролиз по катиону. Как мы помним, гидролизация происходит только при наличии слабого иона, в данном случае — иона основания. Его катион вступает в реакцию и связывает гидроксид-ионы воды OH − . В итоге образуется раствор с избытком ионов водорода H + .
Среда водного раствора — кислая, pH меньше 7.
Реакция индикаторов: фенолфталеин остается бесцветным, лакмус и метиловый оранжевый — краснеют.
Нитрат аммония NH4NO3 состоит из слабого основания NH4OH и сильного кислотного остатка HNO3, поэтому он гидролизуется по катиону, то есть его катион NH4 + связывает ионы воды OH − .
Соль с сильным основанием и слабой кислотой
Гидролиз по аниону. Если слабым оказывается ион кислотного остатка, его отрицательно заряженная частица (анион) взаимодействует с катионом водорода H + в молекуле воды. В итоге получается раствор с повышенным содержанием OH − .
Среда водного раствора — щелочная, pH больше 7.
Реакция индикаторов: фенолфталеин становится малиновым, лакмус — синим, а метиловый оранжевый желтеет.
Нитрат калия KNO2 отличается сильным основанием KOH и слабым кислотным остатком HNO2, поэтому он гидролизуется по аниону. Другими словами, анион кислоты NO2 − связывает ионы воды H + .
Молекулярное уравнение: KNO2 + H2O ↔ HNO2 + KOH
Ионное уравнение: K + + NO2 − + HOH ↔ HNO2 + K + + OH −
Гидролиз по катиону и аниону. Если у соли оба компонента — слабые, при взаимодействии с водой в реакцию вступает и анион, и катион. При этом катион основания связывает ионы воды OH − а анион кислоты связывает ионы H +
Среда водного раствора: нейтральная, слабокислая или слабощелочная.
Реакция индикаторов: могут не изменить свой цвет.
Цианид аммония NH4CN включает слабое основание NH4OH и слабую кислоту HCN.
Молекулярное уравнение: NH4CN + H2O ↔ NH4OH + HCN
Ионное уравнение: NH4 + + CN − + HOH ↔ NH4OH + HCN
Среда в данном случае будет слабощелочной.
Обобщим все эти сведения в таблице гидролиза солей.
Ступенчатый гидролиз
Любой из видов гидролиза может проходить ступенчато. Так бывает в тех случаях, когда с водой взаимодействует соль с многозарядными катионами и анионами. Сколько ступеней будет включать процесс — зависит от числового заряда иона, отвечающего за гидролиз.
Как определить количество ступеней:
если соль содержит слабую многоосновную кислоту — число ступеней равняется основности этой кислоты;
если соль содержит слабое многокислотное основание — число ступеней определяют по кислотности основания.
Для примера рассмотрим гидролиз карбоната калия K2CO3. У нас есть двухосновная слабая кислота H2CO3, а значит, гидролизация пройдет по аниону в две ступени.
I ступень: K2CO3+HOH ↔ KOH+KHCO3, итогом которой стало получение гидроксида калия (KOH) и кислой соли (KHCO3).
II ступень: K2HCO3+HOH ↔ KOH+H2CO3, в итоге получился тот же гидроксид калия (KOH) и слабая угольная кислота (H2CO3).
Для приблизительных расчетов обычно принимают в учет только результаты первой ступени.
Обратимый и необратимый гидролиз
Химические вещества могут гидролизоваться обратимо или необратимо. В первом случае распадается лишь некоторое количество частиц, а во втором — практически все. Если соль полностью разлагается водой, это необратимый процесс, и его называют полным гидролизом.
Необратимо гидролизуются соли, в составе которых есть слабые нерастворимые основания и слабые и/или летучие кислоты. Такие соединения могут существовать лишь в сухом виде, их не получить путем смешивания водных растворов других солей.
Например, полному гидролизу подвергается сульфид алюминия:
Как видите, в результате гидролизации образуется гидроксид алюминия и сероводород.
Необратимые реакции при взаимодействии с водой имеют место и в органической химии. В качестве примера рассмотрим полный гидролиз органического вещества — карбида кальция, в результате которого образуется ацетилен:
Степень гидролиза
Взаимодействие соли или другого химического соединения с водой может усиливаться или ослабляться в зависимости от нескольких факторов. Если нужно получить количественное выражение гидролиза, говорят о его степени, которая указывается в процентах.
h — степень гидролиза,
nгидр. — количество гидролизованного вещества,
nобщ. — общее количество растворенного в воде вещества.
На степень гидролизации может повлиять:
температура, при которой происходит процесс;
концентрация водного раствора;
состав участвующих в гидролизе веществ.
Можно усилить гидролиз с помощью воды (просто разбавить полученный раствор) или стимулировать процесс повышением температуры. Более сложным способом будет добавление в раствор такого вещества, которое могло бы связать один из продуктов гидролиза. К соли со слабой кислотой и сильным основанием нужно добавить соль со слабым основанием и сильной кислотой.
Для ослабления гидролиза раствор охлаждают и/или делают более концентрированным. Также можно изменить его состав: если гидролизация идет по катиону — добавляют кислоту, а если по аниону — щелочь.
Итак, мы разобрались, что такое гидролиз солей и каким он бывает. Пора проверить свои знания и ответить на вопросы по материалу.
Вопросы для самопроверки:
Назовите необходимое условие для гидролиза.
Какие типы гидролиза вы знаете?
В каком случае в результате гидролиза может образоваться слабощелочная или слабокислая среда?
По какому типу гидролизуется соль с сильным основанием и слабым кислотным остатком?
При гидролизе соли с сильным основанием и слабой кислотой для ослабления процесса нужно добавить в раствор кислоту или щелочь?
Как воздействует на гидролиз разбавление раствора водой?
Как определяется количество ступеней гидролиза?
Какая среда раствора образуется при гидролизации солей NaF, KCl, FeBr2, Na2PO4? Ответов может быть несколько.
Какие из солей гидролизуются по катиону: Csl, FeSO4, RbNO3, CuSO4, Mn(NO3)2? Ответов может быть несколько.
Какая из солей не подвергается гидролизу: K2HPO4, KNO3, KCN, Ni(NO3)2?
http://zadachi-po-khimii.ru/obshaya-himiya/gidroliz-solej.html
http://skysmart.ru/articles/chemistry/gidroliz
Гидролиз солей
Тема «Гидролиз солей» – одна из наиболее
трудных для учащихся 9-го класса, изучающих
неорганическую химию. И как думается, трудность
ее не в действительной сложности самого
изучаемого материала, а в том, как он излагается в
учебниках. Так, у Ф.Г.Фельдмана и Г.Е.Рудзитиса из
соответствующего параграфа очень мало, что можно
понять. В учебниках же Л.С.Гузея и Н.С.Ахметова
данная тема вообще исключена, хотя учебник
Ахметова предназначен для учащихся 8–9-х классов
с углубленным изучением химии.
Пользуясь учебниками указанных авторов, ученик
вряд ли сможет хорошо понять теорию растворов,
сущность электролитической диссоциации веществ
в водной среде, соотнести реакции ионного обмена
с реакциями гидролиза солей, образованных
разными по силе кислотами и основаниями. Кроме
того, в конце каждого учебника имеется таблица
растворимости, но нигде и никак не поясняется,
почему в отдельных ее клеточках стоят прочерки, а
в текстах учебников ученики встречают формулы
этих солей.
Мы попытаемся в краткой лекции для учителей
(прежде всего для начинающих, им особенно трудно
отвечать на возникающие у детей вопросы)
восполнить данный пробел и по-своему осветить
проблему составления уравнений реакций
гидролиза и определения характера образующейся
среды.
Гидролизом называется процесс разложения
веществ водой (само слово «гидролиз» об этом
говорит: греч. –
вода и –
разложение). Разные авторы, давая определение
этому явлению, выделяют, что при этом
образуется кислота или кислая соль, основание
или основная соль (Н.Е.Кузьменко); при
взаимодействии ионов соли с водой образуется
слабый электролит (А.Э.Антошин); в результате
взаимодействия ионов соли с водой смещается
равновесие электролитической диссоциации воды (А.А.Макареня);
составные части растворенного вещества
соединяются с составными частями воды
(Н.Л.Глинка) и т.д.
Каждый автор, давая определение гидролиза,
отмечает наиболее важную, на его взгляд, сторону
этого сложного, многогранного процесса. И каждый
из них по-своему прав. Думается, дело учителя,
какому определению отдать предпочтение – что
ему ближе по его образу мышления.
Итак, гидролиз – это разложение веществ водой.
Причиной его является электролитическая
диссоциация соли и воды на ионы и взаимодействие
между ними. Вода диссоциирует незначительно на
ионы Н+ и ОН– ( 1
молекула из 550 000), причем в процессе гидролиза
один или оба этих иона могут связываться с
ионами, образующимися при диссоциации соли, в
малодиссоциирующее, летучее или нерастворимое в
воде вещество.
Соли, образованные сильными основаниями (NаОН,
КОH, Ва(ОH)2) и сильными кислотами (Н2SO4,
HCl, НNO3), гидролизу не подвергаются, т.к.
образующие их катионы и анионы не способны в
растворах связывать ионы Н+ и ОН–
(причина – высокая диссоциация).
Когда соль образована слабым основанием или
слабой кислотой или оба «родителя» – слабые,
соль в водном растворе подвергается гидролизу.
При этом реакция среды зависит от относительной
силы кислоты и основания. Другими словами, водные
растворы таких солей могут быть нейтральными,
кислыми или щелочными в зависимости от констант
диссоциации образующихся новых веществ.
Так, при диссоциации ацетата аммония СН3СООNН4
реакция раствора будет слабощелочной, т.к.
константа диссоциации NН4ОН (kдис =
6,3•10–5) больше константы диссоциации СН3СООН
(kдис = 1,75•10–5). У другой же соли
уксусной кислоты – ацетата алюминия (СН3СОО)3Al
– реакция раствора будет слабокислой, т.к. kдис(СН3СООН)
= 1,75•10–5 больше kдис(Al(ОН)3) =
1,2•10–6.
Реакции гидролиза в одних случаях являются
обратимыми, а в других – идут до конца.
Количественно гидролиз характеризуется
безразмерной величиной г, называемой степенью гидролиза и
показывающей, какая часть от общего количества
молекул соли, находящихся в растворе,
подвергается гидролизу:
г
= n/N•100%,
где n – число гидролизованных молекул, N
– общее число молекул в данном растворе.
Например, если г
= 0,1%, то это означает, что из 1000 молекул соли водой
разложилась только одна:
n = г•N/100
= 0,1•1000/100 = 1.
Степень гидролиза зависит от температуры,
концентрации раствора и природы растворенного
вещества. Так, если рассмотреть гидролиз cоли СН3СООNа,
то степень ее гидролиза для растворов различной
концентрации будет следующая: для 1М раствора –
0,003%, для 0,1М – 0,01%, для
0,01М – 0,03%, для 0,001М – 0,1% (данные взяты из книги
Г.Реми). Эти значения согласуются с принципом Ле
Шателье.
Повышение температуры увеличивает кинетическую
энергию молекул, их распад на катионы и анионы и
взаимодействие с ионами воды (Н+ и ОН–)
– слабого при комнатной температуре
электролита.
Учитывая природу реагирующих веществ, для
связывания ионов ОН– к раствору соли можно
добавить кислоту, а для связывания ионов Н+
– щелочь. Можно также добавить другие соли,
гидролизующиеся по противоположному иону. В этом
случае происходит взаимное усиление гидролиза
обеих солей.
Ослабить гидролиз можно (если это необходимо)
понижением температуры, увеличением
концентрации раствора, введением в него одного
из продуктов гидролиза: кислоты, если при
гидролизе накапливаются ионы Н+, или
щелочи, если накапливаются ионы ОН–.
Все реакции нейтрализации протекают
экзотермически, а гидролиза – эндотермически.
Поэтому выход первых с повышением температуры
уменьшается, а вторых – увеличивается.
Ионы Н+ и ОН– не могут существовать в
растворе в значительных концентрациях – они
соединяются в молекулы воды, смещая равновесие
вправо.
Разложение соли водой объясняется связыванием
катионов и/или анионов диссоциированной соли в
молекулы слабого электролита ионами воды (Н+
и/или ОН–), всегда имеющимися в растворе.
Образование слабого электролита, осадка, газа
или полное разложение нового вещества
равноценно удалению ионов соли из раствора, что в
соответствии с принципом Ле Шателье (действие
равно противодействию) смещает равновесие
диссоциации соли вправо, а следовательно,
приводит к разложению соли до конца. Отсюда и
появляются прочерки в таблице растворимости
против ряда соединений.
Если молекулы слабого электролита образуются за
счет катионов соли, то говорят, что гидролиз идет
по катиону и среда будет кислая, а если за счет
анионов соли, то говорят, что гидролиз идет по
аниону и среда будет щелочная. Иными словами, кто
сильнее – кислота или основание, – тот и
определяет среду.
Гидролизу подвергаются только растворимые соли
слабых кислот и/или оснований. Дело в том, что
если соль малорастворима, то концентрации ее
ионов в растворе ничтожно малы и говорить о
гидролизе такой соли не имеет смысла.
Составление уравнений реакций
гидролиза солей
Гидролиз солей слабых многоосновных оснований
и/или кислот происходит ступенчато. Число
ступеней гидролиза равно наибольшему заряду
одного из ионов соли.
Например:
Однако гидролиз по второй ступени и особенно по
третьей идет очень слабо, поскольку
г1 >>
г2 >>
г3. Поэтому
при написании уравнений гидролиза обычно
ограничиваются первой ступенью. Если гидролиз
практически завершается на первой ступени, то
при гидролизе солей слабых многоосновных
оснований и сильных кислот образуются основные
соли, а при гидролизе солей сильных оснований и
слабых многоосновных кислот образуются кислые
соли.
Количество молекул воды, участвующих в
процессе гидролиза соли по схеме реакции,
определяется произведением валентности катиона
на число его атомов в формуле соли
(правило автора).
Например:
Nа2СО3 2Na+
1•2 = 2 (H2O),
Al2(SО4)3 2Al3+
3•2
= 6 (H2O),
Co(CH3COO)2 Со2+
2•1 = 2 (H2O).
Поэтому при составлении уравнения гидролиза
пользуемся следующим алгоритмом (на
примере гидролиза Al2(SО4)3):
1. Определяем, из каких веществ образована соль:
2. Предполагаем, как мог бы пойти гидролиз:
Al2(SО4)3 + 6Н–ОН = 2Аl3+
+ 3 + 6H+ + 6OH–.
3. Поскольку Al(ОН)3 – слабое основание и
его катион Al3+ связывают ионы ОН– из
воды, то процесс фактически идет так:
Al2(SO4)3 + 6Н+ + 6OH–
= 2Аl(ОН)2+ + 3 +
6H+ + 2OH–.
4. Сопоставляем количества оставшихся в
растворе ионов Н+ и ОН– и определяем
реакцию среды:
6Н+ + 2ОН– = 2Н2О + 4Н+
кислая среда.
5. После гидролиза образовалась новая соль:
(Al(ОН)2)2SО4, или Аl2(ОН)4SO4,
– дигидроксосульфат алюминия (или
тетрагидроксосульфат диалюминия) – основная
соль. Частично может образоваться и AlОНSО4
(гидроксосульфат алюминия), но в значительно
меньшем количестве, и им можно пренебречь.
Другой пример:
1.
2. Na2SiO3 + 2Н2О = 2Na+ +
+ 2Н+ + 2ОН–.
3. Поскольку Н2SiO3 – слабая кислота и
ее ионсвязывает
ионы Н+ из воды, то фактически реакция идет
так:
2Na+ + + 2Н+ + 2ОН– = 2Na+ + Н
+ Н+ + 2ОН–.
4. Н+ + 2ОН– = Н2О + ОН–
щелочная среда.
5. Na+ + Н
=
NаНSiO3 – гидросиликат натрия – кислая соль.
Кислотность или щелочность среды легко
определить по количеству оставшихся в растворе
ионов Н+ или ОН– при условии, что
новые вещества образовались и существуют в
растворе в эквивалентных отношениях и другие
реактивы в ходе реакции не добавлялись. Среда
может быть кислая или слабокислая (если ионов Н+
мало), щелочная (если ионов ОН– много) или
слабощелочная, а также нейтральная, если
значения констант диссоциации слабой кислоты и
слабого основания близки и все оставшиеся в
растворе ионы Н+ и ОН– после
гидролиза снова соединились с образованием Н2О.
Мы уже отмечали, что степень гидролиза соли тем
больше, чем слабее кислота или основание,
образовавшие эту соль. Поэтому необходимо для
помощи учащимся привести ряды анионов и
катионов, соответствующие уменьшению силы
кислот и оснований их образующих (по
А.В.Метельскому).
Сd2+ > Mg2+ > Mn2+ > Fe2+
> Co2+ > Ni2+ >
> Cu2+ > Pb2+ > Zn2+ > Al2+
> Cr2+ > Fe2+.
Чем правее в этих рядах расположен ион, тем с
большей силой идет гидролиз образованной им
соли, т.е. его основание или кислота cлабее, чем у
стоящих слева от него. Особенно сильно идет
гидролиз солей, образованных одновременно
слабыми основанием и кислотой. Но даже для них
степень гидролиза обычно не превышает 1%. Тем не
менее в некоторых случаях гидролиз таких солей
протекает особенно сильно и степень гидролиза
достигает почти 100%. Такие соли в водных растворах
не существуют, а хранятся только в сухом виде. В
таблице растворимости против них стоит прочерк.
Примерами таких солей могут служить ВаS, Аl2S3,
Сr2(SO3)3 и другие (см. таблицу
растворимости в учебниках).
Подобные соли, имеющие высокую степень
гидролиза, гидролизуются полностью и необратимо,
т. к. продукты их гидролиза выводятся из раствора
в виде малорастворимого, нерастворимого,
газообразного (летучего), малодиссоциирующего
вещества или разлагаются водой на другие
вещества.
Например:
Соли, полностью разлагаемые водой, нельзя
получить реакцией ионного обмена в водных
растворах, т.к. вместо ионного обмена более
активно протекает реакция гидролиза.
Например:
2АlCl3 + 3Na2S Аl2S3 + 6NaCl (так могло бы быть),
2АlCl3 + 3Na2S + 6H2O 2Al(OH)3
+ 3H2S
+ 6NaCl (так есть фактически).
Соли, подобные Al2S3, получают в
безводных средах спеканием компонентов в
эквивалентных количествах или другими
способами:
Многие галогениды, как правило, активно
реагируют с водой, образуя гидрид одного
элемента и гидроксид другого.
Например:
СlF + H–OH HClO + HF,
PСl3 + 3H–OH
P(OH)3 + 3HCl
(по Л.Полингу).
Как правило, при такого рода реакциях, также
называемых гидролизом, более
электроотрицательный элемент соединяется с Н+,
а менее электроотрицательный – с ОН–.
Легко заметить, что приведенные выше реакции
протекают в соответствии с этим правилом.
Кислые соли слабых кислот также подвергаются
гидролизу. Однако в этом случае наряду с
гидролизом протекает диссоциация кислотного
остатка. Так, в растворе NaHCО3 одновременно
протекают гидролиз H, приводящий к
накоплению ОH–-ионов:
Н + Н–ОН
Н2СО3
+ ОH–,
и диссоциация, хотя и незначительная:
Н
+ H+.
Таким образом, реакция раствора кислой соли
может быть как щелочной (если гидролиз аниона
преобладает над его диссоциацией), так и кислой (в
обратном случае). Это определяется соотношением
константы гидролиза соли (Кгидр) и
константы диссоциации (Кдис)
соответствующей кислоты. В рассмотренном
примере Кгидр аниона больше Кдис
кислоты, поэтому раствор данной кислой соли
имеет щелочную реакцию (что и используют
страдающие изжогой от повышенной кислотности
желудочного сока, хотя делают это зря). При
обратном соотношении констант, например в случае
гидролиза NaHSO3, реакция раствора будет
кислой.
Гидролиз основной соли, например
гидроксохлорида меди(II), протекает так:
Сu(ОН)Сl + Н–ОН
Сu(ОН)2 + НСl,
или в ионном виде:
СuОН+ + Сl– + H+ + ОH–
Сu(ОН)2
+ Cl– + H+
среда кислая.
Гидролиз в широком смысле – это реакции
обменного разложения между различными
веществами и водой (Г.П.Хомченко). Такое
определение охватывает гидролиз всех соединений
– как неорганических (солей, гидридов,
галогенидов, халькогенов и др.), так и
органических (сложных эфиров, жиров, углеводов,
белков и др.).
Например:
(C6H10O5)n + nH–OH nC6H12O6,
CaC2 + 2H–OH
Ca(OH)2 + C2H2,
Cl2 + H–OH HCl
+ HClO,
PI3 + 3H–OH H3PO3
+ 3HI.
В результате гидролиза минералов –
алюмосиликатов – происходит разрушение горных
пород. Гидролиз некоторых солей – Na2CO3,
Na3РО4 – применяется для очистки воды
и уменьшения ее жесткости.
Растущая быстрыми темпами гидролизная отрасль
промышленности вырабатывает из отходов
(древесные опилки, хлопковая шелуха,
подсолнечная лузга, солома, кукурузные
кочерыжки, отходы сахарной свеклы и др.) ряд
ценных продуктов: этиловый спирт, кормовые
дрожжи, глюкозу, «сухой лед», фурфурол, метанол,
лигнин и многие другие вещества.
Гидролиз протекает в организме человека и
животных при переваривании пищи (жиров,
углеводов, белков) в водной среде под действием
ферментов – биологических катализаторов. Он
играет важную роль в ряде химических превращений
веществ в природе (цикл Кребса, цикл
трикарбоновых кислот) и промышленности. Поэтому
нам думается, что вопросам изучения гидролиза в
школьном курсе химии необходимо уделять
значительно больше внимания.
Ниже приведен пример раздаточной карточки,
предлагаемой учащимся для закрепления материала
после изучения темы «Гидролиз солей» в 9-м классе.
Алгоритм написания уравнения
гидролиза Fe2(SO4)3
1. Определяем, чем образована соль:
2. Предполагаем, как мог бы пойти
гидролиз:
Fe2(SO4)3 + 6Н2О = 2Fe3+
+ 3 + 6H+ + 6OH–.
3. Поскольку Fe(OH)3 – слабое
основание, то катионы Fe3+ будут связываться
анионами ОН– из воды и гидролиз фактически
будет протекать так:
2Fе3+ + 3 + 6H+ + 6OH– = 2Fe(OH)2+ + 3
+ 6H+ + 2OH–.
4. Определяем реакцию среды:
6Н+ + 2ОН– = 2Н2О + 4Н+
кислая среда.
5. Определяем новую соль по ионам,
оставшимся в растворе:
2Fe(OH)2+ + = [Fe(OH)2]2SO4 –
дигидроксосульфат железа(III)
– основная соль.
Гидролиз идет по катиону.
Дополнительная информация
(на обороте карточки)
1. Кто сильнее – основание или кислота,
тот и определяет среду: кислую или щелочную.
2. Диссоциацию и гидролиз многоосновных
кислот и оснований учитываем только по первой
ступени. Например:
Аl(ОН)3 = Аl + ОH–,
Н3РO4 = Н+ + .
3. Ряд активности кислот (их силы):
4. Ряд активности оснований (их силы):
5. Чем правее в своем ряду стоит
кислота и основание, тем они слабее.
6. Количество молекул воды, участвующих
в гидролизе соли по схеме реакции, определяется
произведением валентности катиона на число его
атомов в формуле соли:
Na2SO3
2Na+ 1•2 = 2 (H2O),
ZnCl2 1Zn2+
2•1 = 2 (H2O),
Al2(SO4)3 2Al3+
3•2
= 6 (H2O).
7. Гидролиз идет по катиону, если
основание слабое, и по аниону, если кислота
слабая.
Применение данного алгоритма
способствует осознанному написанию учащимся
уравнений гидролиза и при достаточной
тренировке не вызывает никаких затруднений.
ЛИТЕРАТУРА
Антошин А.Э., Цапок П.И. Химия. М.: Химия, 1998;
Ахметов Н.С. Неорганическая химия. М.:
Просвещение, 1990;
Глинка Н.Л. Общая химия. Л.: Химия, 1978;
Еремин В.В., Кузьменко Н.Е. Химия. М.: Экзамен,
1998;
Еремин В.В., Кузьменко Н.Е., Попов В.А. Химия. М.:
Дрофа, 1997;
Кузьменко Н.Е., Чуранов С.С. Общая и
неорганическая химия. М.: Изд-во МГУ, 1977;
Метельский А.В. Химия. Минск: Белорусская
энциклопедия, 1997;
Полинг Л., Полинг П. Химия. М.: Мир, 1998;
Пиментел Д.С. Химия. М.: Мир, 1967;
Фельдман Ф.Г., Рудзитис Г.Е. Химия-9. М.:
Просвещение, 1997;
Холин Ю.В., Слета Л.А. Репетитор по химии.
Харьков: Фолино, 1998;
Хомченко Г.П. Химия. М.: Высшая школа, 1998.