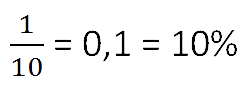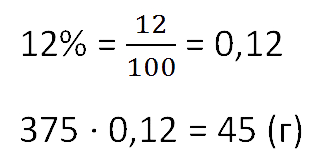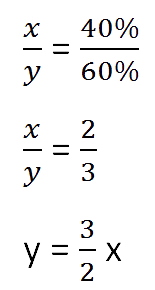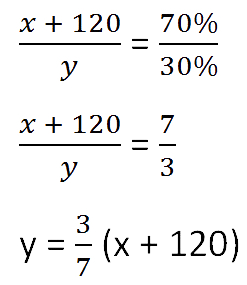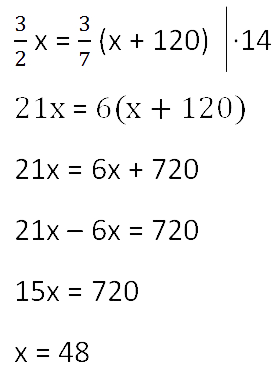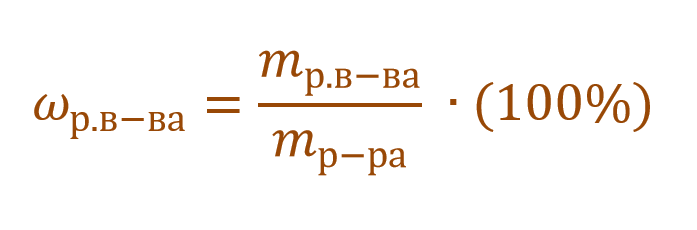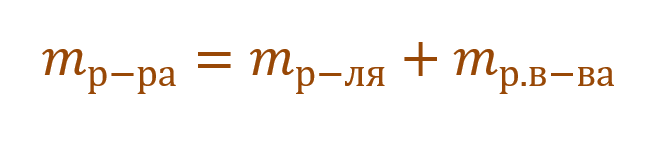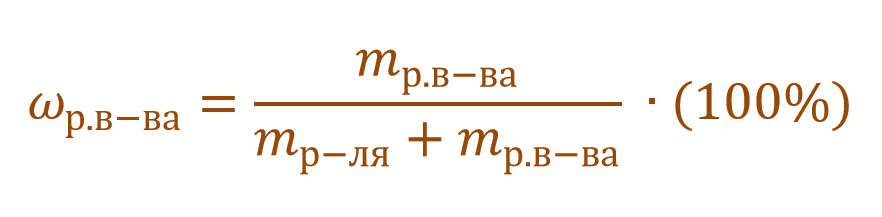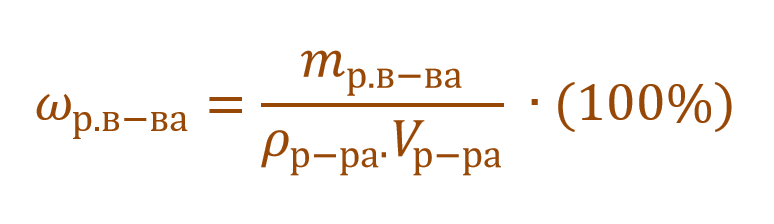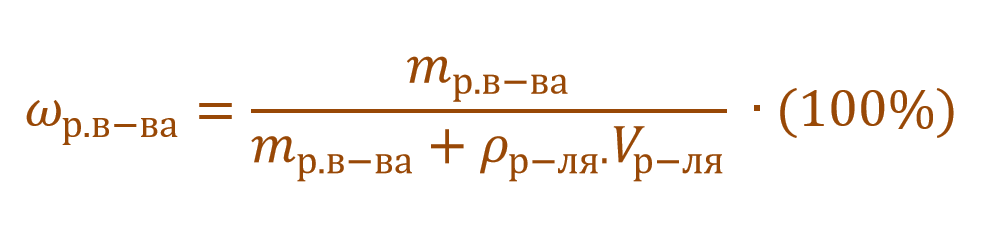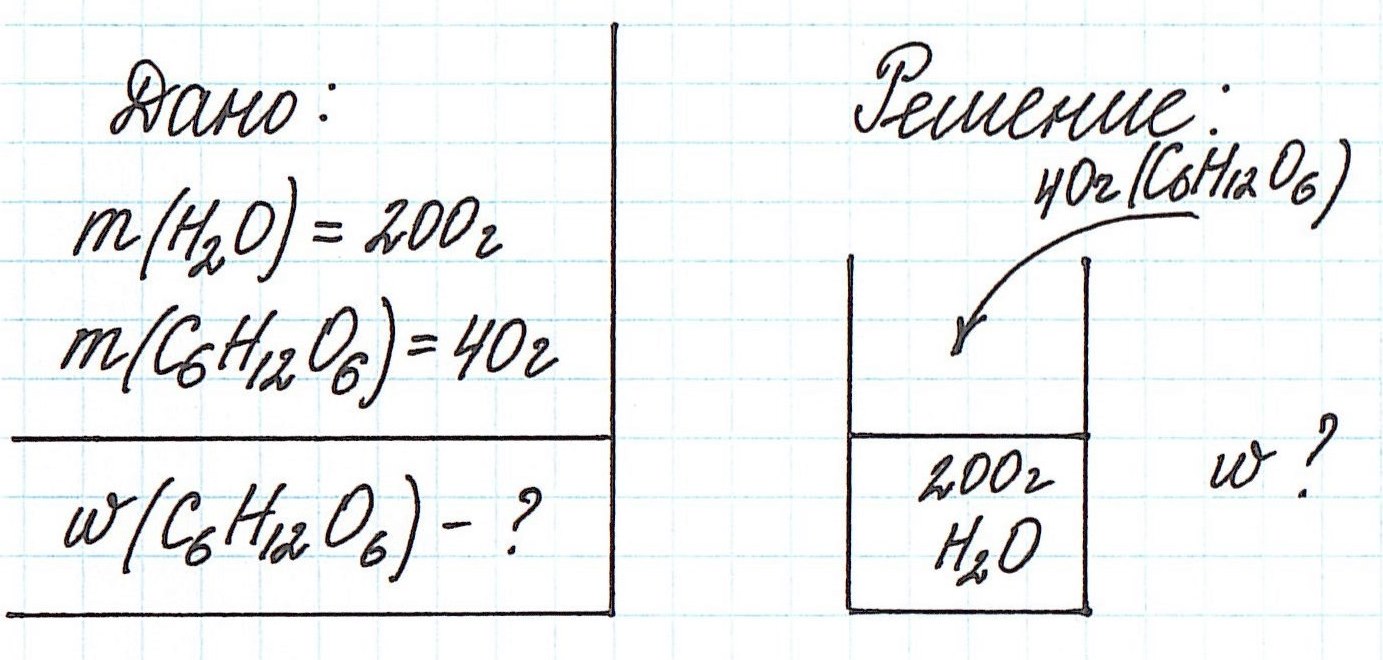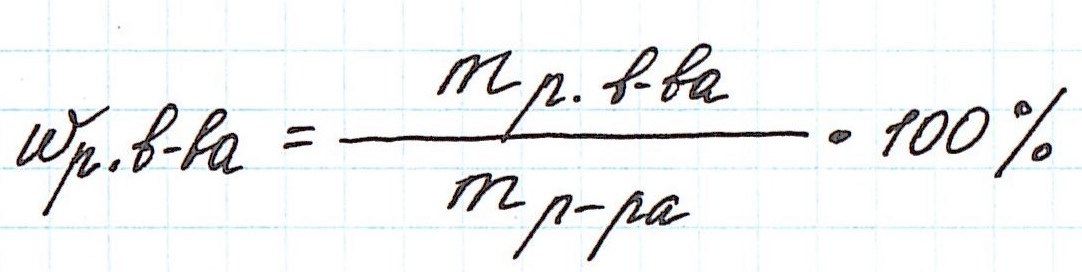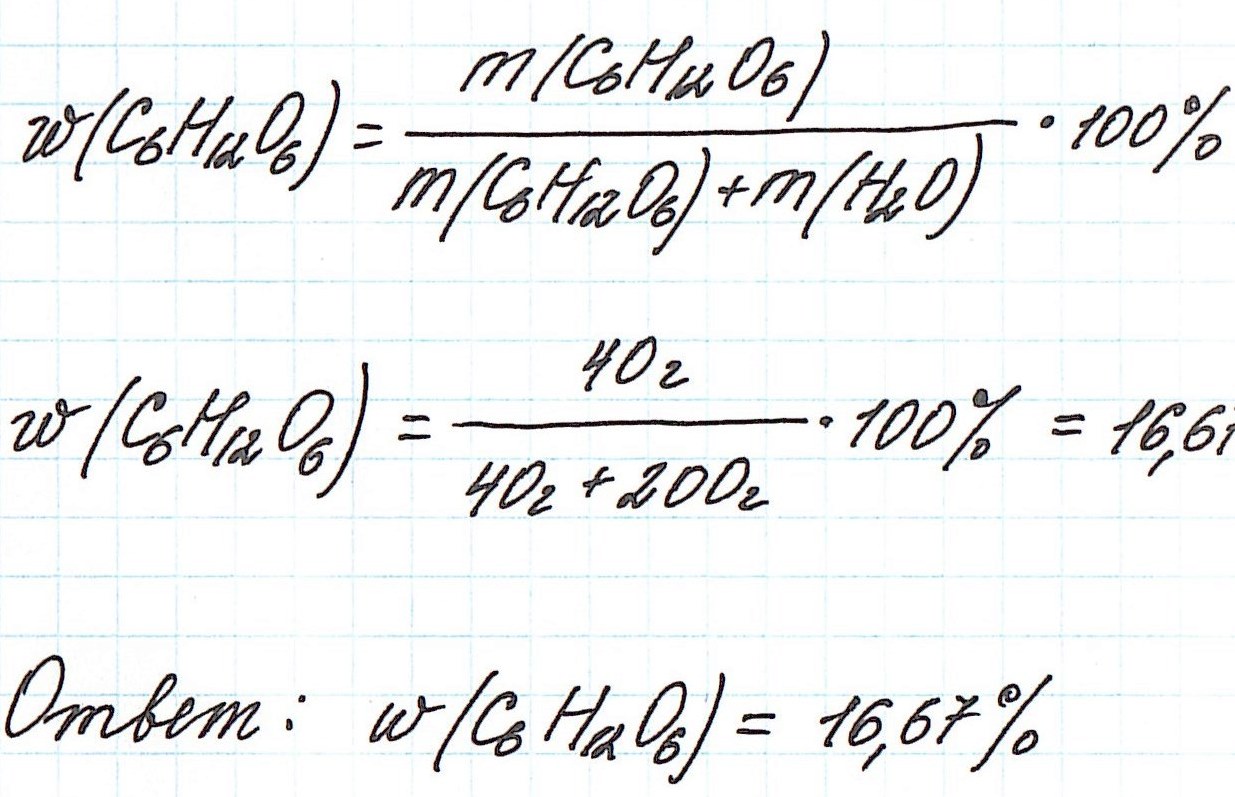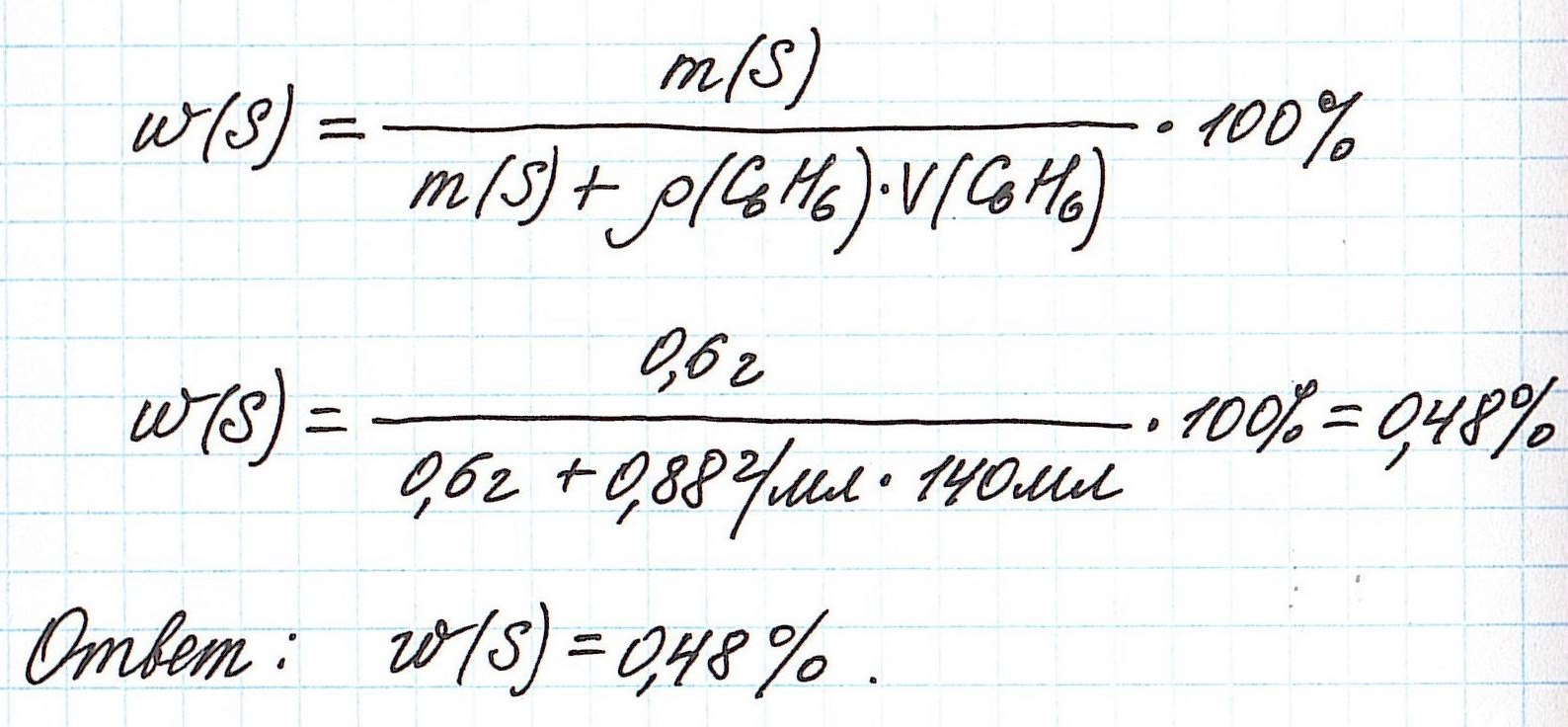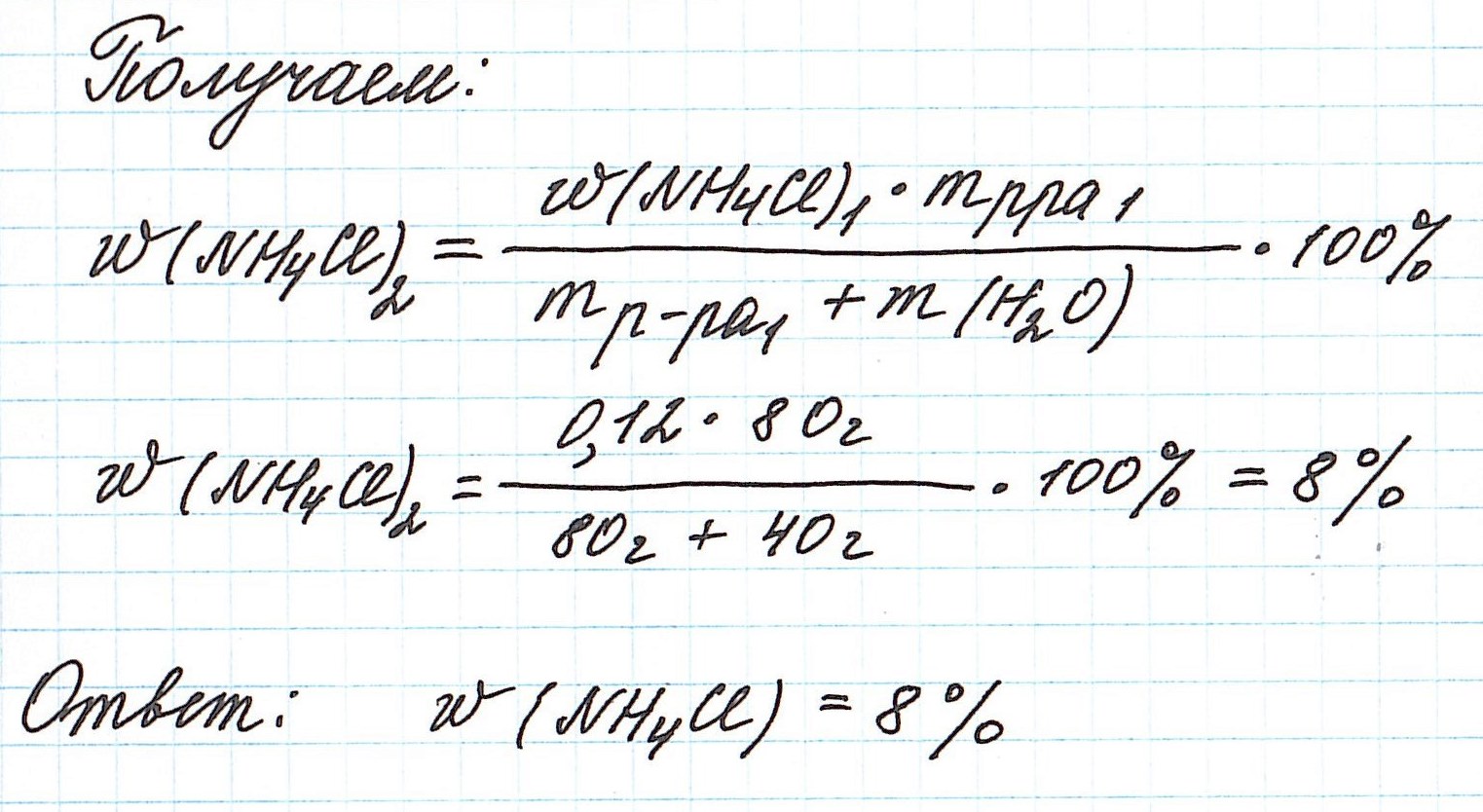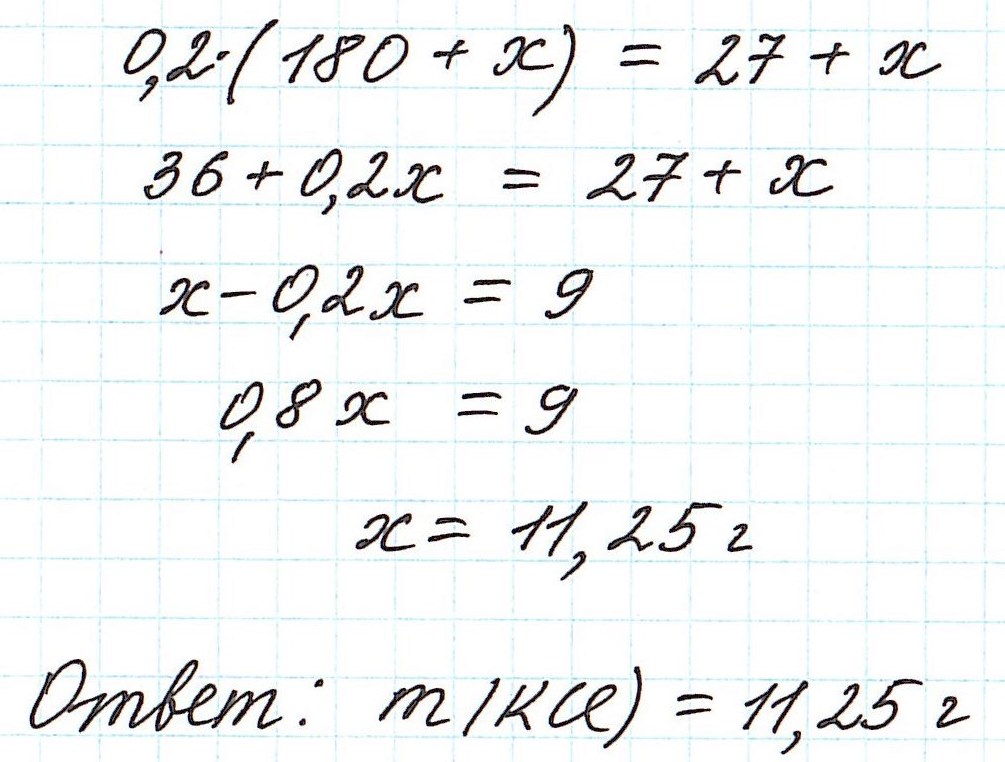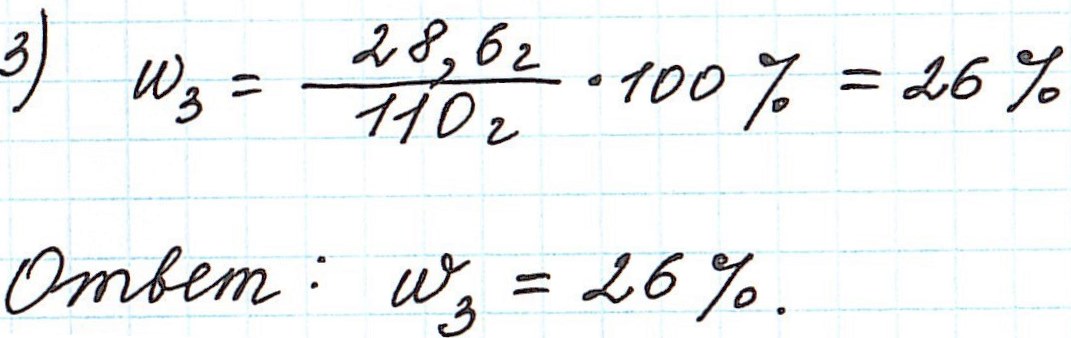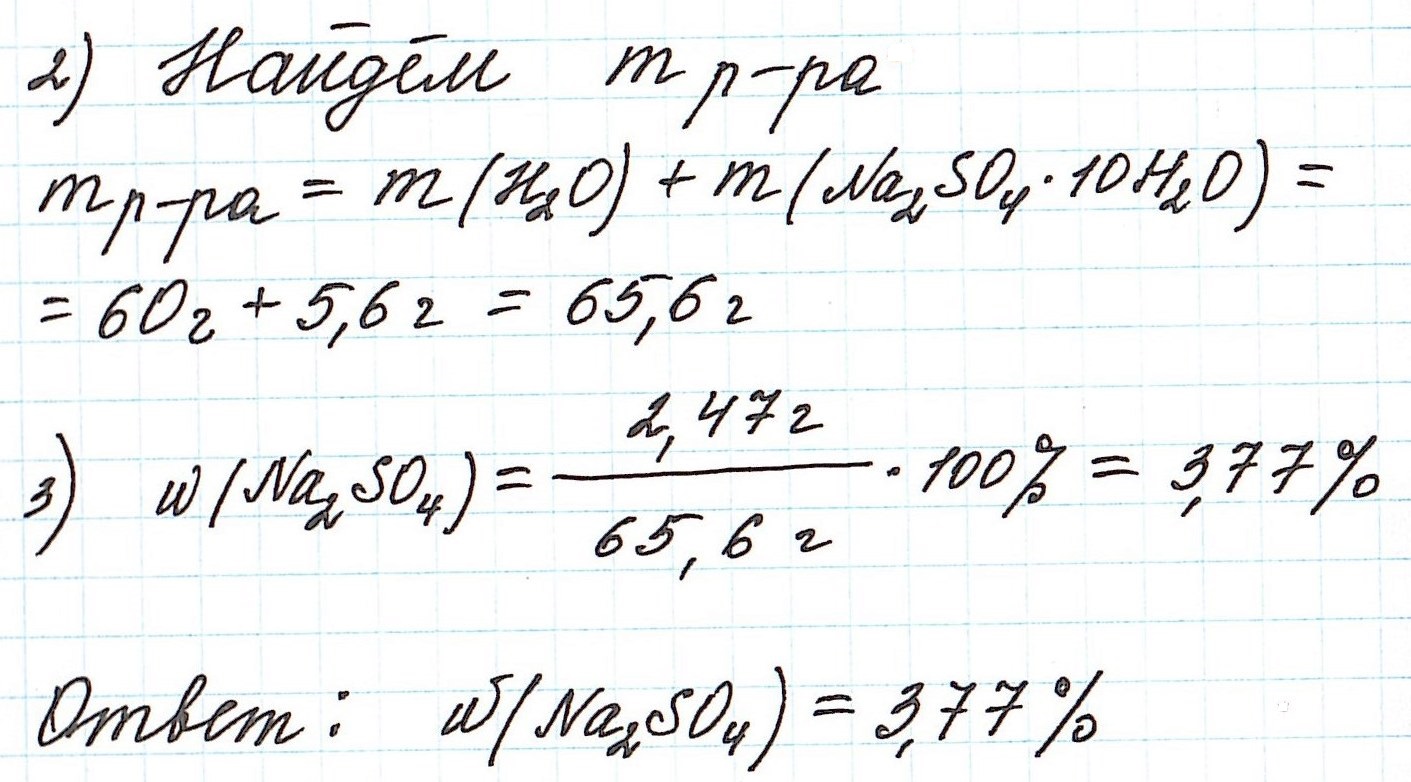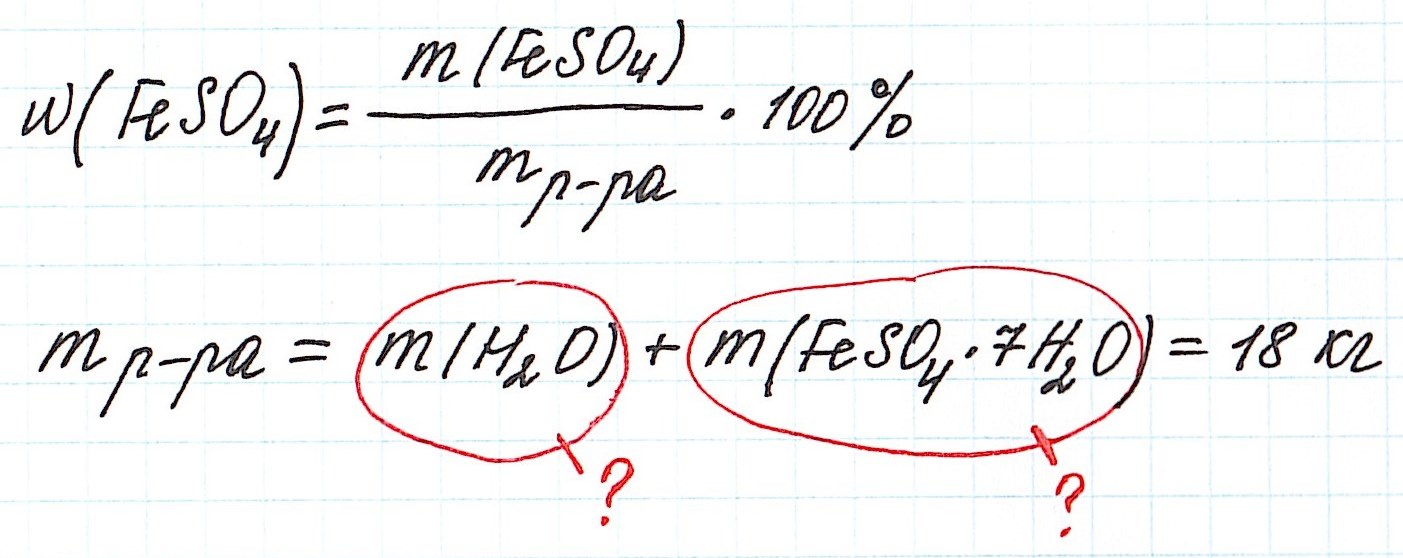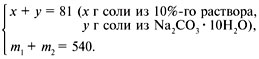Для того, чтобы решать задачи на растворы и концентрацию, необходимо чётко понимать, что
называется концентрацией раствора.
Запомните!
Концентрация раствора — это часть, которую составляет масса растворённого вещества от
массы всего раствора.
- 9%-я концентрация раствора соли — это 9 грамм соли в
100 граммах раствора.
Разбор примера
Килограмм соли растворили в 9 л воды. Чему равна концентрация полученного раствора?
(Масса 1 л воды составляет 1 кг)
Используя определение концентрации данное выше, решим задачу следующим образом.
- 1 кг — масса растворённого вещества (соли)
- 9 кг — масса воды в растворе (не путать с общей массой раствора)
- 9 + 1 = 10 кг — общая масса раствора.
Ответ: 10% — концентрация раствора.
Разбор примера
Теперь решим обратную задачу.
Сколько соли получится при выпаривании 375 граммов 12%-го раствора?
Чтобы найти массу выпаренной соли из раствора, умножим общую массу раствора на процент концентрации.
Не забудем предварительно перевести процент в десятичную дробь.
Ответ: 45 г соли.
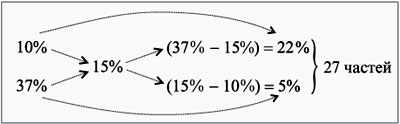
Сложная задача на растворы
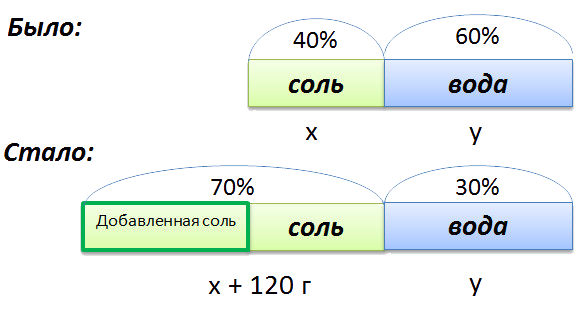
В растворе 40% соли. Если добавить 120 г соли,
то процентное содержание соли станет равным 70.
Сколько грамм соли было первоначально в растворе?
Для составления пропорции обозначим за «x» первоначальную массу соли в растворе, а
за «y» массу
воды в растворе. Так как концентрация соли в исходном растворе 40%, то соответственно вода составляет
100% − 40%= 60%
Изобразим графически условия задачи.
Составим пропорцию, связывающую эти величины до добавления соли.
Для решения задачи нам надо определить какая из неизвестных («x» или «y») остаётся неизменной
после добавления соли.
Этой величиной является масса воды в растворе «y».
Выразим её, учитывая изменения в растворе после добавления соли.
- (x + 120) г — масса соли в новом растворе
- (100% − 70% = 30% — процентное содержание воды в новом растворе.
Составим пропорцию аналогично предыдущей, но с учётом изменений произошедших
после добавления соли.
Так как масса воды осталось неизменной после добавления соли, приравняем её значения до и
после добавления соли и решим уравнение.
Ответ: 48 г — масса соли в первоначальном растворе.
Ваши комментарии
Важно!
Чтобы оставить комментарий, вам нужно войти на наш сайт при помощи
«ВКонтакте».

Оставить комментарий:
31 октября 2016 в 18:30
Роман Роршахов
Профиль
Благодарили: 0
Сообщений: 1
Роман Роршахов
Профиль
Благодарили: 0
Сообщений: 1
Сколько граммов 6%-ного раствора соли можно получить из 300 г жидкости содержащей 40% этой соли?
0
Спасибо
Ответить
5 ноября 2016 в 21:36
Ответ для Роман Роршахов
София Деревянко
Профиль
Благодарили: 0
Сообщений: 2
София Деревянко
Профиль
Благодарили: 0
Сообщений: 2
Если соли 40%, то воды — 60%. проценты характеризуют массовые доли, значит в растворе 120 г соли. Для нахождения массы раствора составляем пропорцию, которую можно прочитать так ЕСЛИ 120 Г СОЛИ СОСТАВЛЯЕТ 6 % ОТ ВСЕГО РАСТВОРА, ТО ВЕСЬ РАСТВОР (100%) БУДЕТ ВЕСИТЬ Х г, 120: 6=Х: 100, отсюда находим Х=120: 6 · 100, вес всего раствора 2 кг. проверяем, 2000 г · 0,06 получается 120г. Количество соли не изменилось))))
0
Спасибо
Ответить
6 сентября 2015 в 12:03
Дарья Сидорова
Профиль
Благодарили: 0
Сообщений: 1
Дарья Сидорова
Профиль
Благодарили: 0
Сообщений: 1
0
Спасибо
Ответить
6 сентября 2015 в 13:43
Ответ для Дарья Сидорова
Настюша Кирпичева
Профиль
Благодарили: 0
Сообщений: 1
Настюша Кирпичева
Профиль
Благодарили: 0
Сообщений: 1
1 3-
0
Спасибо
Ответить
2 сентября 2016 в 15:56
Ответ для Дарья Сидорова
Евгений Колосов
Профиль
Благодарили: 12
Сообщений: 197
Евгений Колосов
Профиль
Благодарили: 12
Сообщений: 197
= ? · = ? = ===8
0
Спасибо
Ответить
22 апреля 2015 в 16:36
Амина Загребельная
Профиль
Благодарили: 0
Сообщений: 1
Амина Загребельная
Профиль
Благодарили: 0
Сообщений: 1
в морской воде содержится 5% соли, какую часть морской воды состовляет соль?
0
Спасибо
Ответить
14 апреля 2016 в 13:37
Ответ для Амина Загребельная
Евгений Колосов
Профиль
Благодарили: 12
Сообщений: 197
Евгений Колосов
Профиль
Благодарили: 12
Сообщений: 197
В статье подробно описано, как это делается: http://math-prosto.ru/index.php?page=pages/percent/percent1.php
А именно: «Чтобы перевести проценты в дробь, нужно убрать знак % и разделить число на 100.»
5: 100=0,05=
0
Спасибо
Ответить
Формула концентрации раствора. Их множество. И каждая соответствует тому или иному способу выражения концентрации. А в химии их применяются достаточно: массовая доля растворенного вещества, молярная, нормальная, моляльная, титр и др.
Зачем так много? Ответ на этот вопрос очень прост. Каждый вид концентрации удобен в том или ином случае, когда применение другого вида концентрации неуместно.
Например, при исследовании содержания массы вещества в очень небольшом объеме раствора удобно пользоваться титром. А в каких-то технологиях вообще концентрация заменяется другими количественными характеристиками раствора. Так, в технологии посола рыбы для расчета необходимой концентрации тузлука (раствора поваренной соли) используют не его процентную концентрацию, а плотность.
Содержание:
1. Концентрация – что это такое
2. Формула концентрации раствора: основные виды
3. Массовая доля растворенного вещества и примеры ее вычисления
- разбавление раствора водой
- концентрирование раствора путем упаривания
- концентрирование раствора путем добавления растворенного вещества
- смешивание двух растворов
- применение кристаллогидратов для приготовления раствора (задачи на кристаллогидраты)
4. Правило «креста» в химии растворов как метод решения задач на процентную концентрацию растворов
Концентрация – что это такое
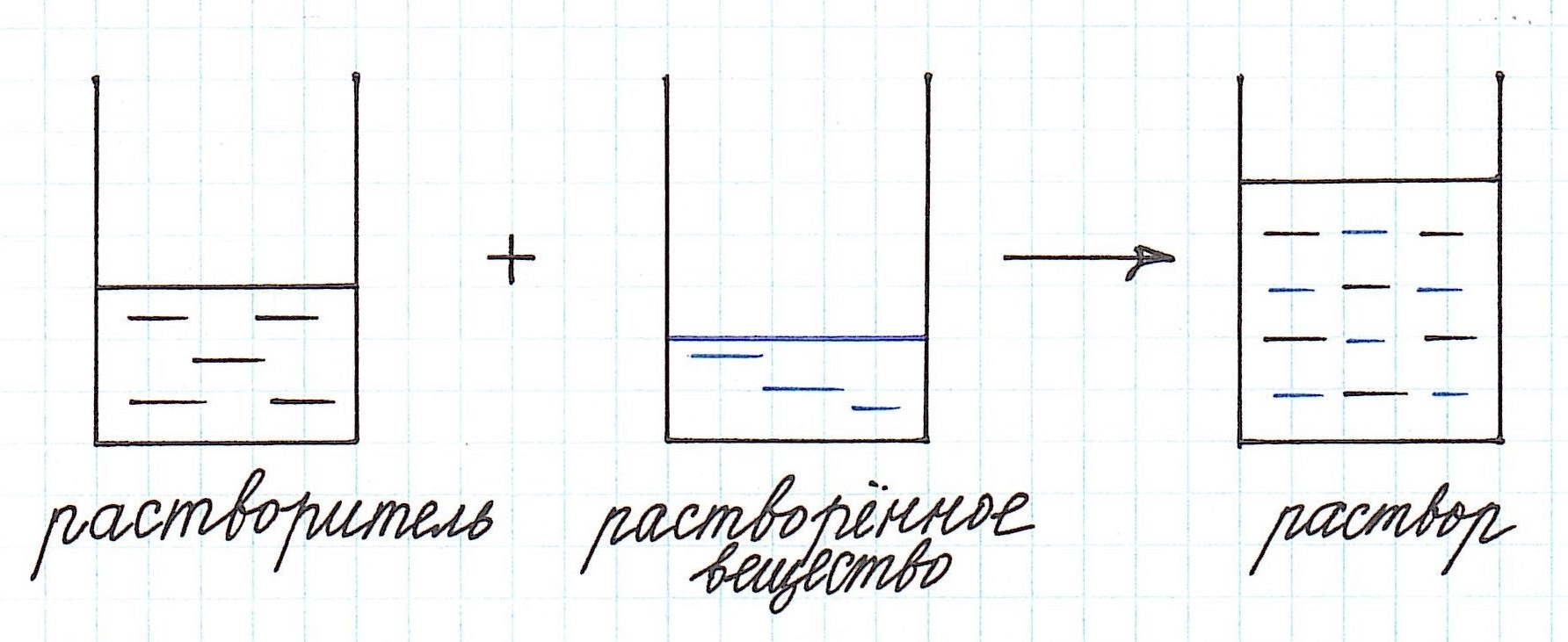
Любой раствор имеет различные характеристики: качественные и количественные. Одной из важнейших количественных характеристик является концентрация раствора.
Концентрация раствора – это количество растворенного вещества, содержащееся в определенном количестве раствора.
Как видно из приведенного определения, основными компонентами раствора являются:
— растворитель;
— растворенное вещество.
Растворенного вещества в растворе всегда меньше, а растворителя больше.
И вот именно с вычислением количественного содержания растворенного вещества чаще всего и связаны все расчеты, основанные на применении формулы концентрации раствора.
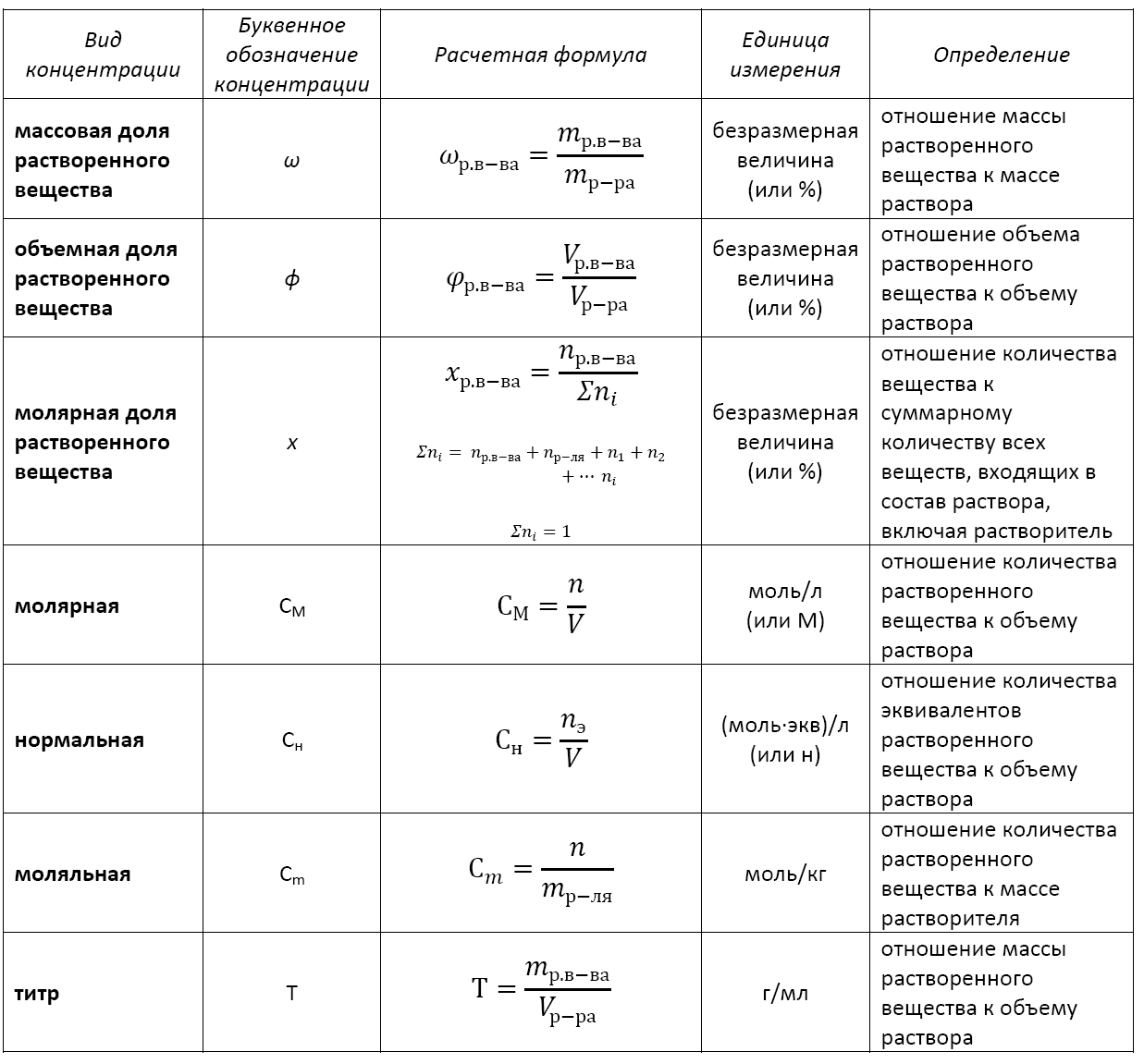
Существует несколько видов концентрации раствора:
— массовая доля растворенного вещества;
— объемная доля растворенного вещества;
— молярная доля растворенного вещества;
— молярная (или молярность);
— моляльная (или моляльность);
— нормальная (или эквивалентная);
— титр.
Формула концентрации раствора: основные виды
Применение того или иного вида концентрации уместно в каждом конкретном случае. Не существует какой-то универсальной концентрации или универсальной формулы концентрации раствора.
Кстати, с помощью математических преобразований можно перейти от одной концентрации к другой или найти взаимосвязь между разными их видами.
Основные расчетные формулы концентрации раствора приведены в таблице:
Массовая доля растворенного вещества и примеры ее вычисления
Массовая доля растворенного вещества – это отношение массы растворенного вещества к массе раствора.
Ее расчетная формула выглядит так:
где ωр.в-ва – массовая доля растворенного вещества, mр.в-ва – масса растворенного вещества, mр-ра – масса раствора.
ωр.в-ва представляет собой долю или от единицы или от 100%. Так, например, имеется двухпроцентный раствор NaCl. Его концентрация будет записана в первом случае ω(NaCl) = 0,02, а во втором – ω(NaCl) = 2%. Форма записи основной сути не меняет. Можно записывать и так, и так.
Что же означает выражение ω(NaCl) = 0,02 или ω(NaCl) = 2%? Буквально следующее: в 100 г водного раствора поваренной соли содержится 2 г этой соли и 98 г воды.
Необходимо помнить, что раствор состоит из растворителя и растворенного вещества. Поэтому масса раствора будет состоять из массы растворителя и массы растворенного вещества:
Тогда основную расчетную формулу для массовой доли растворенного вещества можно преобразовать:
Очень часто в расчетах с процентной концентрацией используются плотность и объем раствора:
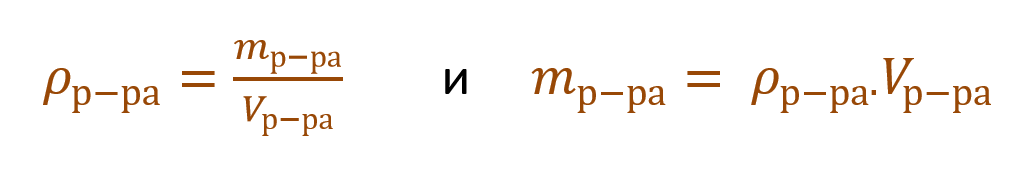
В других ситуациях могут использоваться объем и плотность не раствора, а растворителя. Тогда основная формула для расчета концентрации будет выглядеть так:
На практике бывает необходимо не только приготовить раствор с какой-либо определенной концентрацией, но и увеличить, либо уменьшить ее значение. Это достигается различными приемами:
— упариванием раствора;
— добавлением растворенного вещества;
— добавлением к раствору растворителя (например, воды).
Кроме того, приходится часто смешивать друг с другом растворы разных концентраций.
Разберем все возможные случаи.
Мы рекомендуем задачи, в которых речь идет о растворах, решать с использованием схематических рисунков. Это очень наглядно, особенно, когда речь идет о смешивании растворов.
Начнем с самого простого: вычислим концентрацию раствора.
Пример 1. В 200 г воды растворили 40 г глюкозы. Вычислите массовую долю глюкозы в полученном растворе.
Обратите внимание, что речи о каком-либо химическом взаимодействии не идет! Поэтому записывать уравнения реакций не требуется!
Запишем общую формулу для расчета массовой доли растворенного вещества:
В данной задаче глюкоза (C6H12O6) – растворенное вещество, а вода (H2O) – растворитель. Масса раствора будет складываться из массы глюкозы и массы воды:
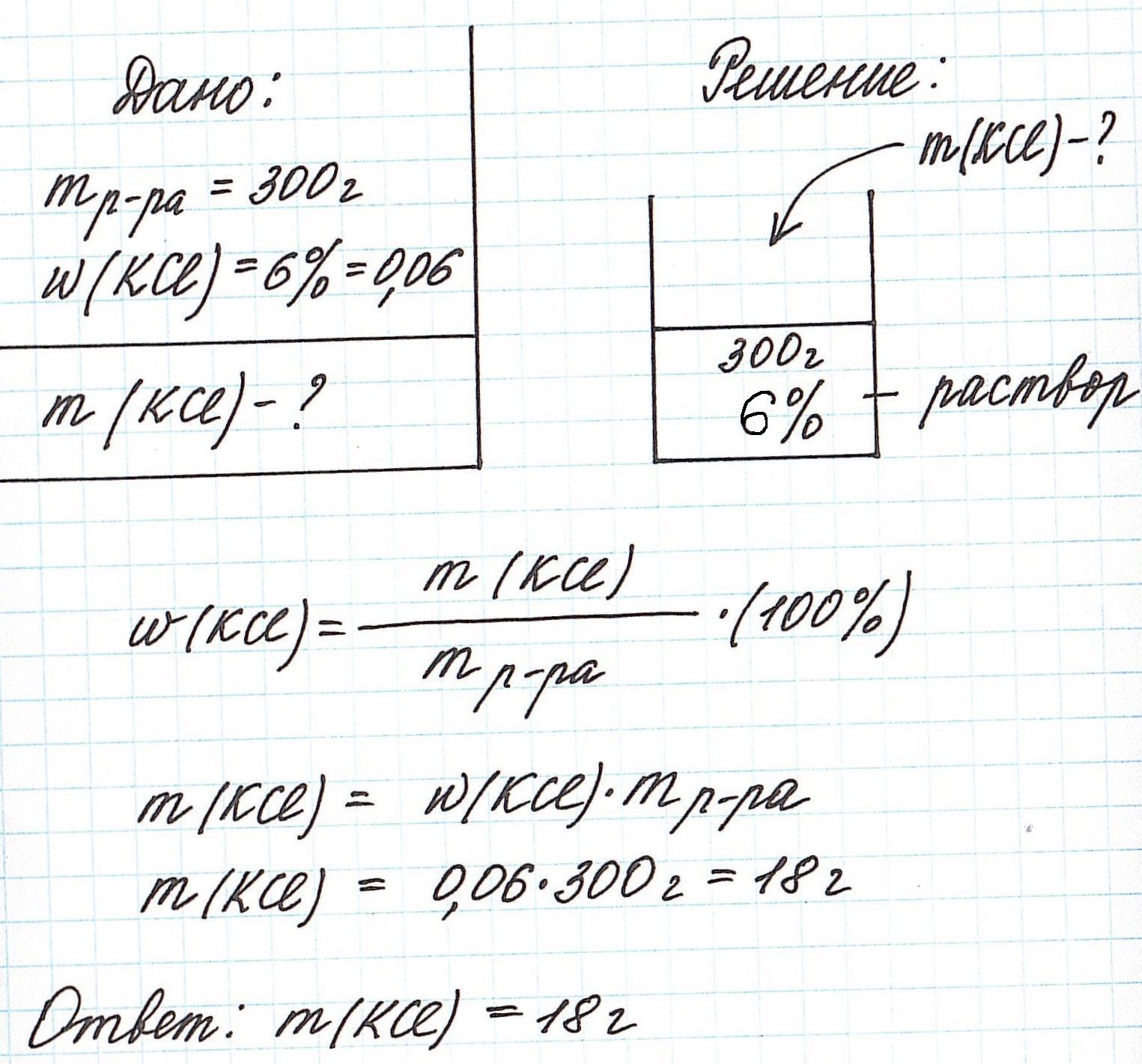
Пример 2. Рассчитайте, сколько потребуется хлорида калия, чтобы приготовить 300 г раствора с массовой долей соли 6%.
Обратите внимание, для того, чтобы расчеты были менее громоздкими, будем использовать выражение концентрации не в %, а в долях от единицы.
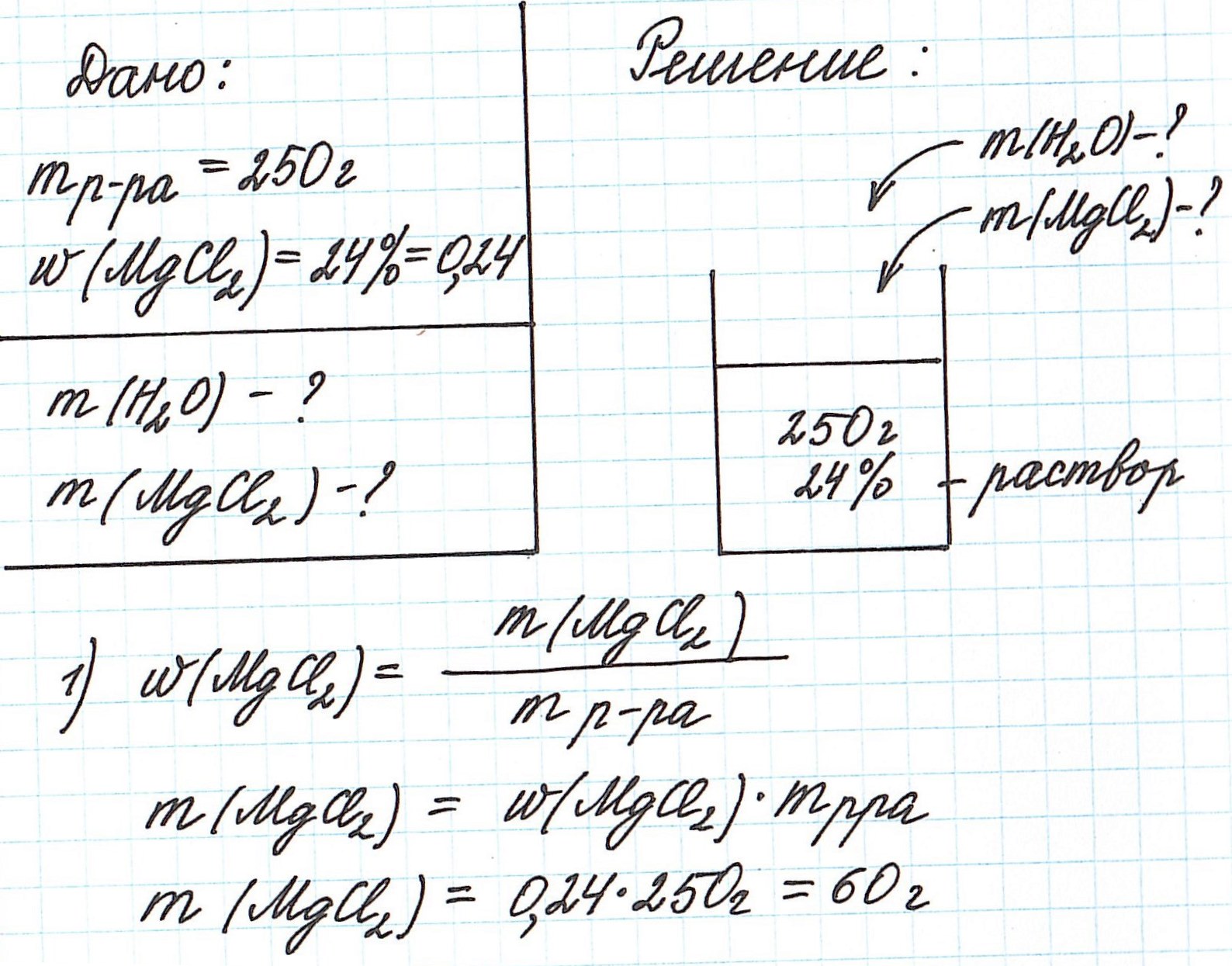
Пример 3. Необходимо приготовить 250 г раствора с массовой долей хлорида магния 24%. Рассчитайте массу требуемых воды и соли.
Так как раствор готовится из хлорида магния и воды, то и масса раствора равна сумме масс хлорида магния и воды:
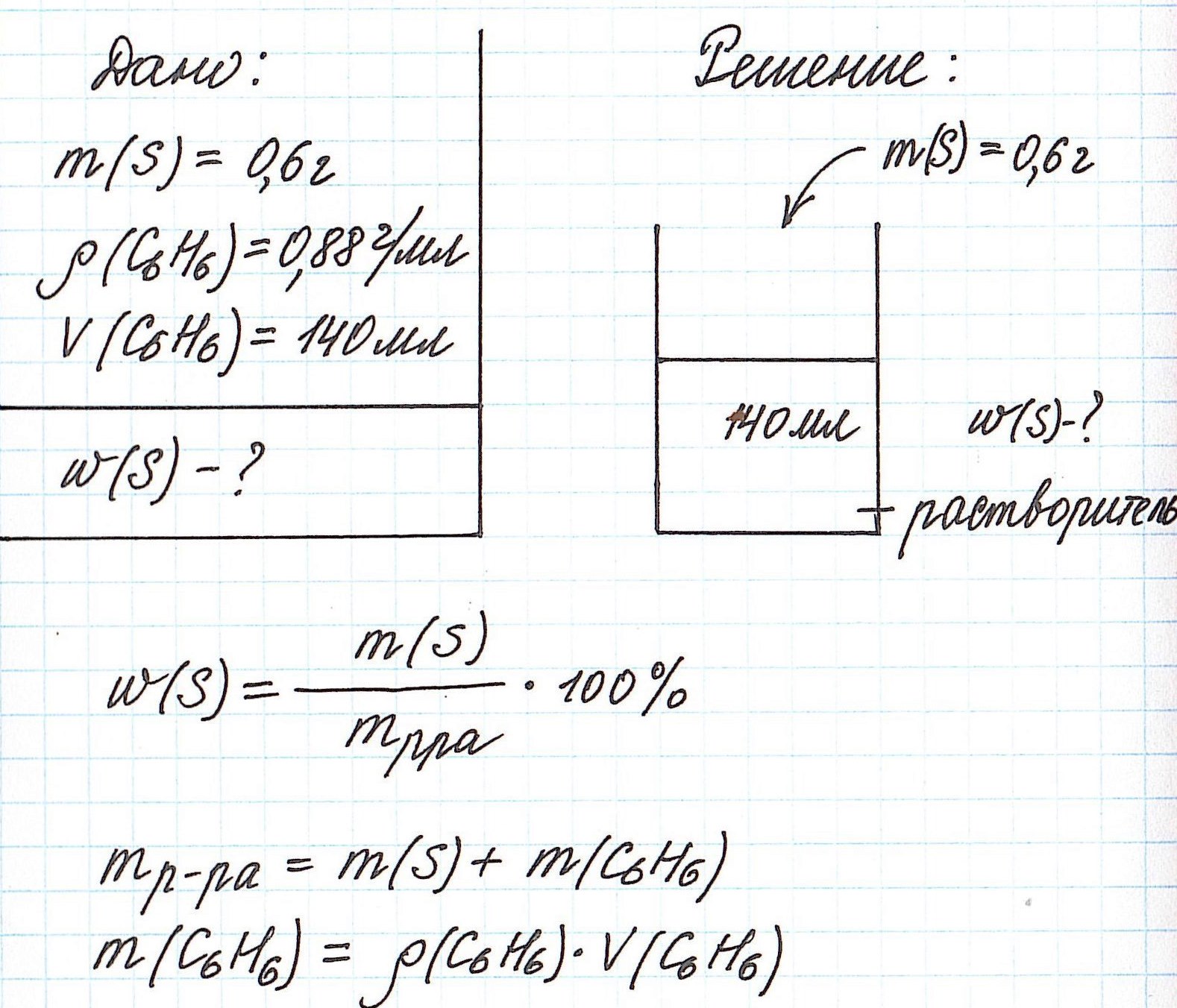
Рассмотрим задачу, в которой в качестве растворителя выступает не вода, а другое вещество.
Пример 4. В органическом растворителе бензоле объемом 140 мл растворили серу массой 0,6 г. Вычислите массовую долю серы в полученном растворе, если плотность бензола составляет 0,88 г/мл.
Обратите внимание, что здесь:
— масса раствора не известна;
— масса растворителя (бензола) не известна;
— известны объем и плотность растворителя (бензола), что позволяет нам найти его массу;
— масса раствора состоит из массы растворителя (бензол) и массы растворенного вещества (сера).
Объединим все расчетные формулы в одну и подставим в нее имеющиеся численные значения:
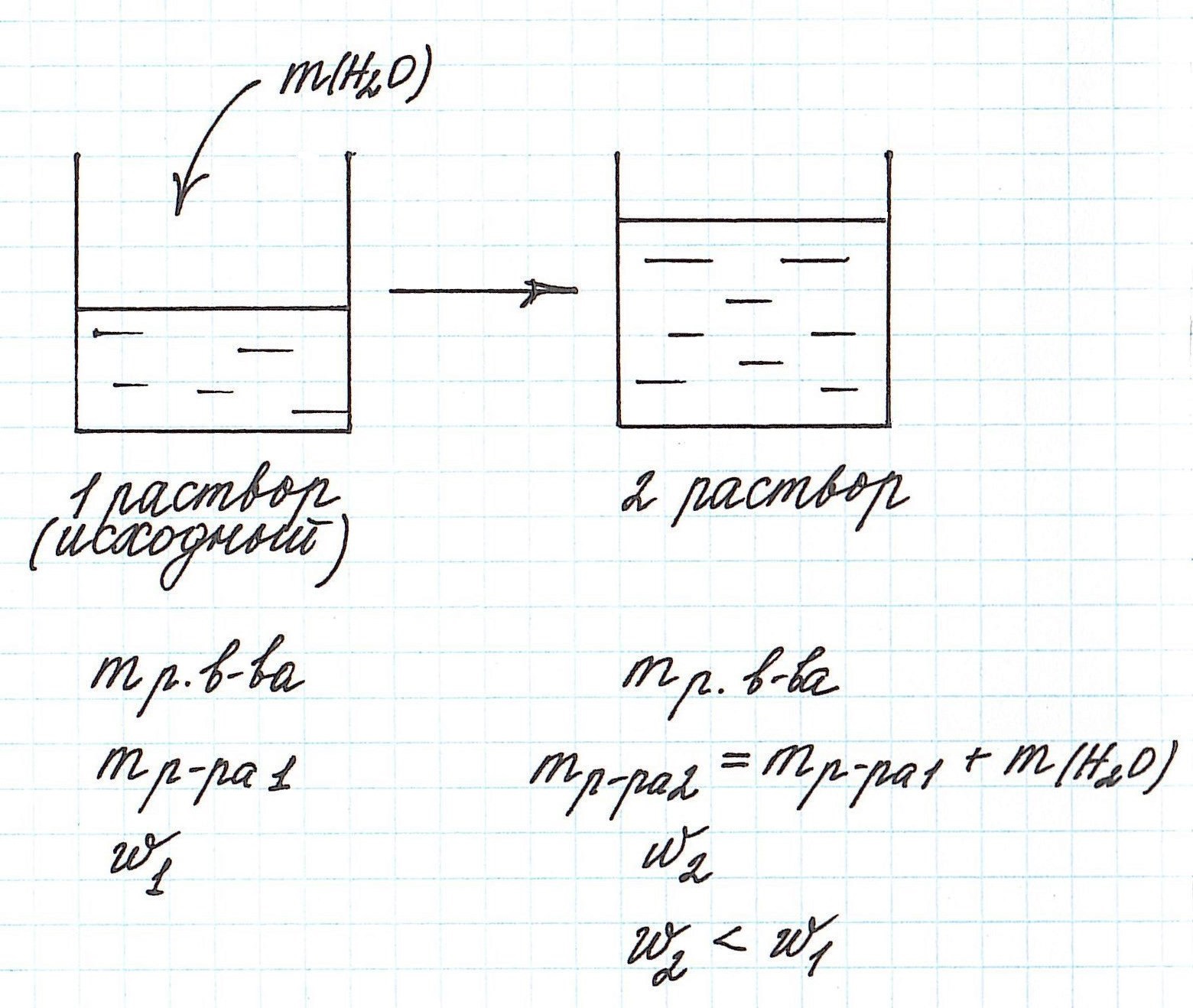
Вычисление массовой доли растворенного вещества при разбавлении раствора водой
Разбавление раствора водой приводит к уменьшению его концентрации.
Запомним, что в таких случаях:
— увеличивается масса раствора;
— увеличивается масса растворителя;
— масса растворенного вещества остается постоянной.
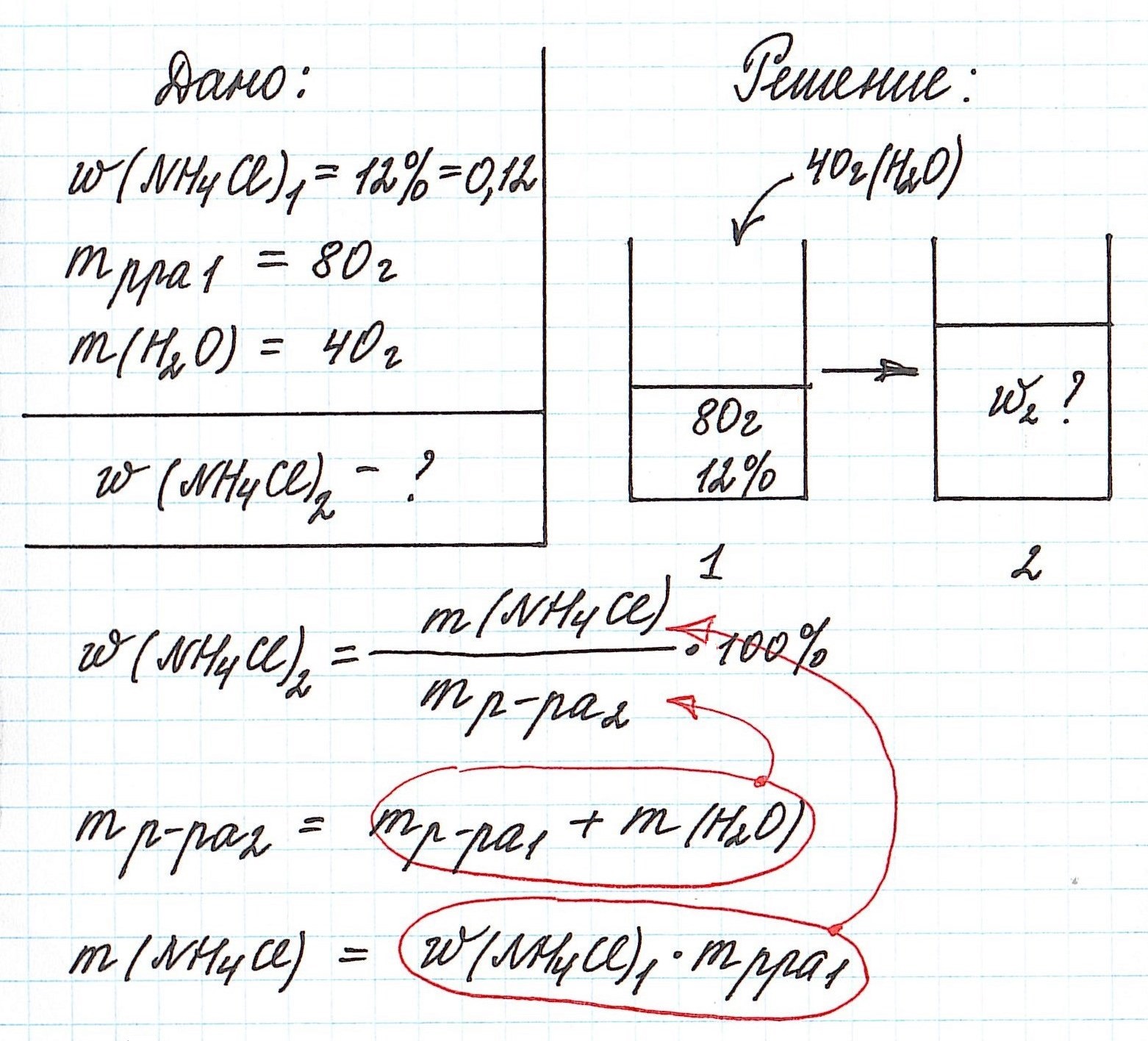
Пример 5. К 80 г раствора с массовой долей NH4Cl 12% добавили 40 г воды. Вычислите массовую долю хлорида аммония в полученном растворе.
Объединим все полученные формулы в одну и подставим имеющиеся данные:
Пример 6. Рассчитайте объем раствора фосфорной кислоты (массовая доля кислоты 12%, плотность 1,065 г/мл), который потребуется для приготовления раствора с массовой долей H3РO4 4% объемом 250 мл (плотность 1,02 г/мл).
В данной задаче речь напрямую о разбавлении раствора не идет. Но судя по тому, что исходный раствор имел концентрацию 12%, а конечный – 4%, становится ясно: последний раствор можно получить путем разбавления первого водой.
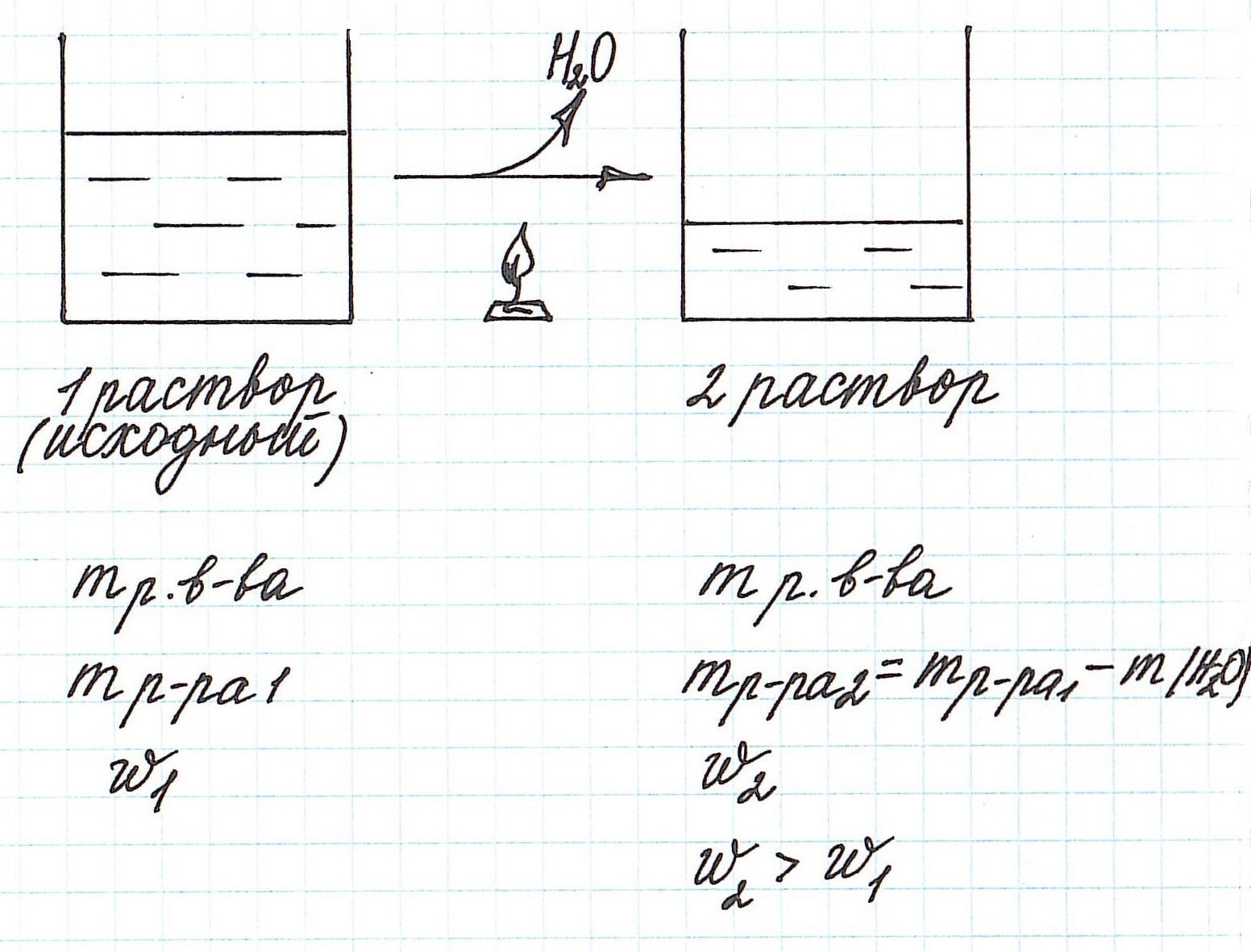
Вычисление массовой доли растворенного вещества при концентрировании раствора путем упаривания
Упаривание раствора, т.е. его нагревание, при котором происходит испарение воды, приводит к увеличению концентрации.
Учтите, что при этом:
— уменьшается масса раствора;
— уменьшается масса растворителя;
— масса растворенного вещества остается постоянной (при условии, что растворенное вещество не разлагается при данной температуре).
Пример 7. Из 200 г 27%-ного раствора глюкозы выпарили 20 г воды. Определите массовую долю глюкозы в полученном растворе.
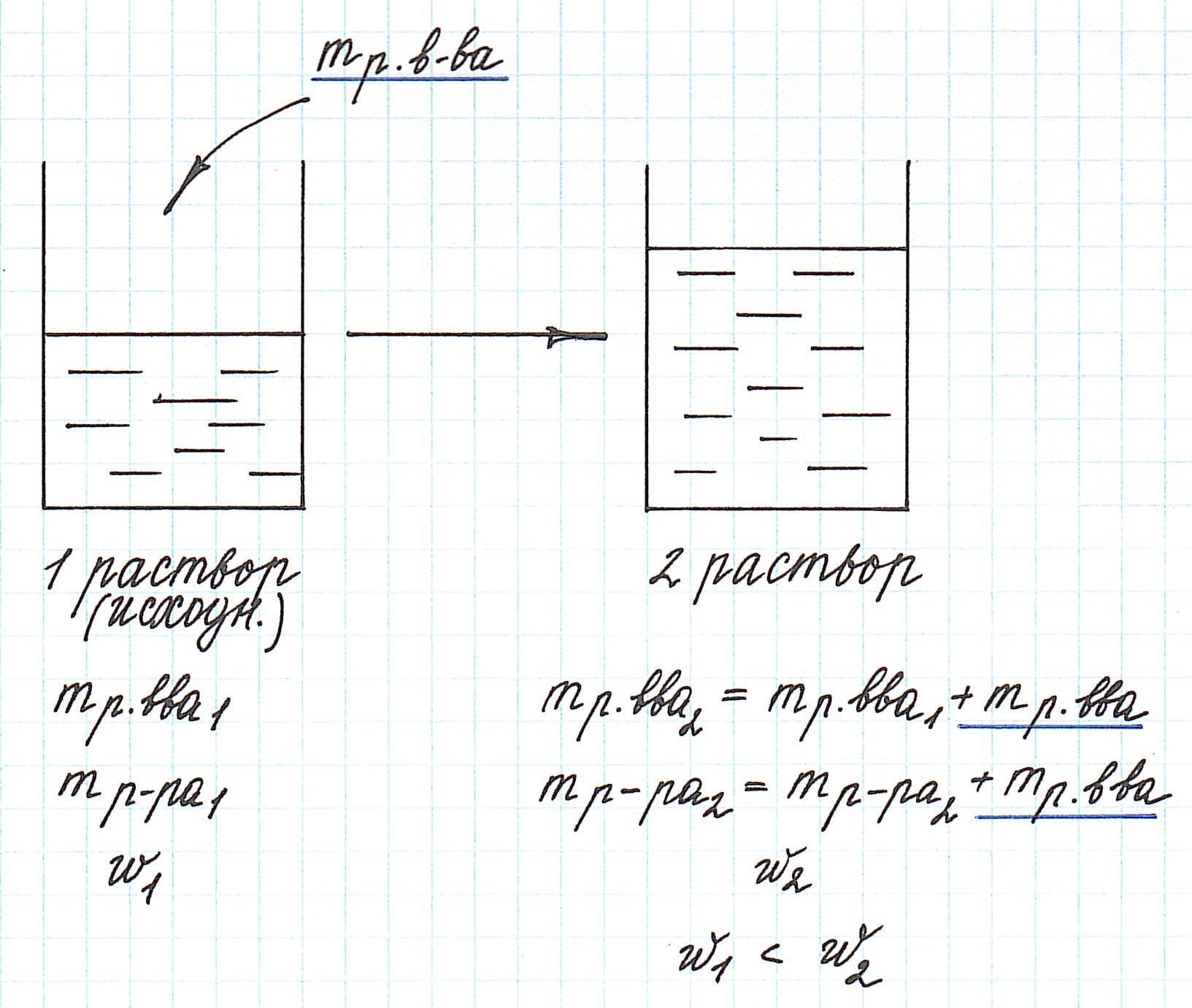
Вычисление массовой доли растворенного вещества при концентрировании раствора путем добавления растворенного вещества
Добавление к уже существующему раствору новой порции растворенного вещества приводит к увеличению концентрации раствора.
Помните, что в таких случаях:
— увеличивается масса раствора;
— увеличивается масса растворенного вещества.
Пример 8. Определите массу хлорида калия, который надо добавить к 180 г 15%-ного раствора этой соли, чтобы получить 20%-ный раствор.
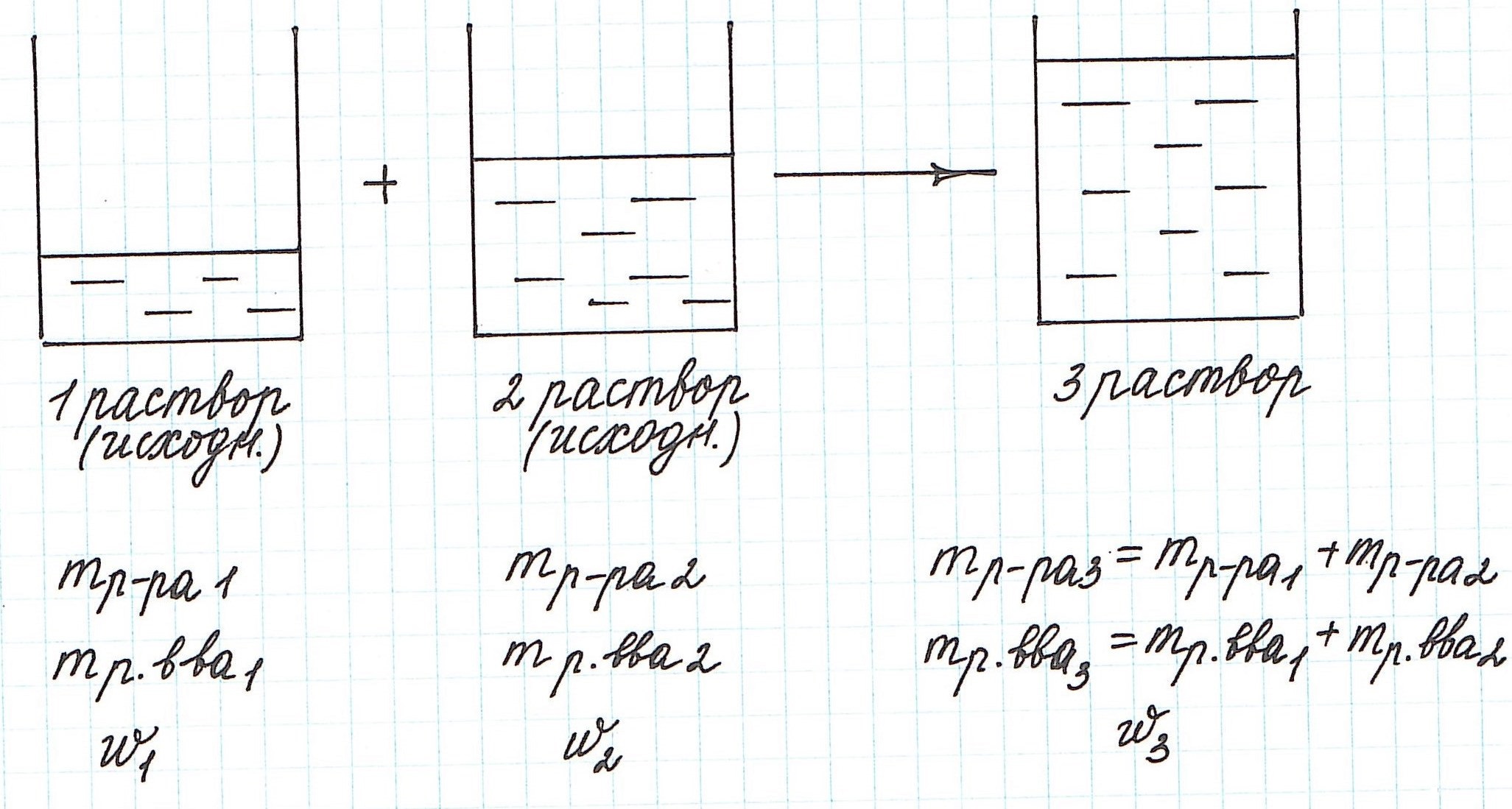
Вычисление массовой доли растворенного вещества при смешивании двух растворов
При смешивании двух растворов (речь о растворах одного и того же вещества конечно же) изменяются все количественные характеристики:
— увеличивается масса раствора;
— увеличивается масса растворенного вещества;
— изменяется массовая доля растворенного вещества.
Пример 9. Смешали 80 г 32%-ного раствора и 30 г 10%-ного раствора нитрата меди (II). Какова концентрация соли в полученном растворе?
Вычисление массовой доли растворенного вещества с применением кристаллогидратов для приготовления раствора
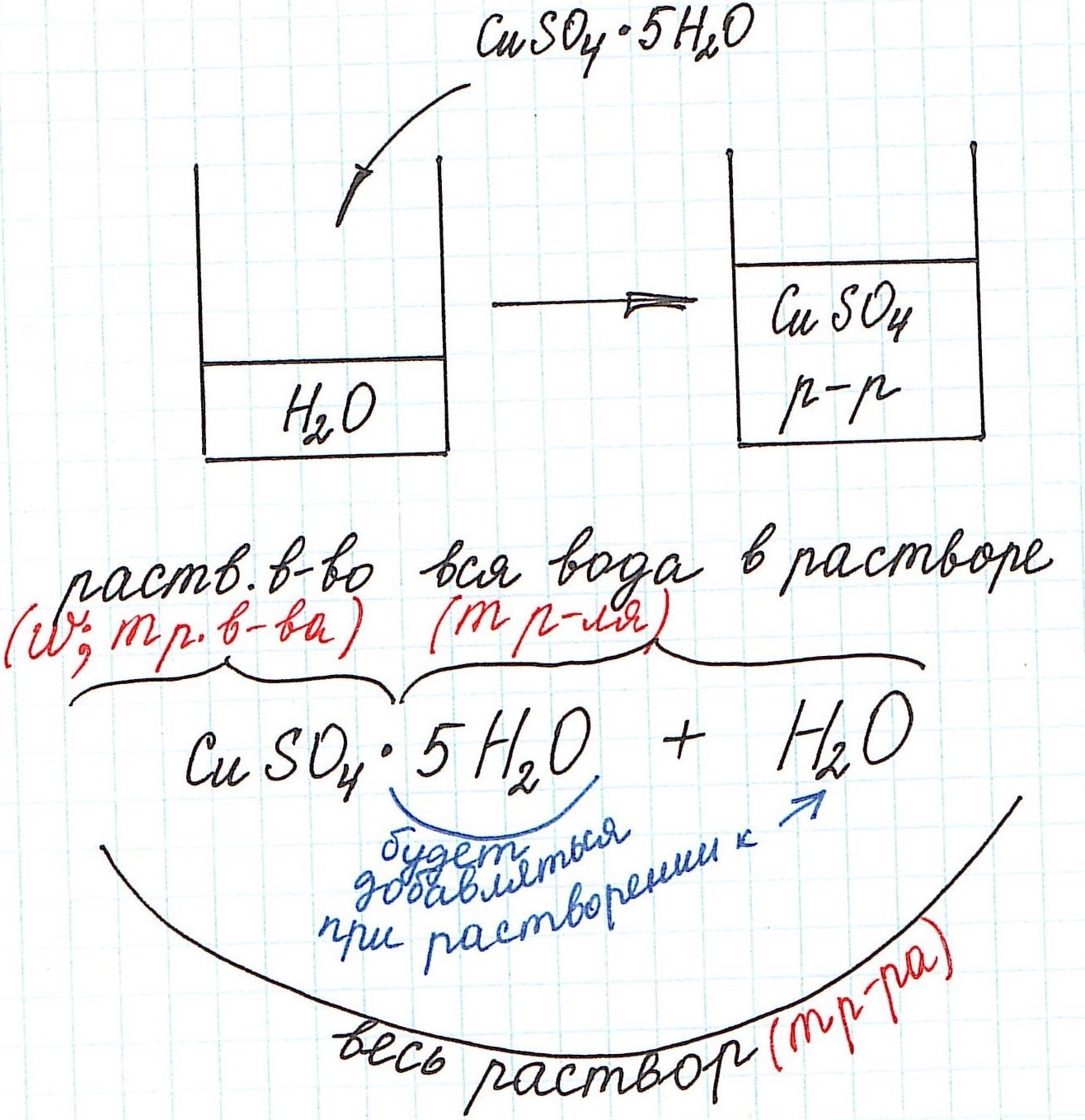
Кристаллогидраты используются для приготовления растворов довольно часто. Кристаллогидраты представляют собой вещества, в состав которых помимо основного вещества входят молекулы воды. Например:
CuSO4·5H2O – кристаллогидрат сульфата меди (II) (или медный купорос);
Na2SO4·10H2O – кристаллогидрат сульфата натрия (или глауберова соль).
Больше примеров здесь.
Вода, входящая в состав кристаллогидрата, называется кристаллизационной.
Кристаллогидраты различаются прочностью связи между основным веществом и кристаллизационной водой. Одни из них теряют воду при комнатной температуре с течением времени и перестают быть кристаллогидратами (например, Na2СO3·10H2O). Другие – обезвоживаются только при сильном нагревании (например, CuSO4·5H2O).
При расчете концентрации с использованием кристаллогидратов для получения растворов часто приходится учитывать и кристаллизационную воду.
Но сначала поясним некоторые нюансы на конкретном примере:
1) Формула CuSO4·5H2O означает, что 1 моль CuSO4·5H2O содержит 1 моль CuSO4 и 5 моль H2O. Это можно было бы записать так:
n(CuSO4) = n(CuSO4·5H2O); n(H2O) = 5n(CuSO4·5H2O)
2) Относительная молекулярная (и численно молярная) масса будет складываться из относительной молекулярной массы вещества и относительной молекулярной массы воды. Например:
Mr(CuSO4·5H2O) = Mr(CuSO4) + 5·Mr(H2O) = 160 + 5·18 = 250 и, соответственно,
M(CuSO4·5H2O) = M(CuSO4) + 5·M(H2O) = 160 + 5·18 = 250 г/моль.
3) Еще одну особенность поясним с помощью рисунка:
Итак, разберем несколько типичных задач.
Пример 10. В 60 г воды растворили глауберову соль Na2SO4·10H2O массой 5,6 г. Какова массовая доля сульфата натрия в полученном растворе?
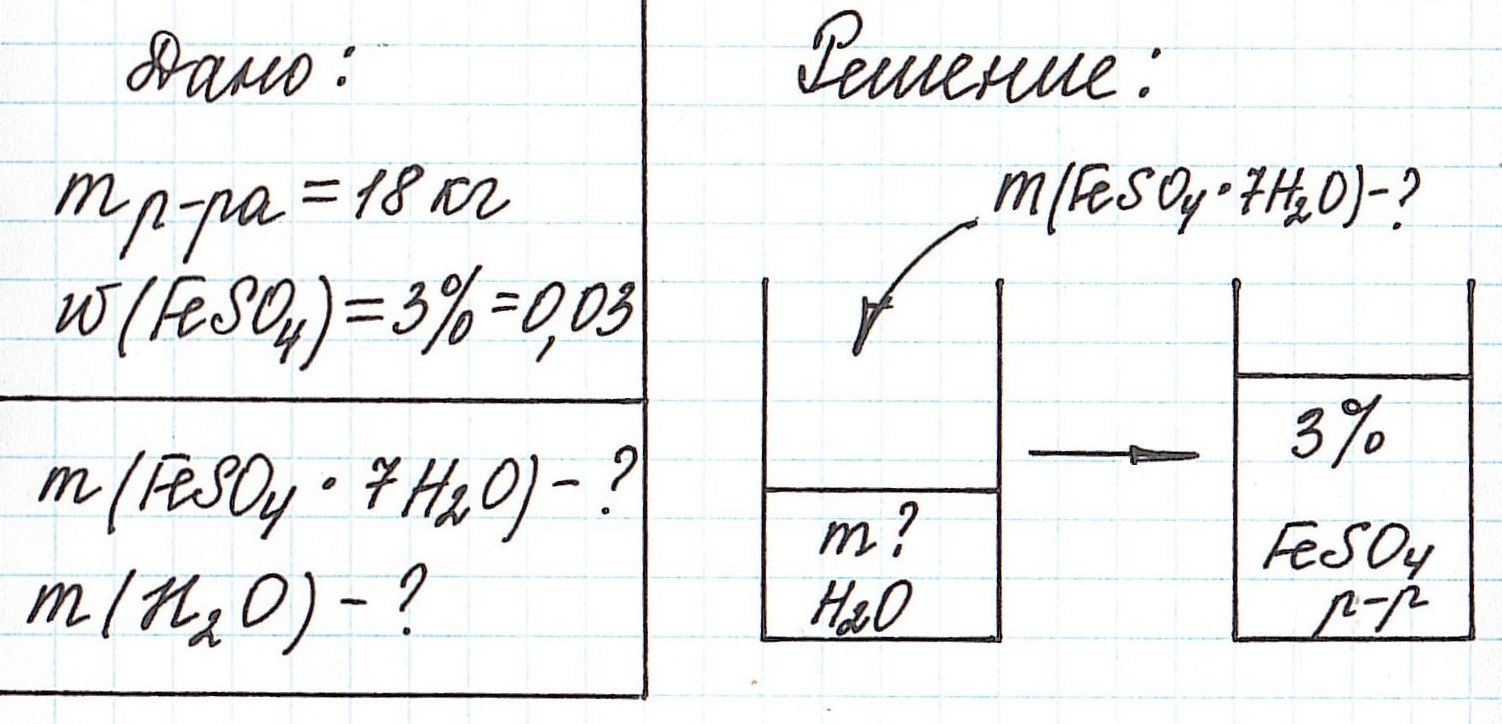
Пример 11. Какая масса железного купороса FeSO4·7H2O и воды потребуется для приготовления 18 кг раствора сульфата железа (II) с массовой долей FeSO4 3%?
Обратите внимание, что масса раствора дана не в граммах (г), а в килограммах (кг). Для того, чтобы привести в ходе расчетов все единицы измерения к единой системе, можно перевести килограммы в граммы и вычислять как обычно.
Но есть более простой способ. Можно считать количество вещества не в моль, а в киломоль (кмоль). Молярную массу вычислять не в г/моль, а в кг/кмоль. В этом случае ответ в задаче мы сразу получим в килограммах.
Пример 12. Вычислите массу кристаллогидрата сульфата никеля NiSO4·7H2O, который надо добавить к 180 г раствора с массовой долей сульфата никеля 1,5%, чтобы получить раствор с массовой долей соли 6%?
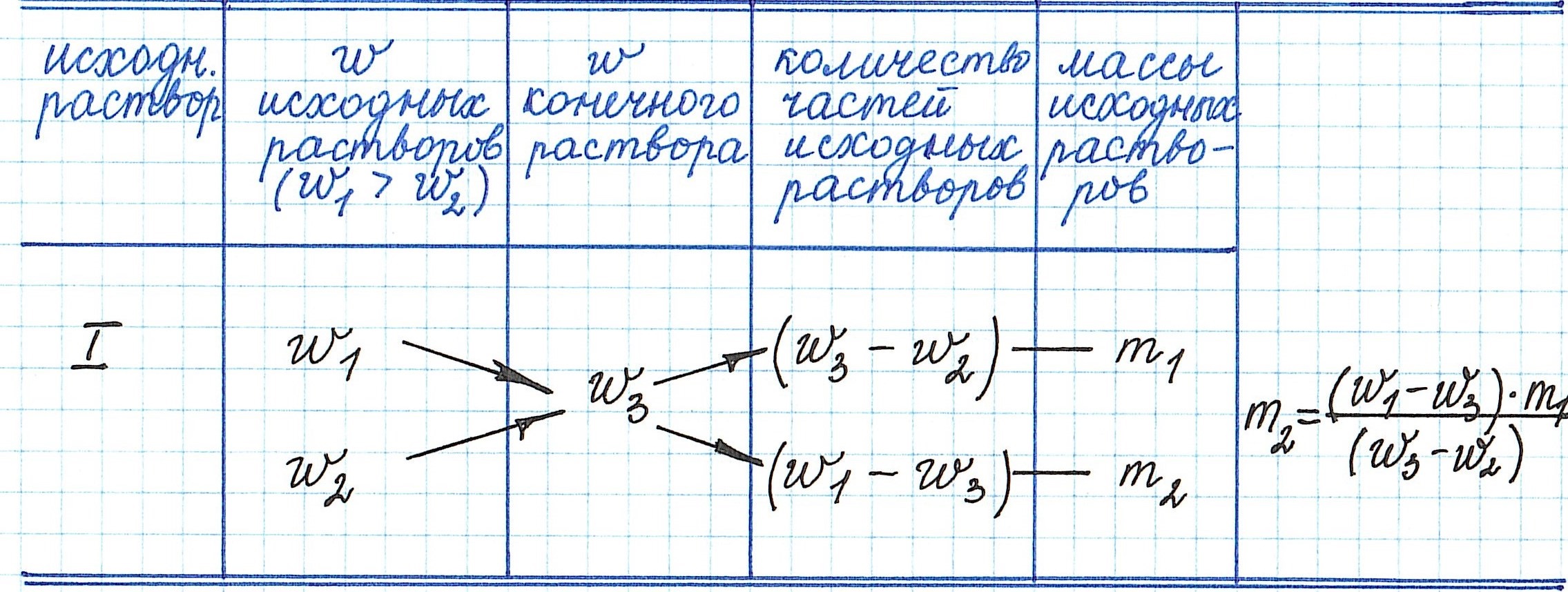
Правило «креста» в химии растворов как метод решения задач на процентную концентрацию растворов
Правилом «креста» (или «квадратом Пирсона») очень удобно пользоваться в расчетах, связанных с разбавлением или смешиванием растворов.
Общая схема вычислений выглядит так:
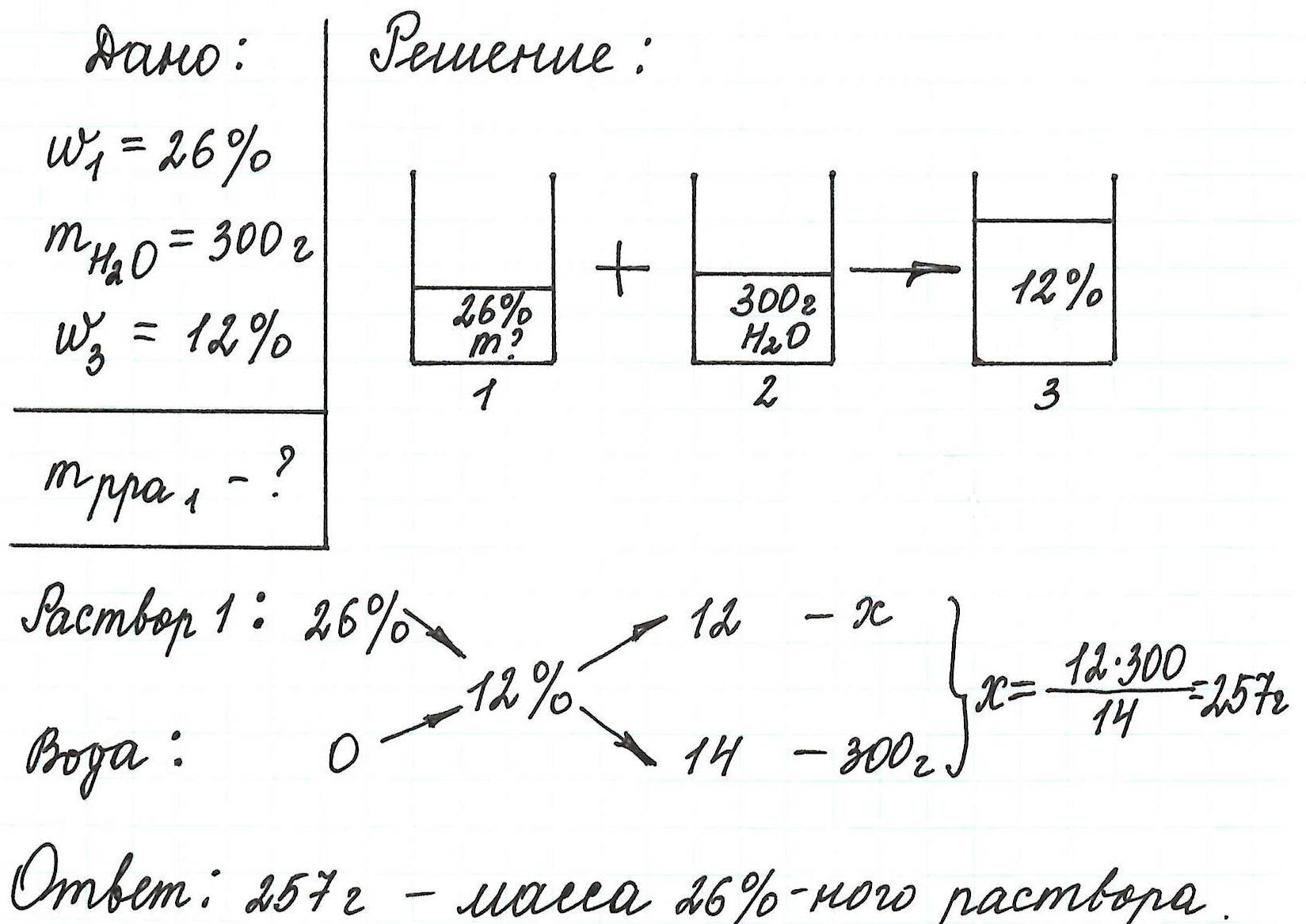
Пример 13. Какую массу 5%-ного раствора глюкозы надо добавить к 70 г 21%-ного раствора этого же вещества, чтобы получить 12%-ный раствор?
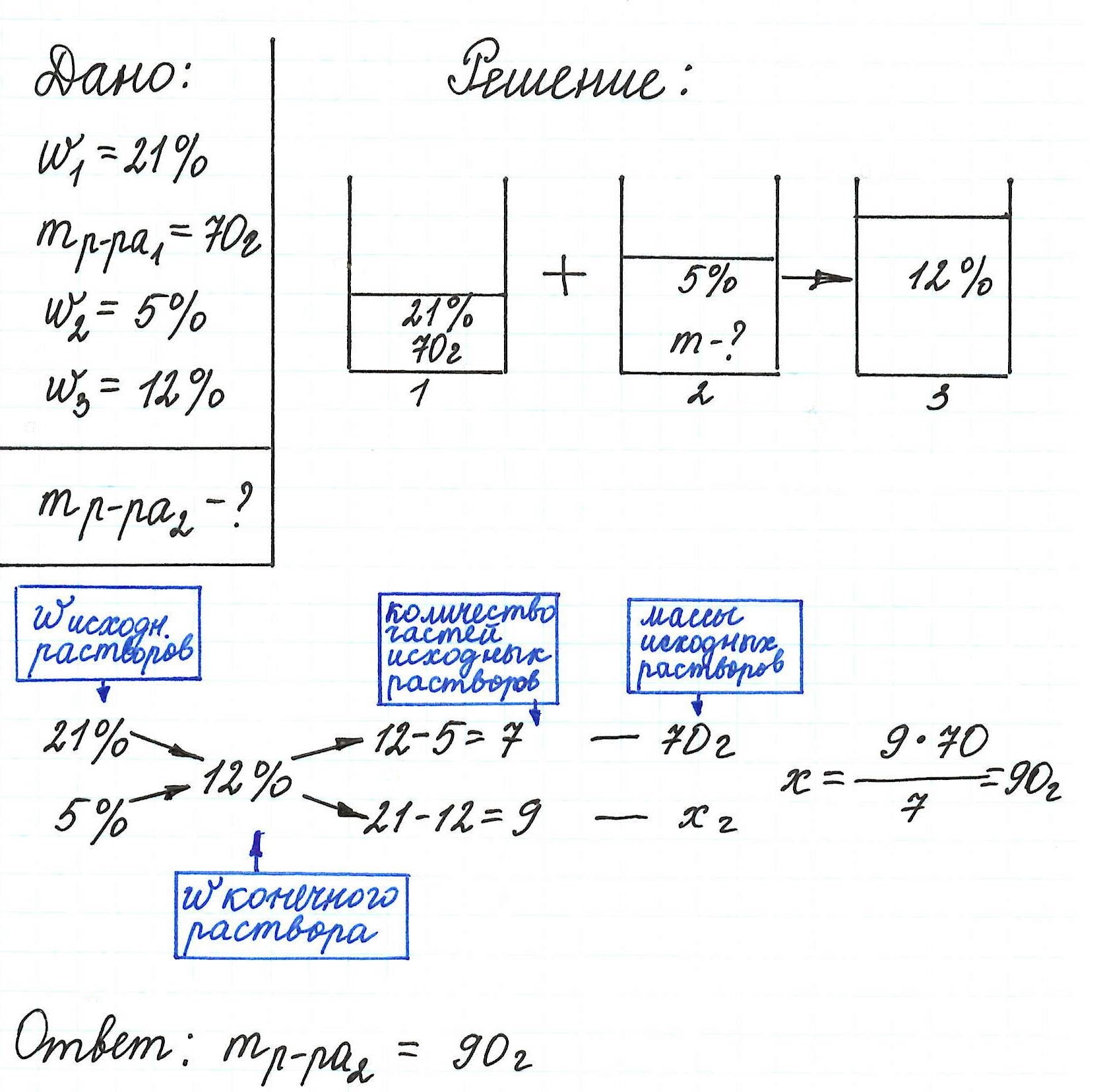
Еще примеры с применением правила «креста» можно посмотреть здесь.
Мы рассмотрели достаточно примеров расчетов, где используется формула такой концентрации раствора как массовая доля растворенного вещества. Как видим, ситуаций, в которых требуется ее применение, множество. Однако, есть достаточно случаев, когда более приемлемыми являются формулы других концентраций (молярной, нормальной, титра и т.д.). Об этом читайте в других статьях.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
или на Одноклассниках
Пожалуйста, оцените публикацию. Большая просьба, если вы оцениваете публикацию от 1 до 3 звезд, обязательно оставьте свой комментарий с указанием того, что не так с этой публикацией. Мы постараемся устранить недостатки.
Ваше мнение для нас важно!
Способы выражения концентрации растворов.
Молярная концентрация См– отношение количества вещества в молях
(n) к объему раствора в
литрах:
Если вещество обозначить через Xто:
Нормальная концентрация или молярная
концентрация эквивалента Сн
– отношение количества эквивалентов
вещества к объему раствора
Молярная и нормальная концентрации
связаны между собой: См
= Сн∙f
или Сн = См
/f
Титр (Т) – часто используется на
практике. Титр раствора –это масса
вещества в граммах в 1 мл раствора (г/мл).
Если Т(HNO3) = 0,006354
г/мл, то это значит, что в 1 мл раствора
содержится 0,006354 г азотной кислоты.
Титр раствора по определяемому
веществу– это масса вещества в г,
взаимодействующая с 1 мл титранта.
Например, ТHCl/NaOHсоставляет 0,003954 г/мл, это означает, что
1 мл раствораHCl(титранта)
реагирует с 0,003954 гNaOH(определяемого вещества).
Массовая доля вещества (ω)––
отношение массы растворенного вещества
(mв-ва) к массе
раствора(mр-ра).
Массовая доля – величина безразмерная,
ее представляют либо в долях, либо в
процентах. Например, для 5%-го раствора
хлорида кальция, широко применяемого
в медицине, ω%(CaCl2)
=5% или в долях ω=0,05. И это означает, что
в 100 г раствора содержится 5 г хлорида
кальция.
ω
где ρ – плотность раствора.
Моляльная концентрация Cm– отношение количества молей растворенного
вещества к 1000 г растворителя, т.е. число
молей растворенного в-ва в 1000 г
растворителя.
Формулы для перерасчета концентраций.
(плотность (ρ) раствора дана в г/мл)
|
ω,% |
См, |
Сн, |
Т, г/мл |
|
|
ω,% |
|
|
|
|
|
См, |
|
|
|
|
|
Сн, |
|
|
|
|
|
Т, г/мл |
|
|
|
|
Приготовление рабочих растворов
Растворы
титр, которых известен, называются
титрованными. Титрованный раствор можно
приготовить, если точную навеску
растворить в мерной колбе. Например,
навеску 0,2750 г Nа2SО4поместим в колбу на 200 мл и доведем объем
дистиллированной водой до метки, то
титр приготовленного раствора точно,
конечно, известен:
Т= 0,2750/200 =0,0013750 г/мл
Вещества,
из которых готовят растворы с известным
титром, называются исходными (стандартными
веществами). Исходные вещества должны
удовлетворять следующим требованиям:
а) они
должны быть химически чистыми (примеси
не более 0,05-0,1 %);
б) состав
должен строго соответствовать химической
формуле;
в)
устойчивы при хранении в растворе и в
твердом состоянии;
г)
величина эквивалента должна быть
наибольшей.
Раствор,
приготовленный таким образом, называется
стандартными раствором с приготовленным
титром. Способ приготовления титрованных
растворов зависит от свойств вещества
и агрегатного состояния
1. Из
веществ кристаллических х.ч. готовят
по точной навеске.
Например:
приготовить 250 мл 0,1н раствораNa2CO3,
М(Na2CO3)
= 106 г/моль. Эквивалентная масса Э(Na2CO3)
= 53 г/моль,
Необходимо:
а)
рассчитать навеску, необходимую для
приготовления раствора:
m
= CH∙
M(1/z Na2CO3)∙V(л)
= 0,1∙53∙0,25 = 1,325 (г)
б)
отвесить навеску на аналитических
весах,
в)
навеску количественно перенести в
мерную колбу на 250 мл, растворить в
небольшом количестве дистиллированной
воды и долить ею до метки, тщательно
перемешивая.
2.
Приготовление из фиксанала.Готовят
раствор, сразу разбивая фиксанал в
мерную колбу нужного объема, и вымывают
из фиксанала все кристаллы дистиллированной
водой и доводят раствор до метки.
3. Из
кристаллических веществ, загрязненных,
гигроскопичных, летучих и т.д.
Необходимо
для приготовления;
а)
рассчитать навеску,
б)
отвесить ее на технических весах,
перенести в любую склянку на 250 мл,
растворить в дистиллированной воде и
долить до метки,
в)
установить точную концентрацию
приготовленного раствора по исходному
веществу (титрованному раствору).
Растворы, титр которых находят не по
точной навеске, а путем титрования
титрованным раствором, называют растворы
с установленным титром.
Примеры:
1.
Приготовить400мл 0,05 н раствора буры
из кристаллической.
Решение:
Определить
массу навески буры, она равна:
m=
Э(Nа2В4О7∙10Н2О)∙Сн∙V(л)=190,71∙0,05∙0,4=3,81
г.
Отвешиваем
на аналитических весах навеску, переносим
в мерную колбу, тщательно растворяем и
доводим до метки 400 мл.
2.Приготовить
100 мл0,15 н раствора из 3н раствора её.
Вопросы
к задаче: а) в каких объемах реагируют
растворы с одинаковой концентрацией?
б) какая зависимость между объемами
реагирующих веществ и нормальными
концентрациями?
Данную
задачу можно решить по формуле: Сн1∙V1= Сн2∙V2;
Сн1
и Сн2 — концентрации растворов
моль/л;V1иV2
– объемы исходного и конечного
раствора в мл,
V1= Сн2∙V2/ Сн1= 0,15 100 / 3 = 5 мл
Значит,
для приготовления 100 мл 0,15 н раствора
нужно взять 5 мл 3н раствора и довести
до метки 100 мл дистиллированной водой.
3.Приготовить
100г 14% раствора,хлорида натрия из 22%-
го и 10%-го растворов этой соли.
Весовое
соотношение исходных растворов находим
по правилу смешения (правило креста):
1
8 весовых частей
1
2
4 весовые части
Из
большего числа вычитаем меньшее: 22-14= 8
в.ч. 10%-го
14-10 = 4
в.ч. 22%-го
Получим
12 г 14% -го раствора
Дальше
рассуждаем:
на 12 г
14%-го раствора нужно 8 г 10%-ного
на 100 г
Х

на 12 г
14%-го раствора нужно 4 г 22%-ного
н
100 г Х
Х = 33,3 г
Измеряем ареометром плотность исходных
растворов. Разделив массы растворов на
плотность, получим объемы исходных
растворов, необходимых для приготовления
нужного раствора. Отмериваем их и
переливаем в склянку для использования
в работе.
Определить
титр раствора хлорида натрия, если
известно, что на титрование его 10 мл
расходовалось 9,2 мл 0,1 н раствора нитрата
серебра. Титр можно определить:
по
закону эквивалентов: (Cн∙V)NaCl= (Cн∙V)AgNO3
Cн
(NaCl) = (9,2∙0,1)/10 = 0,092 моль/л,
Т = (58,5∙0,092)/1000 = 0,005382 г/мл
58,5 –
это эквивалентная масса хлорида натрия.
ФИКСИРОВАНИЕ ТОЧКИ ЭКВИВАЛЕНТНОСТИ
Установление состояния эквивалентности
является очень важным моментом в
проведении анализа. Несоответствие
момента прекращения титрования (точки
эквивалентности) приводит к возникновению
индикаторных ошибок титрования, к
неправильным ответам, что чревато
последствиями. В принципе, индикаторная
ошибка неизбежна при любом определении,
но при правильном определении точки
конца реакции столь мала, что ею можно
пренебречь. Точку эквивалентности можно
определить химическими методами
(применение индикаторов) и физико-химическими
методами (потенциометрическими,
кондуктометрическими, фотоколометрическими).
В
некоторых случаях изменения в системе
титрования столь заметны, что не требуется
каких то заметных особых приемов для
обнаружения конца реакции. Проблема
выбора способа фиксирования точки
эквивалентности всегда решается
применительно к конкретной практике
(методике исследования). Чаще всего
используют индикаторы. Полученные
результаты должны быть достоверны, т.е.
должны быть подвергнуты статистической
обработке. Методику статобработки см.
в данном методическом руководстве.
Метод нейтрализации
и его применение в медико-санитарной
практике
Медико биологическое значение.
Метод кислотно-основного титрования
позволяет определять количественно в
исследуемых объектах кислые и основные
продукты.
Так, в санитарно-гигиенической практике
этим методом определяют кислотность и
щелочность многих пищевых продуктов,
питьевых и сточных вод.
В клинической практике кислотно-основное
титрование используют для определения
кислотности желудочного сока, буферной
емкости крови, спинно-мозговой жидкости,
мочи и других биологических жидкостей.
Этот метод широко используется в
фармацевтической химии при анализе
лекарственных веществ, установления
доброкачественных продуктов питания
(например,молока).
Большое значение имеет рассматриваемый
метод и при санитарно гигиенической
оценке объектов окружающей среды.
Промышленные стоки могут содержать или
кислые, или щелочные продукты. Закисление
или защелачивание природных водоемов
и почвы приводит порой к необратимым
последствиям, в связи с чем контроль
кислотно-основного баланса весьма
важен.
МЕТОД НЕЙТРАЛИЗАЦИИ
Краткое описание метода нейтрализации
сводится к следующим моментам:
а)
Реакция
В основе метода лежит реакция взаимодействия
H++ OH— →
H2O.
б)
Определяемые
вещества:
кислоты:
сильные и слабые
основания:
сильные и слабые: соли, подвергающиеся
гидролизу.
в)
Титранты:
Сильные
кислоты (соляная, серная) с концентрацией
от 0,01 до 1,0 моль/л используются для
определения концентрации оснований и
солей, гидролизующихся по аниону.
Сильные
основания: (NaOH, KOH) с концентрацией от
0,01 до 1,0 моль/л
используются
для определения концентрации кислот и
солей, гидролизующихся по катиону.
Чаще всего
титранты для метода нейтрализации
готовят из фиксаналов. Иногда растворы
сильных кислот готовят разбавлением
концентрированного раствора кислоты,
а растворы сильных оснований, растворением
навески твердой щелочи. Последние
способы приготовления растворов, требуют
экспериментального уточнения концентрации
приготовленного титранта с использованием
установочных (исходных) веществ.
Для
титрантов кислот, в качестве установочных
веществ, используют соду Na2CO3
или буру Na2B4O7•10H2O.
Для
титрантов щелочей — щавелевую кислоту
(H2C2O4•2H2O).
г)
Индикаторы
Реакция
между кислотами и основаниями не
сопровождается, как правило, какими-либо
внешними эффектами, поэтому для
фиксирования точки эквивалентности
приходится использовать специальные
вещества-индикаторы. Кислотно-основные
индикаторы это, слабые кислоты или
основания, степень ионизации которых
определяется концентрацией [H+]
ионов в растворе.
H+Ind
↔
H++Ind—
Чем больше
концентрация H+
ионов, тем меньше будет степень ионизации
индикатора. Молекулярная HInd и ионная
HInd формы индикатора имеют разные окраски.
Таким образом, концентрация ионов H+
влияет
на соотношение концентраций HInd и Ind что,
в свою очередь, определяет характер или
яркость окраски.
Для
характеристики кислотности растворов
в химии широко пользуются водородным
показателем, pH — отрицательный десятичный
логарифм молярной концентрации [H+].
В кислых
растворах pH<7, в щелочных pH>7, в
нейтральных
Все
индикаторы изменяют свою окраску не
скачкообразно, а плавно, т.е. в определенном
интервале значений pH, называемом
интервалом перехода.
Поскольку
индикаторы как кислоты или основания
отличаются друг от друга по силе, они
имеют разные интервалы перехода (см.
табл.1).
Таблица
1
|
N п/п |
Анализ вещество |
pH в точке эквивалент-ности |
Скачок титрования |
Используемые индикаторы |
Интервал перехода окраски индикатора |
|
1. |
Сильная Сильное или наоборот |
7.0 |
3-11 |
Метилоранж Метилрот Фенолфталеин |
3.1-4.4 4.2-6.3 8.3-10.0 |
|
2. |
Слабая Сильное основание |
8-10 |
6-11 |
Фенолфталеин |
8.3-10.0 |
|
3. |
Слабое Сильная кислота |
4-6 |
3-7 |
Метилоранж Метилрот |
3.1-4.4 4.2-6.3 |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Задачи на растворы, смеси и сплавы относятся к традиционным арифметическим и алгебраическим задачам, решение которых нередко вызывает трудности. Для решения таких задач нужно уметь рассуждать и уметь решать задачи на проценты и дроби, на составление уравнений и систем уравнений.
Давайте, сначала, определим, что это за задачи на смеси и сплавы. Довольно часто приходится смешивать различные жидкости, порошки, разбавлять что-либо водой или наблюдать испарение воды. В задачах такого типа эти операции приходится проводить мысленно и выполнять расчёты, а для этого надо четко понимать, что:
— масса раствора = масса воды + масса соли;
— масса сплава равна сумме масс металлов, входящих в этот сплав;
— масса смеси равна сумме масс компонентов этой смеси.
При решении задач на смеси, растворы и сплавы, мы используем их общее свойство, которое заключается в том, что масса смеси, раствора или сплава равна сумме масс их компонентов.
Введем понятие концентрации или процентного содержания вещества в растворе (смеси, сплаве).
Концентрация соли или процентное содержание соли в растворе — это отношение массы соли к массе раствора, записанное в виде процентов:
K=(mc/M)*100%,
где mс — масса соли, M – масса всего раствора, К – концентрация (процентное содержание) соли.
Концентрация вещества или процентное содержание вещества в смеси — это отношение массы вещества к массе смеси, записанное в виде процентов: K=(mв/M)*100%, где mв — масса вещества, M – масса всей смеси, К – концентрация (процентное содержание) вещества
Концентрация вещества или процентное содержание вещества в сплаве — это отношение массы вещества к массе сплава, записанное в виде процентов : K=(mв/M)*100%, где mв — масса вещества, M – масса всего сплава, К – концентрация (процентное содержание) вещества.
Пример раствора. Возьмем 180 грамм воды и добавим в воду 20 грамм соли. Получим раствор, его масса равна 180 + 20 = 200 грамм. Определим концентрацию соли (процентное содержание соли) в растворе: К= (20/(180+20))*100%=10% . Тогда процентное содержание воды 90%. (100%-10%=90%). Процентное содержание воды можно определить и так: Кв=(180/(180+20))*100%=90%. Результаты запишем в виде таблицы.
| соль | 20гр | 10% |
| вода | 180гр | 90% |
| раствор | 200гр | 100% |
Пример смеси. Возьмем и перемешаем одно ведро цемента с тремя ведрами песка. Получим смесь цемента с песком, её масса равна 1 + 3 = 4 (единиц массы). Определим концентрацию (процентное содержание) цемента в смеси : К=(1/(1+3))*100%=25%.. Концентрация (процентное содержание) песка в смеси 100%-25%=75%.
Результаты запишем в виде таблицы.
| цемент | 1 ведро | 25% |
| песок | 3ведра | 75% |
| смесь | 4 ведра | 100% |
Пример сплава. Сплав цинка и меди массой 600 гр. содержит 270 гр.меди. Определим концентрацию (процентное содержание) меди в сплаве:
Км= (270/600)*100%= 45%.
Концентрация (процентное содержание) цинка в смеси:
100%-45%=55%. Или Кц=((600-270)/600))*100%= 55%.
Результаты запишем в виде таблицы.
| цинк | 330 | 55% |
| медь | 270 | 45% |
| сплав | 600гр | 100% |
Масса вещества в растворе, смеси, сплаве.
Из формулы K=(m/M)*100%, где m масса вещества, М — масса всего раствора ( смеси, сплава), получим, что масса вещества в растворе находится по формуле: m=(M*K)/100%.
Например: а) Имеется 200 гр 40% раствора соли. Определите массу соли.
Решение : mc = (200*40%)/100 = 80г. Ответ: 80 г
б) Сплав меди и цинка массой 900г содержит 64% меди. Определите массу цинка в сплаве.
Решение: 1 способ. 100% — 64% = 36% цинка в смеси,
mц=(900*36%)/100%=324г.
2 способ. mм= (900*64%)/100%=576г, 900 – 576 = 324 г.
Ответ: 324г.
.
Последнее изменение: Четверг, 24 июля 2014, 21:53
В ПОМОЩЬ МОЛОДОМУ
УЧИТЕЛЮ
Методика решения задач
на растворы с применением
правила креста
Многие важные вопросы изучения курса химии по
ряду причин исключены из школьной программы.
Среди них закон эквивалентов, разные способы
выражения концентрации растворов, правило
креста и многие другие. Однако на факультативных
занятиях, при подготовке ребят к олимпиадам без
них не обойтись. Да и в жизни ребятам они
пригодятся, особенно тем, кто свяжет будущую
профессию с химией (заводские лаборатории,
аптеки, научно-исследовательская работа, да и
просто химия в быту).
Особенно трудно в этом отношении молодым
учителям – у них нет той массы дополнительной
литературы, которую накопили старые учителя за
десятки лет работы в школе, а что издает
современная книгопечатная отрасль
промышленности – известно всем. Поэтому
предлагаемая методика решения задач на растворы
с применением правила креста, думается, хоть
сколько-то поможет молодым коллегам в этом деле.
«Конверт Пирсона»
Очень часто в лабораторной практике и при
решении олимпиадных задач приходится
встречаться со случаями приготовления растворов
с определенной массовой долей растворенного
вещества, смешением двух растворов разной
концентрации или разбавлением крепкого раствора
водой. В некоторых случаях можно провести
достаточно сложный арифметический расчет.
Однако это малопродуктивно. Чаще для этого лучше
применить правило смешения (диагональную модель
«конверта Пирсона», или, что то же самое, правило
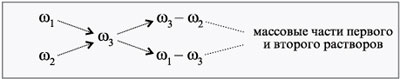
креста).
Допустим, нужно приготовить раствор
определенной концентрации, имея в распоряжении
два раствора с более высокой и менее высокой
концентрацией, чем нужно нам. Тогда, если
обозначить массу первого раствора через m1,
а второго – через m2, то при смешивании
общая масса смеси будет слагаться из суммы этих
масс. Пусть массовая доля растворенного вещества
в первом растворе – 1, во втором –
2, а в их смеси –
3. Тогда общая масса
растворенного вещества в смеси будет слагаться
из масс растворенного вещества в исходных
растворах:
m1•1 + m2•
2 =
3(m1 + m2).
Отсюда
m1(1 –
3) = m2(
3 –
2),
m1/m2 = (3 –
2)/(
1 –
3).
Видно, что отношение массы первого раствора к
массе второго раствора есть отношение разности
массовых долей растворенного вещества в смеси и
во втором растворе к разности соответствующих
величин в первом растворе и в смеси.
При решении задач на растворы с разными
концентрациями чаще всего применяют
диагональную схему правила смешении. При
расчетах записывают одну над другой массовые
доли растворенного вещества в исходных
растворах, справа между ними – его массовую долю
в растворе, который нужно приготовить, и вычитают
по диагонали из большего меньшее значение.
Разности их вычитаний показывают массовые доли
для первого и второго растворов, необходимые для
приготовления нужного раствора.
Для пояснения этого правила сначала решим
простейшую задачу.
ЗАДАЧА 1
Определите концентрацию раствора,
полученного при слиянии 150 г 30%-го и 250 г 10%-го
растворов какой-либо соли.
Дано:
m1 = 150 г,
m2 = 250 г,
1 = 30%,
2 = 10%.
Найти:
3.
Решение
1-й способ (метод
пропорций).
Общая масса раствора:
m3 = m1 + m2 = 150
+ 250 = 400 г.
Массу вещества в первом растворе находим
методом пропорций, исходя из определения:
процентная концентрация раствора показывает,
сколько граммов растворенного вещества
находится в 100 г раствора:
100 г 30%-го р-ра – 30 г в-ва,
150 г 30%-го р-ра – х г в-ва,
х = 150•30/100 = 45 г.
Для второго раствора составляем аналогичную
пропорцию:
100 г 10%-го р-ра – 10 г в-ва,
250 г 10%-го р-ра – y г в-ва,
y = 250•10/100 = 25 г.
Следовательно, 400 г нового раствора содержит 45 +
25 = 70 г растворенного вещества.
Теперь можно определить концентрацию нового
раствора:
400 г р-ра – 70 г в-ва,
100 г р-ра – z г в-ва,
z = 100•70/400 = 17,5 г, или 17,5%.
2-й способ
(алгебраический).
m1•1 + m2•
2 =
3(m1 + m2).
Отсюда
3
= (m1•1
+ m2•2)/(m1
+ m2).
В результате находим:
3 =
(150•30 + 250•10)/(150 + 250) = 17,5%.
3-й способ (правило
креста).
(3
– 10)/(30 – 3) =
150/250.
Тогда
(30 – 3)•150
= (3 – 10)•250,
4500 – 1503
= 2503 – 2500,
4500 – 2500 = 2503 – 150
3,
7000 = 4003,
3 = 7000/400 = 17,5%.
Ответ. При слиянии взятых
растворов получится новый раствор с
концентрацией 3
= 17,5%.
Теперь решим задачи посложнее.
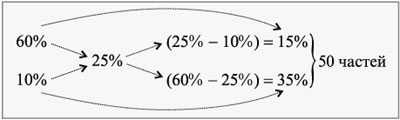
ЗАДАЧА 2
Определите, сколько нужно взять 10%-го раствора
соли и 30%-го раствора этой же соли для
приготовления 500 г 20%-го раствора.
Дано:
1 = 10%,
2 = 30%,
3 = 20%,
m3 = 500 г.
Найти:
m1, m2.
Решение
Используем правило креста.
Для приготовления 500 г 20%-го раствора соли нужно
взять по 10 частей растворов исходных
концентраций.
Проверим правильность нашего решения, учитывая,
что 1 часть равна 500/(10 + 10) = 25 г.
250 г 10%-го р-ра – х г соли,
100 г 10%-го р-ра – 10 г соли,
х = 250•10/100 = 25 г.
250 г 30%-го р-ра – y г соли,
100 г 30%-го р-ра – 30 г соли,
y = 250•30/100 = 75 г.
m(р-ра) = 250 + 250 = 500 г.
m(соли) = 25 + 75 = 100 г.
Отсюда находим 3:
500 г р-ра – 100 г соли,
100 г р-ра – 3 г соли,
3 =
100•100/500 = 20 г, или 20%.
Ответ. Для приготовления 500 г 20%-го
раствора нужно взять исходные растворы по 250 г
(m1 = 250 г, m2 = 250 г).
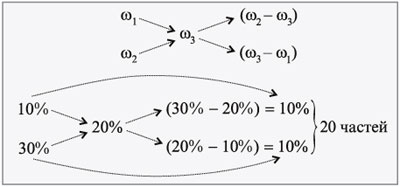
ЗАДАЧА 3
Определите, сколько нужно взять растворов
соли 60%-й и 10%-й концентраций для приготовления 300
г раствора 25%-й концентрации.
Дано:
1 = 60%,
2 = 10%,
3 = 25%,
3 = 300 г.
Найти:
m1, m2.
Решение
Масса одной части: 300/50 = 6 г.
Тогда
m1 = 6•15 = 90 г, m2 = 6•35 =
210 г.
Проверим правильность решения.
100 г 60%-го р-ра – 60 г соли,
90 г 60%-го р-ра – х г соли,
х = 54 г.
100 г 10%-го р-ра – 10 г соли,
210 г 30%-го р-ра – y г соли,
y = 21 г.
m(соли) = 54 + 21 = 75 г.
Находим концентрацию нового раствора:
300 г р-ра – 75 г соли,
100 г р-ра – z г соли,
z = 100•75/300 = 25 г, или 25%.
Ответ. m1 = 90 г, m2
= 210 г.
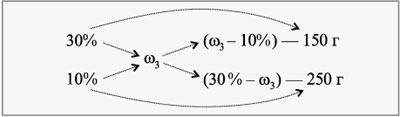
Теперь перейдем к еще более сложным задачам.
ЗАДАЧА 4
Определите массу раствора Nа2СО3
10%-й концентрации и массу сухого
кристаллогидрата Na2CO3•10H2O,
которые нужно взять для приготовления 540 г
раствора 15%-й концентрации.
Дано:
1 = 10%,
3 = 15%,
m3 = 540 г.
Найти:
m1, m2.
Решение
1-й способ (через систему
уравнений с двумя неизвестными).
Определяем массу соли Na2CO3 в 540 г
15%-го раствора:
100 г 15%-го р-ра – 15 г соли,
540 г 15%-го р-ра – z г соли,
z = 540•15/100 = 81 г.
Cоставляем систему уравнений:
Находим молярную массу:
Избавляемся от лишних неизвестных:
m2 = 286y/106;
100 г 10%-го р-ра – 10 г соли,
m1 г 10%-го р-ра – х г соли,
m1 = 100х/10 = 10х.
Подставляем m2 и m1 в систему
уравнений:
С учетом того, что х = 81 – y, избавляемся
от второго неизвестного:
10(81 – y) + 286y/106 = 540.
Отсюда
y = 270/7,3 = 37 г.
Тогда m2 = 286y/106 = 2,7•37 100 г – это масса необходимого
количества кристаллогидрата Na2СО3•10H2O.
Далее находим: х = 81 – y = 81 – 37 = 44 г – это
масса соли из 10%-го раствора.
Находим массу 10%-го раствора:
100 г 10%-го р-ра – 10 г соли,
m1 г 10%-го р-ра – 44 г соли,
m1 = 100•44/10 = 440 г.
Видно, что так можно решить данную задачу –
способ надежный, но, к сожалению, достаточно
длинный, громоздкий и сложный. Им успешно могут
воспользоваться учащиеся с достаточно развитым
логическим мышлением. Для других он будет
сложноват.
2-й способ (правило
креста).
Допустим, что Na2СО3•10H2O – это
«сухой раствор» (ведь он же содержит воду). Тогда
найдем его «концентрацию»:
286 г – 106 г соли,
100 г – х г соли,
х = 100•106/286 = 37 г, или 37%.
Применяем правило креста.
Находим массу одной части и массы веществ:
540/27 = 20 г,
m1 = 20•22 = 440 г, m2 = 20•5 =
100 г.
Ответ. Для приготовления 540 г
раствора Na2CO3 15%-й концентрации
необходимо взять 440 г 10%-го раствора и 100 г
кристаллогидрата.
Таким образом, применение правила креста удобнее
и проще при решении подобных задач. Этот способ
более экономичен по времени и менее трудоемок.
Правило креста можно применять и в тех случаях,
когда нужно получить раствор меньшей
концентрации путем разбавления водой более
концентрированного раствора или получить более
концентрированный раствор путем добавления к
исходному раствору сухой смеси. Рассмотрим это
на примерах.
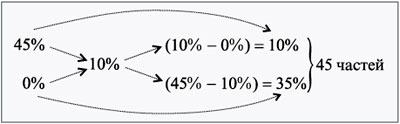
ЗАДАЧА 5
Сколько воды нужно добавить к 250 г раствора
соли для понижения его концентрации с 45% до 10%?
Дано:
1 = 45%,
3 = 10%,
m1 = 250 г.
Найти:
m2.
Решение
Принимаем, что концентрация для добавляемой
воды – 2 = 0%.
Используем правило креста.
Определяем массу одной части через первый
раствор: 250/10 = 25 г.
Тогда масса необходимой воды равна:
m2 = 25•35 = 875 г.
Проверим правильность решения.
Масса нового раствора:
m3 = 250 + 875 = 1125 г.
Масса соли в исходном растворе:
250 г 45%-го р-ра – х г соли,
100 г 45%-го р-ра – 45 г соли,
х = 250•45/100 = 112,5 г.
Находим 3:
1125 г р-ра – 112,5 г соли,
100 г р-ра – y г соли,
y = 100•112,5/1125 = 10 г, или 10%.
Ответ. m2 = 875 г.
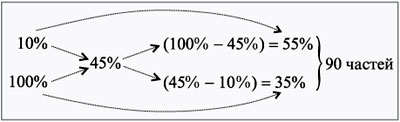
ЗАДАЧА 6
Сколько сухой соли нужно добавить к 250 г
раствора 10%-й концентрации для ее увеличения до
45%?
Дано:
1 = 10%,
m1 = 250 г,
3 = 45%.
Найти:
m(с. с.).
Решение
Принимаем, что сухая соль – это раствор с 2 = 100%.
Используем правило креста.
Определяем массу одной части через первый
раствор: 250/55 = 4,5 г.
Определяем массу сухой соли:
m(с. с.) = 4,5•35 = 158 г.
Проверяем правильность решения.
Масса нового раствора:
m3 = 250 + 158 = 408 г.
Масса соли в исходном растворе:
100 г 10%-го р-ра – 10 г соли,
250 г 10%-го р-ра – х г соли,
х = 250•10/100 = 25 г.
Общая масса соли в новом растворе:
25 + 158 = 183 г.
Концентрация нового раствора:
408 г р-ра – 183 г соли,
100 г р-ра – y г соли,
y = 100•183/408 = 45 г, или 45%.
Ответ. m(с. с.) = 158 г.
Думается, что опытный учитель всегда найдет
несколько способов решения любой задачи. Но как
учила меня моя первая учительница по химии
Клавдия Макаровна в школе № 17 г. Иркутска, так и я
стараюсь учить своих учеников: всегда глубоко
продумывать и понимать химическую сущность
задачи и находить наиболее рациональный способ
ее решения, а не просто подгонять под ответ в
конце учебника.