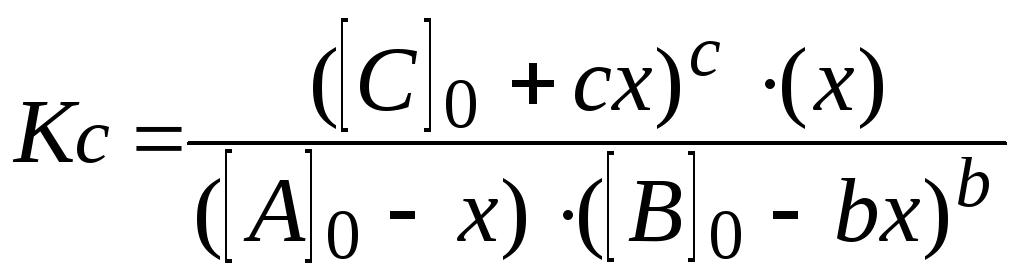Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Понятие химического равновесия
Признаки химического равновесия
Принцип Ле Шателье
Влияние температуры на химическое равновесие
Влияние давления на химическое равновесие
Влияние концентрации на химическое равновесие
Константа химического равновесия
Примеры решения задач
Задачи для самостоятельного решения
Понятие химического равновесия
Равновесным считается состояние системы, которое остается неизменным, причем это состояние не обусловлено действием каких-либо внешних сил. Состояние системы реагирующих веществ, при котором скорость прямой реакции становится равной скорости обратной реакции, называется химическим равновесием. Такое равновесие называется еще подвижным или динамическим равновесием.
Признаки химического равновесия
- Состояние системы остается неизменным во времени при сохранении внешних условий.
- Равновесие является динамическим, то есть обусловлено протеканием прямой и обратной реакции с одинаковыми скоростями.
- Любое внешнее воздействие вызывает изменение в равновесии системы; если внешнее воздействие снимается, то система снова возвращается в исходное состояние.
- К состоянию равновесия можно подойти с двух сторон – как со стороны исходных веществ, так и со стороны продуктов реакции.
- В состоянии равновесия энергия Гиббса достигает своего минимального значения.
Принцип Ле Шателье
Влияние изменения внешних условий на положение равновесия определяется принципом Ле Шателье (принципом подвижного равновесия):
Если на систему, находящуюся в состоянии равновесия, производить какое–либо внешнее воздействие, то в системе усилится то из направлений процесса, которое ослабляет эффект этого воздействия, и положение равновесия сместится в том же направлении.
Принцип Ле Шателье применим не только к химическим процессам, но и к физическим, таким как кипение, кристаллизация, растворение и т. д.
Рассмотрим влияние различных факторов на химическое равновесие на примере реакции окисления NO:
2NO(г) + O2(г) → 2NO2(г); ΔHо298 = — 113,4 кДж/моль.
Влияние температуры на химическое равновесие
При повышении температуры равновесие сдвигается в сторону эндотермической реакции, при понижении температуры – в сторону экзотермической реакции.
Степень смещения равновесия определяется абсолютной величиной теплового эффекта: чем больше по абсолютной величине энтальпия реакции ΔH, тем значительнее влияние температуры на состояние равновесия.
В рассматриваемой реакции синтеза оксида азота (IV) повышение температуры сместит равновесие в сторону исходных веществ.
Влияние давления на химическое равновесие
Сжатие смещает равновесие в направлении процесса, который сопровождается уменьшением объема газообразных веществ, а понижение давления сдвигает равновесие в противоположную сторону.
В рассматриваемом примере в левой части уравнения находится три объема, а в правой – два. Так как увеличение давления благоприятствует процессу, протекающему с уменьшением объема, то при повышении давления равновесие сместится вправо, т.е. в сторону продукта реакции – NO2. Уменьшение давления сместит равновесие в обратную сторону. Следует обратить внимание на то, что, если в уравнении обратимой реакции число молекул газообразных веществ в правой и левой частях равны, то изменение давления не оказывает влияния на положение равновесия.
Влияние концентрации на химическое равновесие
Для рассматриваемой реакции введение в равновесную систему дополнительных количеств NO или O2 вызывает смещение равновесия в том направлении, при котором концентрация этих веществ уменьшается, следовательно, происходит сдвиг равновесия в сторону образования NO2. Увеличение концентрации NO2 смещает равновесие в сторону исходных веществ.
Катализатор одинаково ускоряет как прямую, так и обратную реакции и поэтому не влияет на смещение химического равновесия.
При введении в равновесную систему (при Р = const) инертного газа концентрации реагентов (парциальные давления) уменьшаются. Поскольку рассматриваемый процесс окисления NO идет с уменьшением объема, то при добавлении инертного газа равновесие сместится в сторону исходных веществ.
Константа химического равновесия
Для химической реакции:
2NO(г) + O2(г) → 2NO2(г)
константа химической реакции Кс есть отношение:
Кс = [NO2]2/([NO]2 · [O2]) (1)
В этом уравнении в квадратных скобках – концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, т.е. равновесные концентрации веществ.
Константа химического равновесия связана с изменением энергии Гиббса уравнением:
ΔGTо = – RTlnK (2)
Примеры решения задач
Задача 1. При некоторой температуре равновесные концентрации в системе 2CO (г) + O2 (г)→2CO2 (г) составляли: [CO] = 0,2 моль/л, [O2] = 0,32 моль/л, [CO2] = 0,16 моль/л. Определите константу равновесия при этой температуре и исходные концентрации CO и O2, если исходная смесь не содержала СО2.
Решение.
2CO(г) + O2(г) →2CO2(г)
|
Вещество |
CO | O2 | CO2 |
| Сисходн, моль/л | 0,36 | 0,40 | 0 |
| Спрореагир,моль/л | 0,16 | 0,08 | 0,16 |
| Сравн, моль/л | 0,2 | 0,32 | 0,16 |
Во второй строке под Спрореагир понимается концентрация прореагировавших исходных веществ и концентрация образующегося CO2, причем, Сисходн= Спрореагир + Сравн.
Задача 2. Используя справочные данные, рассчитайте константу равновесия процесса
3 H2 (г) + N2 (г) →2 NH3 (г) при 298 К.
Решение.
ΔG298о = 2·(- 16,71) кДж = -33,42·103 Дж.
ΔGTо = — RTlnK.
lnK = 33,42·103/(8,314× 298) = 13,489. K = 7,21× 105.
Задача 3. Определите равновесную концентрацию HI в системе
H2(г) + I2(г) →2HI(г),
если при некоторой температуре константа равновесия равна 4, а исходные концентрации H2 , I2 и HI равны, соответственно, 1, 2 и 0 моль/л.
Решение. Пусть к некоторому моменту времени прореагировало x моль/л H2.
| Вещество | H2 | I2 | HI |
| сисходн., моль/л | 1 | 2 | 0 |
| спрореагир., моль/л | x | x | 2x |
| cравн., моль/л | 1-x | 2-x | 2x |
Тогда, К = (2х)2/((1-х)(2-х))
Решая это уравнение, получаем x = 0,67.
Значит, равновесная концентрация HI равна 2× 0,67 = 1,34 моль/л.
Задача 4. Используя справочные данные, определите температуру, при которой константа равновесия процесса: H2(г) + HCOH(г) →CH3OH(г) становится равной 1. Принять, что ΔНоТ » ΔНо298, а ΔSоT » ΔSо298.
Решение.
Если К = 1, то ΔGоT = — RTlnK = 0;
ΔGоT = ΔНо298 — ТΔ Sо298 .
ΔНо298 = -202 – (- 115,9) = -86,1 кДж = — 86,1× 103 Дж;
ΔSо298 = 239,7 – 218,7 – 130,52 = -109,52 Дж/К;
0 = — 86100 — Т·(-109,52)
Т = 786,15К
Задача 5. Для реакции SO2(Г) + Cl2(Г) →SO2Cl2(Г) при некоторой температуре константа равновесия равна 4. Определите равновесную концентрацию SO2Cl2, если исходные концентрации SO2, Cl2 и SO2Cl2 равны 2, 2 и 1 моль/л соответственно.
Решение. Пусть к некоторому моменту времени прореагировало x моль/л SO2.
SO2(г) + Cl2(г) →SO2Cl2(г)
| Вещество | SO2 | Cl2 | SO2Cl2 |
| cисходн., моль/л | 2 | 2 | 1 |
| cпрореагир., моль/л | x | x | х |
| cравн., моль/л | 2-x | 2-x | x + 1 |
Тогда получаем:
(х + 1)/(2 — х)2 = 4
Решая это уравнение, находим: x1 = 3 и x2 = 1,25. Но x1 = 3 не удовлетворяет условию задачи.
Следовательно, [SO2Cl2] = 1,25 + 1 = 2,25 моль/л.
Задачи для самостоятельного решения
1. В какой из приведенных реакций повышение давления сместит равновесие вправо? Ответ обоснуйте.
1) 2 NH3 (г) → 3H2 (г) + N2 (г)
2) ZnCO3 (к) → ZnO(к) + CO2 (г)
3) 2HBr (г) → H2 (г) + Br2 (ж)
4) CO2 (г) + C (графит) →2CO (г)
|
Так как увеличение давления благоприятствует процессу, протекающему с уменьшением количества |
2. При некоторой температуре равновесные концентрации в системе:
2HBr (г) →H2 (г) + Br2 (г)
составляли: [HBr] = 0,3 моль/л, [H2] = 0,6 моль/л, [Br2] = 0,6 моль/л. Определите константу равновесия и исходную концентрацию HBr.
3. Для реакции H2(г) + S(г) →H2S(г) при некоторой температуре константа равновесия равна 2. Определите равновесные концентрации H2 и S, если исходные концентрации H2, S и H2S равны, соответственно, 2, 3 и 0 моль/л.
4. Используя справочные данные, вычислите температуру, при которой константа равновесия процесса
CO2(г) + C(графит) →2CO(г)
становится равной 1. Примите, что ΔНоТ≈ΔНо298, а ΔSоT≈ΔSо298
5. Используя справочные данные, рассчитайте константу равновесия процесса:
С2Н4(г) →С2Н2(г) + Н2(г) при 298 К
6. Для реакции 2С3Н8(г) → н-С5Н12(г)+СН4(г) при температуре 1000 К константа равновесия равна 4. Определите равновесную концентрацию н-пентана, если исходная концентрация пропана равна 5 моль/л.
7. При температуре 500 К константа равновесия процесса:
СО2(г) + 3Н2(г) → СН3ОН(г) + Н2О(г)
равна 3,4·10-5. Вычислите Δ Gо500.
8. При температуре 800 К константа равновесия процесса н-С6Н14(г)+ 2С3Н6(г)+Н2(г) равна 8,71. Определите ΔGоf,800(С3Н6(г)), если ΔGоf,800(н-С6Н14(г)) = 305,77 кДж/моль.
9. Для реакции СО(г) + Cl2(г) →СO2Cl2(г) при некоторой температуре равновесная концентрация СO2Cl2(г) равна 1,2 моль/л. Определите константу равновесия данного процесса, если исходные концентрации СО(г) и Cl2(г) равны соответственно 2,0 и 1,8 моль/л.
10. При некоторой температуре равновесные концентрации в системе 2SО2(г) + О2(г) →2SO3(г) составляли: [SО2 ]=0,10 моль/л, [О2]=0,16 моль/л, [SО3]=0,08 моль/л. Вычислите константу равновесия и исходные концентрации SО2 и О2.
|
К=4,0; исходная концентрация SО2 составляет 0,18 моль/л; |
Зная
величины констант равновесия и используя
стехиометрические соотношения реакции
(закон сохранения массы), рассчитывают
равновесный состав продуктов по
следующей схеме.
-
Пишут
уравнение реакции.
2.
Пишут под формулами уравнения начальные
концентрации исходных веществ (в
моль/л). Если начальные концентрации
продуктов реакции не оговариваются в
условии задачи, они обычно принимаются
равными нулю.
3.
Принимают, что в ходе реакции до состояния
равновесия прореагировало x
моль/л какого-либо вещества. Обычно за
x
принимают изменение концентрации того
реагента, стехиометрический коэффициент
при котором в уравнении реакции
наименьший, чтобы избежать дробных
коэффициентов при неизвестном x.
Например, прореагировало x
моль/л вещества А.
4.
По уравнению реакции определяют изменение
концентраций других веществ.
5.
Определяют равновесные концентрации
веществ. При протекании реакции в прямом
направлении до состояния равновесия
происходит уменьшение концентраций
исходных веществ и увеличение концентраций
продуктов реакции.
А
+ b
В
c
С + D
начальное
состояние
А0
В0
С0
0
число молей
по уравнению
1 b
c
1
изменение
концентраций
x
b
x
c
x
x
равновесное
состояние
А0
—
x
В0
–
bx
С0
+ c
x
x
6.
Пишут выражение закона действующих
масс. Подставляют в него найденные
значения равновесных концентраций.
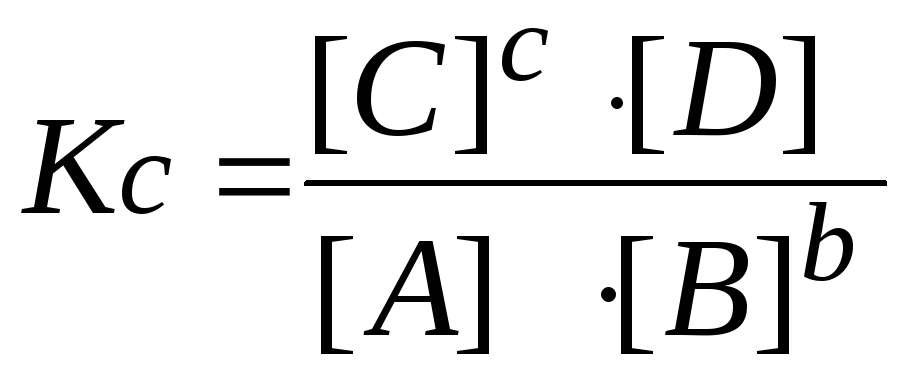
7.
Решают уравнение. При этом учитывают,
что отрицательный корень не имеет
физического смысла, и убыль концентрации
исходного вещества не может быть больше
величины самой концентрации (начальная
концентрация исходного вещества не
может быть меньше его остаточной
равновесной концентрации).
-
Находят
равновесные концентрации.
А
= А0—
x;
B
= B0
—
b
x;
C
= С0
+
cx;
D
=
x.
4. Смещение химического равновесия. Принцип Ле Шателье
Истинное
химическое равновесие является
динамическим и подвижным: изменение
внешних условий (температуры, давления,
концентраций реагирующих веществ) ведет
к смещению равновесия в сторону прямой
или обратной реакции.
Характер
влияния внешних факторов на равновесные
системы выражает принцип Ле Шателье.
Если
на систему, находящуюся в состоянии
равновесия, оказать внешнее воздействие,
то смещение равновесия происходит в
сторону той реакции (прямой или обратной),
которая ослабляет эффект внешнего
воздействия.
4.1. Изменение концентраций
Равновесное
состояние в системе
H2
(г)
+ I2
(г)
2 HI
(г)
характеризуется
(для одной и той же температуры) константой
равновесия:
.
Если,
например, в систему добавить водород,
т.е. увеличить его концентрацию, то
скорость прямой реакции увеличится (в
соответствии с законом действующих
масс):
пр
= kпр
[H2]
[I2],
пр
обр,
равновесие
сместится вправо. Концентрация
йодоводорода будет увеличиваться, а
концентрация водорода и йода будет
уменьшаться. Процесс будет протекать
до тех пор, пока не установится новое
равновесие. Новые равновесные концентрации
всех компонентов будут другими, но
соотношение между ними, определяемое
константой равновесия, останется
постоянным.
Если
в систему ввести дополнительное
количество йодоводорода, то скорость
обратной реакции увеличится:
обр
=
kобр
[HI]
2
,
обр
пр
,
равновесие
сместится влево.
В
соответствии с принципом Ле Шателье:
—
при увеличении концентрации какого-либо
из веществ, участвующих в равновесии,
равновесие смещается в сторону расхода
этого вещества;
—
при уменьшении концентрации какого-либо
из веществ равновесие смещается в
сторону образования этого вещества.
Удаление
из системы продуктов (или продукта)
реакции ведет к смещению равновесия
в сторону прямой реакции, а уменьшение
концентрации
исходных (или исходного) веществ,
приводит к сдвигу равновесия в направлении
обратной реакции.
Соседние файлы в папке Кинетика_лекции
- #
- #
- #
- #
Как определять исходную концентрацию вещества
Вещества, вступающие в химическую реакцию, претерпевают изменения состава и строения, превращаясь в продукты реакции. Концентрация исходных веществ уменьшается вплоть до нуля, если реакция идет до конца. Но может протекать обратная реакция, когда продукты распадаются на исходные вещества. В таком случае устанавливается равновесие, когда скорость прямой и обратной реакции становится одинаковой. Разумеется, равновесные концентрации веществ будут меньше исходных.

Инструкция
Произошла химическая реакция по схеме: А + 2Б = В. Исходные вещества и продукт реакции – газы. В какой-то момент установилось равновесие, то есть, скорость прямой реакции (А + 2Б = В) сравнялась со скоростью обратной (В = А + 2Б). Известно, что равновесная концентрация вещества А равна 0,12 моль/литр, элемента Б – 0,24 моль/литр, а вещества В – 0,432 моль/литр. Требуется определить исходные концентрации А и Б.
Изучите схему химического взаимодействия. Из нее следует, что один моль продукта (элемента В) образовывался из одного моля вещества А и двух молей вещества Б. Если в одном литре реакционного объема образовывалось 0,432 моля элемента В (по условиям задачи), то, соответственно, одновременно расходовалось 0,432 моля вещества А и 0,864 моля элемента Б.
Вам известны равновесные концентрации исходных веществ: [A] = 0,12 моль/литр, [Б] = 0,24 моль/литр. Прибавив к этим величинам те, которые были израсходованы в ходе реакции, вы получите величины исходных концентраций: [A]0 = 0,12 + 0,432 = 0,552 моль/литр; [Б]0 = 0,24 + 0,864 = 1,104 моль/литр.
Также вы можете определить исходные концентрации веществ с помощью константы равновесия (Кр) — отношения произведений равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ. Константа равновесия рассчитывается по формуле: Кр = [C]n [D]m /([A]0x[B]0y), где [C] и [D] – равновесные концентрации продуктов реакции С и D; n, m – их коэффициенты. Соответственно, [A]0, [В]0 – равновесные концентрации элементов, вступающих в реакцию; x,y – их коэффициенты.
Зная точную схему протекающей реакции, равновесную концентрацию хотя бы одного продукта и исходного вещества, а также величину константы равновесия, можно записать условия этой задачи в виде системы двух уравнений с двумя неизвестными.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Куприянчик
Г.Г.
Учитель
химии ГУО «Гимназия № 2 г. Пинска»
Задачи на БИС
(табличный метод: было – израсходовано – стало)
Умение
решать расчётные задачи — это важная составляющая для успешной сдачи ЦТ. И
каждому учащему для того, чтобы научиться быстро и качественно решать задачи,
необходимо их решить немалое количество. Со временем у учащихся появляется
навык решения задач несколькими способами, и чем более простой способ решения
задачи они выберут, тем быстрее решиться задача. Учителю необходимо научить,
показать различные способы решения тех или иных задач. В данной статье я
предлагаю рассмотреть табличный метод решения задач на равновесие. Такого рода
задачи я называю – задачи на БИС (было – израсходовано – стало). Данный метод
не является новым, его используют уже давно многие учителя. Однако в литературе
он не часто встречаем. Сам метод является очень удобным. Я полагаю, он будет
полезен для молодых учителей.
Задача
1. Некоторое количество азота и водорода
смешали в сосуде емкостью 3дм3 и нагрели в присутствии железного
катализатора до установления химического равновесия. Определите исходные
концентрации (моль/дм3) веществ в сосуде,
если известно, что равновесная смесь содержала 1,0 моль азота , 2,4 моль
водорода и 0,7 моль аммиака.
Решение:
1)Записываем уравнение
реакции N2+3H2=2NH3.
Решение очень удобно оформлять в виде таблицы (сначала
вносятся известные данные, затем по ходу решения заполняется таблица): стало —
это равновесные количества веществ или концентрации веществ, израсходовано —
это сколько прореагировало, было – исходные количества или концентрации.
|
N2 |
H2 |
NH3 |
|
|
Было |
1,35 |
3,45 |
— |
|
Израсходовано |
0,35 |
1,05 |
— |
|
Стало |
1,0 |
2,4 |
0,7 |
2)По уравнению реакции
находим химическое количество прореагировавшего азота: n(N2)=0,35
моль (вносим в таблицу).
3)Находим
прореагировавшее химическое количество водорода: n(H2)
= 0,35*3= 1,05 моль (вносим в таблицу).
4)Затем находим nисх(N2)=1,0+0,35=1,35
моль.
5)Находим концентрацию
исходного азота: сисх
(N2)=n/V=1,35/3=0,45моль/дм3
6)Находим сисх(H2)=3,45/3=1,15
моль/дм3 .
Ответ:
сисх
(N2)=0,45моль/дм3,
сисх(H2)=1,15
моль/дм3 .
Задача 2.В
гомогенной системе установилось равновесие:
2SO2+O2
↔ 2SO3
Равновесные химические
количества (моль) SO2,
O2
и SO3
соответственно равны 0,1, 0,2 , 0,6.
Определите исходные
химические количества SO2
и O2.
Решение
1)Записываем уравнение
реакции 2SO2+O2=2SO3.
Вносим известные значения
в таблицу и заполняем по мере решения.
|
SO2 |
O2 |
SO3 |
|
|
Было |
0,7 |
0,5 |
— |
|
Израсходовано |
0,6 |
0,3 |
— |
|
Стало |
0,1 |
0,2 |
0,6 |
2)Если SO3
образовалось n(SO3)=
0,6 моль, то значит, прореагировало n(SO2)=
0,6 моль (по уравнению реакции), а химическое количество прореагировавшего O2
по уравнению будет в 2 раза меньше nпрор(O2)=0,6/2=0,3моль.
3)Находим химическое
количество исходного SO2:
nисх(SO2)=0,1+0,6=0,7(моль),
nисхO2=0,2+0,3=0,5(моль).
Ответ: nисх(SO2)=0,7(моль),
nисхO2=0,5(моль).
Задача
3.В замкнутый сосуд поместили 6 моль H2
и 3 моль O2.
Через некоторое время установилось равновесие 2H2(г)
+ O2(г)
=2H2O
(г) и образовалась вода химическим количеством 1,5 моль. Как изменилось
давление в сосуде к моменту установления равновесия?
Решение
1)Записываем уравнение 2H2(г)
+ O2(г)
=2H2O.
Вносим в таблицу значение
количества воды и по мере решения заполняем эту таблицу.
|
H2 |
O2 |
H2O |
|
|
Было |
6 |
3 |
— |
|
Израсходовано |
1,5 |
0,75 |
— |
|
Стало |
4,5 |
2,25 |
1,5 |
2)Находим химическое
количество прореагировавшего водорода: nпрор(H2)=n(H2O);
nпрор(H2)=1,5
моль.
2)Находим химическое
количество прореагировавшего (израсходовано) кислорода: nпрор
(O2)=1,5/2=0,75
моль
3)Находим равновесные
химические количества (стало) H2
и O2;
nравн(H2)=4,5
моль
nравн(O2)=3-0,75=2,25
моль.
4) Находим исходное
количество водорода и кислорода: nисх
(смеси H2+O2)=9
моль
5)Находим
количество равновесной смеси: n2
(смеси)=4,5+2,25+1,5=8,25(моль)
6)Находим изменение
давление по количествам: ∆р = nисх(смеси)
/ n2
(смеси)= 9/8,25=1,091 (давление уменьшится), так как уменьшилось химическое
количество.
Ответ: уменьшилось
в 1,091 раза.
Задача
4.Равновесные
молярные концентрации СO, O2 и CO2 после
установления равновесия 2CO(г) + O2(г) = 2CO2(г) равны
0,3; 0,2 и 0,1 (моль/дм3) соответственно. Рассчитайте объемную долю кислорода в
исходной газовой смеси (исходная молярная концентрация CO2 равна
нулю).
Решение
1)Записываем
уравнение 2СО(г) + O2(г)
=2СO2(Г)
2)Вносим
в таблицу значение равновесных молярных концентраций веществ.
|
СО |
O2 |
СО2 |
|
|
Было |
0,4 |
0,25 |
— |
|
Израсходовано |
0,1 |
0,05 |
— |
|
Стало |
0,3 |
0,2 |
0,1 |
3)По уравнению находим молярные
концентрации прореагировавших угарного газа СО и кислорода: cпрор(CO)=c(CO2)=0,1моль/дм3,
спрор(О2)==
=0,05 (моль/дм3).
4)Затем находим
исходные молярные концентрации угарного газа и кислорода:
сисх(CO)=
cпрор(CO)
+ cравн
(СО) =0,3+0,1=0,4 (моль/дм3); сисх(О2)=
спрор(О2)+ сравн(О2)=0,2+0,05=0,25 (моль/дм3).
5) Находим мольную
долю кислорода в смеси, которая будет равна объёмной доле: если
предположить, что объём смеси равен 1 дм3, то n(O2)=0,25
моль, n(CO)=0,4
моль, мольная доля равна
ᵡ(О2)
= ᵠ = =
=
0,385.
Ответ: ᵡ (О2)=0,385.
Задача 5.В
гомогенной системе установилось равновесие:
2SO2(г)+O2(г)
↔ 2SO3(г)
Равновесная молярная
концентрация SO3
равна 0,3 моль/дм3.Рассчитай равновесную молярную концентрацию
оксида серы(II), если известно, что к
моменту установления равновесия прореагировало 60 % от начального химического
количества оксида серы(II).
Решение
1)Записываем уравнение реакции2SO2(г)+O2(г)
↔ 2SO3(г).
Вносим известные значения
в таблицу и заполняем по мере решения.
|
SO2 |
SO3 |
|
|
Было |
0,5 |
— |
|
Израсходовано |
0,3 |
— |
|
Стало |
0,2 |
0,3 |
2) Находим по уравнению
молярную концентрацию израсходованного оксида SO2:
c(SO2)=c(SO3)=0,3моль/дм3.
3)Так как SO2
к моменту установления равновесия прореагировало 60 % от начального
химического количества, находим исходную молярную концентрацию SO2:
сисх(SO2)=0,3/0,6=0,5
моль/дм3.
4) Находим равновесную
молярную концентрацию SO2:
сравн(SO2)=сисх—
сизр=0,5-0,3=0,2 моль/дм3.
Ответ: сравн(SO2)=0,2
моль/дм3.
Расчет равновесных концентраций веществ, константы равновесия реакции
Определение равновесных концентраций веществ
Задача 52.
Константа равновесия реакции FeO(тв.) + CO(г) = Fe(тв.) + CO2(г) при некоторой температуре равна 0,5. Найти равновесные концентрации CO и CO2, если начальные концентрации этих веществ составляли: [CO] = 0,05 моль/л, [CO2] = 0,01 моль/л.
Решение:
Уравнение реакции имеет вид:
FeO(тв.) + CO(г) = Fe(тв.) + CO2(г)
К = 0,5.
Начальные концентрации [CO] = 0,05 моль/л; [CO2] = 0,01 моль/л. По мере течения реакции концентрация исходных веществ уменьшается, а концентрация продуктов реакции увеличивается. Изменение концентрации идет в строгом соответствии со стехиометрическими соотношениями, которые берутся из уравнения реакции, примем изменение концентрации [СО] до равновесия равному «х» моль/л тогда в момент равновесия его концентрация станет (0,05 — х), а у СО2 увеличится на х, т.е. будет (0,01 + х). Коэффициенты в уравнении одинаковы n(CO) = n(CO2). Для момента равновесия концентрации взяты равновесны.
Запишем выражение константы равновесия для реакции, получим:
К = [CO2]/[CO];
0,5 = (0,01 + х)/(0,05 — х);
0,01 + х = 0,5(0,05 — х);
0,01 + x = 0,025 — 0,5x;
x + 0,5x = 0,025 — 0,01;
1,5x = 0,015;
x = 0,01.
Таким образом, x = 0,01моль/л. Отсюда в момент равновесия равновесные концентрации будут равны:
[CO2]равн. = 0,01 + 0,01 = 0,02 моль/л;
[CO]равн. = 0,05 — 0,01 = 0,04 моль/л.
Ответ: [CO2]равн. = 0,02 моль/л; [CO]равн. = 0,04 моль/л.
Расчет константы равновесия
Задача 53.
Реакция идет по уравнению: А + 2В = С + D. К моменту равновесия прореагировало 20% вещества В. Чему равна константа равновесия, если исходные концентрации (моль/л) веществ А = 3; В = 4?
Решение:
Согласно условию, прореагировало 20% вещества (В). Это составило 4 * 0,2 = 0,8 моль. Исходя из стехиометрических коэффициентов, расходование 0,8 молей идет на получение по 0,4 молей веществ (С) и (D). Столько же израсходовано вещества (А). Если начальные концентрации веществ (А) и (В) 3 и 4 моль соответственно, то равновесная их концентрация составила:
вещества (А) – 3 — 0,4 = 2,6 моль/л;
вещества (В) – 4 — 0,8 = 3,2 моль/л.
Выражение константы равновесия данной реакции:
К = [С][D]/[А][В]2 = [0,4][0,4]/[2,6][3,2]2 = 0,16/26,624 = 6 . 10-3 моль/л.
Ответ: К = 6 . 10-3 моль/л.