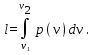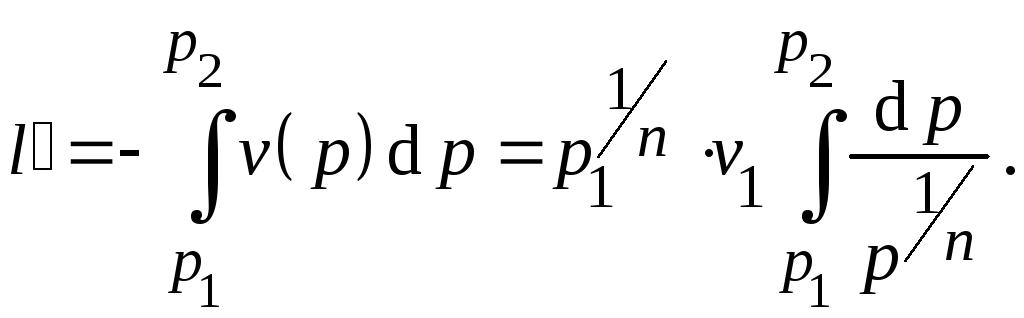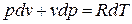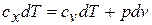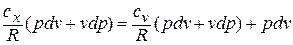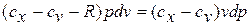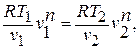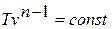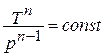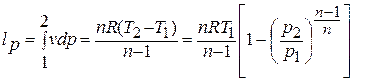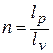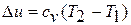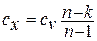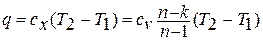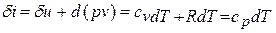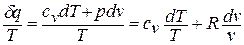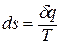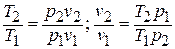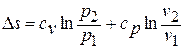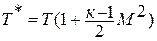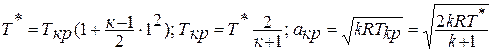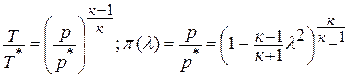Министерство
образования и науки Российской Федерации
ФГАОУ ВПО Уральский
Федеральный Университет
имени первого
Президента России Б.Н. Ельцина
кафедра теоретической
теплотехники
анализ политропного
процесса
смеси идеальных газов
курсовая работа
по
технической термодинамике
Вариант 4
Преподаватель Нейская
Студент Иванова
И.Л.
Группа Т-200901
Екатеринбург
2011
Оглавление
-
Теоретический
анализ обратимого политропного
процесса…………………………………………………………………………3-
Определение
политропного процесса…………………………………….…3 -
Вывод уравнения
политропного процесса в переменных………………….3 -
Способы
определения показателя политропы………………………….…5 -
Вычисление
параметров состояния в начале и в конце
процесса………6 -
Вычисление
теплоемкости и количества теплоты
процесса……….….6 -
Вычисление
работы изменения объема и внешней
работы………….…..6 -
Вычисление
изменения термодинамических
функций……………….…..7
-
-
Расчет политропного
процесса……………………………………10-
Расчет
термодинамических свойств……………………………………..10-
Расчет
газовых постоянных и удельных массовых
теплоемкостей.10 -
Вычисление
массовых долей компонентов
смеси……………………….10 -
Удельные
теплоёмкости смеси…………………………………………….11 -
Газовая
постоянная смеси…………………………………………………..11 -
Показатель
адиабаты смеси……………………………………………….11
-
-
Определение
параметров в начале и в конце
процесса…………………..11 -
Расчет удельных
характеристик процесса………………………………12-
Удельная
работа изменения объема………………………………………12 -
Удельная
внешняя работа……………………………………………..……12 -
Удельное
количество теплоты процесса…………………………..……12 -
Расчёт
изменения термодинамических
функций………………………12 -
Проверка
расчётов по первому закону
термодинамики………………13 -
Изображение
процесса на диаграммах
и
……………….14
-
-
Основные
обозначения……………………………………………………15
Список использованных
источников……………………………..16
1. Теоретический
анализ обратимого
политропного
процесса.
1.1. Определение
политропного процесса
По определению
политропным процессом называется
процесс с постоянной заданной теплоёмкостью
cn
или, что то же, с постоянным заданным
отношением работы процесса к теплоте
процесса на любой стадии его протекания,
т.е.
Анализ процесса
включает
-
вывод
уравнения политропного процесса в
переменных;
-
вычисление
параметров состояния в начале и в конце
процесса; -
вычисление
теплоемкости cn
и количества теплоты процесса q; -
вычисление
работы изменения объема l
и внешней работы процесса l`. -
вычисление
изменения термодинамических функций:
a)
внутренней энергии
,
b)
энтальпии
,
c)
энтропии
.
6) изображение
процесса на диаграммах
и
.
Рабочее тело –
идеальный газ, подчиняющийся уравнению
состояния
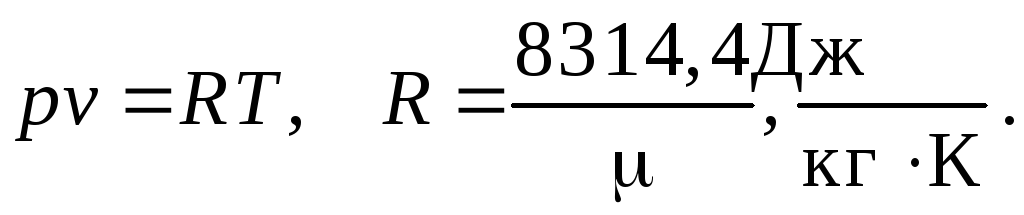
Анализ проводится
для 1 кг рабочего тела при постоянных
теплоёмкостях
,
вычисляемых с помощью молекулярно–кинетической
теории.
1.2. Вывод
уравнения политропного процесса в
переменных
(p,v)
Выражения первого
начала термодинамики можно записать в
двух эквивалентных формах (через
внутреннюю энергию и через энтальпию):
Здесь
(два последние
равенства представляют собой закон
Джоуля: внутренняя энергия и энтальпия
идеального газа не зависят только от
температуры).
Подставив
в уравнения и исключая из них
,
после простых преобразований получим
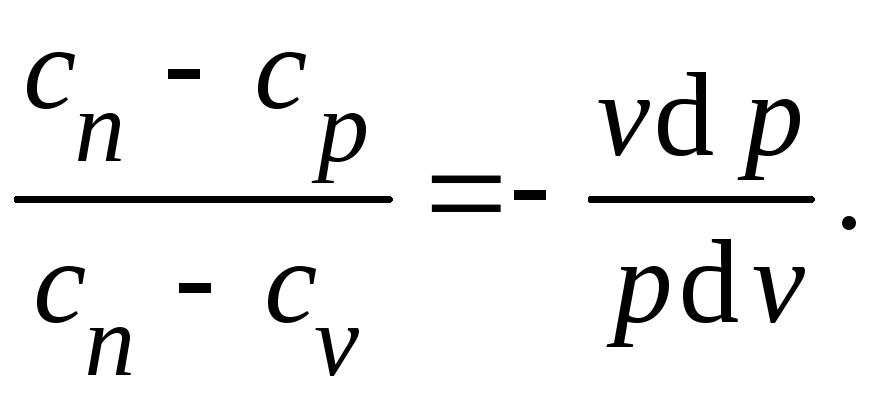
Постоянная величина
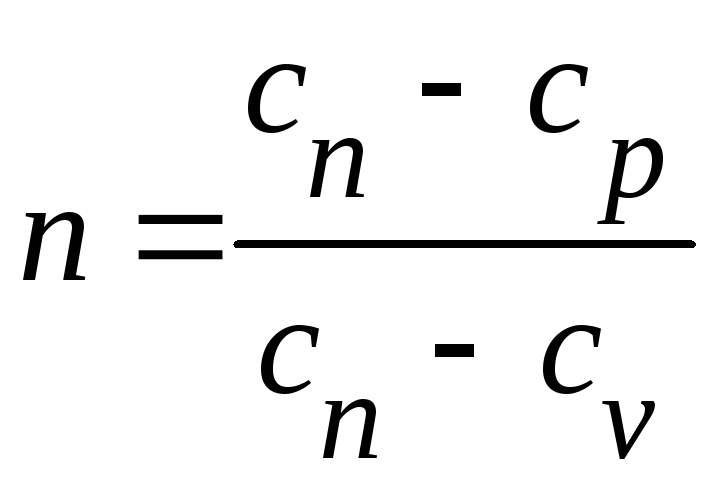
Называется
показателем
политропы.
Выражение
записывается в
виде дифференциального уравнения
первого порядка с разделёнными переменными
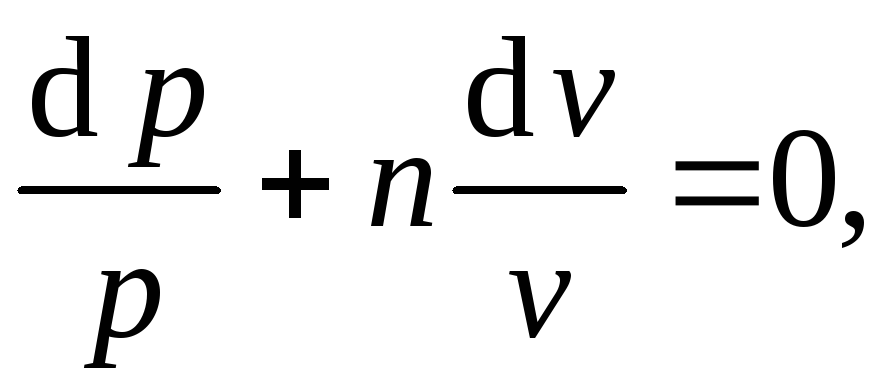
решение которого
имеет вид:
Или
(8)
Графическое
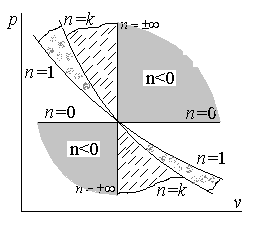
изображение политропного процесса.
Зависимость для
различных значений показателя политропы
представлена на рис.1.
Рис.1. Изображение политропного процесса
в диаграмме
для различных значений показателя
политропы
.
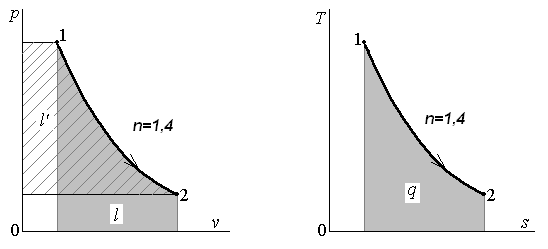
Выражение (4) для
показателя политропы n
представляет
собой отношение внешней работы и работы
расширения, которые на диаграмме p
–
v
графически изображаются площадями
слева от кривой процесса и под ней
соответственно (рис. 2).
Рис. 2. Графическое определение показателя
политропы

Таким образом, для
определения показателя политропы
необходимо знать, что процесс является
политропным, и иметь его изображение
на диаграмме p
–
v.
Такой способ называется графическим.
Показатель политропы
можно определить также по значениям
двух параметров в начале и в конце
процесса. Записывая уравнение политропного
процесса, например, для известных
давлений и объемов в начале и в конце
процесса (точки 1 и 2)
(10)
получим
(11)
Такой способ
определения показателя политропы
называется аналитическим.
1.4. Вычисление параметров состояния в начале и в конце процесса
Соотношение для
давлений и объемов в начальном и конечном
состояниях следует из (10); соотношения
для температур и давлений или температур
и объемов можно получить, выражая объемы
и давления через температуры из уравнения
состояния (1):
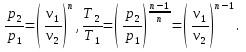
1.5. Вычисление теплоемкости и количества теплоты процесса
При заданном
значении показателя политропы
из определения находим теплоёмкость
политропного процесса:
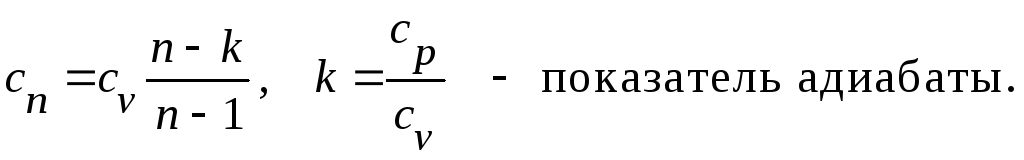
Тогда теплота
процесса ввиду постоянства теплоёмкости
определится простым выражением:
(14)
1.6. Вычисление работы изменения объема и внешней работы
Работа изменения
объема по определению
Поскольку теперь
известно уравнение процесса в переменных
p,v,
этот интеграл
может быть вычислен:
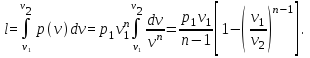
Используя
соотношение между давлением и объемом
в политропном процессе и уравнение
состояния, выражение для работы можно
также записать в виде:
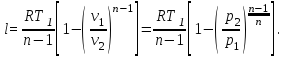
Внешняя
работа процесса.
Внешнюю
работу процесса также можно вычислить,
используя определение внешней работы
и взяв соответствующий интеграл
Однако проще
получить это выражение, воспользовавшись
определением показателя политропы (9),
из которого видно, что внешняя работы
в n
раз больше работы изменения объема:
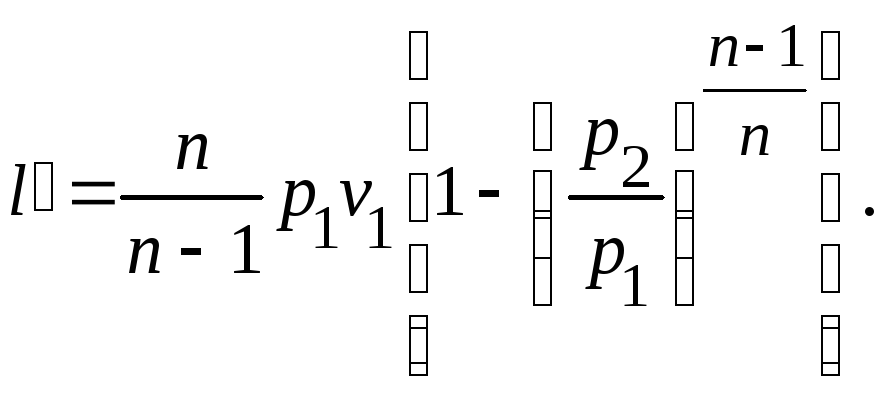
1.7. Вычисление изменения термодинамических функций
Для вычисления
изменения внутренней энергии и энтальпии
необходимо проинтегрировать два
последних уравнения в (3). Тогда
изменение
внутренней энергии
(18)
изменение
энтальпии
(19)
Выражение
для изменения энтропии можно получить
на основании II
закона термодинамики для необратимых
процессов:
(20)
Тогда изменение
энтропии
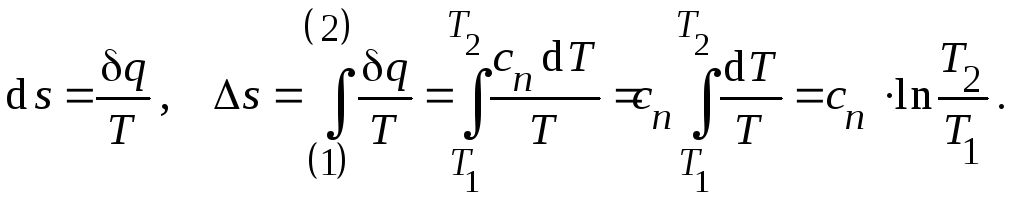
Уравнение
политропного процесса в переменных
следует из определения количества
теплоты через теплоёмкость (3) и из
математической записи второго начала
термодинамики (20):
Если известны
значения температуры и энтропии в
начальном состоянии, то после нахождения
произвольной постоянной получаем:
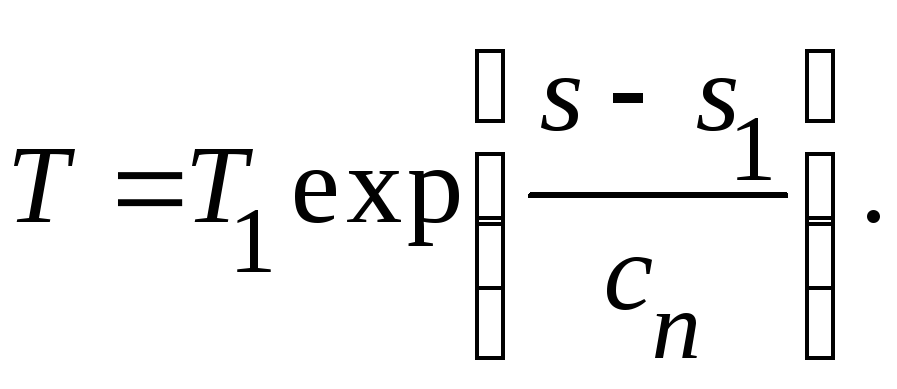
Графическое
изображение политропного процесса в
переменных
на основании (22) представлена на рис.3.
Рис.3. Изображение политропного процесса
в диаграмме
для различных значений показателя
политропы
.
Примечание.
Для адиабатического процесса
Расчёт проводится по приведённым
формулам политропного процесса с заменой
n
на k.
Из первого закона термодинамики при
следует:
(23)
где
вычисляются по формулам (18) и (19).
Проверка расчётов
проводится на основе первого закона
термодинамики:
(24)
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Определение политропный процесс
«Политропный процесс — это термодинамический процесс, который подчиняется соотношению: PVn = C, где p — давление, V — объем, n — показатель политропы, а C — постоянная. Уравнение политропного процесса может описывать множественные процессы расширения и сжатия, которые включают теплопередачу ».
Политропное уравнение | Политропное уравнение состояния
Политропный процесс можно определить уравнением
PVn = C
показатель степени n называется индексом политропы. Он зависит от материала и варьируется от 1.0 до 1.4. Это метод постоянной удельной теплоемкости, при котором учитывается поглощение тепла газом из-за повышения температуры на единицу.
Политропный индекс
Некоторые важные соотношения между давлением [P], объемом [V] и температурой [T] в политропном процессе для идеального газа
Политропное уравнение:
PVn = C
………………………. Соотношение между давлением [P] и объемом [V]
………………………. Связь между объемом [В] и температурой [Т]
………………………. Связь между давлением [P] и температурой [T]
Политропные работы
Уравнение идеального газа для политропного процесса дается формулой
Политропная теплопередача
По данным 1st закон термодинамики,
dQ = dU + W
Политропный против изэнтропического процесса
Политропный процесс — это термодинамический процесс, который подчиняется уравнению
PVn = C
Этот процесс учитывает потери на трение и фактор необратимости процесса. Это реальный процесс, за которым следует газ в определенных условиях.
Изэнтропический процесс, также известный как обратимый адиабатический процесс, представляет собой идеальный процесс, в котором не происходит передача энергии или тепла через границы системы. В этом процессе предполагается, что система имеет изолированную границу. Т.к. теплопередача равна нулю. дQ = 0
Согласно первому закону термодинамика,
ΔU=-W=∫Pdv
Политропный процесс против адиабатического процесса
Политропный процесс — это термодинамический процесс, который подчиняется уравнению
PVn = C
Этот процесс учитывает потери на трение и фактор необратимости процесса. Это реальный процесс, за которым следует газ в определенных условиях.
Адиабатический процесс — это особое и специфическое состояние политропного процесса, при котором.
Подобно изэнтропическому процессу, в этом процессе также не происходит передачи энергии или тепла через границы системы. В этом процессе предполагается, что система имеет изолированную границу.
Политропная эффективность
«Политропический КПД, точно определяемый как отношение идеальной работы сжатия для изменения перепада давления в многоступенчатом компрессоре к фактической работе сжатия при изменении перепада давления в многоступенчатом компрессоре».
Проще говоря, это изоэнтропическая эффективность процесса для бесконечно малой ступени многоступенчатого компрессора.
Где, γ = индекс адиабаты
Pd = Давление нагнетания
Ps = Давление всасывания
Td = Температура подачи
Ц = Температура всасывания
Политропная голова
Политропный напор можно определить как напор, создаваемый центробежным компрессором при политропном сжатии газа или воздуха. Величина развиваемого давления зависит от плотности сжатого газа, и это зависит от изменения плотности газа.
Где,
γ = индекс адиабаты
zсредний = Средний коэффициент сжимаемости
η = политропная эффективность
Pd = Давление нагнетания
Ps = Давление всасывания
S = удельный вес газа
Ts = Температура всасывания
Политропный процесс для воздуха | Политропный процесс для идеального газа
Считается, что воздух является идеальным газом, и поэтому законы идеального газа применимы к воздуху.
Политропное уравнение:
PVn=C
………………………. Соотношение между давлением [P] и объемом [V]
………………………. Связь между объемом [В] и температурой [Т]
………………………. Связь между давлением [P] и температурой [T]
Примеры политропных процессов
1. Рассмотрим политропный процесс с индексом политропы. п = (1.1). Начальные условия: P1 = 0, В1 = 0 и заканчивается на P2= 600 кПа, В2 = 0.01 м3. Оцените проделанную работу и теплоотдачу.
Ответ: Работы, выполненные политропным процессом, предоставлены
W=0-600*1000*0.01/1.1-1=60kj
Теплопередача определяется выражением
dQ=1.4-1.1/1.4-1*60=45kJ
2. Поршневой цилиндр содержит кислород при 200 кПа объемом 0.1 м.3 и при 200 ° С. Масса добавляется так, чтобы газ сжимался с PV.1.2 = постоянная до конечной температуры 400 ° C. Подсчитайте проделанную работу.
Ответ: Выполненная политропная работа определяется
3. Рассмотрим аргон при 600 кПа, 30 ° C, сжатый до 90 ° C в политропном процессе с n = 1.33. Найдите проделанную работу на Газе.
Ответ: Выполненная политропная работа определяется
для аргона при 30 ° C составляет 208.1 Дж / кг. K
Принимая m = 1 кг
проделанная работа
4. Предположим, что масса 10 кг ксенона хранится в баллоне при 500 К, 2 МПа, расширение представляет собой политропный процесс (n = 1.28) с конечным давлением 100 кПа. Посчитайте проделанную работу. Учтите, что система имеет постоянную удельную теплоемкость.
Ответ: Выполненная политропная работа определяется
Мы знаем это,
для ксенона при 30 ° C — 63.33 Дж / кг. K
Принимая m = 10 кг
проделанная работа
5. Рассмотрим цилиндр-поршень с начальным объемом 0.3, содержащий 5 кг газообразного метана при давлении 200 кПа. Газ сжимают политропно (n = 1.32) до давления 1 МПа и объема 0.005. Рассчитайте теплопередачу во время процесса.
Ответ: политропный Теплопередача дан кем-то
6. Примите во внимание цилиндр-поршень, содержащий 1 кг метана при 500 кПа, 20 ° C. Газ политропно сжимают до давления 800 кПа. Рассчитайте теплопередачу с показателем n = 1.15.
Ответ: Политропная теплопередача определяется
Мы знаем, что R для метана = 518.2 Дж / кг. K
7. 1 кг гелия хранится в системе поршень-цилиндр при 303 К, 200 кПа сжимается до 400 К в обратимом политропном процессе с показателем степени n = 1.24. Гелий является идеальным газом, поэтому удельная теплоемкость будет фиксированной. Найдите работу и теплопередачу.
Ответ: Выполненная политропная работа определяется
R для гелия составляет 2077.1 Дж / кг.
W=2077.1*[400-303]/1.24-1=839.494kJ
Политропная теплопередача определяется выражением
dQ=γ-n/γ-1Wполи
dQ=1.4-1.24/1.4-1*839.494=335.7976kJ
8. Предположите, что воздух хранится в баллоне объемом 0.3 литра при 3 МПа, 2000 К. Воздух расширяется в соответствии с обратимым политропным процессом с показателем степени n = 1.7, объемное соотношение в этом случае составляет 8: 1. Рассчитайте политропную работу для процесса и сравните ее с адиабатической работой, если процесс расширения следует за обратимым адиабатическим расширением.
Ответ: Нам дается
Отношения между давлением [P] и объемом [V
Выполненная политропная работа определяется выражением
В=П1V1-P2V2/n-1
Проделанная адиабатическая работа определяется выражением
В=П1V1-P2V2/γ-1
Для процесса расширения Работа, выполняемая посредством обратимого адиабатического процесса, больше, чем Работа, выполняемая посредством обратимого политропного процесса.
9. В закрытом контейнере содержится 200 л газа при 35 ° C, 120 кПа. Газ сжимается в политропном процессе до температуры 200 ° C, 800 кПа. Найти политропную работу, совершаемую воздухом для n = 1.29.
Ответ: соотношение между давлением [P] и объемом [V]
800/120=200/В21.29
V2=45.95 л
Выполненная политропная работа определяется выражением
В=П1V1-P2V2/n-1
10. Масса 12 кг газообразного метана при 150 ° C, 700 кПа подвергается политропному расширению с n = 1.1 до конечной температуры 30 ° C. Найти теплопередачу?
Ответ: Мы знаем, что R для метана = 518.2 Дж / кг. K
Политропная теплопередача определяется выражением
11. Узел цилиндр-поршень содержит R-134a при 10 ° C; объем 5 литров. Охлаждающая жидкость сжимается до 100 ° C, 3 МПа в соответствии с обратимым политропным процессом. рассчитать проделанную работу и теплоотдачу?
Ответ: Мы знаем, что R для R-134a = 81.49 Дж / кг. K
Выполненная политропная работа определяется выражением
Вт=мР[Т2-T1]/n-1
Политропная теплопередача определяется выражением
dQ=γ-n/γ-1*W
dQ=1.4-1.33/1.4-1*22.224=3.8892kJ
12. Является ли политропный процесс изотермическим по своей природе?
Ответ: Когда n становится 1 для политропного процесса: согласно предположению об идеальном газовом законе, PV = C представляет постоянную температуру или изотермический процесс.
13. Обратим ли политропный процесс?
Ответ: политропные процессы внутренне обратимы. Вот несколько примеров:
п = 0: Р = С: Представляет собой изобарический процесс или процесс постоянного давления.
n = 1: PV = C: Согласно предположению об идеальном газовом законе, PVγ = C представляет постоянную температуру или Изотермический процесс.
п = γ: В предположении закона идеального газа, представляет собой постоянную энтропию, изэнтропический процесс или обратимый адиабатический процесс.
n = Бесконечность: Представляет собой изохорный процесс или процесс постоянного объема.
14. Адиабатический политропный процесс?
Ответ: когда п = γ: В предположении закона идеального газа PVγ = C, представляет постоянную энтропию или изэнтропический процесс или обратимый адиабатический процесс.
14. Что такое политропная эффективность?
Ответ: Политропический КПД можно определить как отношение идеальной работы сжатия к фактической работе сжатия при изменении перепада давления в многоступенчатом компрессоре. Проще говоря, это изоэнтропическая эффективность процесса для бесконечно малой ступени многоступенчатого компрессора.
Проще говоря, это изоэнтропическая эффективность процесса для бесконечно малой ступени многоступенчатого компрессора.
Где, γ = индекс адиабаты
Pd = Давление нагнетания
Ps = Давление всасывания
Td = Температура подачи
Ts = Температура всасывания
15. Что такое гамма в политропном процессе?
Ответ: В политропном процессе, когда п = γ: В предположении закона идеального газа PVγ = C, представляет постоянную энтропию или изэнтропический процесс или обратимый адиабатический процесс.
16. что такое политропный процесс?
Ответ: Политропный процесс можно определить уравнением
PVn = C
показатель степени n называется индексом политропы. Он зависит от материала и варьируется от 1.0 до 1.4. Его также называют процессом с постоянной удельной теплотой, при котором тепло, поглощаемое газом, учитываемое из-за повышения температуры на единицу, является постоянным.
17. Какие выводы можно сделать для политропного процесса с n = 1?
Ответ: когда п = 1: PVn = C : Согласно предположению об идеальном газе, закон становится PV = C представляет собой постоянную температуру или изотермический процесс.
18. Что такое неполитропный процесс?
Ответ: Политропный процесс можно определить уравнением PVn = C показатель степени n называется индексом политропы. Когда,
- п <0: Отрицательный показатель политропы обозначает процесс, в котором Работа и теплопередача происходят одновременно через границы системы. Однако такой самопроизвольный процесс нарушает Второй закон термодинамики. Эти частные случаи используются в тепловом взаимодействии для астрофизики и химической энергии.
- п = 0: Р = С: Представляет собой изобарический процесс или процесс постоянного давления.
- n = 1: PV = C: Согласно предположению об идеальном газовом законе, PV = C представляет постоянную температуру или изотермический процесс.
- 1 <n <γ: В предположении закона идеального газа, в этом процессе тепло и рабочий поток движутся в противоположном направлении (K> 0). Как и в циклах сжатия пара, тепло теряется в горячее окружение.
- п = γ: В предположении закона идеального газа PVγ = C представляет постоянную энтропию или изэнтропический процесс или обратимый адиабатический процесс.
- γn <Бесконечность: В этом процессе предполагается, что тепло и рабочий поток движутся в том же направлении, что и в двигателе внутреннего сгорания, когда некоторое количество выделяемого тепла теряется на стенках цилиндра и т. Д.
- n = Бесконечность: Представляет собой изохорный процесс или процесс постоянного объема
19. Почему в политропном процессе теплопередача отрицательна?
Ответ: Политропная теплопередача определяется
Q=γ-n/γ-1*Wполи
После появления γ n <Бесконечность : В этом процессе предполагается, что тепло и рабочий поток движутся в одном направлении. Изменение температуры происходит из-за изменения внутренней энергии, а не подводимого тепла. Таким образом, даже если при политропном расширении добавляется тепло, температура газа снижается.
20. Почему в политропном процессе температура понижается при добавлении тепла?
Ответ: Политропная теплопередача определяется
Q=γ-n/γ-1*Wполи
Для условия: 1 <n <γ: В предположении закона идеального газа, в этом процессе тепло и рабочий поток движутся в противоположном направлении (K> 0). Как и в циклах сжатия пара, тепло теряется в горячее окружение. Изменение температуры происходит из-за изменения внутренней энергии, а не подводимого тепла. Произведенная работа превышает количество поданного или добавленного тепла. Таким образом, даже если при политропном расширении добавляется тепло, температура газа снижается.
21. В политропном процессе, когда PVn = константа, температура тоже постоянна?
Ответ: В политропном процессе, когда PVn = постоянная, температура остается постоянной только при показателе политропы n = 1. Для n = 1: PV = C: Согласно предположению об идеальном газовом законе, PV = C представляет постоянную температуру или изотермический процесс.
Чтобы узнать о просто поддерживаемой балке (нажмите здесь.)и консольная балка (Кликните сюда)
Уравнение политропного процесса.
Продифференцируем уравнение состояния для 1 кг идеального газа:
Принимая теплоемкость не зависящей от температуры, получим уравнение первого закона термодинамики в дифференциальной форме:
Подставляя в это уравнение выражение для 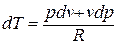
Разделяя переменные и произведя интегрирование, получаем
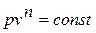
где 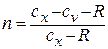
Зависимость между температурой и удельным объёмом определяется путём замены давления в уравнении политропного процесса его значением из уравнения состояния идеального газа:
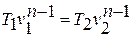
Исключая подобным же образом удельный объём, находим зависимость между давлением и температурой:

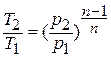
Деформационная работа, производимая 1 кг газа в политропном процессе, определяется по формуле:
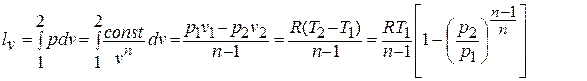
То есть отношение технической и деформационной работ равно показателю политропы:
Изменение внутренней энергии в политропном процессе находится общей формулой:
Теплоёмкость процесса 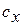
Количество теплоты в политропном процессе находится по формуле:
1.12. Энтальпия рабочего тела.
В термодинамике важную роль играет сумма внутренней энергии системы 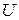
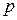
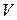
Так как входящие в нее величины являются функциями состояния, то и сама энтальпия является функцией состояния.
Так же как внутренняя энергия, работа и теплота, она измеряется в джоулях (Дж).
Энтальпия обладает свойством аддитивности . Величина
называемая удельной энтальпией ( 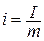
Поскольку энтальпия есть функция состояния, то она может быть представлена в виде функции двух любых параметров состояния:
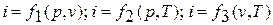
Изменение энтальпии в любом процессе определяется только начальным и конечным состояниями тела и не зависит от характера процесса.
Физический смысл энтальпии выясним на следующем примере. Рассмотрим расширенную систему, включающую газ в цилиндре и поршень с грузом общим весом G (рис.1.7). Энергия этой системы складывается из внутренней энергии газа и потенциальной энергии поршня с грузом в поле внешних сил: 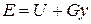
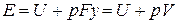

Уравнение 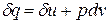
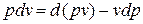
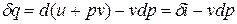
Рис.1.10. К определению физического смысла энтальпии
Из этого соотношения следует, что если давление термодинамической системы сохраняется неизменным, то есть осуществляется изобарный процесс (dp = 0), то 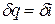
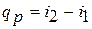
Это выражение очень часто используется в расчетах, так как огромное
количество процессов подвода теплоты в теплоэнергетике (в паровых котлах, камерах сгорания газовых турбореактивных двигателей, теплообменных аппаратах), а также целый ряд процессов химической технологии и многих других производствах осуществляется при постоянном давлении. Кстати, по этой причине в таблицах термодинамических свойств обычно приводятся значения энтальпии, a не внутренней энергии.
Для идеального газа для вычисления энтальпии используется формула
Так как между энтальпией и внутренней энергией существует связь, выбор начала отсчета одной из них произволен: в точке, принятой за начало отсчета внутренней энергии, 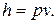

р = 610,8 Па, 
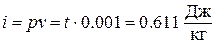
При расчетах практический интерес представляет изменение энтальпии в конечном процессе:
1.13. Энтропия рабочего тела.
Как уже указывалось, величина 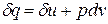
В математике доказывается, что дифференциальный двучлен всегда можно превратить в полный дифференциал путем умножения (или деления) на интегрирующий множитель (или делитель). Таким интегрирующим делителем для элементарного количества теплоты 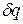
Покажем это на примере изменения состояния идеального газа в равновесных процессах:
Выражение 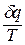
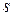
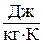
Для произвольного количества газа энтропия, обозначаемая через 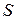
равна 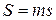
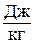
Таким образом, аналитически энтропия определяется следующим образом:
Эта формула справедлива как для идеальных, так и для реальных газов.
Подобно любой другой функции состояния энтропия может быть представлена в виде функции любых двух параметров состояния:
Понятием «энтропия» (от греч. Entropia – поворот, превращение) будем называть в термодинамике направление теплообмена между рабочим телом термодинамической системы и внешней средой.
Значение энтропии для заданного состояния газа определяется интегрированием уравнения для энтропии:
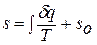

При температурах, близких к абсолютному нулю, все известные газы находятся в конденсированном состоянии. Вальтер Нернст (1864 – 1941), немецкий физик и химик, в 1906 году экспериментально установил, а Макс Планк (1858 – 1947), немецкий физик, в 1912 году окончательно сформулировал следующий принцип:
при температуре, стремящейся к абсолютному нулю, энтропия газа, находящегося в конденсированном состоянии с упорядоченной кристаллической структурой, стремится к нулю,то есть 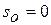
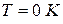
Этот закон называют третьим законом термодинамикиили тепловой теоремой В.Нернста. Он позволяет рассчитать абсолютное значение энтропии в отличие от внутренней энергии и энтальпии, которые всегда отсчитываются от произвольного уровня.
Однако в технической термодинамике обычно используется не абсолютное значение энтропии, а ее изменение в каком-либо процессе:
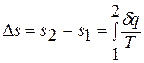
поэтому энтропию тоже отсчитывают от произвольно выбранного уровня.
Получим формулы, позволяющие вычислить изменение энтропии идеального газа. Для этого проинтегрируем уравнение для энтропии, полагая 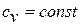
Имея в виду уравнение состояния, записанное для состояний «1» и «2», получаем:
После подстановки отношений 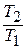
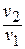
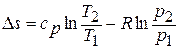
Поскольку энтропия есть функция состояния рабочего тела, написанными уравнениями можно пользоваться вне зависимости от пути перехода рабочего тела между состояниями «1» и «2» и, в частности, от того, равновесный этот переход или нет.
Понятие энтропии позволяет ввести чрезвычайно удобную для термодинамических расчетов 
на 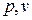
Из уравнения для изменения энтропии следует, что в равновесном процессе: 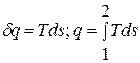

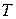
Рис.1.11. Графическое изображение теплоты в 
линией процесса, крайними ординатами и осью абсцисс, эквивалентна теплоте процесса.
Формула для элементарного изменения энтропии показывает, что 
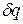
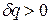
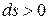

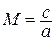
Данное отношение названо в честь Эрнста Маха (1838 – 1916), австрийского физика и философа; отношение является критерием( от греч. Kriterion – средство для суждения) – признаком, на основании которого производится оценка, определение или классификация чего — либо; мерило оценки; в данном случае критерий сжимаемости газа. Формула 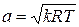
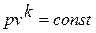
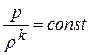
Дифференциальное уравнение этого процесса представляется так 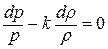
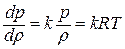
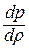
Отсюда выражение для полной энергии потока в сечении записывается так:
Число Маха, таким образом, является характеристикой сжимаемости рабочего тела. Например, при 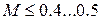
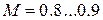
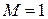

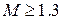
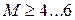
Принимая 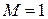
Если формулу для полной энергии потока разделить на 
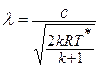
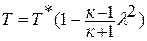
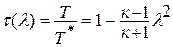
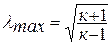
Если принять процесс торможения потока от температуры 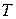
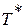
или плотности 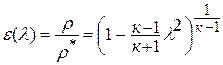
Уравнение сохранения энергии широко используется в авиационной практике для различных элементов двигателей. Например:
а) работа , подводимая к валу ротора компрессора 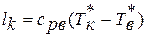
Блог об энергетике
энергетика простыми словами
Основные термодинамические процессы
Основными процессами в термодинамике являются:
- изохорный, протекающий при постоянном объеме;
- изобарный, протекающий при постоянном давлении;
- изотермический, происходящий при постоянной температуре;
- адиабатный, при котором теплообмен с окружающей средой отсутствует;
- политропный, удовлетворяющий уравнению pv n = const.
Изохорный, изобарный, изотермический и адиабатный процессы являются частными случаями политропного процесса.
При исследовании термодинамических процессов определяют:
- уравнение процесса в p—v иT—s координатах;
- связь между параметрами состояния газа;
- изменение внутренней энергии;
- величину внешней работы;
- количество подведенной теплоты на осуществление процесса или количество отведенной теплоты.
Изохорный процесс

При изохорном процессе выполняется условие v = const.
Из уравнения состояния идеального газа (pv = RT) следует:
т. е. давление газа прямо пропорционально его абсолютной температуре:
Работа расширения в изохорном процессе равна нулю (l = 0), так как объем рабочего тела не меняется (Δv = const).
Количество теплоты, подведенной к рабочему телу в процессе 1-2 при cv = const определяется по формуле:
Т. к.l = 0, то на основании первого закона термодинамики Δu = q, а значит изменение внутренней энергии можно определить по формуле:
Изменение энтропии в изохорном процессе определяется по формуле:
Изобарный процесс
Изобарным называется процесс, протекающий при постоянном давлении p = const. Из уравнения состояния идеального газа слуедует:
т. е. в изобарном процессе объем газа пропорционален его абсолютной температуре.
Работа будет равна:
Количество теплоты при cp = const определяется по формуле:
Изменение энтропии будет равно:
Изотермический процесс
При изотермическом процессе температура рабочего тела остается постоянной T = const, следовательно:
т. е. давление и объем обратно пропорциональны друг другу, так что при изотермическом сжатии давление газа возрастает, а при расширении – снижается.
Работа процесса будет равна:
Так как температура остается неизменной, то и внутренняя энергия идеального газа в изотермическом процессе остается постоянной (Δu = 0) и вся подводимая к рабочему телу теплота полностью превращается в работу расширения:
При изотермическом сжатии от рабочего тела отводится теплота в количестве, равном затраченной на сжатие работе.
Изменение энтропии равно:
Адиабатный процесс
Адиабатным называется процесс изменения состояния газа, который происзодит без теплообмена с окружающей средой. Так как dq = 0, то уравнение первого закона термодинамики для адиабатного процесса будет иметь вид:
В адиабатном процессе работа расширения совершается только за счет расходования внутренней энергии газа, а при сжатии, происходящем за счет действия внешних сил, вся совершаемая ими работа идет на увеличение внутренней энергии газа.
Обозначим теплоемкость в адиабатном процессе через cад, и условие dq = 0 выразим следующим образом:
Это условие говорит о том, что теплоемкость в адиабатном процессе равна нулю (cад = 0).
и уравнение кривой адиабатного процесса (адиабаты) в p, v-диаграмме имеет вид:
В этом выражении k носит название показателя адиабаты (так же ее называют коэффициентом Пуассона).
kвыхлопных газов ДВС = 1,33
Из предыдущих формул следует:
Техническая работа адиабатного процесса (lтехн) равна разности энтальпий начала и конца процесса (i1 – i2).
Адиабатный процесс, происходящий без внутреннего трения в рабочем теле, называется изоэнтропийным. В T, s-диаграмме он изображается вертикальной линией.
Обычно реальные адиабатные процессы протекают при наличии внутреннего трения в рабочем теле, в результате чего всегда выделяется теплота, которая сообщается самому рабочему телу. В таком случае ds > 0, и процесс называется реальным адиабатным процессом.
Политропный процесс
Политропным называется процесс, который описывается уравнением:
Показатель политропы n может принимать любые значения в пределах от -∞ до +∞, но для данного процесса он является постоянной величиной.
Из уравнения политропного процесса и уравнения Клайперона можно получить выражение, устанавливающее связь между p, vи Tв любых двух точках на политропе:
Работа расширения газа в политропном процессе равна:
В случае идеального газа эту формулу можно преобразовать:
Количество подведенной или отведенной в процессе теплоты определяется с помощью первого закона термодинамики:
представляет собой теплоемкость идеального газа в политропном процессе.
При cv, k и n = const cn = const, поэтому политропный процесс иногда определят как процесс с постоянной теплоемкостью.
Политропный процесс имеет обобщающее значение, ибо охватывает всю совокупность основных термодинамических процессов.
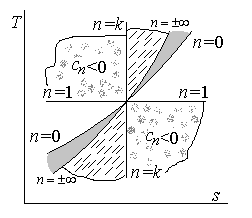
Графическое представление политропа в p, v координатах в зависимости от показателя политропа n.
pv 0 = const (n = 0) – изобара;
pv = const (n = 1) – изотерма;
p 0 v = const, p 1/∞ v = const, pv ∞ = const – изохора;
n > 0 – гиперболические кривые,
n По материалам моего конспекта лекций по термодинамике и учебника «Основы энергетики». Автор Г. Ф. Быстрицкий. 2-е изд., испр. и доп. — М. :КНОРУС, 2011. — 352 с.
Политропный процесс
Уравнение политропы в системе координат 

где 
Характеристикой политропного процесса является величина

которая может быть определена из выражения

где 
Зависимости между начальными и конечными параметрами процесса:
между 


между 


между 

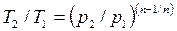
Работу 1 кг газа находят по следующим формулам:


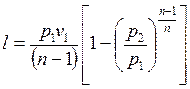
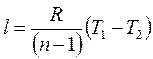
Если количество теплоты, участвующей в процессе, известно, то работа может быть также вычислена по формуле

Для определения работы M кг газа нужно в формулах (11.6) – (11.8)заменить удельный объем v полным объемом V газа. Тогда получим



Формулы (11.9) и (11.10) для M кг газа имеют следующий вид:


Теплоемкость политропного процесса можно найти из уравнения 
или, заменяя 

Количество теплоты, сообщаемой газу или отнимаемой от него:
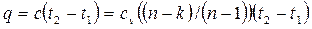

Величину 

Изменение внутренней энергии газа в политропном процессе

Показатель политропного процесса 

Задачи
11.1. 1 кг воздуха при р1=0.5 МПа и t1=111°С расширяется политропно до давления Р2=0.1 МПа.
Определить конечное состояние воздуха, изменение внутренней энергии, количество подведенной теплоты и полученную работу, если показатель политропы n=1.2.
Определяем начальный объем воздуха
Конечный объем воздуха находим из уравнения (11.3)
Конечную температуру проще всего получить из характеристического уравнения
Величину работы находим из уравнения (10.9)
Изменение внутренней энергии
Количество теплоты, сообщенной воздуху , по уравнению (11.17)
Нетрудно видеть, что в этом процессе внешняя работа совершается за счет подведенной теплоты и уменьшения внутренней энергии. Исходя из этого можно проверить полученные результаты следующим образом:
q=Du+L; L=q — Du=65.8-(-65.8)=131.6 кДж/кг.
Этот же результат получен выше другим путем.
11.2. 1.5 кг воздуха сжимают политропно от р1=0.09 МПа и t1=18°С до р2=1 МПа, температура при этом повышается до t2=125°С.
Определить показатель политропы, конечный объем, затраченную работу и количество отведенной теплоты.
Конечный объем находим из характеристического уравнения
Затраченная работа по уравнению (10.46)
Количество отведенной теплоты по уравнению
=1.5∙20.93/28.96∙(1.149-1.4)/(1.149-1) (125-18)=-195.4 кДж.
11.3. Воздух в количестве 3 м 3 расширяется политропно от р1=0.54 МПа и t1=45°С до р2=0.15 МПа. Объем, занимаемый при этом воздухом, становится равным 10 м 3 .
Найти показатель политропы, конечную температуру, полученную работу и количество подведенной теплоты.
Ответ: m=1.064, t2=21.4°С, L=1875 кДж, Q=1575 кДж.
11.4. В цилиндре двигателя с изобарным подводом теплоты сжимается воздух по политропе с показателем m=1.33.
Определить температуру и давление воздуха в конце сжатия, если степень сжатия ( e=V1/V2) равна 14, t1=77°С и р1=0.1 МПа.
Знак плюс(+) показывает , что теплота в данном процессе подводится . Об этом можно судить также по величине показателя политропы.
Изменение внутренней энергии
DU= Q – L =672.4-1923=-1250.6 кДж.
Знак минус (-) показывает, что внутренняя энергия убывает . В данном процессе работа совершается за счет подводимой извне теплоты, а также внутренней энергии газа.
11.5. В процессе политропного сжатия затрачивается работа , равная 195 кДж, причем в одном случае от газа отводится 250 кДж, а в другом — газу сообщается 42 кДж.
Определить показатели обеих политроп.
Ответ: 1). m=0.9, 2). m=1.49.
11.6. 1.5 м 3 воздуха сжимаются от 0.1 МПа и 17°С до 0.7 МПа, конечная температура при этом равна 100°С.
Какое количество теплоты требуется отвести, какую работу затратить и каков показатель политропы?
Ответ: Q=-183 кДж, L=-290 кДж, m=1.147.
11.7. 0.01 м 3 воздуха при давлении р1=1 МПа и температуре t1=25°С расширяется в цилиндре с подвижным поршнем до 0.1 МПа.
Найти конечный объем, конечную температуру, работу, произведенную газом, и подведенную теплоту, если расширение в цилиндре происходит: а)изотермически, б)адиабатно и в)политропно с показателями m =1.3.
а). Изотермическое расширение. Конечный объем определяют по формуле (11.11)
Так как в изотермическом процессе t=const, то конечная температура t2=t1=25°С.
Работа газа по уравнению (10.17)
Количество подведенной теплоты по формуле (11.19)
б). Адиабатное расширение. Конечный объем определяется по уравнению (11.20)
Пользуясь табл. XIX, получаем 10 1/1.4 =5.188.
Конечная температура воздуха на основании уравнения (11.22)
Работа газа по уравнению (10.29)
=25000∙0.48=12 000Дж=12 кДж.
в). Политропное расширение. Конечный объем найдем из уравнения (11.35)
Конечная температура по уравнению (10.37)
Работа газа по уравнению (10.45)
=1∙10 6 ∙0.01/0.3∙(1-(0.1/1) 0.3/1.3 )=13700 Дж=13.7 кДж.
Подведенная теплота по уравнению (10.50)
11.8.В процессе политропного расширения воздуху сообщается 83.7 кДж тепла.
Найти изменение внутренней энергии воздуха и произведенную работу, если объем воздуха увеличился в 10 раз, а давление его уменьшилось в 8 раз.
Ответ: DU=16.7 кДж; L=6702 кДж.
11.10. Воздух расширяется по политропе, совершая при этом работу, равную 270 кДж, причем в одном случае ему сообщается 420 кДж теплоты, а в другом — от воздуха отводится 92 кДж теплоты.
Определить в обоих случаях показатели политропы.
Ответ: 1). m=0.78; 2). m=1.88.
11.11. 2 м 3 воздуха при давлении р1=0.09 МПа и температуре t1=40°С сжимаются до давления р2=1.1 МПа и объема V2=0.5 м 3 .
Определить показатель политропы, работу сжатия и количество отведенной теплоты.

Дата добавления: 2014-11-13 ; просмотров: 502 ; Нарушение авторских прав
http://lektsii.com/1-2793.html
- B. C. Соловьёв о праве, государстве и историческом процессе.
- I. Повышение управляемости организации при внедрении процессного подхода.
- II. Начало процесса исторического развития общества.
- III. Технологическое проектирование строительных процессов.
- III.1.1) Формы уголовного процесса.
- IV.3.2) Виды легисакционного процесса.
- IV.4.1) Происхождение и смысл формулярного процесса.
- IV.4.3) Общий ход формулярного процесса.
- IV.5. Когниционный процесс
- VI. Педагогические технологии на основе эффективности управления и организации учебного процесса
При адиабатическом и политропическом течении процесса расчет реакторных устройств может вестись по тем же уравнениям, но под температурами Н и и подразумеваются температуры, эквивалентные средней скорости процесса. [c.270]
Пары бензина с воздухом самовоспламеняются при 550° С. До какого давления требуется их сжать (адиабатически) для самовоспламенения, если начальная температура их 110° С, давление 760 мм рт. ст. и сжатие протекает во политропическому закону с показателем политропы т=1,35. [c.150]
Показано 2 что добавление твердых частиц в газовый поток уменьшает рост температуры при сжатии, приближая процесс в компрессоре к изотермическому, а расход энергии — к минимальному. Это может быть учтено, если в выражение (XVI,34) подставлять эффективную политропическую работу Яд, рассчитанную по уравнению (XVI,33) с использованием показателя политропы значения мощности в этом случае получаются более точными. Эта гипотеза требует еще экспериментальной проверки. [c.616]
Для предотвращения значительного изменения температуры в реакторе, которое может иметь место при повышенном тепловом эффекте реакции, обеспечивается теплообмен реактора с внешней средой, т.е. осуществляется политропический процесс. [c.622]
Температура, эквивалентная средней скорости политропического процесса, [c.628]
Над каждым слоем катализатора расположен маточник из хромоникелевых труб для подачи охлаждающего циркуляционного газа. Это позволяет поддерживать в каждой секции необходимую-температуру с постепенным повышением ее по ходу парогазовой смеси. Таким образом, в любой секции протекает адиабатический процесс, а в реакторе в целом — политропический. [c.300]
Температура идеального газа в политропическом процессе равна [c.22]
Величина удельного объема обратно пропорциональна плотности газа. Номограмма рис. 1.7 определяет работу, затрачиваемую в политропическом цикле на 1 кг различных газов в зависимости от плотности ро при 0 = 0° С и Ро = 101,325 кн м , отношения давлений, показателя политропы и начальной температуры Газы рассматриваются как идеальные, С увеличением показателя политропы п кривая процесса сжатия становится более крутой. Поэтому повышается затрата работы в цикле компрессора (рис. 1.8). [c.23]
При вычислении значения АВ руководствуются формулой (1.46) значения р определяют по температурам в политропическом процессе. [c.23]
Политропический процесс изображается в з, Г-диаграмме наклонной кривой, направление которой зависит от величины показателя политропы. Если процесс сжатия протекает с отводом тепла, то политропа проходи слева от адиабаты (кривая 1—2″), а с подводом тепла — справа (кривая 1—2″ ). Сжатие газа с подводом тепла возможно только при температуре стенок цилиндра выше температуры газа. [c.31]
Для идеального газа количество тепла, отводимого от цилиндра д) и холодильника (д- при охлаждении до начальной температуры Г , равно работе в цикле компрессора. В изотермическом процессе I = д н работа выражается площадью под изотермой. В адиабатическом цикле работа равна количеству тепла д1, выделяемого в холодильнике, и выражается площадью под изобарой р., на участке 2 —2. В политропическом цикле она выражается суммой количеств тепла (2] д -= < + 1), отводимого [c.31]
При политропическом сжатии конечную температуру Гг газа можно определить но этой же формуле, но подставляя вместо к значение показателя п политропы. [c.175]
Теоретическая работа сжатия, температура в конце сжатия и объемный коэффициент при политропическом сжатии могут быть определены из уравнений (IV,32)—(IV,34) с заменой в них показателя адиабаты на показатель политропы т. [c.165]
В действительности достигаемое снижение температуры меньше и соответствует реальному политропическому процессу расширения. [c.653]
Находят среднюю температуру участка, эквивалентную средней скорости политропического процесса [2, с. 181] [c.371]
В изотермических реакторах для сохранения постоянной температуры процесса необходимо подводить или отводить тепло соответственно тепловому эффекту реакции. Однако изотермические реакторы сравнительно редко используются в крупномасштабных производствах из-за высокой стоимости оборудования или теплообмена, что делает процесс неэкономичным. Поэтому промышленные реакторы чаще проектируются как адиабатические или политропические. [c.327]
Количество тепла, отводимое в адиабатических условиях, целиком определяется разностью теплот в потоке на входе в реактор и выходе из него. Это можно изобразить в виде прямой, пересекающей абсциссу в точке То (температура на входе). Для политропических условий линия теплоотвода проходит при температуре более низкой, отвечающей температуре охлаждающего агента. [c.348]
В отличие от изотермических реакторов, в которых температура остается неизменной в процессе реакции, и адиабатических реакторов в которых изменение температуры в процессе реакции жестко связано со степенью превращения и величиной теплового эффекта реакции, в политропических реакторах изменение температуры может происходить независимо от величины теплового эффекта реакции и степени превращения по любому закону. [c.359]
Соотношение абсолютных температур сжатого воздуха в пневмоцилиндре Тд и ресивере Т зависит от условий теплообмена с окружающей средой. При расширении воздуха после дросселя его температура уменьшается по сравнению с величиной Т . Так как последняя обычно соответствует температуре окружающей среды (стенок трубопроводов, цилиндра и атмосферы), то сразу после дросселя возникает процесс передачи теплоты от окружающей среды к рабочей среде пневмопривода. Кроме того, при течении воздуха через дроссель возникает внутреннее тепловыделение из-за трения между частицами и стенками. Ориентируясь на уравнение (1.95) и полагая в общем случае процесс расширения воздуха после дросселя политропическим, можно принять [c.68]
При движении поршня 2 от крайнего левого положения вправо из патрубка 5 через всасывающий клапан 3 происходит впуск воздуха в цилиндр 1. На диаграмме /) F, помещенной под схемой цилиндра компрессора, это изображено линией всасывания аЪ. После того, как поршень достигнет крайнего правого положения и начнет двигаться влево, происходит сжатие воздуха. На диаграмме этот процесс изображен линией сжатия Ьс. Процесс сжатия может протекать различно если при сжатии полностью отсутствует теплообмен между воздухом и внешней средой, то будет адиабатическое сжатие (линия Ъс) если же при сжатии полностью отводится все выделяющееся тепло, то процесс будет происходить прп постоянной температуре. В диаграмме pV это изображено изотермой Ъс. В действительности обычно происходит политропическое сжатие с показателем политропы тп, величина которого больше единицы и меньше к i < т <к). [c.273]
Температура, эквивалентная средней скорости политропического процесса с криволинейным распределением температур в зоне реакции, определяется уравнением [c.50]
Для политропических процессов соотношение между давлением р, температурой Т, удельным объемом или плотностью можно выразить как [c.275]
В отличие от течения несжимаемой жидкости, для газа не сохраняется постоянство объемного расхода 2, а расход увеличивается вследствие расширения, вызванного понижением давления вдоль потока, а расширение приводит к изменению температуры (10.1). Поэтому уравнение Бернулли для идеального газа отличается от уравнения для идеальной жидкости. Если не учитывать разность нивелирных высот 2] и 22, поскольку плотность газа мала (для воздуха при атмосферном давлении р = 1,29 кг/м ), то уравнение Бернулли для политропического процесса можно записать в таком виде [c.276]
Политропический процесс, протекающий с отводом или подводом тепла, когда скорость отвода или подвода тепла не пропорциональна количеству выделенного или поглощенного тенла. В рассматриваемом случае температура в реакторе также меняется от входа к выходу, но характер температурной кривой зависит в большей степени от работы поверхности теплообмена, чем от вида кинетической кривой. К полптропическим системам могут быть отнесены реакционные секции змеевиков печей термического крекинга и пиролиза, реакторы каталитического крекинга с неподвижным катализатором в процессе регенерации, змеевиковые реакторы полиэтилена ысокого давления и др. [c.263]
В нещироком интервале температур значения теплоемкостей Ср и v можно считать постоянными. В общем случае изохори-ческие и изобарические процессы можно считать частным случаем политропического (perpoly — много, trope — изменение, обращение). Для произвольного процесса теплоемкость можно определить по формуле [c.55]
К аппаратам политропического типа относятся реакторы, выполненные в виде кожухотрубчатых теплообменных аппаратов, у которых обычно трубное пространство заполнено фанулированным катализатором и является таким образом реакционным объемом, а через межтрубное пространство пропускается агент, осуществляющий теплообмен через поверхность трубок. Такое конструктивное оформление реактора позволяет иметь сравнительно развитую поверхность теплообмена и небольшой толщины в направлении потока тепла слой катализатора, а следовательно, и сравнительно небольшое различие температур в слое катализатора. Последнее обстоятельство является особенно важным для реакций, которые эффективно протекают только в узких температурных пределах. [c.637]
Процесс полунепрерывного (замедленного) коксования можно осуществить в лаборатории лишь с известной степенью приближения, воспроизводя работу реактора при изотермическом режиме, а не при режиме переменной по высоте реактора температуры, как в промышленном процессе (см. стр. 81). Изотермический режим лабораторного реактора обвспечивается регулированием электрообогрева. Для приближения к промышленному режиму следует исходить из температур нагрева коксуемого сырья в трубчатой печи и выхода паров из коксовых камер иа промышленных установках. По эксплуатацнопным данным максимальная температура нагрева сырья в печи пе превышает 500—510 °С перепад температур по высоте камер составляет от 40 до 60 °С. Приближенно темнературу в реакторе изотермического режима можпо считать среднеарифметической между температурами на входе и выходе из камеры. Более точно эту температуру можно определить по номограмме А. И. Зиновьевой и Д. И. Орочко (рис. 54). Для данного случая Если, например, принять начальную температуру (поступления в камеры) равной 505 °С, а конечную 1., — 460 °С, то температура с.с.п, эквивалентная средней скорости политропического процесса, по номограмме составит около 484 °С. При этой температуре к нуншо проводить пробег лабораторной установки. [c.128]
Как видно из сопоставления результатов, при высоком давлении работа в изотермическом, политропическом и адиабатичес1 ом циклах больше, чем при низком давлении, соответственно на 41,7 42,4 и 43,1 кдж или на 30,1 27,2 и 25,4%. Близкие значения избытков работы в различных циклах характерны только для газов с низкой критической температурой. [c.27]
В действительности сжатие газа лишь в большей или меньшей степени приближается к одному из этих теоретических процессов. При сжатии газа наряду с изменением его объема и давления происходит изменение температуры и одновременно часть выделяющегося тепла отводится в окружающую среду. Такой процесс сжатия называется политропически м. [c.154]
Расширение сжатого газа (с совершением внешней работы) осуществляется в поршневых или турборасширительных машинах (детандерах). Изменение температуры идеального газа при его расширении в политропическом процессе с показателем политропы /г [c.55]
Отношение средних скоростей политропического и изотермического процессов прп одинаковых их глубинах зависит только от распределения температур в зоне реакции. Для процессов с криволинейным распределением температур расчетное уравнение имеет следуюищй вид [c.48]
При работе в паровой фазе циркуляция продуктов внутри аппарата предотвращается насадкой катализатора и тепло, выделяющееся при процессе, вызывает подъем температуры по высоте реактора. Температуры в пароф азных системах регулируются так же, как и I жидкофазвых, многоточечным поддувом холодного циркуляционного водорода (см. фи1. 109). Режим процесса в отдельных секциях между точками ввода охлаждающего газа устанавливается адиабатический с постепенным подъемом температуры по ходу парогазовой смеси, а в реакционных системах в целом — политропический. Ступенчатое охлаждение реагирующих продуктов в итоге приводит к пилообразному распределению температур в зоне реакции, которое обычно не замечается на практике из-за искажения замеров вследствие выравнивания температур карманами многозонных термопар. [c.325]
Рассматривая совместно линии сжатия на рис. 4.1 и диафам-му рабочего цикла компрессора на рис. 4.5, можно видеть, что работа минимальна при изотермическом сжатии, больше — при адиабатическом сжатии и наибольшая (поскольку реально, как правило, т > к) при политропическом сжатии. Физически это объясняется тем, что ПК — машина объемного действия на сжатие одинаковых объемов газа (строго говоря, газов равной атомности) зафачивается одинаковая энергия. Поэтому повышению температуры при сжатии газа, приводящему к увеличению его объема, закономерно сопутствует повышение затрат энергии. Отсюда следует вывод, что для снижения энергетических затрат надо стремиться к приближению процесса сжатия к изотермическому или хотя бы к адиабатическому. На практике это стремление реализуется путем охлаждения стенок компрессора в процессе сжатия (а также исходного газа до компрессора, если это не противоречит требованиям технологии). [c.334]
Диаграмма h — s с характерными изолиниями некоторых параметров состояния и изображенными на ней процессами в компрессоре показана на рис. 4.2. Изотермический процесс изображается на этой диаграмме линией 1—2t, адиабатический — вертикальным отрезком 1—2s, политропические процессы — линиями 1—2 (при очень хорошем охлаждении газа в процессе его сжатия) и 1—2″ (преобладающий практический случай). В начале расчета обычно располагают исходным состоянием газа в точке 1 (известны начальные давление pi и температура tx) и знают конечное давление pj. Тогда нетрудно построить линию адиабатического сжатия (вертикаль от точки 1 до линии Р2 = onst) и найти удельную адиабатическую работу Ah . Переход к реальным затратам энергии (удельным Al = Ah и полным — в единицу времени) рассмотрен в разд.4.3.6. [c.337]
На практике в ходе работы компрессора снимается часть теплоты трения дг, так что сжатие происходит политропически — с показателем т < то, а конечная температура Т2 < Тз . Здесь Т2 также определяется по (4.7), но при рабочем значении т. Удельное количество теплоты, отведенной в ходе работы компрессора, запишется как [c.352]
В опытах использовались кислоты фракции С17—Сго-Тепловой режим по зонам реактора поддерживался термостатами. Для ознакомления с характером протекания процесса были получены распределения температур по длине реактора при неуправляемых 7бмпературных режимах, характерных для политропического реактора (рис. 2). Это семейство кривых было получено при изменении мольных отношений реагентов 50з (СЖК от 0,9 до 1,6)). В аппарате было установлено 4 завихрителя. Расход СЖК и воздуха составлял соответственно — 2,5 л/час и 10 м /час. [c.230]
Политропический процесс
Вы будете перенаправлены на Автор24
Что такое политропический процесс
Политропическим или политропным процессом называют процесс, который происходит при неизменной теплоемкости. Все уравнения изо процессов и адиабатный процесс можно легко получить изменяя показатель политропы. Так, при изохорном процессе молярная теплоемкость равна $<(c>_<mu V>)$:
При изобарном ($c_<mu p>$):
При изотермическом процессе теплоемкость равна $pm infty $. При адиабатическом процессе теплоемкость равна нулю.
Уравнение политропы для идеального газа
Получим уравнение политропы для идеального газа, следуя тому, что теплоемкость должна быть постоянна.
Из уравнения Менделеева — Клайперона для идеального газа:
Из соотношения Майера:
[C_p-C_V=nu R left(5right).]
Подставим (5) в (4), получим:
Разделим уравнение (3) $T $, получим:
Очевидно, что если теплоемкость процесса постоянная, то
Уравнение интегрируем, потенцируем, получаем:
Уравнение (8) — уравнение политропы в переменных T, V. Используя уравнение Менделеева — Клайперона легко получить политропу в параметрах $p,V$ или $p,T$.
При $С=0$, $n=𝛾$. При $C=infty , n=1$ получаем уравнение Бойля — Мариотта ($T=const$). При С=$C_p$, n=0 — уравнение для $p=const$, при С=$C_V, n=pm infty $- уравнение для $V=const$.
Задание: Идеальный газ совершает политропный процесс. Найти молярную теплоемкость в этом процессе $с_<mu n>$, если $i$ — число степеней свободы для этого газа.
Запишем первое начало термодинамики:
[CdT=frac<2>nu RdT+pdV left(1.1right).]
Разделим уравнение на $dT$, получим:
Запишем уравнение процесса:
Используем уравнение Менделеева — Клайперона:
Подставим в (1.2) результаты преобразований (1.4) и (1.5), получим:
Ответ: Выражение для молярной теплоемкости в политропном процессе: $с_<mu n>$=$frac<2>+frac<1><1-n>$.
Готовые работы на аналогичную тему
Задание: Можно ли вычислить работу газа по формуле:
для адиабатного, изотермического и изобарного процессов?
Основанием для решения задачи является уравнение политропы в параметрах $p,V$ (можно и в других):
Все перечисленные в условиях задачи процессы являются частными случаями политропического процесса. Рассмотрим адиабатный процесс. Для него $n=gamma$. Подставим показатель адиабаты в (2.1) вместо n, получим:
Сравним с уравнением работы для адиабатного процесса, которое было рассмотрено в разделе, посвященном этому процессу, имеем:
Если учесть, что из уравнения Менделеева-Клайперона:
то получаем, что выражения (2.3) и (2.4) эквивалентны.
Рассмотрим изотермический процесс. Для него $n=1$, соответственно, уравнение политропы имеет вид:
Уравнение (2.6) известный закон Бойля — Мариотта. Подставим $n=1$ в (2.1), получим:
Мы получили, что работа стремится к $infty $. Следовательно, приведенная формула (2.1) для вычисления работы в изотермическом процессе не подходит.
Рассмотри изобарный процесс. Для него $n=0$. Уравнение политропы примет вид:
[pV^0=const to p=const left(2.8right).]
Подставим $n=0$ в выражение для работы (2.1), получим:
Выражение (2.9) соответствует формуле вычисления работы для изобарного процесса.
Ответ: Данная формула подходит для вычисления работы в процессах: адиабатном и изобарном, не подходит для вычисления работы в изотермическом процессе.
Задание: Газ участвует в политропическом процессе. Пусть уравнение процесса задано в параметрах $p,V$ при каких значениях $n$
- Температура растет при расширении газа?
- Температура падает при увеличении объема?
- T=const при увеличении объема?
Уравнение политропы имеет вид:
Рассматривая уравнение (3.1), сразу можно дать ответ на третий вопрос: температура постоянна при n=0, так как в таком случае мы получаем закон Бойля — Мариотта:
Если перейти от (3.1) в уравнение политропы в параметрах T, V, то ответим и на два первых вопроса. Для перехода используем уравнение Менделеева — Клайперона (возьмем его для одного моля, что не нарушит общности рассуждений):
Подставим (3.3) вместо p (3.2), получим:
Для того, чтобы определить, что происходит с температурой согласно уравнению (3.4), необходимо сравнить $1-n$ с нулем. Если $1-n>0$, то с ростом $V$ растет и $T$. И наоборот.
- $1-n>0, to n
- $1-n1$ при таком n, если $Vuparrow , то Tdownarrow$.
Ответ: Температура растет при расширении газа если $n1$. $T=const$ при увеличении объема, если $n=0$.
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 26 11 2021
Блог об энергетике
энергетика простыми словами
Основные термодинамические процессы
Основными процессами в термодинамике являются:
- изохорный, протекающий при постоянном объеме;
- изобарный, протекающий при постоянном давлении;
- изотермический, происходящий при постоянной температуре;
- адиабатный, при котором теплообмен с окружающей средой отсутствует;
- политропный, удовлетворяющий уравнению pv n = const.
Изохорный, изобарный, изотермический и адиабатный процессы являются частными случаями политропного процесса.
При исследовании термодинамических процессов определяют:
- уравнение процесса в p—v иT—s координатах;
- связь между параметрами состояния газа;
- изменение внутренней энергии;
- величину внешней работы;
- количество подведенной теплоты на осуществление процесса или количество отведенной теплоты.
Изохорный процесс

При изохорном процессе выполняется условие v = const.
Из уравнения состояния идеального газа (pv = RT) следует:
т. е. давление газа прямо пропорционально его абсолютной температуре:
Работа расширения в изохорном процессе равна нулю (l = 0), так как объем рабочего тела не меняется (Δv = const).
Количество теплоты, подведенной к рабочему телу в процессе 1-2 при cv = const определяется по формуле:
Т. к.l = 0, то на основании первого закона термодинамики Δu = q, а значит изменение внутренней энергии можно определить по формуле:
Изменение энтропии в изохорном процессе определяется по формуле:
Изобарный процесс
Изобарным называется процесс, протекающий при постоянном давлении p = const. Из уравнения состояния идеального газа слуедует:
т. е. в изобарном процессе объем газа пропорционален его абсолютной температуре.
Работа будет равна:
Количество теплоты при cp = const определяется по формуле:
Изменение энтропии будет равно:
Изотермический процесс
При изотермическом процессе температура рабочего тела остается постоянной T = const, следовательно:
т. е. давление и объем обратно пропорциональны друг другу, так что при изотермическом сжатии давление газа возрастает, а при расширении – снижается.
Работа процесса будет равна:
Так как температура остается неизменной, то и внутренняя энергия идеального газа в изотермическом процессе остается постоянной (Δu = 0) и вся подводимая к рабочему телу теплота полностью превращается в работу расширения:
При изотермическом сжатии от рабочего тела отводится теплота в количестве, равном затраченной на сжатие работе.
Изменение энтропии равно:
Адиабатный процесс
Адиабатным называется процесс изменения состояния газа, который происзодит без теплообмена с окружающей средой. Так как dq = 0, то уравнение первого закона термодинамики для адиабатного процесса будет иметь вид:
В адиабатном процессе работа расширения совершается только за счет расходования внутренней энергии газа, а при сжатии, происходящем за счет действия внешних сил, вся совершаемая ими работа идет на увеличение внутренней энергии газа.
Обозначим теплоемкость в адиабатном процессе через cад, и условие dq = 0 выразим следующим образом:
Это условие говорит о том, что теплоемкость в адиабатном процессе равна нулю (cад = 0).
и уравнение кривой адиабатного процесса (адиабаты) в p, v-диаграмме имеет вид:
В этом выражении k носит название показателя адиабаты (так же ее называют коэффициентом Пуассона).
kвыхлопных газов ДВС = 1,33
Из предыдущих формул следует:
Техническая работа адиабатного процесса (lтехн) равна разности энтальпий начала и конца процесса (i1 – i2).
Адиабатный процесс, происходящий без внутреннего трения в рабочем теле, называется изоэнтропийным. В T, s-диаграмме он изображается вертикальной линией.
Обычно реальные адиабатные процессы протекают при наличии внутреннего трения в рабочем теле, в результате чего всегда выделяется теплота, которая сообщается самому рабочему телу. В таком случае ds > 0, и процесс называется реальным адиабатным процессом.
Политропный процесс
Политропным называется процесс, который описывается уравнением:
Показатель политропы n может принимать любые значения в пределах от -∞ до +∞, но для данного процесса он является постоянной величиной.
Из уравнения политропного процесса и уравнения Клайперона можно получить выражение, устанавливающее связь между p, vи Tв любых двух точках на политропе:
Работа расширения газа в политропном процессе равна:
В случае идеального газа эту формулу можно преобразовать:
Количество подведенной или отведенной в процессе теплоты определяется с помощью первого закона термодинамики:
представляет собой теплоемкость идеального газа в политропном процессе.
При cv, k и n = const cn = const, поэтому политропный процесс иногда определят как процесс с постоянной теплоемкостью.
Политропный процесс имеет обобщающее значение, ибо охватывает всю совокупность основных термодинамических процессов.
Графическое представление политропа в p, v координатах в зависимости от показателя политропа n.
pv 0 = const (n = 0) – изобара;
pv = const (n = 1) – изотерма;
p 0 v = const, p 1/∞ v = const, pv ∞ = const – изохора;
n > 0 – гиперболические кривые,
n По материалам моего конспекта лекций по термодинамике и учебника «Основы энергетики». Автор Г. Ф. Быстрицкий. 2-е изд., испр. и доп. — М. :КНОРУС, 2011. — 352 с.
Политропный процесс | 20+ важных часто задаваемых вопросов и числовых значений
Content
Политропный процесс
Определение политропный процесс
Политропное уравнение | Политропное уравнение состояния
Политропный процесс можно определить уравнением
показатель степени n называется индексом политропы. Он зависит от материала и варьируется от 1.0 до 1.4. Это метод постоянной удельной теплоемкости, при котором учитывается поглощение тепла газом из-за повышения температуры на единицу.
Политропный индекс
- п nd закон термодинамики. Эти частные случаи используются в тепловом взаимодействии для астрофизики и химической энергии.
- п = 0: Р = С: Представляет собой изобарический процесс или процесс постоянного давления.
- n = 1: PV = C: Согласно предположению об идеальном газовом законе, PV = C представляет постоянную температуру или изотермический процесс.
- 1 0). Как и в циклах сжатия пара, тепло теряется в горячее окружение.
- п = γ: В предположении закона идеального газа, представляет собой постоянную энтропию, изэнтропический процесс или обратимый адиабатический процесс.
- γ st закон термодинамики,
Политропный против изэнтропического процесса
Политропный процесс — это термодинамический процесс, который подчиняется уравнению
Этот процесс учитывает потери на трение и фактор необратимости процесса. Это реальный процесс, за которым следует газ в определенных условиях.
Изэнтропический процесс, также известный как обратимый адиабатический процесс, представляет собой идеальный процесс, в котором не происходит передача энергии или тепла через границы системы. В этом процессе предполагается, что система имеет изолированную границу. Т.к. теплопередача равна нулю. дQ = 0
Согласно первому закону термодинамики,
Политропный процесс против адиабатического процесса
Политропный процесс — это термодинамический процесс, который подчиняется уравнению
Этот процесс учитывает потери на трение и фактор необратимости процесса. Это реальный процесс, за которым следует газ в определенных условиях.
Адиабатический процесс — это особое и специфическое состояние политропного процесса, при котором.
Подобно изэнтропическому процессу, в этом процессе также не происходит передачи энергии или тепла через границы системы. В этом процессе предполагается, что система имеет изолированную границу.
Политропная эффективность
«Политропический КПД, точно определяемый как отношение идеальной работы сжатия для изменения перепада давления в многоступенчатом компрессоре к фактической работе сжатия при изменении перепада давления в многоступенчатом компрессоре».
Проще говоря, это изоэнтропическая эффективность процесса для бесконечно малой ступени многоступенчатого компрессора.
Где, γ = индекс адиабаты
Pd = Давление нагнетания
Ps = Давление всасывания
Td = Температура подачи
Ts = Температура всасывания
Политропная голова
Политропный напор можно определить как напор, создаваемый центробежным компрессором при политропном сжатии газа или воздуха. Величина развиваемого давления зависит от плотности сжатого газа, и это зависит от изменения плотности газа.
γ = индекс адиабаты
zсредний = Средний коэффициент сжимаемости
η = политропная эффективность
Pd = Давление нагнетания
Ps = Давление всасывания
S = удельный вес газа
Ts = Температура всасывания
Политропный процесс для воздуха | Политропный процесс для идеального газа
Считается, что воздух является идеальным газом, и поэтому законы идеального газа применимы к воздуху.
………………………. Соотношение между давлением [P] и объемом [V]
………………………. Связь между объемом [В] и температурой [Т]
………………………. Связь между давлением [P] и температурой [T]
Примеры политропных процессов
1. Рассмотрим политропный процесс с индексом политропы. п = (1.1). Начальные условия: P1 = 0, В1 = 0 и заканчивается на P2= 600 кПа, В2 = 0.01 м 3 . Оцените проделанную работу и теплоотдачу.
Ответ: Работы, выполненные политропным процессом, предоставлены
Теплопередача определяется выражением
2. Поршневой цилиндр содержит кислород при 200 кПа объемом 0.1 м. 3 и при 200 ° С. Масса добавляется так, чтобы газ сжимался с PV. 1.2 = постоянная до конечной температуры 400 ° C. Подсчитайте проделанную работу.
Ответ: Выполненная политропная работа определяется
3. Рассмотрим аргон при 600 кПа, 30 ° C, сжатый до 90 ° C в политропном процессе с n = 1.33. Найдите проделанную работу на Газе.
Ответ: Выполненная политропная работа определяется
для аргона при 30 ° C составляет 208.1 Дж / кг. K
Принимая m = 1 кг
4. Предположим, что масса 10 кг ксенона хранится в баллоне при 500 К, 2 МПа, расширение представляет собой политропный процесс (n = 1.28) с конечным давлением 100 кПа. Посчитайте проделанную работу. Учтите, что система имеет постоянную удельную теплоемкость.
Ответ: Выполненная политропная работа определяется
для ксенона при 30 ° C — 63.33 Дж / кг. K
Принимая m = 10 кг
5. Рассмотрим цилиндр-поршень с начальным объемом 0.3, содержащий 5 кг газообразного метана при давлении 200 кПа. Газ сжимают политропно (n = 1.32) до давления 1 МПа и объема 0.005. Рассчитайте теплопередачу во время процесса.
Ответ: Политропная теплопередача определяется
6. Примите во внимание цилиндр-поршень, содержащий 1 кг метана при 500 кПа, 20 ° C. Газ политропно сжимают до давления 800 кПа. Рассчитайте теплопередачу с показателем n = 1.15.
Ответ: Политропная теплопередача определяется
Мы знаем, что R для метана = 518.2 Дж / кг. K
7. 1 кг гелия хранится в системе поршень-цилиндр при 303 К, 200 кПа сжимается до 400 К в обратимом политропном процессе с показателем степени n = 1.24. Гелий является идеальным газом, поэтому удельная теплоемкость будет фиксированной. Найдите работу и теплопередачу.
Ответ: Выполненная политропная работа определяется
R для гелия составляет 2077.1 Дж / кг.
Политропная теплопередача определяется выражением
8. Предположите, что воздух хранится в баллоне объемом 0.3 литра при 3 МПа, 2000 К. Воздух расширяется в соответствии с обратимым политропным процессом с показателем степени n = 1.7, объемное соотношение в этом случае составляет 8: 1. Рассчитайте политропную работу для процесса и сравните ее с адиабатической работой, если процесс расширения следует за обратимым адиабатическим расширением.
Ответ: Нам дается
Соотношение между давлением [P] и объемом [V]
Выполненная политропная работа определяется выражением
Проделанная адиабатическая работа определяется выражением
Для процесса расширения Работа, выполняемая посредством обратимого адиабатического процесса, больше, чем Работа, выполняемая посредством обратимого политропного процесса.
9. В закрытом контейнере содержится 200 л газа при 35 ° C, 120 кПа. Газ сжимается в политропном процессе до температуры 200 ° C, 800 кПа. Найти политропную работу, совершаемую воздухом для n = 1.29.
Ответ: соотношение между давлением [P] и объемом [V]
Выполненная политропная работа определяется выражением
10. Масса 12 кг газообразного метана при 150 ° C, 700 кПа подвергается политропному расширению с n = 1.1 до конечной температуры 30 ° C. Найти теплопередачу?
Ответ: Мы знаем, что R для метана = 518.2 Дж / кг. K
Политропная теплопередача определяется выражением
11. Узел цилиндр-поршень содержит R-134a при 10 ° C; объем 5 литров. Охлаждающая жидкость сжимается до 100 ° C, 3 МПа в соответствии с обратимым политропным процессом. рассчитать проделанную работу и теплоотдачу?
Ответ: Мы знаем, что R для R-134a = 81.49 Дж / кг. K
Выполненная политропная работа определяется выражением
Политропная теплопередача определяется выражением
12. Является ли политропный процесс изотермическим по своей природе?
Ответ: Когда n становится 1 для политропного процесса: согласно предположению об идеальном газовом законе, PV = C представляет постоянную температуру или изотермический процесс.
13. Обратим ли политропный процесс?
Ответ: политропные процессы внутренне обратимы. Вот несколько примеров:
п = 0: Р = С: Представляет собой изобарический процесс или процесс постоянного давления.
n = 1: PV = C: Согласно предположению об идеальном газовом законе, PV γ = C представляет собой постоянную температуру или изотермический процесс.
п = γ: В предположении закона идеального газа, представляет собой постоянную энтропию, изэнтропический процесс или обратимый адиабатический процесс.
n = Бесконечность: Представляет собой изохорный процесс или процесс постоянного объема.
14. Адиабатический политропный процесс?
Ответ: когда п = γ: В предположении закона идеального газа PV γ = C, представляет постоянную энтропию или изэнтропический процесс или обратимый адиабатический процесс.
14. Что такое политропная эффективность?
Ответ: Политропический КПД можно определить как отношение идеальной работы сжатия к фактической работе сжатия при изменении перепада давления в многоступенчатом компрессоре. Проще говоря, это изоэнтропическая эффективность процесса для бесконечно малой ступени многоступенчатого компрессора.
Проще говоря, это изоэнтропическая эффективность процесса для бесконечно малой ступени многоступенчатого компрессора.
Где, γ = индекс адиабаты
Pd = Давление нагнетания
Ps = Давление всасывания
Td = Температура подачи
Ts = Температура всасывания
15. Что такое гамма в политропном процессе?
Ответ: В политропном процессе, когда п = γ: В предположении закона идеального газа PV γ = C, представляет постоянную энтропию или изэнтропический процесс или обратимый адиабатический процесс.
16. что такое политропный процесс?
Ответ: Политропный процесс можно определить уравнением
показатель степени n называется индексом политропы. Он зависит от материала и варьируется от 1.0 до 1.4. Его также называют процессом с постоянной удельной теплотой, при котором тепло, поглощаемое газом, учитываемое из-за повышения температуры на единицу, является постоянным.
17. Какие выводы можно сделать для политропного процесса с n = 1?
Ответ: когда п = 1: PV n = C : Согласно предположению об идеальном газе, закон становится PV = C представляет собой постоянную температуру или изотермический процесс.
18. Что такое неполитропный процесс?
Ответ: Политропный процесс можно определить уравнением PV n = C показатель степени n называется индексом политропы. Когда,
- п 0). Как и в циклах сжатия пара, тепло теряется в горячее окружение.
- п = γ: В предположении закона идеального газа PV γ = C представляет постоянную энтропию или изэнтропический процесс или обратимый адиабатический процесс.
- γn0). Как и в циклах сжатия пара, тепло теряется в горячее окружение. Изменение температуры происходит из-за изменения внутренней энергии, а не подводимого тепла. Произведенная работа превышает количество поданного или добавленного тепла. Таким образом, даже если при политропном расширении добавляется тепло, температура газа снижается.
21. В политропном процессе, когда PV n = константа, температура тоже постоянна?
Ответ: В политропном процессе, когда PV n = постоянная, температура остается постоянной только при показателе политропы n = 1. Для n = 1: PV = C: Согласно предположению об идеальном газовом законе, PV = C представляет постоянную температуру или изотермический процесс.
источники:
http://energoworld.ru/theory/osnovnyie-termodinamicheskie-protsessyi/
http://ru.lambdageeks.com/polytropic-process/