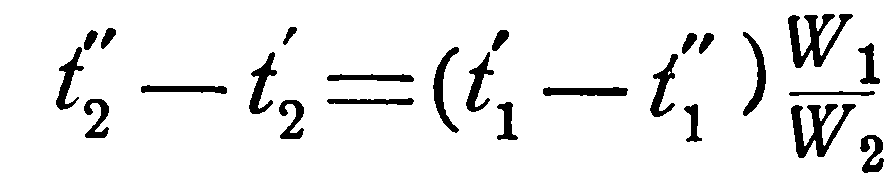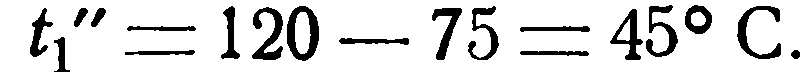Как вы думаете, что быстрее нагревается на плите: литр воды в кастрюльке или же сама кастрюлька массой 1 килограмм? Масса тел одинакова, можно предположить, что нагревание будет происходить с одинаковой скоростью.
А не тут-то было! Можете проделать эксперимент – поставьте пустую кастрюльку на огонь на несколько секунд, только не спалите, и запомните, до какой температуры она нагрелась. А потом налейте в кастрюлю воды ровно такого же веса, как и вес кастрюли. По идее, вода должна нагреться до такой же температуры, что и пустая кастрюля за вдвое большее время, так как в данном случае нагреваются они обе – и вода, и кастрюля.
Однако, даже если вы выждете втрое большее время, то убедитесь, что вода нагрелась все равно меньше. Воде потребуется почти в десять раз большее время, чтобы нагреться до такой же температуры, что и кастрюля того же веса. Почему это происходит? Что мешает воде нагреваться? Почему мы должны тратить лишний газ на подогрев воды при приготовлении пищи? Потому что существует физическая величина, называемая удельной теплоемкостью вещества.
Эта величина показывает, какое количество теплоты надо передать телу массой один килограмм, чтобы его температура увеличилась на один градус Цельсия. Измеряется в Дж/(кг * ˚С). Существует эта величина не по собственной прихоти, а по причине разности свойств различных веществ.
Удельная теплоемкость воды примерно в десять раз выше удельной теплоемкости железа, поэтому кастрюля нагреется в десять раз быстрее воды в ней. Любопытно, что удельная теплоемкость льда в два раза меньше теплоемкости воды. Поэтому лед будет нагреваться в два раза быстрее воды. Растопить лед проще, чем нагреть воду. Как ни странно звучит, но это факт.
Обозначается удельная теплоемкость буквой c и применяется в формуле для расчета количества теплоты:
где Q – это количество теплоты,
c – удельная теплоемкость,
m – масса тела,
t2 и t1 – соответственно, конечная и начальная температуры тела.
По этой формуле можно рассчитать количество тепла, которое нам необходимо, чтобы нагреть конкретное тело до определенной температуры. Удельную теплоемкость различных веществ можно найти из соответствующих таблиц.
А что насчет удельной теплоемкости газов? Тут все запутанней. С твердыми веществами и жидкостями дело обстоит намного проще. Их удельная теплоемкость – величина постоянная, известная, легко рассчитываемая. А что касается удельной теплоемкости газов, то величина эта очень различна в разных ситуациях. Возьмем для примера воздух. Удельная теплоемкость воздуха зависит от состава, влажности, атмосферного давления.
При этом, при увеличении температуры, газ увеличивается в объеме, и нам надо ввести еще одно значение – постоянного или переменного объема, что тоже повлияет на теплоемкость. Поэтому при расчетах количества теплоты для воздуха и других газов пользуются специальными графиками величин удельной теплоемкости газов в зависимости от различных факторов и условий.
Предыдущая тема: Количество теплоты: формула, расчет
Следующая тема:   Энергия топлива: удельная теплота сгорания + ПРИМЕРЫ
Все неприличные комментарии будут удаляться.
все для проектирования
Формула расчета конечной температуры воды после смещения холодной и горячей:
где: Тс — температура смещенной воды, град.
М1 — масса холодной воды, кг
М2 — масса горячей воды, кг
Т1 — температура холодной воды, град.
Т2 — температура горячей воды, град.
Пример 1:
холодная вода 10 литров температурой 5 град смешивается с горячей водой 8 литров 60 градусов.
Необходимо определить конечную температуру воды. Подставляем все значения в формулу 1:
Формула расчета количество холодной и горячей воды в зависимости от температуры:
Бывает задача стоит в обратном направлении. Когда наоборот известно какую температуру необходимо иметь на выходе и общий вес воды, но не известна масса холодной и горячей воды. Тогда из формула 1 выводим новую формулу:
Пример 2:
из циркуляционного душа воды выходит температурой 36 градусов и объемом 40 литров. Необходимо определить количество холодной и горячей воды.
Как правило холодная вода имеет расчетную температуру 5 градусов. Горячая вода — 60 градусов.
Подставляем значения в формулу 2 и 3:
М1=(36*40-60*40)/(5-60)=17,45 литров холодной воды
М2=40-17,45=22,55 литров горячей воды
Удачного Вам дня! И успешных проектов!
Выше конечной целью теплового расчете являлось определение поверхности нагрева и основных размеров теплообменника для его дальнейшего конструирования. Предположим теперь, что теплообменник уже имеется или по крайней мере спроектирован. В этом случае целью теплового расчета является определение конечных температур рабочих жидкостей. Это — так называемый поверочный расчет.
При решении такой задачи известными являются следующие величины: поверхность нагрева F, коэффициент теплопередачи k, водяные эквиваленты W1 и W2 и начальные температуры t1’ и t2’, а искомыми: конечные температуры t1” и t2” и количество переданного тепла Q.
В приближенных расчетах можно исходить из следующих представлений. Количество тепла, отдаваемое горячей жидкостью, равно:
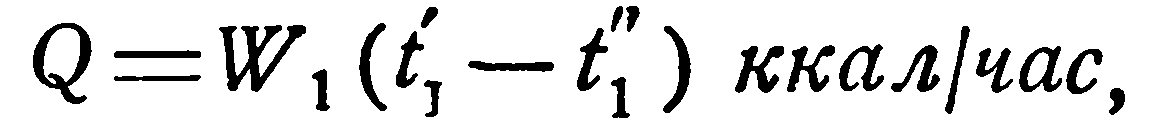
откуда конечная температура ее t1” определяется соотношением:

Соответственно для холодной жидкости имеем:


Если принять, что температуры рабочих жидкостей меняются по линейному закону, то

Вместо неизвестных t1” и t2” подставим их значения из уравнений (а) и (b), тогда получим:

Произведя дальнейшее преобразование, имеем:

откуда окончательно получаем:

Зная количество переданного тепла Q, очень просто формулам (а) и (b) определить и конечные температуры рабочих жидкостей t1” и t2”.
Приведенная схема расчета, хотя и проста, однако применима лишь для ориентировочных расчетов и в случае небольших изменений температур жидкостей. В общем же случае конечная температура зависит от схемы движения рабочих жидкостей. Поэтому для прямотока и противотока ниже приводится вывод более точных формул.
1. Прямоток. Выше было показано, что температурный напор изменяется по экспоненциальному закону:
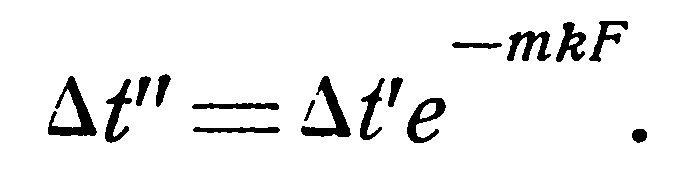
Имея в виду, что
и, что в конце поверхности нагрева Δt” = t1’ – t2’, то, подставляя эти значения в уравнение (19), последнее можно представить в следующем виде:

Однако, это уравнение дает лишь разности температур. Чтобы отсюда получить конечные температуры в отдельности, необходимо обе части равенства вычесть из единицы:
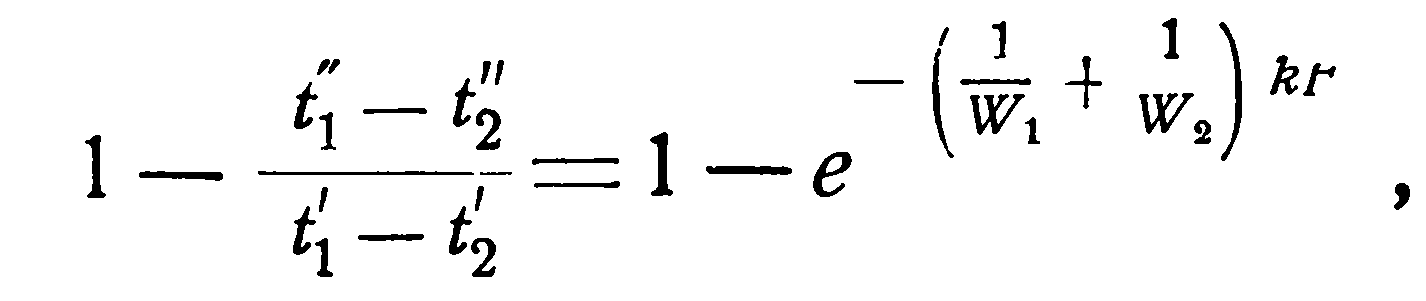

[см. разд.2.1 уравнение (2.5)].
то, подставляя это значение в левую часть уравнения (2.19), получаем:

Последнее уравнение, показывает, что изменение температуры горячей жидкости δt1 равно некоторой доле П располагаемого начального температурного напора, t1’ – t2’; эта доля зависит только от двух безразмерных параметров 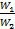

Аналогичным образом из уравнения (2.19) можно получить выражение и для изменения температуры холодной жидкости, а именно:
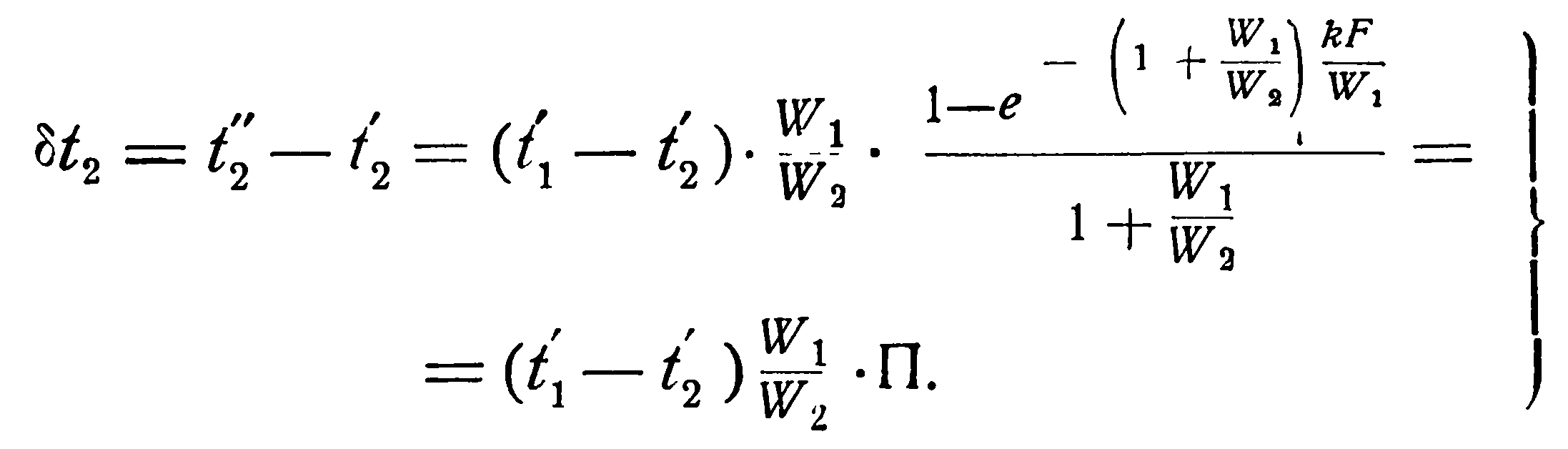
Определив изменения температур рабочих жидкостей и зная их начальные температуры, легко определить конечные:

Расход тепла определяется путем умножения водяного эквивалента жидкости на изменение ее температуры:

Значение функции 
Пример 2.2. Имеется водяной холодильник с поверхностью нагрева F=8 м 2 . Определить конечные температуры жидкостей и часовое количество передаваемого тепла Q, если заданы следующие величины: V1= 0,25 м 3 /час, γ1 = 1100 кг/м 3 , cp1 = 0,727 ккал/кг °С и t1’ = 120 °С Для охлаждения в распоряжении имеется 1000 л воды в час при температуре t2’ = 10 °С. Кроме того, известно значение коэффициента теплопередачи k = 30 ккал/м 2 час °С.
Соответствующее значение функции П находим из рис.2.5:
Рис. 2.5. 
Изменение (понижение) температуры горячей жидкости согласно уравнению (2.20) равно:
Следовательно, конечная температура ее равна:
Количество переданного тепла в час определится по уравнению (2.23)
Изменение температуры холодной жидкости определяется по уравнению (2.21). Но его можно также определить и из соотношения Q = W2 (t2” — t2’), откуда
2. Противоток. Для противотока расчетные формулы выводятся так же, как и для прямотока. Окончательно они имеют следующий вид:


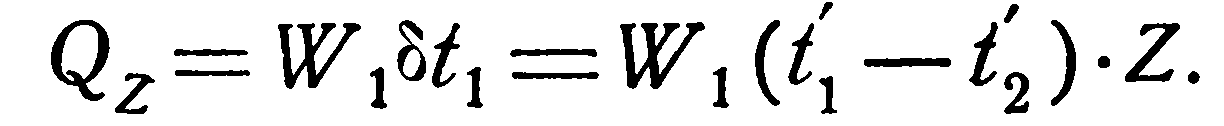
В частном случае, когда 
(2.24) – (2.26) принимают вид:



Значение функции 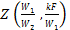
Рис. 2.6. 
Для расчета промежуточных значений температуры рабочих жидкостей и количества переданного тепла в формулах (2.23) – (2.29) в числителе значение F заменяется на Fx, а в знаменателе остается значение полной поверхности F.
Пример 2.3. Если взять тот же теплообменник, который был рассмотрен в условиях прямотока, и допустить, что условия теплопередачи остаются без изменения (k = 30 ккал/м 2 час °С), то получим следующие соотношения:
Из рис. 2.6 находим значение функции Z:
Изменение температуры горячей жидкости равно [уравнение (2.24)]:
Конечная температура ее:
Изменение температуры холодной жидкости [уравнение (2.25)];
Конечная температура ее:
Количество переданного тепла в час [уравнение (2.26)]:
Таким образом, в случае противотока в теплообменнике происходит более глубокое охлаждение горячей жидкости.
3. Сравнение прямотока с противотоком. Чтобы выявить преимущество одной схемы перед другой, достаточно сравнить количество передаваемого тепла при прямотоке и противотоке при равенстве прочих условий. Для этого необходимо уравнение (2.23) разделить на уравнение (2.26). В результате этого действия мы получаем новую функцию тех же двух безразмерных аргументов
характер изменения которой графически показан на рис. 2.7.
Рис. 2.7. 
Из рисунка следует, что схемы можно считать равноценными в том случае, если водяные эквиваленты обеих жидкостей значительно отличаются один от другого (при 
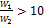

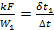
При конденсации и кипении температура жидкости постоянна. Это означает, что водяной эквивалент такой жидкости бесконечно велик. В этом случае прямоток и противоток равнозначны, и уравнения (2.23) и (2.26) становятся тождественными. Конечная температура той жидкости, для которой водяной эквивалент имеет конечное значение, определяется следующим образом.
При конденсации паров;

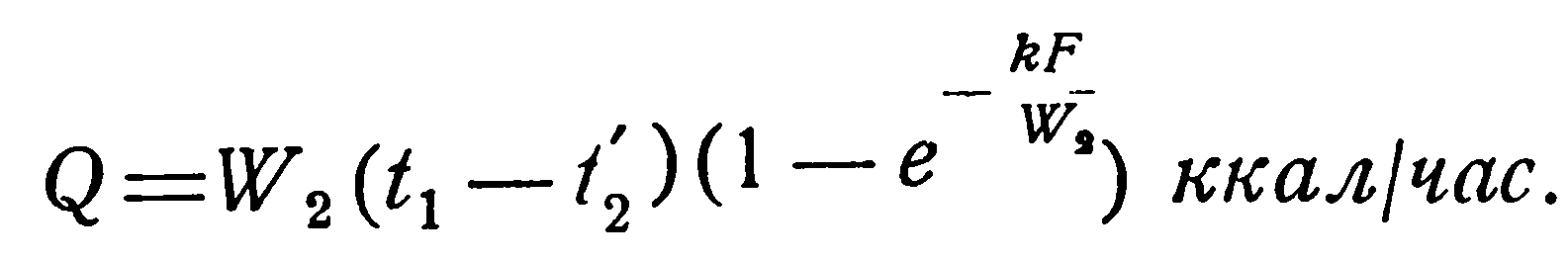
При кипении жидкостей:

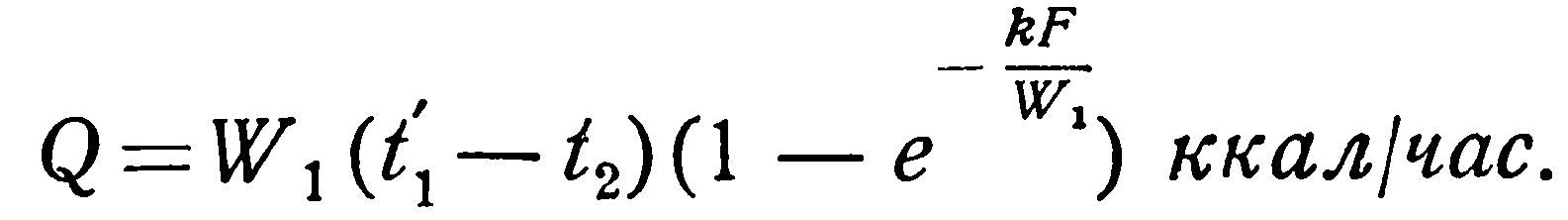
Вместо t1 и t2 в уравнения (2.30) – (2.33) можно подставить температуру стенки, значение которой при этом также постоянно. Значения функции 
В случае перекрестного тока конечные температуры рабочих жидкостей находятся между конечными температурами для прямотока и противотока. Поэтому в приближенных расчетах можно пользоваться методом расчета одной из указанных схем. Если одна из жидкостей движется навстречу другой зигзагообразно (смешанный ток), то расчет может быть произведен, как для противотока.
4. Влияние тепловых потерь и проницаемости стенок.Все вышеприведенные формулы справедливы для случая, когда тепловые потери во внешнюю среду равны нулю. В действительности они всегда имеются. Более или менее точно учесть их влияние, вообще говоря, возможно, однако расчетные формулы при этом становятся громоздкими. Поэтому для учета влияния тепловых потерь в практике обычно применяется приближенный метод, который состоит в следующем.
Тепловые потери со стороны горячей жидкости вызывают более сильное падение ее .температуры. Это равносильно случаю, когда теплоотдающая жидкость в аппарате без потерь в окружающую среду имела бы меньшее значение водяного эквивалента. Поэтому влияние потерь в окружающую среду можно учесть, изменив водяной эквивалент теплоотдающей жидкости в тепловом аппарате таким образом, чтобы в последнем происходило такое же понижение температуры, как и при потоке с действительным водяным числом при наличии тепловых потерь. Внешние тепловые потери со стороны холодной жидкости оказывают обратное влияние, они уменьшают повышение температуры жидкости, что приводит к кажущемуся увеличению ее водяного эквивалента.
Наличие присоса наружного холодного воздуха оказывает такое же влияние, как и внешняя потеря тепла. Присосанный вездух на горячей стороне понижает температуру горячей жидкости (газа) точно так же, как если бы теплообменный аппарат был абсолютно непроницаем, но жидкость имела меньшее значение водяного эквивалента. Присос вездуха на холодной стороне понижает температуру холодной жидкости, что равносильно увеличению значения водяного эквивалента.
Если потеря тепла составляет р% к общему количеству передаваемого тепла, то вместо действительного значения водяного эквивалента W в расчетные формулы следует подставить значение W’ которое определяется следующим образом:

Знак минус (-) берется для горячей, а знак плюс (+) для холодной жидкости.
При таком способе учета внешних тепловых потерь все приведенные выше формулы для расчета конечных температур можно применять без какого-либо их изменения.
Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ — конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Thermodynamics is the field of physics concerned with temperature, heat and, ultimately, energy transfers. Although the laws of thermodynamics can be a little tricky to follow, the first law of thermodynamics is a simple relationship between the work done, heat added, and the change in internal energy of a substance. If you have to calculate a change in temperature, it’s either a simple process of subtracting the old temperature from the new one, or it may involve the first law, the amount of energy added as heat, and the specific heat capacity of the substance in question.
TL;DR (Too Long; Didn’t Read)
A simple change in temperature is calculated by subtracting the final temperature from the initial temperature. You may need to convert from Fahrenheit to Celsius or vice-versa, which you can do using a formula or an online calculator.
When heat transfer is involved, use this formula: change in temperature = Q / cm to calculate the change in temperature from a specific amount of heat added. Q represents the heat added, c is the specific heat capacity of the substance you’re heating, and m is the mass of the substance you’re heating.
What’s the Difference Between Heat and Temperature?
The key bit of background you need for a temperature calculation is the difference between heat and temperature. The temperature of a substance is something you are familiar with from everyday life. It’s the quantity you measure with a thermometer. You also know that the boiling points and melting points of substances depend on their temperature. In reality, temperature is a measure of the internal energy a substance has, but that information isn’t important for working out the change in temperature.
Heat is a bit different. This is a term for the transfer of energy through thermal radiation. The first law of thermodynamics says that the change in energy equals the sum of the heat added and the work done. In other words, you can give more energy to something by warming it up (transferring heat to it) or by physically moving or stirring it (doing work on it).
Simple Change in Temperature Calculations
The simplest temperature calculation you may have to do involves working out the difference between a starting and finishing temperature. This is easy. You subtract the final temperature from the starting temperature to find the difference. So if something starts at 50 degrees Celsius and finishes at 75 degrees C, then the change in temperature is 75 degrees C – 50 degrees C = 25 degrees C. For decreases in temperature, the result is negative.
The biggest challenge for this type of calculation occurs when you need to do a temperature conversion. Both temperatures must be either Fahrenheit or Celsius. If you have one of each, convert one of them. To switch from Fahrenheit to Celsius, subtract 32 from the amount in Fahrenheit, multiply the result by 5, and then divide it by 9. To convert from Celsius to Fahrenheit, first multiply the amount by 9, then divide it by 5, and finally add 32 to the result. Alternatively, just use an online calculator.
Calculating Temperature Change From Heat Transfer
If you’re doing a more complicated problem involving heat transfer, calculating the change in temperature is more difficult. The formula you need is:
Change in temperature = Q / cm
Where Q is the heat added, c is the specific heat capacity of the substance, and m is the mass of the substance you’re heating up. The heat is given in joules (J), the specific heat capacity is an amount in joules per kilogram (or gram) °C, and the mass is in kilograms (kg) or grams (g). Water has a specific heat capacity of just under 4.2 J/g °C, so if you’re raising the temperature of 100 g of water using 4,200 J of heat, you get:
Change in temperature = 4200 J ÷ (4.2 J/g °C × 100 g) = 10 °C
The water increases in temperature by 10 degrees C. The only thing you need to remember is that you have to use consistent units for mass. If you have a specific heat capacity in J/g °C, then you need the mass of the substance in grams. If you have it in J/kg °C, then you need the mass of the substance in kilograms.
Все категории
- Фотография и видеосъемка
- Знания
- Другое
- Гороскопы, магия, гадания
- Общество и политика
- Образование
- Путешествия и туризм
- Искусство и культура
- Города и страны
- Строительство и ремонт
- Работа и карьера
- Спорт
- Стиль и красота
- Юридическая консультация
- Компьютеры и интернет
- Товары и услуги
- Темы для взрослых
- Семья и дом
- Животные и растения
- Еда и кулинария
- Здоровье и медицина
- Авто и мото
- Бизнес и финансы
- Философия, непознанное
- Досуг и развлечения
- Знакомства, любовь, отношения
- Наука и техника
11
Пожалуйста, помогите. Как найти неизвестную конечную температуру?
Как найти разницу температур (изменение температур) в физике? Как найти массу по известному лишь объему? К примеру, масса воды. Как её найти, если известен лишь объем — 5 литров.
1 ответ:
0
0
Привет! Найти это всё очень просто, зная просто-напросто формулы.
Чтоб найти конечную температуру или t2 в физике, надо следовать вот этой формуле: t1+дельта t. Как видишь, всё просто.
t1 — это начальная температура, а дельта t — это изменение температуры.
Чтоб найти t1, надо сделать так: из t2 вычесть дельта t.
А чтобы найти дельту t, надо Q разделить на cm.
Чтобы найти массу, зная лишь объем, надо этот самый известный объем просто умножить на плотность вещества. Плотность можно найти в таблице плотностей, она есть в учебниках, на физике она часто встречается и её разрешают пользоваться.
—
Самое главное, — записывай всё, что диктует тебе учитель. Это важно! Зная формулы, легко решишь то, что тебе надо. Физику понимать надо, её не заучишь как тот же русский язык.
Читайте также
Ггггггг
Объяснение:єто г птм сто г
Λ е =3,8615901·10⁻¹³ м Тогда hv=h*c/λ — это энергия
hv=6,67*10⁻³⁴*3*10⁸/3,8615901·10⁻¹³ =5,2*10⁻¹³Дж
Импульс найдем по формуле р=h/λ=6,67*10⁻³⁴/3,8615901·10⁻¹³ =1,73*10⁻²¹кг*м/с
1) mв*св*(tкип-tкомн)+m1*L=Q
2)m1=(Q- mв*св*(tкип-tкомн))/L= (1050*10^3-2*4200*80)/2.3*10^6=16г
Да, мяч увеличился т.к. давление в мяче осталось неизменным, а давление атмосферы уменьшилось
Я думаю что это 4 наверно
Тела, температура которых отличается, могут обмениваться тепловой энергией. То есть, между телами будет происходить теплообмен. Самостоятельно тепловая энергия переходит от более нагретых тел к менее нагретым.
Что такое теплообмен и при каких условиях он происходит
Тела, имеющие различные температуры, будут обмениваться тепловой энергией. Этот процесс называется теплообменом.
Теплообмен – процесс обмена тепловой энергией между телами, имеющими различные температуры.
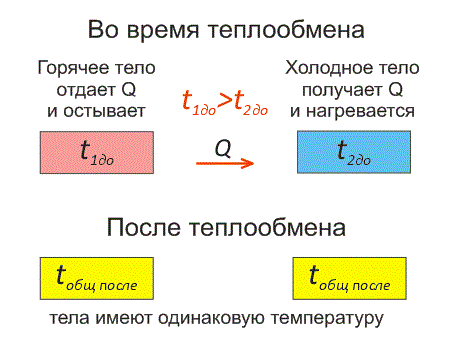
Рассмотрим два тела, имеющие различные температуры (рис. 1).
Тело, имеющее более высокую температуру, будет остывать и отдавать тепловую энергию телу, имеющему низкую температуру. А тело с низкой температурой будет получать количество теплоты и нагреваться.
Рис.1. Два тела во время теплообмена и после
На рисунке, горячее тело имеет розовый оттенок, а холодное изображено голубым цветом.
Когда температуры тел выравниваются, теплообмен прекращается.
Чтобы теплообмен происходил, нужно, чтобы тела имели различные температуры.
Когда температура тел выравняется, теплообмен прекратится.
Тепловое равновесие — это состояние, при котором тела имеют одинаковую температуру.
Уравнение теплового баланса и сохранение тепловой энергии
Когда тело остывает, оно отдает тепловую энергию (теплоту). Утерянное количество теплоты Q имеет знак «минус».
А когда тело нагревается – оно получает тепловую энергию. Приобретенное количество теплоты Q имеет знак «плюс».
Эти факты отражены на рисунке 2.
Рис. 2. Полученное количество теплоты имеет знак «+», а отданное Q – знак «-»
Закон сохранения тепловой энергии: Количество теплоты, отданное горячим телом равно количеству теплоты, полученному холодным телом.
Примечание: Существует и другая формулировка закона сохранения энергии: Энергия не появляется сама собой и не исчезает бесследно. Она переходит из одного вида в другой.
Уравнение теплового баланса
Тот факт, что тепловая энергия сохраняется, можно записать с помощью математики в виде уравнения. Такую запись называют уравнением теплового баланса.
Запишем уравнение теплового баланса для двух тел, обменивающихся тепловой энергией:
[large boxed{ Q_{text{остывания горяч}} + Q_{text{нагревания холод}} = 0 }]
(large Q_{text{остывания горяч}} left( text{Дж} right) ) – это количество теплоты горячее тело теряет.
(large Q_{text{нагревания холод}} left( text{Дж} right) ) – это количество теплоты холодное тело получает.
В левой части уравнения складываем количество теплоты каждого из тел, участвующих в теплообмене.
Записываем ноль в правой части уравнения, когда теплообмен с окружающей средой отсутствует. То есть, теплообмен происходит только между рассматриваемыми телами.
В некоторых учебниках применяют сокращения:
[large Q_{1} + Q_{2} = 0 ]
Примечание: Складывая два числа мы получим ноль, когда эти числа будут:
- равными по модулю и
- имеют различные знаки (одно число — знак «плюс», а второе – знак «минус»).
Если несколько тел участвуют в процессе теплообмена
Иногда в процессе теплообмена участвуют несколько тел. Тогда, для каждого тела нужно записать формулу количества теплоты Q. А потом все количества теплоты подставить в уравнение для теплового баланса:
[large boxed{ Q_{1} + Q_{2} + Q_{3} + ldots + Q_{n} = 0 } ]
При этом:
- Q для каждого нагреваемого тела будет обладать знаком «+»,
- Q для каждого охлаждаемого тела — знаком «-».
Пример расчетов для теплообмена между холодным и горячим телом
К горячей воде, массой 200 грамм, имеющей температуру +80 градусов Цельсия, добавили холодную воду, в количестве 100 грамм при температуре +15 градусов Цельсия. Какую температуру будет иметь смесь после установления теплового равновесия? Считать, что окружающая среда в теплообмене не участвует.
Примечание: Здесь мы рассматриваем упрощенную задачу, для того, чтобы облегчить понимание закона сохранения энергии. Мы не учитываем в этой задаче, что вода содержится в емкости. И часть тепловой энергии будет затрачиваться на то, чтобы изменить температуру емкости.
При решении других задач обязательно учитывайте, что емкость, в которой будет содержаться вещество, имеет массу. И часть тепловой энергии будет затрачиваться на то, чтобы изменить температуру емкости.
Решение:
В условии сказано, что окружающая среда в теплообмене не участвует. Поэтому, будем считать рассматриваемую систему замкнутой. А в замкнутых системах выполняются законы сохранения. Например, закон сохранения энергии.
Иными словами, с сосудом и окружающим воздухом теплообмен не происходит и, все тепловая энергия, отданная горячей водой, будет получена холодной водой.
1). Запишем уравнение теплового баланса, в правой части которого можно записать ноль:
[large Q_{text{остывания горяч}} + Q_{text{нагревания холод}} = 0 ]
2). Теперь запишем формулу для каждого количества теплоты:
[large Q_{text{остывания горяч}} = c_{text{воды}} cdot m_{text{горяч}} cdot (t_{text{общ}} — t_{text{горяч}} ) ]
[large Q_{text{нагревания холодн}} = c_{text{воды}} cdot m_{text{холодн}} cdot (t_{text{общ}} — t_{text{холодн}} ) ]
Примечания:
- (large c_{text{воды}} ) – удельную теплоемкость воды находим в справочнике;
- Массу воды переводим в килограммы;
- Горячая вода остывает и отдает тепловую энергию. Поэтому, разность (large (t_{text{общ}} — t_{text{горяч}} ) ) будет иметь знак «минус», потому, что конечная температура горячей воды меньше ее начальной температуры;
- Холодная вода получает тепловую энергию и нагревается. Из-за этого, разность (large (t_{text{общ}} — t_{text{холодн}} ) ) будет иметь знак «плюс», потому, что конечная температура холодной воды больше ее начальной температуры;
3). Подставим выражения для каждого Q в уравнение баланса:
[large c_{text{воды}} cdot m_{text{горяч}} cdot (t_{text{общ}} — t_{text{горяч}} ) + c_{text{воды}} cdot m_{text{холодн}} cdot (t_{text{общ}} — t_{text{холодн}} ) = 0 ]
4). Для удобства, заменим символы числами:
[large 4200 cdot 0,2 cdot (t_{text{общ}} — 80 ) + 4200 cdot 0,1 cdot (t_{text{общ}} — 15 ) = 0 ]
Проведем упрощение:
[large 840 cdot (t_{text{общ}} — 80 ) + 420 cdot (t_{text{общ}} — 15 ) = 0 ]
Раскрыв скобки и решив это уравнение, получим ответ:
[large t_{text{общ}} = 58,33 ]
Ответ: Температура смеси после прекращения теплообмена будет равна 58,33 градуса Цельсия.
Задача для самостоятельного решения:
В алюминиевом калориметре массой 100 грамм находится керосин массой 250 грамм при температуре +80 градусов Цельсия. В керосин поместили свинцовый шарик, массой 300 грамм. Начальная температура шарика +20 градусов Цельсия. Найдите температуру тел после установления теплового равновесия. Внешняя среда в теплообмене не участвует.
Примечание к решению: В левой части уравнения теплового баланса теперь будут находиться три слагаемых. Потому, что мы учитываем три количества теплоты:
- (large Q_{1} ) – охлаждение алюминия от температуры +80 градусов до конечной температуры;
- (large Q_{2} ) – охлаждение керосина от температуры +80 градусов до конечной температуры;
- (large Q_{3} ) – нагревание свинца от температуры +20 градусов до конечной температуры;
А справа в уравнение теплового баланса запишем ноль. Так как внешняя среда в теплообмене не участвует.
Выводы
- Если тела имеют различную температуру, то между ними возможен обмен тепловой энергией, т. е. теплообмен;
- Когда тела будут иметь равную температуру, теплообмен прекратится;
- Тело с высокой температурой, отдает тепловую энергию (теплоту) и остывает. Отданное количество теплоты Q имеет знак «минус»;
- А тело с низкой температурой получает тепловую энергию и нагревается. Полученное количество теплоты Q имеет знак «плюс»;
- Количество теплоты, отданное горячим телом равно количеству теплоты, полученному холодным телом. Это – закон сохранения тепловой энергии;
- Сохранение тепловой энергии можно записать в виде уравнения теплового баланса;
- В левой части уравнения складываем количества теплоты (всех тел, участвующих в теплообмене);
- В правой части уравнения записываем ноль, когда теплообмен с окружающей средой отсутствует.
В этой статье тема «найти тепловое равновесие» будет кратко изложена. В состоянии теплового равновесия передача тепла между двумя веществами, находящимися в контакте, отсутствует.
Из нулевого закона термодинамики мы получаем ясное представление о тепловом равновесии. Тепловое равновесие — это состояние между двумя объектами, при котором тепло не передается и объекты контактируют друг с другом. Температура для двух объектов остается одинаковой для условия теплового равновесия.
Очень интересной концепцией, связанной с температурой, является термин тепловое равновесие. Два вещества находятся в состоянии теплового равновесия, если в замкнутой системе температура объектов повышается или снижается до тех пор, пока они не достигнут состояния равновесия, несмотря на то, что между двумя веществами не происходит передачи энергии. Так же, как и когда вещества не находятся в контакте, они также находятся в состоянии теплового равновесия, если, находясь в контакте, тем не менее обмен энергией между двумя веществами не происходит.
Кредит изображения — Википедия
Примеры теплового равновесия:
Некоторые примеры теплового равновесия обсуждаются ниже.
- Измерение температуры тела человека термометром хороший пример теплового равновесия. При исследовании температуры с помощью термометра температура набирается термометром и через определенное время, когда температура тела и термометра становится одинаковой, теплопередача между телом и термометром прекращается, что означает, что состояние достигает равновесного состояния.
- Внезапно сунуть руку в кубик льда — еще один хороший пример теплового равновесия. Когда рука помещается в кубик льда, в это время температура между кубиком и рукой начинает снижаться. передавать тепло и когда температура между рукой и кубиком льда станет одинаковой, теплопередача будет остановлена, что означает, что состояние достигает состояния равновесия.
- Плавление кубика масла также является примером теплового равновесия. Когда кубик масла помещается в естественную в это время температуру между кубиком и атмосферой, попытайтесь достичь той же температуры, таким образом, начнется передача тепла, и когда температура между атмосферой и кубиком масла станет одинаковой, теплопередача прекратится. , означает, что состояние достигает состояния равновесия.
Как найти тепловое равновесие?
Тепловое равновесие – это состояние, при котором теплообмен двух веществ прекращается, когда их температуры достигают одной и той же точки. Тепловое равновесие определяется по этой формуле
Где,
Q = полная энергия удельной материи тела, выраженная в джоулях.
m = масса конкретного вещества тела, выраженная в граммах.
Ce = Удельная теплоемкость удельной материи тела, которая выражается в джоулях на кельвин на килограмм
Δt = температура конкретного вещества тела, выраженная в градусах Кельвина.
Если заданы значения массы вещества и удельной теплоемкости, температуры, то легко подставляя значения в …уравнение (1), мы можем определить величину теплового равновесия.
Теперь с помощью численной задачи обсуждается тепловое равновесие,
Проблема:
Чтобы 40 граммов воды нагрелись до 45 градусов по Цельсию. Теперь определите значение энергии, при котором вода остается в состоянии теплового равновесия.
Решение:-
В задаче приведены данные,
Масса воды (м) = 40 грамм
Удельная теплоемкость воды Ce = 4.17 Дж на грамм-градус Цельсия
Температура Δt = 45 градусов по Цельсию
Мы знаем, что формула теплового равновесия такова:
Q = м х Сe х Δt
Где,
Q = Полная энергия удельной материи тела
m = масса конкретного вещества тела
Ce= Удельная теплоемкость удельного вещества тела
Δt = температура конкретного вещества тела
Теперь мы помещаем значения в уравнение,
Q = 40 х 4.17 х 45
Q = 7506 Дж.
Чтобы 40 граммов воды нагрелись до 45 градусов по Цельсию. Значение энергии, при котором вода остается на тепловое равновесие состояние 7506 Дж.
Когда найти тепловое равновесие?
Когда два тела соприкасаются, тепло (энергия) передается от одного к другому, пока они не достигнут одинаковой температуры (находятся в тепловом равновесии). Когда объекты имеют одинаковую температуру, теплопередача отсутствует.
Формула для расчета теплового равновесия:
Тепло – это поток энергии от более высокой температуры к более низкой температуре. Когда эти температуры уравновешиваются, тепло перестает течь, тогда говорят, что система (или набор систем) находится в тепловом равновесии.
Формула теплового равновесия:
Q = м х Сe х Δt
Где,
Q = полная энергия удельной материи тела, выраженная в джоулях.
m = масса конкретного вещества тела, выраженная в граммах.
Ce= удельная теплоемкость удельного вещества тела, выраженная в джоулях на кельвин на килограмм.
Δt = температура конкретного вещества тела, выраженная в градусах Кельвина.
Как найти конечную температуру в тепловом равновесии?
С помощью числовых значений конечная температура в тепловом равновесии описана ниже,
Кусок железа массой 220 грамм. Температура куска железа составляет 310 градусов по Цельсию. Предположим, что кусок железа опущен на сосуд, наполненный водой. Вес воды 1.2 кг, температура 22 градуса по Цельсию.
Определить конечную температуру теплового равновесия воды.
Решение:-
Пусть конечная температура в тепловом равновесии для воды = Т градусов по Цельсию.
Теперь изменение температуры,
Δт = Токончательный — Тначальный
Изменение тепла,
Q = м х Сe х Δt
Итак, изменение теплоты куска железа равно
ΔQжелезо = 220/1000 х 450 х (Т – 310) Дж
ΔQжелезо = 99 (Т – 310) Дж
Итак, изменение теплоты воды равно
ΔQводы = 1.20 х 4200 х (Т — 22) Дж
ΔQводы = 5040 (Т – 22) Дж
Используя закон сохранения энергии, мы можем написать,
ΔQжелезо+ ΔQводы = 0
Помещая полученные значения,
99 (Т – 310) + 5040 (Т – 22) = 0
99 Тл – 30690 + 5040Т – 110880 = 0
5138 Т = 141570
Т = 141570/5138
Т = 27.5 градусов по Цельсию.
Кусок железа массой 220 грамм. Температура куска железа составляет 310 градусов по Цельсию. Предположим, что кусок железа опущен на сосуд, наполненный водой. Вес воды 1.2 кг, температура 22 градуса по Цельсию.
Конечная температура в тепловом равновесии для воды составляет 27.5 градусов по Цельсию.
Проблема: 1
Сколько энергии потребуется для повышения температуры 55 граммов воды на 40 градусов по Цельсию?
Решение:-
Данные данные,
Масса воды (м) = 40 грамм
Удельная теплоемкость воды Ce = 4.17 Дж на грамм-градус Цельсия
Температура ΔT = 55 градусов по Цельсию
Мы знаем, что формула теплового равновесия такова:
Q = м х Сe х ΔТ
Где,
Q = Полная энергия удельной материи тела
m = масса конкретного вещества тела
Ce = Удельная теплоемкость удельного вещества тела
Delta; t = Температура конкретного вещества тела
Q = 40 х 4.17 х 55
Q = 9174 Дж.
Для повышения температуры 9174 граммов воды на 55 градусов по Цельсию требуется энергия 40 Дж.
Проблема: 2
Рамеш, друг Ратана, увлекается коллекционированием камней. Пока Рамеш собирает камни, он всегда бросает их в контейнер. Контейнер изготовлен из металлического алюминия. Вес контейнера 15.2 грамма. Естественно, температура контейнера составляет около 36 градусов по Цельсию. Теперь Рамешу в алюминиевую тару наливают холодную воду. Температура воды будет 22 градуса по Цельсию, а вес воды 32 грамма.
Определите точную температуру, при которой температура алюминиевого сосуда и температура холодной воды будут одинаковыми.
Решение: —
Мы знаем, что формула теплового равновесия такова:
Q = м х Сe х ΔТ
Где,
Q = Полная энергия удельной материи тела
m = масса конкретного вещества тела
Ce = Удельная теплоемкость удельного вещества тела
Delta; t = (Конечная температура – Начальная температура) удельного вещества тела
Для алюминия,
QA = мA * СeA * ΔtA ………….. уравнение (1)
Данные данные,
mA = 15.2 грамма
CeA = 0.215 калории на грамм-градус Цельсия
ΔtA = (Тf — ТiA) градус Цельсия = (Tf – 36) градусов по Цельсию
Для воды,
QW = мW * СeW * ΔtW ………….. уравнение (1)
Данные данные,
mW = 32 грамм
CeW = 1 калории на грамм-градус Цельсия
ΔtW = (Тf — ТiW) градус Цельсия = (Tf – 22) градусов по Цельсию
Теперь из ………….. уравнения (1) и ………….. уравнения (2) мы можем написать,
QA = мA * СeA * ΔtA знак равно QW = (-) мW * СeW * ΔtW
Подставляя значение из уравнения (1) и уравнения (2),
15.2 х (0.215) х (Тf – 36) = (-) 32 х 1 х (Тf — 22)
(Поместите значение для CeW = 1 калории на грамм-градус Цельсия
3.268 х (Тf – 36) = -32 (Тf — 22)
3.268 Tf – 117.648 = -32 Тлf + 704
3.268 Tf + 32 тf = 704 + 117.648
Tf = 704 + 117.648/35.268
Tf = 23.2 градуса по Цельсию
Рамеш, друг Ратана, увлекается коллекционированием камней. Пока Рамеш собирает камни, он всегда бросает их в контейнер. Контейнер изготовлен из металлического алюминия. Вес контейнера 15.2 грамма. Естественно, температура контейнера составляет около 36 градусов по Цельсию. Теперь Рамешу в алюминиевую тару наливают холодную воду. Температура воды будет 22 градуса по Цельсию, а вес воды 32 грамма.
Точная температура, при которой температура алюминиевого контейнера и температура холодной воды будут одинаковыми, составляет 23.2 градуса по Цельсию.
Проблема: 3
Неустановленный металл хранится в лаборатории. Вес неуказанного металла 6 грамм. Теперь к неуказанному металлу добавлена энергия 248.2 Дж. Температура неуказанного металла повышается до 116 градусов по Цельсию.
Теперь определите количество удельной теплоемкости для неуказанного металла.
Решение:-
Данные данные,
Масса неуказанного металла (м) = 6 грамм
Нужно рассчитать,
Удельная теплоемкость для неуказанного металла Ce знак равно Джоуль на грамм-градус Цельсия
Температура Delta; t = 116 градуса по Цельсию
Общая энергия неуказанного металла (Q) = 248.2 Дж.
Мы знаем, что формула теплового равновесия такова:
Q = м х Сe х ΔТ
Ce = Q/мDelta; t
Где,
Q = Полная энергия удельной материи тела
m = масса конкретного вещества тела
Ce= Удельная теплоемкость удельного вещества тела
Delta; t = Температура конкретного вещества тела
Ce = 248.2 / 6Delta; t
Ce= 248.2/6 х 116
Ce = 0.356 Дж на грамм-градус Цельсия.
Неустановленный металл хранится в лаборатории. Вес неуказанного металла 6 грамм. Теперь к неуказанному металлу добавлена энергия 248.2 Дж. Температура неуказанного металла повышается до 116 градусов по Цельсию. Количество удельной теплоты для неуказанного металла составляет 0.356 Дж на грамм-градус Цельсия.
Вывод:
Две физические системы находятся в тепловом равновесии, если между ними нет чистого потока тепловой энергии, когда они соединены путем, проницаемым для тепла.