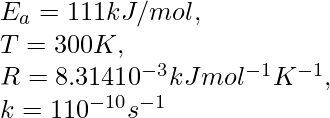
система переходит на более низкий энергетический уровень. Изменение потенциальной энергии системы вдоль пути реакции (или вдоль координаты реакции х) представляют в виде энергетической диаграммы.
На рис. 7 изображена энергетическая диаграмма элементарной экзотермической реакции А +ВС [АВС]= → АВ +С. Кривая показывает, как изменяется потенциальная энергия системы в процессе реакции. Эта кривая энергетически описывает весь путь реакции, т. е. совокупность наиболее вероятных состояний системы. На вершине энергетического барьера система находится в переходном состоянии или в состоянии активированного комплекса, а высота барьера определяет энергию активации Eа прямой реакции.
Рис. 7. Изменение потенциальной энергии системы при протекании элементарной химической реакции (x — координата реакции; H — изменение энтальпии)
В соответствии с уравнением Аррениуса, чем меньше энергия активации, тем больше константа скорости реакции и тем больше скорость химической реакции.
Рассмотрим методы расчета энергии активации. Для расчета
энергии активации используют уравнение Аррениуса.
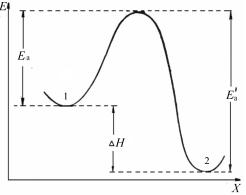
1. Графический метод. Запишем уравнение Аррениуса (см. (41)) в логарифмической форме:
22
удобной для графического определения энергии активации. Энергию активации можно найти по значениям константы скорости реакции, измеренным при нескольких значениях температуры. При этом экспериментальные данные представляют в координатах Аррениуса (lnk; 1/T). Тангенс угла наклона полученной прямой линии равен (−Eа/R) (рис. 8).
Рис. 8. Графическое определение энергии активации
2. Аналитический метод. Уравнение Аррениуса (см. (41)) можно представить в дифференциальной форме:
|
dlnk |
= |
Ea |
. |
(44) |
|
dT |
||||
|
RT2 |
Тогда, интегрируя уравнение (44) в пределах от T1 до T2, получаем
|
ln(k2/k1) = |
Ea(T2 −T1) |
. |
(45) |
||
|
RT2T1 |
|||||
|
Из уравнения (45) следует: |
|||||
|
Ea = |
RT1T2 ln(k2/k1) |
. |
(46) |
||
|
T2 −T1 |
Таким образом, энергию активации можно рассчитать аналитически по формуле (46), если известны константы скорости реакции при двух значениях температуры T1 и T2. Однако такой
23
Энергия активации – это количество энергии, которое необходимо подать для протекания химической реакции. В приведенном ниже примере задачи показано, как определить энергию активации реакции по константам скорости реакции при различных температурах.
Содержание
- Проблема энергии активации
- Решение
- Как использовать график для определения энергии активации
- Кто обнаружил энергию активации?
Проблема энергии активации
Наблюдалась реакция второго порядка. Константа скорости реакции при трех градусах Цельсия составила 8,9 x 10 -3 л/моль и 7,1 x 10 -2 л/моль при 35 градусах. Цельсия. Какова энергия активации этой реакции?
Решение
Энергию активации можно определить с помощью уравнения:
ln (k 2 /k 1 ) = E a /R x (1/T 1 – 1/T 2 )
, где
E a = энергия активации реакция в Дж/моль
R = постоянная идеального газа = 8,3145 Дж/К · моль
T 1 и T 2 = абсолютные температуры (в Кельвинах)
k 1 и k 2 = константы скорости реакции при T 1 и T 2
Шаг 1: преобразование температуры из градусов Цельсия до Кельвина
T = градусы Цельсия + 273,15
T 1 = 3 + 273,15
T 1 = 276,15 К
T 2 = 35 + 273,15
T 2 = 308,15 Кельвина
Шаг 2 – Найдите E a
ln (k 2 /k 1 ) = E a /R x (1/T 1 – 1/T 2 )
ln (7,1 x 10 -2 /8,9 x 10 -3 ) = E a /8,3145 Дж/К · моль x (1/276,15 K – 1/308,15 K)
ln (7,98) = E a / 8,3145 Дж/К · моль x 3,76 x 10 -4 K -1
2,077 = E a (4,52 x 10 -5 моль/Дж)
E a = 4,59 x 10 4 Дж/моль
или в кДж/моль (разделить на 1000)
E a = 45,9 кДж/моль
Ответ: Энергия активации этой реакции составляет 4,59 x 10 4 Дж/моль или 45,9 кДж/моль.
Как использовать график для определения энергии активации
Другой способ вычислить энергию активации реакции – построить график ln k ( константа скорости) в зависимости от 1/T (величина, обратная температуре в Кельвинах). График будет образовывать прямую линию, выраженную уравнением:
m = – E a /R
где m – наклон линии, Ea – энергия активации, а R – постоянная идеального газа, равная 8,314 Дж/моль-К. Если вы измеряли температуру в градусах Цельсия или Фаренгейта, не забудьте преобразовать их в градусы Кельвина, прежде чем рассчитывать 1/T и строить график..
Если бы вы построили график зависимости энергии реакции от координаты реакции, разница между энергией реагентов и продуктов была бы ΔH , в то время как избыточная энергия (часть кривой выше, чем у продуктов) будет энергией активации.
Имейте в виду, в то время как скорость большинства реакций увеличивается В зависимости от температуры в некоторых случаях скорость реакции уменьшается с увеличением температуры. Эти реакции имеют отрицательную энергию активации. Итак, хотя вы должны ожидать, что энергия активации будет положительным числом, имейте в виду, что она также может быть отрицательной.
Кто обнаружил энергию активации?
Шведский ученый Сванте Аррениус предложил термин «энергия активации» в 1880 году для определения минимальной энергии, необходимой для набора химических реагентов для взаимодействия и образования продуктов. На диаграмме энергия активации изображена как высота энергетического барьера между двумя точками минимума потенциальной энергии. Точки минимума – это энергии стабильных реагентов и продуктов.
Даже экзотермические реакции, такие как горение свечи, требуют ввода энергии. В случае возгорания горящая спичка или сильный жар запускают реакцию. Оттуда тепло, выделяющееся в результате реакции, обеспечивает энергию, чтобы сделать ее самоподдерживающейся.
Arrhenius Equation is a formula or expression that explains a relationship between k (the rate constant for a reaction), absolute temperature T and the pre-exponential factor A. Let us look at the Arrhenius equation in detail in this article.
Arrhenius Equation
The Arrhenius equation is written as follows:
k = Ae-Ea / RT
In the above equation,
k is rate constant
A is the pre-exponential factor
Ea is the activation energy for the reaction per mole of the reactants
R is the universal gas constant
T denotes the absolute temperature of the reaction in Kelvin (K)
The above equation may also be written as follows when the energy is taken as energy per molecule of the reactants.
k = Ae-Ea / kbT
where
kb represents the Boltzmann constant.
Graph of Arrhenius Equation
We shall plot the graph for the Arrhenius equation using the example of the decomposition reaction of Nitrogen dioxide. The X-axis will represent the Absolute temperature T in Kelvin and the Y-axis will represent the rate constant k. Let us first write the decomposition reaction for nitrogen dioxide.
2NO2 —> 2NO + O2
The image given below shows the decomposition of the above reaction,
We can see in the above graph that as the temperature rises the rate of reaction also increases.
Now we shall plot the graph for the Arrhenius equation. The Arrhenius equation is written as:
k = Ae-Ea / RT
Taking logarithm on both sides, we get
ln k = ln(Ae-Ea / RT)
ln k = ln (A) + ln (e-Ea / RT)
ln k = ln (A) + -Ea / RT ln (e)
ln k = ln (A) + (-Ea / RT ) [ln (e) = 1]
ln k = -Ea / RT + ln(A)
The equation thus obtained is of the form y=mx+c where m = -Ea / RT.
The above equation can be easily plotted to obtain the Arrhenius Graph. The image given below shows the Arrhenius Graph,
Arrhenius Equation for Catalysts
A catalyst reduces the activation energy required for the reaction. Thus the lowered activation energy can be used in the Arrhenius equation to get the rate constant for the catalyzed reaction. We know that the rate of a chemical reaction is directly proportional to the rate constant of that reaction, the decrease in activation energy results in an exponential increase in the reaction rate.
As compared to non-catalytic reactions, the effect of temperature is more on the catalytic reactions. This is because the exponential term -Ea/RT contains the activation energy in the numerator and the absolute temperature in the denominator. Since the activation energy of catalytic reactions is comparatively low, the effect of temperature on rate constants is very large in the corresponding uncatalyzed reactions.
Arrhenius Equation and the Pre-Exponential Factor (A)
We already discussed that A is known as the pre-exponential factor in the Arrhenius equation. This factor deals with intermolecular collisions and can be thought of as the frequency of precisely aligned collisions between molecules with sufficient energy to initiate a chemical reaction.
A = ρZ
where
Z represents the frequency factor
ρ represents the steric factor
The value of A has different values for different reactions and must be determined experimentally. It also depends on the temperature at which the reaction takes place. The units of A depend on the order of reactions. For example, the units of ‘A’ for the second order rate constant are Lmol-1s-1 whereas the units of the first order rate constant are s-1.
Arrhenius Equation without Pre-Exponential Factor
Consider a chemical reaction taking place at two different temperatures T1 and T2, and the rate constants for these two reactions are k1 and k2 respectively.
We know that the Arrhenius equation can be written as follows for the given temperatures:
ln k = ln (A) – Ea / RT
ln k1 = ln (A) – Ea / RT1 …(1)
ln k2 = ln (A) – Ea / RT2 …(2)
We can obtain the value of ln(A) from the above equation as follows:
ln (A) = ln k2 + Ea / RT2
Using this value of ln (A) in equation 1, the following equation can be formed:
ln k1 = ln k2 + Ea / RT2 – Ea / RT1
Transporting ln k2 to the left-hand side, the value of ln k1 – ln k2 is as:
ln k1 – ln k2 = Ea / RT2 – Ea / RT1
The LHS of the equation is of the form ln(x) – ln(y), which can be rewritten as ln (x/y) using the property of logarithms.
Also, the term Ea / R is common in both the terms on the right-hand side. Therefore, the entire equation can be written as follows:
ln (k1 / k2) = Ea / R [ 1/T2 – 1/T1]
Also, Check
- Temperature Dependence of the Rate of a Reaction
- Rate of a Reaction
- Collision Theory of Chemical Reactions
Solved Examples
Example 1: The activation energy for a chemical reaction is 2000 J per mole and its A factor is 10 per Mole per second. Find the rate constant of this equation at a temperature of 200 K.
Solution:
Given:
A = 10 M-1s-1
T = 200 K
R = 8.314 J.mol-1.K-1
k = ?
We know that,
= 2.303-(10/8.314)
= 1.1
Thus the value of K = e1.1.
Example 2: The rate constant of a chemical reaction is 2.5×10-7 M−1s−1 at 300K. The rate constant for this reaction is 1.5×10-6 M−1s−1 at 600K. Calculate the activation energy of the reaction.
Solution:
Given:
T1 = 300K, k1 = 2.5×10-7 M−1s−1
T2 = 600K, k2 = 1.5×10-6 M−1s−1
Using the Arrhenius equation without a pre-exponential factor
ln (k1 / k2) = Ea / R [ 1/T2 – 1/T1]
ln (2.5×10-7/1.5×10-6} = (Ea / 8.314) [1/600-1/300]
-1.79 = (Ea / 8.314) [-1/600]
Ea = 129.17 Jmol-1
Example 3: The activation energy for a chemical reaction is 10000 J per mole and its A factor is 50 per Mole per second. Find the rate constant of this equation at a temperature of 700 K. Given ln(50) = 3.912
Solution:
Given:
A = 50 M-1s-1
T = 700 K
R = 8.314 J.mol-1.K-1
k = ?
We know that,
= 3.912 – ln(1.718)
= 3.912 – 0.541
= 3.371
Thus the value of k = e3.371
Example 4: It is given that the activation energy of the decomposition of Nitrogen Dioxide at 300K is 111 kJ/mol, and the rate coefficient is 1.0×10-10. Calculate the pre-exponential factor.
Solution:
Given:
Using Arrhenius’s equation,
Thus,
A = 10^{-10}*e^{44.50}
Example 5: Given that the activation energy of a reaction at 100K is 100 kJ/mol, and the rate coefficient is 2.0×10-8s-1. Calculate the pre-exponential factor.
Solution:
Given:
Using Arrhenius’s equation,
Thus,
FAQs on Arrhenius Equation
Question 1: What is Arrhenius’s equation explain?
Answer:
The Arrhenius equation is expressed as,
k = Ae-E/RT
where,
k is the rate of chemical reaction,
A is a constant depending on the chemicals involved,
E is the activation energy,
R is the universal gas constant,
T is the temperature.
Question 2: Which theory is the basis for the Arrhenius equation?
Answer:
The Arrhenius equation is based on the concept that the number of effective collisions is proportional to the number of molecules above certain threshold energy and the number of molecules with energies exceeding the threshold energy increases as temperature increases.
Question 3: What is the use of the Arrhenius equation?
Answer:
Arrhenius Equation is a formula or expression that explains a relationship between k (the rate constant for a reaction), absolute temperature T and the pre-exponential factor A.
Question 4: How does a catalyst increase the rate of the reaction?
Answer:
A catalyst lowers the activation energy needed for the reaction and thus the reactants react at a faster rate due to the lower energy barrier and hence the rate of reaction increases.
Question 5: What are the values of the Boltzmann constant and universal gas constants used in the Arrhenius equation?
Answer:
The value of the Boltzmann constant is 1.38 × 10-23 m2 kg s-2 K-1 and that of the universal gas constant is 8.314 JK-1mol-1. The Boltzmann constant is used when the activation energy is expressed as per molecule of the reactants whereas the universal gas constant is used when the energy is expressed as per mole of the reactants.
Question 6: What are the units of the pre-exponential factors for first and second-order reactions?
Answer:
The units for pre-exponential factor A for first and second-order reactions are s-1 and Lmol-1s-1 respectively.
Question 7: What is the relation between the rates of reaction at different temperatures?
Answer:
Let the rates of reaction be k1 and k2 and the temperatures are T1 and T2 respectively. Thus the relationship between them is as follows:
ln (k1 / k2) = Ea / R [ 1/T2 – 1/T1]
where,
Ea is the activation energy
R is the universal gas constant
Как найти энергию активации по уравнению аррениуса
Из качественных соображений понятно, что скорость реакций должна увеличиваться с ростом температуры, т.к. при этом возрастает энергия сталкивающихся частиц и повышается вероятность того, что при столкновении произойдет химическое превращение. Для количественного описания температурных эффектов в химической кинетике используют два основных соотношения — правило Вант-Гоффа и уравнение Аррениуса.
Правило Вант-Гоффа заключается в том, что при нагревании на 10 о С скорость большинства химических реакций увеличивается в 2 4 раза. Математически это означает, что скорость реакции зависит от температуры степенным образом:
, (4.1)
где — температурный коэффициент скорости ( = 24). Правило Вант-Гоффа является весьма грубым и применимо только в очень ограниченном интервале температур.
Гораздо более точным является уравнение Аррениуса, описывающее температурную зависимость константы скорости:
, (4.2)
где R — универсальная газовая постоянная; A — предэкспоненциальный множитель, который не зависит от температуры, а определяется только видом реакции; EA — энергия активации, которую можно охарактеризовать как некоторую пороговую энергию: грубо говоря, если энергия сталкивающихся частиц меньше EA, то при столкновении реакция не произойдет, если энергия превышает EA, реакция произойдет. Энергия активации не зависит от температуры.
Графически зависимость k(T) выглядит следующим образом:
При низких температурах химические реакции почти не протекают: k(T) 0. При очень высоких температурах константа скорости стремится к предельному значению: k(T) A. Это соответствует тому, что все молекулы являются химически активными и каждое столкновение приводит к реакции.
Энергию активации можно определить, измерив константу скорости при двух температурах. Из уравнения (4.2) следует:
. (4.3)
Более точно энергию активации определяют по значениям константы скорости при нескольких температурах. Для этого уравнение Аррениуса (4.2) записывают в логарифмической форме
и записывают экспериментальные данные в координатах ln k — 1/T. Тангенс угла наклона полученной прямой равен —EA / R.
Для некоторых реакций предэкспоненциальный множитель слабо зависит от температуры. В этом случае определяют так называемую опытную энергию активации:
. (4.4)
Если предэкспоненциальный множитель — постоянный, то опытная энергия активации равна аррениусовской энергии активации: Eоп = EA.
Пример 4-1. Пользуясь уравнением Аррениуса, оцените, при каких температурах и энергиях активации справедливо правило Вант-Гоффа.
Решение. Представим правило Вант-Гоффа (4.1) как степенную зависимость константы скорости:
,
где B — постоянная величина. Сравним это выражение с уравнением Аррениуса (4.2), приняв для температурного коэффициента скорости значение
.
Возьмем натуральный логарифм обеих частей этого приближенного равенства:
.
Продифференцировав полученное соотношение по температуре, найдем искомую связь связь между энергией активации и температурой:
.
Если энергия активации и температура примерно удовлетворяют этому соотношению, то правилом Вант-Гоффа для оценки влияния температуры на скорость реакции пользоваться можно.
Пример 4-2. Реакция первого порядка при температуре 70 о С завершается на 40% за 60 мин. При какой температуре реакция завершится на 80% за 120 мин, если энергия активации равна 60 кДж/моль?
Решение. Для реакции первого порядка константа скорости выражается через степень превращения следующим образом:
,
где a = x/a — степень превращения. Запишем это уравнение при двух температурах с учетом уравнения Аррениуса:
,
где EA = 60 кДж/моль, T1 = 343 K, t1 = 60 мин, a 1 = 0.4, t2 = 120 мин, a 2 = 0.8. Поделим одно уравнение на другое и прологарифмируем:
Подставляя в это выражение приведенные выше величины, находим T2 = 333 К = 60 о С.
Пример 4-3. Скорость бактериального гидролиза мышц рыб удваивается при переходе от температуры -1.1 о С к температуре +2.2 о С. Оцените энергию активации этой реакции.
Решение. Увеличение скорости гидролиза в 2 раза обусловлено увеличением константы скорости: k2 = 2k1. Энергию активации по отношению констант скорости при двух температурах можно определить из уравнения (4.3) с T1 = t1 + 273.15 = 272.05 K, T2 = t2 + 273.15 = 275.35 K:
130800 Дж/моль = 130.8 кДж/моль.
4-1. При помощи правила Вант-Гоффа вычислите, при какой температуре реакция закончится через 15 мин, если при 20 о С на это требуется 2 ч. Температурный коэффициент скорости равен 3.(ответ)
4-2. Время полураспада вещества при 323 К равно 100 мин, а при 353 К — 15 мин. Определите температурный коэффициент скорости.(ответ)
4-3. Какой должна быть энергия активации, чтобы скорость реакции увеличивалась в 3 раза при возрастании температуры на 10 0 С а) при 300 К; б) при 1000 К?(ответ)
4-4. Реакция первого порядка имеет энергию активации 25 ккал/моль и предэкспоненциальный множитель 5 . 10 13 сек -1 . При какой температуре время полураспада для данной реакции составит: а) 1 мин; б) 30 дней?(ответ)
4-5. В каком из двух случаев константа скорости реакции увеличивается в большее число раз: при нагревании от 0 о С до 10 о С или при нагревании от 10 о С до 20 о С? Ответ обоснуйте с помощью уравнения Аррениуса.(ответ)
4-6. Энергия активации некоторой реакции в 1.5 раза больше, чем энергия активации другой реакции. При нагревании от T1 до T2 константа скорости второй реакции увеличилась в a раз. Во сколько раз увеличилась константа скорости первой реакции при нагревании от T1 до T2?(ответ)
4-7. Константа скорости сложной реакции выражается через константы скорости элементарных стадий следующим образом:
Выразите энергию активации и предэкспоненциальный множитель сложной реакции через соответствующие величины, относящиеся к элементарным стадиям.(ответ)
4-8. В необратимой реакции 1-го порядка за 20 мин при 125 о С степень превращения исходного вещества составила 60%, а при 145 o C такая же степень превращения была достигнута за 5.5 мин. Найдите константы скорости и энергию активации данной реакции .(ответ)
4-9. Реакция 1-го порядка при температуре 25 о С завершается на 30% за 30 мин. При какой температуре реакция завершится на 60% за 40 мин, если энергия активации равна 30 кДж/моль?(ответ)
4-10. Реакция 1-го порядка при температуре 25 о С завершается на 70% за 15 мин. При какой температуре реакция завершится на 50% за 15 мин, если энергия активации равна 50 кДж/моль?(ответ)
4-11. Константа скорости реакции первого порядка равна 4.02 . 10 -4 с -1 при 393 К и 1.98 . 10 -3 с -1 при 413 К. Рассчитайте предэкспоненциальный множитель для этой реакции.(ответ)
4-12. Для реакции H2 + I2 2HI константа скорости при температуре 683 К равна 0,0659 л/(моль. мин), а при температуре 716 К — 0,375 л/(моль. мин). Найдите энергию активации этой реакции и константу скорости при температуре 700 К.(ответ)
4-13. Для реакции 2N2O 2N2 + O2 константа скорости при температуре 986 К равна 6,72 л/(моль. мин), а при температуре 1165 К — 977,0 л/(моль. мин). Найдите энергию активации этой реакции и константу скорости при температуре 1053,0 К.(ответ)
4-14. Трихлорацетат-ион в ионизирующих растворителях, содержащих H + , разлагается по уравнению
H + + CCl3COO — CO2 + CHCl3
Стадией, определяющей скорость реакции, является мономолекулярный разрыв связи C- C в трихлорацетат-ионе. Реакция протекает по первому порядку, и константы скорости имеют следующие значения: k = 3.11 . 10 -4 с -1 при 90 о С, k = 7.62 . 10 -5 с -1 при 80 о С. Рассчитайте а) энергию активации, б) константу скорости при 60 о С.(ответ)
4-15. Для реакции CH3COOC2H5 + NaOH ѕ CH3COONa + C2H5OH константа скорости при температуре 282,6 К равна 2,307 л/(моль. мин), а при температуре 318,1 К — 21,65 л/(моль. мин). Найдите энергию активации этой реакции и константу скорости при температуре 343 К.(ответ)
4-16. Для реакции C12H22O11 + H2O C6H12O6 + C6H12O6 константа скорости при температуре 298,2 К равна 0,765 л/(моль. мин), а при температуре 328,2 К — 35,5 л/(моль. мин). Найдите энергию активации этой реакции и константу скорости при температуре 313,2 К.(ответ)
4-17. Вещество разлагается двумя параллельными путями с константами скорости k1 и k2. Какова разность энергий активации этих двух реакций, если при 10 o C k1/k2 = 10, а при 40 o C k1/k2 = 0.1?(ответ)
4-18. В двух реакциях одинакового порядка разница энергий активации составляет E2 — E1 = 40 кДж/моль. При температуре 293 К отношение констант скорости равно k1/k2 = 2. При какой температуре константы скорости сравняются?(ответ)
4-19. Разложение ацетондикарбоновой кислоты в водном растворе — реакция первого порядка. Измерены константы скорости этой реакции при разных температурах:
T, о С
k. 10 5 , с -1
Рассчитайте энергию активации и предэкспоненциальный множитель. Чему равен период полураспада при 25 о С? (ответ)
Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Как найти энергию активации по уравнению аррениуса
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
2.1 СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
2.1.9 Влияние температуры на константу скорости реакции
Константа скорости реакции есть функция от температуры; повышение температуры, как правило, увеличивает константу скорости. Первая попытка учесть влияние температуры была сделана Я. Г. Вант-Гоффом, который сформулировал следующее эмпирическое правило:
При повышении температуры на каждые 10 градусов константа скорости элементарной химической реакции увеличивается в 2 – 4 раза.
Величина, показывающая, во сколько раз увеличивается константа скорости при повышении температуры на 10 градусов, есть температурный коэффициент константы скорости реакции γ . Математически правило Вант-Гоффа можно записать следующим образом:
(II.29)
(II.30)
Однако правило Вант-Гоффа применимо лишь в узком температурном интервале, поскольку температурный коэффициент скорости реакции γ сам является функцией от температуры; при очень высоких и очень низких температурах γ становится равным единице (т.е. скорость химической реакции перестает зависеть от температуры).
2.1.10 Уравнение Аррениуса
Очевидно, что взаимодействие частиц осуществляется при их столкновениях; однако число столкновений молекул очень велико и, если бы каждое столкновение приводило к химическому взаимодействию частиц, все реакции протекали бы практически мгновенно. С. Аррениус постулировал, что столкновения молекул будут эффективны (т.е. будут приводить к реакции) только в том случае, если сталкивающиеся молекулы обладают некоторым запасом энергии – энергией активации.
Энергия активации есть минимальная энергия, которой должны обладать молекулы, чтобы их столкновение могло привести к химическому взаимодействию.
Рассмотрим путь некоторой элементарной реакции
Поскольку химическое взаимодействие частиц связано с разрывом старых химических связей и образованием новых, считается, что всякая элементарная реакция проходит через образование некоторого неустойчивого промежуточного соединения, называемого активированным комплексом:
Образование активированного комплекса всегда требует затраты некоторого количества энергии, что вызвано, во-первых, отталкиванием электронных оболочек и атомных ядер при сближении частиц и, во-вторых, необходимостью построения определенной пространственной конфигурации атомов в активированном комплексе и перераспределения электронной плотности. Таким образом, по пути из начального состояния в конечное система должна преодолеть своего рода энергетический барьер. Энергия активации реакции приближённо равна превышению средней энергии активированного комплекса над средним уровнем энергии реагентов. Очевидно, что если прямая реакция является экзотермической, то энергия активации обратной реакции Е’А выше, нежели энергия активации прямой реакции EA. Энергии активации прямой и обратной реакции связаны друг с другом через изменение внутренней энергии в ходе реакции. Вышесказанное можно проиллюстрировать с помощью энергетической диаграммы химической реакции (рис. 2.5).
Рис. 2.5 Энергетическая диаграмма химической реакции.
Eисх – средняя энергия частиц исходных веществ,
Eпрод – средняя энергия частиц продуктов реакции
Поскольку температура есть мера средней кинетической энергии частиц, повышение температуры приводит к увеличению доли частиц, энергия которых равна или больше энергии активации, что приводит к увеличению константы скорости реакции (рис.2.6):
Рис. 2.6 Распределение частиц по энергии
Здесь nЕ/N – доля частиц, обладающих энергией E;
Ei — средняя энергия частиц при температуре Ti (T1 уравнения Аррениуса . Согласно уравнению изобары Вант-Гоффа,
(II.31)
Поскольку константа равновесия есть отношение констант скоростей прямой и обратной реакции, можно переписать выражение (II.31) следующим образом:
(II.32)
Представив изменение энтальпии реакции ΔHº в виде разности двух величин E1 и E2, получаем:
(II.33)
(II.34)
Здесь С – некоторая константа. Постулировав, что С = 0, получаем уравнение Аррениуса, где EA – энергия активации :
(II.35)
После неопределенного интегрирования выражения (II.35) получим уравнение Аррениуса в интегральной форме:
(II.36)
(II.37)
Рис. 2.7 Зависимость логарифма константы скорости химической
реакции от обратной температуры.
Здесь A – постоянная интегрирования. Из уравнения (II.37) нетрудно показать физический смысл предэкспоненциального множителя A, который равен константе скорости реакции при температуре, стремящейся к бесконечности. Как видно из выражения (II.36), логарифм константы скорости линейно зависит от обратной температуры (рис.2.7); величину энергии активации EA и логарифм предэкспоненциального множителя A можно определить графически (тангенс угла наклона прямой к оси абсцисс и отрезок, отсекаемый прямой на оси ординат).
(II.38)
Зная энергию активации реакции и константу скорости при какой-либо температуре T1, по уравнению Аррениуса можно рассчитать величину константы скорости при любой температуре T2:
(II.39)
Copyright © С. И. Левченков, 1996 — 2005.
Расчеты энергии активации реакции по уравнению Аррениуса
Задача 341.
Чему равна энергия активации реакции, если при повышении температуры от 290 до 300 К скорость ее увеличится в 2 раза?
Решение:
Из уравнения Аррениуса находим:
Ea — энергия активации, k и k’ — константы скорости реакции, Т – температура в К (298). Учитывая, что происходит повышение температуры реакции от 290 К до 300 К, уравнение можно преобразовать, получим:
Ответ: 49,9кДж/моль.
Задача 342.
Каково значение энергии активации реакции, скорость которой при 300 К в 10 раз больше, чем при 280 К?
Решение:
Из уравнения Аррениуса находим:
Ea — энергия активации, k и k’ — константы скорости реакции, Т – температура в К (298). Учитывая зависимость константы скорости реакции от изменения температуры, получим:
Подставляя в последнее уравнение данные задачи и, выражая энергию активации в джоулях, получим:
Ответ: 80,3кДж/моль.
Задача 343.
Энергия активации реакции O3(г) + NO(г) → O2(г) + NO2(г) равна 10 кДж/моль. Во сколько раз изменится скорость реакции при повышении температуры от 27 до 37 °С ?
Решение:
Из уравнения Аррениуса находим:
Ea — энергия активации, k и k’ — константы скорости реакции, Т – температура в К (298). Учитывая зависимость константы скорости реакции от изменения температуры, получим:
Подставляя в последнее уравнение данные задачи и, выражая энергию активации в джоулях, получим:
Окончательно находим: k/k’ = 1,14.
Ответ: В 1,14 раз.
Задача 344.
Зависит ли температурный коэффициент скорости реакции от значения энергии активации? Ответ обосновать.
Решение:
Согласно правилу Вант-Гоффа, зависимость скорости реакции от температуры определяется уравнением:
Здесь vt и kt — скорость и константа скорости реакции при температуре t °С; v(t + 10) и k(t + 10) те же величины при температуре (t + 10 °С ); — температурный коэффициент скорости реакции, значение которого для большинства реакций лежит в пределах 2 — 4 (правило Вант-Гоффа).
Возрастание скорости реакции с ростом температуры принято характеризовать температурным коэффициентом скорости реакции — числом, показывающим, во сколько раз возрастёт скорость данной реакции при повышении температуры системы на 10 градусов. Температурный коэффициент различных реакций различен. В то же время каждая реакция характеризуется определённым барьером энергии; для его преодоления необходима энергия активации – избыточная энергия, которой должны обладать молекулы при данной температуре, для того чтобы их столкновение привело бы к образованию нового вещества. Зависимость константы скорости реакции (k) от энергиия активации (Ea кДж/моль) выражается уравнением Аррениуса: или , где
Еа — энергия активации, k и k’ — константы скорости реакции, Т – температура в К (298). Учитывая зависимость константы скорости реакции от изменения температуры, получим:
Из чего следует, что чем меньше энергия активации и выше температура, тем больше константа скорости реакции и k’/k .
В стандартных условиях энергия активации различных реакций различна и она зависит от природы реагирующих веществ.
Таким образом, температурный коэффициент () не зависит от энергия активации (Ea).
Задача 345.
Зависит ли значение энергии активации реакции в случае гетерогенного катализа от площади поверхности катализатора и от ее структуры?
Решение:
Известно, что катализатор снижает энергию активации реакции, чем дольше активность катализатора, тем большее снижение энергии активации реакции наблюдается в присутствии катализатора.
При гетерогенном катализе реакция протекает на поверхности катализатора. Отсюда следует, что активность катализатора зависит от величины поверхности (площади) его и свойств этой поверхности. Чаще всего используют пористую структуру (пемза, асбест и др.). Чтобы увеличить активность данного катализатора, нужно увеличить площадь соприкосновения его с реагентом. Применяют катализаторы с различной структурой поверхности (пористую, порошковую, в виде колец, трубок и т.п.).
Таким образом, с увеличением площади поверхности твёрдого катализатора увеличивается его активность и, соответственно, значительно уменьшается энергия активация катализируемой реакции.
Задача 346.
Реакция 2Н2(г) + О2(г) = 2Н2О(г) протекает с выделением теплоты. Однако для того, чтобы реакция началась, исходную смесь газов надо нагреть. Как это объяснить?
Решение:
Данная реакция является экзотермической, но для начала протекания реакции необходимо дополнительно подогреть смесь водорода и кислорода. Это можно объяснить тем, что энергия активации реакции слишком велика ( больше 120 кДж/моль), значит лишь только малая часть столкновений молекул водорода и кислорода друг с другом приводит к их взаимодействию. Для того чтобы увеличить число активных столкновений необходимо исходную смесь нагреть, т.е. повысить температуру системы, что вызовет разрыв или ослабление связей между атомами молекул газов. При нагревании смеси Н2 и О2 в отношении 2 : 1 происходит взрыв. Объясняется это тем, что из атомов водорода и кислорода, изначально образовавшихся при подогревании газовой смеси, образуются радикалы * ОН, которые легко реагируют с молекулой Н2 с образованием молекул Н2О и * Н. Последний реагирует с молекулой О2 с образованием радикалов * О *, и * ОН. В свою очередь, атом кислорода, реагируя с молекулой Н2, порождает радикалы * Н и * ОН, при столкновении которых образуется молекула Н2О.
Таким образом, при нагревании смеси водорода и кислорода происходит увеличение образования активных частиц(* О * , *Н, *ОН), что порождает цепную реакцию, и скорость её резко возрастает, происходит взрыв смеси газов.
http://physchem.chimfak.sfedu.ru/Source/PCC/Kinetics_4.htm
http://buzani.ru/zadachi/khimiya-glinka/1140
Расчёт
констант скоростей первого и второго порядка. Расчёт энергии активации».
Цель работы:
Математически рассчитать энергию активации и константы скоростей реакций по
заданным условиям.
Теоретическая
часть:
Энергия
активации – это минимальное количество энергии,
которая требуется сообщить системе, чтобы произошла химическая реакция.
Согласно теории
активных соодарений, для того, чтобы произошла химическая реакция происходят
следующие условия:
1.
Молекулы должны столкнуться.
2.
Молекулы должны быть правильно
ориентированы относительно друг друга.
3.
Молекулы должны обладать необходимой
энергией (энергией активации).
Уравнение Аррениуса
устанавливает связь между энергией активации и скоростью протекания реакции.
Еа = —RT
ln()
K – const скорости реакции;
А — фактор частоты
для реакции;
R – универсальная
газовая постоянная;
Т – температура в
градусах Кельвина.
Для количественного
описания температурных эффектов используют правило Вант – Гоффа: повышение
температуры на каждые 10 увеличивает скорость хим. Реакции в 2-4 раза.
=
Правило Вант- Гоффа
является не точным, гораздо точнее описывает зависимость температуры и скорости
уравнения Аренниуса
K(T) = Aexp
При низких
температурах реакция почти не протекает К(Т)→0; при высоких температурах constскорости К(Т) →А.
Энергию активации
можно определить измерив constскорости, при двух разных
температурах.
EA =
Для реакции первого
порядка const скорости К(Т)
выражается
через степень
превращения К =
Aexp =
(1)
Aexp =
(2)
поделили
первый уровень на второй и прологарифмировали.
=
ln
Задание 1:
Используя уравнение
Аррениуса, оцените при каких температурах и энергиях активации справедливо
правило Вант – Гоффа.
.
Задание 2:
При какой
температуре завершается на 80% реакция, если энергия активации равна 60 и время 120 мин.
Принять необходимым
условием, что эта реакция имеет первый порядок и при температуре 70 завершается на 40% за 60 мин.
Задание 3:
Скорость гидролиза
удваивается при переходе от температуры – 1,1 к температуре 2,2
. Найдите энергию активации реакции.

.png)
.png)