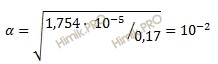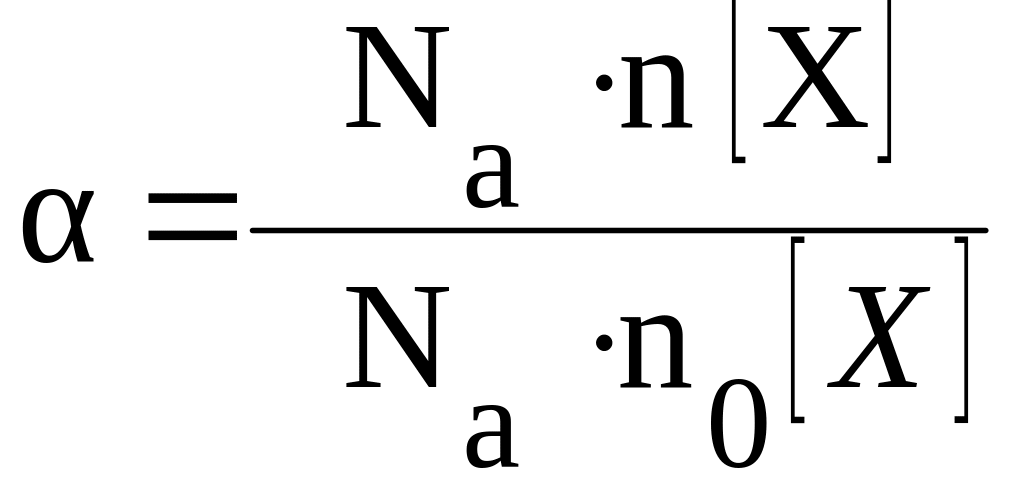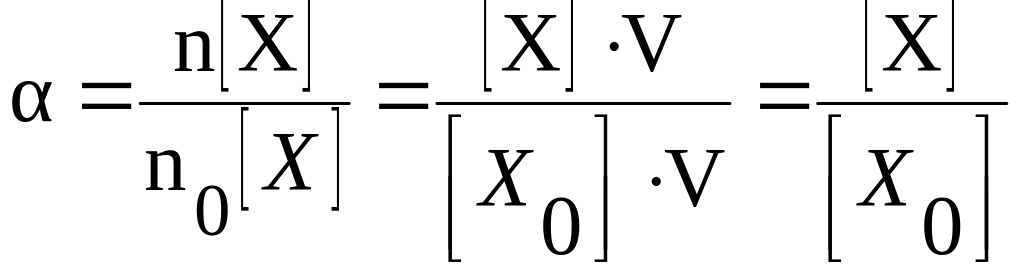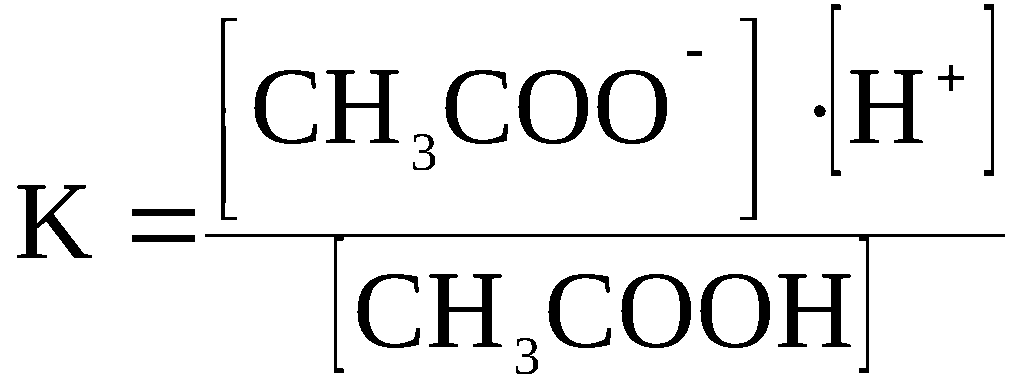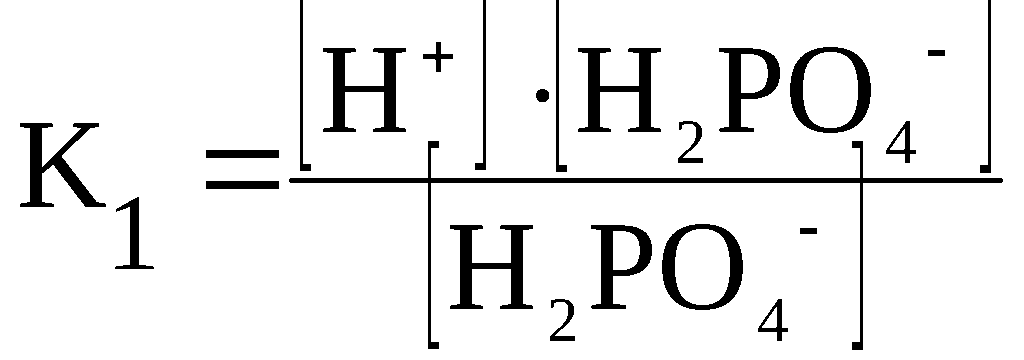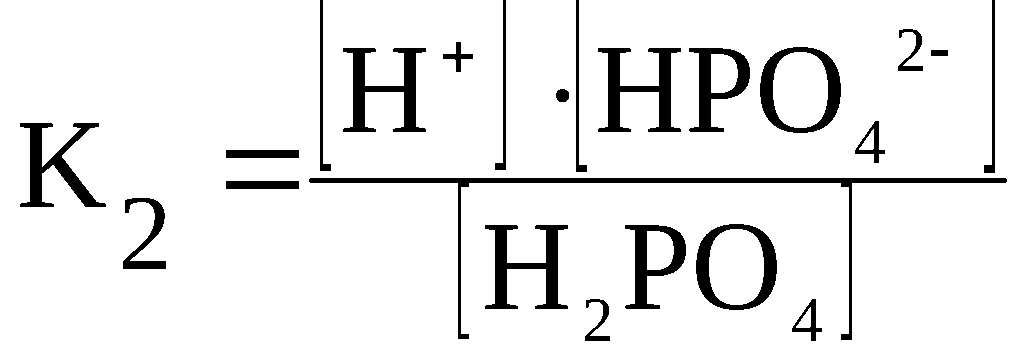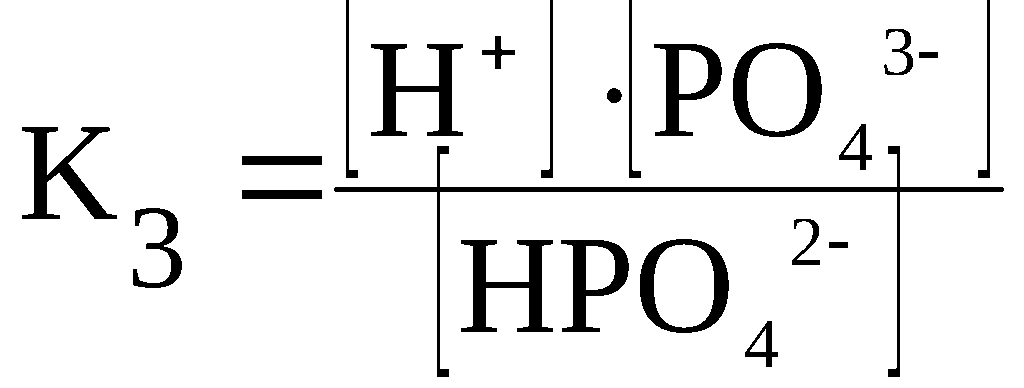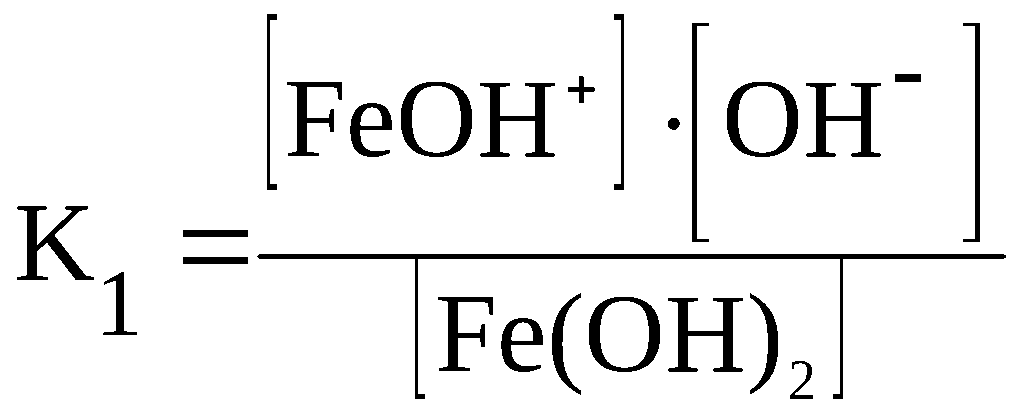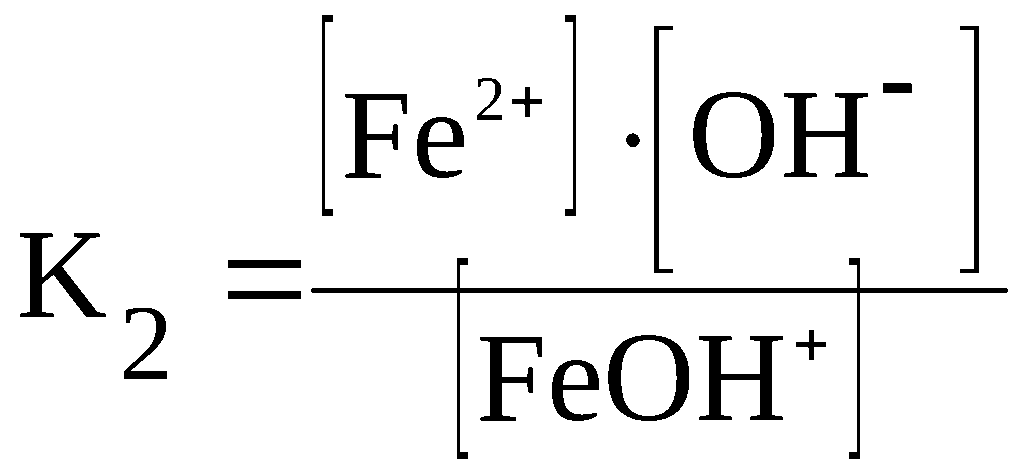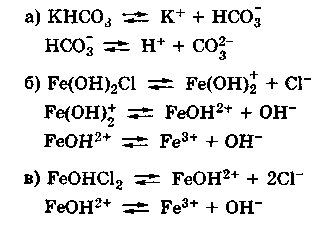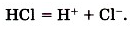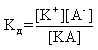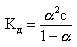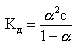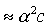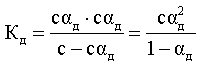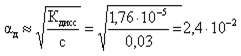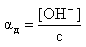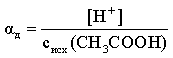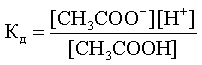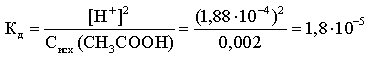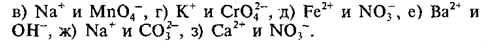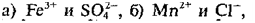Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Степень диссоциации
Классификация электролитов
Диссоциация электролитов
Константа диссоциации
Примеры решения задач
Задачи для самостоятельного решения
Степень диссоциации
Вещества, которые в растворах или расплавах полностью или частично распадаются на ионы, называются электролитами.
Степень диссоциации α — это отношение числа молекул, распавшихся на ионы N′ к общему числу растворенных молекул N:
α = N′/N
Степень диссоциации выражают в процентах или в долях единицы. Если α =0, то диссоциация отсутствует и вещество не является электролитом. В случае если α =1, то электролит полностью распадается на ионы.
Классификация электролитов
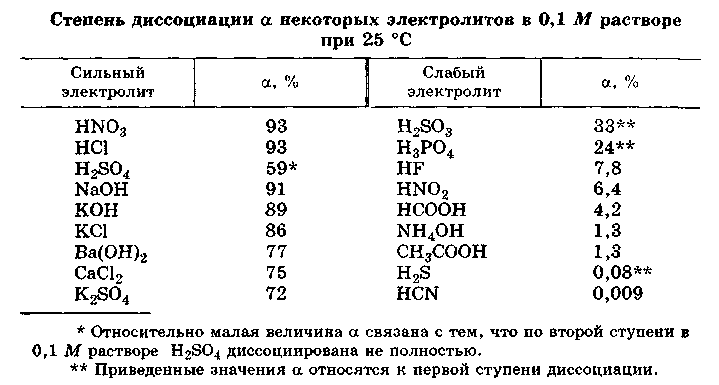
Согласно современным представлениям теории растворов все электролиты делятся на два класса: ассоциированные (слабые) и неассоциированные (сильные). Неассоциированные электролиты в разбавленных растворах практически полностью диссоциированы на ионы. Для этого класса электролитов a близко к единице (к 100 %). Неассоциированными электролитами являются, например, HCl, NaOH, K2SO4 в разбавленных водных растворах.
Ассоциированные электролиты подразделяются на три типа:
-
-
- Слабые электролиты существуют в растворах как в виде ионов, так и в виде недиссоциированных молекул. Примерами ассоциированных электролитов этой группы являются, в частности, Н2S, Н2SO3, СН3СOОН в водных растворах.
- Ионные ассоциатыобразуются в растворах путем ассоциации простых ионов за счет электростатического взаимодействия. Ионные ассоциаты возникают в концентрированных растворах хорошо растворимых электролитов. В результате в растворе находятся как простые ионы, так и ионные ассоциаты. Например, в концентрированном водном растворе КCl образуются простые ионы К+, Cl— , а также возможно образование ионных пар (К+Cl— ), ионных тройников (K2Cl+, KCl2— ) и ионных квадруполей (K2Cl2, KCl32- , K3Cl2+).
- Комплексные соединения(как ионные, так и молекулярные), внутренняя сфера которых ступенчато диссоциирует на ионные и (или) молекулярные частицы.
Примеры комплексных ионов: [Cu(NH3)4]2+, [Fe(CN)6]3+, [Cr(H2O)3Cl2]+.
-
При таком подходе один и тот же электролит может относиться к различным типам в зависимости от концентрации раствора, вида растворителя и температуры. Подтверждением этому являются данные, приведенные в таблице.
Таблица. Характеристика растворов KI в различных растворителях
| Концентрация электролита, С, моль/л | Температура
t,оС |
Растворитель | Тип электролита |
| 0,01 | 25 | Н2О | Неассоциированный (сильный) |
| 5 | 25 | Н2О | Ионный ассоциат |
| 0,001 | 25 | С6Н6 | Ассоциированный (слабый) |
Приближенно, для качественных рассуждений можно пользоваться устаревшим делением электролитов на сильные и слабые. Выделение группы электролитов “средней силы” не имеет смысла. Эти электролиты являются ассоциированными. К слабым электролитам обычно относят электролиты, степень диссоцииации которых мала α<<1.
Таким образом, к сильным электролитам относятся разбавленные водные растворы почти всех хорошо растворимых в воде солей, многие разбавленные водные растворы минеральных кислот (НСl, HBr, НNО3, НСlO4 и др.), разбавленные водные растворы гидроксидов щелочных металлов. К слабым электролитам принадлежат все органические кислоты в водных растворах, некоторые водные растворы неорганических кислот, например, H2S, HCN, H2CO3, HNO2, HСlO и др. К слабым электролитам относится и вода.
Диссоциация электролитов
Уравнение реакции диссоциации сильного электролита можно представить следующим образом. Между правой и левой частями уравнения реакции диссоциации сильного электролита ставится стрелка или знак равенства:
HCl → H+ + Cl—
Na2SO3 = 2Na+ + SO32-
Допускается также ставить знак обратимости, однако в этом случае указывается направление, в котором смещается равновесие диссоциации, или указывается, что α≈1. Например:
NaOH → Na+ + OH—
Диссоциация кислых и основных солей в разбавленных водных растворах протекает следующим образом:
NaHSO3 → Na+ + HSO3—
Анион кислой соли будет диссоциировать в незначительной степени, поскольку является ассоциированным электролитом:
HSO3— → H+ + SO32-
Аналогичным образом происходит диссоциация основных солей:
Mg(OH)Cl → MgOH+ + Cl—
Катион основной соли подвергается дальнейшей диссоциации как слабый электролит:
MgOH+ → Mg2+ + OH—
Двойные соли в разбавленных водных растворах рассматриваются как неассоциированные электролиты:
KAl(SO4)2 → K+ + Al3+ + 2SO42-
Комплексные соединения в разбавленных водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы:
K3[Fe(CN)6] → 3K+ + [Fe(CN)6]3-
В свою очередь, комплексный ион в незначительной степени подвергается дальнейшей диссоциации:
[Fe(CN)6]3- → Fe3+ + 6CN—
Константа диссоциации
При растворении слабого электролита КА в растворе установится равновесие:
КА ↔ К+ + А—
которое количественно описывается величиной константы равновесия Кд, называемой константой диссоциации:
Kд = [К+] · [А—] /[КА] (2)
Константа диссоциации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем больше ионов в растворе слабого электролита. Например, в растворе азотистой кислоты HNO2 ионов Н+ больше, чем в растворе синильной кислоты HCN, поскольку К(HNO2) = 4,6·10— 4, а К(HCN) = 4,9·10— 10.
Для слабых I-I электролитов (HCN, HNO2, CH3COOH) величина константы диссоциации Кд связана со степенью диссоциации α и концентрацией электролита c уравнением Оствальда:
Кд = (α2·с)/(1-α) (3)
Для практических расчетов при условии, что α<<1 используется приближенное уравнение:
Кд = α2·с (4)
Поскольку процесс диссоциации слабого электролита обратим, то к нему применим принцип Ле Шателье. В частности, добавление CH3COONa к водному раствору CH3COOH вызовет подавление собственной диссоциации уксусной кислоты и уменьшение концентрации протонов. Таким образом, добавление в раствор ассоциированного электролита веществ, содержащих одноименные ионы, уменьшает его степень диссоциации.
Следует отметить, что константа диссоциации слабого электролита связана с изменением энергии Гиббса в процессе диссоциации этого электролита соотношением:
ΔGT0 = — RTlnKд (5)
Уравнение (5) используется для расчета констант диссоциации слабых электролитов по термодинамическим данным.
Примеры решения задач
Задача 1. Определите концентрацию ионов калия и фосфат-ионов в 0,025 М растворе K3PO4.
Решение. K3PO4 – сильный электролит и в водном растворе диссоциирует полностью:
K3PO4 → 3К+ + РО43-
Следовательно, концентрации ионов К+ и РО43- равны соответственно 0,075М и 0,025М.
Задача 2. Определите степень диссоциации αд и концентрацию ионов ОН— (моль/л) в 0,03 М растворе NH3·H2О при 298 К, если при указанной температуре Кд(NH3·H2О) = 1,76× 10— 5.
Решение. Уравнение диссоциации электролита:
NH3·H2О → NH4+ + OH—
Концентрации ионов: [NH4+] = αС ; [OH—] = αС , где С – исходная концентрация NH3·H2О моль/л. Следовательно:
Kд = αС · αС /(1 — αС)
Поскольку α << 1, то:
Кд ≈ α 2С
Константа диссоциации зависит от температуры и от природы растворителя, но не зависит от концентрации растворов NH3·H2О. Закон разбавления Оствальда выражает зависимость α слабого электролита от концентрации.
α = √(Кд / С) = √(1,76× 10— 5 / 0,03) = 0,024 или 2,4 %
[OH—] = αС, откуда [OH— ] = 2,4·10— 2·0,03 = 7,2·10-4 моль/л.
Задача 3. Определите константу диссоциации уксусной кислоты, если степень диссоциации CH3CОOH в 0,002 М растворе равна 9,4 %.
Решение. Уравнение диссоциации кислоты:
CH3CОOH → СН3СОО— + Н+.
α = [Н+] / Сисх(CH3CОOH)
откуда [Н+] = 9,4·10—2·0,002 = 1,88·10-4 М.
Так как [CH3CОO—] = [Н+] и [CH3CОOH] ≈ Сисх(CH3CОOH), то:
Kд = [Н+]2 / Сисх(CH3CОOH)
Константу диссоциации можно также найти по формуле: Кд ≈ α 2С.
Задача 4. Константа диссоциации HNO2 при 298К равна 4,6× 10— 4. Найдите концентрацию азотистой кислоты, при которой степень диссоциации HNO2 равна 5 %.
Решение.
Кд =α 2С , откуда получаем Сисх(HNO2) = 4,6·10— 4/(5·10— 2)2 = 0,184 М.
Задача 5. На основе справочных данных рассчитайте константу диссоциации муравьиной кислоты при 298 К.
Решение. Уравнение диссоциации муравьиной кислоты
НСООН →Н+ + СООН—
В “Кратком справочнике физико–химических величин” под редакцией А.А. Равделя и А.М. Пономаревой приведены значения энергий Гиббса образований ионов в растворе, а также гипотетически недиссоциированных молекул. Значения энергий Гиббса для муравьиной кислоты и ионов Н+ и СООН— в водном растворе приведены ниже:
| Вещество, ион | НСООН | Н+ | СООН— |
| ΔGT0, кДж/моль | — 373,0 | 0 | — 351,5 |
Изменение энергии Гиббса процесса диссоциации равно:
ΔGT0 = — 351,5- (- 373,0) = 21,5 кДж/моль.
Для расчета константы диссоциации используем уравнение (5). Из этого уравнения получаем:
lnKд = — Δ GT0/RT= — 21500/(8,31 298) = — 8,68
Откуда находим: Kд = 1,7× 10— 4.
Задачи для самостоятельного решения
1. К сильным электролитам в разбавленных водных растворах относятся:
- СН3СOOH
- Na3PO4
- NaCN
- NH3
- C2H5OH
- HNO2
- HNO3
13.2. К слабым электролитам в водных растворах относятся:
- KAl(SO4)2
- NaNO3
- HCN
- NH4Cl
- C2H5OH
- H2SO3
- H2SO4
3. Определите концентрацию ионов NH4+ в 0,03 М растворе (NH4)2Fe(SO4)2;
4. Определите концентрацию ионов водорода в 6 мас.% растворе H2SO4, плотность которого составляет 1,038 г/мл. Принять степень диссоциации кислоты по первой и второй ступеням равной 100 %.
5. Определите концентрацию гидроксид-ионов в 0,15 М растворе Ba(OH)2.
6. Степень диссоциации муравьиной кислоты в 0,1 М растворе равна 4 %. Рассчитайте Концентрацию ионов водорода в этом растворе и константу диссоциации НСООН.
7. Степень диссоциации муравьиной кислоты в водном растворе увеличится при:
а) уменьшении концентрации HCOOH;
б) увеличении концентрации HCOOH;
в) добавлении в раствор муравьиной кислоты HCOONa;
г) добавлении в раствор муравьиной кислоты НCl.
8. Константа диссоциации хлорноватистой кислоты равна 5× 10— 8. Определите концентрацию HClO, при которой степень диссоциации HClO равна 0,5 %, и концентрацию ионов Н+ в этом растворе.
9. Вычислите объем воды, который необходимо добавить к 50 мл 0,02 М раствора NH3·H2О, чтобы степень диссоциации NH3·H2О увеличилась в 10 раз, если Кд(NH4OH) = 1,76·10— 5.
10. Определите степень диссоциации азотистой кислоты в 0,25 М растворе при 298 К, если при указанной температуре Кд(HNO2) = 4,6× 10— 4.
Как правильно рассчитать константу диссоциации слабого электролита
Задача 94.
Концентрация ионов Н+ в 0,1 М растворе СН3СООН равна 1,3 · 10–3 моль/дм3. Вычислите константу и степень диссоциации кислоты.
Решение:
СМ(СН3СООН) = 0,1 моль/дм3;
[H+] = 1,3 · 10–3 моль/дм3;
KD(CH3COOH) = ?
α = ?
1. Вычисление степень диссоциации уксусной кислоты
Для расчета будем использовать формулу: [H+] = СМ · α
Тогда
α = [H+]/CM(CH3COOH) = (1,3 · 10–3)/0,1 = 1,3 · 10–2 или 1,3%.
2. Вычисление константы диссоциации уксусной кислоты
В случае слабых электролитов константа диссоциации определяется по формуле:
KD = (αCM · αCM)/CM(1 — α) = α2CM/(1 — α).
Тогда
KD(СН3СООН) = [(α)2 · СМ(СН3СООН)]/(1 — α) = [(1,3 · 10–2)2 · 0,1]/(1 — 1,3 · 10–2) =
= 0,0000169/0,987 = 0,0000171 = 1,71 · 10–5.
Ответ: KD(СН3СООН) = 1,71 · 10–5; альфа = 1,3%.
Задача 95.
Вычислите константу диссоциации НСООН, если в растворе w% = 0,46% и она диссоциирована на 4,2%.
Решение:
М(НСООН) = 46 г/моль;
w% = 0,46%;
α = 4,2% или 0,042
KD(НСООН) = ?
1. Вычисление концентрацию муравьиной кислоты
Концентрацию кислоты находим из вычисления:
СМ(НСООН) = [(w% · 1000г)/100%]/M(НСООН); СМ(НСООН) = [(0,46% · 1000г)/100%]/46 г/моль = 0,1 моль/дм3.
2. Вычисление константы диссоциации НСООН
В случае слабых электролитов константа диссоциации определяется по формуле:
KD = (αCM · αCM)/CM(1 — α) = α2CM/(1 — α).
Тогда
KD(НСООН) = [(0,042)2 · 0,1]/(1 — 0,042) = 0,0001764/0,958 = 0,000184 или 1,84 · 10–4.
Ответ: KD(НСООН) = 1,84 · 10–4.
Задача 96.
Вычислите константу диссоциации диметиламина, если в 0,2 М растворе он диссоциирован на 7,42%.
Решение:
M[(CH3)2NH] = 45,08 г/моль;
CM[(CH3)2NH] = 0,2 М;
α = 7,42% или 0,0742.
1. Вычисление константы диссоциации (CH3)2NH
В случае слабых электролитов константа диссоциации определяется по формуле:
KD = (αCM · αCM)/CM(1 — α) = α2CM/(1 — α).
Тогда
KD[(CH3)2NH] = [(0,0742)2 · 0,2]/(1 — 0,0742) = 0,0011/0,9258 = 0,0012 или 1,20 · 10–3.
Ответ: KD[(CH3)2NH] = 1,20 · 10–3.
Задача 97.
Концентрация ионов Н+ в 0,2 М растворе C2H5COOH равна 1,2 · 10–2 моль/дм3. Вычислите константу и степень диссоциации кислоты.
Решение:
СМ(C2H5COOH) = 0,2 моль/дм3;
[H+] = 1,2 · 10–2 моль/дм3;
KD(C2H5COOH) = ?
α = ?
1. Вычисление степень диссоциации этановой кислоты
Для расчета будем использовать формулу: [H+] = СМ · α
Тогда
α = [H+]/CM(C2H5COOH) = (1,2 · 10–2)/0,2 = 6,0 · 10–2 или 6%.
2. Вычисление константы диссоциации этановой кислоты
В случае слабых электролитов константа диссоциации определяется по формуле:
KD = (αCM · αCM)/CM(1 — α) = α2CM/(1 — α).
Тогда
KD(C2H5COOH) = [(α)2 · СМ(СН3СООН)]/(1 — α) = [(6,0 · 10–2)2 · 0,2]/(1 — 6,0 · 10–2) = 0,00072/0,94 = 0,0000171 = 7,7 · 10-4.
Ответ: KD(C2H5COOH) = 7,7 · 10-4; α = 0,06%.
Определите pH кислоты (0,17 нормальной уксусной кислоты (CH3COOH)), константа диссоциации которой равна 1,75 ⋅ 10-5.
Решение задачи
Константа и степень диссоциации слабого электролита связаны между собой соотношением:
где:
α – степень диссоциации;
K – константа диссоциации;
C– общая концентрация электролита.
Определить pH кислоты
Получаем:
Определяем концентрацию ионов водорода [H+]:
[H+] = 0,17 ⋅ 1 ⋅ 10-2 = 0,17 ⋅ 10-2 (моль/л).
Определим pH кислоты (CH3COOH) по формуле:
Водородный показатель (pH) раствора численно равен отрицательному десятичному логарифму концентрации ионов водорода в этом растворе.
Получаем:
pH (CH3COOH) = -lg 0,17 ⋅ 10-2 = 2,77.
Ответ:
водородный показатель раствора 2,77.
Изучая
свойства растворов электролитов, С.
Аррениус ввёл понятие «степень
диссоциации», предположив, что некоторые
электролиты не могут полностью
диссоциировать на ионы.
Степенью
диссоциации называется отношение
числа молекул, распавшихся в растворе
на ионы, к общему числу молекул электролита
в растворе.
|
|
(1) |
где:
N(X)
– число продиссоциировавших молекул
электролита X;
N0(X)
– общее число молекул электролита X
в растворе.
Степень
диссоциации ()
зависит от следующих факторов:
– от
природы электролита и растворителя;
– концентрации
электролита;
– температуры.
Степень
диссоциации можно также выразить через
количество вещества по формуле:
|
|
(2) |
где
n(X)
– количество молей продиссоциировавшего
вещества X;
n0б(X)
– общее количество молей вещества X
в растворе;
Na
–
число Авогадро.
Количество вещества
можно выразить через молярную концентрацию
раствора и объём раствора, поэтому
степень диссоциации можно также
определить как отношение молярной
концентрации продиссоциировавшего
вещества к молярной концентрации всего
вещества, находящегося в растворе.
|
|
( |
где
[Х] – молярная концентрация
продиссоциировавшего вещества X;
[Х0]
– общая молярная концентрация вещества
X
в растворе.
Электролиты
можно разделить на 2 большие группы:
электролиты сильные и слабые.
Сильные
электролиты
диссоциируют в растворах полностью и
процесс диссоциации необратим:
HNO3
H+
+ NO3–
. Из этого следует, что степень
диссоциации сильного электролита равна
1.
Сильными
электролитами являются:
–все
растворимые соли;
– гидроксиды
щелочных и щелочно-земельных металлов
(NaOH,
KOH,
Ba(OH)2;
– некоторые
кислоты (H2SO4,
HNO3,
HCl,
HBr,
HI.
Для
слабых электролитов степень диссоциации
α < 1,
поскольку слабые электролиты диссоциируют
лишь частично, и
процесс диссоциации обратим, т.е.
в растворе устанавливается динамическое
равновесие между ионами и
непродиссоциировавшими молекулами.
Основные
слабые электролиты:
– вода
H2O;
– гидроксиды
Al(OH)3;
Обратимый
характер диссоциации слабых электролитов
отражается при записи уравнений.
CH3COOH
⇆
CH3COO–
+ H+
H3PO4
⇆
H+
+ H2PO4–
H2PO4–
⇆
H+
+ HPO42–
HPO42–
⇆
H+
+ PO43–
4 Константа диссоциации
К
равновесию, которое устанавливается в
растворе слабого электролита между
молекулами и ионами, можно применить
законы химического равновесия и записать
выражение константы равновесия.
Ниже
приводится выражение константы равновесия
для процесса диссоциации уксусной
кислоты CH3COOH
⇆
CH3COO–
+ H+.
К
онстанта
равновесия, соответствующая процессу
диссоциации слабого электролита,
называется
константой
диссоциации.
Величина
константы диссоциации зависит от природы
электролита и растворителя, температуры,
но не зависит от концентрации электролита
в растворе.
Она
характеризует способность данной
кислоты или данного основания распадаться
на ионы: чем легче электролит диссоциирует
на ионы, тем больше константа диссоциации.
Константа
диссоциации является справочной
величиной.
Ступенчатая
диссоциация электролитов. Многоосновные
кислоты и многокислотные основания
диссоциируют ступенчато.
Каждая
стадия ступенчатой диссоциации
многоосновной кислоты характеризуется
своей константой диссоциации.
H3PO4
⇆
H+
+ H2PO4–
H2PO4–
⇆
H+
+ HPO42–
HPO42–
⇆
H+
+ PO43–
Аналогичные
соотношения характеризуют и ступенчатую
диссоциацию оснований многовалентных
металлов.
Fe(OH)2
⇆
FeOH+
+ OH–
F
eOH+
⇆
Fe2+
+ OH–
При
ступенчатой диссоциации веществ распад
по первой ступени всегда происходит в
гораздо большей степени, чем по второй;
по второй стадии – больше, чем по третьей
и т.д. Иначе говоря, соблюдается
неравенство:
K1
>> K2
> K3
> … .
Это
объясняется тем, что энергия, необходимая
для отрыва иона от нейтральной молекулы,
меньше, чем от заряженной частицы.
Например, отрыв иона H+
будет происходить более легко от
нейтральной частицы – молекулы H3PO4,
чем от отрицательно заряженного иона
H2PO4–.
В свою очередь, отрыв иона H+
от однозарядного иона H2PO4–
требует меньшей энергии, чем от
двухзарядного иона HPO4–.
Кислые
и основные соли также диссоциируют
ступенчато, например:
Нетрудно заметить,
что диссоциация гидроаниона или
гидроксокатиона идентична второй или
третьей ступени диссоциации соответствующих
кислоты или основания и потому подчиняется
тем же закономерностям, которые были
сформулированы для ступенчатой
диссоциации кислот и оснований. В
частности, если основная соль
соответствует слабому основанию, а
кислая соль — слабой кислоте, то диссоциация
гидроаниона или гидроксокатиона (т. е.
вторая или третья ступень диссоциации
соли) протекает в незначительной степени.
Во всякой
кислородсодержащей кислоте и во всяком
основании (имеются в виду кислоты и
основания в традиционном понимании)
имеются гидроксогруппы. Разница между
кислотой и основанием заключается в
том, что в первом случае диссоциация
происходит по связи ЭО—Н, а во втором
— по связи Э—ОН.
Амфотерные
гидроксиды диссоциируют и как основания,
и как кислоты (и те и другие очень слабые).
Так, ионизацию гидроксида цинка можно
представить следующей схемой (без учета
гидратации образующихся ионов):
Прибавление кислоты
смещает эти равновесия влево, а
прибавление щелочи — вправо. Поэтому
в кислой среде преобладает диссоциация
по типу основания, а в щелочной — по
типу кислоты. В обоих случаях связывание
в молекулы воды ионов, образующихся
при диссоциации малорастворимого
амфотерного электролита, вызывает
переход в раствор новых порций таких
ионов, их связывание, переход в раствор
новых ионов и т. д. Следовательно,
растворение такого электролита происходит
как в растворе кислоты, так и в растворе
щелочи.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
5.3. Электролитическая диссоциация. Степень и
константа диссоциации
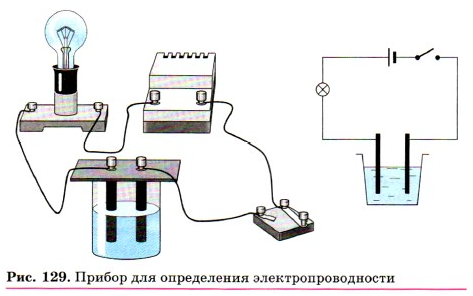
Как вы знаете из уроков физики, растворы
одних веществ способны проводить электрический ток, а других — нет. Чтобы
опытным путём проверить эту способность у растворов различных веществ,
воспользуемся следующим прибором.
Он состоит из стакана, в который наливают
раствор исследуемого вещества. На стакан ставят пластинку из эбонита с
вмонтированными в неё двумя угольными электродами, к клеммам которых
присоединены провода. Один из них соединён с лампочкой. Выходной контакт от
лампочки и провод от другой клеммы идут к источнику тока. Если раствор, налитый
в стакан, проводит электрический ток, то лампочка загорается, и чем лучше эта
способность, тем ярче горит лампочка. Проводят электрический ток растворы
солей, щелочей, кислот.
Растворы сахара, спирта, глюкозы и
некоторых других веществ не проводят электрический ток.
Почему же растворы электролитов проводят
электрический ток?
Шведский учёный Сванте Аррениус, изучая
электропроводность растворов различных веществ, пришёл в 1877 г. к выводу, что
причиной электропроводности является наличие в растворе ионов, которые
образуются при растворении электролита в воде.
С. Аррениус, который придерживался
физической теории растворов, не учитывал взаимодействия электролита с водой и
считал, что в растворах находятся свободные ионы. В отличие от него русские
химики И. А. Каблуков и В. А. Кистяковский применили к объяснению
электролитической диссоциации химическую теорию Д. И. Менделеева и доказали,
что при растворении электролита происходит химическое взаимодействие
растворённого вещества с водой, которое приводит к образованию гидратов, а
затем они диссоциируют на ионы. Они считали, что в растворах находятся не
свободные, не «голые» ионы, а гидратированные, т. е. «одетые в шубку» из
молекул воды.
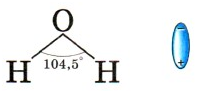
Молекулы воды представляют собой диполи (два полюса), так как атомы водорода
расположены под углом 104,5°, благодаря чему молекула имеет угловую форму.
Молекула воды схематически представлена ниже.
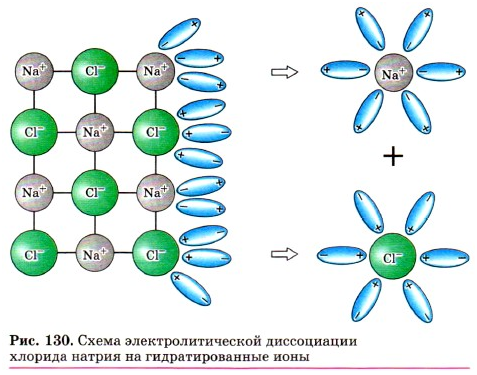
Как правило, легче всего диссоциируют
вещества с ионной связью и соответственно с ионной кристаллической решёткой,
так как они уже состоят из готовых ионов. При их растворении диполи воды
ориентируются противоположно заряженными концами вокруг положительных и отрицательных
ионов электролита.
Между ионами электролита и диполями воды
возникают силы взаимного притяжения. В результате химическая связь между ионами
ослабевает, и происходит переход ионов из кристалла в раствор. Очевидно, что
последовательность процессов, происходящих при диссоциации веществ с ионной
связью (солей и щелочей), будет такой:
1)
ориентация молекул — диполей воды около ионов кристалла;
2)
гидратация (взаимодействие) молекул воды с противоположно заряженными ионами
поверхностного слоя кристалла;
3)
диссоциация (распад) кристалла электролита на гидратированные ионы.
Упрощённо происходящие процессы можно
отразить с помощью следующего уравнения:
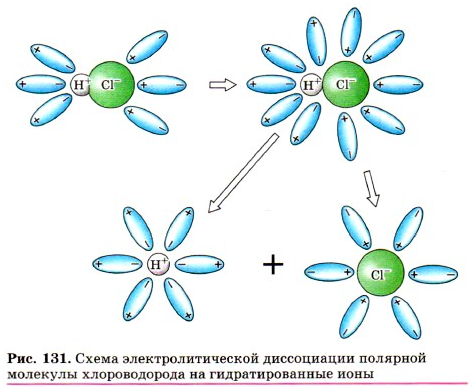
Аналогично диссоциируют и электролиты, в
молекулах которых ковалентная полярная связь (например, молекулы хлороводорода
НСl),
только в этом случае под влиянием диполей
воды происходит превращение ковалентной полярной связи в ионную, и
последовательность процессов, происходящих при этом, будет такая:
1)
ориентация молекул воды вокруг полюсов молекулы электролита;
2)
гидратация (взаимодействие) молекул воды с молекулами электролита;
3)
ионизация молекул электролита (превращение ковалентной полярной связи в
ионную);
4)
диссоциация (распад) молекул электролита на гидратированные ионы.
Уравнение диссоциации соляной кислоты:
В растворах электролитов хаотически
движущиеся гидратированные ионы могут столкнуться и объединиться. Этот обратный
процесс называют ассоциацией.
Свойства гидратированных и
негидратированных ионов различаются. Например, негидратированный ион меди Си2+ — бесцветный в безводных кристаллах
сульфата меди (II) CuSO4 и
имеет голубой цвет, когда гидратирован, т. е. связан с молекулами воды Си2+ • пН2O. Гидратированные
ионы имеют как постоянное, так и переменное число молекул воды.
В растворах электролитов наряду с ионами
присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации, которую обозначают греческой буквой α («альфа»).
Степень
диссоциации электролита
определяют опытным путём и выражают в долях или в процентах. Если α = 0, то
диссоциация отсутствует, а если α = 1, или 100%, то электролит полностью
распадается на ионы. Электролиты имеют различную степень диссоциации, т. е.
степень диссоциации зависит от природы электролита. Она также зависит и от
концентрации: с разбавлением раствора степень диссоциации увеличивается.
По степени электролитической диссоциации
электролиты разделяют на сильные и слабые.
Cильные электролиты при растворении в воде практически
полностью диссоциируют на ионы. У таких электролитов значение степени
диссоциации стремится к единице в разбавленных растворах.
К сильным электролитам относят:
1)
практически все соли;
2) сильные
кислоты, например: H2SO4, HCl, HNO3;
3) все щёлочи,
например: NaOH, КОН.
Слабые электролиты при растворении в воде почти не
диссоциируют на ионы. У таких электролитов значение степени диссоциации
стремится к нулю.
К слабым электролитам относят:
1) слабые
кислоты, например: H2S, H2CO3, HNO2;
2) водный
раствор аммиака NH3 •
Н2O.
Константа
диссоциации (ионизации)
При растворении
слабого электролита АК в растворе установится равновесие:
КА ⇌ К+ + А—
которое количественно
описывается величиной константы равновесия Кд, называемой константой
диссоциации:
(13.2)
Константа
диссоциации характеризует способность электролита диссоциировать на ионы. Чем
больше константа диссоциации, тем больше ионов в растворе слабого электролита.
Например, в растворе азотистой кислоты HNO2 ионов Н+ больше, чем в растворе синильной
кислоты HCN, поскольку К(HNO2) = 4,6·10— 4, а К(HCN) = 4,9·10— 10.
Для
слабых I-I электролитов (HCN, HNO2,
CH3COOH) величина константы диссоциации Кд связана со степенью диссоциации α и концентрацией электролита c уравнением Оствальда:
.
(13.3)
Для практических
расчетов при условии, что α <<1
используется приближенное уравнение
Кд
.
(13.4)
Поскольку
процесс диссоциации слабого электролита обратим, то к нему применим принцип Ле
Шателье. В частности, добавление CH3COONa к водному раствору CH3COOH
вызовет подавление собственной диссоциации уксусной кислоты и уменьшение
концентрации протонов. Таким образом, добавление в раствор ассоциированного
электролита веществ, содержащих одноименные ионы, уменьшает его степень
диссоциации.
Следует
отметить, что константа диссоциации слабого электролита связана с изменением
энергии Гиббса в процессе диссоциации этого электролита соотношением:
D GT0 = — RTlnKд .
(13.5)
Уравнение
(13.5) используется для расчета констант диссоциации слабых электролитов по
термодинамическим данным.
Процесс диссоциации электролитов является равновесным
и, как любой равновесный процесс, характеризуется константой равновесия,
которая в этом случае называться константой диссоциации. Рассмотрим пример
диссоциации уксусной кислоты, которая протекает по
уравнению:
CH3COOH ↔ CH3COO— + H+
молекулярная
форма ионная
форма
Поскольку уксусная кислота является слабым
электролитом, то равновесие процесса диссоциации сдвинуто в сторону
молекулярной формы кислоты. Запишем выражение для константы равновесия этого
процесса по закону действующих масс:
[H+]рав [CH3COO—]рав
Крав =Кдис = ¾¾¾¾¾¾¾¾¾ = 1,8
10—5
[CH3COOH]рав
По
своему смыслу Кдис определяет степень
необратимости процесса диссоциации. Кдис не зависит от
концентрации слабого электролита в растворе, а зависит только от температуры и
природы электролита. Значение Кдис говорит о
силе электролита — чем больше значение Кдис , тем сильнее
электролит.
HCN ↔ H+ + CN— Кдис = 4
10-4
HNO2 ↔ H+ + NO2— Кдис =
7,2 10-10
Из сравнения значений Кдис для уксусной,
синильной и азотистой кислот видно, что HCN сильнее HNO2 , а
уксусная кислота — сильнее HNO2, но слабее HCN.
УПРАЖНЕНИЯ
1.
Определить
концентрацию ионов калия и фосфат-ионов в 0,025 М растворе K3PO4.
Решение:
K3PO4 – сильный электролит и в водном
растворе диссоциирован нацело:
K3PO4 → 3 К+ + РО43- .
Следовательно, концентрации ионов К+ и РО43- равны соответственно 0,075М и
0,025М.
_____________________________________________________________
2.
Определить
степень диссоциации a д и концентрацию ионов ОН— (моль/л) в 0,03 М растворе NH4OH
при 298 К, если при указанной температуре Кд(NH4OH) =
1,76× 10— 5.
Решение: Уравнение диссоциации электролита:
NH4OH ⇌ NH4+ + OH—.
Концентрации ионов: [NH4+] = ca ; [OH—] = ca ,
где c – исходная концентрация NH4OH
моль/л. Следовательно:
Поскольку a << 1, то Кд » сa 2. Константа диссоциации
зависит от температуры и от природы растворителя, но не зависит от
концентрации растворов NH4OH. Закон разбавления Оствальда выражает
зависимость a слабого электролита от концентрации.
или 2,4 %
, откуда [OH— ] = 2,4·10— 2·0,03 = 7,2·10-4 моль/л.
_____________________________________________________________
3.
Определить константу диссоциации уксусной кислоты,
если степень диссоциации CH3CОOH в 0,002 М растворе равна 9,4 %.
Решение: Уравнение диссоциации
кислоты:
CH3CОOH ⇌ СН3СОО— +
Н+.
,
откуда [Н+] = 9,4·10— 2·0,002 =
1,88·10— 4 М.
.
Так как [CH3CОO—]
= [Н+] и [CH3CОOH] » cисх(CH3CОOH),
то
.
Константу диссоциации
можно также найти по формуле: Кд » ca 2.
_____________________________________________________________
4.
Константа
диссоциации HNO2 при 298К
равна 4,6× 10— 4. Найти концентрацию азотистой
кислоты, при которой степень диссоциации HNO2 равна 5 %.
Решение:
Кд ca 2 , откуда получаем cисх(HNO2) =
4,6·10— 4/(5·10— 2)2 =
0,184 М.
_____________________________________________________________
5.
Степень
диссоциации уксусной кислоты в 0,1 М растворе равна 1,32∙10-2.
Найдите константу диссоциации кислоты и значение р К.
Решение: Подставим данные задачи в уравнение
закона разбавления
К = a2См/(1 –a) = (1,32∙10-2)2∙0,1/(1–0,0132)
= 1,77∙10-5, откуда
рК = – lg (1,77∙10-5) = 4,75.
Расчет по приближенной формуле К = a2См приводит к близкому значению К:
К = (1,32∙10-2)2 ∙0,1= 1,74∙10-5 , откуда рК=4,76.
_____________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1.
Какая химическая
связь существует в молекулах электролитов.
2.
Какова главная
причина электролитической диссоциации в водных растворах.
3.
Что характеризует
константа диссоциации.
4.
Почему водный раствор серной кислоты проводит
электрический ток, а безводная серная кислота не проводит.
5.
Какие из следующих жидкостей проводят электрический
ток: этиловый спирт, водный раствор глюкозы, водный раствор гидроксида натрия,
раствор азота в воде, водный раствор сульфата натрия, расплав гидроксида калия.
6.
Какие из следующих ионов являются катионами и какие
анионами:
7.
Раствор фосфорной кислоты разбавили в 3 раза.
Уменьшится или увеличится степень диссоциации кислоты.
8.
Изобразите схему образования гидратированных ионов
фторида калия при его растворении в воде.
9.
Изобразите схему образования гидратированных ионов в
водном растворе бромоводорода.
10.
Напишите формулы электролитов, в водном растворе
которых содержатся ионы:
|
1. Сильными электролитами являются: |
|
|
а) разбавленный водный раствор серной |
б) все ответы верны |
|
в) водный раствор гидроксида калия |
г) водный раствор хлорида натрия |
|
2. Электролитическая диссоциация угольной кислоты |
|
|
а) сильная |
б) неустойчивая |
|
в) слабая |
г) нерастворима в воде |
|
3. Вещество, при диссоциации которого образуются |
|
|
а) кислотой |
б) щелочью |
|
в) средней солью |
г) кислой солью |
|
4. Укажите формулы веществ, которые в водном растворе |
|
|
а)FeCl3 |
б) PO4 |
|
в) NaHCO3 |
г) KOH |
|
5. Концентрация какой из частиц наименьшая в водном |
|
|
а) H+ |
б)HSO3— |
|
в)SO32- |
г)H2O |
|
6. Какие из веществ, формулы которых приведены ниже, |
|
|
а) CH3COOH |
б) Н2О |
|
в) Ba(OH)2 |
г)Zn(OH)2 |
|
7. Вещества, которые при диссоциации в качестве |
|
|
а) солями |
б) кислотами |
|
в) щелочами |
г) амфотерными гидроксидами |
|
8. Окраска лакмуса изменяется в: |
|
|
а) воде |
б) растворе гидроксида железа (III) |
|
в) растворе серной кислоты |
г) растворе хлорида натрия |
|
9. Сколько молекул электролита продиссоциирует из каждых 120 внесенных в раствор, если |
|
|
а) 96 |
б) 120 |
|
в) 20 |
г) 24 |
|
10. Степень |
|
|
а)111 |
б) 67 |
|
в) 133 |
г)200 |
Ответы:
|
1 |
б |
|
2 |
в |
|
3 |
г |
|
4 |
в |
|
5 |
в |
|
6 |
г |
|
7 |
в |
|
8 |
в |
|
9 |
г |
|
10 |
в |