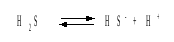Как правильно рассчитать константу диссоциации слабого электролита
Задача 94.
Концентрация ионов Н+ в 0,1 М растворе СН3СООН равна 1,3 · 10–3 моль/дм3. Вычислите константу и степень диссоциации кислоты.
Решение:
СМ(СН3СООН) = 0,1 моль/дм3;
[H+] = 1,3 · 10–3 моль/дм3;
KD(CH3COOH) = ?
α = ?
1. Вычисление степень диссоциации уксусной кислоты
Для расчета будем использовать формулу: [H+] = СМ · α
Тогда
α = [H+]/CM(CH3COOH) = (1,3 · 10–3)/0,1 = 1,3 · 10–2 или 1,3%.
2. Вычисление константы диссоциации уксусной кислоты
В случае слабых электролитов константа диссоциации определяется по формуле:
KD = (αCM · αCM)/CM(1 — α) = α2CM/(1 — α).
Тогда
KD(СН3СООН) = [(α)2 · СМ(СН3СООН)]/(1 — α) = [(1,3 · 10–2)2 · 0,1]/(1 — 1,3 · 10–2) =
= 0,0000169/0,987 = 0,0000171 = 1,71 · 10–5.
Ответ: KD(СН3СООН) = 1,71 · 10–5; альфа = 1,3%.
Задача 95.
Вычислите константу диссоциации НСООН, если в растворе w% = 0,46% и она диссоциирована на 4,2%.
Решение:
М(НСООН) = 46 г/моль;
w% = 0,46%;
α = 4,2% или 0,042
KD(НСООН) = ?
1. Вычисление концентрацию муравьиной кислоты
Концентрацию кислоты находим из вычисления:
СМ(НСООН) = [(w% · 1000г)/100%]/M(НСООН); СМ(НСООН) = [(0,46% · 1000г)/100%]/46 г/моль = 0,1 моль/дм3.
2. Вычисление константы диссоциации НСООН
В случае слабых электролитов константа диссоциации определяется по формуле:
KD = (αCM · αCM)/CM(1 — α) = α2CM/(1 — α).
Тогда
KD(НСООН) = [(0,042)2 · 0,1]/(1 — 0,042) = 0,0001764/0,958 = 0,000184 или 1,84 · 10–4.
Ответ: KD(НСООН) = 1,84 · 10–4.
Задача 96.
Вычислите константу диссоциации диметиламина, если в 0,2 М растворе он диссоциирован на 7,42%.
Решение:
M[(CH3)2NH] = 45,08 г/моль;
CM[(CH3)2NH] = 0,2 М;
α = 7,42% или 0,0742.
1. Вычисление константы диссоциации (CH3)2NH
В случае слабых электролитов константа диссоциации определяется по формуле:
KD = (αCM · αCM)/CM(1 — α) = α2CM/(1 — α).
Тогда
KD[(CH3)2NH] = [(0,0742)2 · 0,2]/(1 — 0,0742) = 0,0011/0,9258 = 0,0012 или 1,20 · 10–3.
Ответ: KD[(CH3)2NH] = 1,20 · 10–3.
Задача 97.
Концентрация ионов Н+ в 0,2 М растворе C2H5COOH равна 1,2 · 10–2 моль/дм3. Вычислите константу и степень диссоциации кислоты.
Решение:
СМ(C2H5COOH) = 0,2 моль/дм3;
[H+] = 1,2 · 10–2 моль/дм3;
KD(C2H5COOH) = ?
α = ?
1. Вычисление степень диссоциации этановой кислоты
Для расчета будем использовать формулу: [H+] = СМ · α
Тогда
α = [H+]/CM(C2H5COOH) = (1,2 · 10–2)/0,2 = 6,0 · 10–2 или 6%.
2. Вычисление константы диссоциации этановой кислоты
В случае слабых электролитов константа диссоциации определяется по формуле:
KD = (αCM · αCM)/CM(1 — α) = α2CM/(1 — α).
Тогда
KD(C2H5COOH) = [(α)2 · СМ(СН3СООН)]/(1 — α) = [(6,0 · 10–2)2 · 0,2]/(1 — 6,0 · 10–2) = 0,00072/0,94 = 0,0000171 = 7,7 · 10-4.
Ответ: KD(C2H5COOH) = 7,7 · 10-4; α = 0,06%.
Пример
1. Константа
диссоциации муравьиной кислоты 1,7010–4.
Найти концентрацию ионов водорода и
степень диссоциации кислоты в ее 1 М
растворе.
Решение.В соответствии с уравнением диссоциации
кислоты:
записываем
выражение для константы диссоциации:
Кдис
=
.
Концентрация ионов
водорода существенно меньше единицы и
ею можно пренебречь. Находим концентрацию
ионов водорода:
.
Наконец,
определяем степень диссоциации кислоты:
или
1,31 %.
Пример
2.Степень диссоциации слабой
одноосновной кислоты в 0,1 М растворе
составляет 0,1 %. Найти концентрацию ионов
водорода в ее 1 М растворе.
Решение.Для
нахождения константы диссоциации
кислоты воспользуемся соотношением
Кдис
=
.
В
соответствии с уравнением диссоциации
кислоты
константа
диссоциации связана с концентрацией
ионов водорода следующим образом:
Кдис
=
Определяем концентрацию
ионов водорода в 1 М растворе:
моль/л
.
Пример
3. В 1 л 0,1 М
раствора уксусной кислоты растворили
4,48 л (н.у.) хлороводорода. Как изменилась
при этом степень диссоциации уксусной
кислоты? Принять объем окончательного
раствора равным 1 л, константа диссоциации
уксусной кислоты составляет 1,7510–5.
Решение.Определим степень диссоциации уксусной
кислоты в исходном растворе:
Кдис
=
.
В
соответствии с уравнением диссоциации
появление в растворе сильной хлороводородной
кислоты приведет к резкому смещению
равновесия диссоциации уксусной кислоты
влево. Пусть концентрация ионов водорода,
образующихся за счет собственной
диссоциации уксусной кислоты равна Х
моль/л, такова же концентрация и
ацетат-анионов; общая концентрация
ионов водорода в растворе составит (X +
0,2) моль/л (4,48 л хлороводорода составляют
0,2 моль). Подставляем эти величины в
выражение для константы диссоциации и
находим X:
Кдис
=.
Определяем степень
диссоциации уксусной кислоты в
окончательном растворе:
.
Таким
образом, введение в раствор 0,2 моль
хлороводорода привело
к уменьшению
степени диссоциации уксусной кислоты
в:
раз.
Пример
4. Константы
ступенчатой диссоциации сероводородной
кислоты составляют 9,7410–8,
1,3610–13.
Найти концентрации ионов Н+,
HS–
и S2–
в 0,01 М растворе этой кислоты.
Решение.
В соответствии с уравнением диссоциации
H2S
по первой ступени
определяем
концентрацию ионов Н+и HS– :
Кдис(1) =
;
Диссоциация
по второй ступени
протекает
в значительно меньшей степени за счет
подавления ее продуктами диссоциации
по первой ступени и большей трудности
отрыва протона от аниона по сравнению
с нейтральной молекулой. Пусть концентрация
анионов серы в растворе равна Х моль/л,
концентрация ионов водорода составит
(X + 3,1210–5)
моль/л, а концентрация ионов HS–
– (3,1210–5
– X) моль/л. Подставляем эти величины в
выражение для второй константы
диссоциации:
Кдис(2)
=.
Таким
образом, концентрация аниона серы
практически равна значению второй
константы диссоциации кислоты.
3.3. Шкала термодинамических функций образования ионов в водных растворах
Пример 1.На основе
справочных данных определить вторую
константу диссоциации ортофосфорной
кислоты при 298,15 К.
Решение.Второй ступени диссоциации ортофосфорной
кислоты соответствует процесс:
Находим
стандартную энергию Гиббса этого
процесса:
G0=G0обрH+(р-р,
ст.с) + G0обрHPO42-(р-р,
ст.с, гип.недис) –
– G0обрH2PO4—
(р-р, ст.с,
гип.недис) = 0
+ (–1083,2) – (–1124,3) = 41,1 кДж .
Затем определяем
константу диссоциации:
G0
= –RTlnKравн
= –RTlnKдис(2)
Кдис(2) =.
Пример
2. Стандартная
энтальпия образования NaCl
(к) равна –411,1 кДж/моль, энтальпия
растворения этого соединения в воде с
образованием бесконечно разбавленного
раствора равна 3,6 кДж/моль, а стандартная
энтальпия образования аниона хлора в
водном растворе составляет –167,1 кДж/моль.
Определить стандартную энтальпию
образования иона Na+
.
Решение.
Ключом к нахождению искомой величины
является положение, что стандартная
энтальпия образования NaCl
в растворе равна сумме стандартных
энтальпий образования ионов Na+
и Сl–
в растворе. Первая же величина, в свою
очередь, равнасумме
стандартных энтальпий образования NaCl
(к) и энтальпии его растворения с
образованием бесконечно разбавленного
раствора. Таким образом:
H0обр
NaCl(р-р, ст.с)=
H0обр
Na+(р-р, ст.с)+
H0обр
Cl—(р-р, ст.с)=
= H0обр
NaCl(к)+
H0раств;
H0обр
Na+(р-р, ст.с)=
H0обр
NaCl
(к)+
H0раств– H0обр
Cl—(р-р, ст.с)=
= –411,1 + 3,6 – (–167,1)
= –240,4 кДж/моль .
Пример 3. По следующим
данным:
H0обр
NaCl(р-р, ст.с)=
–407,5 кДж/моль = H01;
H0обр
KCl(р-р, ст.с)=
–419,4 кДж/моль = H02;
H0обр
NaBr(р-р, ст.с)=
–361,8 кДж/моль = H03;
H0обр
NaI(р-р, ст.с)=
–295,6 кДж/моль = H04
.
определить
H0обрKBr(р-р, ст.с);H0обрKI(р-р, ст.с) .
Решение.Поскольку стандартные энтальпии
образования электролитов
в растворе
тождественно равны сумме стандартных
энтальпий образования составляющих их
ионов, можно записать:
H0обрKCl(р-р, ст.с)–
H0обрNaCl(р-р, ст.с)=
H0обрK+(р-р, ст.с)+
+
H0обрCl–
(р-р, ст.с)– H0обрNa+(р-р, ст.с)–
H0обрCl–(р-р, ст.с) =
=
H0обрK+(р-р, ст.с)–
H0обрNa+(р-р, ст.с)
Складываем
эту величину c
H0обрNaBr(p-p,
ст.с)и получаем:
H0обрK+(р-р, ст.с)–
H0обрNa+(р-р, ст.с) +
H0обрNaBr(р-р, ст.с)=
=
H0обрK+(р-р, ст.с)–
H0обрNa+
(р-р,
ст.с)
+ H0обрNa+
(р-р,
ст.с) +
+
H0обрBr–
(р-р, ст.с)= H0обрKBr(р-р, ст.с)
Находим
одну из искомых величин:
H0обрKBr(р-р, ст.с)=
H02
–
H01
+
H03
= –419,4 –
(–407,5) + (–361,8) =
= – 373,7 кДж/моль.
Аналогично
определяем H0обрKI(р-р, ст.с):
H0обрKCl(р-р, ст.с)–
H0обрNaCl(р-р, ст.с)+
H0обрNaI(р-р, ст.с)=
=
H0обрK+
(р-р, ст.с)–
H0обрNa+
(р-р,
ст.с)
+ H0обрNa+
(р-р,
ст.с) +
+
H0обрI–(р-р,
ст.с)= H0обрKI(р-р, ст.с)=
H02
– H01
+
H04
=
= –419,4 – (–407,5) +
(–295,6) = – 307,5 кДж/моль.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Степень диссоциации
Классификация электролитов
Диссоциация электролитов
Константа диссоциации
Примеры решения задач
Задачи для самостоятельного решения
Степень диссоциации
Вещества, которые в растворах или расплавах полностью или частично распадаются на ионы, называются электролитами.
Степень диссоциации α — это отношение числа молекул, распавшихся на ионы N′ к общему числу растворенных молекул N:
α = N′/N
Степень диссоциации выражают в процентах или в долях единицы. Если α =0, то диссоциация отсутствует и вещество не является электролитом. В случае если α =1, то электролит полностью распадается на ионы.
Классификация электролитов
Согласно современным представлениям теории растворов все электролиты делятся на два класса: ассоциированные (слабые) и неассоциированные (сильные). Неассоциированные электролиты в разбавленных растворах практически полностью диссоциированы на ионы. Для этого класса электролитов a близко к единице (к 100 %). Неассоциированными электролитами являются, например, HCl, NaOH, K2SO4 в разбавленных водных растворах.
Ассоциированные электролиты подразделяются на три типа:
-
-
- Слабые электролиты существуют в растворах как в виде ионов, так и в виде недиссоциированных молекул. Примерами ассоциированных электролитов этой группы являются, в частности, Н2S, Н2SO3, СН3СOОН в водных растворах.
- Ионные ассоциатыобразуются в растворах путем ассоциации простых ионов за счет электростатического взаимодействия. Ионные ассоциаты возникают в концентрированных растворах хорошо растворимых электролитов. В результате в растворе находятся как простые ионы, так и ионные ассоциаты. Например, в концентрированном водном растворе КCl образуются простые ионы К+, Cl— , а также возможно образование ионных пар (К+Cl— ), ионных тройников (K2Cl+, KCl2— ) и ионных квадруполей (K2Cl2, KCl32- , K3Cl2+).
- Комплексные соединения(как ионные, так и молекулярные), внутренняя сфера которых ступенчато диссоциирует на ионные и (или) молекулярные частицы.
Примеры комплексных ионов: [Cu(NH3)4]2+, [Fe(CN)6]3+, [Cr(H2O)3Cl2]+.
-
При таком подходе один и тот же электролит может относиться к различным типам в зависимости от концентрации раствора, вида растворителя и температуры. Подтверждением этому являются данные, приведенные в таблице.
Таблица. Характеристика растворов KI в различных растворителях
| Концентрация электролита, С, моль/л | Температура
t,оС |
Растворитель | Тип электролита |
| 0,01 | 25 | Н2О | Неассоциированный (сильный) |
| 5 | 25 | Н2О | Ионный ассоциат |
| 0,001 | 25 | С6Н6 | Ассоциированный (слабый) |
Приближенно, для качественных рассуждений можно пользоваться устаревшим делением электролитов на сильные и слабые. Выделение группы электролитов “средней силы” не имеет смысла. Эти электролиты являются ассоциированными. К слабым электролитам обычно относят электролиты, степень диссоцииации которых мала α<<1.
Таким образом, к сильным электролитам относятся разбавленные водные растворы почти всех хорошо растворимых в воде солей, многие разбавленные водные растворы минеральных кислот (НСl, HBr, НNО3, НСlO4 и др.), разбавленные водные растворы гидроксидов щелочных металлов. К слабым электролитам принадлежат все органические кислоты в водных растворах, некоторые водные растворы неорганических кислот, например, H2S, HCN, H2CO3, HNO2, HСlO и др. К слабым электролитам относится и вода.
Диссоциация электролитов
Уравнение реакции диссоциации сильного электролита можно представить следующим образом. Между правой и левой частями уравнения реакции диссоциации сильного электролита ставится стрелка или знак равенства:
HCl → H+ + Cl—
Na2SO3 = 2Na+ + SO32-
Допускается также ставить знак обратимости, однако в этом случае указывается направление, в котором смещается равновесие диссоциации, или указывается, что α≈1. Например:
NaOH → Na+ + OH—
Диссоциация кислых и основных солей в разбавленных водных растворах протекает следующим образом:
NaHSO3 → Na+ + HSO3—
Анион кислой соли будет диссоциировать в незначительной степени, поскольку является ассоциированным электролитом:
HSO3— → H+ + SO32-
Аналогичным образом происходит диссоциация основных солей:
Mg(OH)Cl → MgOH+ + Cl—
Катион основной соли подвергается дальнейшей диссоциации как слабый электролит:
MgOH+ → Mg2+ + OH—
Двойные соли в разбавленных водных растворах рассматриваются как неассоциированные электролиты:
KAl(SO4)2 → K+ + Al3+ + 2SO42-
Комплексные соединения в разбавленных водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы:
K3[Fe(CN)6] → 3K+ + [Fe(CN)6]3-
В свою очередь, комплексный ион в незначительной степени подвергается дальнейшей диссоциации:
[Fe(CN)6]3- → Fe3+ + 6CN—
Константа диссоциации
При растворении слабого электролита КА в растворе установится равновесие:
КА ↔ К+ + А—
которое количественно описывается величиной константы равновесия Кд, называемой константой диссоциации:
Kд = [К+] · [А—] /[КА] (2)
Константа диссоциации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем больше ионов в растворе слабого электролита. Например, в растворе азотистой кислоты HNO2 ионов Н+ больше, чем в растворе синильной кислоты HCN, поскольку К(HNO2) = 4,6·10— 4, а К(HCN) = 4,9·10— 10.
Для слабых I-I электролитов (HCN, HNO2, CH3COOH) величина константы диссоциации Кд связана со степенью диссоциации α и концентрацией электролита c уравнением Оствальда:
Кд = (α2·с)/(1-α) (3)
Для практических расчетов при условии, что α<<1 используется приближенное уравнение:
Кд = α2·с (4)
Поскольку процесс диссоциации слабого электролита обратим, то к нему применим принцип Ле Шателье. В частности, добавление CH3COONa к водному раствору CH3COOH вызовет подавление собственной диссоциации уксусной кислоты и уменьшение концентрации протонов. Таким образом, добавление в раствор ассоциированного электролита веществ, содержащих одноименные ионы, уменьшает его степень диссоциации.
Следует отметить, что константа диссоциации слабого электролита связана с изменением энергии Гиббса в процессе диссоциации этого электролита соотношением:
ΔGT0 = — RTlnKд (5)
Уравнение (5) используется для расчета констант диссоциации слабых электролитов по термодинамическим данным.
Примеры решения задач
Задача 1. Определите концентрацию ионов калия и фосфат-ионов в 0,025 М растворе K3PO4.
Решение. K3PO4 – сильный электролит и в водном растворе диссоциирует полностью:
K3PO4 → 3К+ + РО43-
Следовательно, концентрации ионов К+ и РО43- равны соответственно 0,075М и 0,025М.
Задача 2. Определите степень диссоциации αд и концентрацию ионов ОН— (моль/л) в 0,03 М растворе NH3·H2О при 298 К, если при указанной температуре Кд(NH3·H2О) = 1,76× 10— 5.
Решение. Уравнение диссоциации электролита:
NH3·H2О → NH4+ + OH—
Концентрации ионов: [NH4+] = αС ; [OH—] = αС , где С – исходная концентрация NH3·H2О моль/л. Следовательно:
Kд = αС · αС /(1 — αС)
Поскольку α << 1, то:
Кд ≈ α 2С
Константа диссоциации зависит от температуры и от природы растворителя, но не зависит от концентрации растворов NH3·H2О. Закон разбавления Оствальда выражает зависимость α слабого электролита от концентрации.
α = √(Кд / С) = √(1,76× 10— 5 / 0,03) = 0,024 или 2,4 %
[OH—] = αС, откуда [OH— ] = 2,4·10— 2·0,03 = 7,2·10-4 моль/л.
Задача 3. Определите константу диссоциации уксусной кислоты, если степень диссоциации CH3CОOH в 0,002 М растворе равна 9,4 %.
Решение. Уравнение диссоциации кислоты:
CH3CОOH → СН3СОО— + Н+.
α = [Н+] / Сисх(CH3CОOH)
откуда [Н+] = 9,4·10—2·0,002 = 1,88·10-4 М.
Так как [CH3CОO—] = [Н+] и [CH3CОOH] ≈ Сисх(CH3CОOH), то:
Kд = [Н+]2 / Сисх(CH3CОOH)
Константу диссоциации можно также найти по формуле: Кд ≈ α 2С.
Задача 4. Константа диссоциации HNO2 при 298К равна 4,6× 10— 4. Найдите концентрацию азотистой кислоты, при которой степень диссоциации HNO2 равна 5 %.
Решение.
Кд =α 2С , откуда получаем Сисх(HNO2) = 4,6·10— 4/(5·10— 2)2 = 0,184 М.
Задача 5. На основе справочных данных рассчитайте константу диссоциации муравьиной кислоты при 298 К.
Решение. Уравнение диссоциации муравьиной кислоты
НСООН →Н+ + СООН—
В “Кратком справочнике физико–химических величин” под редакцией А.А. Равделя и А.М. Пономаревой приведены значения энергий Гиббса образований ионов в растворе, а также гипотетически недиссоциированных молекул. Значения энергий Гиббса для муравьиной кислоты и ионов Н+ и СООН— в водном растворе приведены ниже:
| Вещество, ион | НСООН | Н+ | СООН— |
| ΔGT0, кДж/моль | — 373,0 | 0 | — 351,5 |
Изменение энергии Гиббса процесса диссоциации равно:
ΔGT0 = — 351,5- (- 373,0) = 21,5 кДж/моль.
Для расчета константы диссоциации используем уравнение (5). Из этого уравнения получаем:
lnKд = — Δ GT0/RT= — 21500/(8,31 298) = — 8,68
Откуда находим: Kд = 1,7× 10— 4.
Задачи для самостоятельного решения
1. К сильным электролитам в разбавленных водных растворах относятся:
- СН3СOOH
- Na3PO4
- NaCN
- NH3
- C2H5OH
- HNO2
- HNO3
13.2. К слабым электролитам в водных растворах относятся:
- KAl(SO4)2
- NaNO3
- HCN
- NH4Cl
- C2H5OH
- H2SO3
- H2SO4
3. Определите концентрацию ионов NH4+ в 0,03 М растворе (NH4)2Fe(SO4)2;
4. Определите концентрацию ионов водорода в 6 мас.% растворе H2SO4, плотность которого составляет 1,038 г/мл. Принять степень диссоциации кислоты по первой и второй ступеням равной 100 %.
5. Определите концентрацию гидроксид-ионов в 0,15 М растворе Ba(OH)2.
6. Степень диссоциации муравьиной кислоты в 0,1 М растворе равна 4 %. Рассчитайте Концентрацию ионов водорода в этом растворе и константу диссоциации НСООН.
7. Степень диссоциации муравьиной кислоты в водном растворе увеличится при:
а) уменьшении концентрации HCOOH;
б) увеличении концентрации HCOOH;
в) добавлении в раствор муравьиной кислоты HCOONa;
г) добавлении в раствор муравьиной кислоты НCl.
8. Константа диссоциации хлорноватистой кислоты равна 5× 10— 8. Определите концентрацию HClO, при которой степень диссоциации HClO равна 0,5 %, и концентрацию ионов Н+ в этом растворе.
9. Вычислите объем воды, который необходимо добавить к 50 мл 0,02 М раствора NH3·H2О, чтобы степень диссоциации NH3·H2О увеличилась в 10 раз, если Кд(NH4OH) = 1,76·10— 5.
10. Определите степень диссоциации азотистой кислоты в 0,25 М растворе при 298 К, если при указанной температуре Кд(HNO2) = 4,6× 10— 4.
Запишем уравнение диссоциации:
HCOOH = H⁺ + HCOO⁻
Введем обозначения: Ca — концентрация кислоты, α — степень диссоциации, [H⁺], [HCOO⁻] — равновесные концентрации ионов водорода и формиат-ионов соответственно.
Запишем выражение для константы диссоциации:
Так как муравьиная кислота слабая, то ее равновесные концентрации можно представить в виде:
[H⁺] = αCa
[HCOO⁻] = αCa
Это видно из уравнения диссоциации
[HCOOH] = (1-α)Ca т.к. α — мала, ей можем пренебречь и получим: [HCOOH] = Ca
С учетом введенный обозначений перепишем уравнение для константы диссоциации:
Подставляем формулу:
Kd = Ca*α² = 0,2 моль/л * (0,032)² = 2,048*10⁻⁴
0
Константа диссоциации равна по определению:
α = [H+]*[HCOO—]/
[HCOOH]Концентрацию HCOOH можно считать равной концентрации ионов OH—, т.к. они получаются одновременно в в процессе гидролиза:
HCOO— + H2O = HCOOH + OH—
Концентрация OH— равна 10-(14-8,6) = 10-5,4
Концентрацию HCOO— можно считать равной концентрации исходной соли (равновесие в реакции гидролиза сильно смещено влево), т.е. 0,25М.
Концентрация H+ находится тривиально как 10-8,6.
Итого α = 10-8.6*0.25/10-5.4 = 10-3.8 = 1.58*10-4,
что неплохо согласуется с табличными данными (1,8*10-4)