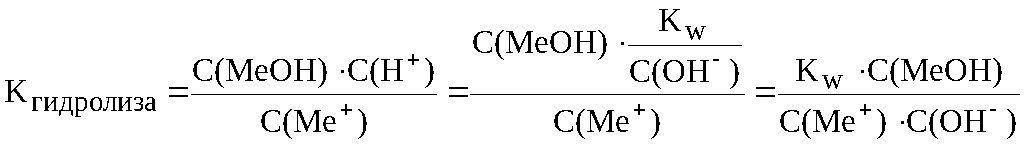…
В общем случае, гидролиз солей – это процесс обменного разложения воды и растворенной в ней соли – электролита, приводящий к образованию малодиссоциирующего вещества.
Гидролиз является частным случаем сольволиза – обменного разложения растворенного вещества и растворителя.
Характеризовать гидролиз количественно позволяют такие величины, как Степень гидролиза и константа гидролиза.
Степень гидролиза
Степень гидролиза — это соотношение количества подвергающейся гидролизу соли nгидр и общего количества растворенной соли nобщ.
Обычно, ее обозначают через hгидр (или α ):
hгидр = (nгидр/nобщ)·100 %
Величина hгидр увеличивается с уменьшением силы образующих соль кислоты или основания.
Константа гидролиза
Представим в общем виде процесс гидролиза соли, в котором в роли соли выступает – МА, а НА и МОН — соответственно, кислота и основание, которые образуют данную соль:
MA + H2O ↔ HA + MOH
Применив закон действующих масс, запишем константу, соответствующую этому равновесию:
K = [HA]·[MOH]/[MA]·[H2O]
Известно, что концентрация воды в разбавленных растворах, имеет практически постоянное значение, поэтому ее можно включить в константу
K·[H2O]= Kг,
тогда соотношение для константы гидролиза соли Kгбудет иметь такой вид:
Kг = [HA]·[MOH]/[MA]
По величине константы гидролиза можно судить о полноте гидролиза:
чем больше значение константы гидролиза Kг, тем в большей мере протекает гидролиз.
Константа и степень гидролиза связаны соотношением:
Kг = С·h2/(1- h), моль/л
Где С – концентрация соли в растворе,
h- степень гидролиза.
Это выражение можно упростить, т.к. обычно h˂˂1, тогда
Kг = С·h2
Зная, константу гидролиза, можно определить pH среды:
Kг = [HA]·[MOH]/[MA]
Концентрация образовавшейся кислоты равна концентрации гидроксид ионов, тогда
Kг = [OH—]2/[MA]
Используя это выражение можно вычислить pH раствора
[OH—] = (Kг·[MA])1/2 моль/л
[H+] = 10-14/[OH—] моль/л
pH = -lg[H+]
Гидролиз солей можно представить, как поляризационное взаимодействие ионов и их гидратной оболочки.
Гидролиз протекает тем полнее, сильнее поляризующее действие ионов.
Возможны 4 случая протекания гидролиза:
1. Соли, образованные сильным основанием и сильной кислотой (гидролиз не протекает)
Соли, образованные сильным основанием и сильной кислотой не подвергаются гидролизу.
В этом случае, гидролиз практически не происходит, т.к. катионы и анионы, образующиеся в растворе при диссоциации соли, слабо поляризуют гидратную оболочку. pH среды не изменяется (рН ≈ 7):
NaCl ↔ Na+ + Cl—
Na+ + HOH ↔ реакция практически не протекает
Cl— + HOH ↔ реакция практически не протекает
2. Соли, образованные слабым основанием и сильной кислотой (гидролиз по катиону)
Такое соединение, при ионизации, образует катионы, способные к поляризации гидратной оболочки и анионы, которые их поляризуют слабо. Тогда гидролиз проходит по катиону, при этом среда носит кислый характер, т.е. рН ˂ 7:
NH4Cl ↔ NH4+ + Cl—
NH4+ + HOH ↔ NH4OH + H+
Cl—+ HOH ↔ реакция практически не идет
NH4Cl+ HOH ↔ NH4OH + HCl
Для солей, образованных слабым основанием и сильной кислотой, константа гидролиза и константа диссоциации основания связаны соотношением:
Kг = KH2O/Kосн
Понятно, что чем меньше сила основания, тем в большей степени протекает гидролиз.
Если соль образованна слабым основанием многовалентного металла и сильной кислотой, то ее гидролиз будет протекать ступенчато:
FeCl2 ↔ Fe2+ + 2Cl—
| I ступень | Fe2++ HOH ↔ (FeOH)+ + H+ FeCl2 + HOH ↔ (FeOH)Cl + HCl |
| II ступень | (FeOH)+ + HOH ↔ Fe(OH)2 + H+ (FeOH)Cl + HOH↔ Fe(OH)2 + HCl |
Константа гидролиза по первой ступени связана с константой диссоциации основания по второй ступени, а константа гидролиза по второй ступени — с константой диссоциации основания по первой ступени:
Kг1 = KH2O/Kосн2
Kг2 = KH2O/Kосн1
Поскольку первая константа диссоциации кислоты всегда больше второй, то первая константа гидролиза всегда больше, чем константа вторая гидролиза, так как первая константа диссоциации основания всегда больше второй
Kг1 > Kг2
Отсюда следует, что по первой ступени, гидролиз всегда будет протекать в большей степени, чем по второй. Этому также способствуют ионы, которые образуются при гидролизе по первой ступени, они приводят подавлению гидролиза по второй ступени, смещая равновесие влево.
Сравнивая величины Kг и Kосн можно качественно определить pH среды.
Так, если Kгнамного больше Kосн, то среда сильнокислая, при Kгнамного меньшей Kосн — среда слабокислая, а если Kги Kосн сопоставимы, то — среднекислая.
3. Соль, образованная сильным основанием и слабой кислотой (гидролиз по аниону)
Такое соединение в растворе образует слабополяризующие катионы и среднеполяризующие анионы. Гидролиз протекает по аниону, и в его результате создается щелочная среда, pH > 7:
NaCN ↔ Na+ + CN—
CN— + HOH ↔ HCN + OH—
Na+ + HOH ↔ реакция практически не идет
NaCN + HOH ↔ HCN + NaOH
Константа гидролиза и константа диссоциации кислоты связаны зависимостью:
Kг = KH2O/Kк-ты
Т.е. гидролиз соли протекает тем полнее, чем слабее образующая эту соль, кислота.
Возможен гидролиз соли, образованной слабой многоосновной кислотой и сильным основанием. В этом случае гидролиз протекает по ступеням:
Na2SO3 ↔ 2Na+ + SO32-
| I ступень | SO32- + HOH ↔ HSO3— + OH— Na2SO3 + HOH ↔ NaHSO3 + NaOH |
| II ступень | HSO3— + HOH ↔ H2SO3 + OH— NaHSO3 + HOH ↔ H2SO3 + NaOH |
В этом случае, константа гидролиза по первой и второй ступеням определяется соотношениями:
Kг1 = KH2O/Kк-ты2
Kг2 = KH2O/Kк-ты1
Следует помнить, что гидролиз по второй ступени протекает в ничтожно малой степени.
Сравнивая величины Kг и Kк-ты, можно качественно определить pH среды. Так, если Kгнамного больше Kк-ты, то среда сильнощелочная, при Kгнамного меньшей Kк-ты — среда слабощелочная, а если Kги Kосн сопоставимы, то — среднещелочная.
4. Соли, образованные слабым основанием и слабой кислотой (гидролиз и по катиону и по аниону)
Такие соли, при ионизации образуют среднеполяризующие катионы и анионы, поэтому гидролиз возможен как по катиону, так и по аниону.
При этом относительная сила образовавшихся кислоты и основания, будут влиять на характер среды (слабокислая или слабощелочная, pH ≈ 7). Такого типа гидролиз протекает особо полно, обычно с образованием малорастворимого вещества:
Al2S3 + 6HOH ↔ 2Al(OH)3↓+ 3H2S↑
Константу гидролиза можно рассчитать, зная константы диссоциации кислоты и основания с помощью следующего соотношения:
Kг = KH2O/(Kк-ты·Kосн)
Совместный гидролиз солей
Совместный гидролиз протекает при взаимодействии растворов двух солей, одна из которых образована слабым основанием и сильной кислотой, а вторая напротив сильным основанием и слабой кислотой. Т.е. одна соль гидролизуется по катиону, а другая – по аниону.
В таких случаях гидролиз взаимно усиливается.
Например, рассмотрим совместный гидролиз растворов солей хлорида алюминия и сульфида натрия:
При гидролизе хлорида алюминия соль гидролизуется по катиону:
AlCl3 ↔ Al3+ + 3Cl—
Al3+ + 3HOH ↔ Al(OH)3 + 3H+
При гидролизе сульфида натрия соль гидролизуется по аниону:
Na2S ↔ 2Na+ + S2-
S2- + 2HOH ↔ H2S + 2OH—
Суммарная реакция гидролиза:
2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3↓ + 3H2S↑ + 6NaCl
Влияние различных факторов на протекание гидролиза
- Природа соли. Это видно из выражения для константы гидролиза.
- Концентрация соли и продуктов реакции. В соответствии с принципом Ле-Шателье, равновесие должно смещаться вправо, при этом увеличивается концентрация ионов водорода (или гидроксид-ионов), что приводит к уменьшению степени гидролиза.
- Температура. Известно, что гидролиз притекает с поглощением теплоты (эндотермическая реакция), поэтому согласно принципу Ле Шателье, при увеличении температуры равновесие сдвигается вправо, что ведет к росту степени гидролиза.
В разделе Задачи к разделу Гидролиз солей приведены задачи на определение степени и константы гидролиза, составление уравнений гидролиза, определение рН среды и др.
Гидролиз
солей в большинстве случаев протекает
обратимо. Поэтому для процесса гидролиза,
как и любого равновесного процесса
можно записать выражение константы
равновесия. Константа равновесия в
данном случае называется константой
гидролиза.
Для
соли, гидролизующейся по катиону Me+
+ HOH ⇆
MeOH + H+
.
(8.1)
Поскольку
в разбавленных водных растворах
концентрация воды постоянна (см. раздел
7.7 предыдущей лекции), то её не записывают
в выражении константы гидролиза. Формулу
8.1 можно преобразовать, выразив
концентрацию ионов водорода из уравнения
ионного произведения воды C(H+)·C(OH–)
= Kw
.
В
ыражение
есть ни что иное, как величина, обратная
константе
диссоциации слабого основания KMeOH
. Таким образом, окончательно получается
следующее уравнение для расчёта
константы гидролиза соли, гидролизующейся
по катиону:
.
(8.2)
Это
уравнение показывает, что константа
гидролиза соли, гидролизующейся только
по катиону тем больше, чем меньше
константа диссоциации основания,
которым образована соль. Это означает,
что соль гидролизуется тем сильнее,
чем более слабым основанием, она
образована.
Можно
также показать, что для соли гидролизующейся
только по аниону An–
+ HOH ⇆
HAn + OH–
константа гидролиза
(8.3)
может
быть вычислена по следующему уравнению,
аналогичному уравнению 8.2:
.
(8.4)
В
формуле 8.4 KHAn
– константа диссоциации слабой кислоты,
которой образована соль. Последнее
уравнение показывает, что Kгидролиза
тем больше, чем меньше KHAn,
т.е. гидролиз по аниону протекает тем
сильнее, чем слабее кислота, которой
образована соль.
Ниже
приводится вывод формулы константы
гидролиза для соли, гидролизующейся
одновременно и по катиону, и по аниону.
Me+
+ An–
+ HOH ⇆
MeOH + HAn.
(8.5)
Уравнение
8.5 можно преобразовать, умножая и
числитель, и знаменатель на константу
ионного произведения воды.
(8.6)
8.3 Степень гидролиза соли; её связь с константой гидролиза
Отношение
концентрации соли, подвергшейся
гидролизу к общей концентрации соли в
растворе называется степенью гидролиза
соли.
(8.7)
В
формуле 8.7 h – степень гидролиза;
Cгидр.
– концентрация соли, подвергшейся
гидролизу;
C0
– общая концентрация соли в растворе
.
П
x
C0-x
x
усть имеется раствор соли,
гидролизующейся по катиону, с общей
концентрацией соли C0.
Обозначим концентрацию соли, подвергшейся
гидролизу x моль/л. Тогда в результате
гидролиза образовалось x моль/л основания
MeOH и x моль/л ионов H+;
концентрация соли, не подвергшейся
гидролизу, будет равна C0
— x моль/л.
Me+
+ HOH ⇆
MeOH + H+
Если
гидролиз соли протекает в небольшой
степени, то «иксом» в знаменателе
последнего выражения можно пренебречь,
поскольку C0
>> x.
(8.8 а)
П
оскольку
x
= C(H+),
эта формула применима для расчёта
концентрация ионов водорода в растворе
соли, гидролизующейся по катиону.
(8.8 б)
Ниже
приведён вывод формулы для степени
гидролиза соли, гидролизующейся по
катиону.
(8.9)
Можно
также показать, что концентрацию ионов
OH–
в растворе соли, гидролизующейся только
по аниону, можно вычислить по формуле
,
(8.10)
которая
аналогична уравнению 8.8 б.
Степень
гидролиза соли, гидролизующейся по
аниону, также как и степень гидролиза
соли, гидролизующейся по катиону,
вычисляется по формуле 8.9.
Как
видно из полученных формул, степень
гидролиза соли, гидролизующейся только
по катиону, или только по аниону тем
больше, чем меньше концентрация соли,
т.е. степень гидролиза такой соли
увеличивается с разбавлением раствора.
Степень
гидролиза соли, гидролизующейся
одновременно и по катиону, и по аниону
Me+
+ An–
+ HOH ⇆
MeOH + HАn ,
не
зависит от концентрации раствора. Если
общая концентрация этой соли в растворе
равна C0
моль/л, а концентрация соли, подвергшейся
гидролизу равна x моль/л, то в результате
гидролиза образуется x моль/л основания
MeOH и x моль/л кислоты HAn; концентрация
соли, не подвергшейся гидролизу, будет
равна C0-x
моль/л.
M
x
x
С0-x
С0-x
e+
+ An–
+ HOH ⇆
MeOH + HAn
(8.11)
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Теоретическое введение
Примеры обратимого гидролиза
Случаи необратимого гидролиза
Константа и степень гидролиза
Примеры решения задач
Задачи для самостоятельного решения
Теоретическое введение
Гидролиз – обменная реакция взаимодействия растворенного вещества (например, соли) с водой. Гидролиз происходит в тех случаях, когда ионы соли способны образовывать с Н+ и ОН— ионами воды малодиссоциированные электролиты.
Примеры обратимого гидролиза
Соли, образованные сильным основанием и слабой кислотой, например, CH3COONa, Na2CO3, Na2S, KCN гидролизуются по аниону:
СН3СООNa + НОН ↔ СН3СООН + NaОН (рН > 7)
Гидролиз солей многоосновных кислот протекает ступенчато. 1 ступень:
CO32– + HOH ↔ HCO3– + OH–,
или в молекулярной форме:
Na2CO3 + HOH ↔ NaHCO3 + NaOH.
2 ступень:
НCO3– + HOH ↔ Н2CO3 + OH—,
или в молекулярной форме:
NaНCO3 + HOH ↔ H2CO3 + NaOH.
Продукты гидролиза по первой ступени подавляют вторую ступень гидролиза, в результате вторая ступень гидролиза протекает незначительно.
Соли, образованные слабым основанием и сильной кислотой, например, NH4Cl, FeCl3, Al2(SO4)3, гидролизуются по катиону:
NH4+ + HOH ↔ NH3·H2О + H+
или в молекулярной форме:
NH4Cl + HOH ↔ NH3·H2О + HCl (рН < 7).
Соли, образованные многокислотными основаниями, гидролизуются ступенчато, образуя катионы основных солей. 1 ступень:
Fe3+ + HOH ↔ FeOH2+ + H+;
FeCl3 + HOH ↔ FeOHCl2 + HCl
2 ступень:
FeOH2+ + HOH ↔ Fe(OH)2+ + H+;
FeOHCl2 + HOH ↔ Fe(OH)2Cl+ HCl.
3 ступень:
Fe(OH)2+ + HOH ↔ Fe(OH)3 + H+;
Fe(OH)2Cl + HOH ↔ Fe(OH)3+ HCl.
Гидролиз по второй и, в особенности, по третьей ступени практически не протекает при комнатной температуре.
Соли, образованные слабым основанием и слабой кислотой, например, CH3COONH4, (NH4)2CO3, HCOONH4, гидролизуются и по катиону, и по аниону:
СH3COO– + NH4+ + HOH ↔ СH3COOH + NH3·H2О.
СH3COONH4 + HOH ↔ СH3COOH + NH3·H2О.
В этом случае реакция раствора зависит от соотношения констант диссоциации образующихся кислот и оснований. Поскольку в рассматриваемом примере константы диссоциации СH3COOH и NH3·H2О при 25оС примерно равны (Кд(СH3COOH) = 1,75·10–5, Кд(NH3·H2О) = 1,76·10–5), то раствор соли будет нейтральным.
При гидролизе HCOONH4 реакция раствора будет слабокислой, поскольку константа диссоциации муравьиной кислоты (Кд(HCOOН) = 1,77·10–4) больше константы диссоциации уксусной кислоты.
Соли, образованные сильным основанием и сильной кислотой (например, NaNO3, KCl, Na2SO4), при растворении в воде гидролизу не подвергаются.
Случаи необратимого гидролиза
Гидролиз некоторых солей, образованных слабыми основаниями и слабыми кислотами, протекает необратимо. Необратимо гидролизуется, например, сульфид алюминия:
Al2S3 + 6H2O → 2Al(OH)3↓ + 3H2S↑
Следует отметить, что при смешении растворов солей гидролизующихся по аниону и катиону:
Mg2+ + HOH ↔ MgOH+ + H+,
CO32– + HOH ↔ HCO3– + OH–
Продукты гидролиза первой соли усиливают гидролиз второй соли и наоборот. В результате при смешении водных растворов сульфата магния и карбоната натрия образуется основной карбонат магния:
2MgSO4 + 2Na2CO3 + H2O → Mg2(OH)2CO3↓ + CO2↑ + 2Na2SO4
Основные карбонаты выпадают в осадок также при смешивании растворов карбонатов щелочных металлов и солей Be2+, Co2+, Ni2+, Zn2+, Pb2+, Cu2+ и др.
При сливании растворов соды и солей Fe2+, Ca2+, Sr2+, Ba2+ реакции протекают следующим образом:
МеCl2 + Na2CO3 = МеCO3↓ + 2NaCl
(Ме – Fe, Ca, Sr, Ba)
При взаимодействии солей Аl3+, Сr3+ и Fe3+ в растворе с сульфидами, карбонатами и сульфитами в результате гидролиза в осадок выпадают не сульфиды, карбонаты и сульфиты этих катионов, а их гидроксиды:
2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3↓ + 3H2S↑ + 6NaCl,
2CrCl3 + 3K2CO3 + 3H2O = 2Сr(ОН)3↓ + 3СO2↑ + 6KCl,
2Fe(NO3)3 + 3Na2SO3 + 3H2O = 2Fe(ОН)3↓ + 3SO2↑ + 6NaNO3.
Следует отметить, что катион Fe3+ производит окисляющее действие на анион S2-. В результате протекает реакция:
2Fe3+ + S2- = 2Fe2+ + Sо.
Например, хлорид железа (III) реагирует с сульфидом калия:
2FeCl3 + 3K2S = 2FeS + S + 6KCl
Некоторые соли в результате гидролиза в воде образуют малорастворимые оксосоединения:
Bi(NO3)3 + H2O → BiONO3↓ + 2 HNO3,
SbCl3 + H2O → SbOCl↓ + 2HCl.
Необратимо гидролизуются в водных растворах галогенангидриды:
SO2Cl2 + 2 H2O = H2SO4 + 2 HCl,
SOCl2 + 2 H2O = H2SO3 + 2 HCl,
PCl5 + 4 H2O = H3PO4 + 5 HCl,
CrO2Cl2 + 2H2O = H2CrO4 + 2HCl.
Константа и степень гидролиза
Константа Кг и α г степень гидролиза для растворов электролитов связаны между собой уравнением, по форме совпадающим с уравнением Оствальда:

Константа гидролиза Кг может быть рассчитана на основе значений ионного произведения воды Кw и константы диссоциации Кд образующихся в результате гидролиза слабой кислоты или слабого основания:

Примеры решения задач
Задача 1. Вычислите Кг, α г и рН 0,01 М раствора NH4Cl при температуре 298 К, если при указанной температуре Кд(NH3·H2O) = 1,76× 10-5.
Решение.
NH4+ + H2O ↔ NH3·H2O + H+

Кг ≈ Cисх(NH4Cl)·αг2.
αг2 = √(Kг / Cисх(NH4Cl))
или 2,4× 10-2 %.
[Н+] = 2,4·10–4× 0,01 = 2,4× 10–6М.
рН = — lg 2,4× 10–6 = 5,6.
Задача 2. Определите константу гидролиза, степень гидролиза и рН 0,02 М раствора НСООNa при 298 К, если при указанной температуре Кд(НСООН) = 1,77× 10–4.
Решение. Формиат натрия гидролизуется в соответствии с уравнением:
НСОО— + Н2О ↔ НСООН + ОН—.
Поскольку [НСООН] = [ОН–] и [НСОО–]·Сисх(НСООNa), то константу гидролиза можно записать следующим образом:

или 5,3·10-3%.
[Н+] = 10–14÷1,06× 10–6 = 9,4·10–9 М
рН = — lg 9,4× 10–9 = 8
Задача 3. Определите рН 0,006М раствора NaNO2, если α г = 7·10–3%.
Решение.
NO2– + H2O ↔ HNO2 + OH–.
[ОН–] = 0,006× 7× 10–5 = 4,2× 10–7 М.
[Н+] = 10–14:4,2× 10–7 = 2,4× 10–8 М.
рН = — lg 2,4× 10–8 = 7,6.
Задача 5. Определите рН 0,1 М раствора Na3PO4 при 298 К, если константы диссоциации ортофосфорной кислоты при указанной температуре соответственно равны: Кд.1 = 7,11× 10— 3, Kд.2 = 6,34× 10— 8, Kд.3 = 4,40× 10— 13.
Решение. Na3PO4 диссоциирует в растворе и подвергается ступенчатому гидролизу:
Na3PO4 → 3Na+ + PO43-
PO43- + H2O ↔ HPO42- + OH—
.
Следует обратить внимание на выбор “нужной” величины Кд.
HPO42- + H2O ↔ H2PO4- + OH—
H2PO4— + H2O H3PO4 + OH—
.
H2PO4— HPO42- + H+
Kдисс.2 = 6,34·10— 8
Поскольку Кг,3 < < Kд,2, то гидролиз по третьей ступени практически не идет и в растворе NaH2PO4 преобладает процесс диссоциации ионов H2PO4— .
Так как Кг,1 > > Кг,2, то можно считать, что соль подвергается гидролизу только по первой ступени.
Значит:

поскольку [HPO42- ] = [OH—].
Можно принять, что Сисх(Na3PO4) ≈ [PO43- ], тогда
рОН = –lg 4,76× 10— 2 = 1,32 и рН = 14 – 1,32 = 12,68.
Задачи для самостоятельного решения
1. Гидролиз соли Na2SO3 усилится при добавлении в раствор веществ:
| а) Н2O | б) Na2CO3 | в) NaOH |
| г) H2SO4 | д) Na2S | е) Na2SO4 |
2. Напишите уравнение реакции NiCl2 + Na2CO3 + H2O → .
3. Напишите уравнение реакции Fe2(SO4)3 + Na2CO3 + H2O→
4. Напишите уравнение реакции KCr(SO4)2 + K2S + 6H2O → .
5. Напишите уравнение реакции гидролизa BiCl3.
6. Напишите уравнение реакции гидролизa Al2(SO4)3.
7. Напишите уравнение реакции гидролизa SO2Cl2.
8. Определите рН 0,01 М раствора Na2 НPO4 при 298 К, если константы диссоциации ортофосфорной кислоты при указанной температуре соответственно равны:
К1 = 7,11× 10— 3, K2 = 6,34× 10— 8, K3 = 4,4× 10— 13.
9. При 298 К рН 0,049 М раствора KCN равен 11. Определите константу диссоциации синильной кислоты при указанной температуре.
10. Рассчитать константу гидролиза, степень гидролиза NH4NO3 в 0,18 М растворе, если рН 0,18 М раствора нитрата аммония равен 5.
План урока:
Гидролиз
Электролиз
Виды электродов
Значение электролиза
Гидролиз
Гидролиз – процесс распада молекул под действием молекул воды. Гидролизу подвергаются соли. Во время этого процесса образуются исходные вещества – кислота и основание. Если исходные компоненты растворимы в воде, процесс гидролиза обратим и продукты зафиксировать сложно, поэтому, гидролиз возможен только для тех солей, один из исходных компонентов которой – слабое соединение. В этом случае образуется продукт – осадок, газ или вода, выпадающий из общей реакции.
Процесс диссоциации хлорида натрия
Кроме гидролиза существует процесс диссоциации. По сути, это первая стадия гидролиза – разрушение молекулы водой. Если после этого происходит образование новых химических соединений, происходит гидролиз. Эти процессы могут идти одновременно и конкурировать между собой или будет преобладать только один из вариантов.
Константа гидролиза солей
Хоть гидролиз и является общим свойством селей, многие соли подвергаются ему в разной степени. Это зависит не только от наличия сильного и слабого иона, но и от растворимости самой соли.
Степень гидролиза определенной соли называют константой гидролиза солей и обозначают Kr. Это табличные данные, но в эксперименте их можно посчитать по формуле: К = [К+][А–]/[КА]. То есть, чтобы определить этот параметр, нужно концентрацию катионов и анионов разделить на концентрацию недиссоциированных молекул. Максимальное значение константы = 1. Чем ближе к этой цифре, тем выше степень гидролиза молекулы.
Константа зависит от ряда параметров:
- Температура раствора;
- Природа соли (ее растворимость);
- Длительность процесса.
Но, не зависит от концентрации соли и объема реакционной среды.
Одно и то же вещество может иметь разные значения константы гидролиза. Это характерно для таких молекул, у которых несколько атомов катиона или аниона. Например, Na3PO4 распадается постепенно, отщепляя по одному атому Na:
- Na3PO4↔ Na+ + Na2PO4—
- Na2PO42- ↔ Na+ + NaPO42-
- NaPO42-↔ Na+ + PO43-
- Суммарно: Na3PO4↔3Na+ + PO43-
Активнее всего процесс будет идти по первой ступени, ниже по второй. Третий этап, практически, не осуществим.
Обратимый гидролиз
Если в растворе идет как распад исходной молекулы с образованием новых продуктов, так и образование молекул этого же вещества, это обратимый гидролиз. В качестве примера рассмотрим этот процесс для фосфата натрия Na3PO4 по первой ступени: в растворе образуются ионы, соединяющиеся в продукты NaOH и Na2HPO4. Оба вещества растворимы в воде, а значит, тоже могут распадаться на ионы. В результате устанавливается равновесие между двумя процессами – прямой и обратный гидролиз:
Na3PO4 + H2O ↔ Na2HPO4 + NaOH
3Na+ + PO43- + HOH ↔2Na+ + HPO42- + Na ++ OH—
Для того чтобы реакция шла только в одном направлении можно удалять нужный продукт или формировать подходящую кислотность.
Гидролиз растворов может протекать по аниону или катиону. Анион – ион, заряженный отрицательно, а катион – положительно. Условием этого процесса является наличие одного или дух слабых ионов. При их распаде образуется необратимый продукт, позволяющий зафиксировать процесс.
К слабым кислотам (анион) относятся:
- все органические кислоты;
- бескислородные кислоты, кроме HBr, HCl, HI;
- кислоты, проявляющие переменную степень окисления (H2SO3, HNO2);
- кислоты, которые быстро распадаются (H2CO3, H2SiO3, H3PO4).
Слабость основания (катиона) можно определить по таблице растворимости. К слабым основаниям относятся все малорастворимые и нерастворимые вещества. Например, Al(OH)3 и Zn(OH)2 – слабые основания.
Возможно 4 варианта гидролиза в зависимости от состава соли.
Щелочь + слабая кислота (гидролиз по аниону)
Гидролиз по аниону проходит, если соль имеет кислотный остаток слабой кислоты. В финальном растворе останутся гидроксид-ионы, за счет чего сформируется щелочная среда (pH>7).
Пример: Na3PO4 + H2O ↔ Na2HPO4 + NaOH
Реакцию можно рассмотреть с точки зрения последовательного образования анионов и катионов.
- Na3PO4 ↔ 3 Na3+ + PO43-
- 3 Na3+ + PO43- + H2O ↔ 3 Na+ + HPO42- + OH—
Растворимое слабое основание + сильная кислота (гидролиз по катиону)
Если в соли слабо основание, будет происходить его распад. В этом случае в растворе останется больше катионов водорода и среда сформируется кислая (pH<7).
Пример: AlCl3 + H2O ↔ AlOHCl + HCl
Гидролиз веществ проходит в две стадии.
- AlCl3 ↔ Al3+ + 3 Cl—
- Al3+ +3 Cl—+ H2O ↔ AlOH2+Cl + H+ + Cl—
Слабое основание + слабая кислота (гидролиз по катиону и аниону)
Если обе части соли слабые, гидролиз будет идти по обеим частям. Так как образуются и катионы водорода, и гидроксид-ионы в равном количестве, среда будет нейтральная(рН = 7).
Пример: (NH4)2S + 2 H2O → 2 NH4OH + H2S
- (NH4)2S → 2 NH4+ + S—
- NH4+ + H2O ↔ NH4OH + H+
S— + H2O ↔ HS— + OH—
Щелочь + сильная кислота
Сильные молекулы называются так из-за очень высокой реакционной способности ионов, в таком случае, даже если происходит их распад на катионы и анионы, они сразу соединяются обратно. Молекулы воды не успевают оттащить их достаточно далеко, чтобы образовались новые продукты реакции.
Электролиз
Электролиз – разложение веществ под действием электрического тока. Он представляет собой окислительно-восстановительную реакцию.
Под действием электрического тока ионы начинают двигаться направленно – положительно заряженные катионы к отрицательному катоду, а отрицательно заряженные анионы к положительному аноду. На катоде катионы принимают электроны и восстанавливаются, а на аноде анионы отбирают электроны и окисляются. Электролиз протекает в расплаве или в растворе.
Виды электродов
Электрод – один из основных компонентов электролиза. Именно на нем происходит процесс объединение ионов и формирования продуктов реакции. Существует несколько видов электродов, на каждом из которых есть особенности процессов.
В химических лабораториях используют несколько видов электродов:
- платиновый,
- инертный,
- угольный,
- стандартный водородный.
Электроды отличаются стандартным электродным потенциалом. Это значит, на разных электродах скорость ОВР будет различна. Для каждого электрода приведены стандартные значения его потенциала, что может быть использовано в решении задач для определения степени электролиза.
Электролиз расплавов
При электролизе расплавов солей вода не участвует в процессе реакции. Этот способ применяется в том случае, если продукты электролиза вступают в реакцию с водой, например, при получении щелочных и щелочно-земельных металлов. В этом случае вместо металла образуется щелочь.
2NaCl(расплав) электролиз 2Na + Cl2↑
Катод( ): Na+ + ē =Na
Анод(+): 2Cl—— 2ē = 2Cl = Cl2↑
Электролиз растворов
Электролиз растворов протекает в присутствии воды.
Продукты реакции на катоде и аноду зависят от характеристик соответствующих катионов и анионов.
Процесс на катоде
На катоде происходит восстановление металлов и водорода, в зависимости от активности металла. Можно выделить три варианта продуктов реакции на катоде, в зависимости от положения металла в электрохимическом ряду напряжений.
- Активный металл (металлы в ряду напряжений стоят до алюминия включительно)
В процессе реакции восстанавливается водород, т.к.активные металлы не могут долго существовать в чистом виде и быстро образуют новые соединения в растворе.
2 Н2О + 2 ē → Н2 + 2 ОН—
- Металл со средней активностью (металл находится между алюминием и водородом)
В процессе электролиза одновременно восстанавливаются вода и металл.
Меn+ + n ē → Me0
2 H2O + 2 ē → Н2 + 2 ОН—
- Неактивный металл (металлы в ряду располагаются после водорода)
В процессе электролиза восстанавливается только металл, так как его реакционная активность низкая.
Меn+ + n ē → Me0
Процессы на аноде
К положительно заряженному аноду подходят анионы. Анионы играют роль окислителя, а кислотные остатки или вода – восстановителей. Здесь, так же, возможно образования различных продуктов в зависимости от аниона.
- Бескислородный кислотный остаток (I—, Br—, Cl—) восстанавливается до соответствующего неметалла:
неМеn-— n ē → неМе0
- Кислородсодержащий кислотный остаток сильной кислоты (SO42-, NO3—) и фторид-ион (F—) не окисляются. Вместо них происходит окисление воды с образованием кислорода:
2 Н2О-2 – 4 ē → О20 + 4 Н+
- Гидроксид-ион (OH—) окисляется с образованием кислорода:
4 ОН— — 4 ē → О2 + 2 Н2О
Суммарные процессы электролиза
В суммарном уравнении электролиза записывают те продукты, которые образовались н электродах. Например, процесс электролиза раствора сульфата меди выглядит следующим образом:
2 Cu2+SO4 + 2 H2O → 2 Cu0 + 2 H2SO4 + O2
К (-): Сu2+ + 2 ē → Сu0
А (+): 2 H2O — 4 ē → О20 + 4 Н+
Электролиз раствора хлорида натрия выглядит следующим образом:
2 NaCl— + 2 H2O → H2 + 2 NaOH + Cl20
K (-):2 H2O + 2 ē → Н2 + 2 ОН—
А (+): 2 Cl— — 2 ē → Cl20
Значение электролиза
Электролиз – важный химический процесс. Основная область его применения – получение неустойчивых элементов, которые нельзя синтезировать в процессе стандартной реакции. Например, так получают щелочные металлы.
Другой вариант – покрытие металлических изделий антикоррозионными элементами. В этом случае, нахождение металлического объекта (например, корабля) в соленой воде приравнивается к процессу электролиза, что приводит к коррозии. Чтобы предотвратить этот процесс, к конструкции прикрепляется элемент с большим потенциалом. Тогда он будет вступать в этот процесс вместо основной конструкции.
В городах электролиз применяют для очистки сточных вод.
Константа гидролиза

4.3
Средняя оценка: 4.3
Всего получено оценок: 280.
4.3
Средняя оценка: 4.3
Всего получено оценок: 280.
Равновесие гидролитической реакции в соответствии с законом действующий масс называется константой гидролиза. Величина показывает, насколько вещество способно к электролитической диссоциации. Чем больше значение константы, тем в большей мере протекает реакция.
Процесс гидролиза
Гидролиз – процесс обменного разложения соединений водой. Гидролизу подвергаются органические и неорганические соединения, распадаясь на ионы.
Среди неорганических веществ гидролиз характерен для растворимых солей, образованных:
- слабой кислотой и сильным основанием (гидролиз по аниону);
- сильной кислотой и слабым основанием (по катиону);
- слабой кислотой и слабым основанием (по катиону и аниону).
Соли, образованные сильными кислотами и основаниями, гидролизу не подвергаются.
Гидролиз солей протекает в два этапа:
- диссоциация – распад веществ на ионы (катионы и анионы);
- взаимодействие ионов с молекулами воды и образование нового вещества.
Конечным продуктом гидролиза солей является слабый электролит – кислота или основание.
В зависимости от природы соли и связи с ионами воды выделяют гидролиз:
- по катиону – реакция обратима, катионы связываются с анионом воды;
- по аниону – реакция обратима, анионы связываются с катионом воды;
- по катиону и аниону – реакция необратима, с водой связываются и катионы, и анионы.
Большинство органических веществ – белки, углеводы, жиры, галогеналканы, сложные эфиры – подвергаются гидролизу частично и зачастую требуют дополнительных условий. Например, галогеналканы гидролизуются в щелочной среде, а жиры – при нагревании и под действием кислот. Гидролиз органических веществ протекает необратимо.
Слабые электролиты, образованные при гидролизе солей, практически не распадаются на ионы.
Константа
Гидролиз характеризуется двумя величинами:
- степенью гидролиза – количественным отношением распавшихся молекул (Сгидр) к общему количеству молекул электролита
(Собщ): α = (Сгидр/Собщ)·100 %;
- константой – равновесием реакции.
Константа подчиняется закону действующих масс: скорость реакции прямо пропорциональна произведению концентрации реагентов. Соответственно, вычислить константу равновесия можно по следующей формуле:
К = [К+][А–]/[КА],
где:
- [К+] – концентрация катионов;
- [А–] – концентрация анионов;
- [КА] – концентрация начального соединения.
Значение некоторых веществ можно найти в таблице константы гидролиза.
|
Название |
Формула |
Значение константы |
|
Муравьиная кислота |
HCOOH |
1,77·10-4 |
|
Уксусная кислота |
СН3СООН |
1,74·10-5 |
|
Ортокремниевая |
H4SiO4 |
1,6·10-10 |
|
Азотистая кислота |
HNO2 |
4,0·10-4 |
|
Фосфорная кислота |
Н3РО4 |
7,52·10-3 |
|
Сероводородная кислота |
H2S |
6,0·10-8 |
|
Сернистая кислота |
H2SO3 |
1,58·10-2 |
|
Серная кислота |
Н2SO4 |
1,0·103 |
|
Фтороводородная кислота |
HF |
6,61·10-4 |
|
Хлорноватистая кислота |
HClO |
5,01·10-8 |
|
Гидроксид натрия |
NaOH |
1,5 |
|
Гидроксид калия |
KOH |
2,9 |
|
Гидроксид магния |
Mg(OH)2 |
2,5·10-3 |
|
Гидроксид кальция |
Сa(OH)2 |
4,3·10-2 |
|
Гидроксид стронция |
Sr(OH)2 |
0,15 |
|
Гидроксид бария |
Ba(OH)2 |
0,23 |
|
Гидроксид меди (II) |
Cu(OH)2 |
3,4·10-7 |
|
Гидроксид цинка |
Zn(OH)2 |
1,3·10-5 |
|
Гидроксид железа (III) |
Fe(OH)3 |
4,8·10-11 |
Величины зависят друг от друга. Чем выше значение константы, тем сильнее электролит распадается на ионы. Взаимосвязь величин выражает формула K = С·h2, где С – концентрация соли в растворе, h – степень гидролиза.
Что мы узнали?
Константа равновесия гидролиза – величина, показывающая способность вещества к электролитической диссоциации. Чем больше значение константы, тем активнее протекает реакция. Константа равновесия характерна только для обратимых гидролитических реакций, к которым относится гидролиз солей по катиону или аниону. Обратимый гидролиз характерен для солей, образованных слабым основанием и сильной кислотой или сильным основанием и слабой кислотой.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Хадиша Битабарова
5/5
-
Екатерина Давыдова
4/5
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 280.
А какая ваша оценка?