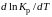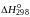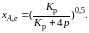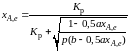Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Понятие химического равновесия
Признаки химического равновесия
Принцип Ле Шателье
Влияние температуры на химическое равновесие
Влияние давления на химическое равновесие
Влияние концентрации на химическое равновесие
Константа химического равновесия
Примеры решения задач
Задачи для самостоятельного решения
Понятие химического равновесия
Равновесным считается состояние системы, которое остается неизменным, причем это состояние не обусловлено действием каких-либо внешних сил. Состояние системы реагирующих веществ, при котором скорость прямой реакции становится равной скорости обратной реакции, называется химическим равновесием. Такое равновесие называется еще подвижным или динамическим равновесием.
Признаки химического равновесия
- Состояние системы остается неизменным во времени при сохранении внешних условий.
- Равновесие является динамическим, то есть обусловлено протеканием прямой и обратной реакции с одинаковыми скоростями.
- Любое внешнее воздействие вызывает изменение в равновесии системы; если внешнее воздействие снимается, то система снова возвращается в исходное состояние.
- К состоянию равновесия можно подойти с двух сторон – как со стороны исходных веществ, так и со стороны продуктов реакции.
- В состоянии равновесия энергия Гиббса достигает своего минимального значения.
Принцип Ле Шателье
Влияние изменения внешних условий на положение равновесия определяется принципом Ле Шателье (принципом подвижного равновесия):
Если на систему, находящуюся в состоянии равновесия, производить какое–либо внешнее воздействие, то в системе усилится то из направлений процесса, которое ослабляет эффект этого воздействия, и положение равновесия сместится в том же направлении.
Принцип Ле Шателье применим не только к химическим процессам, но и к физическим, таким как кипение, кристаллизация, растворение и т. д.
Рассмотрим влияние различных факторов на химическое равновесие на примере реакции окисления NO:
2NO(г) + O2(г) → 2NO2(г); ΔHо298 = — 113,4 кДж/моль.
Влияние температуры на химическое равновесие
При повышении температуры равновесие сдвигается в сторону эндотермической реакции, при понижении температуры – в сторону экзотермической реакции.
Степень смещения равновесия определяется абсолютной величиной теплового эффекта: чем больше по абсолютной величине энтальпия реакции ΔH, тем значительнее влияние температуры на состояние равновесия.
В рассматриваемой реакции синтеза оксида азота (IV) повышение температуры сместит равновесие в сторону исходных веществ.
Влияние давления на химическое равновесие
Сжатие смещает равновесие в направлении процесса, который сопровождается уменьшением объема газообразных веществ, а понижение давления сдвигает равновесие в противоположную сторону.
В рассматриваемом примере в левой части уравнения находится три объема, а в правой – два. Так как увеличение давления благоприятствует процессу, протекающему с уменьшением объема, то при повышении давления равновесие сместится вправо, т.е. в сторону продукта реакции – NO2. Уменьшение давления сместит равновесие в обратную сторону. Следует обратить внимание на то, что, если в уравнении обратимой реакции число молекул газообразных веществ в правой и левой частях равны, то изменение давления не оказывает влияния на положение равновесия.
Влияние концентрации на химическое равновесие
Для рассматриваемой реакции введение в равновесную систему дополнительных количеств NO или O2 вызывает смещение равновесия в том направлении, при котором концентрация этих веществ уменьшается, следовательно, происходит сдвиг равновесия в сторону образования NO2. Увеличение концентрации NO2 смещает равновесие в сторону исходных веществ.
Катализатор одинаково ускоряет как прямую, так и обратную реакции и поэтому не влияет на смещение химического равновесия.
При введении в равновесную систему (при Р = const) инертного газа концентрации реагентов (парциальные давления) уменьшаются. Поскольку рассматриваемый процесс окисления NO идет с уменьшением объема, то при добавлении инертного газа равновесие сместится в сторону исходных веществ.
Константа химического равновесия
Для химической реакции:
2NO(г) + O2(г) → 2NO2(г)
константа химической реакции Кс есть отношение:
Кс = [NO2]2/([NO]2 · [O2]) (1)
В этом уравнении в квадратных скобках – концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, т.е. равновесные концентрации веществ.
Константа химического равновесия связана с изменением энергии Гиббса уравнением:
ΔGTо = – RTlnK (2)
Примеры решения задач
Задача 1. При некоторой температуре равновесные концентрации в системе 2CO (г) + O2 (г)→2CO2 (г) составляли: [CO] = 0,2 моль/л, [O2] = 0,32 моль/л, [CO2] = 0,16 моль/л. Определите константу равновесия при этой температуре и исходные концентрации CO и O2, если исходная смесь не содержала СО2.
Решение.
2CO(г) + O2(г) →2CO2(г)
|
Вещество |
CO | O2 | CO2 |
| Сисходн, моль/л | 0,36 | 0,40 | 0 |
| Спрореагир,моль/л | 0,16 | 0,08 | 0,16 |
| Сравн, моль/л | 0,2 | 0,32 | 0,16 |
Во второй строке под Спрореагир понимается концентрация прореагировавших исходных веществ и концентрация образующегося CO2, причем, Сисходн= Спрореагир + Сравн.
Задача 2. Используя справочные данные, рассчитайте константу равновесия процесса
3 H2 (г) + N2 (г) →2 NH3 (г) при 298 К.
Решение.
ΔG298о = 2·(- 16,71) кДж = -33,42·103 Дж.
ΔGTо = — RTlnK.
lnK = 33,42·103/(8,314× 298) = 13,489. K = 7,21× 105.
Задача 3. Определите равновесную концентрацию HI в системе
H2(г) + I2(г) →2HI(г),
если при некоторой температуре константа равновесия равна 4, а исходные концентрации H2 , I2 и HI равны, соответственно, 1, 2 и 0 моль/л.
Решение. Пусть к некоторому моменту времени прореагировало x моль/л H2.
| Вещество | H2 | I2 | HI |
| сисходн., моль/л | 1 | 2 | 0 |
| спрореагир., моль/л | x | x | 2x |
| cравн., моль/л | 1-x | 2-x | 2x |
Тогда, К = (2х)2/((1-х)(2-х))
Решая это уравнение, получаем x = 0,67.
Значит, равновесная концентрация HI равна 2× 0,67 = 1,34 моль/л.
Задача 4. Используя справочные данные, определите температуру, при которой константа равновесия процесса: H2(г) + HCOH(г) →CH3OH(г) становится равной 1. Принять, что ΔНоТ » ΔНо298, а ΔSоT » ΔSо298.
Решение.
Если К = 1, то ΔGоT = — RTlnK = 0;
ΔGоT = ΔНо298 — ТΔ Sо298 .
ΔНо298 = -202 – (- 115,9) = -86,1 кДж = — 86,1× 103 Дж;
ΔSо298 = 239,7 – 218,7 – 130,52 = -109,52 Дж/К;
0 = — 86100 — Т·(-109,52)
Т = 786,15К
Задача 5. Для реакции SO2(Г) + Cl2(Г) →SO2Cl2(Г) при некоторой температуре константа равновесия равна 4. Определите равновесную концентрацию SO2Cl2, если исходные концентрации SO2, Cl2 и SO2Cl2 равны 2, 2 и 1 моль/л соответственно.
Решение. Пусть к некоторому моменту времени прореагировало x моль/л SO2.
SO2(г) + Cl2(г) →SO2Cl2(г)
| Вещество | SO2 | Cl2 | SO2Cl2 |
| cисходн., моль/л | 2 | 2 | 1 |
| cпрореагир., моль/л | x | x | х |
| cравн., моль/л | 2-x | 2-x | x + 1 |
Тогда получаем:
(х + 1)/(2 — х)2 = 4
Решая это уравнение, находим: x1 = 3 и x2 = 1,25. Но x1 = 3 не удовлетворяет условию задачи.
Следовательно, [SO2Cl2] = 1,25 + 1 = 2,25 моль/л.
Задачи для самостоятельного решения
1. В какой из приведенных реакций повышение давления сместит равновесие вправо? Ответ обоснуйте.
1) 2 NH3 (г) → 3H2 (г) + N2 (г)
2) ZnCO3 (к) → ZnO(к) + CO2 (г)
3) 2HBr (г) → H2 (г) + Br2 (ж)
4) CO2 (г) + C (графит) →2CO (г)
|
Так как увеличение давления благоприятствует процессу, протекающему с уменьшением количества |
2. При некоторой температуре равновесные концентрации в системе:
2HBr (г) →H2 (г) + Br2 (г)
составляли: [HBr] = 0,3 моль/л, [H2] = 0,6 моль/л, [Br2] = 0,6 моль/л. Определите константу равновесия и исходную концентрацию HBr.
3. Для реакции H2(г) + S(г) →H2S(г) при некоторой температуре константа равновесия равна 2. Определите равновесные концентрации H2 и S, если исходные концентрации H2, S и H2S равны, соответственно, 2, 3 и 0 моль/л.
4. Используя справочные данные, вычислите температуру, при которой константа равновесия процесса
CO2(г) + C(графит) →2CO(г)
становится равной 1. Примите, что ΔНоТ≈ΔНо298, а ΔSоT≈ΔSо298
5. Используя справочные данные, рассчитайте константу равновесия процесса:
С2Н4(г) →С2Н2(г) + Н2(г) при 298 К
6. Для реакции 2С3Н8(г) → н-С5Н12(г)+СН4(г) при температуре 1000 К константа равновесия равна 4. Определите равновесную концентрацию н-пентана, если исходная концентрация пропана равна 5 моль/л.
7. При температуре 500 К константа равновесия процесса:
СО2(г) + 3Н2(г) → СН3ОН(г) + Н2О(г)
равна 3,4·10-5. Вычислите Δ Gо500.
8. При температуре 800 К константа равновесия процесса н-С6Н14(г)+ 2С3Н6(г)+Н2(г) равна 8,71. Определите ΔGоf,800(С3Н6(г)), если ΔGоf,800(н-С6Н14(г)) = 305,77 кДж/моль.
9. Для реакции СО(г) + Cl2(г) →СO2Cl2(г) при некоторой температуре равновесная концентрация СO2Cl2(г) равна 1,2 моль/л. Определите константу равновесия данного процесса, если исходные концентрации СО(г) и Cl2(г) равны соответственно 2,0 и 1,8 моль/л.
10. При некоторой температуре равновесные концентрации в системе 2SО2(г) + О2(г) →2SO3(г) составляли: [SО2 ]=0,10 моль/л, [О2]=0,16 моль/л, [SО3]=0,08 моль/л. Вычислите константу равновесия и исходные концентрации SО2 и О2.
|
К=4,0; исходная концентрация SО2 составляет 0,18 моль/л; |
Функциональная
зависимость константы равновесия от
температуры при постоянном давлении
передается уравнением изобары
Вант-Гоффа
(2.9)
где ∆H°
– изменение энтальпии при стандартном
состоянии.
Из
уравнения (2.9) следует, что при положительных
значениях ∆H° (эндотермические
реакции)
>0
и Кр(Т)
– возрастающая функция. Если ∆H° < 0
(экзотермические реакции), то
< 0
и константа равновесия уменьшается
с повышением температуры. В обоих
случаях равновесные концентрации
участников реакции меняются, т. е.
анализ уравнения показывает, что оно в
количественной форме отражает вывод,
вытекающий из принципа смещения
равновесия: повышение температуры
всегда смещает равновесие в направлении
эндотермической реакции.
Для
процессов, протекающих при постоянном
объеме, зависимость константы равновесия
от температуры передается уравнением
изохоры Вант-Гоффа
,
где ∆U° – изменение внутренней
энергии в стандартном состоянии.
Уравнения
изобары и изохоры реакции определяют
зависимость константы равновесия от
температуры в дифференциальной форме.
Для практических расчетов равновесия
при различных температурах требуется
провести интегрирование этих уравнений.
Если ∆H° не зависит от температуры
(это справедливо для узкого интервала
температур), то из выражения (2.9) получаем

по которому, располагая данными о ∆Н°
и Кр
для какой-либо одной температуры
Т1
можно легко определить значение константы
равновесия при другой температуре Т2.
Интегрируя
уравнение (2.9) при условии независимости
теплового эффекта от температуры, можно
вынести ∆Н° из-под знака интеграла
и получить следующее уравнение:
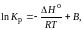
где В – постоянная интегрирования.
Так как
согласно уравнению изотермы Вант-Гоффа
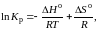
то В = ∆S°/R (при условии независимости
∆Н° и ∆S°
от температуры).
§ 2.4. Расчет равновесия по термодинамическим данным
Расчет
константы равновесия и изменения энергии
Гиббса позволяет определить равновесный
состав реакционной смеси, а также и
максимально возможное количество
продуктов.
Определение
констант равновесия химических реакций.
В основе расчета констант равновесия
для идеальных газов по термодинамическим
данным лежат уравнения (2.5) и (2.6). Эти
уравнения связывают константу равновесия
с изменением энергии Гиббса ∆G°,
зависящей от изменения энтальпии ∆Н°
и энтропии ∆S°. При этом, поскольку
важно не абсолютное значение
термодинамических функций отдельных
участников реакции, а лишь их изменение,
необходимо иметь какую-то точку отсчета.
В качестве таковой принято, что для
простых веществ (С, О2,
Н2 и т.
п.) в стандартных условиях и стандартном
состоянии (для газов – идеальный газ,
для жидкостей – чистая жидкость, для
твердого тела – наиболее стабильная
при данных условиях модификация)
=
0 и
=
0. Тогда каждое сложное соединение можно
охарактеризовать стандартной энергией
Гиббса
энтальпией
и энтропией
его образования из простых веществ.
Значения
термодинамических функций для большого
числа простых веществ и соединений
приводятся в справочной литературе.
Пользуясь справочными данными, можно
вычислить стандартные изменения энергии
Гиббса, используя правило Гесса. Так,
например, для реакции
СО2
(г) + 4Н2
(г)
СН4
(г) + 2Н2О
(г)
–394,4
0 –50,8 –228,4
значения
всех участников реакции известны и
приведены под уравнением (в кДж/моль).
Тогда
для реакции
= –50,8 – 2·228,4 + 394,4 = –113,2 кДж/моль.
Отсюда
легко рассчитать константу равновесия
при 298 К:

и,
следовательно, значение константы
равновесия при температуре процесса.
Определение
констант равновесия сложных реакций
осуществляют комбинированием простых
реакций. При этом важно выделить и учесть
каждую из составляющих простых реакций.
Комбинирование необходимо проводить
таким образом, чтобы через константы,
известные и приводимые в таблицах,
можно было выразить константы более
сложных реакций или получить по известным
константам неизвестные.
Так, для
последовательных превращений
1) А + B
R
2) R
S + Z
A + B
S + Z
константа
равновесия суммарной реакции равна
произведению констант равновесия
составляющих ее простых реакций:
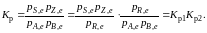
Соответственно,
суммарное изменение энергии Гиббса
равно сумме ее изменений для отдельных
реакций:

Определение
состава реакционной смеси при химическом
равновесии. Рассмотрим связь константы
равновесия Kр
и равновесной степени превращения хa,е
для газовой реакции А
2R.
После
установления равновесия на 1 моль
введенного вещества реакционная смесь
будет содержать (1 – хa,е)
моль реагента А и 2хa,е
моль продукта R. Всего в равновесном
состоянии будет находиться
1 – хa,е
+ 2хa,е
= = 1 + хa,е
моль. Если общее давление системы в
момент равновесия равно р, можем
записать равновесные парциальные
давления компонентов согласно выражению
(2.8):

Тогда связь
между константой равновесия и равновесной
степенью превращения выразится уравнением
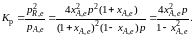
Получили
простое уравнение, из которого видно
также влияние давления: при постоянной
температуре снижение общего давления
ведет к увеличению хa,е.
Перегруппировав это выражение, получаем
(2.10)
Расчетная
формула (2.10) позволяет найти значения
хa,е для
разных давлений при постоянной температуре
и, следовательно, рассчитать равновесный
состав смеси. На рис. 2.1 приведена
зависимость равновесной степени
превращения реагента хa,е
при протекании реакции А
2R от относительного давления
= р/р0,
где р0
– стандартное давление, равное 0,098 МПа.
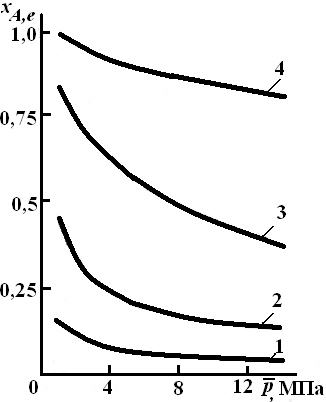
Рис.
2.1.
Зависимость равновесной степени
превращения
обратимой реакции А
2R
от давления для разных значений
константы
равновесия Кр:
1
– 0,1; 2 – 1,0; 3 – 10,0; 4 – 100,0
Пример 2.1. Рассмотрим расчет равновесия
по известным значениям Kр
для реакции окисления диоксида серы:
SO2
+ 0,5О2
+ zN2
SO3
+ zN2,
a b n
где а, b, n – количество (моль)
компонентов исходной смеси SO2,
O2, N2,
(а + b + n) = 1.
Количество
каждого компонента (моль) при достижении
равновесной степени превращения хA,е
составит
SO2
O2
N2
SO3
а – ахA,е
b –
0,5ахA,е
n ахA,е
Общее число
молей равновесной смеси
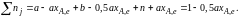
Обозначив
общее давление через р, выразим
равновесные давления компонентов:
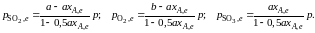
Тогда

Отсюда
.
(2.11)
Найдем
состав равновесной смеси, если в исходной
смеси содержится 7 % SO2,
11 % О2, 82
% N2.
При T
= 650 К константа равновесия Кр
= 629. Подставляя исходные
данные в уравнение (2.11), получим
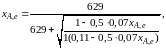
откуда находим хA,е
= 0,994 и, следовательно, в равновесной
смеси содержится (моль): SO3
– 0,069, SO2
– 0,001, О2
– 0,076, N2
– 0,82.
В
приведенном примере рассмотрена реакция,
протекающая с
уменьшением числа молей (∆n
< 0). Полученная расчетная формула
(2.11) наглядно иллюстрирует зависимость
равновесной степени превращения от
давления в системе – повышение общего
давления ведет за собой увеличение
хA,е.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Ульяна Власова
Эксперт по предмету «Химия»
Задать вопрос автору статьи
Химическое равновесие
Определение 1
Химическое равновесие — это состояние, в котором скорости прямой и обратной реакций равны.
Количественно состояние химического равновесия характеризуется константой равновесия. Для обратимой реакции уравнения скорости прямой и обратной реакции будет выглядеть следующим образом:
$mathrm{mA + nB rightleftarrows pC + qD}$
$mathrm {v_1 = k_1[A]^m[B]^n}$ — скорость прямой реакции
$mathrm {v_2 = k_2[С]^p[D]^q}$ — скорость обратной реакции
Когда достигается равновесие, то скорости обратной и прямой реакции равны. $mathrm {k_1[A]^m[B]^n = k_2[С]^p[D]^q}$
Замечание 1
Обратимой называется реакция, которая при одних и тех же условиях может идти в противоположных направлениях.
Сдай на права пока
учишься в ВУЗе
Вся теория в удобном приложении. Выбери инструктора и начни заниматься!
Получить скидку 3 000 ₽
$mathrm {K = frac {k_1}{k_2} = frac {[C]^p[D]^q}{[A]^m[B]^n}}$ — данное уравнение является математическим выражением закона действующих масс при химическом равновесии.
По численному значению константы равновесия оценивается положение равновесия. При $mathrm {K gg 1}$ равновесие смещено в сторону продуктов реакции, следовательно реакция практически необратима. При $mathrm {K ll 1}$ химическое равновесие смещается в сторону реагентов и реакция практически не идет, так как выход продуктов очень мал.
Принцип Ле Шателье
С помощью данного принципа определяются изменения, которые происходят в системе в результате внешних воздействий.
Теорема 1
Внешнее воздействие на систему, находящуюся в состоянии равновесия, приводит к смещению этого равновесия в направлении, при котором эффект произведенного воздействия ослабляется.
То есть внешнее воздействие меняет отношение скоростей прямого и обратного процессов, при этом благоприятствует тому процессу, который оказывает противодействие внешнему влиянию.
«Зависимость констант равновесия от температуры » 👇
Зависимость химического равновесия от температуры
Теорема 2
При повышении температуры химическое равновесие смещается в сторону продуктов эндотермической реакции, а при понижении — в сторону продуктов экзотермической реакции.
Рассмотрим примеры изменения температуры в ходе определенных реакций:
-
$mathrm {CO_2 + C_(т) rightleftarrows 2CO — Q}$
Прямая реакция идет с поглощением тепла, следовательно, нагревание способствует прямой реакции, поэтому равновесие сместится в сторону продуктов реакции (в сторону экзотермической реакции).
-
$mathrm {CO + H_2O_(г) rightleftarrows CO_2 + H_2 + Q}$
Прямая реакция идет с отдачей тепла, поэтому при нагревании равновесие сместится в сторону исходных веществ (в сторону эндотермической реакции).
Правило Вант-Гоффа
Теорема 3
При повышении температуры на $mathrm {10^circ C}$ скорость большинства газовых реакций увеличивается в 2-4 раза.
$mathrm { gamma = frac {v_{T+10}}{v_T} = 2 div 4}$
Температурный коэффициент $mathrm {gamma}$ показывает, во сколько раз меняется скорость реакции при изменении температуры от $mathrm {T_1 до T_2}$.
Зная температурный коэффициент можно рассчитать изменение скорости реакции при изменении температуры:
$mathrm {frac {v(T_2)}{v(T_1} = gamma^{(T_2 — T_1)/10}}$
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме