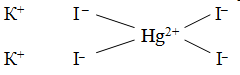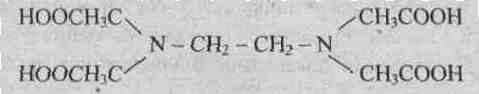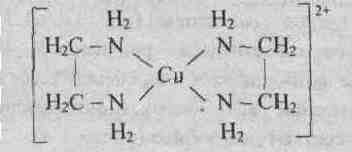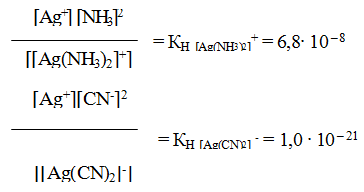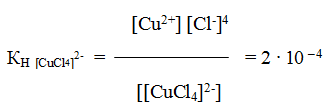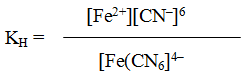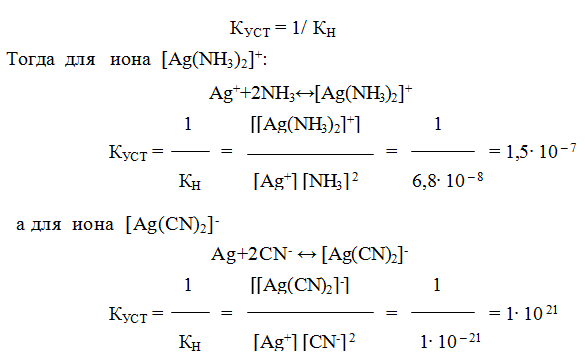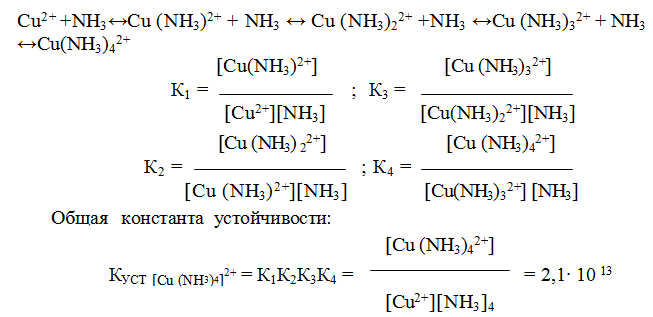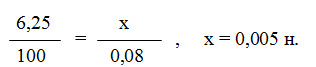В уроке 7 «Комплексные ионы» из курса «Химия для чайников» выясним, что такое сложный ион, а также чему равен заряд комплексного иона; рассмотрим примеры комплексных катионов и анионов; научимся определять координационное число и структуру комплексного иона, давать правильные названия ионам. Комплексные ионы тесно связаны с простыми ионами, поэтому советую вам подробно изучить урок 6 «Простые ионы», если вы этого еще не сделали.
Сложные ионы
Итак, мы уже знакомы с простыми ионами, состоящими из одного атома с избытком или недостатком электронов. Однако существуют и сложные ионы, состоящие из двух и более простых ионов. Сложные ионы часто называют комплексными ионами.
Приведем пример: аммоний NH4+, который состоит из одного иона азота N3- и четырех атомов водорода H1+, его общий заряд равен +1; имеет форму тетраэдра, в вершинах которого расположен водород, а в центре — атом азота. Еще один пример комплексного иона: карбонат СO32-, в состав которого входит ион углерода С4+ и три иона кислорода O2-, общий заряд комплексного иона равен -2; имеет форму треугольника. Очевидно, что суммарный заряд комплексного иона равен сумме зарядов простых ионов, входящих в его состав.
Как и простые ионы, комплексные ионы образуют химические соединения:
- Ag+ + NO3— → AgNO3 (Нитрат серебра)
- 2NH4+ + SO42- → (NH4)2SO4 (Сульфат аммония)
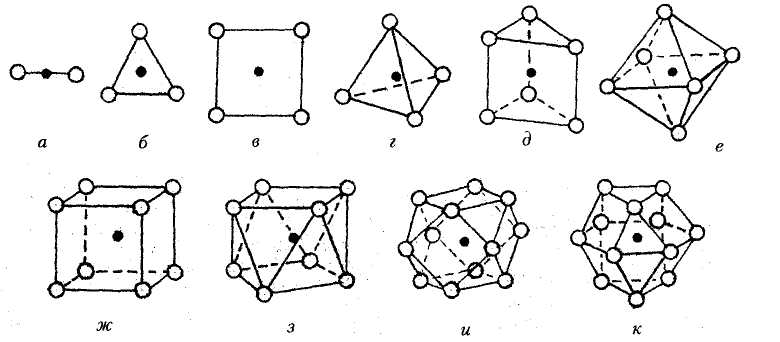
Наиболее распространенные комплексные катионы смотрите на рисунке ниже:
Наиболее распространенные комплексные анионы смотрите на рисунке ниже:
Координационное число
Координационное число – это число атомов комплексного иона, которые окружают центральный атом и равноудалены от него. Координационное число зависит прежде всего от размеров центрального атома, а также окружающих его атомов или групп. Например, атом азота N в нитрат-ионе NO3— окружают три атома кислорода, поэтому его координационное число равно 3. Атом серы больше атома азота, поэтому координационное число сульфат-иона SO4 равно 4. Чаще всего встречаются координационные числа 2, 3, 4 и 6. Ниже приведены наиболее распространенные координационные числа и соответствующие им ионы:
Возможные структуры ионов или молекул с координационными числами 3, 4 и 6 показаны на рисунке ниже:
Название ионов
Простые анионы получают название путем добавления окончания -ид к названию элемента, например фторид(F—)-, оксид(O2-)-, хлорид(Cl—) ионы и т.д. Если один элемент образует с кислородом несколько разных комплексных анионов, они получают окончания -ат или -ит в зависимости от того, выше или ниже степень окисления центрального атома в соответствующем анионе. Например: SO42-(сульфат-ион) и SO32-(сульфит-ион).
Надеюсь урок 7 «Комплексные ионы» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
Certain kinds of atoms form regular three-dimensional repeating structures when they bond with other elements. These repeating patterns are called crystal lattices, and they are characteristic of ionic solids, or compounds that contain ionic bonds, such as table salt (much more below).
These crystals have tiny repeating sections that boast cations, or positively charged atoms, at their center. This central atom is geometrically associated with a certain number of anions via one of a number of familiar patterns. Each anion in turn can be envisioned as sitting at the center of its own repeating unit and associating with a certain number of cations, which may be the same number or a different number as in the cation-at-center example.
This number, called the coordination number or ligancy, applies to ions rather than «native» atoms and determines the greater three-dimensional shape of the solid in predictable ways that relate to fundamental atomic architecture. It also determines the color owing to specific and unique distances between electrons and other components of the crystal lattice.
Determining the Coordination Number
If you happen to have access to three-dimensional models of common crystal lattice patters, you can visually inspect one «unit» from the perspective of both the anion and the cation and see how many «arms» reach out to the ion of opposite charge. In most cases, however, you will have to rely on a combination of online research and using molecular formulas.
Example: The formula for the ionic compound sodium chloride, or table salt, is NaCl. This means that every cation should have exactly one anion associated with it; in the language of ligancy, this means that the cation Na+ and the anion Cl− have the same coordination number.
Upon inspection, the structure of NaCl shows each Na+ ion having a Cl− neighbor above and below, to the left and to the right, and ahead and behind. The same is true from the Cl− perspective. The coordination number for both ions is 6.
Coordination Number of a Heavier Ion
Cations and anions present a 1:1 molecular ratio in a crystal, which means that they have the same coordination number, but this does not mean that the number is fixed at 6. The number 6 is a convenient number in three-dimensional space because of the up-down-right-left-forward-backward symmetry. But what if these «connections» were oriented diagonally, as if pointing away from the center of a cube toward all its corners?
In fact, this is how the lattice of cesium chloride, or CsCl, is arranged. Cesium and sodium have the same number of valence electrons, so in theory NaCl and CsCl might exhibit similar crystals. However, a cesium ion is far more massive than a sodium ion, and because it takes up more space, it is better accommodated with a coordination number of 8. Now, neighboring ions are found purely along diagonals; they are more distant than in NaCl, but also more numerous.
Because cesium and chlorine exist in a 1:1 ratio in this compound, the coordination number for the chloride ion in this instance is 8.
Unequal Coordination Number Example
Titanium oxide (TiO2) is an example of a crystal structure containing anions and cations in a 2:1 ratio. So, the fundamental unit of the lattice is tetrahedral: Each Ti4+ cation is amid six O2-ions, while every O2-ion has three immediate Ti4+ neighbors.
The coordination number for Ti4+ is 6, while that of the O2-ion is 3. This makes chemical sense since the formula TiO2 implies that twice as many oxygen ions exist in this compound as do titanium ions.
Как определить координационное число
Координационное число характеризует, со сколькими частицами связан тот, или иной атом (ион) в молекуле вещества. Само понятие «координационное число» возникло по мере развития раздела химии, изучающего комплексные соединения, многие из которых имеют весьма сложный состав. Потребовался показатель, четко указывающий, какое именно количество частиц входят во внутреннюю («координационную») сферу комплексного вещества. Как определить координационное число?

Инструкция
Прежде всего, составьте точную формулу вещества. Например, возьмите хорошо известную из курса школьной химии желтую кровяную соль. Ее формула К3[Fe(CN)6]. Каково координационное число иона железа в этом соединении? Из формулы легко можно понять, что в первую очередь железо связано с циан-ионами СN-, следовательно, его координационное число равно 6.
Понятие «координационное число» используется не только в химии комплексных соединений, но и в кристаллографии. Давайте рассмотрим еще более знакомую вам поваренную моль – хлористый натрий. Его формула NaCl. Казалось бы, проще некуда – координационное число и натрия, и хлора равно 1. Но не торопитесь с выводами.
Вспомните: ведь в обычном, твердом состоянии хлористый натрий имеет кубическую кристаллическую решетку. В ее узлах попеременно чередуются ионы хлора и натрия, связанные с «соседями». А сколько таких «соседей» у каждого иона? Нетрудно подсчитать, что их 6. (Четыре по «горизонтали», два по «вертикали»). Вот и получается: координационное число и у натрия, и у хлора в этом веществе равно 6.
А как быть, к примеру, с самым известным драгоценным камнем – алмазом? Какое координационное число имеет углерод, входящий в его состав? Вспомните, что алмаз представляет собой углеродную кристаллическую решетку так называемой «тетрагональной» формы. Каждый атом углерода связан в ней с четырьмя другим атомами, следовательно, координационное число равно 4.
Где еще применяется понятие «координационного числа»? Его можно использовать при описании химических свойств жидких и аморфных веществ, в тех случаях, когда фактическое количество химических связей центрального атома не совпадет с его валентностью. Рассмотрите, например, широко применяемое соединение – азотную кислоту. Ее эмпирическая формула HNO3, и из нее следует, что валентность азота явно больше 3.
Написав же структурную формулу, вы увидите, что атом азота связан только с тремя кислородными атомами, следовательно, его координационное число равно 3.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Зная
модель кристаллической структуры, т.
е. пространственное расположение
атомов относительно элементов симметрии
в элементарной ячейке — их координаты,
а, следовательно, и характеристики
правильных систем точек, которые занимают
атомы, можно сделать ряд кристаллохимических
выводов, используя достаточно простые
приемы описания структур. Поскольку
14 выведенных решеток Браве не могут
отразить все многообразие известных к
настоящему времени кристаллических
структур, необходимы характеристики,
позволяющие однозначно описать
индивидуальные особенности каждой
кристаллической структуры. К таким
характеристикам, дающим представление
о геометрическом характере структуры,
относятся: координационные
числа (КЧ),
координационные
многогранники (КМ),
или полиэдры
(КП),
и число
формульных единиц (Z).
Прежде всего по модели можно решить
вопрос о типе
химической формулы рассматриваемого
соединения, т. е. установить количественное
соотношение атомов в структуре. Это
нетрудно сделать на основе анализа
взаимного окружения — взаимной
координации — атомов разных (или
одинаковых) элементов.
Термин
«координация атома» был введен в химии
в конце XIX
в. в процессе формирования ее новой
области — химии координационных
(комплексных) соединений. И уже в 1893 г.
А.
Вернер ввел
понятие координационное
число (КЧ)
как число атомов (лигандов — ионы,
непосредственно связанные с центральными
атомами (катионами)), непосредственно
связанных с центральным. Химики в свое
время столкнулись с тем фактом, что
число связей, образуемых атомом, может
отличаться от его формальной валентности
и даже превышать ее. Например, в ионном
соединении NaCl
каждый ион окружен шестью ионами
противоположного заряда (KЧNa/Cl
= 6, KЧCl/Na
= 6), хотя формальная валентность атомов
Na
и С1 равна 1. Таким образом, согласно
современному представлению, КЧ — это
число ближайших к данному атому (иону)
соседних атомов (ионов) в структуре
кристалла независимо от того, являются
они атомами того же сорта, что и
центральный, или иного. При
этом межатомные расстояния являются
основным критерием, используемым при
подсчете КЧ.
Например,
в кубических структурах модификации
a-Fe
(рис. 7.2.а) и CsCl
(рис. 7.2. в) координационные числа всех
атомов равны 8: в структуре a-Fe
атомы Fe
располагаются в узлах объемноцентрированного
куба, отсюда KЧFe=
8; в структуре CsCl
в вершинах элементарной ячейки
располагаются ионы Сl—
, а в центре объема — ион Cs+,
координационное число которого тоже
равно 8 (КЧ Cs/Cl
= 8), так же как и каждый ион Cl
окружен восемью ионами Cs+
по кубу (КЧ Cl/Cs
= 8). Это подтверждает отношение Cs
: С1 = 1: 1 в структуре этого
соединения.
|
|
||
|
а |
б |
в |
|
Рис. |
В
структуре α
–Fe
координационное число атома Fe
по первой координационной сфере равно
8, с учетом второй сферы — 14 (8 + 6).
Координационные полиэдры — соответственно
куб и ромбододекаэдр.
Координационные
числа и координационные многогранники
являются
важнейшими характеристиками конкретной
кристаллической структуры,
отличающими ее от остальных структур.
На этой основе можно
проводить классификацию, относя
конкретную кристаллическую структуру
к определенному структурному типу.
Установить
тип химической формулы по структурным
данным (т. е. по
модели структуры или по ее проекции —
чертежу) можно и иным путем,
подсчитав число атомов каждого сорта
(химического элемента), приходящихся
на одну элементарную ячейку. Это
подтверждает тип химической формулы
NaCl.
|
|
|
Рис. |
В
структуре NаС1 (рис. 7.4), типичной для
ионных кристаллов типа АВ (где А—атомы
(ионы) одного сорта, В—другого), в
построении элементарной ячейки принимают
участие 27 атомов обоих сортов, из них
14 атомов А (шары большого размера) и 13
атомов В (меньшие шары), но полностью
входит в ячейку лишь один. атом, находящийся
в ее центре. Атом, находящийся в центре
грани элементарной ячейки, принадлежит
одновременно двум ячейкам—данной и
смежной с ней. Поэтому данной ячейке
принадлежит лишь половина этого атома.
В каждой из вершин ячейки сходится
одновременно по 8 ячеек, поэтому данной
ячейке принадлежит лишь 1/8 атома,
расположенного в вершине. От каждого
атома, находящегося на ребре ячейки, ей
принадлежит лишь 1/4.
Вычислим общее
число атомов, приходящихся на одну
элементарную ячейку NаС1:
|
Положение атома |
Объем |
Число атомов |
Всего |
|
В вершине В середине ребра В центре грани В центре ячейки |
1/8 1/4 1/2 1 |
8 12 6 1 |
1 3 3 1 |
Итак,
на долю ячейки, показанной на рис. 7.4,
приходится не 27 атомов, а всего 8 атомов:
4 атома натрия и 4 атома хлора.
|
|
|
— — Na |
|
Рис.7.4 |
Определение
числа атомов в ячейке Браве позволяет
кроме типа химической формулы получить
еще одну полезную константу — число
формульных единиц, обозначаемое
буквой Z.
Для простых веществ, состоящих из атомов
одного элемента (Сu,
Fe,
Se
и др.), число формульных единиц соответствует
числу атомов в элементарной ячейке. Для
простых молекулярных веществ (I2,
S8
и т. д.) и молекулярных соединений (СО2)
число Z
paвно
числу молекул в ячейке. В подавляющем
же большинстве неорганических и
интерметаллических соединений (NaCl,
CaF2,
СuАu
и т. д.) молекул нет, и в этом случае вместо
термина «количество молекул» используют
термин «число формульных единиц».
Число
формульных единиц можно определить
экспериментально в процессе рентгеновского
исследования вещества.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Комплексные соединения
Общая химия. Учебное пособие — Таирова А.Р., Кузнецов А.И. — 2005
- 9.1. Определение комплексных соединений
- 9.2. Комплексообразователи
- 9.3.Лиганды
- 9.4. Номенклатура комплексных соединений
- 9.5. Диссоциация комплексных соединений
- 9.6. Константы устойчивости комплексов
- 9.7.Роль комплексных соединений
- 9.8. Комплексонометрия. Жесткость воды
9.1. Определение комплексных соединений. Такие соединения, как оксиды, кислоты, основания, соли образованы из атомов в результате возникновения между ними химической связи. Это соединения обычные, или соединения первого порядка.
Однако имеются вещества, которые образованы в результате соединения друг с другом нейтральных молекул без возникновения новых связующих электронных пар. Например:
K2S04 + A12 (S04)3 = K2S04·AI2 (SО4)3 = 2KA1 (SO4)2
CuSO4 + 5H2O = CuSO4 · 5H2O
CuS04 + 4NH3 = CuSО4·4NH3 = [Cu (NH3)4] SO4
Fe (CN)3 + 3KCN = Fe (CN)3·3KCN = K3 [Fe (CN)6]
HgI2 + 2KI = HgI2·2KI = K2[HgI4]
Это молекулярные соединения, или соединения высшего порядка. Одни из них диссоциируют в водном растворе на простые ноны, например:
КА1 (SО4)2 ↔ K+ + А13+ + 2 SО42 —
другие — на сложные (комплексные) ионы, состоящие, в свою очередь, из более простых ионов, как, например:
К3 [Fe (CN)6] ↔ЗК + + [Fe (CN)6]3-
Молекулярные соединения, образующие комплексные ионы, способные к существованию как в растворе, так и в кристалле, называют комплексными. Но такое определение применимо лишь в известных пределах. Оно не охватывает соединений типа неэлектролитов, например карбонилов металлов —Ni(CO)4 и др., а потому не является и полным.
Чтобы объяснить, почему происходит присоединение одних простых молекул к другим, швейцарский химик А. Вернер ввел понятие о главной и побочной валентности. Тогда образование, скажем, K2[HgI4] можho представить так: ион ртути за счет своей главной валентности (обозначается сплошной линией), равной двум, присоединяет два иодид-иона, а за счет побочной — (обозначается пунктиром) — дополнительно еще два иодид-иона. По Вернеру, это может быть изображено формулой
В настоящее время главную валентность надо объяснить ионной или ковалентной связью, а побочную – ковалентной связью, возникшей по донорно-акцепторному механизму (см. раздел 4.8.2.). Исходя из механизма образования комплексных соединений, им можно дать более точное, не имеющее исключений определение: комплексные соединения – это соединения, характеризующиеся наличием хотя бы одной ковалентной связи, возникшей по донорно-акцепторному механизму.
Комплексообразование происходит во всех случаях, когда из менее сложных систем образуются системы более сложные. Согласно координационной теории А. Вернера в структуре комплексного соединения различают координационную (внутреннюю) сферу, состоящую из центральной частицы – комплексообразователя (ион или атом) – и окружающих ее лигандов (ионы противоположного знака или молекулы). Ионы, находящиеся за пределами координационной сферы, образуют внешнюю сферу комплексного соединения. Число лигандов вокруг комплексообразователя называется его координационным числом. Внутренняя сфера (комплекс) может быть анионом, катионом и не иметь заряда. Например, в комплексном соединении K3[Fe(CN)6] внешняя сфера – 3К+, внутренняя сфера [Fe(CN)6]3-, где Fe3+ — комплексообразователь, a 6CN – лиганды, причем, 6 – координационное число. Таким образом, комплексное соединение (как правило) в узлах кристаллической решетки содержит комплекс, способный к самостоятельному существованию и в растворе.
9.2. Комплексообразователи. Комплексообразователями служат атомы или ионы, имеющие вакантные орбитали. Способность к комплексообразованию возрастает с увеличением заряда иона и уменьшением его размера. К наиболее распространенным комплексообразователям относятся ионы d-элементов VII, VIII, I и II групп периодической таблицы элементов.
9.3.Лиганды. К числу лигандов относятся простые анионы, такие как F— , СI—, Вr—, I—, S2-, сложные анионы, например CN– , NCS – , NO2—) , молекулы, например Н2О, NH3, C. Ионы или отдельные атомы ионов и молекул лигандов имеют неподеленные пары электронов. В зависимости от того, какое число вакантных орбиталей у комплексообразователя занимают лиганды, они подразделяются на монодентантные (одна орбиталь), например NН3, СI—, бидентантные, например N2H4или En, полидентантные, например этилендиаминтетрауксусная кислота (ЕДТА), являющаяся шестидентантным лигандом
Динатриевая соль ЕДТА и сама кислота относятся к классу соединений, называемых комплексонами. Би- и полидентантные лиганды при взаимодействии с комлексообразователями образуют замкнутые циклы, называемые хелатными, поэтому и комплексы с би- и полидентантными лигандами называют хелатными (или клешневидными), например
Пример 1. Определите заряд комплексного иона, координационное число (к.ч.) и степень окисления комплексообразователя в соединениях: a) K4[Fe(CN)6]; б) Na[Ag(NO2)2]; в) K2[MoF8]; г) [Сr(Н2O)2(NН3)3С1]С12.
Решение. Заряд комплексного иона равен заряду внешней сферы, но противоположен ему по знаку. Координационное число комплексообразователя равно числу лигандов, координированных вокруг него. Степень окисления комплексообразователя определяется так же, как степень окисления атома в любом соединении, исходя из того, что сумма степеней окисления всех атомов в молекуле равна нулю. Заряды нейтральных молекул (H2O, NН3) равны нулю. Заряды кислотных остатков определяют из формул соответствующих кислот. Отсюда:
| Заряд иона | К.ч. | Степень окисления | |
| а) | -4 | 6 | +2 |
| б) | -1 | 2 | +1 |
| в) | -2 | 8 | +6 |
| г) | +2 | 6 | +3 |
9.4. Номенклатура комплексных соединений. Название комплексного катиона записывается одним словом, начинающимся с названия отрицательного лиганда с прибавлением буквы «о», затем приводятся нейтральные молекулы и центральный атом с указанием римской цифрой его степени окисления для металлов переменной валентности. Для молекул Н2О (аква), NН3 (аммин), СО (карбонил), NO (нитрозил) даются особые названия, указанные в скобках.
Число лигандов обозначают греческими приставками (ди-, три-, тетра- и т.д.) или бис-, трис-, тетракис-, пентакис- и гексакис- для 2, 3, 4, 5 и 6 соответственно у сложных лигандов. Например, соединение [Zn(NH3)2Cl]CI называется хлорид хлородиамин цинка (II), а [Ni(En)2]Cl2 – хлорид бис(этилендиамин) никеля (II).
Комплексный анион записывается аналогично названию катиона, но с добавлением суффикса -«am» к названию комплексообразователя, например K2[Zn(CN)4] — тетрацианоцинкат (II) калия. Нейтральный комплекс записывается подобно катиону, например комплекс [Ni(CО)4] называется тетракарбонил никеля (II). Соответственно по типу лигандов комплексы называют аквакомплексы (лиганд Н2О), аминокомплексы (лиганд NH3), ацидокомплексы (лиганды анионы кислот), комплексонатные комплексы (лиганды-комплексоны) и т.д.
9.5. Диссоциация комплексных соединений. Комплексные соединения — неэлектролиты в водных растворах диссоциации не подвергаются. У них отсутствует внешняя сфера комплекса, например: [Zn(NH3)2Cl2], [Co(NH3)3(NO3)3], [Pt (NH3)2C12]. В водной среде такие молекулы гидратируются как единое образование.
Комплексные соединения — электролиты при диссоциации в водных растворах образуют комплексные ионы, например:
[Ag (NH3)2] CI ↔[Ag (NH3)2]+ +С1– ; К [Ag (CN)2 ↔K+ + [Ag (CN)2]—
Такая диссоциация протекает полностью, ионы гидратируются. Комплексные ионы в свою очередь подвергаются вторичной диссоциации:
[Ag(NH3)2]+ ↔Ag++2NH3 (a)
[Ag (CN)2] — ↔ Ag+ +2CN— (б)
Однако эта диссоциация обычно протекает в незначительной степени. Применяя закон действующих масс к обратимым процессам (а) и (б), получаем выражения констант нестойкости комплексных ионов:
Константа нестойкости комплексного иона характеризует прочность (устойчивость) внутренней сферы комплексного соединения. В приведенных примерах комплекс [Ag(CN)2]— более прочен, чем
комплекс [Ag(NH3)2]+, так как имеет меньшее значение КН.
Соединения с малоустойчивой внутренней сферой называют двойными солями. Обозначают их иначе, чем комплексные соединения, а именно — как соединения молекул, например K2SO4∙A12(SO4)3. Принципиальной же разницы между двойными солями и комплексными соединениями нет. В растворе двойной соли имеется некоторое количество комплексных ионов (например, [Al (SO4)2]—). Двойная соль отличается от комплексной соли лишь диссоциацией комплексного иона: у первой она практически полная, а у второй — незначительная.
Двойные соли — довольно распространенные соединения. К ним относятся соль Мора (NH4)2SO4∙FeSO4∙6H2O, двойной хлорид калия и меди 2КС1 ∙ СuС12 ∙ 2Н2О и многие другие. Если, например, растворить в воде двойной хлорид, то происходит диссоциация
2КС1∙СuС12∙2Н2О↔2К++Сu2+ + 4С1—+2Н2О
и все образовавшиеся в растворе ионы можно обнаружить с помощью соответствующих реакций. Но если это соединение рассматривать как комплексное, то его формулу надо изобразить как K2[CuС14]∙2H2О. Диссоциация K2[CuС14]∙2H2О протекает по уравнению:
К2 [CuCl4] ∙ 2H2O↔ 2К + + [CuC14]2 — + 2Н2О
и
[CuCl4]2-↔Cu2+ + 4Cl—
Образующийся комплексный ион устойчив только в концентрированных растворах, и его константа нестойкости при комнатной температуре
Сравним значение КН [CuCl4]2- со значением константы нестойкости одного из комплексных ионов меди, например КН[Cu(NH3)4]2+ = 4,6 ∙ 10 – 14. Тогда мы увидим, что КН [CuCl4]2- > КН[Cu(NH3)4]2+ на несколько порядков, а чем меньше константа нестойкости комплекса, тем больше его устойчивость.
Пример 1. Напишите выражение для константы нестойкости комплекса [Fе(СМ)6]4-.
Решение. Если комплексная соль гексацианоферрат (II) калия, являясь сильным электролитом, в водном растворе необратимо диссоциирует на ионы внешней и внутренней сфер
K4[Fe(CN)6] = 4K+ + [Fe(CN)6]4–
то комплексный ион диссоциирует обратимо и в незначительной степени на составляющие его частицы:
[Fe(CN)6]4– ↔ Fe2+ + 6CN–
Обратимый процесс характеризуется своей константой равновесия, которая в данном случае называется константой нестойкости (Кн) комплекса:
Чем меньше KH, тем более прочен данный комплекс.
9.6. Константы устойчивости комплексов. Для характеристики устойчивости (прочности) комплексного иона применяют также величину, обратную константе нестойкости. Ее называют константой устойчивости (КУСТ) или константой образования комплекса. Величины КН и КУСТ взаимосвязаны:
Очевидно, чем выше КУСТ, тем прочнее комплексный ион и тем больше его концентрация при равновесии.
Следует подчеркнуть, что как диссоциация комплексного иона, так и его образование являются процессами обратимыми и протекают ступенчато, как у слабых электролитов. Каждой ступени соответствует определенная величина константы устойчивости — К1, К2 …, Кn. Ион [Ag(NH3)2] + будет иметь две константы устойчивости — K1 и K2:
У иона [Cu(NH3)4]2+ будет четыре константы устойчивости, так как комплексообразователь в четыре стадии присоединяет лиганд NH3
Таким образом, при образовании комплексов в растворе происходит последовательное (стадийное) внедрение лигандов во внутреннюю сферу комплексообразователя с соответствующим отщеплением молекул воды, так как исходный ион Сu2+ был гидратирован (он имел состав [Cu(H2O)4]2+). При диссоциации комплекса [Cu(NH3)4]2+, наоборот, происходит соответствующая замена лигандов на молекулы воды. Поскольку концентрация воды при таких процессах не изменяется, ее не включают в выражение констант устойчивости или констант нестойкости.
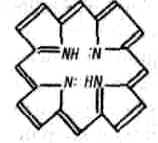
9.7.Роль комплексных соединений. Комплексные соединения широко распространены в природе. В состав многих растений и живых организмов входят соединения с макроциклическими лигандами. В упрощенном виде тетрадентантный макроцикл порфин представлен на рис. 3.3
Рис. 3.3. Структура молекул порфина
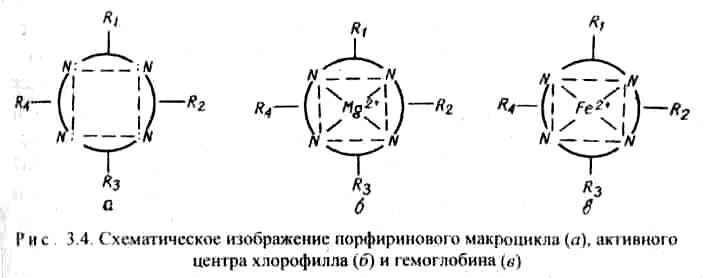
Комплексы с участием порфина называются порфи-ринами. Они отличаются друг от друга центральными ионами-комплексообразователями и заместителями, присоединенными к атомам углерода на периферии лиганда. В наиболее простом виде порфиновый цикл представлен четырьмя атомами азота, соединенными углеродными цепями (рис. 3.3). Кроме того, имеются четыре или более заместителей — радикалов R1, R2, R 3, R4. В зеленом катализаторе фотосинтеза — хлорофилле роль комплексообразователя выполняет магний (рис. 3.4). Макроциклический комплекс железа входит в состав гемоглобина (рис. 3.4).
Железо координирует кислород в комплексе гемоглобина и переносит его по организму с кровью. Связь кислорода с железом в комплексе не очень прочная и поэтому кислород в организме легко реагирует с восстановителями. Недостаток железа в организме приводит к болезни — анемии. Макроциклы крови могут взаимодействовать с каталитическими ядами, например, монооксидом углерода СО, что приводит к отравлению организма.
Сложные лиганды-комплексоны широко используются в энергетике для очистки парогенераторов от накипи, в медицине — для очистки почек от камней, для выведения ядов из организма, таких как Hg2+ Pb2+ Cd2+, в химии — как катализаторы некоторых реакций, например восстановления кислорода, в аналитической химии, в частности, при определении жесткости воды.
9.8. Комплексонометрия. Жесткость воды. Жесткость воды выражается суммой миллиэквивалентов ионов Са2+ и Mg2+, содержащихся в 1 л воды (ммоль/л). Один миллимоль жесткости отвечает содержанию 20,04 мг/л Са2+ или 12,16 мг/л Mg2+.
Пример 1. Вычислите жесткость воды, зная, что в 500 л ее содержится 202,5 г Са(НСО3)2.
Приведенные примеры решают, применяя формулу Ж = m / (mЭ ∙ V)
где: т – масса вещества, обусловливающего жесткость воды или применяемого для устранения жесткости, мг;
mэ, – молярная масса эквивалента этого вещества;
V – объем воды, л.
Решение. В 1 л воды содержится 202,5 : 500 = 0,405 г Са(НСО3)2, что составляет 0,405 : 81 = 0,005 ммоль/л. 81 г/моль — эквивалентная масса Са(НСО3)2. Следовательно, жесткость воды 5ммоль. (Ж = т / (mэV)= 202 500 / (81 • 500) = 5 ммоль. 81 – эквивалентная масса Са(НСО3)2, равная половине его молярной массы).
Пример 2. Сколько граммов CaSO4 содержится в 1 м3 воды, если жесткость, обусловленная присутствием этой соли, равна 4 ммоль?
Решение. Молярная масса CaSO4 136,14 г/моль; молярная масса эквивалента равна 136,14:2 = 68,07 г/моль. В 1 м3 воды жесткостью 4 ммоль содержится 4 · 1000 = 4000 ммоль, или 4000 · 68,07 = 272 280 мг = 272,280 г CaSO4. Из формулы Ж = m / (mэV),m = 468,071000 = 272 280 мг = 272,280 г CaSO4).
Пример 3. Какую массу соды надо добавить к 500 л воды, чтобы устранить ее жесткость, равную 5 ммоль?
Решение. В 500 л воды содержится 500 · 5 = 2500 моль солей, обусловливающих жесткость воды. Для устранения жесткости следует прибавить 2500 · 53 = 132 500 мг = 132,5 г соды (53 г/моль — молярная масса эквивалента Na2CO3).
Пример 4. Вычислите карбонатную жесткость воды, зная, что на титрование 100 см3 этой воды, содержащей гидрокарбонат кальция, потребовалось 6,25 см3 0,08 н. раствора НС1.
Решение. Вычисляем молярную концентрацию эквивалентов раствора гидрокарбоната кальция. Обозначив число эквивалентов растворенного вещества в 1 л раствора, через х, составляем пропорцию:
Таким образом, в 1 л исследуемой воды содержится 0,005·1000 = 5 ммоль гидрокарбоната кальция или 5 ммоль Са2+-ионов. Карбонатная жесткость воды 5 ммоль.