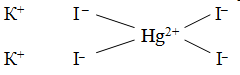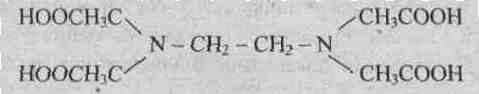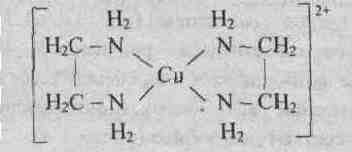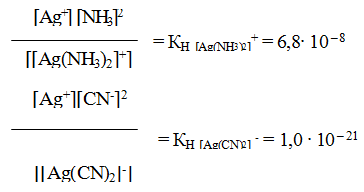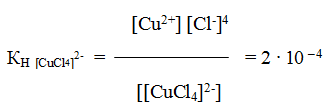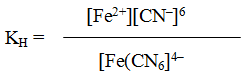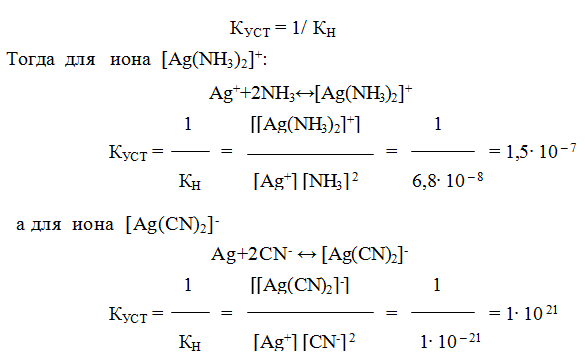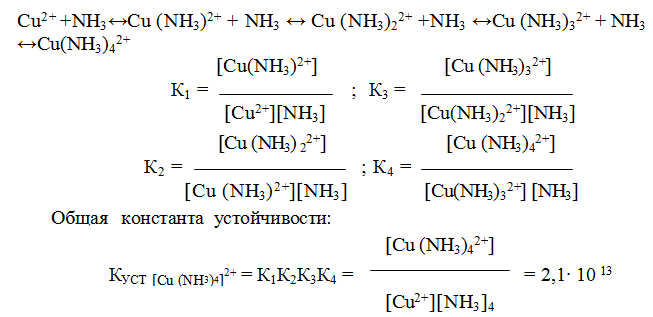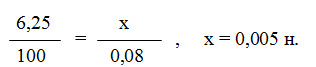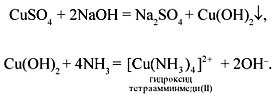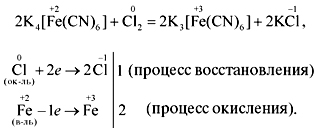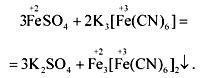Важнейшей характеристикой
комплексообразователя является
количество химических связей, которые
он образует с лигандами, или координационное
число (КЧ).
Эта характеристика комплексообразователя
определяется главным образом строением
его электронной оболочки и обусловливается
валентными возможностями
центрального атома или условного
иона-комплексообразователя.
Когда комплексообразователь координирует
монодентатные
лиганды, то координационное число равно
числу присоединяемых лигандов. А число
присоединяемых к комплексообразователю
полидентатных
лигандов всегда меньше значения
координационного числа.
Значение координационного
числа комплексообразователя
зависит от его природы, степени окисления,
природы лигандов и условий (температуры,
природы растворителя, концентрации
комплексообразователя и лигандов и
др.), при которых протекает реакция
комплексообразования. Значение КЧ может
меняться в различных комплексных
соединениях от 2 до 8 и даже выше. Наиболее
распространенными координационными
числами являются 4 и 6.
Между значениями координационного
числа и степенью окисления
элемента-комплексообразователя
существует определенная
зависимость. Так, для
элементов-комплексообразователей,
имеющих степень окисления +I (AgI,
CuI, AuI, II и др.) наиболее
характерно координационное число 2 –
например, в комплексах типа [Ag(NH3)2]+,
[Cu(CN)2]—, [IBr2]—.
Элементы-комплексообразователи
со степенью окисления +II (ZnII, PtII,
PdII, CuII и др.) часто образуют
комплексы, в которых проявляют
координационное число 4, такие как
[Zn(NH3)4]2+, [PtCl4]2-,
[Pd(NH3)2Cl2]0, [ZnI4]2-,
[Cu(NH3)4]2+.
В аквакомплексах
координационное число комплексообразователя
в степени окисления +II чаще всего равно
6: [Fe(H2O)6]2+, [Mg(H2O)6]2+,
[Ni(H2O)6]2+.
Элементы-комплексообразователи,
обладающие степенью окисления +III и +IV
(PtIV, AlIII, CoIII, CrIII,
FeIII), имеют в комплексах, как
правило, КЧ 6.
Например, [Co(NH3)6]3+,
[Cr(OH)6]3-, [PtCl6]2- ,
[AlF6]3-, [Fe(CN)6]3-.
Известны комплексообразователи, которые
обладают практически постоянным
координационным числом в комплексах
разных типов. Таковы кобальт(III), хром(III)
или платина(IV) с КЧ 6 и бор(III), платина(II),
палладий(II), золото(III) с КЧ 4. Тем не менее
большинство комплексообразователей
имеет переменное координационное число.
Например, для алюминия(III) возможны КЧ
4 и КЧ 6 в комплексах [Al(OH)4]—
и [Al(H2O)2(OH)4]—.
Координационные числа 3, 5, 7, 8 и 9 встречаются
сравнительно редко. Есть всего несколько
соединений, в которых КЧ равно 12 –
например, таких как K9[Bi(NCS)12].
5. Внутренняя и внешняя сфера комплексного соединения
Лиганды, непосредственно связанные с
комплексообразователем, образуют вместе
с ним внутреннюю
(координационную) сферу комплекса.
Так, в комплексном катионе [Cu(NH3)4]2+
внутренняя сфера образована атомом
комплексообразователя – меди(II) и
молекулами аммиака, непосредственно с
ним связанными.
Обозначается внутренняя сфера квадратными
скобками: [Fe(CN)6]3-, [HgI4]2-,
[SnCl6]2-.
В зависимости от
соотношения суммарного заряда лигандов
и комплексообразователя внутренняя
сфера может иметь
положительный заряд, например,
[Al(H2O)6]3+, либо
отрицательный,
например, [Ag(SO3S)2]3-, или
нулевой заряд,
например, как для [Cr(NH3)3(NCS)3]0.
Ионы, нейтрализующие заряд внутренней
сферы, но не связанные с комплексообразователем
ковалентно, образуют внешнюю
сферу комплексного соединения.
Например, в комплексном соединении
[Zn(NH3)4]Cl2 два иона Cl—
находятся во внешней сфере:
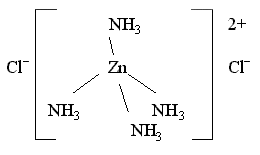
Внешнесферные ионы Cl— находятся
на более значительном
удалении от комплексообразователя,
чем молекулы NH3, иначе говоря,
расстояние Zn – Cl больше, чем длина
химической связи Zn – N. Более того,
химическая связь комплексного катиона
[Zn(NH3)4]2+ и хлорид-ионов
Cl— имеет ионный характер, в то
время как молекулы аммиака NH3,
входящие во внутреннюю сферу, образуют
с комплексообразователем Zn(II) ковалентные
связи по донорно-акцепторному механизму
(донором неподеленных пар электронов
являются атомы азота в NH3). Таким
образом, различие между лигандами
внутренней сферы и
ионами внешней сферы
очень существенно.
Изображая формулу комплексного
соединения, внешнесферные ионы располагают
за квадратными скобками.
Например, в соединениях [Cu(NH3)4](OH)2
и K2[HgI4] внешнесферными ионами
являются соответственно ионы OH—
и K+. Вполне понятно, что в нейтральных
комплексах [Cr(NH3)3(NCS)3]0
и [Pd(NH3)2Cl2]0 внешняя
сфера отсутствует.
Обычно внешнюю сферу составляют простые
одноатомные или
многоатомные ионы.
Однако возможны случаи, когда комплексное
соединение состоит из
двух и более внутренних
сфер, выполняющих функции катионной
и анионной части соединения. Здесь
каждая из внутренних сфер
является внешней по отношению к другой.
Например, в соединениях [Cu(NH3)4][PtCl6]
и [Ni(NH3)6]2[Fe(CN)6]
формально функции внешнесферных ионов
могут выполнять.
Выводы
Комплексное
соединение включает комплексообразователь
и лиганды. По детантности различают
монодетаннтные и бидетантные комплексы.
Жоспар
I.Кіріспе.
II.Негізгі
бөлім.
2.1Комплексті
қосындылар.
2.2
Комплексті қосылыстардың құрылысы.
2.3
Комплексті қосылыстардың магниттік
қасиеттері.
2.4
Комплексті қосылыстардың классификациясы.
2.5
Комплексті қосылыстардың изомериясы.
III.Қорытынды.
КОМПЛЕКСТІ
ҚОСЫЛЫСТАР
Валенттік
жайындағы ілім химияға әбден орныққаннан
кейін химиялық
Біздің
осы уақытқа дейін оқып келген
қосылыстарымыздың басым
Комплексті
қосылыстар туралы ілімнің негізін
жасаған Швейцария ғалымы
Мүндағы
қосылысудың ретін түзілген Н2SіҒб
қасиеттері көрсетеді; бұл
н+Гғ-
ғ- «» Sі4+н+ Іғ+ ғ+
Демек,
SіҒ4 құрамындағы кремний НҒ құрамындағы
Ғ~ ионын
Құрамында
осындай комплекс ионы бар қосылыстар
комплексті қосылыстарға
Комплексті
қосылыстарды ғылыми түрғыдан А л ь ф
XX
ғасырдан бастап комплексті қосылыстарды
жете тексерген теориялар
Лев
Александрович Чугаев Москвада туған.
Москва университетін бітірген.
Л.
А. Чугаевтың платиналық металдардың
химиясы жөнінде істеген
Координациялық
теория бойынша комплексті қосылыста
орталық орын алып
Комплекс
түзушінің айналасына, соның әсері
жететіндей жақындатқанда жиналған,
[Рі(NНз)4],
Сi,- [NН4]С1, [Рі(NНз)2С12]С12 т.б. Комплексті
қосылысты суға
[РІ(NН3)4С12]С12
[Рі(NНз)4С12]» + 2С1
Комплекстің
ішкі сферасында координацияланатын
лигандтар
Комплексті
қосылыстың қүрамы белгілі болса, комплекс
түзушінің зарядын
Осы
уақытқа дейін оқыған және алдымызда
оқитын атомдық
Құрамында
оттек бар қосылыстар —
таллогидраттар
түзеді), спирттер (алкоголяттар түзеді),
қышқылдар (ацидат
түзеді),
альдегидтер мен кетондар да комплекстің
ішкі сферасына
Құрамында
азот бар
органикалық
аминдер (аминат түзеді), нитридтер,
амидтер т. б.
ішкі
сфераға кіре алады.
Құрамында
күкірт бар
эфирлер
т. б. қосылыстар да ішкі сфераға кіріп
Тұздар
және түздардың қос түз типті комплексті
қосылыстары.
Полигалогенид,
полисульфид сияқты комплексті қосылыстар.
6.
Күрделі қышқылдар (изополиқышқылдар,
гетерополиқышқылдар).
Химияда
неше комплекс түзуші элемент болса,
соның әрқайсысы
Комплекс
иондарының беріктігі әр түрлі болады,
мысалы Қ2[РіС1б]
Координациялық
сан 2 бір валентті күміс А§, алтын
Ш~
Орталық атом
о ©
о
Координациялық
сан 3 сирек кездеседі. Мысал ретінде
сынаптың
Комплекс
түзушінің координациялық саны 4 болғанда
комплексті ионның
[ВеҒ4]2~,[ВҒ4Г,„
[ВСI]», [ВВг4]-,
Жазық
квадратты комплекстерді
[Р1С14]2+,
[Рс1С14]2~, [АиСI]» және т. б.
Координациялық
саны 5 болып келетін комплекстер сонша
көп
Ең
жиі кездесетін координациялық сан 6.
Мұндай комплекстердің
Шынында
да қос тұздар мен комплексті тұздардың
арасында
ал
комплексті тұздар комплекс ион тұзеді.
К2[РіС16]^2ІС +
Сондықтан
қос тұздарды комплексті тұздардан
айырмашы-
лығын
көрсету үшін К2[СиС14] деп жазбайды,
СиС12-2КС1 деп
жазады.
*
Комплексті
қосылыстардың беріктігік сипаттау
үшін, ком-плексті ионның диссоциациялану
[Р14+1
[СГ]6 т
Неғұрлым
Кт мәні кіші болса, соғұрлым комплексті
ионның
Комплексті
ионның диссоциациялануы қайтымды
Қазіргі
кезде комплексті қосылыстардағы
байланыстың табиғатын қарастыратын үш
1)
валенттік байланыс әдісі, 2) кристальдық
өріс теорйясы,
Орталық
атомның бос орбитальдарының саны оның
комплекс-ті қосылыстағы
Кобальт
катионының валенттік қауызында төрт
бос орбиталь бар
Жұлдызша
(*) белгісі кобальт катионының қозған
күйде екенін
Кобальт
катионының аталған алты орбиталі аммиак
молекуласының құрамындағы
Сонымен
валенттік байланыс әдісі бойынша
комплексті қосылыстағы орталық
Валенттік
байланыс әдісі комплексті қосылыстардағы
орталық атом мен
Аталған
орбитальдар гибридтенгенде алты
sр3<і2-орбитальдар
Аммиакты
комплексте кобальт
Қазіргі
заманғы кристалдық өріс теориясы Коссель
(1916 ж.)
Иондық
түрғыдан бір валентті күмістің
дииодокомпексінің [Аg12] түзілуін
22 2
р —
Д
Сонымен
молекулаға қарағанда комплексті ион
[Аg12] ~ түзілгенде
!-а^
Кристалдық
өріс теориясы бойынша комплексті
қосылыстардың магниттік қасиеттерін
байланысты
болады. Егер, лигандтың тудыратын
Комплексті
қосылыстардың түсі. Комплексті
қосылыстардың түсі (бояуы) электронның
Сонымен
кристалдық өріс теориясы комплексті
қосылыстардың көптеген қасиеттерін
Комплекстер
ішкі сферасының зарядына қарай, катионды,
анионды және
Катионды
комплекстер орталық ионның айналасына
бейтарап молекулалар (N2О,
Анионды
комплекстерде комплекс түзушінің ролін
оң зарядталған ион,
Бейтарап
комплекстер атомның айналасына
молекулалар координацияланғанда
(мысалы, [Nі(СО)4]
Комплекс
түзушінің ролін кезкелген элемент
аткаруы мүмкін. Бірақ,
—СН2
2]2+
[Си(еп)
[си(NН3)А]2+
Хелатты
комплекстер өте түрақты болады. Хелатты
комплекстер түзетін
Бірінші
комплексте сульфат ион орталық атоммен
бір оттек
Қомплекстердің
аталуы. Комплексті қосылыстардың аттары
ұзақ уақыт бойы
Жаңа
номеійклатура бойынша комплекс
қүрамындағы теріс зарядталған лигандтардың
Комплексті
катионды атағанда алдымбн саны көрсетіліп
теріс зарядталған
Сонымен
халықаралық номенклатура бойынша
формула «басынан соңына» қарай
К4[Ғе(СN)б]
-гексацианоферрат (II) калия қазақшасы:
калийдің гексацианофеорраты (II).Күрделі
Қөп
ядролы комплекстердің аталуы. Құрамында
екі немесе дан
(III)(I)
комплексте орталық атомдар Со3+
бірімен-бірі гидроксил (ОН),
Құрамдары
бірдей бірақ құрылысы мен қасиеттері
әртүрлі заттар
Гидраттық
изомерия су молекуласының комплекс
қүрамында әртүрлі орналасуынан
[Сг(Н2О)б]
СІз [Сг (Н2О)5С1] С1
Бұл
изомерлердің судағы ерітінділеріне
Аg+ иондарын қосқанда күлгін
Иондық
изомерия аниондардың ішкі сфера мен
сыртқы сфераға
[Со(NНз)5Вг]SО4
[Со(NНз)SО4]Вг
қызыл-күлгін
қызыл
Қызыл-күлгін
түсті изомер ерітінді де [Со(NН3)5Вг]2+
және $О2~
Координациялық
изомерия екі түрлі лигандтардың
екі
комплекс түзушінің айналасына әртүрлі
жолмен
[Со(NН3)6]
[Сг(СN)6] [Сг(NН3)б] [Со(СN)б]
I II
изомерде
Со3+-тың айналасына аммиак молекулалары,
ал
изомерде
СЫ~ аниондары координацияланған.
Геометриялық
изомерия комплекс қүрамында кем дегенде
екі түрлі
Цис-
изомер (сары түсті) транс- изомер (ашық
сары
Әрбір
лиганд өзіне транс- бағытта орналасқан
лиганд пен
Бұған
деңін қарастырылған қосылыстар атомдық
деп аталады, өйткені
Судағы
ерітінділерінде комплекс қосылыстар
комплекс ионына және қарапайым
К4[Ғе(СN)6—4К++
[Ғе(СN)6]4-
[Си
(NH3) 4] (ОН) 2- ± [Си (N)
Н[АиСI]-Н++[АиСI]-
Кристалда
да, ерітіндіде де құрамында комплекс
ионы болатын
Барлық
комплекс қосылыстарын қамтитын толық
анықтама беру үшін
Комплекс
қосылыстарының құрылысы мен қасиеттерін
Щвецария ғалымы Альфред
1.
Комплекс қосылыстардағы басты орый
комплекс түзуші үлесіне
2.
Комплекс түзушінің маңайына теріс
зарядталған аниондар немесе
Комплекс
түзушінің маңайына орналасқан немесе
координацияланған лигандалардың жалпы
динациялық
саны деп аталады.
Комплекс
түзуші мен лигандалар комплекс
қосылысыныку ішкі сферасын
Ішкі
сфераға симай қалған иондар комплекс
қосылысының сыртқы
Комплекс
қосылыстарының формулаларын жазғанда
ішкі сфера квадрат жақшаға
Негізгі
комплекс түзушілерге Д. И. Менделеев
периодтық системасының
Кейбір
көп кездесетін комплекс түзушілер және
олардық координациялық
Си+,
А^+, Аи+ Си2+, Аи3+, Н^2+ А13+, 2п2+,
Маңызды
лигандаларға мына төмендегі полюсті
молекулалар мен аниондар
Полюсті
молекулалар Н2О, NН3, СО, N0, NH20Н т.
Иондар:
Ғ~, С1~, Вг~, I», 02~, 0Н~, СN~,
Комплекс
қосылысының сыртқы сферасында аниондар
немесе катиондар болуы
Комплекс
қосылысының формуласын құрастыру үшін
комплекс түзушінің координациялық
Мысалы
комплекс түзуші екі оң зарядты темір
ионынан,
Жоғарыда
келтірілген мәліметтерден Ғе2+ ионының
координациялық саны 6
[Ғе(СN6]
Енді
комплекс ионының зарядын табамыз.
Комплекс ионының заряды
+
2+(-1).6=-4
Комплекс
ионының заряды — 4 болғандықтан сыртқы
сферада
НІшкі
сфераның құрамында бір ғана комцлекс
түзуші болатын
Қурамында
комплекс катионы бар қосылыстың
систематикалық аттарын былай
[Аg(NНз)С1
— диаммин күміс (I) хлориды [Си(Н2О)4]SО4
Н2О
К[Ag(СN)2]—калий
дицианоаргентаты (I)
Nа3[СО(NО2)б]
— натрий гексанитриткобальтаты (III)
Кз[Nі
(NОNSгОзN — калий дитиосульфатодинитрозилниколать
(I)
Сыртқы
сферасы жоқ нейтрал’ комплекстердің
аттарын атаe
үшін
алдымен лигандалардың аттарын онан
кейін атау септігіндег
Rи[Н2О)
(NНз)4SОз]—сульфиттетраамминаква рутений
Комплекс
қосылыстар құрамындағы лигандалардың
типтеріне және комплекс түзушінің
І.Құрамында
бір орын алатын лигандаларболатын
комплекс қосылыстар. Бұларға
Ішкі
сферасында лигандалар түрінде су
молекулалары болатын комплекс
[А1(Н2О)б]С1з;
[Ғе(Н2О)6]SО4-Н2О;
[Сг(Н2O)6](N)з)з;
[Со(Н2О)6]СI; [Ni(Н2O4Br2
Лигандалары
тек аммиак молекулаларынан тұратын
комплекс қосылыстарын аммиакаттар
[СгNН3)6]С13;
[Zп(NН8)4]SО4;.[Аи(NН3)4]С1з
Лигандалары
тек көміртегі (II) оксидінен тұратын
комплекс қосылыстарды
2.
Құрамында лигандалар түрінде тек
аниондар болатын комплекс
Кейбір
ацидокомплекстердің мысалдары төменде
келтірілген: К4[Pd(СNS)б]; К2[Нg(NО3)4];
Кз[Ғе(СN)6];
3.
Сақина тәрізді немесе циклды комплекс
қосылыстар. Сақина
СН2-NН2
Си Н2N-СН2 СН2-NН2
Түзілген
комплекс косылыста лиганда — аминсірке
қышқылы-ның қалдығы
Никель
диметилглиоксиматындағы никель мен
екі лиганда арасында екі
4.
Көп ядролы комплекс қосылыстар. Жоғарыда
қарастырылған бір
Комплекс
қосылыстарының изомер л
Комплекс
иондарыньщ диссоциациялары аз мөлшерде
жүретін қайтымды процесс
Тұрақсыздық
константаларының сандық мәндері комплекс
иондарының тұрақтылығын немесе
Комплекс
иондарының тұрақсыздық константалары
оқу құра-лының (III) қосымша
[Аg
(NН3) 2]+ + 2Н+±Аg+ + 2 [NН4]
Тотығу-тотықсыздану
реакцияларының нәтижесінде бір комплекс
косылысын бұзып басқа
.
Комплекс қосылыстарының иондарын
анықтау
Химиялық
реакциялардың жәрдемімен ерітіндідегі
комплекс қосылыстарының сыртқы және
Дегенмен
Кз[Ғе(СN)б] ерітіндісіне екі зарядты
темір тұздарын қосу
[Ғе(СN)б]4″
комплекс ионын анықтау үшін К4[Ғе(СN)6]
ерітіндісіне үш
Комплекс
қосылыстарда химиялық байланыстардың
түзілуі, бүрын қарастырылған атомдық
Қазіргі
кезде комплекс қосылыстардың түзілуін,
қүрылысын, қасиеттерін үш
Валенттік
байланыс теориясы. Валенттік байланыс
теориясының негізі мынадай
Комплекс
түзуші мен лигандалардың арасындағы
байланыс донорлы-акцепторлы болады.
Комплекс
түзушінің химиялық байланысқа қатысатын
орбитальдары алдымен гибридтеледі,
Комплекс
түзушінің орбитальдарының гибридтелу
типі комплекс қосылысының геометриялық
Комплекс
қосылысында дара электрондар болса
парамагнитті яғни магнитке
Енді
валенттік байланыс теориясы тұрғысынан
бірнеше комплекс түзушілер
Екінші
период элементтері комплекс түзуші
ретінде болса
олардың
бір 5-, үш р-орбитальдары гибридтеледі.
Мысал
ретінде аммоний комплекс ионының [МН4]+
түзілу ме-ханизмін
10
Комплексные соединения
Общая химия. Учебное пособие — Таирова А.Р., Кузнецов А.И. — 2005
- 9.1. Определение комплексных соединений
- 9.2. Комплексообразователи
- 9.3.Лиганды
- 9.4. Номенклатура комплексных соединений
- 9.5. Диссоциация комплексных соединений
- 9.6. Константы устойчивости комплексов
- 9.7.Роль комплексных соединений
- 9.8. Комплексонометрия. Жесткость воды
9.1. Определение комплексных соединений. Такие соединения, как оксиды, кислоты, основания, соли образованы из атомов в результате возникновения между ними химической связи. Это соединения обычные, или соединения первого порядка.
Однако имеются вещества, которые образованы в результате соединения друг с другом нейтральных молекул без возникновения новых связующих электронных пар. Например:
K2S04 + A12 (S04)3 = K2S04·AI2 (SО4)3 = 2KA1 (SO4)2
CuSO4 + 5H2O = CuSO4 · 5H2O
CuS04 + 4NH3 = CuSО4·4NH3 = [Cu (NH3)4] SO4
Fe (CN)3 + 3KCN = Fe (CN)3·3KCN = K3 [Fe (CN)6]
HgI2 + 2KI = HgI2·2KI = K2[HgI4]
Это молекулярные соединения, или соединения высшего порядка. Одни из них диссоциируют в водном растворе на простые ноны, например:
КА1 (SО4)2 ↔ K+ + А13+ + 2 SО42 —
другие — на сложные (комплексные) ионы, состоящие, в свою очередь, из более простых ионов, как, например:
К3 [Fe (CN)6] ↔ЗК + + [Fe (CN)6]3-
Молекулярные соединения, образующие комплексные ионы, способные к существованию как в растворе, так и в кристалле, называют комплексными. Но такое определение применимо лишь в известных пределах. Оно не охватывает соединений типа неэлектролитов, например карбонилов металлов —Ni(CO)4 и др., а потому не является и полным.
Чтобы объяснить, почему происходит присоединение одних простых молекул к другим, швейцарский химик А. Вернер ввел понятие о главной и побочной валентности. Тогда образование, скажем, K2[HgI4] можho представить так: ион ртути за счет своей главной валентности (обозначается сплошной линией), равной двум, присоединяет два иодид-иона, а за счет побочной — (обозначается пунктиром) — дополнительно еще два иодид-иона. По Вернеру, это может быть изображено формулой
В настоящее время главную валентность надо объяснить ионной или ковалентной связью, а побочную – ковалентной связью, возникшей по донорно-акцепторному механизму (см. раздел 4.8.2.). Исходя из механизма образования комплексных соединений, им можно дать более точное, не имеющее исключений определение: комплексные соединения – это соединения, характеризующиеся наличием хотя бы одной ковалентной связи, возникшей по донорно-акцепторному механизму.
Комплексообразование происходит во всех случаях, когда из менее сложных систем образуются системы более сложные. Согласно координационной теории А. Вернера в структуре комплексного соединения различают координационную (внутреннюю) сферу, состоящую из центральной частицы – комплексообразователя (ион или атом) – и окружающих ее лигандов (ионы противоположного знака или молекулы). Ионы, находящиеся за пределами координационной сферы, образуют внешнюю сферу комплексного соединения. Число лигандов вокруг комплексообразователя называется его координационным числом. Внутренняя сфера (комплекс) может быть анионом, катионом и не иметь заряда. Например, в комплексном соединении K3[Fe(CN)6] внешняя сфера – 3К+, внутренняя сфера [Fe(CN)6]3-, где Fe3+ — комплексообразователь, a 6CN – лиганды, причем, 6 – координационное число. Таким образом, комплексное соединение (как правило) в узлах кристаллической решетки содержит комплекс, способный к самостоятельному существованию и в растворе.
9.2. Комплексообразователи. Комплексообразователями служат атомы или ионы, имеющие вакантные орбитали. Способность к комплексообразованию возрастает с увеличением заряда иона и уменьшением его размера. К наиболее распространенным комплексообразователям относятся ионы d-элементов VII, VIII, I и II групп периодической таблицы элементов.
9.3.Лиганды. К числу лигандов относятся простые анионы, такие как F— , СI—, Вr—, I—, S2-, сложные анионы, например CN– , NCS – , NO2—) , молекулы, например Н2О, NH3, C. Ионы или отдельные атомы ионов и молекул лигандов имеют неподеленные пары электронов. В зависимости от того, какое число вакантных орбиталей у комплексообразователя занимают лиганды, они подразделяются на монодентантные (одна орбиталь), например NН3, СI—, бидентантные, например N2H4или En, полидентантные, например этилендиаминтетрауксусная кислота (ЕДТА), являющаяся шестидентантным лигандом
Динатриевая соль ЕДТА и сама кислота относятся к классу соединений, называемых комплексонами. Би- и полидентантные лиганды при взаимодействии с комлексообразователями образуют замкнутые циклы, называемые хелатными, поэтому и комплексы с би- и полидентантными лигандами называют хелатными (или клешневидными), например
Пример 1. Определите заряд комплексного иона, координационное число (к.ч.) и степень окисления комплексообразователя в соединениях: a) K4[Fe(CN)6]; б) Na[Ag(NO2)2]; в) K2[MoF8]; г) [Сr(Н2O)2(NН3)3С1]С12.
Решение. Заряд комплексного иона равен заряду внешней сферы, но противоположен ему по знаку. Координационное число комплексообразователя равно числу лигандов, координированных вокруг него. Степень окисления комплексообразователя определяется так же, как степень окисления атома в любом соединении, исходя из того, что сумма степеней окисления всех атомов в молекуле равна нулю. Заряды нейтральных молекул (H2O, NН3) равны нулю. Заряды кислотных остатков определяют из формул соответствующих кислот. Отсюда:
| Заряд иона | К.ч. | Степень окисления | |
| а) | -4 | 6 | +2 |
| б) | -1 | 2 | +1 |
| в) | -2 | 8 | +6 |
| г) | +2 | 6 | +3 |
9.4. Номенклатура комплексных соединений. Название комплексного катиона записывается одним словом, начинающимся с названия отрицательного лиганда с прибавлением буквы «о», затем приводятся нейтральные молекулы и центральный атом с указанием римской цифрой его степени окисления для металлов переменной валентности. Для молекул Н2О (аква), NН3 (аммин), СО (карбонил), NO (нитрозил) даются особые названия, указанные в скобках.
Число лигандов обозначают греческими приставками (ди-, три-, тетра- и т.д.) или бис-, трис-, тетракис-, пентакис- и гексакис- для 2, 3, 4, 5 и 6 соответственно у сложных лигандов. Например, соединение [Zn(NH3)2Cl]CI называется хлорид хлородиамин цинка (II), а [Ni(En)2]Cl2 – хлорид бис(этилендиамин) никеля (II).
Комплексный анион записывается аналогично названию катиона, но с добавлением суффикса -«am» к названию комплексообразователя, например K2[Zn(CN)4] — тетрацианоцинкат (II) калия. Нейтральный комплекс записывается подобно катиону, например комплекс [Ni(CО)4] называется тетракарбонил никеля (II). Соответственно по типу лигандов комплексы называют аквакомплексы (лиганд Н2О), аминокомплексы (лиганд NH3), ацидокомплексы (лиганды анионы кислот), комплексонатные комплексы (лиганды-комплексоны) и т.д.
9.5. Диссоциация комплексных соединений. Комплексные соединения — неэлектролиты в водных растворах диссоциации не подвергаются. У них отсутствует внешняя сфера комплекса, например: [Zn(NH3)2Cl2], [Co(NH3)3(NO3)3], [Pt (NH3)2C12]. В водной среде такие молекулы гидратируются как единое образование.
Комплексные соединения — электролиты при диссоциации в водных растворах образуют комплексные ионы, например:
[Ag (NH3)2] CI ↔[Ag (NH3)2]+ +С1– ; К [Ag (CN)2 ↔K+ + [Ag (CN)2]—
Такая диссоциация протекает полностью, ионы гидратируются. Комплексные ионы в свою очередь подвергаются вторичной диссоциации:
[Ag(NH3)2]+ ↔Ag++2NH3 (a)
[Ag (CN)2] — ↔ Ag+ +2CN— (б)
Однако эта диссоциация обычно протекает в незначительной степени. Применяя закон действующих масс к обратимым процессам (а) и (б), получаем выражения констант нестойкости комплексных ионов:
Константа нестойкости комплексного иона характеризует прочность (устойчивость) внутренней сферы комплексного соединения. В приведенных примерах комплекс [Ag(CN)2]— более прочен, чем
комплекс [Ag(NH3)2]+, так как имеет меньшее значение КН.
Соединения с малоустойчивой внутренней сферой называют двойными солями. Обозначают их иначе, чем комплексные соединения, а именно — как соединения молекул, например K2SO4∙A12(SO4)3. Принципиальной же разницы между двойными солями и комплексными соединениями нет. В растворе двойной соли имеется некоторое количество комплексных ионов (например, [Al (SO4)2]—). Двойная соль отличается от комплексной соли лишь диссоциацией комплексного иона: у первой она практически полная, а у второй — незначительная.
Двойные соли — довольно распространенные соединения. К ним относятся соль Мора (NH4)2SO4∙FeSO4∙6H2O, двойной хлорид калия и меди 2КС1 ∙ СuС12 ∙ 2Н2О и многие другие. Если, например, растворить в воде двойной хлорид, то происходит диссоциация
2КС1∙СuС12∙2Н2О↔2К++Сu2+ + 4С1—+2Н2О
и все образовавшиеся в растворе ионы можно обнаружить с помощью соответствующих реакций. Но если это соединение рассматривать как комплексное, то его формулу надо изобразить как K2[CuС14]∙2H2О. Диссоциация K2[CuС14]∙2H2О протекает по уравнению:
К2 [CuCl4] ∙ 2H2O↔ 2К + + [CuC14]2 — + 2Н2О
и
[CuCl4]2-↔Cu2+ + 4Cl—
Образующийся комплексный ион устойчив только в концентрированных растворах, и его константа нестойкости при комнатной температуре
Сравним значение КН [CuCl4]2- со значением константы нестойкости одного из комплексных ионов меди, например КН[Cu(NH3)4]2+ = 4,6 ∙ 10 – 14. Тогда мы увидим, что КН [CuCl4]2- > КН[Cu(NH3)4]2+ на несколько порядков, а чем меньше константа нестойкости комплекса, тем больше его устойчивость.
Пример 1. Напишите выражение для константы нестойкости комплекса [Fе(СМ)6]4-.
Решение. Если комплексная соль гексацианоферрат (II) калия, являясь сильным электролитом, в водном растворе необратимо диссоциирует на ионы внешней и внутренней сфер
K4[Fe(CN)6] = 4K+ + [Fe(CN)6]4–
то комплексный ион диссоциирует обратимо и в незначительной степени на составляющие его частицы:
[Fe(CN)6]4– ↔ Fe2+ + 6CN–
Обратимый процесс характеризуется своей константой равновесия, которая в данном случае называется константой нестойкости (Кн) комплекса:
Чем меньше KH, тем более прочен данный комплекс.
9.6. Константы устойчивости комплексов. Для характеристики устойчивости (прочности) комплексного иона применяют также величину, обратную константе нестойкости. Ее называют константой устойчивости (КУСТ) или константой образования комплекса. Величины КН и КУСТ взаимосвязаны:
Очевидно, чем выше КУСТ, тем прочнее комплексный ион и тем больше его концентрация при равновесии.
Следует подчеркнуть, что как диссоциация комплексного иона, так и его образование являются процессами обратимыми и протекают ступенчато, как у слабых электролитов. Каждой ступени соответствует определенная величина константы устойчивости — К1, К2 …, Кn. Ион [Ag(NH3)2] + будет иметь две константы устойчивости — K1 и K2:
У иона [Cu(NH3)4]2+ будет четыре константы устойчивости, так как комплексообразователь в четыре стадии присоединяет лиганд NH3
Таким образом, при образовании комплексов в растворе происходит последовательное (стадийное) внедрение лигандов во внутреннюю сферу комплексообразователя с соответствующим отщеплением молекул воды, так как исходный ион Сu2+ был гидратирован (он имел состав [Cu(H2O)4]2+). При диссоциации комплекса [Cu(NH3)4]2+, наоборот, происходит соответствующая замена лигандов на молекулы воды. Поскольку концентрация воды при таких процессах не изменяется, ее не включают в выражение констант устойчивости или констант нестойкости.
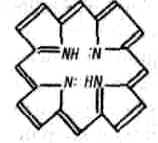
9.7.Роль комплексных соединений. Комплексные соединения широко распространены в природе. В состав многих растений и живых организмов входят соединения с макроциклическими лигандами. В упрощенном виде тетрадентантный макроцикл порфин представлен на рис. 3.3
Рис. 3.3. Структура молекул порфина
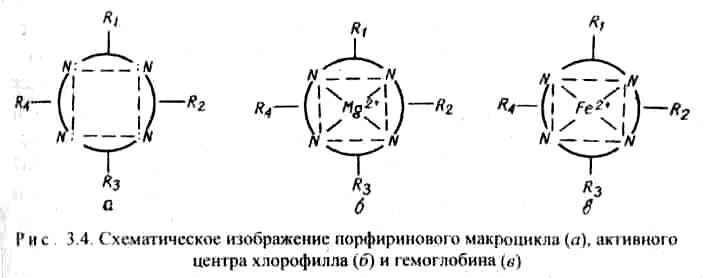
Комплексы с участием порфина называются порфи-ринами. Они отличаются друг от друга центральными ионами-комплексообразователями и заместителями, присоединенными к атомам углерода на периферии лиганда. В наиболее простом виде порфиновый цикл представлен четырьмя атомами азота, соединенными углеродными цепями (рис. 3.3). Кроме того, имеются четыре или более заместителей — радикалов R1, R2, R 3, R4. В зеленом катализаторе фотосинтеза — хлорофилле роль комплексообразователя выполняет магний (рис. 3.4). Макроциклический комплекс железа входит в состав гемоглобина (рис. 3.4).
Железо координирует кислород в комплексе гемоглобина и переносит его по организму с кровью. Связь кислорода с железом в комплексе не очень прочная и поэтому кислород в организме легко реагирует с восстановителями. Недостаток железа в организме приводит к болезни — анемии. Макроциклы крови могут взаимодействовать с каталитическими ядами, например, монооксидом углерода СО, что приводит к отравлению организма.
Сложные лиганды-комплексоны широко используются в энергетике для очистки парогенераторов от накипи, в медицине — для очистки почек от камней, для выведения ядов из организма, таких как Hg2+ Pb2+ Cd2+, в химии — как катализаторы некоторых реакций, например восстановления кислорода, в аналитической химии, в частности, при определении жесткости воды.
9.8. Комплексонометрия. Жесткость воды. Жесткость воды выражается суммой миллиэквивалентов ионов Са2+ и Mg2+, содержащихся в 1 л воды (ммоль/л). Один миллимоль жесткости отвечает содержанию 20,04 мг/л Са2+ или 12,16 мг/л Mg2+.
Пример 1. Вычислите жесткость воды, зная, что в 500 л ее содержится 202,5 г Са(НСО3)2.
Приведенные примеры решают, применяя формулу Ж = m / (mЭ ∙ V)
где: т – масса вещества, обусловливающего жесткость воды или применяемого для устранения жесткости, мг;
mэ, – молярная масса эквивалента этого вещества;
V – объем воды, л.
Решение. В 1 л воды содержится 202,5 : 500 = 0,405 г Са(НСО3)2, что составляет 0,405 : 81 = 0,005 ммоль/л. 81 г/моль — эквивалентная масса Са(НСО3)2. Следовательно, жесткость воды 5ммоль. (Ж = т / (mэV)= 202 500 / (81 • 500) = 5 ммоль. 81 – эквивалентная масса Са(НСО3)2, равная половине его молярной массы).
Пример 2. Сколько граммов CaSO4 содержится в 1 м3 воды, если жесткость, обусловленная присутствием этой соли, равна 4 ммоль?
Решение. Молярная масса CaSO4 136,14 г/моль; молярная масса эквивалента равна 136,14:2 = 68,07 г/моль. В 1 м3 воды жесткостью 4 ммоль содержится 4 · 1000 = 4000 ммоль, или 4000 · 68,07 = 272 280 мг = 272,280 г CaSO4. Из формулы Ж = m / (mэV),m = 468,071000 = 272 280 мг = 272,280 г CaSO4).
Пример 3. Какую массу соды надо добавить к 500 л воды, чтобы устранить ее жесткость, равную 5 ммоль?
Решение. В 500 л воды содержится 500 · 5 = 2500 моль солей, обусловливающих жесткость воды. Для устранения жесткости следует прибавить 2500 · 53 = 132 500 мг = 132,5 г соды (53 г/моль — молярная масса эквивалента Na2CO3).
Пример 4. Вычислите карбонатную жесткость воды, зная, что на титрование 100 см3 этой воды, содержащей гидрокарбонат кальция, потребовалось 6,25 см3 0,08 н. раствора НС1.
Решение. Вычисляем молярную концентрацию эквивалентов раствора гидрокарбоната кальция. Обозначив число эквивалентов растворенного вещества в 1 л раствора, через х, составляем пропорцию:
Таким образом, в 1 л исследуемой воды содержится 0,005·1000 = 5 ммоль гидрокарбоната кальция или 5 ммоль Са2+-ионов. Карбонатная жесткость воды 5 ммоль.
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Состав комплексных соединений
Номенклатура комплексных соединений
Реакции образования комплексных соединений
Реакции разрушения комплексных соединений
Диссоциация комплексных соединений
Примеры решения задач
Задачи для самостоятельного решения
Состав комплексных соединений
Рис. 1. Состав комплексного соединения
Комплексное соединение, рисунок 1, состоит из внутренней и внешней сферы. Центральная частица, вокруг которой расположены окружающие ее лиганды, называется комплексообразователем. Число лигандов комплексообразователя называется координационным числом.
Номенклатура комплексных соединений
Комплексное соединение может состоять из комплексного катиона, комплексного аниона или может быть нейтральным.
Соединения с комплексными катионами. Вначале называют внешнесферный анион, затем перечисляют лиганды, затем называют комплексообразователь в родительном падеже (ему дается русское название данного элемента). После названия комплексообразователя в скобках римской цифрой указывается его степень окисления.
К латинскому названию анионного лиганда добавляется окончание “о” (F— — фторо, Cl— -хлоро, ОН— — гидроксо, CN— — циано и т.д). Аммиак обозначают термином “аммин”, СО – карбонил, NO – нитрозил, H2O – аква.
Число одинаковых лигандов называют греческим числительным: 2 –ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта и т.д.
[Cu(NH3)4]SO4 – сульфат тетраамминмеди (II),
[Ni(H2O)6]Cl2 – хлорид гексаакваникеля (II).
Вначале перечисляют лиганды анионные, затем нейтральные, затем катионные. Например,
[Pt(NH3)5Cl]Cl3 – хлорид хлоропентаамминплатины (IV) .
Если в комплексе имеются несколько лигандов одинакового знака заряда, то они называются в алфавитном порядке:
[CoCl2(H2O)(NH3)3]Cl – хлорид дихлороакватриамминкобальта (III).
Соединения с комплексными анионами. Вначале называют комплексный анион в именительном падеже: перечисляют лиганды, затем комплексообразователь (ему дается латинское название и к названию добавляется окончание “ат”). После названия комплексообразователя указывается его степень окисления. Затем в родительном падеже называется внешнесферный катион.
Na2[Zn(OH)4] – тетрагидроксоцинкат (II) натрия;
K4[Fe(CN)6] – гексацианоферрат (II) калия;
K2[СuCl4] – тетрахлорокупрат (II) калия.
Соединения без внешней сферы. Вначале называют лиганды, затем комплексообразователь в именительном падеже с указанием его степени окисления. Все название пишется слитно.
[Ni(CО)4] – тетракарбонилникель (0);
[Pt(NH3)2Cl4] – тетрахлородиамминплатина (IV).
Реакции образования комплексных соединений
Комплексные соединения обычно получают действием избытка лигандов на содержащее комплексообразователь соединение. Координационное число, как правило, в 2 раза больше степени окисления комплексообразователя. Из этого правила бывают, однако, исключения.
Образование гидроксокомплексов.
AlCl3 + 6NaOH(изб) = Na3[Al(OH)6] + 3NaCl
AlCl3 + 4NaOH(изб) = Na[Al(OH)4] + 3NaCl
ZnSO4 + 4NaOH(изб) = Na2[Zn(OH)4] + Na2SO4
Образование комплексных солей.
Если комплексообразователем является Fe2+ или Fe3+, то координационные числа в обоих случаях равны шести:
FeCl2 + 6KCN(изб) = K4[Fe(CN)6] + 2KCl
Fe2(SO4)3 + 12KCN(изб) = 2 K3[Fe(CN)6] + 3K2SO4
Координационные числа ртути и меди, как правило, равны четырем:
Hg(NO3)2 + 4KI(изб) = K2[HgI4] + 2KNO3
CuCl2 + 4NH3(изб) = [Cu(NH3)4]Cl2
Для большинства аква- и амминных комплексов ионов d-элементов координационное число равно шести:
NiCl2 + 6NH3 (изб) = [Ni(NH3)6]Cl2
Реакции разрушения комплексных соединений
Разрушение комплексных соединений происходит в результате:
-
-
- образования малорастворимого соединения с комплексообразователем:
-
[Cu(NH3)4]SO4 + Na2S = CuS↓ + 4NH3↑ + Na2SO4
-
-
- образования более прочного комплексного соединения с комплексообразователем или с лигандом:
-
[Cu(NH3)4]SO4 + 4KCN(изб) = K2[Cu(CN)4] + 4NH3↑ + K2SO4
[Cu(NH3)4]SO4 + 4HCl = 4NH4Cl + CuSO4
-
-
- образования малодиссоциированного электролита:
-
Na2[Zn(OH)4] + 4HCl(изб) = 2NaCl + ZnCl2 + 4H2O
-
-
- действия любой сильной кислоты на гидрокомплексы; в этом случае образуется соль и вода:
-
К3[Al(OH)6] + 6HCl(изб) = 3KCl + AlCl3 + 6H2O
-
-
- нагревания некоторых комплексных соединений:
-
[Cu(NH3)4]SO4 → CuSO4 + 4NH3↑
Na[Al(OH)4] → NaAlO2 + 2H2O
-
-
- окислительно-восстановительных реакций:
-
2Na[Ag(CN)2] + Zn = Na2[Zn(CN)4] + 2Ag
6K4[Fe(CN)6] +K2Cr2O7 +7H2SO4=6K3[Fe(CN)6] +Cr2(SO4)3 +4K2SO4 +7H2O
Диссоциация комплексных соединений
Комплексные соединения в водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы. В то же время комплексный ион диссоциирует в незначительной степени как ассоциированный электролит. Количественной характеристикой диссоциации внутренней сферы в растворе является константа нестойкости, представляющая собой константу равновесия процесса диссоциации комплексного иона.
Например, в растворе комплексное соединение [Ni(NH3)6]SO4 диссоциирует следующим образом:
[Ni(NH3)6]SO4 = [Ni(NH3)6]2+ + SO42-
Для комплексного иона [Ni(NH3)6]2+, диссоциирующего по уравнению
[Ni(NH3)6]2+ → Ni2+ + 6NH3
константа равновесия процесса диссоциации носит название константы нестойкости Кн. Для рассматриваемого процесса Кн равна
Кн = [Ni2+]·[NH3]6 / [[Ni(NH3)6]2+] (1)
Величина, обратная Кн, называется константой устойчивости:
Ку = 1/Кн (2)
Она представляет собой константу равновесия процесса образования комплексного иона:
Ni2+ + 6NH3 ↔ [Ni(NH3)6]2+
Константа нестойкости Кн связана с изменением энергии Гиббса процесса диссоциации комплекса уравнением:
ΔGTо = — RTln Кн (3)
Примеры решения задач:
Задача 1. Вычислите:
1) Концентрацию ионов NO3— в 0,01 М растворе [Ag(NH3)2]NO3.
2) Концентрацию Ag+ в 0,01 М растворе [Ag(NH3)2]NO3, содержащем 2 моль/л избыточного аммиака,
если Кн[Ag(NH3)2]+ = 5,7× 10— 8 при 298 К.
3) Величину ΔGo298 процесса диссоциации комплексного иона.
Решение:
1)
[Ag(NH3)2]NO3 = [Ag(NH3)2]+ + NO3—
[NO3— ] = 0,01М, поскольку комплекс диссоциирует как сильный электролит на комплексный ион и ионы внешней сферы.
2) Комплексный ион диссоциирует незначительно:
[Ag(NH3)2]+ → Ag+ + 2NH3
Положение равновесия комплексного иона в присутствии избытка NH3 еще больше смещено влево.
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Ag+ и 2x моль/л аммиака. Суммарная концентрация аммиака равна (2x+2) моль/л. Концентрация недиссоциированного комплексного иона [Ag(NH3)2]+ составляет: (0,01–x) моль/л.
Концентрация аммиака, связанная с диссоциацией комплексного иона, ничтожно мала по сравнению с избытком аммиака. Доля комплексного иона, подвергшегося диссоциации, также ничтожно мала. Значит,
x = 1,43× 10— 10
Следовательно, [Ag+] = 1,43× 10— 10 моль/л.
Константа нестойкости связана с изменением энергии Гиббса процесса диссоциации [Ag(NH3)2]+ уравнением:
ΔGоT = — RTln Кн .
Значит, при Т = 298 К получаем:
ΔGо298 = — 8,314× 298× ln5,7× 10— 8 = 41326 Дж = 413,3 кДж.
Задача 2. Произойдет ли осаждение AgCl при сливании 0,01М раствора [Ag(NH3)2]NO3, содержащего 2 моль/л избыточного NH3, с равным объемом 0,5М раствора KCl, если при 298 К ПР(AgCl) = 1,73× 10— 10, Кн.[Ag(NH3)2]+ = 5,7× 10— 8.
Решение. Осадок выпадет при условии: [Ag+][Сl— ] > ПР(AgCl), т.е. если произведение концентраций ионов Ag+ и Сl— в растворе будет больше ПР, то раствор окажется пересыщенным и из него будет выпадать осадок.
После смешения равных объемов растворов концентрации [Ag(NH3)2]NO3, NH3 и KCl уменьшатся в 2 раза и станут равными 5× 10-3, 1 и 0,25 М соответственно.
Найдем концентрацию [Ag+] тем же способом, что и в предыдущей задаче,
откуда x = 2,85× 10— 10.
Значит, [Ag+] = 2,85× 10— 10 моль/л, а [Сl— ] = 0,25 моль/л.
Следовательно, произведение концентраций ионов равно:
[Ag+][Сl— ] = 2,85× 10— 10× 0,25 = 7,1× 10— 11(моль/л)2.
Поскольку [Ag+][Сl— ] = 7,1× 10— 11 < 1,73× 10— 10, то осадок не выпадет.
Задача 3. При какой концентрации ионов S2- начнется выпадение осадка CdS из 0,6М раствора Na2[Cd(CN)4], содержащего 0,04 моль/л избыточного NaCN, если ПР(CdS) = 7,9× 10— 27, Кн[Cd(CN)4]2- = 7,8× 10— 18.
Решение. Осадок выпадет при условии: [Cd2+][S2- ] > ПР(CdS), т.е. если произведение концентраций ионов Cd2+ и S2- в растворе будет больше ПР. Следовательно, выпадение осадка начнется при [S2-] > ПР(CdS):[Cd2+].
Na2[Cd(CN)4] = [Cd(CN)4]2- + 2Na+
Комплексный ион диссоциирует незначительно:
[Cd(CN)4]2- → Cd2+ + 4CN—
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Cd2+ и 4x моль/л ионов CN— . Суммарная концентрация ионов CN— равна (4x + 0,04) моль/л. Концентрация недиссоциированного комплексного иона [Cd(CN)4]2- составляет: (0,6 – x) моль/л.
Кн[Cd(CN)4]2- = [Cd2+ ] · [CN—]4/ [[Cd(CN)4]2-]
x = 1,8·10— 12 .
Следовательно, [Cd2+] = 1,8·10— 12 моль/л.
Выпадение осадка начнется при [S2- ] > 7,9·10— 27: 1,8·10— 12 > 4,39·10— 15 моль/л.
Задачи для самостоятельного решения
1. Назовите следующие комплексные соединения:
Na2[Pt(CN)4Cl2],
[Cu(NH3)4](NO3)2,
[Cu(H2O)4]SO4
|
Na2[Pt(CN)4Cl2] – дихлоротетрацианоплатинат (IV) натрия; [Cu(NH3)4](NO3)2 – нитрат тетраамминмеди (II); [Cu(H2O)4]SO4 – сульфат тетрааквамеди (II); |
2. Назовите следующие комплексные соединения
[Co(H2O)3Cl3],
[Ni(NH3)6][PtCl4].
|
[Co(H2O)3Cl3] – трихлоротриаквакобальт (III); [Ni(NH3)6][PtCl4] – тетрахлороплатинат (II) гексаамминникеля (II). |
3. Составьте уравнение химической реакции:
Cr2(SO4)3 + NaOH (изб.)→
4. Составьте уравнение химической реакции:
Cd(NO3)2 + Na2SO3 (изб.)→
5. Составьте уравнение химической реакции:
[Ag(NH3)2]NO3 + Na2S →
6. Составьте уравнение химической реакции:
[Ag(NH3)2]NO3 -t→
7. Составьте уравнение химической реакции:
K4[Fe(CN)6] + Н2O2 + H2SO4 →
8. Сколько граммов серебра содержится в виде ионов в 0,04М растворе K[Ag(CN)2], содержащем в избытке 1,3 г KCN в 1 л раствора. Константа нестойкости иона [Ag(CN)2] — равна 1,4·10— 20.
9. Произойдет ли осаждение сульфида ртути, если к 1 л 0,3 М раствора K2[HgI4], содержащему избыточных 0,01 моль KI, добавить 1·10— 4 моль K2S? ПР(HgS) = 1,6·10— 52, Кн [HgI4]2- = 1,5·10— 31.
10. При какой концентрации ионов Cl— начнется выпадение осадка AgCl из 0,6М раствора [Ag(NH3)2]NO3, содержащего 1,2 моль/л избыточного аммиака, если ПР(AgCl) = 1,73·10—10, Кн [Ag(NH3)2]+ = 5,7·10— 8.
Как определить координационное число
Координационное число характеризует, со сколькими частицами связан тот, или иной атом (ион) в молекуле вещества. Само понятие «координационное число» возникло по мере развития раздела химии, изучающего комплексные соединения, многие из которых имеют весьма сложный состав. Потребовался показатель, четко указывающий, какое именно количество частиц входят во внутреннюю («координационную») сферу комплексного вещества. Как определить координационное число?

Инструкция
Прежде всего, составьте точную формулу вещества. Например, возьмите хорошо известную из курса школьной химии желтую кровяную соль. Ее формула К3[Fe(CN)6]. Каково координационное число иона железа в этом соединении? Из формулы легко можно понять, что в первую очередь железо связано с циан-ионами СN-, следовательно, его координационное число равно 6.
Понятие «координационное число» используется не только в химии комплексных соединений, но и в кристаллографии. Давайте рассмотрим еще более знакомую вам поваренную моль – хлористый натрий. Его формула NaCl. Казалось бы, проще некуда – координационное число и натрия, и хлора равно 1. Но не торопитесь с выводами.
Вспомните: ведь в обычном, твердом состоянии хлористый натрий имеет кубическую кристаллическую решетку. В ее узлах попеременно чередуются ионы хлора и натрия, связанные с «соседями». А сколько таких «соседей» у каждого иона? Нетрудно подсчитать, что их 6. (Четыре по «горизонтали», два по «вертикали»). Вот и получается: координационное число и у натрия, и у хлора в этом веществе равно 6.
А как быть, к примеру, с самым известным драгоценным камнем – алмазом? Какое координационное число имеет углерод, входящий в его состав? Вспомните, что алмаз представляет собой углеродную кристаллическую решетку так называемой «тетрагональной» формы. Каждый атом углерода связан в ней с четырьмя другим атомами, следовательно, координационное число равно 4.
Где еще применяется понятие «координационного числа»? Его можно использовать при описании химических свойств жидких и аморфных веществ, в тех случаях, когда фактическое количество химических связей центрального атома не совпадет с его валентностью. Рассмотрите, например, широко применяемое соединение – азотную кислоту. Ее эмпирическая формула HNO3, и из нее следует, что валентность азота явно больше 3.
Написав же структурную формулу, вы увидите, что атом азота связан только с тремя кислородными атомами, следовательно, его координационное число равно 3.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
ИЗ ОПЫТА РАБОТЫ
Для самых смелых
Комплексные соединения
Материал данной статьи
может быть с успехом использован при проведении
уроков как по обычной программе в 10–11-х классах
(повторение и обобщение знаний по неорганической
химии, амфотерность), так и по программе с
углубленным изучением химии для отдельного
тематического занятия.
Все познается в сравнении.
Приступая к изучению вопроса о комплексных
соединениях, вспомним строение атома азота и
молекулы аммиака.
Азот имеет на внешнем электронном слое пять
электронов – одну пару и три неспаренных (рис. 1).
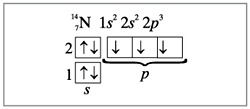 |
Рис. 1.
|
Аммиак: азот затрачивает эти три
неспаренных электрона на образование
ковалентных связей с атомами водорода –
образует с водородом три общие электронные пары.
Собственную неподеленную пару электронов азот
использует на образование донорно-акцепторной
связи, например, с протоном (рис. 2).
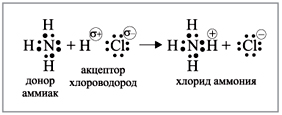 |
Рис. 2.
|
Соединения, образование которых не
связано с возникновением новых электронных пар
(общая электронная пара образовалась за счет
собственной электронной пары одного из
партнеров), называются комплексными.
Создатель теории комплексных соединений, она
называется еще координационной теорией, –
шведский ученый Альфред Вернер. В начале
прошлого столетия наибольший прогресс в этой
области химии достигнут в нашей стране благодаря
Льву Александровичу Чугаеву, который создал
уникальную школу химиков-комплексников.
Рассмотрим комплексное соединение на
конкретном примере: если, получив гидроксид меди,
добавить к осадку раствор аммиака в воде, то
осадок исчезнет, а раствор станет прозрачным и
темно-синим. Это образовалось комплексное
соединение. Запишем уравнения реакций:
Состав комплексного соединения (КС) [Cu(NH3)4](OH)2:
внешняя сфера – два иона ОН–;
внутренняя сфера – ион [Cu(NH3)4]2+;
комплексообразователь (центральный ион,
координатор) – Cu2+;
координационное число (КЧ) (число молекул или
ионов, соединенных непосредственно с
атомом-комплексообразователем) – 4;
лиганды (молекулы или ионы, расположенные около
комплексообразователя) – (NH3).
При написании формул комплексных солей
комплекс заключается в квадратные скобки.
Комплексы могут выполнять роль катионов, анионов
или быть нейтральными молекулами, например:
[Cu(NH3)4]2+ – катион;
[Fe(CN)6]4– – анион;
[Pt(NH3)2Cl4] – нейтральная
молекула.
Заряд комплексного иона равен сумме зарядов
комплексообразователя и лигандов.
Алгебраическая сумма зарядов внутренней и
внешней сферы равна нулю, например, в соединении
Na2[Zn(CN)4]: два иона 2Na+ – внешняя
сфера, ион [Zn(CN)4]2– – внутренняя
сфера, ее заряд складывается из двух
положительных зарядов иона Zn2+ и четырех
отрицательных зарядов четырех ионов CN–,
что в сумме дает минус два.
Образование внутренней сферы комплексов
происходит по донорно-акцепторному механизму.
Комплексообразователь – акцептор,
предоставляющий свободные орбитали. Лиганды –
доноры, предоставляющие свободные пары
электронов. Роль комплексообразователя обычно
выполняют положительно заряженные ионы, имеющие
небольшую величину ионного радиуса. Чаще всего
это катионы d-элементов, хотя известны и
комплексные соединения катионов s-, p- и f-элементов*.
Лигандами, как правило, являются ионы (анионы), к
названию которых прибавляется гласная «о»,
например: ионы F– – фторо, Cl– –
хлоро, I– – йодо, CN– – циано, OH–
– гидроксо, CNS– – роданидо; и нейтральные
молекулы: Н2O – аква, NH3 – амин и др.
Координационное число зависит от радиуса атома
комплексообразователя и его заряда (таблица).
Чем больше радиус комплексообразователя, тем
большее число лигандов может соединиться с ним.
Самостоятельная работа
Составьте комплексные соединения, обозначьте
составные части, заряды ионов.
2AgNO3
…………………….. .
(Ответ. Ag+[Ag+(NO3)2]–.)
Pt+4Cl4•2KCl (КЧ Pt = 6) …………………. . .
(Ответ. [Pt 4+(Cl–)6]2–.)
Таблица
Наиболее частые и возможные (в
скобках) координационные числа
в зависимости от заряда центрального иона
| Примеры соединений |
Заряд комплексообразователя |
КЧ (четное) |
| Na[Au(CN)2] | +1 | 2 |
| [Cu(NH3)4]SO4 | +2 | 4(6) |
| K3[Fe(CN)6] | +3 | 6(4) |
| K4[Mо(CN)8]?2H2O | +4 | 8(6) |
Названия комплексных
соединений
Формула комплексного соединения читается
справа налево. Сначала называется анион (если он
есть): Cl– – хлорид, ОН– – гидроксид,
SO4 – сульфат и т.д. Название комплексного
катиона записывают в одно слово, число лигандов
указывают греческими числительными: 1 – моно, 2
– ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса.
Отрицательные лиганды (анионы) внутренней сферы
в названии приобретают суффикс «о» (см. выше),
затем перечисляют нейтральные лиганды, называют
центральный атом и римской цифрой обозначают его
степень окисления.
В комплексных анионах добавляется суффикс «ат»
к названию комплексообразователя. После
обозначения состава внутренней сферы называют
внешнесферные катионы (если такие имеются).
Cамостоятельная работа
Дайте названия в каждом конкретном примере.
[Al(H2O) 6]Cl3.
(Ответ. Хлорид гексаакваалюминия.)
K2[Pt(Cl)6].
(Ответ. Гексахлороплатинат(IV) калия.)
Na2[Zn(OH)4].
(Ответ. Тетрагидроксоцинкат натрия.)
[Cu(NH3)4](OH).
(Ответ. Гидроксид тетраамминмеди(II).)
NH4Cl.
(Ответ. Хлорид аммония.)
[Ag(NH3)2]Cl.
(Ответ. Хлорид диамминсеребра(I).)
K4[Мо(CN)8]•2H2O.
(Ответ. Дигидрат
октацианомолибдата(IV) калия.)
Свойства комплексных соединений
Свойства КС определяются их составом и
строением. В воде они диссоциируют на внешнюю
сферу и комплексный ион:
K3[Fe(CN)6] 3K+ + [Fe(CN)6]–3.
Важнейшим свойством комплексов в растворах
является их устойчивость. Количественно она
характеризуется константой устойчивости.
Внутренняя сфера комплекса в незначительной
степени подвергается электролитической
диссоциации, распадаясь на
комплексообразователь и лиганды, например:
[Fe(CN)6]3– Fe3+ + 6CN–.
Отношение концентрации недиссоциированного
комплекса к произведению концентраций
комплексообразователя и лигандов называется
константой устойчивости, а обратная ей величина
– константой нестойкости:
Чем больше константа устойчивости и чем меньше
константа нестойкости, тем прочнее комплекс.
Комплексные соли могут вступать в реакции
обмена и в реакции замещения, например:
2CuSO4 + K4[Fe(CN)6] = Cu2[Fe(CN)6] + 2K2SO4,
Zn + 2Na[Au(CN)2] = Na2[Zn(CN)4] + 2Au,
а также в окислительно-восстановительные
реакции:
Таким образом, комплексные соли в растворах
ведут себя так же, как и соли простые.
Объяснение амфотерности гидроксидов
с точки зрения химии комплексных соединений
Согласно протолитической теории амфотерные
соединения способны быть как донорами, так и
акцепторами протона. Типичным примером
амфотерного соединения может служить вода:
Н2О + Н2О Н3О+ + ОН–.
Из гидроксидов наиболее ярко выражены
амфотерные свойства у гидроксида галлия Ga(OH)3,
для которого константы диссоциации в водном
растворе по кислотному и основному типу почти
равны.
Преобладание кислотных или осно’вных свойств у
гидроксидов различных элементов связано с
положением элемента в периодической системе.
Ослабление осно’вных и усиление кислотных
свойств гидроксидов R(OH)n наблюдается с
увеличением поляризующего действия иона Rn+,
т.е.
с уменьшением его радиуса и возрастанием заряда.
Поэтому к сильным основаниям относят гидроксиды
щелочных и щелочно-земельных металлов.
Амфотерные гидроксиды образуют во II группе
периодической системы бериллий и цинк – элемент
II группы, но побочной подгруппы, а в III группе –
алюминий, галлий и индий.
Исследование влияния концентрации ионов Н+
в растворе на свойства различных гидроксидов
показало, что амфотерность обусловлена
устойчивостью гидроксокомплекса данного
металла. Приведем пример – гидроксид цинка
растворяется в кислотах и щелочах:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O,
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4],
или в ионной форме:
Zn(OH)2 + 2H+ = Zn2+ + 2H2O,
Zn(OH)2 + 2ОH– = [Zn(OH)4]2–.
В водном растворе свободные ионы не могут
существовать, они находятся в виде гидратов.
Энергия гидратации велика, и при этом образуются
аквакомплексы постоянного состава. Число
молекул воды обычно равно координационному
числу. Аквакомплексы ведут себя как кислоты.
Например, в водном растворе какой-либо соли цинка
его аквакомплекс диссоциирует:
[Zn(Н2О)4]2+ [Zn(Н2О)3ОН]+ + Н+.
В ряду аква-, аквагидроксо- и гидрокомплексов
цинка (цинк проявляет координационное число 4, а
лигандами являются молекулы воды или ионы ОН–):
[Zn(Н2О)4]2+ [Zn(Н2О)3ОН]+
[Zn(Н2О)2(ОН)2]
L [Zn(Н2О)(ОН)3]–
[Zn(OH)4]2–
каждый последующий член ряда по составу
отличается от предыдущего на один протон. При
переходе каждого предыдущего члена в
последующий первый ведет себя как кислота.
Обратный переход связан с притяжением протона, а
следовательно, с проявлением соединением
основных свойств. Равновесие взаимоперехода
одних комплексов в другие в указанном ряду
смещено вправо в щелочной среде и влево – в
кислой.
Рассмотрим образование аналогичных комплексов
у алюминия. При растворении алюминия в кислоте (в
сильнокислой среде) получается катион в виде
аквакомплекса:
2Al + 6Н+ + 6Н2О = 2[Аl(Н2О)6]3+
+ 3Н2,
При постепенном прибавлении раствора щелочи
происходит замена молекул воды в комплексе на
гидроксильные группы (переход от аквакомплексов
к гидроксокомплексам):
[Al(Н2О)6]3+ + ОН– =
[Al(Н2О)5ОН]2+ + Н2О,
[Al(Н2О)5ОН]2+ + ОН–
= [Al(Н2О)4(ОН)2]+ + Н2О,
[Al(Н2О)4(ОН)2]+ + ОН–
= [Al(Н2О)3(ОН)3] + Н2О.
Нейтральный гидроксид не растворяется в воде и
выпадает в осадок.
При дальнейшем прибавлении раствора щелочи
снова образуются ионы, но уже не катионы, а
анионы, и осадок растворяется:
[Al(Н2О)3(ОН)3] + ОН– =
[Al(Н2О)2(ОН)4]– + Н2О,
[Al(Н2О)2(ОН)4]– +
ОН– = А1[(Н2О)(ОН)5]2– + Н2О,
[Al(Н2О)(ОН)5]2– + ОН–
= [Al(ОН)6]3– + Н2О.
Таким образом, амфотерность трехвалентного
алюминия проявляется в возможности его
существования в водном растворе как в составе
катионов, так и анионов. Состав этих ионов
зависит от кислотности среды. В школьном курсе
химии принято для аниона использовать формулу
[Al(ОН)4]–, где координационное число
алюминия не 6, а 4.
Получение комплексных солей
Комплексные соли получаются в результате
реакций соединения, обмена,
окислительно-восстановительных реакций, а также
при электролизе.
Например:
HgI2 + 2KI (изб.) = K2[HgI4],
CuSO4 + 4NH4OH = [Cu(NH3)4]SO4
+ 4H2O,
ZnCl2 + 4NaOH (изб.) = Na2[Zn(OH)4]
+ 2NaCl.
Применение комплексных соединений
• Гальванические покрытия – защита одного
металла другим. Например, медное покрытие крепко
соединяется с железом, если использовать в
процессе комплексные соединения.
• Электролитическое получение металлов.
Например, алюминий в расплаве криолита образует
комплекс Nа3[AlF6]. Из расплавов
соединений комплексных солей получают такие
металлы, как Nb, Tl, Th, Mg.
• Защита металлов от коррозии. Ингибиторы –
комплексные соли, где лигандами выступают и
органические вещества.
• Аналитическая химия. Многие индикаторы,
реактивы, которые помогают распознать вещества,
ионы и даже заряды ионов, – комплексные
соединения. Катион Fe2+ можно распознать в
реакции с гексацианоферратом(III) калия:
Образуется синий осадок (турнбулева синь).
Катион Fe3+ можно распознать
гексацианоферратом(II) калия:
Образуется темно-синий осадок (берлинская
лазурь).
• Получение металлов. Например золота: золотой
песок растворяется в растворе цианида натрия (NaCN)
в присутствии кислорода и воды, потому что
образуется очень устойчивое комплексное
соединение золота:
4Au + O2 + 2H2O + 8NaCN = 4Na[Au(CN)2]
+ 4NaOH.
Из полученного комплекса золото вытесняют
цинком:
Zn + 2Na[Au(CN)2] = Na2[Zn(CN)4] + 2Au.
Важнейшие органические соединения –
гемоглобин и хлорофилл – тоже соединения
комплексные (схему строения данных соединений
можно посмотреть в книге Л.А.Николаева «Металлы в
живых организмах» и др.) (рис. 3).
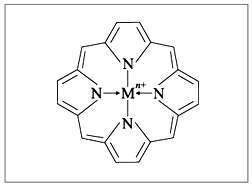 |
Рис. 3.
|
Синтез многих лекарственных
препаратов, витаминов, биодобавок и многих
других веществ связан с комплексными
соединениями.
Л и т е р а т у р а
Гузей Л.С., Суровцева Р.П. Учебник. Химия. 10
класс. М.: Дрофа, 2002; Николаев Л.А. Металлы в
живых организмах. М.: Просвещение, 1983; Глинка Н.Л.
Общая химия. Л.: Химия, Ленингр. отд-ние, 1987; Хомченко
Г.П. Неорганическая химия. М.: Высшая школа, 1978;
Гликина Ф.Б., Ключников Н.Г. Химия комплексных
соединений. М.: Просвещение, 1982; Кукушкин Ю.Н.
Соединения высшего порядка. Л.: Химия. Ленингр.
отд-ние, 1991.
* В химии очень много
исключений. Вот и в комплексных соединениях есть
исключение – ион аммония, в котором
«координатором» является отрицательно
заряженный атом азота. Кроме того, существует еще
целая интересная группа соединений – карбонилы
металлов, в которых и комплексообразователь, и
лиганды (молекулы СО) не заряжены. Например,
карбонил железа
[Fe0(CO)5]0. – Прим. ред.