Кристаллическую решетку характеризуют следующие основные параметры:
· период решетки;
· атомный радиус;
· энергия решетки;
· координационное число;
· базис и коэффициент компактности решетки.
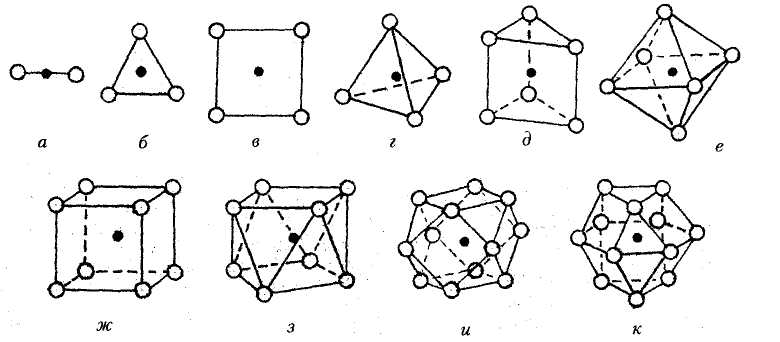
Периодом решетки называется расстояние между центрами двух соседних частиц (атомов, ионов) в элементарной ячейке решетки (см. рис. 1.2, а, b). Периоды решетки выражаются в ангстремах (1 = 10-8 см). Параметры решетки металлов находятся в пределах 0,2 – 0,7 нм и определяются методом рентгеноструктурного анализа с точностью до третьего, а при необходимости и до четвертого или даже пятого знака после запятой.
Под атомным радиусом понимают половину межатомного расстояния между центрами ближайших атомов в кристаллической решетке элемента при нормальной температуре и атмосферном давлении. Однако атомный радиус не является постоянной величиной, а изменяется в зависимости от ряда факторов, важнейшими из которых являются координационное число и тип химической связи между атомами в кристалле.
Энергия кристаллической решетки определяется как энергия, выделяющаяся при образовании кристалла из ионов, атомов или других частиц, образующих кристалл, когда исходное состояние этих частиц газообразное. От величины энергии решетки зависят такие свойства вещества, как температура плавления, модуль упругости, прочность, твердость и др. Увеличение валентности атомов приводит к увеличению энергии решетки.
Координационное число (К), показывает количество атомов, находящихся на наиболее близком и равном расстоянии от любого выбранного атома в решетке.
Базисом решетки называется количество атомов, приходящихся на одну элементарную ячейку решетки.
Коэффициент компактности (?) решетки определяется отношением объема, занимаемого атомами (Va), ко всему объему решетки (Vp), т.е.
? = Va/Vp. Представленные на рис. 1.2 (сверху) типы кристаллических решеток схематично отражают взаимное расположение атомов (ионов) в кристалле. Если условно считать атомы шарами одинакового диаметра, то снизу на рис. 1.2 дано более точное представление о действительном расположении атомов в кристаллах ОЦК, ГЦК и ГПУ
Пример: Гранецентрированная кубическая решетка (рис. 1.2, б) имеет восемь атомов по вершинам и по одному атому в центре граней куба. Определим для нее такие понятия, как «координационное число» и «базис» решетки.
Оперируя с элементарной ячейкой, нельзя забывать, что в реальном кристалле такая ячейка окружена со всех сторон другими ячейками и поэтому не все атомы, отно
сящиеся к рассматриваемой ячейке, принадлежат только этой ячейке. Для того чтобы это понять, рекомендуется изобразить на клетчатой бумаге элементарную ячейку и пристроить к ней со всех сторон другие ячейки. Важность такого построения выявляется при решении конкретных задач.
Из рис. 1.2, б видно, что минимальное расстояние между атомами в решетке ГЦК равно половине диагонали грани. Пристроив около какой-либо вершины куба другие примыкающие к ней ячейки, подсчитаем координационное число: к любой вершине куба реально пристроены 8 элементарных ячеек; в каждой ячейке на расстоянии η диагонали грани находится три атома; каждая грань обслуживает две ячейки, поэтому
К = (3 · 8)/2 = 12.
Зная
модель кристаллической структуры, т.
е. пространственное расположение
атомов относительно элементов симметрии
в элементарной ячейке — их координаты,
а, следовательно, и характеристики
правильных систем точек, которые занимают
атомы, можно сделать ряд кристаллохимических
выводов, используя достаточно простые
приемы описания структур. Поскольку
14 выведенных решеток Браве не могут
отразить все многообразие известных к
настоящему времени кристаллических
структур, необходимы характеристики,
позволяющие однозначно описать
индивидуальные особенности каждой
кристаллической структуры. К таким
характеристикам, дающим представление
о геометрическом характере структуры,
относятся: координационные
числа (КЧ),
координационные
многогранники (КМ),
или полиэдры
(КП),
и число
формульных единиц (Z).
Прежде всего по модели можно решить
вопрос о типе
химической формулы рассматриваемого
соединения, т. е. установить количественное
соотношение атомов в структуре. Это
нетрудно сделать на основе анализа
взаимного окружения — взаимной
координации — атомов разных (или
одинаковых) элементов.
Термин
«координация атома» был введен в химии
в конце XIX
в. в процессе формирования ее новой
области — химии координационных
(комплексных) соединений. И уже в 1893 г.
А.
Вернер ввел
понятие координационное
число (КЧ)
как число атомов (лигандов — ионы,
непосредственно связанные с центральными
атомами (катионами)), непосредственно
связанных с центральным. Химики в свое
время столкнулись с тем фактом, что
число связей, образуемых атомом, может
отличаться от его формальной валентности
и даже превышать ее. Например, в ионном
соединении NaCl
каждый ион окружен шестью ионами
противоположного заряда (KЧNa/Cl
= 6, KЧCl/Na
= 6), хотя формальная валентность атомов
Na
и С1 равна 1. Таким образом, согласно
современному представлению, КЧ — это
число ближайших к данному атому (иону)
соседних атомов (ионов) в структуре
кристалла независимо от того, являются
они атомами того же сорта, что и
центральный, или иного. При
этом межатомные расстояния являются
основным критерием, используемым при
подсчете КЧ.
Например,
в кубических структурах модификации
a-Fe
(рис. 7.2.а) и CsCl
(рис. 7.2. в) координационные числа всех
атомов равны 8: в структуре a-Fe
атомы Fe
располагаются в узлах объемноцентрированного
куба, отсюда KЧFe=
8; в структуре CsCl
в вершинах элементарной ячейки
располагаются ионы Сl—
, а в центре объема — ион Cs+,
координационное число которого тоже
равно 8 (КЧ Cs/Cl
= 8), так же как и каждый ион Cl
окружен восемью ионами Cs+
по кубу (КЧ Cl/Cs
= 8). Это подтверждает отношение Cs
: С1 = 1: 1 в структуре этого
соединения.
|
|
||
|
а |
б |
в |
|
Рис. |
В
структуре α
–Fe
координационное число атома Fe
по первой координационной сфере равно
8, с учетом второй сферы — 14 (8 + 6).
Координационные полиэдры — соответственно
куб и ромбододекаэдр.
Координационные
числа и координационные многогранники
являются
важнейшими характеристиками конкретной
кристаллической структуры,
отличающими ее от остальных структур.
На этой основе можно
проводить классификацию, относя
конкретную кристаллическую структуру
к определенному структурному типу.
Установить
тип химической формулы по структурным
данным (т. е. по
модели структуры или по ее проекции —
чертежу) можно и иным путем,
подсчитав число атомов каждого сорта
(химического элемента), приходящихся
на одну элементарную ячейку. Это
подтверждает тип химической формулы
NaCl.
|
|
|
Рис. |
В
структуре NаС1 (рис. 7.4), типичной для
ионных кристаллов типа АВ (где А—атомы
(ионы) одного сорта, В—другого), в
построении элементарной ячейки принимают
участие 27 атомов обоих сортов, из них
14 атомов А (шары большого размера) и 13
атомов В (меньшие шары), но полностью
входит в ячейку лишь один. атом, находящийся
в ее центре. Атом, находящийся в центре
грани элементарной ячейки, принадлежит
одновременно двум ячейкам—данной и
смежной с ней. Поэтому данной ячейке
принадлежит лишь половина этого атома.
В каждой из вершин ячейки сходится
одновременно по 8 ячеек, поэтому данной
ячейке принадлежит лишь 1/8 атома,
расположенного в вершине. От каждого
атома, находящегося на ребре ячейки, ей
принадлежит лишь 1/4.
Вычислим общее
число атомов, приходящихся на одну
элементарную ячейку NаС1:
|
Положение атома |
Объем |
Число атомов |
Всего |
|
В вершине В середине ребра В центре грани В центре ячейки |
1/8 1/4 1/2 1 |
8 12 6 1 |
1 3 3 1 |
Итак,
на долю ячейки, показанной на рис. 7.4,
приходится не 27 атомов, а всего 8 атомов:
4 атома натрия и 4 атома хлора.
|
|
|
— — Na |
|
Рис.7.4 |
Определение
числа атомов в ячейке Браве позволяет
кроме типа химической формулы получить
еще одну полезную константу — число
формульных единиц, обозначаемое
буквой Z.
Для простых веществ, состоящих из атомов
одного элемента (Сu,
Fe,
Se
и др.), число формульных единиц соответствует
числу атомов в элементарной ячейке. Для
простых молекулярных веществ (I2,
S8
и т. д.) и молекулярных соединений (СО2)
число Z
paвно
числу молекул в ячейке. В подавляющем
же большинстве неорганических и
интерметаллических соединений (NaCl,
CaF2,
СuАu
и т. д.) молекул нет, и в этом случае вместо
термина «количество молекул» используют
термин «число формульных единиц».
Число
формульных единиц можно определить
экспериментально в процессе рентгеновского
исследования вещества.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Перейти к содержанию
Определение координационного числа в химии
На чтение 3 мин. Просмотров 787 Опубликовано 27.05.2021
Координационное число атома в молекуле – это количество атомов, связанных с этим атомом. В химии и кристаллографии координационное число описывает количество соседних атомов по отношению к центральному атому. Этот термин был первоначально определен в 1893 году швейцарским химиком Альфредом Вернером (1866–1919). Значение координационного числа для кристаллов и молекул определяется по-разному. Координационное число может варьироваться от 2 до 16. Значение зависит от относительных размеров центрального атома и лигандов, а также от заряда электронной конфигурации иона.
Координационное число атома в молекуле или многоатомном ионе определяется путем подсчета количества связанных с ним атомов (примечание: не путем подсчета количества химические связи).
В твердотельных кристаллах определить химическую связь сложнее, поэтому координационное число в кристаллах определяется путем подсчета числа соседних атомов . Чаще всего для определения координационного числа используется атом внутри решетки с соседями, простирающимися во всех направлениях. Однако в определенных контекстах важны поверхности кристаллов (например, гетерогенный катализ и материаловедение), где координационное число для внутреннего атома – это координационное число в объеме , а значение для поверхностного атома – это координационное число поверхности .
В координационных комплексах учитывается только первая (сигма) связь между центральным атомом и лигандами. Связи Pi с лигандами не включаются в расчет.
Содержание
- Примеры координационных чисел
- Расчет координационного числа
- Геометрия координационного числа
Примеры координационных чисел
- Углерод имеет координационное число 4 в молекуле метана (CH 4 ), поскольку с ней связано четыре атома водорода.
- В этилене (H 2 C = CH 2 ), координационное число каждого углерода равно 3, где каждый C связан с 2H + 1C, всего 3 атома.
- Координационное число алмаза равно 4, поскольку каждый атом углерода находится в центре правильного тетраэдра, образованного четырьмя атомами углерода.
Расчет координационного числа
Вот шаги для определения координационного числа координационного соединения.
- Определите центральный атом в химической формуле. Обычно это переходный металл.
- Найдите ближайший к центральному атому металла атом, молекулу или ион. Для этого найдите молекулу или ион непосредственно рядом с символом металла в химической формуле координационного соединения. Если центральный атом находится в середине формулы, с обеих сторон будут соседние атомы/молекулы/ионы.
- Сложите количество атомов ближайшего атома/молекулы/ионов. Центральный атом может быть связан только с одним другим элементом, но вам все равно нужно указать количество атомов этого элемента в формуле.. Если центральный атом находится в середине формулы, вам нужно сложить атомы во всей молекуле.
- Найдите общее количество ближайших атомов. Если металл имеет два связанных атома, сложите оба числа,
Геометрия координационного числа
Есть несколько возможные геометрические конфигурации для большинства координационных чисел.
- Координационное число 2 – линейный
- Координационное число 3 – тригональная плоская (например, CO 3 2- ), тригональная пирамида, T -образный
- Координационное число 4 – тетраэдрический, квадратный плоский
- Координационное число 5 – квадратная пирамида (например, соли оксованадия, ванадил VO 2+ ), тригональная бипирамида,
- Координационное число 6 – гексагональная плоская , тригональная призма, октаэдр
- Координационное число 7 – октаэдр с вершиной, тригональная призма с вершиной, пятиугольная бипирамида.
- Координационное число 8 – додекаэдр, куб, квадратная антипризма, гексагональная бипирамида.
- Координационное число ber 9 – трехгранная тригональная призма с центром в центре.
- Координационное число 10 – квадратная антипризма с перемычкой.
- Координационное число 11 – тригональная призма с закрытой головкой.
- Координационное число 12 – кубооктаэдр (например, нитрат цериевого аммония – (NH 4 ) 2 Ce (NO 3 ) 6 )
Certain kinds of atoms form regular three-dimensional repeating structures when they bond with other elements. These repeating patterns are called crystal lattices, and they are characteristic of ionic solids, or compounds that contain ionic bonds, such as table salt (much more below).
These crystals have tiny repeating sections that boast cations, or positively charged atoms, at their center. This central atom is geometrically associated with a certain number of anions via one of a number of familiar patterns. Each anion in turn can be envisioned as sitting at the center of its own repeating unit and associating with a certain number of cations, which may be the same number or a different number as in the cation-at-center example.
This number, called the coordination number or ligancy, applies to ions rather than «native» atoms and determines the greater three-dimensional shape of the solid in predictable ways that relate to fundamental atomic architecture. It also determines the color owing to specific and unique distances between electrons and other components of the crystal lattice.
Determining the Coordination Number
If you happen to have access to three-dimensional models of common crystal lattice patters, you can visually inspect one «unit» from the perspective of both the anion and the cation and see how many «arms» reach out to the ion of opposite charge. In most cases, however, you will have to rely on a combination of online research and using molecular formulas.
Example: The formula for the ionic compound sodium chloride, or table salt, is NaCl. This means that every cation should have exactly one anion associated with it; in the language of ligancy, this means that the cation Na+ and the anion Cl− have the same coordination number.
Upon inspection, the structure of NaCl shows each Na+ ion having a Cl− neighbor above and below, to the left and to the right, and ahead and behind. The same is true from the Cl− perspective. The coordination number for both ions is 6.
Coordination Number of a Heavier Ion
Cations and anions present a 1:1 molecular ratio in a crystal, which means that they have the same coordination number, but this does not mean that the number is fixed at 6. The number 6 is a convenient number in three-dimensional space because of the up-down-right-left-forward-backward symmetry. But what if these «connections» were oriented diagonally, as if pointing away from the center of a cube toward all its corners?
In fact, this is how the lattice of cesium chloride, or CsCl, is arranged. Cesium and sodium have the same number of valence electrons, so in theory NaCl and CsCl might exhibit similar crystals. However, a cesium ion is far more massive than a sodium ion, and because it takes up more space, it is better accommodated with a coordination number of 8. Now, neighboring ions are found purely along diagonals; they are more distant than in NaCl, but also more numerous.
Because cesium and chlorine exist in a 1:1 ratio in this compound, the coordination number for the chloride ion in this instance is 8.
Unequal Coordination Number Example
Titanium oxide (TiO2) is an example of a crystal structure containing anions and cations in a 2:1 ratio. So, the fundamental unit of the lattice is tetrahedral: Each Ti4+ cation is amid six O2-ions, while every O2-ion has three immediate Ti4+ neighbors.
The coordination number for Ti4+ is 6, while that of the O2-ion is 3. This makes chemical sense since the formula TiO2 implies that twice as many oxygen ions exist in this compound as do titanium ions.