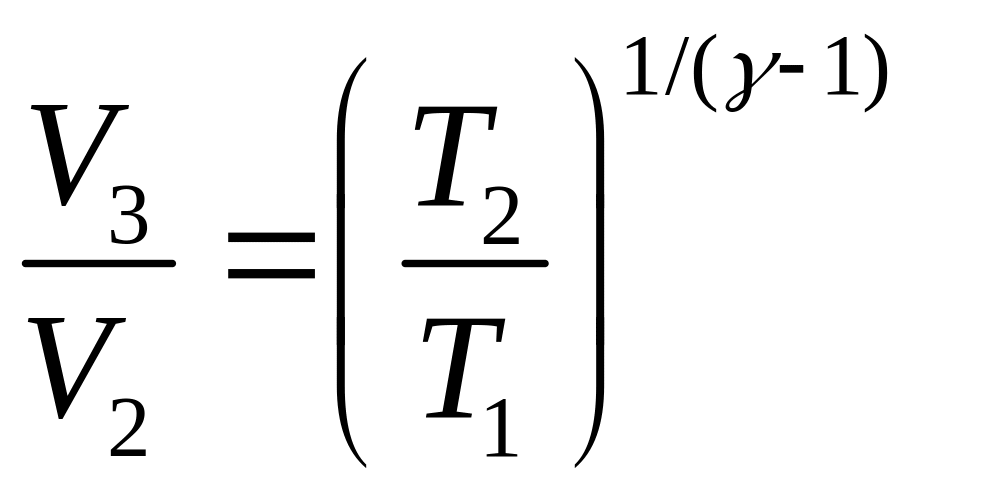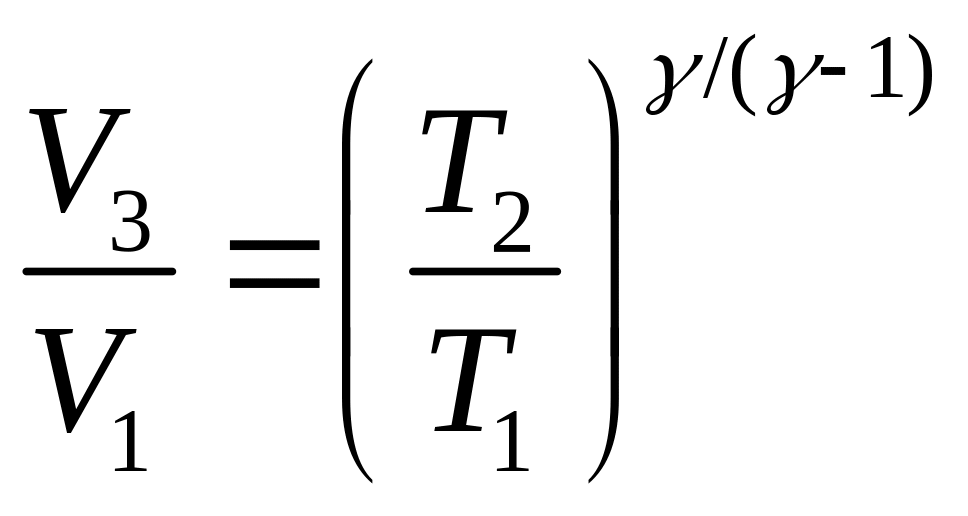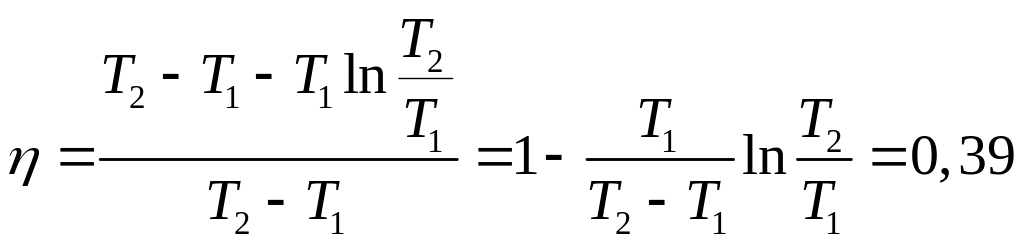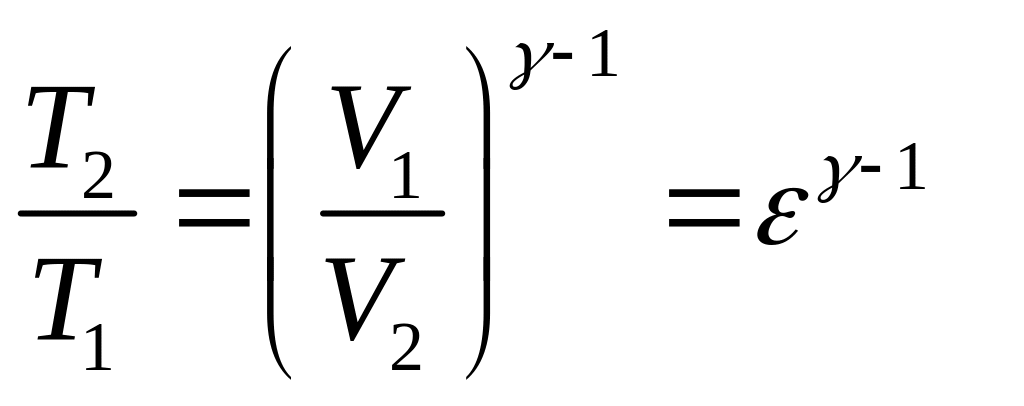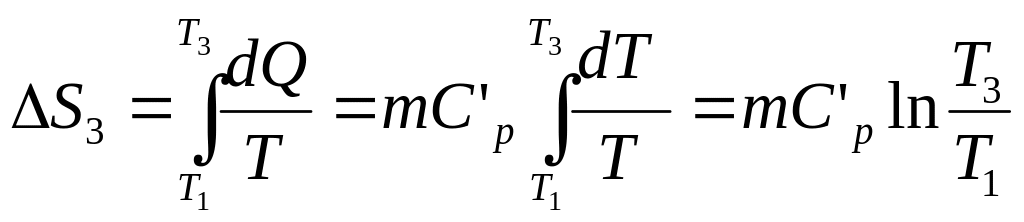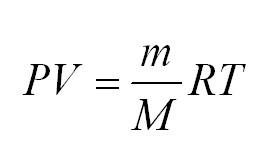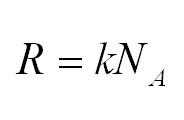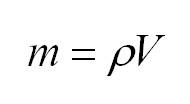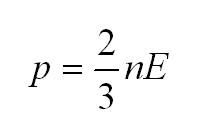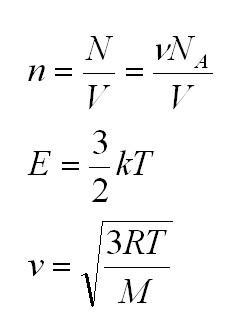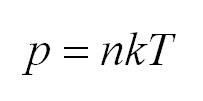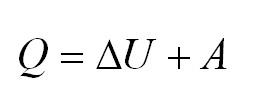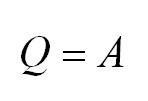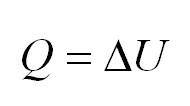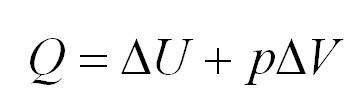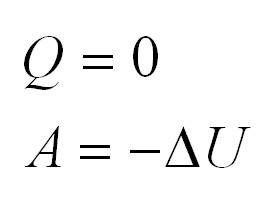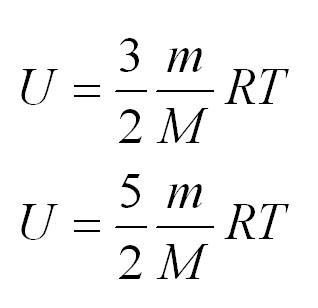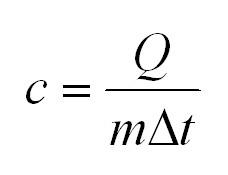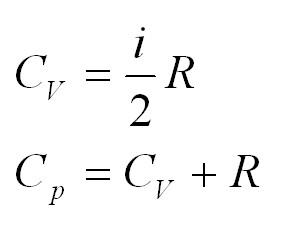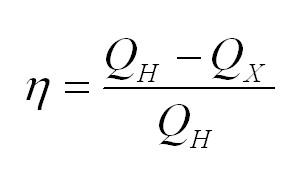Речь в статье пойдет о КПД различных циклов, проводимых с газом. При этом давайте помнить, что внутренняя энергия изменяется тогда, когда изменяется температура, а в адиабатном процессе передачи тепла не происходит, то есть для совершения работы в таком процессе газ «изыскивает внутренние резервы». Кроме того, работа численно равна площади под кривой процесса, а работа за цикл — площади внутри цикла.
Задача 1.
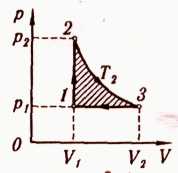
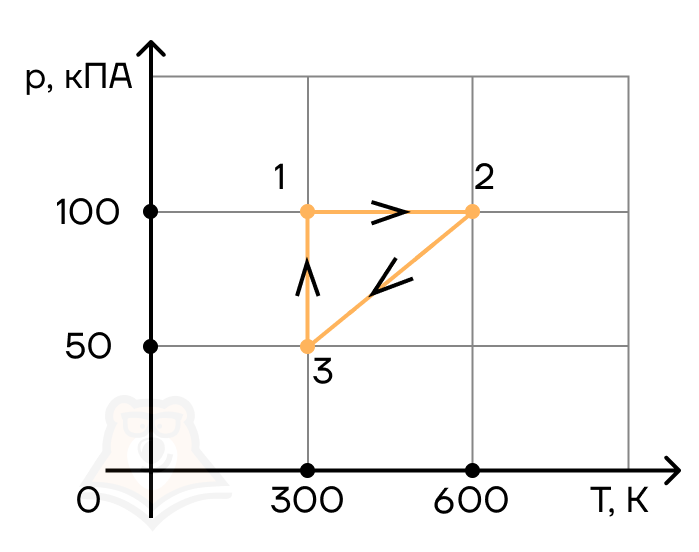
На рисунке представлена диаграмма цикла с одноатомным идеальным газом. Участки и
— адиабаты. Вычислите КПД
данной тепловой машины и максимально возможный КПД
.
К задаче 1
КПД тепловой машины можно вычислить как
Машина получает тепло только на участке AB, и, так как работы здесь не совершается, то можно вычислить количество теплоты, полученное газом, как увеличение его внутренней энергии:
Работа численно равна площади, ограниченной циклом. Поэтому
Участк и
по условию – адиабаты, то есть передачи тепла газу на этих участках не происходит, следовательно, работа будет совершена за счет «внутренних резервов» — то есть внутренней энергии. Нужно, следовательно, найти, как она изменилась.
Задачу можно решить двумя способами. Во-первых, просто определить температуры в точках и
,
и
, это легко сделать из данных графика с помощью уравнения Менделеева-Клапейрона, и затем посчитать
. Но, так как
, а
,то изменение внутренней энергии будет равно
Определим максимальный КПД. Посчитаем его как КПД цикла Карно. Максимальная температура газа будет достигнута в точке , а минимальная – в точке
:
Ответ: ,
.
Задача 2.
Над идеальным одноатомным газом проводят цикл, включающий изобару, изохору, изотерму, при этом работа газа за цикл равна кДж. В процессе изотермического сжатия (3-1) внешние силы совершают над газом положительную работу
кДж. Найдите КПД данной тепловой машины.
К задаче 2
Работа газа в процессе 1-2– площадь под линией процесса 1-2. Работа внешних сил – площадь под циклом (под линией 3-1). Поэтому полная работа за цикл – это разность работы газа и работы внешних сил, площадь, ограниченная линиями цикла. Она будет равна 5 кДж.
Работа газа в процессе 1-2, таким образом, равна 8 кДж. А поскольку процесс изобарный, то кДж. Тогда КПД
Ответ: .
Задача 3.
КПД тепловой машины, работающей по циклу, включающему изотермический (1-2) и адиабатный (3-1) процессы, равен , причем работа, совершенная 2 моль одноатомного идеального газа в изотермическом процессе
кДж. Найдите разность
максимальной и минимальной температур газа в цикле.
К задаче 3
Полная площадь под кривой процесса 1-2 равна кДж. При этом, так как КПД машины 25%, то площадь внутри цикла равна
, а под кривой 3-1 —
. В процессе 1-2 изменения внутренней энергии не было, так как температура не менялась, а в процессе 3-1 газу не передавали тепло, следовательно, работа совершена за счет внутренней энергии. Т.е.
Ответ: 500 K.
-
Примеры решения задач на расчет кпд тепловых двигатлей
Задача 2.1. Идеальный двухатомный
газ, содержащий количество вещества
,
находится под давлением
—
и занимает объем
.
Сначала газ изохорно нагревают до
температуры
.
Далее, изотермически расширяя, доводят
его до первоначального давления. После
этого путем изобарного сжатия возвращают
газ в начальное состояние. Определит
термический КПД
цикла.
|
Дано:
|
|
|
Решение
Д
Рис. 2.1
ля наглядности построим сначала
график цикла, который состоит из изохоры,
изотермы и изобары. В координатах р,V
этот цикл имеет вид, представленный на
рис. 2.1. Характерные точки цикла обозначим
1, 2, 3.
Термический
КПД любого цикла определяется
выражением
или
(1)
где
— количество теплоты, полученное газом
за цикл от нагревателя;
— количество теплоты, отданное газом за
цикл охладителю.
Разность количеств теплоты
равна работе А, совершаемой газом за
цикл. Эта работа на графике в координатах
р,V (рис.2.1) изображается площадью цикла
(площадь цикла заштрихована).
Рабочее вещество (газ) получает количество
теплоты
на двух участках:
на участке 1 — 2 (изохорный процесс) и
,
на участке 2 — 3 (изотермический процесс).
Таким образом
.
Количество теплоты, полученное газом
при изохорном процессе, равно
где
— молярная теплоемкость газа при
постоянном объеме; и
количество
вещества. Температуру
начального состояния газа, воспользовавшись
уравнением Клапейрона—Менделеева:
.
Подставив числовые значения и произведя
вычисления, получим
.
Количество
теплоты, полученное газом при изотермическом
процессе, равно
,
где
— объем, занимаемый газом при температуре
и давлении
(точка 3 на графике).
На участке 3 — 1 газ отдает количество
теплоты
,
равное
,
где Ср —
молярная теплоемкость газа при изобарном
процессе.
Подставим найденные значения
и
в формулу (1):
.
В полученном выражении заменим отношение
объемов
,
согласно закону Гей-Люссака, отношением
температур
и выразим
и
через число степеней свободы молекулы
.
Тогда после сокращения на
и
получим
.
Подставив значения
и
,
и произведя вычисления, найдем
= 0,041 =4 ,1 %
Ответ: = 4,1 %
Задача 2.2. Температура пара,
поступающего в паровую машину,
;
температура в конденсаторе
.
Определить теоретически максимальную
работу при затрате количества теплоты
.
|
Дано:
|
Решение
Д
Рис. 2.2
ля
того чтобы работа, совершаемая тепловой
машиной (тепловым двигателем), была
максимальной, необходимо, чтобы цикл,
по которому работает двигатель, был
обратимым. При наличии только двух
термостатов — нагревателя с температурой
и холодильника с температурой
— возможен только один обратимый цикл
— цикл Карно, состоящий из двух изотерм
и двух адиабат (рис.2.2.).
Коэффициент полезно действия этого
цикла
(1)
КПД любого теплового двигателя
,
(2)
где А —
полезная работа, совершаемая двигателем,
—
количество теплоты, полученное рабочим
телом от нагревателя.
Приравнивая правые части равенств (I) и
(2), получим
,
откуда
.
Ответ: А=1,05 кДж.
Задача 2.3. Тепловой двигатель работает
по циклу, состоящему из изотермического,
изобарного и адиабатного процессов.
При изобарном процессе рабочее тело —
идеальный газ — нагревается от температуры
Т1 = 200 К до Т2 = 500 К. Определить
коэффициент полезного действия данного
теплового двигателя и двигателя,
работающего по циклу Карно, происходящему
между максимальной и минимальной
температурами данного цикла.
|
Дано: |
Решение
В условии задачи неоговорена
последовательность процессов, но
поскольку изобарный процесс, по условию,
— процесс нагревания, следовательно, и
расширения, а тепловая машина является
тепловым двигателем, то прямая,
соответствующая графику этого процесса
в координатах р,V, должна лежать выше
кривых, изображающих изотермический и
адиабатный процессы. После изобарного
расширения 1- 2 (рис. 2.3) газ должен а
диабатно
расширяться (кривая 2-3) до тех пор, пока
температура станет равной
,
а затем изотермическим сжатием (кривая
3-1) газ можно вернуть в исходное состояние.
(Легко убедиться, что при любой другой
последовательности процессов не будет
выполняться условие з
Рис. 2.3
адачи.)
При последовательности процессов,
изображенной на рис. 2.3 газ получает
теплоту только в процессе 1-2, поэтому
,
и отдает теплоту в процессе 3-1 (
).
Процесс 2-3 происходит без теплообмена.
Тогда коэффициент полезного действия
цикла, согласно определению,
.
(1)
Газ идеальный, все процессы предполагаются
обратимыми (фактически это предположение
было сделано уже при изображении
процессов на графике). Тогда
и
могут быть выражены по известным формулам
для изобарного и изотермического
процессов.
Коэффициент полезного действия цикла
Карно найдем по известным формулам, так
как из проведенного анализа очевидно,
что
.
Количество теплоты, получаемое рабочим
телом при изобарном процессе,
,
(2)
где
— молярная теплоемкость при постоянном
давлении.
Количество теплоты, отдаваемое рабочим
телом при изотермическом сжатии,
,
(3)
Для процесса 3-1 количество теплоты
пропорционально
.
Поскольку
,
логарифм будет отрицательным, поэтому
в выражении для
стоит
.
Объемы газа и их отношения неизвестны,
однако состояния I и 2 лежат на одной
изобаре и
.
(4)
Состояния 2 и 3 лежат на одной адиабате:
.
(5)
Учитывая, что
,
и извлекая корень степени
,
получаем
(6)
Перемножая почленно равенства (4) и (6),
имеем
.
Тогда
.
.
(7)
Подставим выражения (2) и (7) в (1):
.
Коэффициент полезного действия цикла
Карно между максимальной и минимальной
температурами
Ответ: =0,39
Задача 2.4. В цикле Отто газовых и
карбюраторных двигателей внутреннего
сгорания теплота подводится и отводится
при постоянных объемах (рис. 2.4).
Особенностью таких двигателей является
то, что в них сжимается рабочая смесь,
приготовленная вне цилиндров:
0—1 — всасывание рабочей смеси (горячий
газ — воздух либо пары легкого топлива
— воздух);
/—2 — адиабатическое
сжатие рабочей смеси.
В конце сжатия происходит
зажигание горючей смеси от электрической
искры;
2—3 —
быстрое возрастание давления продуктов
сгорания (практически при постоянном
объеме) и их температуры;
3—4 — адиабатическое расширение продуктов
сгорания (рабочий ход поршня). В конце
расширения открывается выпускной
клапан, происходит падение давления в
цилиндре (ветвь 4-1) при постоянном объеме;
1—0 — выталкивание поршнем продуктов
сгорания.
О
тношение
называется
степенью адиабатического сжатия.
Рис. 2.4
Определить КПД цикла, если показатель
степени адиабаты равен
.
|
Дано: |
Решение
КПД цикла
(1)
Подводимая теплота соответствует ветви
2-3 (
),
тогда
,
(2)
где
—
число молей,
— молярная теплоемкость рабочей смеси.
Аналогично
.
(3)
Тогда разделив (3) на (2), получим
(4)
Так как ветви 3-4 и 1-2 – адиабаты, то
(5)
и
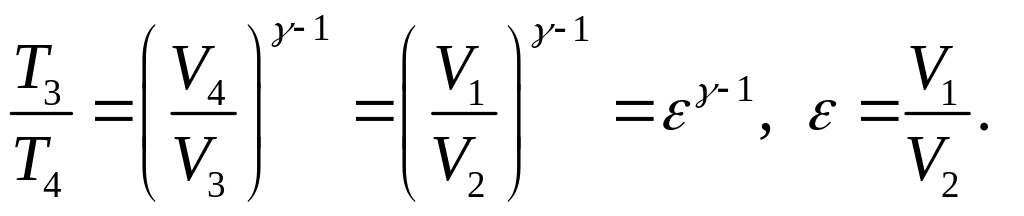
(6)
Из (5) и (6), следует, что
(7)
(8)
Подставив (7) и (8) в (4), получим сначала
(9)
а затем выражение для КПД цикла
(10)
Ответ:
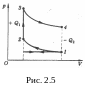
Задача 2.5. Карбюраторный двигатель
внутреннего сгорания работает по циклу,
состоящему из двух адиабат и двух изохор.
Рассчитать КПД двигателя при следующих
значениях температур:
,
,
,
.
|
Дано:
|
Решение
где
Ответ: = 0,38.
Задача 2.6. Цикл четырехтактного
двигателя Дизеля изображен на рисунке
2.6 а) ветвь АВ – в цилиндры засасывается
воздух(Р0=1ат) б) ветвь ВС – воздух
адиабатически сжимается д
о
давления Р1 в) в конце такта
сжатия в цилиндры впрыскивается топливо,
которое воспламеняется в горячем воздухе
и сгорает, при этом поршень движется
вправо сначала изобарически (ветвь
CD), а затем адиабатически
(ветвь DE). г) в конце
адиабатического расширения открывается
выпускной клапан, давление падает до
Р0 (ветвь EB). д) при
движении поршня влево смесь удаляется
из цилиндров (ветвь ВА). Найти КПД
двигателя Дизеля.
|
Дано: T0, T1, T2, T3 |
Решение
Работа, совершаемая при полном цикле:
A=Q1-Q2
(1)
где Q1
– количество тепла, выделившееся при
сгорании топлива, Q2
– количество теплоты, отданное среде
(на ЕВ). Т.к. CD – изобара,
то:
(2)
где Т1 –
температура в начале изобар. расширения,
а Т2 – в конце.
Т.к. ЕВ
– изохора, то:
(3)
где Т3 –
температура в начале изохор. процесса,
а Т0 – в конце.
Следовательно:
(4)
Выразим Ср
через Cv
(5)
Подставив
(5) в (4) получим:
(6)
Для КПД имеем:
(7)
Ответ:
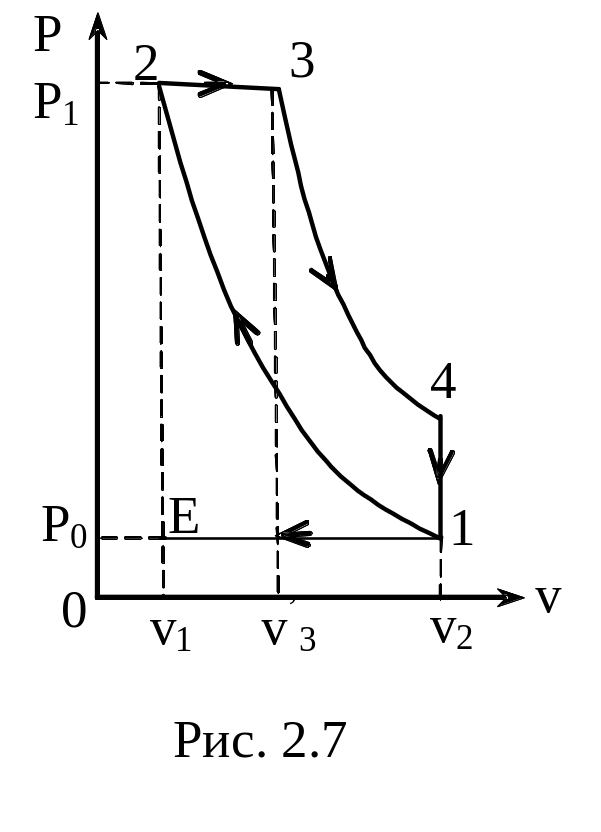
З
адача
2.7. Дизельный двигатель внутреннего
сгорания работает по циклу, состоящему
из 2 адиабат, изобары и изохоры (рис 2.7).
Рассчитать КПД такого двигателя, если
отношение удельных теплоемкостей
, а температуры газа имеют значения:
T1=310 K,
T2=760 K,
T3=1210K,
T4=610K.
|
Дано: T1=310 T2=760 T3=1210 T4=610 |
Решение
1-2 адиабатный
процесс Q12=0
2-3 изобарный
процесс
3-4 адиабатный
процесс Q34=0
4-1 изохорный процесс
,
тогда
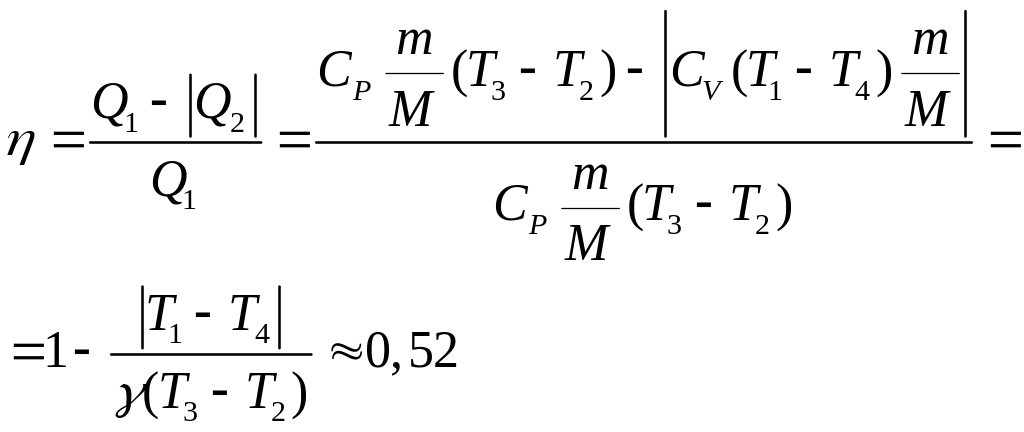
Ответ:
= 0,52
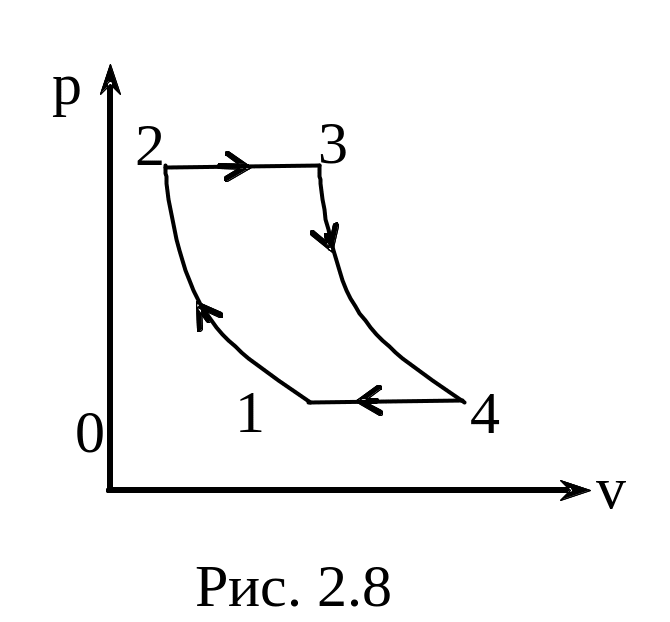
Задача 2.8. Цикл газотурбинной
установки при постоянном давлении (рис
2.8) состоит: из адиабаты 1-2 (сжатие воздуха
в компрессоре перед подачей его в камеру
сгорания), адиабаты 3-4 (расширение
продуктов сгорания в соплах турб
ины,
при этом совершается работа вращения
ротора) и изобары 4-1 (охлаждение
отработанных газов при атмосферном
давлении до температуры окружающей
среды). Отношение
называется степенью повышения давления.
Найти выражение для КПД цикла установки
с подводимой теплотой при Р=const.
Показатель адиабаты равен
,
теплоемкости СР воздуха и продуктов
сгорания считать равными и постоянными.
|
Дано:
|
Решение
КПД цикла:
(1)
где тепло, подводимое
в ходе изобарического процесса 2-3:
(2)
А тепло,
отводимое в ходе изобарического процесса
4-1:
(3)
А т.к. 1-2
адиабата, то
,
откуда
(4)
аналогично
для адиабаты 3-4
,
откуда
(5)
Разделив (3)
на (2), получим:
(6)
Подставляя (6) в (1), получим:
(7)
Ответ:
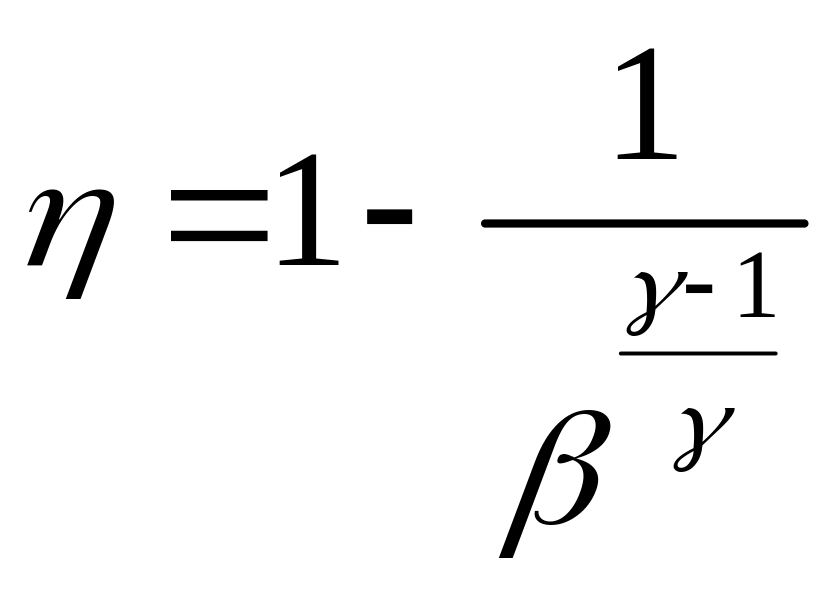
Задача 2.9. Образцовый цикл паросиловой
установки (цикл Ренкина) представлен
на рис 2.9. Нагревание воды в паровом
котле до температуры кипения, испарение
и перегревание полученного пара
происходят при постоянном давлении
(изобарное подведение теплоты происходит
по ветви 1-2). Далее следует адиабатическое
расширение пара в турбине (ветвь 2-3). В
конце расширения пар переходит линию
насыщения и увлажняется. Отработанный
пар сжимается в конденсаторе (изобарное
отведение теплоты, ветвь 3-4), а полученный
конденсат насосом снова подается в
котел (ветвь 4-1). Рассчитать приращение
энтропии при 1) нагревании воды в котле
2) при испарении
3) при перегревании пара
до 500*С , если р1=981*104 Па,
температура перегретого пара tпп=500*С,
р3=39*102Па. Среднюю удельную
теплоемкость воды при давлении р1
принять равной Ср=4620 Дж/кг*К.
Скрытая теплота испарения воды при р=p1
равна r1=133*104
Дж/кг; при р=р3 равна r3=243*104
Дж/кг. Средняя удельная теплоемкость
перегретого пара Ср=3420 Дж/кг*К.
|
Дано: P1=981*104 tпара=500*C T3=773K P3=39*102 Cрводы=4620 При Р=Р1 r1=133*104 при Р=Р3 r3=243*104 С’рп=3420Дж/кг*К m=1 |
|
— ? |
Решение
Из таблиц
водяного пара определяем температуры
кипения воды при давлениях Р1
t1=309,5*C,
Т1=582,5 К; Р3
t3=28,6*C,
T3=301,6 K.
Изменение
энтропии:
1) при нагревании
воды в котле (1)
Подставив
численные значения в (1), получим:
(Дж/к)
2) При испарении
воды
(2)
Подставив
численные значения в (2), найдем
(Дж/К)
3) при
перегревании пара до 500*С
(3)
подставив
численные значения в (3), получим
(Дж/К)
Ответ:
=3041,
=2283,
=968
Дж/К
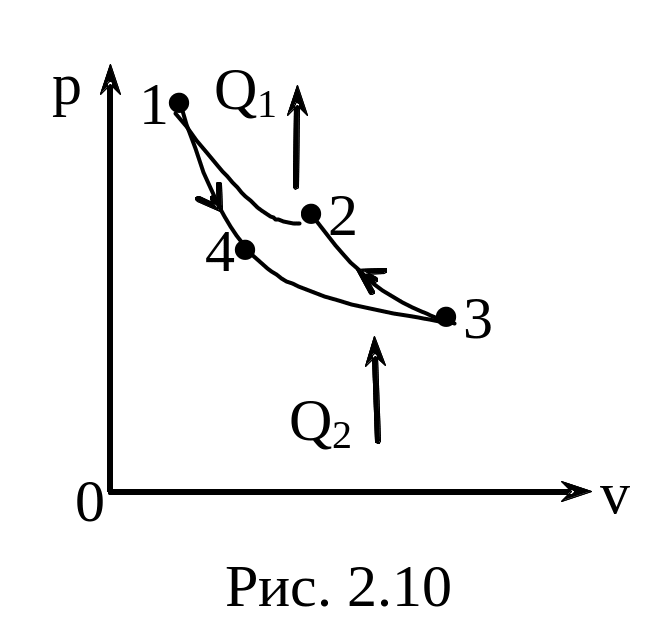
Задача 2.10.
Идеальная холодильная машина работает
как тепловой насос по обратному циклу
Карно(рис. 2.10). При этом она берет тепло
от воды с температурой 2*С и передает
его воздуху с температурой 27*С. Найти
1) коэффициент
— отношение количества тепла, переданного
воздуху за некоторый промежуток времени,
к количеству тепла, отнятому за это же
время у воды. 2) коэффиц
иент
— отношение количества тепла, отнятого
у воды, к затраченной на работу машины
энергией (
называется холодильным коэффициентом
машины), 3) коэффициент
— отношение затраченной на работу машины
энергии к количеству тепла, переданному
за это время воздуху (
— КПД цикла). Найти соотношение м/у
коэффициентами
|
Дано: T1=300 T2=275 |
|
|
Решение
КПД прямого
цикла Карно равен
В то же время
Откуда
Далее
.
Отсюда
Тогда
;
;
Ответ: 1=
1,09 2= 11
3=0,083
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
На этой странице вы узнаете
- В чем прелесть фазовых переходов?
- Что лучше выбрать: Mercedes или BMW?
Люди научились летать в космос, покорять недра Земли и погружаться в глубины океана. Эти и другие достижения возможны благодаря способности извлекать максимум пользы из имеющихся ресурсов,а именно получать тепловую энергию различными доступными способами. Сегодня мы разберем задачи, которые заставят тепловые процессы играть на нашей стороне.
Тепловые машины и их КПД
Рекомендация: перед тем как приступить к выполнению задач неплохо было бы повторить тему «Уравнение состояния идеального газа» . Но ключевую теорию, на которой основано решение задач, сейчас разберем вместе.
Вспомним, что фазовые переходы — это переход из одного агрегатного состояния в другое. При этом может выделяться большое количество теплоты.
Именно благодаря этому они и стали такими полезными для нас. Например, в ядерных реакторах воду используют в качестве рабочего тела, то есть она нагревается вследствие энергии, полученной из ядерных реакций, доходит до температуры кипения, а затем под большим давлением уже в качестве водяного пара воздействует на ротор генератора, который вращается и дает нам электроэнергию! На этом основан принцип работы атомных электростанций.
А самый простой пример фазового перехода — образование льда на лужах в морозные ноябрьские дни. Правда о выделении тепла здесь речи не идет.
Мы не почувствуем, как испарится капелька у нас на руке, потому что это не требует много тепла от нашего тела. Но мы можем наблюдать, как горят дрова в мангале, когда мы жарим шашлык, потому что выделяется огромное количество теплоты. А зачем мы вообще рассматриваем эти фазовые переходы? Все дело в том, что именно фазовые переходы являются ключевым звеном во всех процессах, где нас просят посчитать КПД, от них нашему рабочему телу и подводится теплота нагревателя.

Человечество придумало такие устройства, которые могут переработать тепловую энергию в механическую.
Тепловые двигатели, или тепловые машины, — устройства, способные преобразовывать внутреннюю энергию в механическую.
Их устройство довольно просто: они на входе получают какую-то энергию (в основном — энергию сгорания топлива), а затем часть этой теплоты расходуется на совершение работы механизмом. Например, в автомобилях часть энергии от сгоревшего бензина идет на движение. Схематично можно изобразить так:
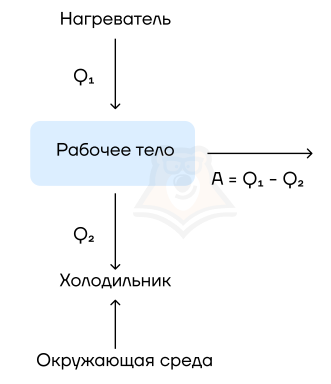
Рабочее тело — то, что совершает работу — принимает от нагревателя количество теплоты Q1, из которой A уходит на работу механизма. Остаток теплоты Q2 рабочее тело отдает холодильнику, по сути — это потеря энергии.
Физика не была бы такой загадочной, если б все в ней было идеально. Как и в любом процессе или преобразовании, здесь возможны потери, зачастую очень большие. Поэтому «индикатором качества» машины является КПД, с которым мы уже сталкивались в механике:
Коэффициент полезного действия (КПД) тепловой машины — это отношение полезной работы двигателя к энергии, полученной от нагревателя.
(eta) — КПД,
A — работа газа (Дж),
Q1 — количество теплоты, полученное от нагревателя (Дж).
Мы должны понимать, что КПД на практике никогда не получится больше 1, поскольку всегда будут тепловые потери.
Полезную работу можно расписать как Q1 — Q2 (по закону сохранения энергии). Тогда формула примет вид:
(eta = frac{Q_1 — Q_2}{Q_1} = 1 — frac{Q_2}{Q_1})
Давайте попрактикуемся в применении данной формулы на задаче номер 9 из ЕГЭ.
Задача. Тепловая машина, КПД которой равен 60%, за цикл отдает холодильнику 100 Дж. Какое количество теплоты за цикл машина получает от нагревателя? (Ответ дайте в джоулях).
Решение:
Давайте сначала вспомним нашу формулу для КПД:
(eta = frac{Q_1 — Q_2}{Q_1}),
где (Q_1) — это теплота, которую тело получает от нагревателя, (Q_2) — теплота, которая подводится к холодильнику.
Тогда отсюда можно вывести искомую теплоту нагревателя:
(eta Q_1 =Q_1-Q_2)
(eta Q_1 — Q_1= -Q_2)
(Q_1=frac{- Q_2}{eta-1}=frac{-100}{0,6-1}=250 Дж).
Ответ: 250 Дж
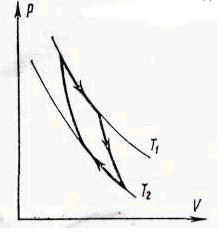
Цикл Карно
Мы знаем, что потери — это плохо, поэтому должны предотвращать их. Как это сделать? Нам ничего делать не нужно, за нас уже все сделал Сади Карно, французский физик, разработавший цикл, в котором машины достигают наивысшего КПД. Этот цикл носит его имя и состоит из двух изотерм и двух адиабат. Рассмотрим, как этот цикл выглядит в координатах p(V).
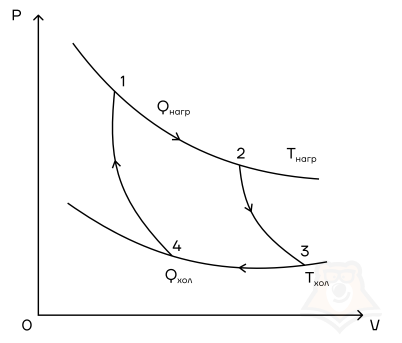
- Температура верхней изотермы 1-2 — температура нагревателя (так как теплота в данном процессе подводится).
- Температура нижней изотермы 3-4 — температура холодильника (так как теплота в данном процессе отводится).
- 2-3 и 4-1 — это адиабатические расширение и сжатие соответственно, в них газ не обменивается теплом с окружающей средой.
Цикл Карно — цикл идеальной тепловой машины, которая достигает наивысшего КПД.
Формула, по которой можно рассчитать ее КПД выражается через температуры:
T1 — температура нагревателя,
T2 — температура холодильника.
Не то круто, что красиво, а то, что по Карно работает! Поэтому присматривайте такой автомобиль, у которого высокий КПД.
Интересно, что максимальный уровень КПД двигателя внутреннего сгорания автомобилей на данный момент всего около 43%. По официальным заявлениям компания Nissan Motor с 2021 года испытывает прообраз двигателя нового поколения с планируемым КПД 50%.
Приступим к задачам
Задачи на данную тему достаточно часто встречаются в задании 27 из КИМа ЕГЭ. Давайте разберем некоторые примеры.
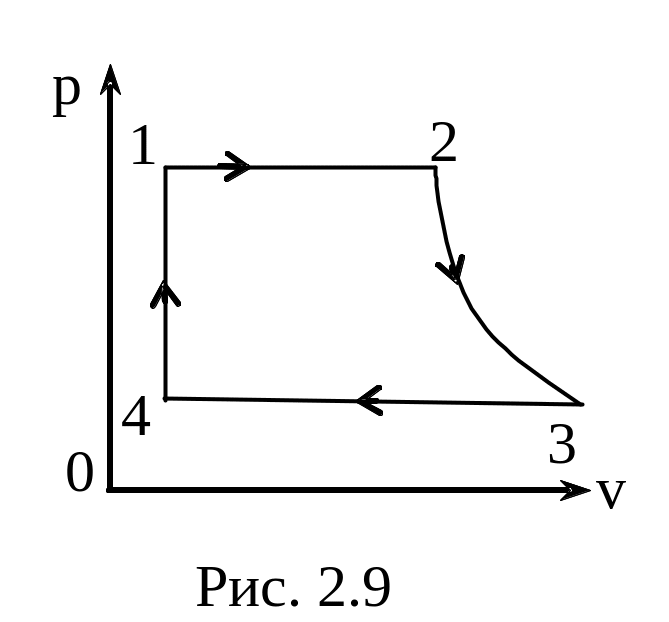
Задание 1. Одноатомный газ совершает циклический процесс, как показано на рисунке. На участке 1–2 газ совершает работу A12 = 1520 Дж. Участок 3–1 представляет собой адиабатный процесс. Количество теплоты, отданное газом за цикл холодильнику, равно |Qхол| = 4780 Дж. Найдите работу газа |A13| на адиабате, если количество вещества постоянно.
Решение:
Шаг 1. Первое, с чего лучше начинать задачи по термодинамике — исследование процессов.
Посмотрим на участок 1-2 графика: продолжение прямой проходит через начало координат, поэтому график функционально можно записать, как p = aV, где a — какое-то число, константа. Графиком является не изотерма, поскольку график изотермы в координатах p-V — гипербола. Из уравнения Менделеева-Клапейрона следует: (frac{pV}{T} = const). Отсюда можно сделать вывод, что возрастает температура, так как растут давление и объем. Температура и объем растут, значит, увеличивается и внутренняя энергия и объем соответственно.
Участок 2-3: процесс изохорный, поскольку объем постоянен, следовательно, работа газом не совершается. Рассмотрим закон Шарля: (frac{p}{T} = const). Давление в этом процессе растет, тогда растет и температура, поскольку дробь не должна менять свое значение. Делаем вывод, что внутренняя энергия тоже увеличивается.
Участок 3-1: адиабата по условию, то есть количество теплоты в этом переходе равна нулю из определения адиабатного процесса. Работа газа отрицательна, так как газ уменьшает объем.
Оформим все данные в таблицу.
Определим знаки Q, используя первый закон термодинамики: Q = ΔU + A.

Из этих данных сразу видно, что количество теплоты, отданное холодильнику — это количество теплоты в процессе 2-3.
Шаг 2. Первый закон термодинамики для процесса 1-2 запишется в виде:
Q12 = ΔU12 + A12.
Работа A12 — площадь фигуры под графиком процесса, то есть площадь трапеции:
(A_{12} = frac{p_0 + 2p_0}{2} * V0 =frac{3p_0V_0}{2}).
Запишем изменение внутренней энергии для этого процесса через давление и объем. Мы выводили эту формулу в статье «Первое начало термодинамики»:
(Delta U_{12} = frac{3}{2}(2p_0 * 2V_0 — p_0V_0) = frac{9p_0V_0}{2}).
Заметим, что это в 3 раза больше работы газа на этом участке:
(Delta U_{12} = 3A_{12} rightarrow Q_{12} = 4A_{12}).
Шаг 3. Работа цикла — площадь фигуры, которую замыкает график, тогда . A = A12 — |A31|. С другой стороны, работа цикла вычисляется как разность между энергиями нагревателя и холодильника: A = Q12 — |Q31|.
Сравним эти формулы:
Q12 -|Q31| = A12 — |A31|,
подставим выражения из предыдущего пункта:
4A12 — |Q31| = A12 — |A31| (rightarrow) |A31| = -3A12 + |Q31| = -31520 + 4780 = 220 Дж.
Ответ: 220 Дж
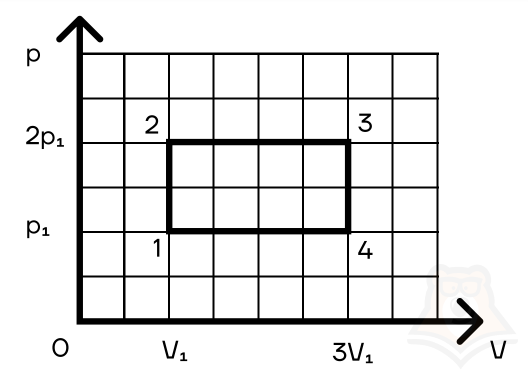
Задание 2. Найти КПД цикла для идеального одноатомного газа.
Решение:
Шаг 1. КПД цикла определим по формуле: (eta = frac{A}{Q}), где Q — количество теплоты от нагревателя, а А — работа газа за цикл. Найдем А как площадь замкнутой фигуры: A = (2p1 — p1)(3V1 — V1) = 2p1V1.
Шаг 2. Найдем процесс, который соответствует получению тепла от нагревателя. Воспользуемся теми же приемами, что и в прошлой задаче:
Посмотрим на участок 1-2 графика: давление растет, объем не меняется. По закону Шарля (frac{p}{T} = const) температура тоже растет. Работа газа равна 0 при изохорном процессе, а изменение внутренней энергии положительное.
2-3: давление не меняется, растет объем, а значит, работа газа положительна. По закону Гей-Люссака (frac{V}{T} = const) температура тоже растет, растет и внутренняя энергия.
3-4: давление уменьшается, следовательно, и температура уменьшается. При этом процесс изохорный и работа газа равна 0.
4-1: давление не меняется, объем и температура уменьшаются — работа газа отрицательна и внутренняя энергия уменьшается.
Оформим данные в таблицу:
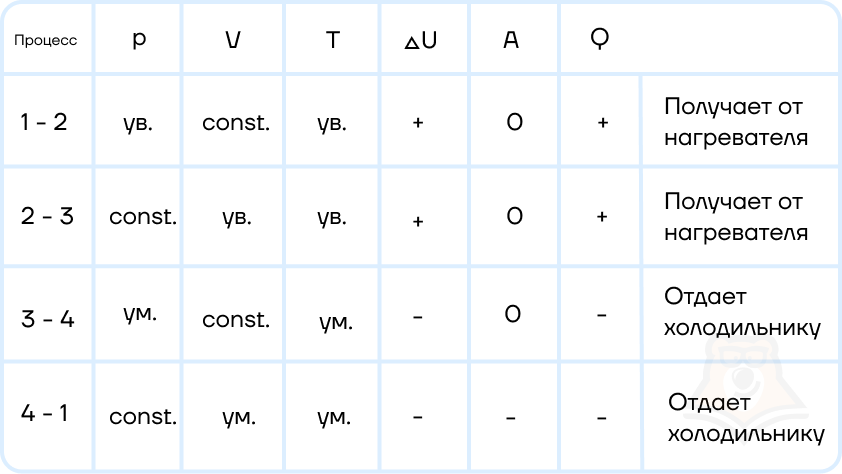
Отметим, что необходимое Q = Q12 + Q23.
Шаг 3. Запишем первый закон термодинамики для процессов 1-2 и 2-3:
(Q_{12} = U_{12} + A_{12} = Delta U_{12} = frac{3}{2}(2p_1V_1 -p_1V_1) = frac{3}{2}p_1V_1).
(Q_{23} = Delta U_{23} + A_{23}), работу газа найдем как площадь под графиком: A23 = 2p1(3V1 — V1) = 4p1V1.
(Delta U_{12} = frac{3}{2}(2p_1 * 3V_1 — 2p_1V_1) = 6p_1V_1).
(Q_{23} = Delta U_{23} + A_{23} = 10p_1V_1).
Шаг 4. Мы готовы считать КПД: (eta = frac{A}{Q} = frac{A}{Q_{12} + Q_{23}} = frac{2p_1V_1}{frac{3}{2}p_1V_1 + 10p_1V_1} = frac{4}{23} approx 0,17).
Ответ: 17%
Теперь вас не должно настораживать наличие графиков в условиях задач на расчет КПД тепловых машин. Продолжить обучение решению задач экзамена вы можете в статьях «Применение законов Ньютона» и «Движение точки по окружности».
Фактчек
- Тепловые двигатели — устройства, способные преобразовывать внутреннюю энергию в механическую.
- Тепловая машина принимает тепло от нагревателя, отдает холодильнику, а рабочим телом совершает работу.
- Коэффициент полезного действия (КПД) тепловой машины — это отношение полезной работы двигателя к энергии, полученной от нагревателя.
(eta = frac{A}{Q_1} = frac{Q_1 — Q_2}{Q_1} = 1 — frac{Q_2}{Q_1}) - Цикл Карно — цикл с максимально возможным КПД: (eta = frac{T_1 — T_2}{T_1} = 1 — frac{T_2}{T_1})
- Не забываем, что работа считается, как площадь фигуры под графиком.
Проверь себя
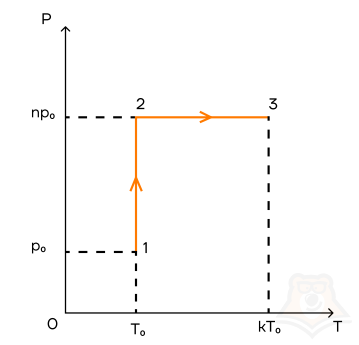
Задание 1.
1 моль идеального газа переходит из состояния 1 в состояние 2, а потом — в состояние 3 так, как это показано графике. Начальная температура газа равна T0 = 350 К. Определите работу газа при переходе из состояния 2 в состояние 3, если k = 3, а n = 2.
- 5672 Дж
- 4731 Дж
- 5817 Дж
- 6393 Дж
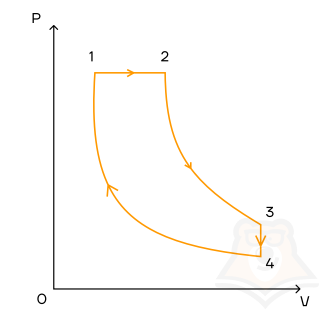
Задание 2.
1 моль идеального одноатомного газа совершает цикл, который изображен на pV-диаграмме и состоит из двух адиабат, изохоры, изобары. Модуль отношения изменения температуры газа при изобарном процессе ΔT12 к изменению его температуры ΔT34 при изохорном процессе равен 1,5. Определите КПД цикла.
- 0,6
- 0,5
- 0,8
- 1
Задание 3.
В топке паровой машины сгорело 50 кг каменного угля, удельная теплота сгорания которого равна 30 МДж/кг. При этом машиной была совершена полезная механическая работа 135 МДж. Чему равен КПД этой тепловой машины? Ответ дайте в процентах.
- 6%
- 100%
- 22%
- 9%
Задание 4.
С двумя молями одноатомного идеального газа совершают циклический процесс 1–2–3–1 (см. рис.). Чему равна работа, совершаемая газом на участке 1–2 в этом циклическом процессе?
- 4444 Дж
- 2891 Дж
- 4986 Дж
- 9355 Дж
Ответы:1 — 3; 2 — 1; 3 — 4; 4 — 3.
Кпд идеального газа треугольник
Чему равен КПД цикла, проводимого с идеальным одноатомным газом? Ответ приведите в процентах, округлить до целых.
КПД тепловой машины определяется как отношение полезной работы и переданного рабочему телу тепла за цикл: Определим сперва полезную работу за цикл, на диаграмме этой величине соответствует площадь цикла: Передаваемое газу тепло рассчитаем при помощи первого начала термодинамики: Рассмотрим последовательно все участки цикла. На участке 1 — 2 газ не совершает работы, а изменение его внутренней энергии (с учетом уравнения Клапейрона-Менделеева) равно: Так как изменение внутренней энергии положительно, газ получает тепло на этом участке. На участке 2 — 3 газ совершает работу Изменение его внутренней энергии на этом участке: Следовательно, на этом участке газ получает тепло На участке 3 — 1 газ совершает отрицательную работу, он остывает, а значит, его внутренняя энергия уменьшается, следовательно, на этом участке он отдает тепло, а не получает. Окончательно, все полученное газом за цикл тепло равно Таким образом, КПД цикла равно
А разве здесь не нужно использовать формулу (дельта)U=Q+A, ведь над газом совершают работу, а не газ сам ее совершает. Или как вообще нужно определять в какой задаче какую формулу использовать, разве не нужно ориентироваться по дано задачи?
Формулу можно использовать любую, в зависимости от того, что Вам удобно в данной конкретной задаче. В данной задаче цикл идет по часовой стрелке, следовательно, газ совершает положительную работу, поэтому, возможно, удобнее использовать то, что использовано 
Алексей! Поздравляю Вас. Вы очередной раз «изобрели» вечный двигатель второго рода. Обратите внимание на то, что в условии задачи указано, что газ одноатомный.
Если проделать те же вычисления с двухатомным газом, то значение КПД будет другим, что противоречит первой теореме Карно, которая гласит: «КПД обратимого цикла не зависит от рода вещества, из которого сделано рабочее тело».
Хотелось бы сделать одно замечание по поводу Ваших «тезисов». Один из них гласит: «Квазистатический (протекающий медленно) процесс обратим». Согласно ему, если дизельный двигатель медленно крутить в противоположном направлении, то в топливный бок потечет солярка, а из воздушного фильтра будет выходить очищенный воздух. Ведь, согласно Вашему тезису, все должно возвратиться в исходное положение Неужели Вы поверите этому бреду?!
Мне кажется, этот спор бесконечен. Мой тезис следующий, постараюсь его еще раз передать: «Если на некоторой диаграмме () задана точка, то состояние системы полностью задано и она находится в равновесном состоянии (мы считаем, что уравнение состояния нам известно). Если система не находится в равновесии, то точка на подобных диаграммах вообще не имеет смысла. Далее, когда на диаграмме нарисована линия, это последовательность равновесных состояний, через которые система проходит непрерывно, квазистатически. По линии можно перемещать систему в разных направлениях».
Что касается теоремы Карно, на которую Вы ссылаетесь, мне кажется, что Вы упускаете, существенный факт, что она формулируется для цикла Карно, когда есть нагреватель при одной температуре и холодильник при другой. Для цикла Крно получается все так, как Вы говорите. Но можно придумать огромную кучу оьратимых машин, отличных от машины Карно. Например, можно построить из адиабат и изотерм цикл с тремя температурами. Дальнейшее обобщение дает произвольную кривую. Я Вам уже рассказывал, что любую линию можно построить из адиабат и изотерм. Надеюсь в их обратимости Вы не сомневаетесь.
Ваш пример с двигателем, конечно, не вписывается в эту картину. Процесс превращения топлива в тепло с выбрасыванием продуктов горения нельзя обратить, как ни старайся.
Кпд идеального газа треугольник
2017-08-13
Рабочим телом тепловой машины является одноатомный идеальный газ. Определите КПД тепловой машины, график цикла которой показан на рисунке.
КПД цикла $eta = frac>>$, где $A^< prime>$ — работа газа за цикл; $Q_<н>$ — количество теплоты, полученное от нагревателя за цикл. Работа газа численно равна площади треугольника 1-2-3, поэтому
Газ получает тепло только на этапе 1-2: здесь происходит расширение газа (т. е. $A_<1-2>^ < prime>> 0$) и его нагревание (т. е. $Delta U_ <1-2>> 0$), так что $Q_ <1-2>= Delta U_ <1-2>+ A_<1-2>^ < prime>> 0$. На двух других этапах газ тепло отдает (см. задачу 4000). Работа $A_<1-2>^< prime>$ вычисляется как площадь соответствующей трапеции:
Изменение внутренней энергии газа на этапе 1-2 составит:
$Delta U_ <1-2>= frac<3> <2>nu R(T_ <2>- T_<1>) = frac<3><2>(4 p_ <0>cdot 4 V_ <0>- p_ <0>V_<0>) = frac<45 p_<0>V_<0>><2>$.
Следовательно, $Q_ <в>= Q_ <1-2>= 30 p_ <0>V_<0>$ и $eta = 0,15$.
Ответ: 15%.
На p-V диаграмме изображен цикл, проводимый с одноатомным идеальным газом
Условие задачи:
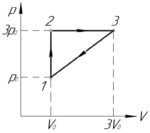
Задача №5.5.54 из «Сборника задач для подготовки к вступительным экзаменам по физике УГНТУ»
Решение задачи:
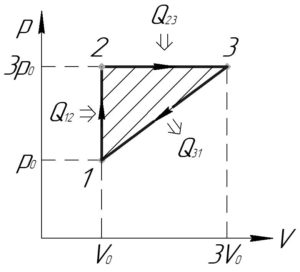
Работу цикла (A) численно равна площади фигуры цикла в координатах p-V, при этом если цикл обходится по часовой стрелке, то работа цикла будет положительной (как у нас). Фигура цикла представляет собой прямоугольный треугольник, поэтому:
Теперь нужно определить процессы в цикле, в которых теплота подводилась к газу. Запишем первый закон термодинамики:
Также запишем формулу для определения изменения внутренней энергии одноатомного идеального газа (Delta U):
Запишем уравнение Клапейрона-Менделеева для точек 1-3:
Рассмотрим изохорный процесс 1-2 ((V=const)), работа газа (A_<12>) в таком процессе равна нулю. Тогда количество теплоты (Q_<12>) по формуле (3), учитывая формулу (4), равно:
Так как давление в процессе 1-2 растёт, значит растёт и температура, то есть (Delta T_<12>>0). Поэтому, согласно формуле (8) (Q_<12>>0), то есть теплота в процессе 1-2 подводилась к газу. Учитывая формулы (5) и (6), формула (8) примет вид:
Теперь рассмотрим изобарный процесс 2-3 ((p=const)). Работа газа (A_<23>) в таком процессе равна:
Учитывая уравнения (6) и (7), имеем:
Количество теплоты (Q_<23>) по формуле (3), учитывая формулу (4), равно:
Так как объем в процессе 2-3 увеличивается, то по закону Гей-Люссака увеличивается и температура ((Delta T_<23>>0)). Поэтому, согласно формуле (10) (Q_<23>>0), то есть теплота в процессе 2-3 к газу подводилась. Учитывая формулы (6) и (7), формула (10) примет вид:
Так как в процессах 1-2 и 2-3 теплота подводится, значит в процессе 3-1 она отводится, так как хотя бы в одном из процессов цикла она должна отводится. Поэтому количество теплоты (Q_н), полученное от нагревателя, равно:
Подставим в эту формулу выражения (9) и (11), тогда:
В формулу (1) для определения КПД (eta) подставим выражения (2) и (12):
Ответ: 11,1%.
Если Вы не поняли решение и у Вас есть какой-то вопрос или Вы нашли ошибку, то смело оставляйте ниже комментарий.
http://earthz.ru/solves/Zadacha-po-fizike-4008
http://easyfizika.ru/zadachi/termodinamika/na-p-v-diagramme-izobrazhen-tsikl-provodimyj-s-odnoatomnym-idealnym-gazom/
Основные формулы термодинамики и молекулярной физики, которые вам пригодятся. Еще один отличный день для практических занятий по физике. Сегодня мы соберем вместе формулы, которые чаще всего используются при решении задач в термодинамике и молекулярной физике.
Ежедневная рассылка с полезной информацией для студентов всех направлений – на нашем телеграм-канале.
Итак, поехали. Попытаемся изложить законы и формулы термодинамики кратко.
Идеальный газ
Идеальный газ – это идеализация, как и материальная точка. Молекулы такого газа являются материальными точками, а соударения молекул – абсолютно упругие. Взаимодействием же молекул на расстоянии пренебрегаем. В задачах по термодинамике реальные газы часто принимаются за идеальные. Так гораздо легче жить, и не нужно иметь дела с массой новых членов в уравнениях.
Итак, что происходит с молекулами идеального газа? Да, они движутся! И резонно спросить, с какой скоростью? Конечно, помимо скорости молекул нас интересует еще и общее состояние нашего газа. Какое давление P он оказывает на стенки сосуда, какой объем V занимает, какая у него температура T.
Для того, чтобы узнать все это, есть уравнение состояния идеального газа, или уравнение Клапейрона-Менделеева
Здесь m – масса газа, M – его молекулярная масса (находим по таблице Менделеева), R – универсальная газовая постоянная, равная 8,3144598(48) Дж/(моль*кг).
Универсальная газовая постоянная может быть выражена через другие константы (постоянная Больцмана и число Авогадро)
Массу, в свою очередь, можно вычислить, как произведение плотности и объема.
Основное уравнение молекулярно-кинетической теории (МКТ)
Как мы уже говорили, молекулы газа движутся, причем, чем выше температура – тем быстрее. Существует связь между давлением газа и средней кинетической энергией E его частиц. Эта связь называется основным уравнением молекулярно-кинетической теории и имеет вид:
Здесь n – концентрация молекул (отношение их количества к объему), E – средняя кинетическая энергия. Найти их, а также среднюю квадратичную скорость молекул можно, соответственно, по формулам:
Подставим энергию в первое уравнение, и получим еще один вид основного уравнения МКТ
Первое начало термодинамики. Формулы для изопроцессов
Напомним Вам, что первый закон термодинамики гласит: количество теплоты, переданное газу, идёт на изменение внутренней энергии газа U и на совершение газом работы A. Формула первого закона термодинамики записывается так:
Как известно, с газом что-то происходит, мы можем сжать его, можем нагреть. В данном случае нас интересуют такие процессы, которые протекают при одном постоянном параметре. Рассмотрим, как выглядит первое начало термодинамики в каждом из них.
Кстати! Для всех наших читателей сейчас действует скидка 10% на любой вид работы.
Изотермический процесс протекает при постоянной температуре. Тут работает закон Бойля-Мариотта: в изотермическом процессе давление газа обратно пропорционально его объёму. В изотермическом процессе:
Изохорный процесс протекает при постоянном объеме. Для этого процесса характерен закон Шарля: При постоянном объеме давление прямо пропорционально температуре. В изохорном процессе все тепло, подведенное к газу, идет на изменение его внутренней энергии.
Изобарный процесс идет при постоянном давлении. Закон Гей-Люссака гласит, что при постоянном давлении газа его объём прямо пропорционален температуре. При изобарном процессе тепло идет как на изменение внутренней энергии, так и на совершение газом работы.
Адиабатный процесс. Адиабатный процесс – это такой процесс, который проходит без теплообмена с окружающей средой. Это значит, что формула первого закона термодинамики для адиабатного процесса выглядит так:
Внутренняя энергия одноатомного и двухатомного идеального газа
Теплоемкость
Удельная теплоемкость равна количеству теплоты, которое необходимо для нагревания одного килограмма вещества на один градус Цельсия.
Помимо удельной теплоемкости, есть молярная теплоемкость (количество теплоты, необходимое для нагревания одного моля вещества на один градус) при постоянном объеме, и молярная теплоемкость при постоянном давлении. В формулах ниже, i – число степеней свободы молекул газа. Для одноатомного газа i=3, для двухатомного – 5.
Тепловые машины. Формула КПД в термодинамике
Тепловая машина, в простейшем случае, состоит из нагревателя, холодильника и рабочего тела. Нагреватель сообщает тепло рабочему телу, оно совершает работу, затем охлаждается холодильником, и все повторяется вновь. Типичным примером тепловой машины является двигатель внутреннего сгорания.
Коэффициент полезного действия тепловой машины вычисляется по формуле
Вот мы и собрали основные формулы термодинамики, которые пригодятся в решении задач. Конечно, это не все все формулы из темы термодинамика, но их знание действительно может сослужить хорошую службу. А если возникнут вопросы – помните о студенческом сервисе, специалисты которого готовы в любой момент прийти на выручку.