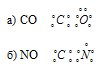Загрузить PDF
Загрузить PDF
На атомном уровне кратностью связи называется число пар связанных электронов между двумя атомами. Например, в двухатомном азоте (N≡N) кратность связи равна трем, поскольку два атома азота соединены тремя химическими связями. В теории молекулярных орбиталей кратность связи определяется как половина разности между количеством связывающих и разрыхляющих электронов. Таким образом, кратность связи можно рассчитать по следующей формуле: Кратность связи = [(Число электронов на связывающих орбиталях) – (Число электронов на разрыхляющих орбиталях)]/2.[1]
-
1
Запомните формулу. В теории молекулярных орбиталей кратность связи определяется как половина разности между количеством связывающих и разрыхляющих электронов: Кратность связи = [(Число электронов на связывающих орбиталях) – (Число электронов на разрыхляющих орбиталях)]/2.
-
2
Чем больше кратность связи, тем стабильнее молекула. Каждый электрон, который попал на связывающую орбиталь, стабилизирует новую молекулу. И наоборот, находящиеся на разрыхляющих орбиталях электроны дестабилизируют молекулу. Кратность связи определяет энергетический уровень образованной молекулы.
- Если кратность связи равна нулю, молекула не может образоваться. Чем выше кратность связи, тем более стабильна молекула.
-
3
Рассмотрим простой пример. Атомы водорода имеют один электрон на s-оболочке, которая способна вместить два электрона. Когда соединяются два атома водорода, s-оболочка каждого дополняется вторым электроном. В результате образуются две связывающие орбитали. Электронам не приходится переходить на более высокую p-оболочку, поэтому не образуется разрыхляющих орбиталей. Таким образом, кратность связи составляет
, то есть 1. В результате образуется обычная молекула газообразного водорода H2.
Реклама
-
1
Научитесь быстро определять кратность связи. В случае простой ковалентной связи кратность равна одному; при двойной ковалентной связи кратность равна двум; для тройной ковалентной связи кратность равна трем, и так далее.[2]
Попросту говоря, кратность связи — это число пар связанных электронов, которые удерживают два атома вместе. -
2
Узнайте, как атомы соединяются в молекулы. В любой молекуле составляющие ее атомы соединены связывающими парами электронов. Эти электроны вращаются вокруг ядра атома по «орбиталям». Например, каждая s-оболочка может вмещать не более двух электронов. Если такая оболочка «не заполнена», то на ней нет электронов или она содержит лишь один электрон. В этом случае несвязанный электрон может соединиться с соответствующим одиночным электроном другого атома.
- В зависимости от размеров и сложности конкретного атома, он может иметь одну или несколько, вплоть до четырех оболочек.
- Когда заполняется ближайшая к ядру электронная оболочка, новые электроны начинают заполнять следующую. Постепенно электроны заполняют следующие оболочки, поэтому чем крупнее атом, тем больше электронов он содержит.[3]
-
3
Изобразите точечные структуры Льюиса. Это удобный способ визуально представить, как атомы соединены друг с другом в молекуле. Обозначьте атомы их химическими символами (например, H для водорода и Cl для хлора). Нарисуйте связи между атомами в виде линий, например – для одинарной, = для двойной и ≡ для тройной связи. Обозначьте несвязанные электроны и электронные пары в виде точек (например, :C:).[4]
После того как вы изобразите точечные структуры Льюиса, посчитайте число связей — это и будет кратностью связи.- Для двухатомной молекулы азота точечная структура Льюиса будет иметь вид N≡N. Каждый атом азота имеет одну электронную пару и три несвязанных электрона. При соединении двух атомов азота их шесть несвязанных электронов образуют сильную тройную ковалентную связь.[5]
Реклама
- Для двухатомной молекулы азота точечная структура Льюиса будет иметь вид N≡N. Каждый атом азота имеет одну электронную пару и три несвязанных электрона. При соединении двух атомов азота их шесть несвязанных электронов образуют сильную тройную ковалентную связь.[5]
-
1
Посмотрите на диаграмму электронных оболочек атомов. Отметьте, что каждая следующая оболочка расположена все дальше и дальше от атомного ядра. Согласно свойствам энтропии, любая система стремится к состоянию с минимальной возможной энергией. Таким образом, электроны стремятся занять самую низкую оболочку, если там есть свободные места.
-
2
Узнайте о разнице между связывающими и разрыхляющими орбиталями. Когда два атома объединяются в молекулу, их электроны стремятся заполнить самые низкие уровни в электронных оболочках. При этом связывающие электроны объединяются друг с другом и заполняют нижние энергетические состояния. Разрыхляющие электроны остаются «свободными», или несвязанными, и вытесняются на более высокие орбитальные уровни.[6]
- Связывающие электроны. Если вы посмотрите, насколько заполнены электронные оболочки каждого атома, то сможете определить, сколько электронов смогут перейти на более стабильные оболочки с низкой энергией. Эти «заполняющие электроны» называют связывающими электронами.
- Разрыхляющие электроны. Когда два атома обмениваются электронами и образуют молекулу, орбитали с низкой энергией могут заполниться, и в этом случае некоторые электроны перейдут на уровни с более высокой энергией. Такие электроны называют разрыхляющими электронами.[7]
Реклама
Об этой статье
Эту страницу просматривали 45 247 раз.
Была ли эта статья полезной?
Кратность
связи определяется количеством
электронных пар, участвующих в связи
между атомами. Химическая связь
обусловлена перекрыванием электронных
облаков. Если это перекрывание происходит
вдоль линии, соединяющей ядра атомов,
то такая связь называется σ-связью.
Она может быть образована за счет s
– s электронов, р
– р электронов, s
– р электронов.
Химическая связь, осуществляемая одной
электронной парой, называется одинарной.
Если
связь образуется более чем одной парой
электронов, то она называется кратной.
Кратная
связь образуется в тех случаях, когда
имеется слишком мало электронов и
связывающихся атомов, чтобы каждая
пригодная для образования связи валентная
орбиталь центрального атома могла
перекрыться с какой-либо орбиталью
окружающего атома.
Поскольку р-орбитали
строго ориентированы в пространстве,
то они могут перекрываться только в том
случае, если перпендикулярные межъядерной
оси р-орбитали
каждого атома будут параллельны друг
другу. Это означает, что в молекулах с
кратной связью отсутствует вращение
вокруг связи.
5. Полярность связи
Если
двухатомная молекула состоит из атомов
одного элемента, как, например, молекулы
Н2,
N2, Cl2 и
т. п., то каждое электронное облако,
образованное общей парой электронов и
осуществляющее ковалентную связь,
распределяется в пространстве симметрично
относительно ядер обоих атомов. В
подобном случае ковалентная связь
называется неполярной или гомеополярной.
Если же двухатомная молекула состоит
из атомов различных элементов, то общее
электронное облако смещено в сторону
одного из атомов, так что возникает
асимметрия в распределении заряда. В
таких случаях ковалентная связь
называется полярной или гетерополярной.
Для
оценки способности атома данного
элемента оттягивать к себе общую
электронную пару пользуются величиной
относительной электроотрицательности.
Чем больше электроотрицательность
атома, тем сильнее притягивает он общую
электронную пару. Иначе говоря, при
образовании ковалентной связи между
двумя атомами разных элементов общее
электронное облако смещается к более
электроотрицательному атому, и в тем
большей степени, чем больше различаются
электроотрицательности взаимодействующих
атомов. Значения электроотрицательности
атомов некоторых элементов по отношению
к электроотрицательности фтора, которая
принята равной 4, приведены в табл. 4.5.
Как
показывает табл. 4.5, электроотрицательность
закономерно изменяется в зависимости
от положения элемента в периодической
системе. В начале каждого периода
находятся элементы с наиболее низкой
электроотрицательностью — типичные
металлы, в конце периода (перед благородными
газами) — элементы с наивысшей
электроотрицательностью, т. е. типичные
неметаллы.
У
элементов одной и той же подгруппы
электроотрицательность с ростом заряда
ядра проявляет тенденцию к уменьшению.
Таким образом, чем более типичным
металлом является элемент, тем ниже его
электроотрицательность; чем более
типичным неметаллом является элемент,
тем выше его электроотрицательность.
Смещение
общего электронного облака при образовании
полярной ковалентной связи приводит к
тому, что средняя плотность отрицательного
электрического заряда оказывается выше
вблизи более электроотрицательного
атома и ниже — вблизи менее
электроотрицательного. В результате
первый атом приобретает избыточный
отрицательный, а второй — избыточный
положительный заряд; эти заряды принято
называть эффективными зарядами атомов
в молекуле.
Так,
в молекуле хлористого водорода общая
электронная пара смещена в сторону
более электроотрицательного атома
хлора, что приводит к появлению у атома
хлора эффективного отрицательного
заряда, равного 0,17 заряда электрона, а
у атома водорода такого же по абсолютной
величине эффективного положительного
заряда. Следовательно, молекула НС1
является полярной молекулой. Ее можно
рассматривать как систему из двух равных
по абсолютной величине, но противоположных
по знаку зарядов, расположенных на
определенном расстоянии друг от друга.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Темы кодификатора ЕГЭ: Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Химические связи
Сначала рассмотрим связи, которые возникают между частицами внутри молекул. Такие связи называют внутримолекулярными.
Химическая связь между атомами химических элементов имеет электростатическую природу и образуется за счет взаимодействия внешних (валентных) электронов, в большей или меньшей степени удерживаемых положительно заряженными ядрами связываемых атомов.
Ключевое понятие здесь – ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ. Именно она определяет тип химической связи между атомами и свойства этой связи.
Электроотрицательность χ – это способность атома притягивать (удерживать) внешние (валентные) электроны. Электроотрицательность определяется степенью притяжения внешних электронов к ядру и зависит, преимущественно, от радиуса атома и заряда ядра.
Электроотрицательность сложно определить однозначно. Л.Полинг составил таблицу относительных электроотрицательностей (на основе энергий связей двухатомных молекул). Наиболее электроотрицательный элемент – фтор со значением 4.
Важно отметить, что в различных источниках можно встретить разные шкалы и таблицы значений электроотрицательности. Этого не стоит пугаться, поскольку при образовании химической связи играет роль разность электроотрицательностей атомов, а она примерно одинакова в любой системе.
Если один из атомов в химической связи А:В сильнее притягивает электроны, то электронная пара смещается к нему. Чем больше разность электроотрицательностей атомов, тем сильнее смещается электронная пара.
Если значения электроотрицательностей взаимодействующих атомов равны или примерно равны: ЭО(А)≈ЭО(В), то общая электронная пара не смещается ни к одному из атомов: А : В. Такая связь называется ковалентной неполярной.
Если электроотрицательности взаимодействующих атомов отличаются, но не сильно (разница электроотрицательностей примерно от 0,4 до 2: 0,4<ΔЭО<2), то электронная пара смещается к одному из атомов. Такая связь называется ковалентная полярная.
Если электроотрицательности взаимодействующих атомов отличаются существенно (разница электроотрицательностей больше 2: ΔЭО>2), то один из электронов практически полностью переходит к другому атому, с образованием ионов. Такая связь называется ионная.
Основные типы химических связей — ковалентная, ионная и металлическая связи. Рассмотрим их подробнее.
Ковалентная химическая связь
Ковалентная связь – это химическая связь, образованная за счет образования общей электронной пары А:В. При этом у двух атомов перекрываются атомные орбитали. Ковалентная связь образуется при взаимодействии атомов с небольшой разницей электроотрицательностей (как правило, между двумя неметаллами) или атомов одного элемента.
Основные свойства ковалентных связей
- направленность,
- насыщаемость,
- полярность,
- поляризуемость.
Эти свойства связи влияют на химические и физические свойства веществ.
Направленность связи характеризует химическое строение и форму веществ. Углы между двумя связями называются валентными. Например, в молекуле воды валентный угол H-O-H равен 104,45о, поэтому молекула воды — полярная, а в молекуле метана валентный угол Н-С-Н 109о28′.
Насыщаемость — это способность атомов образовывать ограниченное число ковалентных химических связей. Количество связей, которые способен образовывать атом, называется валентностью.
Полярность связи возникает из-за неравномерного распределения электронной плотности между двумя атомами с различной электроотрицательностью. Ковалентные связи делят на полярные и неполярные.
Поляризуемость связи — это способность электронов связи смещаться под действием внешнего электрического поля (в частности, электрического поля другой частицы). Поляризуемость зависит от подвижности электронов. Чем дальше электрон находится от ядра, тем он более подвижен, соответственно и молекула более поляризуема.
Ковалентная неполярная химическая связь
Существует 2 вида ковалентного связывания – ПОЛЯРНЫЙ и НЕПОЛЯРНЫЙ.
Пример. Рассмотрим строение молекулы водорода H2. Каждый атом водорода на внешнем энергетическом уровне несет 1 неспаренный электрон. Для отображения атома используем структуру Льюиса – это схема строения внешнего энергетического уровня атома, когда электроны обозначаются точками. Модели точечных структур Льюиса неплохо помогают при работе с элементами второго периода.
H. + .H = H:H
Таким образом, в молекуле водорода одна общая электронная пара и одна химическая связь H–H. Эта электронная пара не смещается ни к одному из атомов водорода, т.к. электроотрицательность у атомов водорода одинаковая. Такая связь называется ковалентной неполярной.
Ковалентная неполярная (симметричная) связь – это ковалентная связь, образованная атомами с равной элетроотрицательностью (как правило, одинаковыми неметаллами) и, следовательно, с равномерным распределением электронной плотности между ядрами атомов.
Дипольный момент неполярных связей равен 0.
Примеры: H2 (H-H), O2 (O=O), S8.
Ковалентная полярная химическая связь
Ковалентная полярная связь – это ковалентная связь, которая возникает между атомами с разной электроотрицательностью (как правило, разными неметаллами) и характеризуется смещением общей электронной пары к более электроотрицательному атому (поляризацией).
Электронная плотность смещена к более электроотрицательному атому – следовательно, на нем возникает частичный отрицательный заряд (δ-), а на менее электроотрицательном атоме возникает частичный положительный заряд (δ+, дельта +).
Чем больше различие в электроотрицательностях атомов, тем выше полярность связи и тем больше дипольный момент. Между соседними молекулами и противоположными по знаку зарядами действуют дополнительные силы притяжения, что увеличивает прочность связи.
Полярность связи влияет на физические и химические свойства соединений. От полярности связи зависят механизмы реакций и даже реакционная способность соседних связей. Полярность связи зачастую определяет полярность молекулы и, таким образом, непосредственно влияет на такие физические свойства как температуре кипения и температура плавления, растворимость в полярных растворителях.
Примеры: HCl, CO2, NH3.
Механизмы образования ковалентной связи
Ковалентная химическая связь может возникать по 2 механизмам:
1. Обменный механизм образования ковалентной химической связи – это когда каждая частица предоставляет для образования общей электронной пары один неспаренный электрон:
А. + .В= А:В
2. Донорно-акцепторный механизм образования ковалентной связи – это такой механизм, при котором одна из частиц предоставляет неподеленную электронную пару, а другая частица предоставляет вакантную орбиталь для этой электронной пары:
А: + B= А:В
При этом один из атомов предоставляет неподеленную электронную пару (донор), а другой атом предоставляет вакантную орбиталь для этой пары (акцептор). В результате образования связи оба энергия электронов уменьшается, т.е. это выгодно для атомов.
Ковалентная связь, образованная по донорно-акцепторному механизму, не отличается по свойствам от других ковалентных связей, образованных по обменному механизму. Образование ковалентной связи по донорно-акцепторному механизму характерно для атомов либо с большим числом электронов на внешнем энергетическом уровне (доноры электронов), либо наоборот, с очень малым числом электронов (акцепторы электронов). Более подробно валентные возможности атомов рассмотрены в соответствующей статье.
Ковалентная связь по донорно-акцепторному механизму образуется:
– в молекуле угарного газа CO (связь в молекуле – тройная, 2 связи образованы по обменному механизму, одна – по донорно-акцепторному): C≡O;
– в ионе аммония NH4+, в ионах органических аминов, например, в ионе метиламмония CH3-NH3+;
– в комплексных соединениях, химическая связь между центральным атомом и группами лигандов, например, в тетрагидроксоалюминате натрия Na[Al(OH)4] связь между алюминием и гидроксид-ионами;
– в азотной кислоте и ее солях — нитратах: HNO3, NaNO3, в некоторых других соединениях азота;
– в молекуле озона O3.
Основные характеристики ковалентной связи
Ковалентная связь, как правило, образуется между атомами неметаллов. Основными характеристиками ковалентной связи являются длина, энергия, кратность и направленность.
Кратность химической связи
Кратность химической связи — это число общих электронных пар между двумя атомами в соединении. Кратность связи достаточно легко можно определить из значения валентности атомов, образующих молекулу.
Например, в молекуле водорода H2 кратность связи равна 1, т.к. у каждого водорода только 1 неспаренный электрон на внешнем энергетическом уровне, следовательно, образуется одна общая электронная пара.
В молекуле кислорода O2 кратность связи равна 2, т.к. у каждого атома на внешнем энергетическом уровне есть по 2 неспаренных электрона: O=O.
В молекуле азота N2 кратность связи равна 3, т.к. между у каждого атома по 3 неспаренных электрона на внешнем энергетическом уровне, и атомы образуют 3 общие электронные пары N≡N.
Длина ковалентной связи
Длина химической связи – это расстояние между центрами ядер атомов, образующих связь. Ее определяют экспериментальными физическими методами. Оценить величину длины связи можно примерно, по правилу аддитивности, согласно которому длина связи в молекуле АВ приблизительно равна полусумме длин связей в молекулах А2 и В2:
Длину химической связи можно примерно оценить по радиусам атомов, образующих связь, или по кратности связи, если радиусы атомов не сильно отличаются.
При увеличении радиусов атомов, образующих связь, длина связи увеличится.
Например. В ряду: C–C, C=C, C≡C длина связи уменьшается.
| Связь |
Длина связи, нм |
| H-F | 0,092 |
| H-Cl | 0,128 |
| H-Br | 0,142 |
| H-I | 0,162 |
При увеличении кратности связи между атомами (атомные радиусы которых не отличаются, либо отличаются незначительно) длина связи уменьшится.
Например. В ряду: C–C, C=C, C≡C длина связи уменьшается.
| Связь |
Длина связи, нм |
| С–С | 0,154 |
| С=С | 0,133 |
| С≡С | 0,120 |
Энергия связи
Мерой прочности химической связи является энергия связи. Энергия связи определяется энергией, необходимой для разрыва связи и удаления атомов, образующих эту связь, на бесконечно большое расстояние друг от друга.
Ковалентная связь является очень прочной. Ее энергия составляет от нескольких десятков до нескольких сотен кДж/моль. Чем больше энергия связи, тем больше прочность связи, и наоборот.
Прочность химической связи зависит от длины связи, полярности связи и кратности связи. Чем длиннее химическая связь, тем легче ее разорвать, и тем меньше энергия связи, тем ниже ее прочность. Чем короче химическая связь, тем она прочнее, и тем больше энергия связи.
Например, в ряду соединений HF, HCl, HBr слева направо прочность химической связи уменьшается, т.к. увеличивается длина связи.
Ионная химическая связь
Ионная связь — это химическая связь, основанная на электростатическом притяжении ионов.
Ионы образуются в процессе принятия или отдачи электронов атомами. Например, атомы всех металлов слабо удерживают электроны внешнего энергетического уровня. Поэтому для атомов металлов характерны восстановительные свойства — способность отдавать электроны.
Пример. Атом натрия содержит на 3 энергетическом уровне 1 электрон. Легко отдавая его, атом натрия образует гораздо более устойчивый ион Na+, с электронной конфигурацией благородного газа неона Ne. В ионе натрия содержится 11 протонов и только 10 электронов, поэтому суммарный заряд иона -10+11 = +1:
+11Na )2)8)1 — 1e = +11Na+ )2)8
Пример. Атом хлора на внешнем энергетическом уровне содержит 7 электронов. Чтобы приобрести конфигурацию стабильного инертного атома аргона Ar, хлору необходимо присоединить 1 электрон. После присоединения электрона образуется стабильный ион хлора, состоящий из электронов. Суммарный заряд иона равен -1:
+17Cl )2 )8 )7 + 1e = +17Cl— )2 )8 )8
Обратите внимание:
- Свойства ионов отличаются от свойств атомов!
- Устойчивые ионы могут образовывать не только атомы, но и группы атомов. Например: ион аммония NH4+, сульфат-ион SO42- и др. Химические связи, образованные такими ионами, также считаются ионными;
- Ионную связь, как правило, образуют между собой металлы и неметаллы (группы неметаллов);
Образовавшиеся ионы притягиваются за счет электрического притяжения: Na+Cl—, Na2+ SO42-.
Наглядно обобщим различие между ковалентными и ионным типами связи:
Металлическая химическая связь
Металлическая связь — это связь, которую образуют относительно свободные электроны между ионами металлов, образующих кристаллическую решетку.
У атомов металлов на внешнем энергетическом уровне обычно расположены от одного до трех электронов. Радиусы у атомов металлов, как правило, большие — следовательно, атомы металлов, в отличие от неметаллов, достаточно легко отдают наружные электроны, т.е. являются сильными восстановителями.
Отдавая электроны, атомы металлов превращаются в положительно заряженные ионы. Оторвавшиеся электроны относительно свободно перемещаются между положительно заряженными ионами металлов. Между этими частицами возникает связь, т.к. общие электроны удерживают катионы металлов, расположенные слоями, вместе, создавая таким образом достаточно прочную металлическую кристаллическую решетку. При этом электроны непрерывно хаотично двигаются, т.е. постоянно возникают новые нейтральные атомы и новые катионы.
Межмолекулярные взаимодействия
Отдельно стоит рассмотреть взаимодействия, возникающие между отдельными молекулами в веществе — межмолекулярные взаимодействия. Межмолекулярные взаимодействия — это такой вид взаимодействия между нейтральными атомами, при котором не появляются новые ковалентные связи. Силы взаимодействия между молекулами обнаружены Ван-дер Ваальсом в 1869 году, и названы в честь него Ван-дар-Ваальсовыми силами. Силы Ван-дер-Ваальса делятся на ориентационные, индукционные и дисперсионные. Энергия межмолекулярных взаимодействий намного меньше энергии химической связи.
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Особый вид межмолекулярного взаимодействия — водородные связи. Водородные связи — это межмолекулярные (или внутримолекулярные) химические связи, возникающие между молекулами, в которых есть сильно полярные ковалентные связи — H-F, H-O или H-N. Если в молекуле есть такие связи, то между молекулами будут возникать дополнительные силы притяжения.
Механизм образования водородной связи частично электростатический, а частично — донорно–акцепторный. При этом донором электронной пары выступают атом сильно электроотрицательного элемента (F, O, N), а акцептором — атомы водорода, соединенные с этими атомами. Для водородной связи характерны направленность в пространстве и насыщаемость.
Водородную связь можно обозначать точками: Н ··· O. Чем больше электроотрицательность атома, соединенного с водородом, и чем меньше его размеры, тем крепче водородная связь. Она характерна прежде всего для соединений фтора с водородом, а также кислорода с водородом, в меньшей степени азота с водородом.
Водородные связи возникают между следующими веществами:
— фтороводород HF (газ, раствор фтороводорода в воде — плавиковая кислота), вода H2O (пар, лед, жидкая вода):
— раствор аммиака и органических аминов — между молекулами аммиака и воды;
— органические соединения, в которых связи O-H или N-H: спирты, карбоновые кислоты, амины, аминокислоты, фенолы, анилин и его производные, белки, растворы углеводов — моносахаридов и дисахаридов.
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение температуры кипения.
Например, как правило, при повышении молекулярной массы наблюдается повышение температуры кипения веществ. Однако в ряду веществ H2O-H2S-H2Se-H2Te мы не наблюдаем линейное изменение температур кипения.
А именно, у воды температура кипения аномально высокая — не меньше -61оС, как показывает нам прямая линия, а намного больше, +100 оС. Эта аномалия объясняется наличием водородных связей между молекулами воды. Следовательно, при обычных условиях (0-20оС) вода является жидкостью по фазовому состоянию.
Тренировочный тест по теме «Химические связи» — 10 вопросов, при каждом прохождении новые.
519
Создан на
07 января, 2022 От Admin
Тренировочный тест «Химические связи»
1 / 10
Из предложенного перечня выберите два вещества, в которых одновременно присутствуют ковалентная неполярная и ионная химическая связи.
1) тетрахлорметан
2) ацетиленид натрия
3) оксид фосфора(III)
4) бензоат калия
5) глицерин
2 / 10
Из предложенного перечня выберите два вещества с атомной кристаллической решёткой.
1) сульфид бария
2) ромбическая сера
3) оксид кремния
4) гидроксид калия
5) карбид кремния
3 / 10
Из предложенного перечня выберите два вещества, которые имеют молекулярную кристаллическую решётку.
1) графит
2) цезий
3) фтор
4) кислород
5) кремнезём
4 / 10
Из предложенного перечня выберите два соединения, в которых присутствует ковалентная неполярная химическая связь.
1) PCl3
2) HBr
3) F2
4) H2O2
5) Ba(OH)2
5 / 10
Из предложенного перечня веществ выберите два вещества, которые в твёрдом состоянии имеют молекулярную кристаллическую решётку.
1) оксид серы (IV)
2) ацетальдегид
3) кремнезем
4) калий
5) формиат калия
6 / 10
Из предложенного перечня веществ выберите два соединения, в которых присутствует ионная связь.
1) хлороводород
2) хлорид натрия
3) оксид серый(IV)
4) аммиак
5) оксид натрия
7 / 10
Из предложенного перечня выберите два вещества, в которых есть связи, образованные по донорно-акцепторному механизму.
1) СО
2) PH3
3) CaO
4) CH3COONH4
5) KHS
Запишите номера выбранных ответов.
8 / 10
Из предложенного перечня выберите два вещества немолекулярного строения.
1) Al4C3
2) C3H8O3
3) CH3ONa
4) H2SO4
5) P4
9 / 10
Из предложенного перечня выберите два вещества, в которых присутствует ковалентная полярная химическая связь.
1) оксид бария
2) фторид натрия
3) фторид серы(VI)
4) сульфат магния
5) ромбическая сера
10 / 10
Из предложенного перечня выберите два вещества, в которых присутствует ковалентная полярная химическая связь.
1) оксид кремния
2) оксид бария
3) бромид бария
4) нитрат бария
5) белый фосфор
Ваша оценка
The average score is 43%
$begingroup$
I know that the U atom has four unpaired electrons. Therefore it has a total spin S of 2. This means its multiplicity is 2S+1 = 5.
Now consider a complicated molecule such as $UF_6$. In theory all I need to do is calculate how many unpaired electrons exist and then for each un paired electron assign a value of 0.5 in order to get the toal spin S and then use the fact that the multiplicity is 2S +1.
However when dealing with d and f block elements things get much trickier and I am unable to work the multiplicity out.
Is there a straighforward way to determine the multiplicity of $UF_6$, or better still an online database that contains this information for many different molecules (as I would also like to eventually determine the multiplicities of Uranium and Tungsten oxides) .
Thanks.
Nike Dattani
31.6k4 gold badges91 silver badges221 bronze badges
asked Jul 29, 2021 at 19:27
$endgroup$
$begingroup$
With metals, they can often exist as different multiplicities depending on the compound they are in and it is not always simple to predict the correct multiplicity. More often than not, determining the multiplicity of the ground state is either done experimentally or by comparing the energies of likely multiplicities computationally.
In your case, it seems be to well established [1-3] that $ce{UF6}$ has a closed shell (and thus singlet) ground state. For other metal compounds, you should generally seek out an experimental value first and if you can’t find one, you will essentially need to brute force the problem, calculating all possible multiplicities to determine which is the global minimum.
- P. Jeffrey Hay , «Ab initio studies of excited states of polyatomic molecules including spin‐orbit and multiplet effects: The electronic states of UF6», The Journal of Chemical Physics 79, 5469-5482 (1983) https://doi.org/10.1063/1.445665
- Fan Wei, Guo-Shi Wu, W. H. Eugen Schwarz, and Jun Li «Excited States and Absorption Spectra of UF6: A RASPT2 Theoretical Study with Spin–Orbit Coupling»
Journal of Chemical Theory and Computation 2011 7 (10), 3223-3231
https://doi.org/10.1021/ct2000233 - Shao-Wen Hu, Xiang-Yun Wang, Tai-Wei Chu, and Xin-Qi Liu
The Journal of Physical Chemistry A 2008 112 (37), 8877-8883
https://doi.org/10.1021/jp804797a
answered Jul 29, 2021 at 19:44
Tyberius♦Tyberius
14.7k4 gold badges27 silver badges118 bronze badges
$endgroup$
3
$begingroup$
To obtain the spin multiplicity of the ground electronic state of a molecule, can be extremely hard.
In your question you mentioned $ce{UF6}$ which has 7 atoms, and not all of them being of the same element. But even for a very simple homonuclear (all atoms being of the same element) diatomic molecule like $ce{Fe2}$, my answer to «Total spin and/or multiplicity for transition metal ions?» shows that several papers from 1975-2015 were dedicated to trying to figure out the ground state spin configuration and still there was no consensus.
A table that I presented in my answer to «How to determine occupied and closed orbitals for a Molpro CASSCF calculation?» shows that $ce{Fe2}$ is not the only homonuclear diatomic molecule for which the spin state remained unknown even after more than a century of modern spectroscopy and quantum mechanics.
Unfortunately to determine the ground state spin multiplicity of a complicated molecule, one needs to either:
-
calculate many energies of the molecule, each time assuming a different spin multiplicity, until you have considered all of the possible candidates, and pick the one that has the lowest energy; or
-
do spectroscopy experiments and find the ground state (most stable version of the molecule) that way.
answered Jul 29, 2021 at 21:25
Nike DattaniNike Dattani
31.6k4 gold badges91 silver badges221 bronze badges
$endgroup$
You must log in to answer this question.
Not the answer you’re looking for? Browse other questions tagged
.
Not the answer you’re looking for? Browse other questions tagged
.
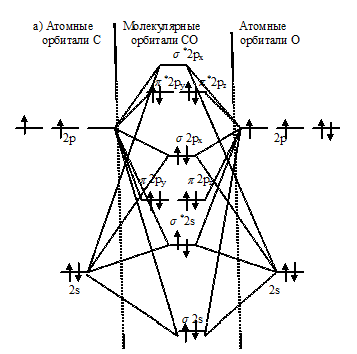
Описание электронного строения молекул с позиций методов валентных связей и молекулярных орбиталей
Задача 241.
Описать электронное строение молекул СО и СN с позиций методов ВС и МО. Какая из молекул характеризуется большей кратностью связи?
Решение:
а) Электронное строение молекул CO и CN с позиции метода ВС.
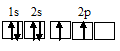
Электронная конфигурация атома углерода 1s22s22p2, атома кислорода 1s22s22p4, атома азота 1s22s22p3. Электронное строение их валентных орбиталей в невозбуждённом состоянии может быть представлено следующими графическими схемами:
а) атом углерода:
б) атом азота:
При возбуждении атом углерода переходит в состояние 1s22s12p3, а электронное строение его валентных орбиталей соответствует схеме:
Два неспаренных электрона невозбуждённого атома углерода могут участвовать в образовании двух ковалентных связей по обычному механизму с атомом кислорода, имеющем два неспаренных электрона, с образованием молекулы СО. При образовании молекулы CN образуются две ковалентные связи по обычному механизму за счёт двух неспаренных электрона атома углерода и двух неспаренных электронов атома азота. Электронные схемы CO и CN:
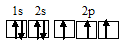
б) Электронное строение молекул CO и CN с позиции метода МО.
Энергетические схемы образования молекул а) CO и б) CN:
Из приведённых схем следует, что кратность связи в молекуле СО равна 3 [(6 — 0)/2 = 3], а в молекуле NO – 2,5[(5 – 0)/2 = 2,5]. Следовательно, молекула СО по отношению к молекуле NO характеризуется большей устойчивостью, чем больше кратность связи, тем короче связь. Молекула СN имеет один неспаренный электрон на связывающей орбитали, следовательно, она парамагнитна. Молекула СО не имеет неспаренных электронов на связывающих и разрыхляющих орбиталях, значит, она диамагнитна.
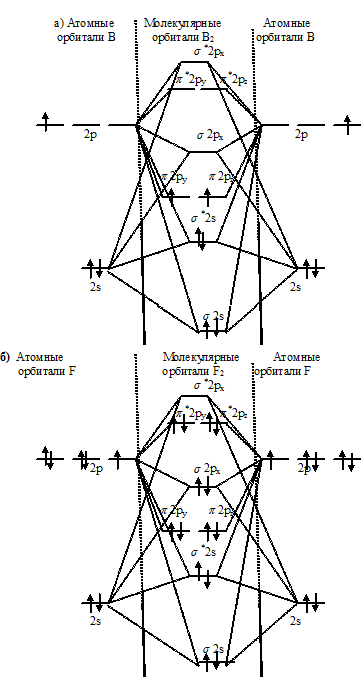
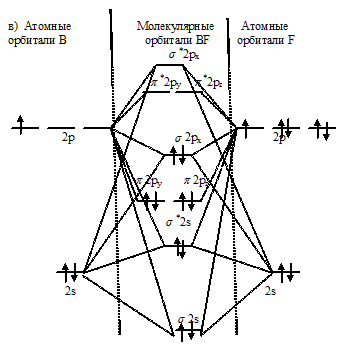
Задача 242.
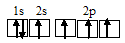
Рассмотреть с позиций метода МО возможность образования молекул В2, F2, BF. Какая из этих молекул наиболее устойчива?
Решение:
Энергетические схемы образования молекул а)В2, б) F2, в) BF:
Из составленных энергетических схем В2, F2, BF вытекает, что разность между числом связывающих и разрыхляющих электронов соответственно равны 2, 2 и 6, что отвечает кратности связи соответственно 1, 1 и 3. Следовательно, молекула BF характеризуется большей кратностью связи между атомами, она должна быть более прочной, чем у В2 и F2.