From Wikipedia, the free encyclopedia
- Subcritical ethane, liquid and gas phase coexist.
- Critical point (32.17 °C, 48.72 bar), opalescence.
- Supercritical ethane, fluid.[1]
In thermodynamics, a critical point (or critical state) is the end point of a phase equilibrium curve. One example is the liquid–vapor critical point, the end point of the pressure–temperature curve that designates conditions under which a liquid and its vapor can coexist. At higher temperatures, the gas cannot be liquefied by pressure alone. At the critical point, defined by a critical temperature Tc and a critical pressure pc, phase boundaries vanish. Other examples include the liquid–liquid critical points in mixtures, and the ferromagnet–paramagnet transition (Curie temperature) in the absence of an external magnetic field.[2]
Liquid–vapor critical point[edit]
Overview[edit]
The liquid–vapor critical point in a pressure–temperature phase diagram is at the high-temperature extreme of the liquid–gas phase boundary. The dashed green line shows the anomalous behavior of water.
For simplicity and clarity, the generic notion of critical point is best introduced by discussing a specific example, the vapor–liquid critical point. This was the first critical point to be discovered, and it is still the best known and most studied one.
The figure to the right shows the schematic PT diagram of a pure substance (as opposed to mixtures, which have additional state variables and richer phase diagrams, discussed below). The commonly known phases solid, liquid and vapor are separated by phase boundaries, i.e. pressure–temperature combinations where two phases can coexist. At the triple point, all three phases can coexist. However, the liquid–vapor boundary terminates in an endpoint at some critical temperature Tc and critical pressure pc. This is the critical point.
The critical point of water occurs at 647.096 K (373.946 °C; 705.103 °F) and 22.064 megapascals (3,200.1 psi; 217.75 atm; 220.64 bar).[3]
In the vicinity of the critical point, the physical properties of the liquid and the vapor change dramatically, with both phases becoming even more similar. For instance, liquid water under normal conditions is nearly incompressible, has a low thermal expansion coefficient, has a high dielectric constant, and is an excellent solvent for electrolytes. Near the critical point, all these properties change into the exact opposite: water becomes compressible, expandable, a poor dielectric, a bad solvent for electrolytes, and mixes more readily with nonpolar gases and organic molecules.[4]
At the critical point, only one phase exists. The heat of vaporization is zero. There is a stationary inflection point in the constant-temperature line (critical isotherm) on a PV diagram. This means that at the critical point:[5][6][7]
Isotherms of a gas. The red line is the critical isotherm, with critical point K. The dashed lines represent parts of isotherms which are forbidden since the gradient would be positive, giving the gas in this region a negative compressibility.
Above the critical point there exists a state of matter that is continuously connected with (can be transformed without phase transition into) both the liquid and the gaseous state. It is called supercritical fluid. The common textbook knowledge that all distinction between liquid and vapor disappears beyond the critical point has been challenged by Fisher and Widom,[8] who identified a p–T line that separates states with different asymptotic statistical properties (Fisher–Widom line).
Sometimes[ambiguous] the critical point does not manifest in most thermodynamic or mechanical properties, but is «hidden» and reveals itself in the onset of inhomogeneities in elastic moduli, marked changes in the appearance and local properties of non-affine droplets, and a sudden enhancement in defect pair concentration.[9]
History[edit]
Critical carbon dioxide exuding fog while cooling from supercritical to critical temperature.
The existence of a critical point was first discovered by Charles Cagniard de la Tour in 1822[10][11] and named by Dmitri Mendeleev in 1860[12][13] and Thomas Andrews in 1869.[14] Cagniard showed that CO2 could be liquefied at 31 °C at a pressure of 73 atm, but not at a slightly higher temperature, even under pressures as high as 3000 atm.
Theory[edit]
Solving the above condition 
However, the van der Waals equation, based on a mean-field theory, does not hold near the critical point. In particular, it predicts wrong scaling laws.
To analyse properties of fluids near the critical point, reduced state variables are sometimes defined relative to the critical properties[15]
The principle of corresponding states indicates that substances at equal reduced pressures and temperatures have equal reduced volumes. This relationship is approximately true for many substances, but becomes increasingly inaccurate for large values of pr.
For some gases, there is an additional correction factor, called Newton’s correction, added to the critical temperature and critical pressure calculated in this manner. These are empirically derived values and vary with the pressure range of interest.[16]
Table of liquid–vapor critical temperature and pressure for selected substances[edit]
| Substance[17][18] | Critical temperature | Critical pressure (absolute) |
|---|---|---|
| Argon | −122.4 °C (150.8 K) | 48.1 atm (4,870 kPa) |
| Ammonia (NH3)[19] | 132.4 °C (405.5 K) | 111.3 atm (11,280 kPa) |
| R-134a | 101.06 °C (374.21 K) | 40.06 atm (4,059 kPa) |
| R-410A | 72.8 °C (345.9 K) | 47.08 atm (4,770 kPa) |
| Bromine | 310.8 °C (584.0 K) | 102 atm (10,300 kPa) |
| Caesium | 1,664.85 °C (1,938.00 K) | 94 atm (9,500 kPa) |
| Chlorine | 143.8 °C (416.9 K) | 76.0 atm (7,700 kPa) |
| Ethane (C2H6) | 31.17 °C (304.32 K) | 48.077 atm (4,871.4 kPa) |
| Ethanol (C2H5OH) | 241 °C (514 K) | 62.18 atm (6,300 kPa) |
| Fluorine | −128.85 °C (144.30 K) | 51.5 atm (5,220 kPa) |
| Helium | −267.96 °C (5.19 K) | 2.24 atm (227 kPa) |
| Hydrogen | −239.95 °C (33.20 K) | 12.8 atm (1,300 kPa) |
| Krypton | −63.8 °C (209.3 K) | 54.3 atm (5,500 kPa) |
| Methane (CH4) | −82.3 °C (190.8 K) | 45.79 atm (4,640 kPa) |
| Neon | −228.75 °C (44.40 K) | 27.2 atm (2,760 kPa) |
| Nitrogen | −146.9 °C (126.2 K) | 33.5 atm (3,390 kPa) |
| Oxygen (O2) | −118.6 °C (154.6 K) | 49.8 atm (5,050 kPa) |
| Carbon dioxide (CO2) | 31.04 °C (304.19 K) | 72.8 atm (7,380 kPa) |
| Nitrous oxide (N2O) | 36.4 °C (309.5 K) | 71.5 atm (7,240 kPa) |
| Sulfuric acid (H2SO4) | 654 °C (927 K) | 45.4 atm (4,600 kPa) |
| Xenon | 16.6 °C (289.8 K) | 57.6 atm (5,840 kPa) |
| Lithium | 2,950 °C (3,220 K) | 652 atm (66,100 kPa) |
| Mercury | 1,476.9 °C (1,750.1 K) | 1,720 atm (174,000 kPa) |
| Sulfur | 1,040.85 °C (1,314.00 K) | 207 atm (21,000 kPa) |
| Iron | 8,227 °C (8,500 K) | |
| Gold | 6,977 °C (7,250 K) | 5,000 atm (510,000 kPa) |
| Aluminium | 7,577 °C (7,850 K) | |
| Water (H2O)[3][20] | 373.946 °C (647.096 K) | 217.7 atm (22,060 kPa) |
Mixtures: liquid–liquid critical point[edit]
A plot of typical polymer solution phase behavior including two critical points: a LCST and an UCST
The liquid–liquid critical point of a solution, which occurs at the critical solution temperature, occurs at the limit of the two-phase region of the phase diagram. In other words, it is the point at which an infinitesimal change in some thermodynamic variable (such as temperature or pressure) leads to separation of the mixture into two distinct liquid phases, as shown in the polymer–solvent phase diagram to the right. Two types of liquid–liquid critical points are the upper critical solution temperature (UCST), which is the hottest point at which cooling induces phase separation, and the lower critical solution temperature (LCST), which is the coldest point at which heating induces phase separation.
Mathematical definition[edit]
From a theoretical standpoint, the liquid–liquid critical point represents the temperature–concentration extremum of the spinodal curve (as can be seen in the figure to the right). Thus, the liquid–liquid critical point in a two-component system must satisfy two conditions: the condition of the spinodal curve (the second derivative of the free energy with respect to concentration must equal zero), and the extremum condition (the third derivative of the free energy with respect to concentration must also equal zero or the derivative of the spinodal temperature with respect to concentration must equal zero).
See also[edit]
- Conformal field theory
- Critical exponent
- Critical phenomena (more advanced article)
- Critical points of the elements (data page)
- Curie point
- Joback method, Klincewicz method, Lydersen method (estimation of critical temperature, pressure, and volume from molecular structure)
- Liquid–liquid critical point
- Lower critical solution temperature
- Néel point
- Percolation thresholds
- Phase transition
- Rushbrooke inequality
- Scale invariance
- Self-organized criticality
- Supercritical fluid, Supercritical drying, Supercritical water oxidation, Supercritical fluid extraction
- Tricritical point
- Triple point
- Upper critical solution temperature
- Widom scaling
References[edit]
- ^ Horstmann, Sven (2000). Theoretische und experimentelle Untersuchungen zum Hochdruckphasengleichgewichtsverhalten fluider Stoffgemische für die Erweiterung der PSRK-Gruppenbeitragszustandsgleichung [Theoretical and experimental investigations of the high-pressure phase equilibrium behavior of fluid mixtures for the expansion of the PSRK group contribution equation of state] (Ph.D.) (in German). Oldenburg, Germany: Carl-von-Ossietzky Universität Oldenburg. ISBN 3-8265-7829-5. OCLC 76176158.
- ^ Stanley, H. Eugene (1987). Introduction to phase transitions and critical phenomena. New York: Oxford University Press. ISBN 0-19-505316-8. OCLC 15696711.
- ^ a b Wagner, W.; Pruß, A. (June 2002). «The IAPWS Formulation 1995 for the Thermodynamic Properties of Ordinary Water Substance for General and Scientific Use». Journal of Physical and Chemical Reference Data. 31 (2): 398. doi:10.1063/1.1461829.
- ^ Anisimov, Sengers, Levelt Sengers (2004):
Near-critical behavior of aqueous systems.
Chapter 2 in
Aqueous System at Elevated Temperatures and Pressures
Palmer et al., eds.
Elsevier. - ^ a b P. Atkins and J. de Paula, Physical Chemistry, 8th ed. (W. H. Freeman 2006), p. 21.
- ^ K. J. Laidler and J. H. Meiser, Physical Chemistry (Benjamin/Cummings 1982), p. 27.
- ^ P. A. Rock, Chemical Thermodynamics (MacMillan 1969), p. 123.
- ^ Fisher, Michael E.; Widom, B. (1969). «Decay of Correlations in Linear Systems». Journal of Chemical Physics. 50 (9): 3756. Bibcode:1969JChPh..50.3756F. doi:10.1063/1.1671624. Retrieved 9 January 2023.
- ^ Das, Tamoghna; Ganguly, Saswati; Sengupta, Surajit; Rao, Madan (3 June 2015). «Pre-Yield Non-Affine Fluctuations and A Hidden Critical Point in Strained Crystals». Scientific Reports. 5 (1): 10644. Bibcode:2015NatSR…510644D. doi:10.1038/srep10644. PMC 4454149. PMID 26039380.
- ^ Charles Cagniard de la Tour (1822). «Exposé de quelques résultats obtenu par l’action combinée de la chaleur et de la compression sur certains liquides, tels que l’eau, l’alcool, l’éther sulfurique et l’essence de pétrole rectifiée» [Presentation of some results obtained by the combined action of heat and compression on certain liquids, such as water, alcohol, sulfuric ether (i.e., diethyl ether), and distilled petroleum spirit]. Annales de Chimie et de Physique (in French). 21: 127–132.
- ^ Berche, B., Henkel, M., Kenna, R (2009) Critical phenomena: 150 years since Cagniard de la Tour. Journal of Physical Studies 13 (3), pp. 3001-1–3001-4.
- ^ Mendeleev called the critical point the «absolute temperature of boiling» (Russian: абсолютная температура кипения; German: absolute Siedetemperatur).
- Менделеев, Д. (1861). «О расширении жидкостей от нагревания выше температуры кипения» [On the expansion of liquids from heating above the temperature of boiling]. Горный Журнал [Mining Journal] (in Russian). 4: 141–152. The «absolute temperature of boiling» is defined on p. 151. Available at Wikimedia
- German translation: Mendelejeff, D. (1861). «Ueber die Ausdehnung der Flüssigkeiten beim Erwärmen über ihren Siedepunkt» [On the expansion of fluids during heating above their boiling point]. Annalen der Chemie und Pharmacie (in German). 119: 1–11. doi:10.1002/jlac.18611190102. The «absolute temperature of boiling» is defined on p. 11: «Als absolute Siedetemperatur müssen wir den Punkt betrachten, bei welchem 1) die Cohäsion der Flüssigkeit = 0° ist und a2 = 0, bei welcher 2) die latente Verdamfungswärme auch = 0 ist und bei welcher sich 3) die Flüssigkeit in Dampf verwandelt, unabhängig von Druck und Volum.» (As the «absolute temperature of boiling» we must regard the point at which (1) the cohesion of the liquid equals 0° and a2 = 0 [where a2 is the coefficient of capillarity, p. 6], at which (2) the latent heat of vaporization also equals zero, and at which (3) the liquid is transformed into vapor, independently of the pressure and the volume.)
- In 1870, Mendeleev asserted, against Thomas Andrews, his priority regarding the definition of the critical point: Mendelejeff, D. (1870). «Bemerkungen zu den Untersuchungen von Andrews über die Compressibilität der Kohlensäure» [Comments on Andrews’ investigations into the compressibility of carbon dioxide]. Annalen der Physik. 2nd series (in German). 141 (12): 618–626. Bibcode:1870AnP…217..618M. doi:10.1002/andp.18702171218.
- ^ Landau, Lifshitz, Theoretical Physics, Vol. V: Statistical Physics, Ch. 83 [German edition 1984].
- ^ Andrews, Thomas (1869). «The Bakerian lecture: On the continuity of the gaseous and liquid states of matter». Philosophical Transactions of the Royal Society. London. 159: 575–590. doi:10.1098/rstl.1869.0021. The term «critical point» appears on page 588.
- ^ Cengel, Yunus A.; Boles, Michael A. (2002). Thermodynamics: an engineering approach. Boston: McGraw-Hill. pp. 91–93. ISBN 978-0-07-121688-3.
- ^ Maslan, Frank D.; Littman, Theodore M. (1953). «Compressibility Chart for Hydrogen and Inert Gases». Ind. Eng. Chem. 45 (7): 1566–1568. doi:10.1021/ie50523a054.
- ^ Emsley, John (1991). The Elements (Second ed.). Oxford University Press. ISBN 978-0-19-855818-7.
- ^ Cengel, Yunus A.; Boles, Michael A. (2002). Thermodynamics: An Engineering Approach (Fourth ed.). McGraw-Hill. pp. 824. ISBN 978-0-07-238332-4.
- ^ «Ammonia – NH3 – Thermodynamic Properties». www.engineeringtoolbox.com. Retrieved 2017-04-07.
- ^ «Critical Temperature and Pressure». Purdue University. Retrieved 2006-12-19.
Further reading[edit]
- «Revised Release on the IAPWS Industrial Formulation 1997 for the Thermodynamic Properties of Water and Steam» (PDF). International Association for the Properties of Water and Steam. August 2007. Retrieved 2009-06-09.
- «Critical points for some common solvents». ProSciTech. Archived from the original on 2008-01-31.
- «Critical Temperature and Pressure». Department of Chemistry. Purdue University. Retrieved 2006-12-03.
Для систем теплоснабжения, отопления, вентиляции и кондиционирования воздуха представляют интерес различные области состояний воды и водяного пара. Относительно низкие параметры характерны для отопления, вентиляции и кондиционирования воздуха вода и насыщенный пар используются здесь как теплоносители в отопительных системах вода имеет температуру 65— 150 °С, насыщенный пар имеет давление 0,1—0,3 МПа. Основной рабочей средой в системах вентиляции и кондиционирования воздуха является влажный воздух, в состав которого входит перегретый или насыщенный водяной пар с температурой менее 100°С. Что касается теплоснабжения и котельных установок, то здесь параметры выще в котлах для централизованного теплоснабжения вырабатывается насыщенный пар с давлением до 4 М.Па, перегретый пар может достигать температуры 250 или 440 °С. Параметры пара перед паровыми турбинами ТЭЦ могут достигнуть 13 МПа и 565 °С и даже быть закритическими 24 МПа и 565 °С (оба параметра выше критических значений). Широко используются насыщенный пар с давлением около 1,4 МПа и вода с температурой 150—180 °С (иод соответствующим давлением для предотвращения вскипания). [c.121]
Плотность исследуемого вещества при опытных значениях параметров состояния определялась нн ЭЦВМ по Международной системе уравнений состояния для точного описания термодинамических свойств воды и водяного пара [3]. По проведенным оценкам, максимальная относительная погрешность измерений коэффициента динамической вязкости почти во всем диапазоне исследованных давлений и температур не превышает 1%. Исключение составляют опытные данные для давлений, близких к критическому (205—220 бар), где значения удельных объемов на линии насыщения имеют допуск 2—3%. Воспроизводимость опытных данных при всех параметрах не хуже 0,3%, что свидетельствует о малой величине случайных ошибок. [c.58]
Рассмотрим 7—5-диаграмму водяного пара (рис. 7.3). Общие свойства этой диаграммы были описаны ранее (см. 18). Т—5-диаграмма строится по данным специальных таблиц, содержащих параметры Т, 5 и 5″, полученные на основании опытов и теоретических исследований. Так как энтропия воды в тройной точке, т. е. при = 0,01°С (7 = 273,16 К), обычно принимается равной нулю, это состояние в 7—5-диаграмме соответствует точке М. Откладывая для разных температур 7 значения 5 и 5″, получим нижнюю (х = 0) и верхнюю (х=1) пограничные кривые с критической точкой К, соединяющей их. [c.85]
Это не означает, что становятся ненужными мероприятия, направленные на повышение рабочих температур пара. Любой успех здесь крайне важен, однако в современных паровых турбинах достигнуты практически предельные параметры. Использование насыщенного пара с температурой свыше 260 С сопровождается большими трудностями, так как для этого требуется создать слишком высокое давление. Вода — вещество с не самыми лучшими термодинамическими свойствами. Вода имеет низкую критическую температуру (647,4 К), и необходим перегрев, чтобы можно было обеспечить высокие рабочие температуры пара, позволяющие добиться хорошего КПД. Для воды характерно высокое критическое давление (21,83 МПа), поэтому при работе с насыщенным паром необходимо сооружать очень дорогие трубопроводы, а при работе оборудования на перегретом паре система трубопроводов становится более протяженной, хотя массу самих труб можно уменьшить. При температуре конденсации упругость водяного пара очень мала (0,00174 МПа при 16°С), из-за чего необходимо устанавливать на конденсаторах дорогостоящие вакуум-насосы. Наконец, жидкая вода имеет высокую теплоемкость, поэтому требуется затрачивать большое количество дополнительной теплоты при более низких температурах воды, чтобы поднять ее температуру до приемлемого рабочего значения. [c.227]
В некоторых частных случаях физические свойства конкретных веществ позволяют построить интерполяционные зависимости, упрощающие определение параметров критического состояния. Например, влажные пары воды и ртути в наиболее существенной для практики области состояний обнаруживают следующие свойства. У насыщенного водяного пара в пределах начальных давлений от 0,07 до 90 бар и значений начальной степени сухости Хд = [c.98]
В послевоенные годы продолжалась работа над усовершенствованием прямоточных котлов. Поскольку прямоточные котлы не имеют естественной циркуляции, они наиболее приспособлены к работе при сверхвысоком давлении пара (выше 150 ата), когда разность удельных весов пара и воды мала. Для пара при давлении выше критического (225 ата) прямоточный принцип является единственно возможным. В послевоенные годы построены опытный котел на 300 ата и 600° С и крупные прямоточные котлы для электростанций на сверхвысокие параметры водяного пара. [c.149]
По мере приближения к критическому состоянию различие между водой и паром (а для других рабочих тел между жидкостью и ее паром) все уменьшается, в частности уменьшается разность удельных объемов пара и воды. При критическом давлении различие между водой и паром исчезает совсем, удельные объемы пара и воды становятся равными вода и пар в этом состоянии обладают одинаковыми свойствами. Критическому состоянию соответствуют следующие значения параметров водяного пара, называемых критическими [c.127]
Заключение. Дано стационарное решение задачи о движении фаз в геотермальной системе, когда слой воды располагается над слоем пара и предполагается малость конвективного переноса энергии по сравнению с кондуктивным. Проведенное исследование нормальной устойчивости решения показывает, что в допустимом диапазоне параметров решение всегда устойчиво, за исключением изолированного решения покоя при проницаемостях А > 2.5-см . Таким образом, критерием устойчивости является критерий малости конвективного переноса тепла. Этот факт позволяет понять физический механизм устойчивости, который состоит в том, что возмущения границы и проникновение водяных «пальцев» в область пара предотвращается доминирующим кондуктивным подтоком тепла, приводящим к испарению жидкой фазы. Расчеты показывают, что существуют устойчивые решения, соответствующие значениям проницаемости /с 10 м , что на полтора порядка превосходят критическое значение, приведенное в работе [4]. При более высоких проницаемостях роль конвективного переноса тепла возрастает и использование невозмущенного решения становится неправомерным. Однако естественно выдвинуть предположение, что увеличение проницаемости не сразу приведет к возникновению неустойчивости, т.е. в реальности слой воды может устойчиво существовать над слоем пара в геотермальных системах и при более высоких проницаемостях пород в течение некоторого времени. [c.11]
Наибольшее значение термического КПД цикла может быть получено при максимально высоких температурах подводимой теплоты, что подтверждается проведенным выше анализом зависимости КПД паровых циклов от параметров рабочего агента. Однако для создания реальных циклов и реализации указанных преимуществ требуются особые природные свойства рабочего тела, так как в отличие от цикла Карно в цикле Ренкина качество рабочего тела существенно влияет на термический КПД установки. Наиболее часто в качестве рабочего тела в современных энергетических паровых установках испольаус-ся водяной пар. Однако вода по своим свойствам не может удовлетворять всем требованиям, предъявляемым к рабочим телам о целью увеличения КПД. Прежде всего она имеет низкую критическую темпера-туру (Т р 647.15 К) и при этом достаточно большое критическое давление р р = 22,219 МПа. При таких физических свойствах воды и водяного пара при росте температуры перегрева не удается существенно повысить среднюю температуру подводимой теплоты. Вода имеет слишком большое значение удельной теплоемкости, а это, как [c.318]
Второе направление эмпирическое. На основе ряда теоретических положений путем обработки экспериментальных данных получен ряд эмпирических и полуэмпи-рических уравнений, описывающих свойства воды и водяного пара в разных областях состояния с различной степенью точности. Большинство этих уравнений обладает рядом общих недостатков параметры вблизи линии насыщения при больших давлениях, в критической и околокритической области, пригодны для сравнительно узких областей состояния, недостаточно термодинамически согласованы. К ним относятся интерполяционные [c.12]
Обычная вода. Международная ассоциация по свойствам водяного пара (МАСПВ) приняла в 1977 г. новый стандарт по теплопроводности воды и водяного пара. Он содержит уточненные данные, особенно в области высоких давлений и в критической области, и охватывает значительно большую область параметров по сравнению с существовавшими международными скелетньют таблицами [c.59]
Если провести линии через точки одинаковых характерных состояний (рис. 3-1), то получим три кривые /, // и ///. Линия / соединит все точки, характеризующие состояние воды при 0° С и разных давлениях. Так как мы исходим из предположения, что вода несжимаема, эта линия должна быть параллельна оси ординат. Линия II представляет собой геометрическое место точек, характеризующих воду в состоянии кипения при разных давлениях, а линия III — точек, характеризующих сухой насыщенный пар. Эти две линии соединяются в точке /<. Это значит, что при некотором давлении нет прямолинейного участка перехода воды в пар. Очевидно, что в этой точке кипящая вода и сухой насыщенный пар обладают одними и теми же параметрами состояния. Эта точка называется критической точкой. Все параметры ее называются критическими и имеют для водяного пара следующие значения критическое давление = 221,145 бар критическая температура 4р = 374,116° С критический удельный объем у р = 0,003145 м 1кг, критическая энтальпия /кр = == 2094,8 кдж1кг. [c.110]
В [126] была предложена другая модель процесса спонтанной конденсации с добавками. Согласно этой модели принимается, что смесь паров воды и ОДА расширяется изоэнтропно. Наличие в паре ОДА в количествах до 10- кг на 1 кг пара оказывает заметного влияния на параметры пара, поэтому расчет течения можно вести вплоть до начала конденсации по обычным газодинамическим формулам, принимая fe=l,3. По заданной относительной концентрации и в предположении, что при низких давлениях смесь водяного пара и ОДА ведет себя, как идеальный газ, можно определить парциальное давление пара ОДА. Рассчитанные в fl60] критические пересыщения в изоэнтропном процессе при заданной температуре пара подтверждают, что пар ОДА не конденсируется раньше, чем водяной пар, даже если массовая концентрация ОДА в паре С=100-10- кг/кг. Однако опыты показали, что при введении определенного количества ОДА в паровой поток дисперсная [c.299]
В закритической области вещество находится в однородном состоянии, и в нем отсутствует резкое разделение на отдельные фазы, что имеет место при пересечении пограничной кривой вдали от критической точки. Различие между жидкостью и паром в этой области носит лишь количественный характер, поскольку между ними можно осуществить непрерывный переход без выделения или поглощения скрытой теплоты изменения агрегатного состояния. Однако в указанных переходах непрерывный ряд микроскопических однородных состояний содержит области максимальной микроскопической неоднородности флуктуац ионного характера. Существование такой микроскопической неоднородности связано с падением термодинамической устойчивости первоначальной фазы и с возникновением внутри >нее островков более устойчивой фазы. Указанная внутренняя перестройка вещества, несмотря на свою нелрерывность, имеет узкие участки наибольшего сосредоточения, которые обусловливают появление резких скачков теплоемкости, сжимаемости, коэффициента объемного расширения, вязкости и других свойств вещества. Эти явления демонстрировались рис. 1-5, где был показан характер изменения критерия Прандтля для воды, и перегретого водяного пара от температуры и давления, и рис. 1-6 — для кислорода в зависимости от температуры при закритическом давлении. Из графиков следует, что при около- и закритиче-ских давлениях наряду с областями резкого изменения физических параметров имеются области, где они изменяются с температурой незначительно. При высоких давлениях в области слабой зависимости тепловых параметров от температуры теплоотдача подчиняется обычным критериальным зависимостям. В этом случае при проведении опытов можно не опасаться применения значительных температурных перепадов между стенкой и потоком жидкости, обработка опытных данныл также не [c.205]
to continue to Google Sites
Not your computer? Use Guest mode to sign in privately. Learn more
-
Критическая точка
Как следует из фазовой P–Vдиаграммы (рис.3.3) по
мере роста давления различие между
удельными объемами кипящей жидкости
(V’) и сухого насыщенного
пара (V») постепенно
уменьшается и в точке К становится
равным нулю. Такое состояние называется
критическим, а точка К – критической
точкой вещества.
Pк,Tк,
Vк ,Sк
– критические термодинамические
параметры вещества.
Например, для воды:
Pк = 22,129 МПа;
Tк = 374, 140С;
Vк= 0, 00326 м3/кг
В критической точке свойства жидкой и
газообразной фаз одинаковы.
Как следует из фазовой Т – Sдиаграммы (рис 3.4) в критической точке
теплота парообразования, изображаемая
как площадь под горизонтальной линией
фазового перехода (С’ — С»), от кипящей
жидкости к сухому насыщенному пару ,
равна нулю.
Точка К для изотермы Тк в фазовойP–Vдиаграмме
(рис.3.3) является точкой перегиба.
Изотерма Тк , проходящая через
точку К, являетсяпредельной
изотермой двухфазной области,
т.е. отделяет область жидкой фазы от
области газообразной.
При температуре выше Тк изотермы
уже не имеют ни прямолинейных участков,
свидетельствующих о фазовых переходах,
ни точки перегиба, характерной для
изотермы Тк , а постепенно принимают
вид плавных кривых, близких по форме к
изотермам идеального газа.
Понятия «жидкость» и «газ» (пар) в
известной степени условны, т.к.
взаимодействия молекул в жидкости и
газе имеют общие закономерности,
отличаясь лишь количественно. Этот
тезис можно проиллюстрировать рисунком3.6,
где переход из точки Е газообразной
фазы в точку L жидкой фазы произведен в
обход критической точки К по траектории
EFL.
Рис.3.6. Два варианта
фазового перехода
из газообразной в
жидкую фазу
При переходе по линии ADв точке С происходит разделение вещества
на две фазы и затем вещество постепенно
переходит из газообразной (парообразной)
фазы в жидкую.
В точке С свойства вещества изменяются
скачком (в фазовой P–Vдиаграмме точка С фазового перехода
превращается в линию фазового перехода
(С’ — С»)).
При переходе по линии EFLпревращение газа в жидкость происходит
непрерывно, так как линияEFLнигде не пересекает кривую парообразования
ТК, где вещество одновременно существует
в виде двух фаз: жидкой и газообразной.
Следовательно, при переходе по линииEFLвещество не будет
распадаться на две фазы и останется
однофазным.
Критическая температура Тк– это предельная температура равновесного
сосуществования двух фаз.
Применительно к термодинамическим
процессам в сложных системах это
классическое лаконичное определение
Ткможет быть развернуто следующим
образом:
Критическая температура Тк
— это нижняя температурная граница
области термодинамических процессов,
в которых невозможно появление двухфазного
состояния вещества «газ — жидкость» ни
при каких изменениях давления и
температуры. Это определение иллюстрируются
рис.3.7 и 3.8. Из этих рисунков следует, что
эта область ограниченная критической
температурой, охватывает только
газообразное состояние вещества (газовую
фазу). Газообразное состояние вещества,
именуемое паром в эту область не входит.
Рис. 3.7. К определению критической
Рис.3.8.К определению критиче-
температуры
ской температуры
Из этих рисунков следует, что эта
заштрихованная область, ограниченная
критической температурой, охватывает
только газообразное состояние вещества
(газовую фазу). Газообразное состояние
вещества, именуемое паром в эту область
не входит.
Используя понятие критической точки,
можно из общего понятия «газообразное
состояние вещества» выделить понятие
«пар».
Пар– это газообразная фаза
вещества в области температур ниже
критической.
В термодинамических процессах, когда
линия процесса пересекает или кривую
парообразования ТК, или кривую сублимации
3, газообразная фаза всегда сначала
является паром.
Критическое давление Рк
– это давление, выше которого
разделение вещества на две одновременно
и равновесно сосуществующие фазы:
жидкость и газ невозможно при любой
температуре.
Это классическое определение Рк,
применительно к термодинамическим
процессам в сложных системах можно
сформулировать более подробно:
Критическое давление Рк
– это нижняя по давлению граница
области термодинамических процессов,
в которых невозможно появление двухфазного
состояния вещества «газ — жидкость» ни
при каких изменениях давления и
температуры. Это определение критического
давления иллюстрируется рис.3.9. и 3.10. Из
этих рисунков следует, что эта область,
ограниченная критическим давлением,
охватывает не только часть газообразной
фазы, расположенную выше изобары Рк,
но и часть жидкой фазы, расположенную
ниже изотермы Тк.
Для сверхкритической области за вероятную
(условную) границу «жидкость-газ» условно
принимают критическую изотерму.
Рис.3.9.К определению критичес — Рис.3.10.
К определению критического
кого давления
давления
Если давление перехода много больше
давления в критической точке, то вещество
из твердого (кристаллического) состояния
будет переходить прямо в газообразное
состояние, минуя жидкое состояние.
Из фазовых Р-Т диаграмм аномального
вещества (рис 3.6, 3.7, 3.9) это не очевидно,
т.к. на них не показана та часть диаграммы,
где вещество, имеющее при больших
давлениях несколько кристаллических
модификаций (и, соответственно, несколько
тройных точек), снова приобретает
нормальные свойства.
На фазовой Р – Т диаграмме нормального
вещества рис. 3.11 этот переход из твердой
фазы сразу в газообразную показан в
виде процесса А’D’.
Рис. 3.11. Переход
нормального
вещества из твердой
фазы сразу в
газообразную при
Р>Ртр
Переход вещества из твердой фазы в
паровую, минуя жидкую, возложен лишь
при Р<Ртр. Примером такого
перехода, называемого сублимацией,
является процесс АDна
рис 3.11.
Критическая температура имеет весьма
простое молекулярно – кинетическое
истолкование.
Объединение свободно движущихся молекул
в каплю жидкости при сжижении газа
происходит исключительно под действием
сил взаимного притяжения. При Т>Тккинетическая энергия относительного
движения двух молекул больше энергии
притяжения этих молекул, поэтому
образование капель жидкости (т.е.
сосуществование двух фаз) невозможно.
Критические точки имеют только кривые
парообразования, так как они соответствуют
равновесному сосуществованию двух
изотропных фаз: жидкой и
газообразной. Линии плавления и
сублимации не имеют критических точек,
т.к. они соответствуют таким двухфазным
состояниям вещества, когда одна из фаз
(твердая) являетсяанизотропной.
Критическое состояние вещества
Сходство свойств ненасыщенных паров и газов натолкнуло М. Фарадея на предположение: не являются ли газы ненасыщенными парами соответствующих жидкостей? Если предположение верно, то можно попытаться сделать их насыщенными и сконденсировать. Действительно, сжатием удалось сделать насыщенными многие газы, кроме шести, которые М. Фарадей назвал «постоянными»: это азот, водород, воздух, гелий, кислород, оксид углерода CO.
Чтобы понять, в чем здесь дело, изучим подробнее изотермический процесс сжатия (расширения) пара. Мы видели, что изотерма реального газа отличается от изотермы идеального газа наличием горизонтального участка, соответствующего области существования двухфазной системы: насыщенного пара и жидкости.
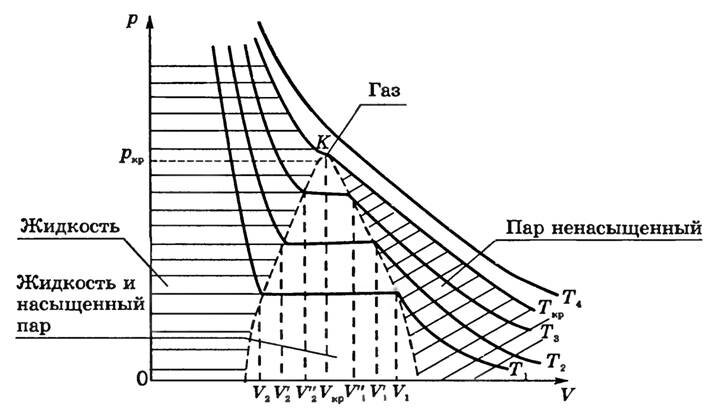
Если проводить опыты при более высоких температурах (T1 < T2 < T3 < Tk < T4), то можно обнаружить закономерность, общую для всех веществ (рис. 1).
Рис. 1
Во-первых, чем выше температура, тем меньше объем, при котором начинается конденсация газа: V1 > V’1 > V’’1, если T1 < T2 < T3.
Во-вторых, чем выше температура, тем больше объем, занимаемый жидкостью после того, как весь пар конденсируется:
V2 < V’2 < V’’2 .
Следовательно, длина прямолинейного участка изотермы с ростом температуры уменьшается.
Это легко объяснить: с ростом Τ давление насыщенного пара быстро нарастает, и для того, чтобы давление ненасыщенного пара сравнялось с давлением насыщенного, необходимо уменьшение объема. Причина увеличения объема V2 — в тепловом расширении жидкости при нагревании. Так как объем V1 уменьшается, то плотность паров при увеличении температуры увеличивается; увеличение объема V2 свидетельствует об уменьшении плотности жидкости. Это значит, что различие между жидкостью и ее насыщенным паром в процессе такого нагревания сглаживается и при достаточно высокой температуре должно исчезнуть совсем.
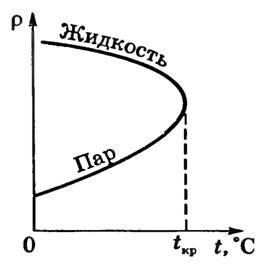
Д. Менделеев установил, что для каждой жидкости должна существовать такая температура, которая экспериментально впервые была установлена для многих веществ Т. Эндрюсом и носит название критической температуры.
Критическая температура Tкр — это такая температура, при которой плотность жидкости и плотность ее насыщенного пара становятся одинаковыми (рис. 2).
Рис. 2
На изотермах при Т = Tкр горизонтальный участок превращается в точку перегиба К.
Давление насыщенного пара какого-либо вещества при его критической температуре называется критическим давлением pкр. Оно является наибольшим возможным давлением насыщенных паров вещества.
Объем, который занимает вещество при pкр и tкр, называется критическим объемом Vкр. Это наибольший объем, который может занимать имеющаяся масса вещества в жидком состоянии.
При критической температуре различие между газом и жидкостью исчезает, и поэтому удельная теплота парообразования становится равной нулю.
Совокупность точек, соответствующих краям горизонтального участка изотерм (см. рис. 1), выделяет в плоскости p-V области существования двухфазной системы и отделяет ее от областей однофазных состояний вещества. Пограничная кривая области двухфазных состояний со стороны больших значений объема описывает состояние насыщенного пара и одновременно представляет собой кривую конденсации (начинается конденсация пара при изотермическом сжатии). Пограничная кривая со стороны меньших объемов представляет собой кривую, на которой заканчивается конденсация при сжатии насыщенного пара и начинается испарение жидкости при изотермическом расширении. Ее называют кривой испарения.
Существование критической температуры вещества объясняет, почему при обычных температурах одни вещества могут быть как жидкими, так и газообразными, а другие остаются газами.
Выше критической температуры жидкость не образуется даже при очень высоких давлениях.
Причина заключается в том, что здесь интенсивность теплового движения молекул оказывается настолько большой, что даже при относительно плотной их упаковке, вызванной большим давлением, молекулярные силы не могут обеспечить создание даже ближнего, а тем более дальнего порядка.
Таким образом, видно, что принципиальной разницы между газом и паром нет. Обычно газом называют вещество в газообразном состоянии, когда его температура выше критической. Паром называют также вещество в газообразном состоянии, но когда его температура ниже критической. Пар можно перевести в жидкость одним только увеличением давления, а газ нельзя.
В настоящее время все газы переведены в жидкое состояние при очень низких температурах. Последним в 1908 г. переведен гелий (tкр = -269 °С).
Литература
Аксенович Л. А. Физика в средней школе: Теория. Задания. Тесты: Учеб. пособие для учреждений, обеспечивающих получение общ. сред, образования / Л. А. Аксенович, Н.Н.Ракина, К. С. Фарино; Под ред. К. С. Фарино. — Мн.: Адукацыя i выхаванне, 2004. — C. 176-178.