Условие задачи:
Определить среднеквадратичную скорость молекул газа при давлении 100 кПа и плотности 1,25 кг/м3.
Задача №4.1.34 из «Сборника задач для подготовки к вступительным экзаменам по физике УГНТУ»
Дано:
(p=100) кПа, (rho=1,25) кг/м3, (upsilon_{кв}-?)
Решение задачи:
Запишем основное уравнение молекулярно-кинетической теории (МКТ) идеального газа:
[p = frac{1}{3}{m_0}nupsilon _{кв}^2;;;;(1)]
Вспомним формулу определения концентрации молекул (n) идеального газа:
[n = frac{N}{V}]
Подставим это выражение в формулу (1), получим:
[p = frac{1}{3}frac{{{m_0}N}}{V}upsilon _{кв}^2]
Произведение массы одной молекулы (m_0) на количество молекул (N) равно массе газа (m), поэтому:
[p = frac{1}{3}frac{m}{V}upsilon _{кв}^2]
Отношение массы (m) к объему (V) – это физическая величина, называемая плотностью газа (rho), поэтому:
[p = frac{1}{3}rho upsilon _{кв}^2]
Осталось сделать последнее действие – выразить искомую скорость (upsilon_{кв}):
[{upsilon _{кв}} = sqrt {frac{{3p}}{rho }} ]
Посчитаем численный ответ задачи:
[{upsilon _{кв}} = sqrt {frac{{3 cdot 100 cdot {{10}^3}}}{{1,25}}} = 489,9;м/с approx 0,49;км/с]
Ответ: 0,49 км/с.
Если Вы не поняли решение и у Вас есть какой-то вопрос или Вы нашли ошибку, то смело оставляйте ниже комментарий.
Смотрите также задачи:
4.1.33 Вычислить среднюю квадратичную скорость молекул углекислого газа
4.1.35 В баллоне емкостью 40 л находится 10 кг кислорода под давлением 20 МПа. Найти
4.1.36 Энергия поступательного движения, которой обладают все молекулы газа, находящегося
Для характеристики движения молекул в физике используют две скорости: среднюю и среднюю квадратичную скорость молекул.
Важно. Следует обязательно понимать, что в реальных условиях мы не можем точно знать ни конкретное число молекул в системе, ни тем более скорость каждой из них в конкретный момент времени. Это обусловлено неимоверно гигантским числом частиц в реальных и даже сколько-нибудь приближенных к ним системах. Например, в 1 см3 при давлении 200 мм. рт. ст. содержится 4,18*1018 молекул водорода. Говоря более понятными категориями, это более чем 4 миллиарда миллиардов. Заметим, что указанное давление меньше атмосферного почти в 4 раза. Последнее в среднем равняется 760 мм. рт. ст. Разрежённый водород по своим свойствам наиболее близок к идеальному газу. В данном случае физика вынуждена иметь дело с распределениями скоростей и энергий частиц.
Что такое средняя скорость движения молекул
Среднюю скорость движения молекул часто именуют скоростью их теплового движения.
Определение 1
Вид формулы средней относительной скорости молекул в физике можно представить выражением:
[text { Vотн }=sqrt{2} sqrt{frac{8 R T}{pi m_{0}}}]
Выражение под корнем – средняя скорость молекул идеального газа.
Как определить среднюю квадратичную скорость движения молекул
Определение 2
Средней квадратичной скоростью молекул идеального газа называют величину равную квадратному корню из среднего арифметического величины квадратов скоростей каждой из молекул.
Средняя скорость молекул равна:
[leftlanglemathrm{V}_{mathrm{KB}}rightrangle=sqrt{frac{1}{N} sum_{i=1}^{N} v_{i}^{2}}]
Если обе её части возвести в квадрат и проинтегрировать, то получим выражение:
[langlemathrm{VKB}rangle^{2}=int_{0}^{infty} v^{2} F(v) d v]
Ещё одно выражение для среднеквадратичной скорости:
[leftlangle V_{K B}rightrangle=sqrt{frac{3 k T}{m_{0}}}=sqrt{frac{3 R T}{mu}}]
Именно она присутствует в уравнении, именуемом основным уравнением молекулярно-кинетической теории
P = (1/3)nm*<Vкв>
Где n – концентрация молекул, которая вычисляется делением их общего числа на объём.
Пример. 1.
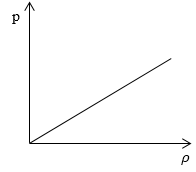
Рассмотрим простейший случай, чтобы использование интегрирования не затруднило понимание сути явления и помогло лучше понять материал. Вычислим как меняется средняя скорость движения молекул в идеальном газе при линейном увеличении его давления. График следующий:
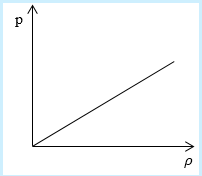
Напомним, что средняя скорость частиц:
[mathrm{Vcp}=sqrt{frac{8 R T}{pi m_{0}}}]
Если присмотреться к представленному графику, то можно заметить, что P приблизительно равно ρ. Эти две величины можно связать соотношением
P=C*ρ
Где С – некоторая постоянная величина, константа.
Далее считаем m0= ρ/n, p = n*k*T = C* ρ. Отсюда следует, что k*T = (C*ρ)/n.
Нужно лишь подставить эти значения в формулу для средней скорости:
[V c p=sqrt{8 mathrm{kT} / pi mathrm{m}}=sqrt{(8 mathrm{C} rho / pi mathrm{n})(mathrm{n} / rho)}=sqrt{8 mathrm{C} / pi}]
В полученном выражении нет ни одной переменной величины, т. е. при увеличении давления, вопреки ожиданиям, скорость оказалась неизменной.
Ответ: В процессе, который был дан нам на графике, при увеличении давления средняя скорость молекул никак не меняется.
Нет времени решать самому?
Наши эксперты помогут!
Пример. 2.
Определим среднюю квадратичную скорость молекул газа при условии, что нам известны его давление (P), молярная масса (M) и концентрация частиц (n).
Воспользуемся формулой:
[leftlanglemathrm{V}_{kappa в}rightrangle=sqrt{frac{3 k T}{m_{0}}}=sqrt{frac{3 R T}{mu}}]
Также нам потребуется уравнение Менделеева-Клайперона
Здесь мы воспользовались тем, что:
m/μ = N/Na
PV = (m/μ)*RT = (N/Na)*RT
Если обе части этого уравнения поделить на V и принять во внимание, что
(N/V) = n, то можно получить
P = (n/Na)*RT. Отсюда находим, что RT = (p*N)/n
Если мы это подставим в выражение для среднеквадратичной скорости [leftlangle V_{K B}rightrangle=sqrt{3 mathrm{kT} / mathrm{m}_{0}}=sqrt{3 mathrm{RT} / mu}], получим, что средняя квадратичная скорость движения молекул газа: [leftlangle V_{K B}rightrangle=sqrt{left(3 rho N_{a}right) /(mu mathrm{n})}]
Ответ: Формула средней квадратичной скорости молекул исходя из данный нам условий следующая:
[leftlangle V_{K B}rightrangle=sqrt{left(3 rho N_{a}right) /(mu mathrm{n})}]
Среднеквадратичная скорость молекулы газа при заданном давлении и объеме газа Калькулятор
| Search | ||
| Дом | Химия ↺ | |
| Химия | Кинетическая теория газов ↺ | |
| Кинетическая теория газов | Средняя квадратичная скорость газа ↺ |
|
✖Давление газа – это сила, с которой газ действует на стенки сосуда.ⓘ Давление газа [Pgas] |
+10% -10% |
||
|
✖Объем газа — это количество места, которое он занимает.ⓘ Объем газа [V] |
+10% -10% |
||
|
✖Количество молекул — это общее количество частиц, присутствующих в конкретном контейнере.ⓘ Количество молекул [Nmolecules] |
+10% -10% |
||
|
✖Масса каждой молекулы представляет собой отношение молярной массы к числу Авагадро.ⓘ Масса каждой молекулы [m] |
+10% -10% |
|
✖Среднеквадратичная скорость представляет собой значение квадратного корня из суммы квадратов значений скорости укладки, деленное на количество значений.ⓘ Среднеквадратичная скорость молекулы газа при заданном давлении и объеме газа [CRMS] |
⎘ копия |
Среднеквадратичная скорость молекулы газа при заданном давлении и объеме газа Решение
ШАГ 0: Сводка предварительного расчета
ШАГ 1. Преобразование входов в базовый блок
Давление газа: 0.215 паскаль —> 0.215 паскаль Конверсия не требуется
Объем газа: 22.4 Литр —> 0.0224 Кубический метр (Проверьте преобразование здесь)
Количество молекул: 100 —> Конверсия не требуется
Масса каждой молекулы: 0.1 грамм —> 0.0001 Килограмм (Проверьте преобразование здесь)
ШАГ 2: Оцените формулу
ШАГ 3: Преобразуйте результат в единицу вывода
1.4448 метр в секунду —> Конверсия не требуется
3 Средняя квадратичная скорость газа Калькуляторы
Среднеквадратичная скорость молекулы газа при заданном давлении и объеме газа формула
Среднеквадратичная скорость = (3*Давление газа*Объем газа)/(Количество молекул*Масса каждой молекулы)
CRMS = (3*Pgas*V)/(Nmolecules*m)
Каковы постулаты кинетической молекулярной теории газа?
1) Фактический объем молекул газа незначителен по сравнению с общим объемом газа. 2) отсутствие силы притяжения между молекулами газа. 3) Частицы газа находятся в постоянном беспорядочном движении. 4) Частицы газа сталкиваются друг с другом и со стенками емкости. 5) Столкновения абсолютно эластичны. 6) Различные частицы газа имеют разную скорость. 7) Средняя кинетическая энергия молекулы газа прямо пропорциональна абсолютной температуре.
Екатерина Владимировна Мосина
Эксперт по предмету «Физика»
Задать вопрос автору статьи
Различают следующие скорости, характеризующие движение молекул.
Средняя скорость движения молекул
средняя скорость движения молекул $leftlangle vrightrangle $, которая определяется как:
где N — число молекул. Или, среднюю скорость можно найти как:
где $Fleft(vright)=4pi {left(frac{m_0}{2pi kT}right)}^{frac{3}{2}}expleft(-frac{m_0v^2}{2kT}right)v^2$ — функция распределения молекул по модулю скорости, указывающая долю молекул со скоростями, находящимися в единичном интервале $dv$ около величины скорости $v$, $m_0$- масса молекулы, $k$- постоянная Болцмана, T — термодинамическая температура. Для того, чтобы определить, как средняя скорость молекулы связана с макропараметрами газа, как системы частиц, найдем значение интеграла (2).
Произведем замену:
Следовательно:
Подставим (4) и (5) в (3), получим:
Проведем интегрирование по частям, получим:
где R — универсальная газовая постоянная, $mu $- молярная масса газа.
Среднюю скорость движения молекул называют также скоростью теплового движения молекул.
Средняя относительная скорость молекул:
[leftlangle v_{otn}rightrangle =sqrt{2}sqrt{frac{8kT}{pi m_0}}=sqrt{2}leftlangle vrightrangle left(7right).]
Средняя квадратичная скорость
Средней квадратичной скоростью движения молекул газа называют величину:
[leftlangle v_{kv}rightrangle =sqrt{frac{1}{N}sumlimits^N_{i=1}{{v_i}^2}}left(8right).]
Или
[{leftlangle v_{kv}rightrangle }^2=intnolimits^{infty }_0{v^2Fleft(vright)dv left(9right).}]
Проводя интегрирование, которое аналогично интегрированию при получении связи средней скорости с температурой газа, получим:
[leftlangle v_{kv}rightrangle =sqrt{frac{3kT}{m_0}}=sqrt{frac{3RT}{mu }}left(10right).]
Именно средняя квадратичная скорость поступательного движения молекул газа входит в основное уравнение молекулярно-кинетической теории:
[p=frac{1}{3}nm_0{leftlangle v_{kv}rightrangle }^2left(11right),]
где $n=frac{N}{V}$ — концентрация частиц вещества, $N$- число частиц вещества, V- объем.
«Средняя скорость молекул» 👇
Пример 1
Задание: Определите, как изменяется средняя скорость движения молекул идеального газа при увеличении давления в процессе, представленном на графике (рис.1).
Рис. 1
Решение:
Запишем выражение для средней скорости движения молекул газа в виде:
[leftlangle vrightrangle =sqrt{frac{8kT}{pi m_0}} left(1.1right)]
По графику видим, что $psim rho или p=Crho , $ где C- некоторая константа.
[m_0=frac{rho }{n}, p=nkT=Crho to kT=frac{Crho }{n} left(1.2right).]
Подставим (1.2) в (1.1), получим:
[leftlangle vrightrangle =sqrt{frac{8kT}{pi m_0}}=sqrt{frac{8Crho }{pi n}frac{n}{rho }}=sqrt{frac{8C}{pi }}left(1.3right)]
Ответ: В процессе, изображенном на графике, с ростом давления средняя скорость движения молекул не изменяется.
Пример 2
Задание: Можно ли вычислить среднюю квадратичную скорость молекулы идеального газа, если известны: давление газа (p), молярная масса газа ($mu $) и концентрация молекул газа (n)?
Решение:
Используем выражение для $leftlangle v_{kv}rightrangle :$
[leftlangle v_{kv}rightrangle =sqrt{frac{3RT}{mu }}left(2.1right).]
Кроме того, из уравнения Менделеева — Клайперона и зная, что $frac{m}{mu }=frac{N}{N_A}$:
[pV=frac{m}{mu }RT=frac{N}{N_A}RTleft(2.2right).]
Разделим правую и левую части (2.2) на V, зная, что $frac{N}{V}=n$ получим:
[p=frac{n}{N_A}RTto RT=frac{pN_A}{n} left(2.3right).]
Подставим (2.3) в выражение для среднеквадратичной скорости (2.1), имеем:
[leftlangle v_{kv}rightrangle =sqrt{frac{3pN_A}{mu n}} left(2.4right).]
Ответ: По заданным в условии задачи параметрам среднеквадратичную скорость движения молекул газа вычислить можно с помощью формулы $leftlangle v_{kv}rightrangle =sqrt{frac{3pN_A}{mu n}}.$
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме
Газ находится под давлением 2 атм и имеет плотность 1,2 кг/м3 Определить среднюю квадратичную скорость молекул газа.
Оцените сложность задачи:
0 голосов, средняя сложность: 0.0000
Решения задачи
Данные задачи: газ находится под давлением
| Давление газа | P | 2 | атм |
|---|---|---|---|
| Плотность | 1,2 | $frac{кг}{м^{3}}$ | |
| Средняя квадратичная скорость молекул газа | $υ$ | ? |
Средняя квадратичная скорость
$ υ = sqrt{frac{3RT}{μ}} $
Уравнение Менделеева-Клайпейрона
$ PV = frac{m}{μ}RT $
Или
$ P =ρfrac{RT}{μ} $
Откуда находим
$ frac{P}{ρ} = frac{RT}{μ} $
и тогда
$ υ = sqrt{3frac{RT}{μ}}=sqrt{3frac{P}{ρ}}=sqrt{3frac{2×1,01×10^{5}}{1,2}}=711 frac{м}{с} $
Ответ:
$ Средняя квадратичная скорость молекул газа 711 frac{м}{с} $
Чтобы предложить решение пожалуйста войдите или зарегистрируйтесь