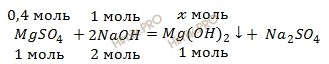А) Реакция с сильным
основанием
Щелочи NaОН
и КОН выделяют из растворов солей магния
белый аморфный осадок гидроксида магния
Мg2+
+ 2ОН–
= Мg(ОН)2
Реакция может быть
использована для отделения иона магния,
поскольку гидроксиды остальных катионов
I
группы хорошо растворимы в воде.
Гидро-ксид магния растворим в кислотах
и солях аммония, поэтому в присутствии
иона аммония эта реакция становится
ненадежной.
К 2 — 3 каплям раствора
соли магния прибавьте столько же раствора
гид-роксида натрия или калия. Обратите
внимание на аморфный характер осадка
Мg(ОН)2.
Б) Реакция с
гидрофосфатом натрия
Гидрофосфат натрия
Na2НРО4
в присутствии NН4ОН
и NН4Сl
образует с
солями магния
белый кристаллический осадок фосфата
магния-аммония
Mg2+
+ HPO42–
+ NH4OH
= MgNH4PO4
+ H2O
Хлорид аммония
добавляют для того, чтобы не выпадал
осадок гидроксида магния. Фосфат
магния-аммония растворим в кислотах,
поэтому реакцию выполняют в нейтральном
или слабощелочном растворе.
К 2 — 3 каплям раствора
соли магния добавьте 2 капли раствора
NН4Сl
и 4 капли реактива Na2НРО4.
Затем
добавляйте 2 н NН4ОН
до появления запаха аммиака, перемешивая
раствор после добавления каждой капли
реактива. Из разбавленных растворов
осадок выпадает не сразу, поэтому
раствору дают постоять 15 — 20 мин.
Реакция с
гидрофосфатом натрия достаточно
чувствительна и чаше всего используется
для открытия магния в ходе систематического
анализа. Однако проведению этой реакции
мешают катионы других аналитических
групп, так как они тоже дают нерастворимые
осадки с гидрофосфатом натрия. Поэтому
эти катионы нужно предварительно
удалить.
В) Реакция с
карбонатом натрия
Растворимые
карбонаты Nа2СО3
и K2СО3
выделяют из растворов солей магния
белый аморфный осадок основного карбоната
2Мg2+
+ 2СO32+
+ Н2О
= (МgОН)2СОз
+ СО2
К 2 — 3 каплям раствора
соли магния добавьте равный объем
раствора карбоната натрия или калия.
Убедитесь, что осадок основного карбоната
магния растворим в кислотах и солях
аммония.
Г) Реакция с
8-оксихинолином
8-оксихинолин
НС9Н6NО
из аммиачных растворов солей магния
выделяет зеленовато-желтый кристаллический
осадок оксихинолята магния
Мg2+
+ 2НС9H6NО
= М(С9H6NO)2
+ 2Н+
Осадок растворим
в кислотах; он образуется только в
присутствии аммонийной буферной смеси
(рН = 9,5 — 12,5).
К 2 каплям раствора
соли магния добавьте I каплю насыщенного
раствора NН4С1,
2 капли концентрированного NН4ОН
и затем 3 капли 5%-ного спиртового раствора
оксихинолина. Перемешайте содержимое
пробирки и наблюдайте образование
осадка. Катионы I
и II групп выполнению реакции не мешают.
Опыт 4. Определение иона аммония
Ион аммония мешает
определению натрия и калия, поэтому
перед обнаружением этих элементов его
надо удалить, пользуясь летучестью
солей аммония при прокаливании или
способностью его реагировать в щелочных,
нейтральных и слабокислых средах с
формальдегидом с образованием осадка
уротропина
4NHз
+ 6СН2О
= (СН2)6N4
+ 6Н2О
А) Реакция с сильными
основаниями
Сильные основания
KОН,
NаОН
и др. выделяют из солей аммония при
нагревании газообразный аммиак
NН4+
+ ОН–
= NН3
+ Н2О
К 2 — 3 каплям раствора
соли аммония прибавьте 3-4 капли щелочи
и поставьте на водяную баню. Выделение
аммиака можно обнаружить по запаху, но
лучше воспользоваться для этого
индикаторной бумагой или бумагой,
пропитанной нитратом ртути (I)
Нg2(NО3)2.
Выделяющийся аммиак окрашивает влажную
индикаторную бумагу в цвет, характерный
для слабощелочного раствора, а бумагу
с нитратом ртути — в черный цвет.
Б) Реакция с
реактивом Несслера
Реактив Несслера
— это смесь тетраиодомеркурата (II)
и гидроксида калия: K2[НgI4]
и KОН.
При реакции с солями аммония образуется
красно-бурый осадок иодида
оксодимеркураммония, растворимый в
избытке солей аммония
NH4+
+ 2[НgI4]2–
+ 4ОН–
= [ОНg2NН2]I
+7I–
+ 3Н2О
К одной капле
разбавленного раствора соли аммония
прибавьте 2 — 3 капли реактива Несслера
(реактив нужно брать в избытке). Реакция
чрезвычайно чувствительна и показывает
присутствие даже случайных примесей
NН4+.
Результаты действия
важнейших реагентов на катионы I
группы приведены в табл. 2.1. Как видно
из таблицы, присутствие катиона NН4+
мешает обнаружению катиона калия, так
как он дает осадки с NаHС4H4О6
и Na3[Со(NО2)],
неотличимые по виду от соответствующих
осадков, образуемых калием. Следовательно,
перед обнаружением калия ион аммония
должен быть удален из раствора. Для
этого исследуемый раствор подкисляют
азотной или соляной кислотой, выпаривают
в фарфоровой чашке, а образовавшийся
сухой осадок прокаливают до полного
удаления катиона аммония (проба с
реактивом Несслера). Ион NН4+
можно также удалить, связав ею
формальдегидом в уротропин. Определению
натрия с помощью ацетата уранила NН4+
не мешает.
Ион магния
обнаружению калия и натрия не мешает.
Таблица 2.1
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Для определения магния растворяют 0,1658 г-хим.-чистого MgO в H i и доводят до литра 1 мл этого раствора—1 мг Mg. [c.341]
Ход определения. Анализируемый раствор, содержащий не более 0,05 г магния, помещают в стакан емкостью 200—300 мл, разбавляют до 150 мл, приливают 5 мл концентрированной НС1 и [c.184]
Аналогичные результаты получены в работе С. Ф. Наумовой, Ю. Н. Михайловского, П. И. Зубова [34] при определении толщины растворившегося слоя магния в чистой атмосфере под защитными покрытиями и без них. Независимо от природы и толщины защитной полимерной пленки скорость окисления металла в чистой атмосфере всегда равна скорости коррозии неизолированного металла. По мнению авторов, во влажной атмосфере, не содержащей [c.31]
Высокотемпературное пламя оксида азота(I) с ацетиленом обеспечивает высокую селективность определения магния в сложных матрицах. Необходимо добавление ионизационного буферного раствора (соль натрия) и уравнивание содерл<ания кислот в пробах и стандартных растворах. [c.164]
Осаждение оксихинолином применяют для определения магния в присутствии алюминия и железа без предварительного отделения этих элементов, а также для определения магния в присутствии кальция. В первом случае магний осаждают оксихинолином из щелочного (N OH) раствора, содержащего виннокислые соли. Железо и алюминий образуют в щелочном растворе с виннокислым натрием устойчивые комплексные соединения, из раствора которых оксихинолин не осаждает этих элементов. Отделение от кальция основано на сравнительно хорошей растворимости оксихинолината кальция в горячем аммиачном растворе, в то время как оксихинолинат магния при этих условиях не растворяется. Последний метод не имеет особых преимуществ по сравнению с обычным методом отделения магния от кальция, так как и в этом случае требуется двукратное [c.398]
Применяется при определении бора, для разделения сульфатов кальция (нерастворим) и магния (растворим) в смеси с изобутило-вым спиртом — для разделения бромидов стронция и бария. [c.115]
ОПРЕДЕЛЕНИЕ КОНЦЕНТРАЦИИ РАСТВОРОВ МАГНИЯ И КАЛЬЦИЯ ЕТОДОМ КОМПЛЕКСОНОМЕТРИЧЕСКОГО ТИТРОВАНИЯ [c.484]
При определении магния методом сравнения взяли навеску сплава массой 0,3 г, растворили в смеси кислот и перенесли в мерную колбу вместимостью 250 см . Перед измерением атомного поглощения магния 5 смЗ пробы разбавили до 200 см . Интенсивность поглощения этого раствора при 285,2 нм составила 42 единицы шкалы. [c.137]
При определении магния «методом стандартных добавок» в две мерные колбы вместимостью 25 см прилили по 10 см анализируемого раствора и в одну из колб — 10 см стандартного раствора магния с концентрацией 1 мкг Mg в см , после чего объемы растворов в мерных колбах довели до метки дистиллированной водой. Атомное поглощение этих растворов при 285,1 нм составляет 20 и 38 единиц соответственно. Определить концентрацию магния в анализируемом растворе (в мг/дм ). [c.139]
Титановый желтый — желто-коричневый порошок с красным оттенком. Растворим в воде, этаноле, метаноле и разбавленных кислотах с образованием желтых растворов в растворах щелочей растворим с оранжевым окрашиванием. Применяют для определения магния при рН>12 по образованию коллоидного адсорбционного соединения, более устойчивого в присутствии поливинилового спирта. Кальций усиливает окраску. [c.211]
Применяют при определении бора, для разделения сульфатов кальция (нерастворим) и магния (растворим). В смеси с изобутиловым спиртом — для разделения бромидов стронция и бария. Сильный яд, поэтому применять метанол в качестве растворителя не рекомендуется. [c.247]
Принцип метода. Суммарное содержание кальция и магния определяют титрованием раствора комплексоном III. В другой части раствора после отделения кальция в виде оксалата, определяют магний. Относительное стандартное отклонение при определении кальция — 0,05, при определении магния — 0,07. [c.237]
Для раздельного определения магния 100 мл раствора подкисляют уксусной кислотой до розовой окраски метилового красного, нагревают до кипения и осаждают кальций оксалатом аммония. Осадок оксалата кальция отфильтровывают через 1—2 ч и промывают горячей водой, содержащей небольшое количество оксалата аммония. Фильтрат и промывные воды собирают в коническую колбу вместимостью 500 мл, добавляют аммиак (до появления запаха) и 15—20 мл хлоридно-аммиачной буферной смеси. Затем добавляют 15—20 капель индикатора и титруют 0,1 М раствором комплексона П1. [c.238]
Определение окиси кальция. К раствору 1 в конической колбе (после отделения титана) добавляют несколько капель индигокармина и по каплям 20%-ный раствор NaOH до изменения окраски индикатора в лимонный цвет, добавляют на кончике шпателя (около 0,1 г) сухого индикатора мурексида и титруют 0,01 М раствором трилона Б до перехода окраски раствора из розовой в темно-фиолетовую. Раствор после титрования сохраняют для определения магния (раствор 2). [c.469]
Из сказанного следует, что даже если титрование раствором КВгОл ведется с точностью до 0,1 мл, это соответствует определению магния с точностью до 0,03 мг, что значительно превосходит точность гравиметрического определения. Кроме того, оксихинолиновый метод определения отнимает меньше времени, чем гравиметрический. Как уже указывалось выше, одним из очень важных преимуш,еств применения 8-оксихинолина для осаждения каких-либо катионов является почти полное отсутствие соосаждения посторонних примесей. В большинстве случаев здесь легко получить чистый осадок. [c.415]
Определение магния этим методом можно вести в присутствии А1 + и Ре +, которые предварительно связывают в виннокислые комплексы. В присутствии Са + определение Mg + тоже возмол<но, так как оксихинолинат кальция довольно хорошо растворим в горячем аммиачном растворе. Однако здесь необходимо переосаж-демие, так как при первом осаждении немного Са + увлекается в осадок. [c.415]
Степень загрязнения технической поваренно/ соли, применяемой на водоочистках, соединениями кальция и магния контролируют обычно путем определения жесткости растворов с массовой долей хлорида кальция 0,10. Вычислить содержание a l2 в технической иоваренной соли, если жесткость 10%-ного раствора соли плотностью 1073 кг/м равна 6,5 ммоль/л. [c.125]
Б соответствии с уравнением реакции (подробнее о расчетах см. стр. 400) 1 мл 0,1 и. раствора бромата эквивалентен 0,3 мг магния. Т ааде соотношение обеспечивает возможность определения магния с точностью до 0,03 мг даже в том случае, если отсчет по бюретке делать с точностью до 0,1 мл это значительно превосходит точность обычного весового определения. [c.399]
Определение магния. Для определения магния пользуются фильтратом, оставшимся после осаждения щавелевокислого кальция. Фильт])ат, если нужно, выпаривают до 100—120 мл, подкисляют соляной кис отой и осаждают магний в виде MgNH PO . Необходимо иметь в виду, что раствор содержит очень большое количество аммонийных солей, в пржут-ствии которых нельзя получить чистый осадок магний-аммоний фосс[)ата. Поэтому для получения точных результатов осадок отфильтровывают, растворяют в соляной кислоте и снова осаждают, приливая к раствору небольшое количество раствора фосфорнокислого натрия. Методика определения магния подробно описана в 42. [c.469]
Выполнение определения. Исследуемый раствор соли магния разбавляют до 150 мл, добавляют 5 мл НС1, 5-7 капель фенолфталеина и нагревают цо SO° , добавляют 15 мл раствора 8-оксихинолина и прибавляют по каплям из бюретки при перемешивании раствор аммиака до слабого запаха (раствор окрашивается в розовый цвет). Раствор с осацком нагревают на во-цяной бане 30-40 мин. Затем отфильтровывают осацок в стеклянный фильтрующий тигель, промывают осацок горячей воцой до тех пор, пока фильтрат не станет бесцветным. Тигель с осацком высушивают в сушильном шкафу при 130°С цо посгоянной массы. Рассчитывают количество Пд или Mg О в граммах. [c.41]
Для построения калибровочного графика при флуоресцентном определении магния с люмомагнезоном ИРЕА 0,1054 г М (М0з)2-6Н20 растворили в мерной колбе емкостью 100 мл. Затем 1,0 мл раствора разбавили в колбе на 100 мл (раствор 1). [c.156]
Для определения магния методом радиометрического титрования к одинаковым объемам исследуемого раствора, равным 5 мл, прибавляют различные объемы 0,5 М аммиачного раствора двузамещен- [c.210]
Приборы и реактивы. (Полумикрометод.) Прибор для определения электропроводности растворов. Стаканы на 50 мл. Сахар (порошок). Поваренная соль кристаллическая. Ацетат натрия. Хлорид аммония. Цинк гранулированный. Индикаторы лакмусовая бумага, спиртоной раствор фенолфталеина, метиловый оранжевый. Спирт метиловый. Глюкоза. Окись кальция. Полупятиокись фосфора. Растворы соляной кислоты (2 и 0,1 н.), серной кислоты (2 и 4 н., 1 1), уксусной кислоты (2 и 0,1 н., концентрированный), едкого натра (2 и 4 н.), трихлорида железа (0,5 н.), сульфата меди (II) (0,5 н.), дихлорида магния (0,5 н.), сульфата натрия (0,5 н.), силиката натрия (0,5 н.), хлорида бария (0,5 н.), хлорида кальция (0,5 н.), нитрата серебра (0,1 н.), иодида калия (0,1 н.), карбоната натрия (0,5 н.), хлорида аммония (0,5 н.), перманганата калия (0,5 н.), сульфата калия (0,5 н,), трихлорида алюминия (0,5 н.), хлорида цинка (0,5 н.), аммиака (0,1 н.), ацетата натрия (2 н.). [c.55]
Примером может служить вышеогшсанный оксихннолинат цинка или оксихинолинат магния МцЬг, (символом НЬ обозначена молекула 8-оксихинолина), осаждающийся из растворов в виде осадка темнозеленого цвета и используемый для определения магния. [c.201]
При определении магния в виде оксихинолята требуется, чтобы раствор содержал не более 0,05 г MgO. [c.63]
Определение концентрации растворов магния и кальция методом комп лексонометрического титрования. ……… [c.509]
При определении в растворе магний осадили в виде MgNH4P04. После прокаливания масса полученного осадка Mg2P207 оказалась равной 0,1669 г. Вычислить массу магния. [c.55]
Пример 9.6. При определении магния мстодом сравнения взяли навеску сплава массой 0,1 г, растворили ее в смеси кислот и перенесли в мерную колбу вместимостью 200 см . Для анализа взяли 10 мл раствора в мерную колбу вместимостью 100 мл. Атомное пofлoщeниe этого раствора составило 35 единиц шкалы прибора при 285,2 нм. Стандартный pa TBOj) магния с концентрацией 1 мкг Mg в 1 смЗ характеризуется поглощением в 40 делений шкалы. Определить массовую долю магния в сплаве. [c.135]
Прииер 9.8. При определении магния «методом стандартных добавок» в две мерные колбы вместимостью 50 см прилили по 20 смЗ анализируемого раствора и в одну из них — 5 см стандартного раствора магния с концентрацией 4 мкг Ме в см , после чего объемы растворов в мерных колбах довели до метки дистиллированной водой. [c.136]
ПРИМЕР 3. При флуоресцентном определении магния с лю-момагнезоном ИРЕА навеску М (МОз)2 6Н2О массой 0,09981 г растворили в мерной колбе вместимостью 100,0 мл. Затем [c.217]
Для построения градуировочного графика при флуоресцентном определении магния с люмомагнезоном ИРЕА навеску Mg(N03)2 6Н2О массой 0,1054 г растворили в мерной колбе вместимостью 100,0 мл. Затем 1,00 мл этого раствора разбавили в колбе вместимостью 100,0 мл (раствор А). [c.221]
Пикраминазо — порощок коричневого цвета. Нерастворим в кислотах и холодной воде. Растворим в ацетоне, этаноле и растворах щелочей. Применяют для фотометрического определения магния в чугунах, титановых и алюминиевых сплавах, а также в водах и биологических материалах. [c.186]
Применяют для фотометрического определения магния-1 в присутствии больших количеств титана (1 2000). Воз- можна фотометрия при содержании в растворе до 10 % пероксида водорода или до 15 % гипохлорита натрия (Na lO). Феназо вдвое более чувствителен к Mg +, чем титановый желтый или магнезон ХС, и менее чувствителен ] к карбонат- и силикат-ионам. [c.216]
Физические свойства
Магний Mg — это щелочной металл. Серебристо-белый, относительно мягкий, пластичный, ковкий металл. На воздухе покрыт оксидной пленкой. Сильный восстановитель.
Относительная молекулярная масса Mr = 24,305; относительная плотность для твердого и жидкого состояния d = 1,737; tпл = 648º C; tкип = 1095º C.
Способ получения
1. В результате электролиза расплава хлорида магния образуются магний и хлор :
MgCl2 = Mg↓ + Cl2↑
2. Нитрид магния разлагается при 700 — 1500º С образуя магний и азот:
Mg3N2 = 3Mg + N2
3. Оксид магния легко восстанавливается углеродом при температуре выше 2000º С, образуя магний и угарный газ:
MgO + C = Mg + CO
4. Оксид магния также легко восстанавливается кальцием при 1300º С с образованием магния и оксида кальция:
MgO + Ca = CaO + Mg
Качественная реакция
Качественной реакцией для магния является взаимодействие соли магния с любой сильной щелочью, в результате которой происходит выпадение студенистого осадка:
1. Хлорид магния взаимодействует с гидроксидом калия и образует гидроксид магния и хлорид калия:
MgCl2 + 2KOH = Mg(OH)2 + 2KCI
Химические свойства
1. Магний — сильный восстановитель. Поэтому он реагирует почти со всеми неметаллами:
1.1. Магний взаимодействует с азотом при 780 — 800º С образуя нитрид магния:
3Mg + N2 = Mg3N2
1.2. Магний сгорает в кислороде (воздухе) при 600 — 650º С с образованием оксида магния:
2Mg + O2 = 2MgO
1.3. Магний активно реагирует при комнатной температуре с влажным хлором. При этом образуется хлорид магния:
Mg + Cl2 = MgCl2
1.4. С водородом магний реагирует при температуре 175º C, избыточном давлении и в присутствии катализатора MgI2 с образованием гидрида магния:
Mg + H2 = MgH2
2. Магний активно взаимодействует со сложными веществами:
2.1. Магний реагирует с горячей водой. Взаимодействие магния с водой приводит к образованию гидроксида магния и газа водорода:
Mg + 2H2O = Mg(OH)2↓ + H2↑
2.2. Магний взаимодействует с кислотами:
2.2.1. Магний реагирует с разбавленной соляной кислотой, при этом образуются хлорид магния и водород:
Mg + 2HCl = MgCl2 + H2 ↑
2.2.2. Реагируя с разбавленной азотной кислотой магний образует нитрат магния, оксид азота (I) и воду:
4Mg + 10HNO3= 4Mg(NO3)2 + 2N2O↑ + 5H2O
2.2.3. В результате реакции сероводородной кислоты и магния при 500º С образуется сульфид магния и водород:
Mg + H2S = MgS + H2
2.3. Магний вступает в реакцию с газом аммиаком при 600 — 850º С. В результате данной реакции образуется нитрид магния и водород:
3Mg + 2NH3 = Mg3N2 + 3H2
2.4. Магний может вступать в реакцию с оксидами:
2.4.1. В результате взаимодействия магния и оксида азота (IV) при температуре 150º С в вакууме, в этилацетилене образуется нитрат магния и оксид азота (II):
Mg + 4NO2 = Mg(NO3)2↓ + 2NO
2.4.2. Магний взаимодействует с оксидом кремния при температуре ниже 800º С в атмосфере водорода образуя силицид магния и оксид магния:
4Mg + SiO2 = Mg2Si + MgO,
а если температуру поднять до 1000º С, то в результате реакции образуется кремний и оксид магния:
2Mg + SiO2 = Si + 2MgO
CH2COOH CH2COOH
CH2COO ООCH2С
Mg
При образовании комплекса, атомы водорода
из карбоксильных групп трилона замещаются на магний, кроме того, атом магния
связывается еще координативными связями с атомами азота. В результате реакции
в растворе накапливаются катионы водорода (повышенная кислотность раствора), однако
комплекс наиболее устойчив в слабо-щелочной среде (рН=8), поэтому для
связывания ионов водорода прибавляют аммиачный буфер (аммиак+хлористый
аммоний).
5
Для определения
эквивалентной точки применяют индикатор «хром кислотный темно-синий», дающий
окрашенное в розово-красный цвет комплексное соединение с ионами магния. В
отсутствии магния индикатор синевато-сиреневого цвета. При титровании трилоном
«Б» розовый комплекс, как менее прочный, разлагается вследствие связывания
ионов магния трилоном в более устойчивый комплекс и в эквивалентной точке
появляется сиреневатая окраска индикатора. Так как разрушения одного комплекса
и образование нового происходят не мгновенно, то титрование в конце нужно
проводить медленно, по каплям. Индикатор может менять свою окраску и при
изменении рН раствора, поэтому необходимо поддерживать постоянное значение рН,
что и достигается прибавлением буфера.
Ход определения. К исследуемому
раствору прибавляют 50 мл дистиллированной воды, 5 мл аммиачного буфера, 5-6
капель индикатора, хорошо перемешивают и медленно титруют раствором трилона «Б»
до изменения окраски в сине-сиреневую. Содержание магния в растворе
вычисляют так:
m(Mg) = Т(тр.«Б»/Мg) ×Vтр. ×1000,
Получение гидроксида магния из раствора сульфата магния
Сколько гидроксида магния (Mg(OH)2) (в граммах) образуется, если к 320 граммам 15-процентного раствора сульфата магния (MgSO4) добавить 250 грамм 16-процентного раствора гидроксида натрия (NaOH)?
Решение задачи
Запишем уравнение реакции образования гидроксида магния (Mg(OH)2) из раствора сульфата магния (MgSO4) и раствора гидроксида натрия (NaOH):
Вычислим, сколько сульфата магния (MgSO4) (в граммах) содержится в 320 грамм 15-процентного раствора сульфата магния (MgSO4) по формуле:
m (MgSO4) = 320 ⋅ 0,15 = 48 (г).
Если раствор сульфата магния 15-процентный, то массовая доля сульфата магния (MgSO4) в нем 0,15.
Вычислим, сколько гидроксида натрия (NaOH) (в граммах) содержится в 250 грамм 16-процентного раствора гидроксида натрия (NaOH):
m (NaOH) = 250 ⋅ 0,16 = 40 (г).
Если раствор гидроксида натрия 16-процентный, то массовая доля гидроксида натрия (NaOH) в нем 0,16.
Учитывая, что молярные массы сульфата магния (MgSO4) и гидроксида натрия (NaOH) соответственно равны 120, 40 г/моль (смотри таблицу Менделеева), вычислим химическое количество сульфата магния (MgSO4) в растворе сульфата магния и гидроксида натрия (NaOH) в раствора гидроксида натрия по формуле, устанавливающей связь между массой и химическим количеством вещества:
Получаем:
n (MgSO4) = 48 / 120 = 0,4 (моль),
n (NaOH) = 40 / 40 = 1 (моль).
По уравнению реакции определим, какое вещество находится в избытке, а какое в недостатке. Думаю, стоит напомнить, что расчет следует вести по недостатку.
Так как, гидроксид натрия (NaOH) взят в избытке, расчет следует вести по числу молей сульфата магния (MgSO4). Составим соотношение:
из 1 моль сульфата магния образуется 1 моль гидроксида магния
из 0,4 моль сульфата магния образуется х моль гидроксида магния
Откуда:
Учитывая, что молярная масса гидроксида магния (Mg(OH)2) равна 58 г/моль (смотри таблицу Менделеева), вычислим, сколько (в граммах) образуется гидроксида магния (Mg(OH)2) по формуле нахождения массы через химическое количество вещества:
m (Mg(OH)2) = 0,4 ⋅ 58 = 23,2 (г).
Ответ:
масса гидроксида магния равна 23,2 грамм.