2018-04-16
Найти максимально возможную температуру идеального газа в каждом из нижеследующих процессов:
а) $p = p_{0} — alpha V^{2}$; б) $p = p_{0} e^{ — beta V}$,
где $p_{0}, alpha$ и $beta$ — положительные постоянные, $V$ — объем одного моля газа.
Решение:
(a) $p = p_{0} — alpha V^{2} = p_{0} — alpha left ( frac{RT}{p} right )^{2}$ (так как, $V = RT/p$ для одного моля газа)
Таким образом, $T = frac{1}{R sqrt{ alpha} } p sqrt{p_{0} — p } = frac{1}{R sqrt{ alpha } } sqrt{ p_{0}p^{2} — p^{3} }$ (1)
Для $T_{max}, frac{d(p_{0}p^{2} — p^{3} ) }{dp}$ должно быть равным нулю
что дает, $p = frac{2}{3} p_{0}$ (2)
Следовательно, $T_{max} = frac{1}{R sqrt{ alpha} } frac{2}{3} p_{0} sqrt{p_{0} — frac{2}{3}p_{0} } = frac{2}{3} left ( frac{p_{0} }{R} right ) sqrt{ frac{p_{0} }{3 alpha} }$
(б) $p = p_{0} e^{ — beta V} = p_{0}e^{ — beta RT/p }$
$frac{ beta RT}{p} = ln frac{p_{0} }{p}$, $T = frac{p}{ beta R} ln frac{p_{0} }{p}$ (1)
Для $T_{max}$ условие равно $frac{dT}{dp} = 0$, что дает
$p = frac{p_{0} }{e}$
Следовательно, используя это значение $p$ в уравнении (1), получаем
$T_{max} = frac{p_{0} }{e beta R}$
Тема .
№27 МКТ. Термодинамика (Расчетная задача высокого уровня сложности)
Вспоминай формулы по каждой теме
Решай новые задачи каждый день
Вдумчиво разбирай решения
ШКОЛКОВО.
Готовиться с нами — ЛЕГКО!
Подтемы раздела
№27 мкт. термодинамика (расчетная задача высокого уровня сложности)
.01МКТ
.02Термодинамика
.03Влажность. Водяной пар
.04Тепловые явления
Решаем задачу:
Показать ответ и решение
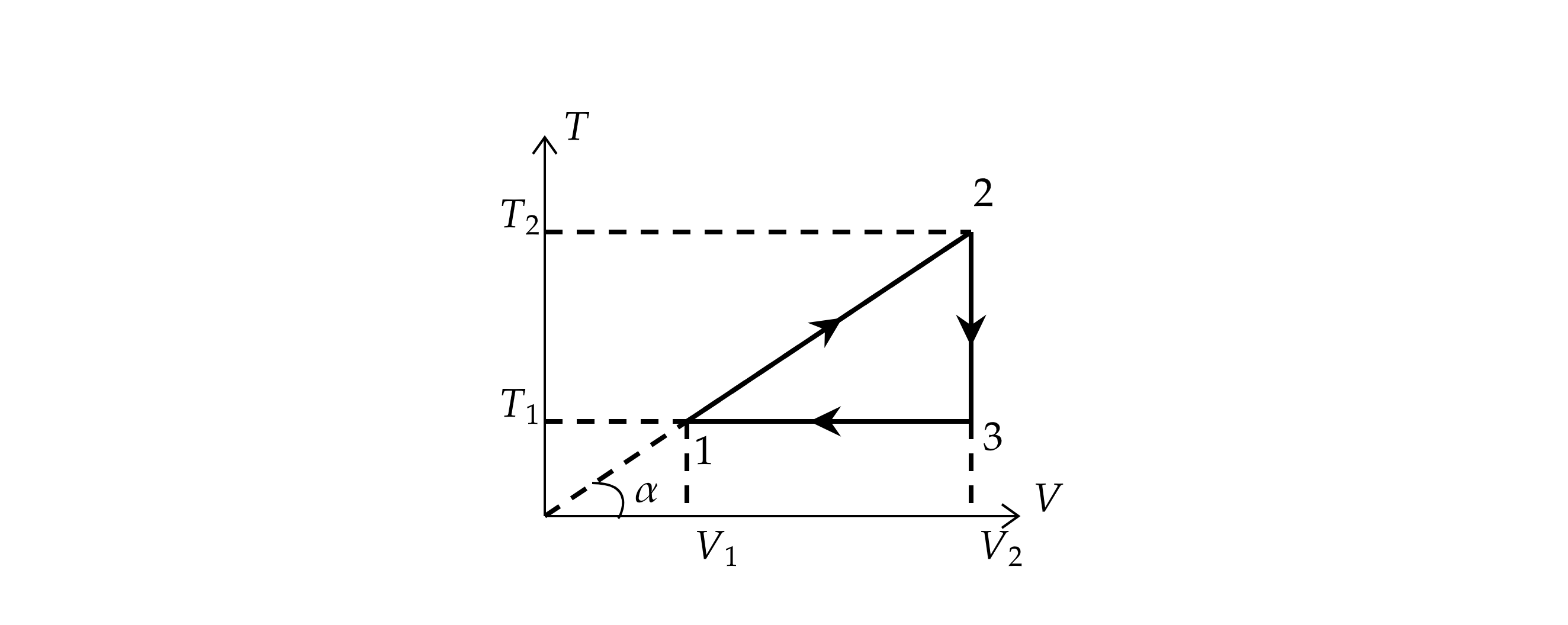
1) По уравнению Менделеева-Клапейрона:
где
– количество вещества,
– давление газа.
Тогда
Так
как по условию , где
– некоторый постоянный коэффициент.
Тогда для процесса 1-2:
То
есть давление постоянно. Тогда по закону Гей-Люссака:
2) Так как 1-2 – изобара, то работа газа равна:
3)
Работа газа за цикл равна:
так
как в процессе 2-3 объём постоянен, то работа равна нулю, при этом . При этом газ получает
количество теплоты в процессе 1-2, значит, КПД равно:
Количество теплоты в процессе 1-2 можно найти по первому началу термодинамики:
где
– изменение внутренней энергии.
Изменение внутренней энергии равно:
Откуда:
КПД
Идеальный газ в количестве 

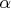
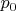
Из данного нам уравнения мы можем найти точку, в которой 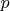


План решения задач на газовые законы
-
Если
в задаче рассматривается одно состояние
газа и требуется найти какой-либо
параметр этого состояния, нужно
воспользоваться уравнением Менделеева
– Клапейрона. -
Если
значения давления и объема явно не
заданы, их нужно выразить через заданные
величины, подставить в записанное
уравнение и, решив его, найти неизвестный
параметр. -
В
том случае, когда в задаче рассматриваются
два различных состояния газа, нужно
установить, изменяется ли масса газа
при переходе из одного состояния в
другое. Если масса остается постоянной,
можно применить уравнение Клапейрона.
Если же при постоянной массе в данном
процессе не изменяется какой-либо из
параметров ( р,V или Т), применяются
уравнение соответствующего закона
(Гей-Люссака, Шарля или Бойля-Мариотта). -
Если
в двух состояниях масса газа разная,
то для каждого состояния записывают
уравнение Менделеева-Клапейрона. Затем
систему уравнений решают относительно
искомой величины.
Примеры решения задач
Пример 3.1. Определите
число молекул воды в бутылке вместимостью
0,33л. Молярная масса воды М=18∙10-3
кг/моль, плотность воды ρ=1г/см3.
Дано:
V=0,33л=0,33∙10-3
м3;
М=18∙10-3
кг/моль; ρ=1г/см3=
1∙103
кг/м3;
Найти:
N.
Решение:
Масса
воды, занимающей объём V,
m=ρV,
(1)
где
ρ – плотность воды.
Масса
молекулы
,
(2)
где
М – молярная масса; NA=6,02∙
1023моль-1
–
постоянная Авогадро.
Число
молекул в бутылке
(3)
Подставляя
в выражение (3) формулы (1) и (2), получим
искомое число молекул:
.
Ответ:
N=1,1∙1025.
Пример 3.1. Узкая
цилиндрическая трубка, закрытая с одного
конца, содержит воздух, отделённый от
наружного воздуха столбиком ртути.
Когда трубка обращена закрытым концом
кверху, воздух внутри неё занимает длину
ℓ, когда же трубка обращена кверху
открытым концом, то воздух внутри неё
занимает длину ℓ’ < ℓ. Длина ртутного
столбика h мм. Определить атмосферное
давление.
Дано:
ℓ; ℓ’ < ℓ; h.
Найти:
Р.
Решение:
В данном процессе
изменяются давление и объём воздуха, а
температура остаётся постоянной.
Следовательно, если начальные параметры
воздуха обозначить Р1
и V1,
а конечные как Р2
и V2 получаем
следующее соотношение:
Р1V1
= Р2V2
Когда
трубка обращена закрытым концом кверху,
воздух в ней находится под давлением
Р1=
Ратм
– h ( здесь и далее измеряем в мм.рт. ст.).
Если же трубку перевернуть, давление
воздуха в ней будет равно Р2
= Ратм
+ h .
Учитывая,
что V1 =
Sℓ1,
V2 =
Sℓ2,
где S — площадь сечения трубки, получаем:
(Ратм
– h) Sℓ =
(Ратм
+ h) Sℓ’,
Отсюда
находим атмосферное давление
Ответ.
Пример
3.2. В сосуде находится
смесь m = 7 г азота и m = 11г углекислого
газа при температуре Т = 290 К и давлении
Р = 1 атм. Найти плотность этой смеси,
считая газа идеальными.
Дано:
m1=7
г=7∙10-3кг;
m2=11
г=11∙10-3кг;
Т=290К; Р=1атм=105Па.
Найти:
ρ.
Решение:
Давление газов в сосуде
известно. Если через Р1
обозначить давление
азота, если бы углекислого газа не было,
а через Р2 давление
углекислого газа, если бы не было азота
(так называемые парциальными давления),
то давление смеси газов Р будет согласно
закону Дальтона Р =
Р1 +
Р2.
Учитывая, что температура каждого газа
Т запишем для азота и кислорода уравнение
Менделеева-Клапейрона:
Складывая
эти выражения, получаем:
Отсюда
находим объём, занимаемый смесью газов
Плотность
смеси газов вычисляется по формуле
Ответ:
Пример
3.3. Кислород массой
m=10г
находится под давлением 200кПа при
температуре 280К. В результате изобарного
расширения газ занял объём 9л. Определите:
1) объём газа V1
до расширения; 2) температуру газа T2
после расширения; 3) плотность газа ρ2
после расширения.
Дано:
M=32∙10-3кг/моль;
m=10г=10∙10-3кг;
р=200кПа=2∙105Па=const;
Т1=280К;
V2=9г=9∙10-3м3.
Найти:
1) V1;
2) Т2;
3) ρ2.
Решение:
Объём газа до расширения найдём, согласно
уравнению Клапейрона-Менделеева,
,
откуда
Записав уравнение Клапейрона-Менделеева
для конечного состояния газа:
,
найдём искомую температуру
Плотность газа после расширения газа
.
Ответ:
1) V1=3,64
л; 2) Т2=693
К; 3) ρ2=1,11
кг/м3.
Пример 3.3. В
цилиндре с площадью основания 100 см2
находится воздух. Поршень расположен
на высоте 50 см от дна цилиндра. На поршень
кладут груз массой 50 кг, при этом он
опускается на 10 см. Найти температуру
воздуха после опускания поршня, если
до его опускания давление было равно
101 кПа, а температура 12С.
Дано: S=100см2=1∙10-2м2;h1=50см=0,5
м;m=50кг; Δh=10см=0,1
мt;P1=101∙103Па; Т1=12С=285
К.
Найти:
Т2.
Решение:
Рассмотрим два состояния воздуха под
поршнем: до опускания поршня и после
его опускания. До опускания поршня
состояние воздуха характеризуется
параметрами Р1,
V1,
T1,
после опускания поршня – параметрами
Р2,
V2,
T2,
где V1=Sh1,
Р2=Р0+Р,
,
V2=Sh2,
или, поскольку h2=h1—
Δh,
V2=S(h1—
Δh).
Применим
к этим двум состояниям формулу Клапейрона:
,
откуда
(1)
Подставим
в формулу (1) выражения для Р1,
V1,
Р2
и V2:
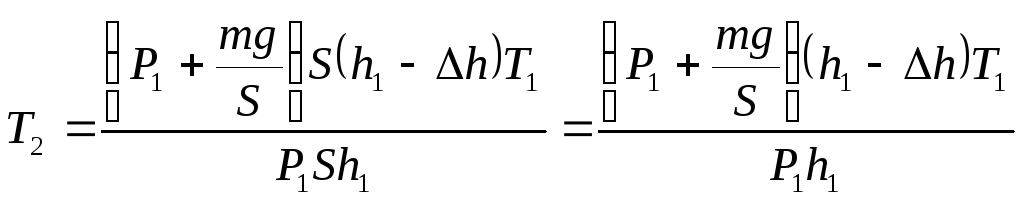
Ответ:
Т2=338К
Пример 3.3. Имеются
два сосуда с газом: один вместимостью
3 л, другой 4 л. В первом сосуде газ
находится под давлением 202 кПа, а во
втором 101 кПа. Под каким давлением будет
находиться газ, если эти cосуды соединить
между собой? Считать, что температура
в сосудах одинакова и постоянна.
Дано: V1=3л=3∙10—3м3;V2=4л=4∙10—3м3;Р1=202кПа=202∙103Па; Р2=101кПа=101∙103Па.
Найти:
Р.
Решение:
По закону Дальтона,
Р
= Р3
+ Р4 (1)
Так
как процесс изотермический, то парциальное
давление газа в каждом сосуде можно
найти по закону Бойля-Мариотта:
Р1V1
=
Р3V,
Р2V2
=
Р4V,
где
V=V1+V2.
Тогда парциальное давление газа в каждом
из сосудов после их соединения
,
, (2)
Подставляем
выражения (2) в (1):
Ответ:
Р=141 Па
Пример 3.3. В
баллоне содержатся сжатый газ при
температуре t1
= 27С
и давлении p1
= 4 МПа. Каково будет давление, если из
баллона выпустить
Δm
= 0,4m
массы газа, а температуру понизить до
t2
= 17С?
Дано: Т1=27С
=300 К;Р1=4МПа=4∙106
Па;Δm
= 0,4m;
Т2=17С
=290 К Найти:
Р.
Решение: Рассмотрим
два состояния газа: до разрежения и
после, когда осталось1-n массы m газа.
Параметры каждого из этих состояний
связаны уравнением Менделеева-Клапейрона:
,
где
Р1,
Т1,
Р2,
Т2
– соответственно давление и температура
газа до и после выпуска; m — масса газа;
М – молярная масса; V — объем.
Разделив
почленно первое равенство на второе,
получим:
,
oткуда
(1)
Ответ:
Р2
= 2,3106
Па = 2,3 МПа.
Пример
3.3. Найти максимально
возможную температуру идеального газа
в процессе P = P0
– αV2,
где P0,
α — положительные постоянные.
Дано:
P = P0
– αV2;
P0, α
— const
Найти:
Tmax.
Решение:
Для нахождения максимальной температуры
необходимо получить явную зависимость
последней от параметров и исследовать
эту зависимость на экстремум. Так как
газ является идеальным, выразим давление
из уравнения Менделеева-Клапейрона и
подставим его в уравнение процесса
Отсюда
выражаем температуру
Условие экстремума
,
которое сводится к выражению.
Решая
данное уравнение, получаем значение
объёма, при котором температура принимает
экстремальное значение
.
Исследуя знак второй производной, приходим к выводу, что при данном
значении объёма температура газа будет
идеальной. Подставляя выражение для
объёма в выражение для температуры при
данном процессе, получаем:
Ответ:
Пример
3.3. В сосуде
вместимостью V=5л
находится кислород массой m=15г.
определите: 1) концентрацию молекул
кислорода в сосуде; 2) число N
молекул газа в сосуде.
Дано:
V=5л=5∙10-3м3;
M=32∙10-3кг/моль;
m=15г=1,5∙10-2кг.
Найти:
1) n; 2) N.
Решение:
Записав
уравнение Клапейрона-Менделеева
(1)
И
уравнение состояния идеального газа
Р=nkT
(2)
И
поделив (1) на (2), найдём искомую концентрацию
молекул кислорода в сосуде
.
Концентрация
молекул
,
Откуда
искомое число молекул газа в сосуде
N=nV.
Ответ:
1)
n=5,64∙1025
м-3;
2) N=2,82∙1023.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
72,2% бесплатных материалов
967 руб. средняя цена курсовой работы
353 руб. средняя цена домашнего задания
116 руб. средняя цена решённой задачи
161 руб. средняя цена лабораторной работы
174 руб. средняя цена реферата
177 руб. средняя цена доклада
1626 руб. средняя цена ВКР
665 руб. средняя цена диссертации
596 руб. средняя цена НИР
358 руб. средняя цена отчёта по практике
276 руб. средняя цена ответов (шпаргалок)
202 руб. средняя цена лекций
232 руб. средняя цена семинаров
280 руб. средняя цена рабочей тетради
187 руб. средняя цена презентации
67 руб. средняя цена перевода
143 руб. средняя цена изложения
150 руб. средняя цена сочинения
308 руб. средняя цена статьи
Гарантия возврата средств