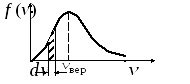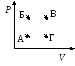№30 вариант 7 ЕГЭ 2016 под ред. Монастырского. Одноатомный идеальный газ совершает процесс, график которого изображён на рисунке. Найдите максимальное значение внутренней энергии газа в ходе данного процесса.

U(V)/=0. Зависимость между P и V линейной функцией: P= kV + P0, где к = (P2-P1)/(V2-V1), к=(12-16)103/(3-1)=
=-2.103. P0 найдем подстановкой любого значения, возьмем первую точку: 16.103 = -2.103.1+ P0, P0=18.103.
Получим зависимость P= -2.103V+18.103 и подставим в уравнение внутренней энергии: U=3(-2.103V+18.103)V/2=
=-3.103V2+27.103V. Найдем произхводную и приравняем к нулю: -6.103V+27.103=0, получим v= 4,5 м3. Найдем давление при этом значении объема: P= -2.103.4,5 + 18.103= 9.103 Па и U= 3.9.103.4,5/2 =60,75.103 Дж = 60,8 кДж.
Ответ: 60,8 кДж.
Как найти внутреннюю энергию воды. Термодинамика
«Физика — 10 класс»
Тепловые явления можно описывать с помощью величин (макроскопических параметров), измеряемых такими приборами, как манометр и термометр. Эти приборы не реагируют на воздействие отдельных молекул. Теория тепловых процессов, в которой не учитывается молекулярное строение тел, называется термодинамикой
. В термодинамике рассматриваются процессы с точки зрения превращения теплоты в другие виды энергии.
Что такое внутренняя энергия.
Какие способы изменения внутренней энергии вы знаете?
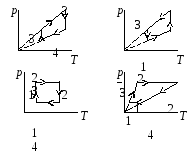
Термодинамика была создана в середине XIX в. после открытия закона сохранения энергии. В её основе лежит понятие внутренняя энергия
. Само название «внутренняя» предполагает рассмотрение системы как ансамбля движущихся и взаимодействующих молекул. Остановимся на вопросе о том, какая связь существует между термодинамикой и молекулярно-кинетической теорией.
Термодинамика и статистическая механика.
Первой научной теорией тепловых процессов была не молекулярно-кинетическая теория, а термодинамика.
Термодинамика возникла при изучении оптимальных условий использования теплоты для совершения работы. Это произошло в середине XIX в., задолго до того, как молекулярно-кинетическая теория получила всеобщее признание. Тогда же было доказано, что наряду с механической энергией макроскопические тела обладают ещё и энергией, заключённой внутри самих тел.
Сейчас в науке и технике при изучении тепловых явлений используется как термодинамика, так и молекулярно-кинетическая теория. В теоретической физике молекулярно-кинетическую теорию называют статистической механикой
Термодинамика и статистическая механика изучают различными методами одни и те же явления и взаимно дополняют друг друга.
Термодинамической системой
называют совокупность взаимодействующих тел, обменивающихся энергией и веществом.
Внутренняя энергия в молекулярно-кинетической теории.
Основным понятием в термодинамике является понятие внутренней энергии.
Внутренняя энергия тела
(системы) — это сумма кинетической энергии хаотичного теплового движения молекул и потенциальной энергии их взаимодействия.
Механическая энергия тела (системы) как целого не входит во внутреннюю энергию. Например, внутренняя энергия газов в двух одинаковых сосудах при равных условиях одинакова независимо от движения сосудов и их расположения относительно друг друга.
Вычислить внутреннюю энергию тела (или её изменение), учитывая движение отдельных молекул и их положения относительно друг друга, практически невозможно из-за огромного числа молекул в макроскопических телах. Поэтому необходимо уметь определять значение внутренней энергии (или её изменение) в зависимости от макроскопических параметров, которые можно непосредственно измерить.
Внутренняя энергия идеального одноатомного газа.
Вычислим внутреннюю энергию идеального одноатомного газа.
Согласно модели молекулы идеального газа не взаимодействуют друг с другом, следовательно, потенциальная энергия их взаимодействия равна нулю. Вся внутренняя энергия идеального газа определяется кинетической энергией беспорядочного движения его молекул.
Для вычисления внутренней энергии идеального одноатомного газа массой т нужно умножить среднюю кинетическую энергию одного атома на число атомов. Учитывая, что kN A = R, получим формулу для внутренней энергии идеального газа:
Внутренняя энергия идеального одноатомного газа прямо пропорциональна его абсолютной температуре.
Она не зависит от объёма и других макроскопических параметров системы.
Изменение внутренней энергии идеального газа
т. е. определяется температурами начального и конечного состояний газа и не зависит от процесса.
Если идеальный газ состоит из более сложных молекул, чем одноатомный, то его внутренняя энергия также пропорциональна абсолютной температуре, но коэффициент пропорциональности между U и Т другой. Объясняется это тем, что сложные молекулы не только движутся поступательно, но ещё и вращаются и колеблются относительно своих положений равновесия. Внутренняя энергия таких газов равна сумме энергий поступательного, вращательного и колебательного движений молекул. Следовательно, внутренняя энергия многоатомного газа больше энергии одноатомного газа при той же температуре.
Зависимость внутренней энергии от макроскопических параметров.
Мы установили, что внутренняя энергия идеального газа зависит от одного параметра — температуры.
У реальных газов, жидкостей и твёрдых тел средняя потенциальная энергия взаимодействия молекул не равна нулю
. Правда, для газов она много меньше средней кинетической энергии молекул, но для твёрдых и жидких тел сравнима с ней.
Средняя потенциальная энергия взаимодействия молекул газа зависит от объёма вещества, так как при изменении объёма меняется среднее расстояние между молекулами. Следовательно, внутренняя энергия реального газа в термодинамике в общем случае зависит наряду с температурой T и от объёма V.
Можно ли утверждать, что внутренняя энергия реального газа зависит от давления, основываясь на том, что давление можно выразить через температуру и объём газа.
Значения макроскопических параметров (температуры Т объёма V и др.) однозначно определяют состояние тел. Поэтому они определяют и внутреннюю энергию макроскопических тел.
Внутренняя энергия U макроскопических тел однозначно определяется параметрами, характеризующими состояние этих тел: температурой и объёмом.
Определение
Внутренней энергией тела (системы)
называют энергию, которая связана со всеми видами движения и взаимодействия частиц,
составляющих тело (систему), включая энергию взаимодействия и движения сложных частиц.
Из выше сказанного следует, что к внутренней энергии не относят кинетическую энергию движения центра масс системы и потенциальную энергию системы, вызванную действием внешних сил. Это энергия, которая зависит только от термодинамического состояния системы.
Внутреннюю энергию чаще всего обозначают буквой U. При этом бесконечно малое ее изменение станет обозначаться dU. Считается, что dU является положительной величиной, если внутренняя энергия системы растет, соответственно, внутренняя энергия отрицательна, если внутренняя энергия уменьшается.
Внутренняя энергия системы тел равна сумме внутренних энергий каждого отдельного тела плюс энергия взаимодействия между телами внутри системы.
Внутренняя энергия – функция состояния системы. Это означает, что изменение внутренней энергии системы при переходе системы из одного состояния в другое не зависит от способа перехода (вида термодинамического процесса при переходе) системы и равно разности внутренних энергий конечного и начального состояний:
Для кругового процесса полное изменение внутренней энергии системы равно нулю:
Для системы, на которую не действуют внешние силы и находящуюся в состоянии макроскопического покоя, внутренняя энергия – полная энергия системы.
Внутренняя энергия может быть определена только с точностью до некоторого постоянного слагаемого (U 0), которое не определимо
методами термодинамики. Однако, данный факт не существенен, так как при использовании термодинамического анализа, имеют дело с изменениями
внутренней энергии, а не абсолютными ее величинами. Часто U_0 полагают равным нулю. При этом в качестве внутренней энергии рассматривают ее
составляющие, которые изменяются в предлагаемых обстоятельствах.
Внутреннюю энергию считают ограниченной и ее граница (нижняя) соответствует T=0K.
Внутренняя энергия идеального газа
Внутренняя энергия идеального газа зависит только от его абсолютной температуры (T) и пропорциональна массе:
где C V – теплоемкость газа в изохорном процессе; c V — удельная теплоемкость газа в изохорном процессе;
– внутренняя энергия, приходящаяся на единицу массы газа
при абсолютном нуле температур. Или:
i – число степеней свободы молекулы идеального газа, v – число молей газа, R=8,31 Дж/(моль К) – универсальная газовая постоянная.
Первое начало термодинамики
Как известно первое начало термодинамики имеет несколько формулировок. Одна из формулировок, которую предложил К.
Каратеодори говорит о существовании внутренней энергии как составляющей полной энергии системы.Она является функцией состояния,
в простых системах зависящей от объема (V), давления (p), масс веществ (m i), которые составляют данную систему:
. В формулировке, которую дал Каратеодори внутренняя
энергия не является характеристической функцией своих независимых переменных.
В более привычных формулировках первого начала термодинамики, например, формулировке Гельмгольца внутренняя энергия системы вводится как физическая характеристика системы. При этом поведение системы определено законом сохранения энергии. Гельмгольц не определяет внутреннюю энергию как функцию конкретных параметров состояния системы:
– изменение внутренней энергии в равновесном процессе,
Q – количество теплоты, которое получила система в рассматриваемом процессе, A – работа, которую система совершила.
Единицы измерения внутренней энергии
Основной единицей измерения внутренней энергии в системе СИ является: [U]=Дж
Примеры решения задач
Пример
Задание.
Вычислите, на какую величину изменится внутренняя энергия гелия имеющего массу 0,1 кг, если его температура увеличилась на 20С.
Решение.
При решении задачи считаем гелий одноатомным идеальным газом, тогда для расчетов можно применить формулу:
Так как мы имеем с одноатомным газом, то , молярную массу
() возьмем из таблицы Менделеева
( кг/моль). Масса газа в представленном процессе
не изменяется, следовательно, изменение внутренней энергии равно:
Все величины необходимые для вычислений имеются:
Ответ.
(Дж)
Пример
Задание.
Идеальный газ расширили в соответствии с законом, который изображен графиком на рис.1. от начального объема
V 0 . При расширении объем сал равен .
Каково приращение внутренней энергии газа в заданном процессе? Коэффициент адиабаты равен
.
При
изучении тепловых явлений наряду с
механической энергией тел вводится
новый вид энергии
—
внутренняя
энергия. Вычислить внутреннюю энергию
идеального газа не составляет большого
труда.
Наиболее
прост по своим свойствам одноатомный
газ, т. е. газ, состоящий из отдельных
атомов, а не молекул. Одноатомными
являются инертные газы — гелий, неон,
аргон и др. Можно получить одноатомный
(атомарный) водород, кислород и т. д.
Однако такие газы будут неустойчивыми,
так как при столкновениях атомов
образуются молекулы Н 2 ,
О 2
и др.
Молекулы
идеального газа не взаимодействуют
друг с другом, кроме моментов
непосредственного столкновения. Поэтому
их средняя потенциальная энергия очень
мала и вся
энергия представляет собой кинетическую
энергию хаотического движения молекул.
Это,
конечно, справедливо, если сосуд с газом
покоится, т. е. газ как целое не движется
(его центр масс находится в покое). В
этом случае упорядоченное движение
отсутствует и механическая энергия
газа равна нулю. Газ обладает энергией,
которую называют внутренней.
Для
вычисления внутренней энергии идеального
одноатомного газа массой т
нужно
умножить среднюю энергию одного атома,
выражаемую формулой (4.5.5), на число
атомов. Это число равно произведению
количества вещества
на
постоянную Авогадро N
A
.
Умножая
выражение (4.5.5) на

получим
внутреннюю энергию идеального одноатомного
газа:

Внутренняя
энергия идеального газа прямо
пропорциональна его абсолютной
температуре.
От
объема газа она не зависит. Внутренняя
энергия газа представляет собой среднюю
кинетическую энергию всех его атомов.
Если
центр масс газа движется со скоростью
v
0
,
то
полная энергия газа равна сумме
механической (кинетической) энергии

:
(4.8.2)
Внутренняя энергия молекулярных газов
Внутренняя энергия
одноатомного газа (4.8.1) — это по существу
средняя кинетическая энергия
поступательного движения молекул. В
отличие от атомов молекулы, лишенные
сферической симметрии, могут еще
вращаться. Поэтому наряду с кинетической
энергией поступательного движения
молекулы обладают и кинетической
энергией вращательного движения.
В
классической молекулярно-кинетической
теории атомы и молекулы рассматриваются
как очень маленькие абсолютно твердые
тела. Любое тело в классической механике
характеризуется определенным числом
степеней свободы
f
— числом независимых переменных
(координат), однозначно определяющих
положение тела в пространстве.
Соответственно число независимых
движений, которые тело может совершать,
также равно f
.
Атом
можно рассматривать как однородный
шарик с числом степеней свободы f
=
3 (рис. 4.16, а). Атом может совершать только
поступательное движение по трем
независимым взаимно перпендикулярным
направлениям. Двухатомная молекула
обладает осевой симметрией (рис. 4.16, б)
и
имеет пять степеней свободы. Три степени
свободы соответствуют ее поступательному
движению и две — вращательному вокруг
двух осей, перпендикулярных друг другу
и оси симметрии (линии, соединяющей
центры атомов в молекуле). Многоатомная
молекула, подобно, твердому телу
произвольной формы, характеризуется
шестью степенями свободы (рис. 4.16, в);
наряду
с поступательным движением молекула
может совершать вращения вокруг трех
взаимно перпендикулярных осей.
От числа степеней
свободы молекул зависит внутренняя
энергия газа. Вследствие полной
беспорядочности теплового движения ни
один из видов движения молекулы не имеет
преимущества перед другим. На каждую
степень свободы, соответствующую
поступательному или вращательному
движению молекул, приходится одна и та
же средняя кинетическая энергия. В этом
состоит теорема о равномерном распределении
кинетической энергии по степеням свободы
(она строго доказывается в статистической
механике).
Средняя
кинетическая энергия поступательного
движения молекул равна

Поступательному
движению соответствуют три степени
свободы. Следовательно, средняя
кинетическая энергия

приходящаяся на одну степень свободы,
равна:

Если
эту величину умножить на число степеней
свободы и число молекул газа массой т,
то
получится внутренняя энергия произвольного
идеального газа:

Эта
формула отличается от формулы (4.8.1) для
одноатомного газа заменой множителя 3
на множитель f
.
Внутренняя
энергия идеального газа прямо
пропорциональна абсолютной температуре
и не зависит от объема газа.
Мы знаем, что внутреннюю энергию тела можно изменить двумя способами — путем совершения работы и путем теплообмена. При осуществлении первого из этих способов внутренняя энергия тела изменяется на величину совершенной работы А, а при осуществлении второго из них — на величину, равную количеству переданной теплоты Q.
Обозначим начальную внутреннюю энергию тела через U 1 , а конечную (после того, как ее изменили) — через U 2 . Тогда изменение внутренней энергии тела будет равно разности U 2 -U 1 . Изменение любой физической величины в физике принято обозначать греческой буквой А (дельта) Поэтому мы можем записать:
ΔU — изменение внутренней энергии
U = U 2 – U 1
Изменение внутренней энергии может выражаться как положительной, так и отрицательной величиной:
1) если внутренняя энергия тела увеличивается, то U 2 > U 1 и, следовательно, ΔU > 0;
2) если внутренняя энергия тела уменьшается, то U 2 < U 1 и, следовательно, ΔU < 0.
В зависимости от того, каким путем (путем совершения над телом работы или путем теплообмена) изменялась внутренняя энергия тела, ее изменение можно рассчитывать двумя способами:
ΔU = A — при совершении работы (33.1)
ΔU = Q — при теплообмене (33.2)
Применяя уравнение (33.1), следует помнить, что в его правой части фигурирует работа внешних сил, действующих на тело. Работа самого тела A тела отличается от нее знаком:
A тела = –A
Количество теплоты Q также может быть как положительным, так и отрицательным:
1) если внутренняя энергия тела увеличивается в процессе теплообмена, то Q>О (тело получает количество теплоты);
2) если внутренняя энергия тела уменьшается в процессе теплообмена, то Q<0 (тело отдает количество теплоты).
В общем случае внутренняя энергия тела (или системы тел) может изменяться сразу двумя способами — и путем совершения работы, и путем теплообмена. Тогда для расчета изменения внутренней энергии применяют уравнение
ΔU = A + Q (33.3)
Согласно этому уравнению, изменение внутренней энергии системы равно сумме работы внешних сил и количества теплоты, полученного системой.
1. Как обозначаются внутренняя энергия тела и изменение внутренней энергии тела? 2. В каком случае изменение внутренней энергии тела положительно и в каком отрицательно? 3. Какой знак имеет: а) количество теплоты, полученное телом; б) количество теплоты, отданное телом? Почему? 4. Напишите формулу, по которой рассчитывается изменение внутренней энергии тела при теплообмене. 5. Напишите формулу, по которой рассчитывается изменение внутренней энергии тела при совершении над ним работы. 6. По какой формуле рассчитывается изменение внутренней энергии в общем случае?
Термодинамика как дисциплина сформировалась к середине 19-го столетия. Это произошло после открытия закона о сохранении энергии. Существует определенная связь между термодинамикой и молекулярной кинетикой. Какое место в теории занимает внутренняя энергия? Рассмотрим это в статье.
Статистическая механика и термодинамика
Исходной научной теорией о тепловых процессах стала не молекулярно-кинетическая. Первой была термодинамика. Она сформировалась в процессе изучения оптимальных условий применения теплоты для осуществления работы. Это случилось в середине 19-го столетия, до того как молекулярная кинетика получила признание. На сегодняшний день в технике и науке применяется как термодинамика, так и молекулярно-кинетическая теория. Последняя в теоретической физике именуется статистической механикой. Она наряду с термодинамикой исследует с применением различных методов одинаковые явления. Эти две теории взаимно дополняют друг друга. Основа термодинамики составлена двумя ее законами. Оба они касаются поведения энергии и установлены опытным путем. Законы эти справедливы для любого вещества вне зависимости от внутреннего строения. Более глубокой и точной наукой считается статистическая механика. По сравнению с термодинамикой она представляет большую сложность. Ее применяют в том случае, когда термодинамические соотношения оказываются недостаточными для объяснения исследуемых явлений.
Молекулярно-кинетическая теория
К середине 19-го века было доказано, что наряду с механической существует и внутренняя энергия макроскопических тел. Она входит в баланс энергетических природных превращений. После того как была открыта внутренняя энергия, было сформулировано положение о ее сохранении и превращении. В то время как шайба, скользящая по льду, останавливается под воздействием силы трения, ее кинетическая (механическая) энергия не просто перестает существовать, но и передается молекулам шайбы и льда. При движении неровности поверхностей тел, подвергающихся трению, деформируются. При этом интенсивность движущихся беспорядочно молекул возрастает. При нагревании обоих тел возрастает внутренняя энергия. Нетрудно пронаблюдать и обратный переход. При нагревании воды в закрытой пробирке внутренняя энергия (и ее, и образующегося пара) начинает возрастать. Давление увеличится, в результате чего пробка будет вытеснена. Внутренняя энергия пара станет причиной увеличения кинетической энергии. В процессе расширения пар совершает работу. При этом его внутренняя энергия уменьшается. В итоге происходит охлаждение пара.
Внутренняя энергия. Общая информация
При беспорядочном движении всех молекул сумма их кинетических энергий, а также потенциальных энергий их взаимодействий составляет внутреннюю энергию. Учитывая положение молекул относительно друг друга и их движение, вычислить эту сумму практически невозможно. Это обусловлено огромным количеством элементов в макроскопических телах. В связи с этим необходимо уметь вычислять значение в соответствии с макроскопическими параметрами, которые можно измерить.
Одноатомный газ
Вещество считается достаточно простым по своим свойствам, поскольку состоит из отдельных атомов, а не молекул. К одноатомным газам относят аргон, гелий, неон. Потенциальная энергия в данном случае равна нулю. Это обусловлено тем, что молекулы в идеальном газе друг с другом не взаимодействуют. Кинетическая энергия беспорядочного молекулярного движения является определяющей для внутренней (U). Для того чтобы вычислить U одноатомного газа массой m, нам необходимо произвести умножение кинетической энергии (средней) 1-го атома на общее число всех атомов. Но при этом нужно учитывать, что kNA=R. Исходя из имеющихся у нас данных, мы получаем следующую формулу: U= 2/3 х m/M х RT,
где внутренняя энергия прямо пропорциональна абсолютной температуре. Все изменения U определяются только T (температурой), замеренной в изначальном и итоговом состоянии газа, и не имеют прямого отношения к объему. Это связано с тем, что взаимодействия его потенциальной энергии равны 0, и уж вовсе не зависят от других системных параметров макроскопических объектов. При наличии более сложных молекул идеальный газ также будет иметь внутреннюю энергию, прямо пропорциональную абсолютной температуре. Но, надо сказать, при этом между U и T коэффициент пропорциональности изменится. Ведь сложные молекулы выполняют не только поступательные движения, но и вращательные. Внутренняя энергия равна сумме этих движений молекул.
От чего зависит U?
Внутренняя энергия находится под влиянием одного из макроскопических параметров. Это температура. У реальных газов, жидких и твердых тел потенциальная энергия (средняя) при взаимодействии молекул не равняется нулю. Хотя, если рассмотреть точнее, для газов она много меньше кинетической (средней же). При этом для твердых и жидких тел — сравнима с ней. А вот средняя U зависит от V вещества, потому что в период его изменения меняется и среднее расстояние, которое есть между молекулами. Из этого следует, что в термодинамике внутренняя энергия зависит не только от температуры T, но и от V (объема). Их значение однозначно определяет состояние тел, а значит и U.
Мировой океан
Сложно представить, какие невероятно большие запасы энергии содержит в себе Мировой океан. Рассмотрим, что собой представляет внутренняя энергия воды. Надо отметить, что она же является тепловой, потому что образовалась в результате перегрева жидкой части поверхности океана. Так вот, имея разницу, к примеру, в 20 градусов по отношению к донной воде, она приобретает значение около 10^26 Дж. При измерении течений в океане его кинетическая энергия оценивается величиной около 10^18 Дж.
Глобальные проблемы
Существуют глобальные проблемы, которые можно поставить на мировой уровень. К ним относят:
Истощение запасов ископаемого топлива (в первую очередь нефти и газа);
Значительное загрязнение окружающей среды, связанное с использованием этих ископаемых;
Тепловое «загрязнение», плюс ко всему повышение концентрации атмосферной углекислоты, грозящее глобальными климатическими нарушениями;
Использование урановых запасов, приводящих к появлению радиоактивных отходов, которые весьма негативно сказываются на жизнедеятельности всего живого;
Использование термоядерной энергии.
Заключение
Вся эта неопределенность касательно ожидания последствий, которые непременно настанут, если не перестать потреблять энергию, добытую такими способами, заставляет ученых и инженеров уделять практически все свое внимание решению этой проблемы. Их главной задачей является поиск оптимального источника энергии, Немаловажно и задействование различных природных процессов. Среди них наибольший интерес представляют: солнце, вернее солнечное тепло, ветер и энергия в Мировом океане.
Во многих странах моря и океаны давно рассматривают как источник энергии, и их перспективы становятся все более многообещающими. Океан таит в себе немало тайн, его внутренняя энергия — это бездонный кладезь возможностей. Одно только то, сколько способов извлечения энергии он нам предоставляет (таких как океанские течения, энергия приливов и отливов, термальная энергия и другие), уже заставляет задуматься о его величии.
Сообщения без ответов | Активные темы
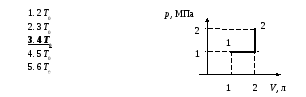
Определить максимальное значение внутренней энергии газа
Модераторы: Prokop, mad_math
| Автор | Сообщение | |||
|---|---|---|---|---|
|
Kikki |
Заголовок сообщения: Определить максимальное значение внутренней энергии газа
|
|||
|
В осях V (объем), p (давление) график процесса в идеальном одноатомном газе имеет вид прямой, соединяющей точки (0,8 л; 100 кПа) и (1 л; 80 кПа). Определите максимальное значение внутренней энергии газа в ходе процесса. Масса газа постоянна.
|
|||
| Вернуться к началу |
|
|||
| Похожие темы | Автор | Ответы | Просмотры | Последнее сообщение |
|---|---|---|---|---|
|
Найти изменение внутренней энергии газа
в форуме Молекулярная физика и Термодинамика |
Kikki |
1 |
1351 |
06 июн 2013, 16:30 |
|
Найти изменение внутренней энергии газа и работу
в форуме Молекулярная физика и Термодинамика |
Orion |
0 |
465 |
13 дек 2014, 14:48 |
|
Изменение внутренней энергии
в форуме Молекулярная физика и Термодинамика |
rivan1 |
3 |
362 |
24 апр 2022, 10:30 |
|
Определение внутренней энергии молекул азота;
в форуме Молекулярная физика и Термодинамика |
Kikki |
0 |
971 |
07 июн 2013, 10:53 |
|
Найти максимальное значение OE * AC
в форуме Геометрия |
Igor kupryniuk |
3 |
160 |
01 фев 2020, 16:15 |
|
Найти максимальное значение
в форуме Дифференциальное исчисление |
arabic |
2 |
283 |
13 окт 2015, 21:32 |
|
Задача про максимальное значение
в форуме Задачи со школьных и студенческих олимпиад |
rabbit-a |
9 |
437 |
18 авг 2021, 23:47 |
|
Максимальное значение выражения
в форуме Алгебра |
gfibr |
4 |
177 |
12 мар 2019, 20:22 |
|
Найти максимальное значение
в форуме Исследование операций и Задачи оптимизации |
AriaRot |
3 |
371 |
20 мар 2016, 18:05 |
|
Максимальное значение интеграла
в форуме Интегральное исчисление |
KOPMOPAH |
3 |
289 |
13 фев 2020, 18:35 |
Кто сейчас на конференции |
|
Сейчас этот форум просматривают: нет зарегистрированных пользователей и гости: 2 |
| Вы не можете начинать темы Вы не можете отвечать на сообщения Вы не можете редактировать свои сообщения Вы не можете удалять свои сообщения Вы не можете добавлять вложения |
Powered by phpBB © 2000, 2002, 2005, 2007 phpBB Group
Вы можете создать форум бесплатно PHPBB3 на Getbb.Ru, Также возможно сделать готовый форум PHPBB2 на Mybb2.ru
Русская поддержка phpBB
Молекулярно-кинетическая теория идеальных газов. Внутренняя энергия
1. Газ считается идеальным, если
можно пренебречь …
А. взаимодействием молекул на
расстоянии
Б. скоростью молекул
В. массой молекул
Г. размером молекул
Д. столкновением молекул
1. А, Б 2. Б, В 3. А, Г4. Б,
Д 5. В, Г
2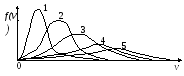
кривых зависимости функции распределения
Максвелла от скорости, наименьшей
температуре соответствует кривая …
1. 1 2. 2
3. 3 4. 4 5. 5
3.На рисунке представлен график
функции распределения молекул идеального
газа по скоростям (распределение
Максвелла), где– доля
молекул, скорости которых заключены в
интервале скоростей отдо
в расчете на единицу этого интервала.
Для этой функции верным утверждением
является …
1. при понижении температуры площадь
под кривой уменьшается
2. при понижении температуры величина
максимума уменьшается
3. При понижении температуры максимум смещается влево
4.На рисунке представлены графики
функций распределения молекул идеального
газа по скоростям (распределение
Максвелла), для различных газов (Н2,
Не,)
при данной температуре. Какому газу
какой график соответствует?
5.В трех одинаковых сосудах при
равных условиях находится одинаковое
количество водорода, гелия и азота.
Распределение молекул гелия по скоростям
будет описывать кривая … (ответ поясните).
6.На рисунке представлен график
функции распределения молекул идеального
газа по скоростям (распределение
Максвелла), где– доля
молекул, скорости которых заключены в
интервале скоростей отдо
в расчете на единицу этого интервала.
Если, не меняя температуры, взять другой
газ сбольшеймолярной массой и
таким же числом молекул, то …
1. величина максимума уменьшится
2. Максимум кривой сместится влево в сторону меньших скоростей
3. максимум кривой сместится вправо
в сторону больших скоростей
4. площадь под кривой увеличится
5. площадь под кривой уменьшится
7.На рисунке представлен
график функции распределения молекул
идеального газа по скоростям (распределение
Максвелла), где– доля
молекул, скорости которых заключены в
интервале скоростей отдо
в расчете на единицу этого интервала.
Если, не меняя температуры, взять другой
газ сменьшеймолярной массой и
таким же числом молекул, то …
1. Величина максимума уменьшится
2. максимум кривой сместится влево
в сторону меньших скоростей
3. Максимум кривой сместится вправо в сторону больших скоростей
4. площадь под кривой уменьшится
5. площадь под кривой увеличится
8. Распределение
молекул в поле силы тяжести определяется
соотношением (m – масса
одной молекулы, n – концентрация
молекул, μ
– молярная масса, υ
– скорость)
1. 2.
3.
4. 5.
9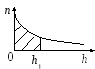
рисунке дан график зависимости
концентрацииnмолекул
воздуха от высотыhнад поверхностью Земли. Заштрихованная
площадь определяет …
-
число молекул в столбе высотой h1
с площадью основания 1 м2 -
число молекул в кубе с ребром h1
-
число молекул в 1 м3
-
концентрацию молекул на высоте h1
-
среднюю концентрацию молекул на высотах
от 0 до h1
10.Если считать температуру
воздуха (молярная масса воздуха
0,029 кг/моль) везде
одинаковой и равной 283 К,
то давление воздуха составляет 60% от
давления на уровне моря на высоте
примерно … км.
1. 1
2. 2 3. 34. 45. 5
11. Если считать температуру
воздуха (молярная масса воздуха
0,029 кг/моль) везде одинаковой и равной
283 К, то давление воздуха составляет
10% от давления на уровне моряна
высоте примерно
…км.
1. 1 2. 9
3. 194. 25
5. 31
1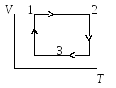
рисунке приведен график процесса,
происходящего с некоторой массой
идеального газа. В координатахр,Тэтот график выглядит …
12
.
3 4
13. В сосуде объемом
1 л находится кислород массой 1 г.
Концентрация молекул кислорода в сосуде
равна … м –3.
1. 1,9·10222. 1,9·10253. 3,4·1023
4. 5,3·1024
14. В пяти одинаковых
сосудах находятся: кислород, азот, неон,
гелий, водород. Температура и масса
газов одинаковы. Наименьшее давление
будет в сосуде, где находится …
1. кислород2. азот
3. неон
4. гелий 5. водород
15.В сосуде находится идеальный
газ плотностью 0,4 кг/м3. Если он
оказывает давление на стенки сосуда
0,81·105Па, то средняя квадратичная
скорость молекул равна … м/с.
1. 950 2. 780
3. 620
4. 450 5.
273
16.Если скорость каждой молекулы
в герметично закрытом баллоне увеличилась
вдвое, то абсолютная температура и
давление идеального газа…
-
увеличатся в 2 раза
2. увеличатся в 4 раза3. не изменятся
4. уменьшатся в 2 раза
5. уменьшатся в 4 раза
17. При
увеличении давления и плотности в 2 раза
среднеквадратичная скорость молекул
…
1. возросла
в 2 раза 2. возросла
в 4 раза 3. уменьшилась
в 2 раза
4. уменьшилась
в 4 раза 5. не
изменилась
18. Плотность кислорода при давлении
2 МПа равна 1,5 кг/м3.
Среднеквадратичная скорость молекул
равна … км/с.
1. 0,75 2. 2,03. 3,0 4. 4,5
5. 1,33
19. До
какой температуры нагреется гелий,
находящийся при 0°С, при протекании
изохорного процесса, если его давление
изменится от р1
до р2 = 2
р1
(в °С)?
1. 546
2. 273
3. 207
4. 97 5. 0
20. До
какой температуры нагреется кислород,
находящийся при нормальных условиях,
если он расширился изобарно от объема
V1
до V2 = 2 V1
(в °С)?
1. 546
2. 273
3. 207
4. 97 5. 0
21. В
сосуде находится 10кг газа при давлении
107 Па.
Какая масса газа вышла из сосуда, если
окончательное давление стало равным
2,5·106 Па,
а температура газа уменьшилась в 3 раза?
1. 7,5
2. 3,3 3. 2,5
4. 9,2 5. 3,0
22. Из сосуда выпустили
половину газа. Чтобы давление оставшегося
газа увеличить в 3 раза, надо его абсолютную
температуру …
1. увеличить в 3 раза
2. уменьшить в 6 раз
3. увеличить в 9 раз
4. увеличить в 6 раз5. уменьшить в 3 раза
23. Из сосуда выпустили половину
газа. Если абсолютная температура
оставшегося газа увеличилась в 6 раз,
то давление …
-
увеличилось в 3 раза2. уменьшилось в 6 раз
3. увеличилось в 9 раз
-
увеличилось в 6 раз 5.
уменьшилось в 3 раза
24. В
сосуде находится 10 кг газа при давлении
107 Па.
Сколько газа взяли из сосуда, если
окончательное давление стало равным
2,5·106 Па,
а температура газа уменьшилась в 3 раза?
1. 2,5
2. 3,3 3. 7,5
4. 9,2 5. 7,0
25. В процессе изменения состояния
газа его давление и температура были
связаны соотношениемр=αТ().
При уменьшении термодинамической
температуры газа в два раза его объем
…
1. не изменился 2. увеличился в 2 раза
3. уменьшился в 2раза
4. уменьшился в 4 раза 5.
увеличился в 2 раза
26. В процессе изменения состояния
газа его давление и объем были связаны
соотношением2(
).
При увеличении объема газа в три раза
его термодинамическая температура …
1. увеличилась в 3 раза
2. уменьшилась в 3 раза 3.
увеличилась в 9 раз
4. уменьшилась в 27 раз
5. увеличилась в 27 раз
27.Баллон содержитm1= 80 г
кислорода (μ1= 0,032 кг/моль)
иm2= 320 г
аргона (μ2= 0,040 кг/моль).
Давление смесиp= 1 МПа,
температураt= 27ºС. Объем
баллона равен … л.
1.10,5 ·1032. 26,23. 11,5
4. 10,5 5. 2,4
28. В
закрытом сосуде вместимостью 2 м3
находится 280 г азота (= 0,028
кг/моль) и 320 г кислорода (= 0,032 кг/моль).
При температуре 16ºС давление такой
газовой смеси
в сосуде равно
… кПа.
1. 240
2. 24
3. 13
4. 2,4 5. 1,3
29. В сосуде объемом 2 л при
температуре 400К находятся 6 г углекислого
газа (СО2) и 4 г закиси азота
(N2O).
Давление смеси в сосуде равно … кПа.
Молярные массы газов одинаковы и равны
0,044 кг/моль.
1. 415,0 2. 235,5
3.101,0 4. 750,5
5. 378
30. В сосуде находится озон при
температуре 527°С. По прошествии некоторого
времени он полностью превращается в
кислород, а его температура падает до
127°С (молярная масса озона 0,048 кг/моль,
кислорода – 0,032 кг/моль).
Давление газа в сосуде при этом …
1. уменьшилось на 75%2. уменьшилось на 25% 3.
увеличилось на 75%
4. увеличилось на 25% 5.
не изменилось
31.Двухатомная молекула имеетi1
поступательных иi2вращательных
степени свободы.i1иi2
равны…
1. 1; 1 2. 2; 2 3. 2; 3 4. 3; 25. 3;
3
32.Молекула угарного газа (СO)
имеетi1 поступательных
иi2вращательных степени
свободы.i1иi2
равны…
1. 1; 1 2. 2; 2 3. 2; 3 4. 3; 25. 3;
3
33.МолекулаH2O
имеетi1 поступательных
иi2вращательных степени
свободы.i1иi2
равны…
1. 1; 1 2. 2; 2 3. 2; 3 4. 3; 2 5. 3; 3
34.Средняя кинетическая энергия
молекул газа при температуреТ зависит
от их структуры, что связано с возможностью
различных видов движения атомов в
молекуле. Средняя кинетическая энергия
молекул гелия (Не) равна …
1.
2.
3.
4.
5.
35. Средняя
кинетическая энергия молекулы идеального
газа притемпературе
Т равна.
Здесьi=nп+nвр+ 2nк,
гдеnп,nвриnк– число
степеней свободы поступательного,
вращательного и колебательного движений
молекулы. Для атомарного водорода числоi равно …
1. 7 2. 5 3. 1
4. 35. 6
36.Средняя кинетическая энергия
молекулы идеального газа при температуреТ равна.
При условии, что имеют место только
поступательное и вращательное движение,
для кислорода (О2) числоiравно …
1. 6 2. 3
3. 54. 8
5. 7
37. Средняя
кинетическая энергия молекулы идеального
газа притемпературе
Т равна.
Здесьi=nп+nвр+ 2nк,
гдеnп,nвриnк– число
степеней свободы поступательного,
вращательного и колебательного движений
молекулы. При условии, что имеет место
только поступательное и вращательное
движение для водяного пара (Н2О)числоiравно …
1. 1 2. 3
3. 5 4. 65. 8
38.Полная кинетическая энергия
молекулы аммиакаNН3при температуре 27°С равна … Дж.
1. 6,2·10-212. 2,07·10-213. 1,03·10-204. 1,24·10-20 5. 1,48·10-20
39.Внутренняя энергия одного моля
идеального одноатомного газа определяется
формулой …
1. 2.
3.
4.
5.
40. Состояние
идеального газа изменилось в соответствии
с графиком нар—V
диаграмме. В состоянии 1 температура
газаТ0. В состоянии 2 температура
газа равна …
41.Максимальную внутреннюю энергию
идеальный газ имеет в состоянии,
соответствующем наP—Vдиаграмме точке … (ответ поясните).
1. А 2. Б 3. В4. Г 5. везде
одинакова
4
внутреннюю энергию идеальный газ имеет
в состоянии, соответствующем точке …
нарVдиаграмме.
1. 1
2. 2
3. 3
4
V
. 4
5. 1 и 3
4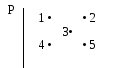
температуру идеальный газ имеет в
состоянии, соответствующем точке … наPV- диаграмме.
1. 1 2. 2
3. 34
V
.
4
5. 5
44.При изотермическом расширении
идеального газа средняя кинетическая
энергия его молекул … (ответ поясните).
1. увеличивается 2. уменьшается
3. не изменяется
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Числом степеней свободы механической системы называют количество независимых величин, с помощью которых может быть задано положение системы.
Внутренняя энергия идеального газа представляет собой сумму только кинетической энергии всех молекул, а потенциальной энергией взаимодействия можно пренебречь:
U=∑Ek0=NEk0=mNAM·ikT2=i2·mMRT=i2νRT=i2pV
i — степень свободы. i = 3 для одноатомного (или идеального) газа, i = 5 для двухатомного газа, i = 6 для трехатомного газа и больше.
Изменение внутренней энергии идеального газа в изопроцессах
| Основная формула |
ΔU=32·mMRT=32νRT=32νR(T2−T1) |
| Изотермический процесс |
ΔU=0 Температура при изотермическом процессе — величина постоянная. Так как внутренняя энергия идеального газа постоянной массы в замкнутой системе зависит только от изменения температуры, то она тоже остается постоянной. |
| Изобарное расширение |
ΔU=32νR(T2−T1)=32(pV2−pV1)=32pΔV |
| Изохорное увеличение давления |
ΔU=32νR(T2−T1)=32(p2V−p1V)=32VΔp |
| Произвольный процесс |
ΔU=32νR(T2−T1)=32(p2V2−p1V1) |
Пример №1. На рисунке показан график циклического процесса, проведенного с идеальным газом. На каком из участков внутренняя энергия газа уменьшалась?
Внутренняя энергия газа меняется только при изменении температуры. Так как она прямо пропорциональная температуре, то уменьшается она тогда, когда уменьшается и температура. Температура падает на участке 3.
Работа идеального газа
Если газ, находящийся под поршнем, нагреть, то, расширяясь, он поднимет поршень, т.е. совершит механическую работу.
Механическая работа вычисляется по формуле:
A=Fscosα
Перемещение равно разности высот поршня в конечном и начальном положении:
s=h2−h1
Также известно, что сила равна произведению давления на площадь, на которое это давление оказывается. Учтем, что направление силы и перемещения совпадают. Поэтому косинус будет равен единице. Отсюда работа идеального газа равна произведению давления на площадь поршня:
Работа идеального газа
F=pS
p — давление газа, S — площадь поршня
Работа, необходимая для поднятия поршня — полезная работа. Она всегда меньше затраченной работы, которая определяется изменением внутренней энергии идеального газа при изобарном расширении:
A‘=p(V2−V1)=pΔV>0
Внимание! Знак работы определяется только знаком косинуса угла между направлением силы, действующей на поршень, и перемещением этого поршня.
Работа идеального газа при изобарном сжатии:
A‘=p(V2−V1)=pΔV<0
Работа идеального газа при нагревании газа:
A‘=νRΔT=νR(T2−T1)=mMνRΔT
Внимание! В изохорном процессе работа, совершаемая газом, равна нулю, так как работа газа определяется изменением его объема. Если изменения нет, работы тоже нет.
Геометрический смысл работы в термодинамике
В термодинамике для нахождения работы можно вычислить площадь фигуры под графиком в осях (p, V).
Примеры графических задач
| Изобарное расширение:
A‘=p(V2−V1) A‘>0 |
 |
| Изобарное сжатие:
A‘=p(V2−V1) A‘<0 |
 |
| Изохорное охлаждение:
V=const A‘=0 |
 |
|
Изохорное охлаждение и изобарное сжатие: 1–2: A‘=0 2–3: A‘=pΔV<0 |
 |
| Замкнутый цикл:
1–2: A‘>0 2–3: A‘=0 3–4: A‘<0 4–1: A‘=0 A‘=(p1−p3)(V2−V1) |
 |
| Произвольный процесс:
A‘=p1+p22(V2−V1) |
 |
Пример №2. На pV-диаграмме показаны два процесса, проведенные с одним и тем же количеством газообразного неона. Определите отношение работ A2 к A1 в этих процессах.
Неон — идеальный газ. Поэтому мы можем применять формулы, применяемые для нахождения работы идеального газа. Работа равна площади фигуры под графиком. С учетом того, что в обоих случаях изобарное расширение, получим:
A2=p(V2−V1)=4p(5V−3V)=4p2V=8pV
A1=p(V2−V1)=p(5V−V)=4pV
Видно, что работа, совершенная во втором процессе, вдвое больше работы, совершенной газом в первом процессе.
Задание EF17505

Для каждой величины подберите соответствующий характер изменения:
1) увеличивается
2) уменьшается
3) не изменяется
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Алгоритм решения
- Определить по графику, как меняется давление.
- Определить, как меняется объем.
- Определить, отчего зависит внутренняя энергия газа, и как она меняется в данном процессе.
Решение
На графике идеальный одноатомный газ изотермически сжимают, так как температура остается неизменной, а давление увеличивается. При этом объем должен уменьшаться. Но внутренняя энергия идеального газа определяется его температурой. Так как температура постоянна, внутренняя энергия не изменяется.
Ответ: 123
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17758
Один моль аргона, находящийся в цилиндре при температуре T1=600 K и давлении p1=4⋅105 Па, расширяется и одновременно охлаждается так, что его температура при расширении обратно пропорциональна объёму. Конечное давление газа p2=105 Па. Какое количество теплоты газ отдал при расширении, если при этом он совершил работу A=2493 Дж?
Алгоритм решения
1.Записать исходные данные.
2.Записать уравнение состояния идеального газа.
3.Записать формулу для расчета внутренней энергии газа.
4.Используя первое начало термодинамики, выполнить общее решение задачи.
5.Подставив известные данные, вычислить неизвестную величину.
Решение
Запишем исходные данные:
• Начальная температура газа: T1 = 600 К.
• Начальное давление: p1 = 4∙105 Па.
• Конечное давление: p2 = 105 Па.
• Работа, совершенная газом: A = 2493 Дж.
Аргон является одноатомным газом. Поэтому для него можно использовать уравнение состояния идеального газа:
pV=νRT
Внутренняя энергия одноатомного идеального газа пропорциональна температуре:
U=32νRT
Внутренняя энергия аргона до расширения и после него:
U1=32νRT1
U2=32νRT2
Согласно условию задачи, температура при расширении обратно пропорциональна объёму. Следовательно:
T=constV
T1V1=T2V2
Выразим конечную температуру:
T2=T1V1V2
Составим уравнение состояния газа для состояний аргона 1 и 2:
p1V1=νRT1
p2V2=νRT2
Отсюда:
νR=p1V1T1=p2V2T2
Отсюда отношение объема аргона в состоянии 1 к объему газа в состоянии 2 равно:
V1V2=p2T1p1T2
Подставим это отношение в формулу для конечной температуры:
T2=T1V1V2=p2T12p1T2
Отсюда:
T2=T1√p2p1
Отсюда внутренняя энергия газа в состоянии 2 равна:
U2=32νRT1√p2p1
Уменьшение внутренней энергии аргона составило (изначально она была выше):
ΔU=U1−U2=32νRT1−32νRT1√p2p1=32νRT1(1−√p2p1)
В соответствии с первым началом термодинамики уменьшение внутренней энергии равно сумме совершённой работы и количества теплоты, отданного газом:
ΔU=Q+A
Следовательно, газ отдал следующее количество теплоты:
Q=ΔU−A=32νRT1(1−√p2p1)−A
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17966
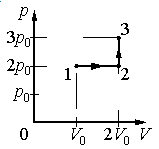
Ответ:
а) р0V0
б) 2р0V0
в) 4р0V0
г) 6р0V0
Алгоритм решения
1.Определить, на каком участке графика совершается работа.
2.Записать геометрический смысл работы.
3.Извлекая данные из графика, вычислить работу, совершенную газом.
Решение
Работа совершается только тогда, когда газ меняет объем. Поэтому работа совершается только на участке 1–2.
Работа идеального газа равна площади фигуры, заключенной под графиком термодинамического процесса в координатах (p, V).
Давление газа при этом равно 2p0, а объем равен разности 2V0 и V0. Следовательно, работа, совершенная газом, будет равна произведению:
A=2p0(2V0−V0)=2p0V0
Ответ: б
pазбирался: Алиса Никитина | обсудить разбор
Алиса Никитина | Просмотров: 15.1k