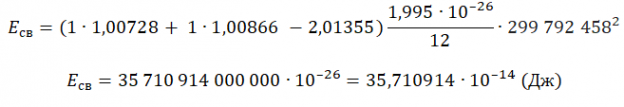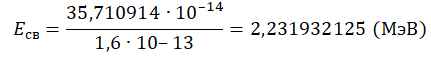«Строение атома. Массовое число»
Ключевые слова конспекта: строение атома, элементарные частицы, протоны и электроны в атомах, атомный номер, массовой число, число нейтронов, нуклид, изотопы, ионы, катионы, заряд иона.
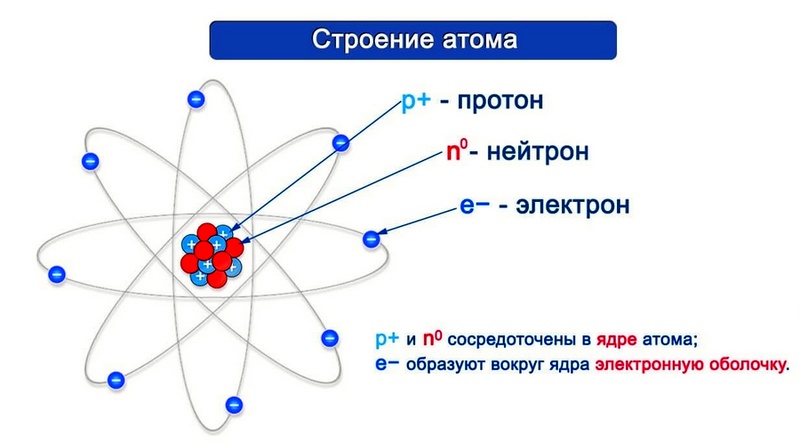
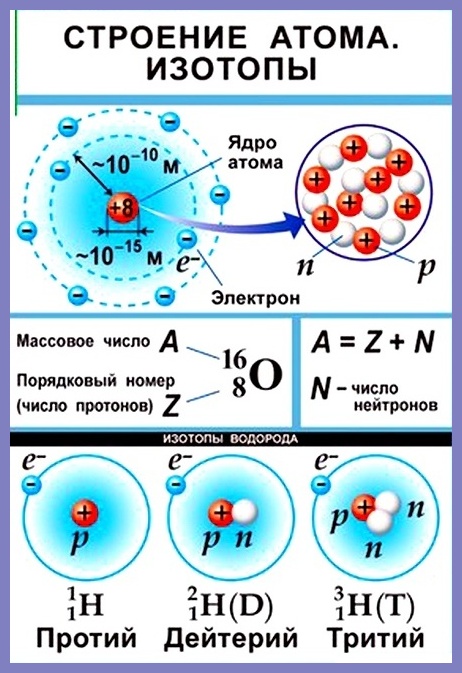
Согласно модели Резерфорда каждый атом состоит из находящегося в его центре ядра и электронной оболочки. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре. Электроны движутся вокруг ядра. Число электронов атома равно положительному заряду ядра.
Диаметр атома 10-10 м, диаметр ядра 10-14 – 10-15 м. Масса атома водорода равна 1,67 • 10-24 г, атома углерода — 1,99 • 10-23 г, атома железа — 9,29 • 10-23 г.
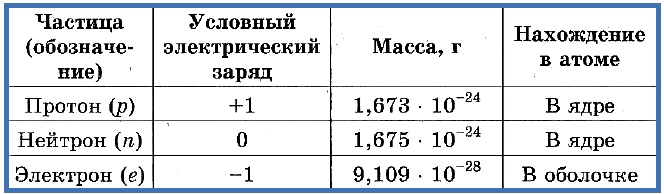
Элементарные частицы — это протоны, электроны и нейтроны, из них состоят все атомы.
Таблица 1. «Элементарные частицы атома»
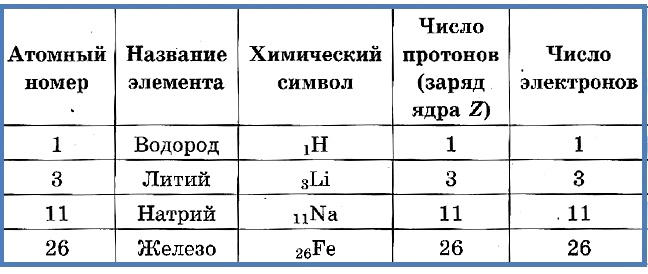
Число протонов разное у атомов различных видов, оно определяет заряд ядра атома и равно атомному номеру элемента в таблице Менделеева. Поскольку атом — электро-нейтральная частица, число электронов в нем равно числу протонов.
Таблица 2. «Протоны и электроны в атомах»
Атомный номер указывают слева внизу от символа элемента, например: 1Н, 26Fe. Обозначение атомного номера — прописная латинская буква Z.
Массовое число атома А — это сумма чисел его протонов и нейтронов в ядре. Массовое число указывают слева вверху от символа элемента или добавляют к названию элемента через дефис, например: 23Na или натрий-23.
Массовое число кислорода, А(16О) = 16 = (8р + 8n).
Число нейтронов N в ядре атома определяют по формуле: N = A — Z. Например, для атома натрия с массовым числом 23, 23Na: А = 23, Z = 11, N = А – Z = 23 — 11 = 12.
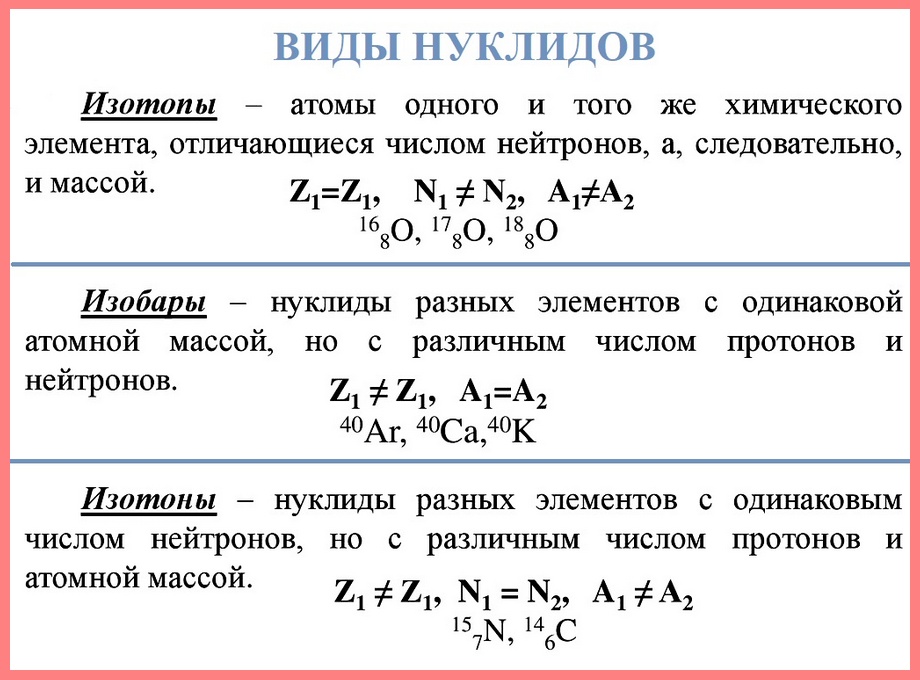
Нуклид — это вид атомов с определенным числом протонов и нейтронов в ядре. Например, в природе встречается три вида нуклидов кислорода: 16О, 17О и 18О.
Изотопы — это атомы одного вида с одинаковым числом протонов, но разным числом нейтронов. Так, атомы 16О, 17О и 18О — это изотопы. Природные изотопы урана — 234U, 235U и 238U.
Ионы — заряженные частицы, образующиеся при отщеплении от нейтральных атомов или присоединении к ним электронов. Ионы образуются также из молекул в результате присоединения протона Н+ (NH3 → NH4+) или отщепления Н+ (HNO3 -> NO3–).
Таблица 3. «Обозначение и название ионов»
Катионы — это положительно заряженные ионы (Na+, Аl3+), анионы — отрицательно заряженные ионы (Cl–, NO3–).
Заряд иона указывают в виде индекса справа вверху от символа химического элемента: Li+ , Са2+. На первом месте пишут цифру, на втором — знак заряда. Цифру 1 не пишут.
Конспект урока по химии «Строение атома».
Строение атома
Автор статьи — профессиональный репетитор И. Давыдова (Юдина).
Атом — в переводе с древнегреческого – неделимый — это наименьшая частица химического элемента, являющаяся носителем его свойств. Современные представления о строении атома требуют для понимания знаний основ квантовой механики, поэтому мы ограничимся упрощенной моделью.
Атом состоит из ядра (в составе которого протоны и нейтроны) и электронов. Несмотря на то, что ядро составляет большую часть массы атома, оно очень мало.
| Заряд z | Масса m | |
| Протон p+ | +1 | 1 |
| Нейтрон n0 | 0 | 1 |
| Электрон e— | -1 | 0 |
Количество протонов равно количеству электронов и равно номеру атома в периодической таблице. Число нейтронов равно разности атомной массы и номера элемента.
Бор – пятый элемент периодической таблицы, в его атоме 5 протонов и 5 электронов. Атомная масса ≈ 11, количество нейтронов равно 11 – 5 = 6.
Элементы, имеющие одинаковое количество протонов в ядре, но различающиеся числом нейтронов, называются изотопами.
Например, 35Cl и 37Cl – изотопы, различающиеся атомной массой и количеством нейтронов.
| Число протонов | Число нейтронов | Число электронов | |
| 35Cl | 17 | 18 | 17 |
| 37Cl | 17 | 20 | 17 |
Вокруг ядра по различным траекториям — орбиталям движутся электроны. Каждой орбитали соответствует определенный уровень энергии, чем ближе орбиталь к ядру, тем меньшей энергией должен обладать электрон, чтобы находиться на ней.
Порядок заполнения орбиталей:
Электроны располагаются на орбиталях в соответствии со следующими правилами:
- Принцип наименьшей энергии: в первую очередь электроны заполняют наиболее низкие по энергии уровни (ближайшие к ядру).
Энергия орбиталей на уровнях и подуровнях изменяется следующим образом: 1s < 2s < 2р < Зs < Зр < 4s < 3d < 4р < 5s <4d < 5р < 6s < 4f ≈ 5d < 6p < 7s < 5f ≈6d < 7p . (●)
| Тип орбитали | Число орбиталей на энергетическом уровне | Максимальное количество электронов на этих орбиталях |
| s | 1 | 2 |
| p | 3 | 6 |
| d | 5 | 10 |
| f | 7 | 14 |
Перед оставшимися двумя принципами введем понятие спина электрона. Спин – характеристика самого электрона, представить его (это упрощенная модель, а ненастоящий физический смысл понятия спин!) можно как направление движения электрона вокруг своей оси: по или против часовой стрелки. Возможных значений всего два: +1/2 (обозначаем стрелкой вверх) и -1/2 (обозначаем стрелкой вниз).
- Принцип Паули: на каждой орбитали может быть не более двух электронов, причем их спины должны быть различными.
- Правило Хунда: суммарный спин системы должен быть максимально возможным.
С правилом Паули всё достаточно ясно: спины двух электронов на одной орбитали различны, а значит у одного электрона +1/2 (стрелочка вверх), у другого – -1/2 (стрелочка вниз). Но каков смысл правила Хунда? В данном случае обратимся всё к тем же значениям спина электрона. При заполнении электронного уровня всегда сначала заполняется один подуровень, только затем электроны помещаются на следующий. Рассмотрим p-подуровень. На нём имеются 3 орбитали (см. таблицу выше). В целом, есть разные варианты развития событий. Допустим, у нас есть 4 электрона, которые надо расположить на подуровне. Мы можем поместить два в первую ячейку, два во вторую. Посчитаем суммарный спин. У двух элетронов спин 1/2, у других -1/2. Тогда при сложении мы получаем ноль. Теперь расположим три первых электрона по одному, оставшийся поместим на первую орбитал (в пару). Теперь суммарный спин 1. Значит, подходит второй случай. Для того чтобы каждый раз не высчитывать суммарный спин, можно запомнить, что вначале следует расположить все имеющиеся электроны по одному, и если на подуровне уже не останется свободных ячеек, начинать составлять пары.
Рассмотрим заполнение орбиталей электронами на нескольких примерах. У каждого следующего элемента таблицы Менделеева на один протон и один электрон больше, чем у предыдущего. У элементов главных подгрупп всегда заполняется внешний электронный уровень, у элементов побочных – один из предыдущих.
— магний – двенадцатый элемент, имеет по 12 протонов и электронов, находится в главной подгруппе. Распределим эти электроны в соответствии с рассмотренными выше правилами, не забывая, что на каждом подуровне может быть не более двух электронов.
Магний – элемент третьего периода, следовательно, первый и второй энергетические уровни полностью заполнены — 1s22s22p6.Магний находится во второй группе, значит, на третьем уровне у него два электрона — 3s2. Итого получаем1s22s22p63s2.
В атоме магния в основном состоянии нет неспаренных электронов.
Если атому сообщили дополнительную энергию (например, нагрели), то электронная пара может распарится и один из электронов переходит на свободную орбиталь того же энергетического уровня. В возбужденном состоянии атом магния имеет два неспаренных электрона и может образовать две связи (валентность II).
— фосфор – пятнадцатый элемент, находится в главной подгруппе. Распределяем 15 электронов: Фосфор — элемент третьего периода, следовательно, первый и второй энергетические уровни полностью заполнены — 1s22s22p6.Фосфор находится в пятой группе, значит, на третьем уровне у него пять электронов — 3s23p3. Итого получаем1s22s22p63s23p3.
В атоме фосфора в основном состоянии 3 неспаренных электрона. В возбужденном состоянии атом фосфора имеет пять неспаренных электронов и может образовать пять связей (валентность V).
— цирконий – сороковой элемент, распределяем 40 электронов. Цирконий – элемент побочной подгруппы! Поэтому у него заполняется предыдущий электронный уровень (4d-подуровень). Цирконий – второй d – элемент в пятом периоде, значит, он содержит 2 электрона на 4d – подуровне. Итого получаем: 1s22s22p63s23p64s23d104p65s24d2.
В атоме циркония в основном состоянии 2 неспаренных электрона.
В возбужденном состоянии цирконий имеет четыре неспаренных электрона.
Важно отметить, что в обычном состоянии цирконий не может образовывать связей, так как для этого необходимы неспаренные электроны на внешнем электронном уровне. Соответственно, во всех соединениях цирконий находится в возбуждённом состоянии.
Исключениями из общего порядка заполнения электронных подуровней являются хром, марганец, медь, серебро и золото – у них наблюдается «провал» электрона с внешного s – подуровня на предвнешний d. (Атому более комфортно иметь на d-подуровне 5 или 10 электронов, чем 4 или 9). Например, электронные конфигурации хрома и меди вместо 4s23d4 и 4s23d9 имеют вид 4s13d5 и 4s13d10.
Задания для тренировки:
- Сколько протонов и электронов содержит ион NO2—
1) 46p, 46e
2) 23p, 24e
3) 23р, 23e
4) 46p, 47e - Чем отличаются изотопы одного и того же химического элемента?
1) Числом протонов
2) Числом электронов
3) Зарядом ядра
4) Массовым числом - Укажите атом, в котором больше всего электронов:
1) 2Н
2) 40Аr
3) 41Ar
4) 39К - Изобразить электронно-графическую схему атома хлора в основном и всех возможных возбужденных состояниях. Какие валентности способен проявлять хлор?
- Объяснить, почему сера проявляет валентность VI, а кислород – не проявляет, хотя оба эти элемента содержат по 6 электронов на внешнем слое.
Благодарим за то, что пользуйтесь нашими статьями.
Информация на странице «Строение атома» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать нужные и поступить в высшее учебное заведение или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из данного раздела.
Публикация обновлена:
07.05.2023
В ПОМОЩЬ МОЛОДОМУ
УЧИТЕЛЮ
Первоначальные представления
о строении атома и химических
элементах
Цель настоящей статьи – изложение
сложных вопросов общей химии, а именно
первоначальных представлений о строении атомов
химических элементов, в доступной форме. Этот
материал может предварять изучение темы на более
сложном уровне. Такой подход многократно
использовался мной на уроках химии.
Как известно, химия – это наука о веществах.
Разные вещества имеют различное строение. Бывают
вещества атомного строения, они состоят из
атомов. Пример вещества атомного строения –
алмаз. Вещества молекулярного строения
образованы молекулами. Например, вода состоит из
молекул H2O. Любая молекула состоит из
атомов. Известны вещества ионного строения.
Например, поваренная соль NaCl состоит из ионов
натрия и ионов хлора. Ионы – это тоже атомы или
группы атомов, только заряженные. Вот и
получается, какое вещество ни возьми, в основе
его строения лежит атом. Чтобы изучить вещества,
нам вначале следует понять, что такое атом.
Еще 150 лет назад некоторые ученые подвергали
сомнению факт существования атомов. Однако
несколько десятилетий спустя, в конце XIX – начале
XX в., была не только подтверждена реальность
атомов, но и доказано их сложное строение. Было
установлено, что в центре атома находится ядро.
Размеры самого атома во много раз превышают
размеры ядра. Представьте себе футбольное поле с
теннисным мячиком посередине. Если увеличить
атом до размеров футбольного поля, то размеры его
ядра будут сопоставимы с теннисным мячиком.
Атом состоит из элементарных частиц –
протонов, нейтронов и электронов. Элементарными
эти частицы назвали потому, что в отличие от
атома они неделимы. Два вида элементарных частиц
– протоны и нейтроны – образуют ядро. Электроны
образуют электронную оболочку вокруг ядра.
Электроны в отличие от ядер находятся в
постоянном движении. Говоря о движении
электрона, я избегаю употребления слов «вокруг»
и «вращается» и заменяю их словами «около» и
«движется». Если бы я сказала: «Электрон
вращается вокруг ядра», вы могли бы подумать, что
у него (электрона) есть постоянная орбита,
подобно тому как у планет Солнечной системы есть
свои орбиты вокруг Солнца. Кстати, на заре
исследований атома некоторое время ученые так и
думали. Была выдвинута так называемая
«планетарная теория строения атома». Однако
позже было установлено, что движение электрона
гораздо сложнее и что скорость этого движения
очень велика. Именно благодаря быстрому движению
электронов возникает электронное облако.
(Возможно, в детстве вы играли с пуговицей и
ниткой. К середине нитки привязывается пуговица
и много раз один ее конец вращается по часовой
стрелке или против нее, а потом концы нитки
натягиваются и пуговица на большой скорости
начинает двигаться в противоположном
направлении. Возникает иллюзия веретена.
Проделайте с пуговицей и ниткой все, как здесь
описано, наблюдайте веретено, и, может быть, тогда
вы лучше себе представите, что такое электронное
облако.)
В табл. 1 представлены характеристики
элементарных частиц, составляющих атомы.
Таблица 1
Сведения о частицах, составляющих
атомы
| Части атома | Элементарные частицы |
Условное обозначение |
Заряд | Масса |
|---|---|---|---|---|
| Ядро | Протон | р | +1 | 1 а.е.м. |
| Нейтрон | n | 0 | 1 а.е.м. | |
| Электронная оболочка |
Электрон | е | –1 | Можно пренебречь |
Из табл. 1 видно, что нейтрон –
электронейтральная частица, ее заряд равен нулю,
а протон и электрон – это заряженные частицы.
Заряды протона и электрона одинаковы по
величине, но отличаются по знаку заряда. Как
всякая материальная частица, электрон имеет
массу. Однако эта масса так мала (масса электрона
в 1840 раз меньше массы одного протона или
нейтрона), что ее вкладом в общую массу атома
можно пренебречь. Отсюда следует важный вывод: масса
атома сосредоточена в ядре.
Масса протона почти такая же, как масса
нейтрона, и равна атомной единице массы (а.е.м). За
атомную единицу массы принята 1/12 часть массы
изотопа углерода 12С.
Для выражения массы атомов чаще используют
относительную атомную массу (безразмерная
величина), которая обозначается Ar.
Например, для кислорода и серы: Ar(О) = 16 и Ar(S)
= 32.
В состав атома входят заряженные частицы,
однако атом – это электронейтральная
частица.
Заряд свободного атома или
атомов простого вещества равен нулю.Число
протонов в атоме равно числу электронов.
В природе существуют разновидности атомов,
различающихся размерами, массой и другими
характеристиками. Совокупность атомов одного
вида называется химическим элементом. Можно
сказать по-другому: химический элемент – это вид
атомов. Известно более ста химических элементов.
Чем же отличаются атомы различных химических
элементов? Во-первых, размерами, во-вторых,
массой, в-третьих, строением.
Рассмотрим более подробно строение атомов
различных химических элементов. Возьмите
периодическую систему химических элементов
Д.И.Менделеева и найдите химический элемент
водород.
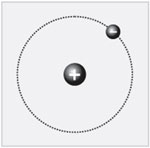
Атомы водорода имеют самое простое строение.
Ядро состоит всего из одного протона. Заряд ядра
равен +1. Поскольку масса атома сосредоточена в
ядре, его масса равна 1 а.е.м. Атом – это
электронейтральная частица, около ядра
находится один электрон.
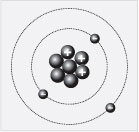
Более сложный элемент – гелий. В периодической
системе он числится под номером 2. Найдите этот
элемент и его порядковый номер в таблице
Менделеева (цифру 2). На рисунке показано, как
условно выглядит строение атома гелия. Как видим,
ядро образовано двумя протонами и двумя
нейтронами. Заряд ядра +2. Около ядра в атоме – два
электрона. Массовое число (оно характеризует
массу атома) равно четырем.
Найдите в периодической системе химический
элемент, порядковый номер которого равен трем.
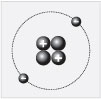
Это – литий. В атоме лития ядро образовано тремя
протонами и четырьмя нейтронами. Заряд ядра
равен +3, около него находятся три электрона,
массовое число равно семи. Внимательно
рассмотрите клетку периодической системы, в
которой расположен литий, и найдите число 6,94.
Если его округлить, то получится 7. Это массовое
число лития.
Запомните, что меньшее из чисел, расположенных
в клетке периодической системы, – это порядковый
номер элемента. Другое число характеризует массу
атома, при округлении его до целых чисел получают
массовое число. Если хотят указать порядковый
номер и массовое число элемента, например гелия,
это делают так: .
А эта запись относится к литию: . Здесь 7 – массовое число, равное
сумме протонов и нейтронов. Число электронов в
атоме равно числу протонов (заряд ядра) и такое
же, как порядковый номер элемента (3).
Следующее положение необходимо хорошо
запомнить:
порядковый номер элемента
указывает на число электронов, число протонов и
заряд ядра атома.
Найдите в периодической системе элемент
серебро. Чему равны его порядковый номер и
массовое число? Оказывается, порядковый номер 47,
а массовое число 108. Какие выводы можно сделать из
этого? Число электронов в атоме серебра 47, число
протонов также 47, заряд ядра +47. Масса атома (масса
ядра) равна 108 а.е.м. Напомним, что ядро образовано
протонами и нейтронами. Чтобы найти число
нейтронов, необходимо из 108 вычесть 47. В атоме
серебра 61 нейтрон.
Если бы все 47 электронов атома серебра
двигались на одинаковом расстоянии от ядра,
«аварий» (столкновений электронов) нельзя было
бы избежать. Чтобы этого не произошло, природа
распорядилась таким образом, что электроны
располагаются на различных расстояниях от ядра.
Так, в атоме лития два электрона находятся ближе
к ядру, а третий – дальше от него. Располагаясь
на различных расстояниях от ядра, электроны
образуют энергетические уровни. Электроны,
находящиеся на различных энергетических
уровнях, обладают различным запасом энергии. Чем
дальше электрон от ядра, тем больше его энергия.
Чтобы легче запомнить это утверждение, приведу
шуточную аналогию. Представьте, что ваши
родители – это ядро, а вы – электрон. Когда ваша
энергия (активность, независимость) больше: когда
вы близко от родителей (например, в одной с ними
квартире) или далеко от них? Конечно же, во втором
случае. Моим ученикам нравится этот пример, и они
легко запоминают сложное утверждение об энергии.
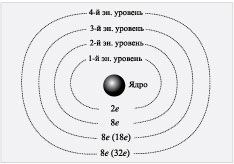
Сколько же электронов может находиться на
различных энергетических уровнях? На ближайшем к
ядру (первом) энергетическом уровне может
находиться не более двух электронов. Вместимость
других электронных слоев показана на схеме.
Схема
В некоторых учебниках вы найдете буквенное
обозначение энергетических уровней:
1-й – уровень К, 2-й – уровень L, 3-й – уровень М, 4-й
– уровень N.
На 2-м энергетическом уровне может находиться 8
электронов. Но что означают цифры 8 (18), 8 (32)?
Установлено, что если 3-й или более дальний
энергетический уровень является внешним, то на
нем может находиться не более восьми электронов.
Если же за 3-м энергетическим уровнем есть другие
энергетические уровни, то на нем может
накапливаться до 18 электронов. Аналогично
обстоит дело с 4-м энергетическим уровнем. Если он
внешний, то может содержать максимально 8
электронов, если же за ним есть другие
энергетические уровни, то на 4-м энергетическом
уровне может накапливаться до 32 электронов.
Важное заключение:
на внешнем энергетическом
уровне не может быть более 8 электронов.
Для нас будет очень важной информация о внешнем
энергетическом уровне, поэтому воспользуемся
сокращением этого словосочетания – ВЭУ.
В дальнейшем, показывая схему атома, мы не будем
обозначать все его протоны и нейтроны, а лишь
укажем в центре заряд его ядра. Заряду ядра атома
мы всегда будем уделять большое внимание, и скоро
вы поймете почему.
Рассмотрим последовательность заполнения
электронами энергетических уровней у атомов
первых 20 элементов периодической системы (табл.
2).
Таблица 2
| Название элемента |
Порядковый номер |
Число электронов на энергетических уровнях |
|||
|---|---|---|---|---|---|
| 1-й | 2-й | 3-й | 4-й | ||
| Водород | 1 | 1 | c | c | c |
| Гелий | 2 | 2 | c | c | c |
| Литий | 3 | 2 | 1 | c | c |
| Бериллий | 4 | 2 | 2 | c | c |
| Бор | 5 | 2 | 3 | c | c |
| Углерод | 6 | 2 | 4 | c | c |
| Азот | 7 | 2 | 5 | c | c |
| Kислород | 8 | 2 | 6 | c | c |
| Фтор | 9 | 2 | 7 | c | c |
| Неон | 10 | 2 | 8 | c | c |
| Натрий | 11 | 2 | 8 | 1 | c |
| Магний | 12 | 2 | 8 | 2 | c |
| Алюминий | 13 | 2 | 8 | 3 | c |
| Kремний | 14 | 2 | 8 | 4 | c |
| Фосфор | 15 | 2 | 8 | 5 | c |
| Сера | 16 | 2 | 8 | 6 | c |
| Хлор | 17 | 2 | 8 | 7 | c |
| Аргон | 18 | 2 | 8 | 8 | c |
| Kалий | 19 | 2 | 8 | 8 | 1 |
| Kальций | 20 | 2 | 8 | 8 | 2 |
Следующий за литием элемент –
бериллий. Его порядковый номер 4, а значит, около
ядра 4 электрона, 2 – на 1-м уровне и 2 – на 2-м. Далее
по мере увеличения порядкового номера идет
накопление электронов на 2-м энергетическом
уровне, и у элемента под номером 10 (неона) на 2-м
(внешнем) энергетическом уровне уже 8 электронов.
Поскольку на внешнем энергетическом уровне не
может быть более 8 электронов, у следующего
элемента с порядковым номером 11 (натрия)
одиннадцатый электрон образует 3-й
энергетический уровень. С увеличением
порядкового номера идет накопление электронов,
но уже на 3-м энергетическом уровне. У аргона, как
и у неона, на ВЭУ максимальное число электронов –
8. Следующий за аргоном элемент – калий.
Размещение электронов на его четырех
энергетических уровнях – 2, 8, 8, 1.
Будем одновременно анализировать табл. 2 и
периодическую систему элементов Д.И.Менделеева.
Обратите внимание, что первые два элемента в
нашей таблице отделены от остальных чертой. Что
объединяет их? И у водорода, и у гелия в атоме
всего лишь один энергетический уровень. В
периодической системе эти элементы расположены
в первой строчке. За гелием следуют 8 элементов:
литий, бериллий, бор, углерод, азот, кислород, фтор
и неон. В табл. 2 эти элементы отделены от других
также чертой. Почему? В атомах этих элементов
электроны распределены по двум энергетическим
уровням. В периодической системе Д.И.Менделеева
элементы от Li по Ne размещены во второй строчке.
Оставшуюся часть табл. 2 проанализируйте сами и
найдите эти элементы в периодической системе.
Напомним, что горизонтальная строчка в
периодической системе элементов Д.И.Менделеева
называется периодом. Такое определение периода
упрощено, и пользоваться им можно лишь на
начальном этапе изучения химии. Обратите
внимание, что четвертый, пятый и шестой периоды
включают в себя не одну, а две строчки (это
большие периоды).
Проанализировав обе таблицы, вы, наверное, сами
смогли сделать вывод:
номер периода указывает на
число энергетических уровней в атоме.
Например, элемент 47Ag (серебро) расположен
в пятом периоде, следовательно, 47 его электронов
распределены на пяти энергетических уровнях.
Обобщим знания и дадим характеристику строения
атомов натрия и калия.
Атом натрия имеет порядковый номер 11,
массовое число 23. Ядро содержит 11 протонов и
12 нейтронов. Заряд ядра +11. Около ядра движется 11
электронов. Натрий находится в третьем периоде,
поэтому 11 его электронов распределены на трех
энергетических уровнях (2е, 8е, 1е).
Атом калия – порядковый номер 19, массовое
число 39. В ядре – 19 протонов и 20 нейтронов. Заряд
ядра +19. Около ядра движется 19 электронов. Калий
находится в четвертом периоде, поэтому 19 его
электронов распределены на четырех
энергетических уровнях (2е, 8е, 8е, 1е).
Сравним распределение электронов в атомах так
называемых сходных элементов, сначала – в атомах
лития, натрия и калия (табл. 3).
Таблица 3
| Элемент | Число электронов на энергетических уровнях |
|||
|---|---|---|---|---|
| 1-й | 2-й | 3-й | 4-й | |
| Литий | 2 | 1 | ||
| Натрий | 2 | 8 | 1 | |
| Kалий | 2 | 8 | 8 | 1 |
Из табл. 3 видно, что на ВЭУ у атомов этих
элементов по одному электрону. Найдем в
периодической системе элементы литий, натрий,
калий. Все они расположены в первом столбце
периодической системы.
Рассмотрим распределение электронов в атомах
бериллия, магния и кальция (табл. 4).
Таблица 4
| Элемент | Число электронов на энергетических уровнях |
|||
|---|---|---|---|---|
| 1-й | 2-й | 3-й | 4-й | |
| Бериллий | 2 | 2 | ||
| Магний | 2 | 8 | 2 | |
| Kальций | 2 | 8 | 8 | 2 |
Оказывается, на ВЭУ у атомов этих
элементов по два электрона. В периодической
системе они расположены во втором столбце.
Рассмотрим распределение электронов в атомах
фтора, хлора и брома (табл. 5).
Таблица 5
| Элемент | Число электронов на энергетических уровнях |
|||
|---|---|---|---|---|
| 1-й | 2-й | 3-й | 4-й | |
| Фтор | 2 | 7 | ||
| Хлор | 2 | 8 | 7 | |
| Бром | 2 | 8 | 18 | 7 |
Из схемы видно, что на ВЭУ у атомов этих
элементов по семь электронов. Они расположены в
седьмом столбце периодической системы.
Вертикальный столбец периодической системы
называется группой. Это определение группы, как и
определение периода, упрощено, и пользоваться им
можно лишь на начальном этапе изучения химии.
Групп в периодической системе – восемь. Как вы
думаете, почему именно восемь, а не семь или
девять? Чтобы ответить на этот вопрос, вспомним,
каково максимальное число электронов на внешнем
энергетическом уровне. Восемь! А теперь очень
важный вывод:
номер группы указывает число
электронов на внешнем энергетическом уровне
атома.
Сколько электронов на ВЭУ у атома серебра?
Чтобы ответить на этот вопрос, уточните
положение серебра в периодической системе.
Серебро находится в первой группе, значит, на
внешнем энергетическом уровне его атомов – один
электрон.
Может быть, кто-то из вас скажет: «Для первых 20
элементов мы знаем распределение электронов в
атоме. А как узнать распределение электронов в
атомах других элементов? Например, как узнать,
что у атома брома на третьем энергетическом
уровне 18 электронов?» На первых порах эту
информацию можно получать из периодической
системы. Найдите в таблице Д.И.Менделеева элемент
№ 35. В его клетке имеется столбик мелких цифр,
если считать снизу, – 2, 8, 18, 7. Значит, на 1-м
энергетическом уровне атома Br – 2e, на 2-м – 8e,
на 3-м – 18e и на 4-м – 7e.
Найдите в периодической системе распределение
электронов в атоме серебра. Как много сведений
можно извлечь из периодической системы! На
экзамене по химии разрешено пользоваться
периодической системой Д.И.Менделеева. Поэтому в
ваших интересах как можно лучше в ней
разобраться. Это не только увлекательно и
интересно, но и может вам пригодиться.
Найдите в периодической системе элементы
гелий, неон, аргон, криптон, ксенон и радон.
Напишите самостоятельно распределение
электронов в атомах этих элементов, а потом
сравните с приведенной ниже табл. 6.
Таблица 6
| Элемент | Число электронов на энергетических уровнях |
|||||
|---|---|---|---|---|---|---|
| 1-й | 2-й | 3-й | 4-й | 5-й | 6-й | |
| Гелий | 2 | |||||
| Неон | 2 | 8 | ||||
| Аргон | 2 | 8 | 8 | |||
| Kриптон | 2 | 8 | 18 | 8 | ||
| Kсенон | 2 | 8 | 18 | 18 | 8 | |
| Радон | 2 | 8 | 18 | 32 | 18 | 8 |
Из табл. 6 видно, что на ВЭУ у атомов этих
элементов максимальное число электронов – по 8.
Перечисленные элементы объединены в группу
инертных газов. Синонимами слова «инертный»
являются слова «неактивный», «пассивный». И
действительно, атомы этих элементов отличаются
чрезвычайно низкой химической активностью.
Правильней было бы сказать, что они отличаются
особой химической неактивностью. Эти газы при
обычных условиях не взаимодействуют ни с какими
веществами, а при особых условиях
взаимодействуют с очень немногими веществами.
Может быть, поэтому другое их название –
благородные газы.
Т.А.ЖУРАВЛЕВА,
учитель химии гимназии № 272
(Санкт-Петербург)
Когда Резерфорд опровергнул модель Томсона о строении атома, возник другой вопрос: из чего состоит ядро? Ответ на этот вопрос был получен спустя пару десятков лет. До этого в качестве элементарного ядра принимали протон — положительную частицу, которая имеет заряд, по модулю равный заряду электрона: е = 1,6*10-19 Кл. Масса же частицы равна 1,6726 · 10−27 кг.
Изотопы
В результате наблюдения огромного числа радиоактивных превращений было обнаружено, что существуют вещества, идентичные по химическим свойствам, но имеющие совершенно различные радиоактивные свойства — в одних и тех же условиях их распад происходил по-разному. Эти вещества не удавалось разделить ни одним из известных химических способов. Поэтому английский радиохимик Содди в 1911 г. высказал предположение о возможности существования элементов с одинаковыми химическими свойствами, но разной радиоактивностью. Эти элементы, по его мнению, нужно было помещать в одну и ту же клетку периодической системы Д. И. Менделеева. Содди назвал такие элементами изотопами (т. е. занимающими одинаковые места).
Предположение Содди о существовании веществ с разной радиоактивностью, но одинаковыми химическими свойствами, было подтверждено экспериментально. Когда английский физик Томсон проводил точные измерения массы ионов неона методом отклонения их в электрическом и магнитном полях, он установил, что неон есть смесь двух видов атомов. Большая часть атомов имела относительную массу 20, но некоторая часть атомов имела массу, равную 22 а. е. м. В результате относительная атомная масса смеси атомов неона была принята равной 20,2. Причем атомы обладали одинаковыми химическими свойствами, но масса их была различна.
С тех пор изотопы были обнаружены у разных химических элементов. Так, они есть у самого тяжелого из существующих в природе элементов — урана (относительные атомные массы 238, 235 и др.) и у самого легкого — водорода (относительные атомные массы 1, 2, 3).
Было установлено, что:
- Изотопы имеют разную массу.
- Заряды ядер изотопов одинаковы;
- Количество электронов у атомов изотопов одинаково.
- Химические свойства изотопов тоже одинаковые.
- Радиоактивность у изотопов разная — ядра одних атомов радиоактивны, в то время как другие могли быть стабильными или менее радиоактивными.
Эти обобщения помогли сделать вывод, что свойства радиоактивности изотопов зависят от их массы. Причем некоторые элементы могут иметь только нестабильные, или радиоактивные изотопы.
Особый интерес для физиков того времени представлял атом водорода, изотопы которого могли отличаться по массе в 2 и 3 раза:
- Дейтерий — изотоп водорода с атомной массой 2. Это стабильный химический элемент, который можно обнаружить в качестве примеси в обычном водороде. На 4500 атомов обычного водорода приходится 1 атом дейтерия. Совместно с кислородом дейтерий образует тяжелую воду. Ее свойства несколько отличаются от обычной воды. Так, при нормальном атмосферном давлении ее температура кипения составляет 101,2 °С, а температура кристаллизации — 3,8 °С.
- Тритий — изотоп водорода с атомной массой 3. Это нестабильный химический элемент. Он претерпевает β-распад. Период полураспада этого вещества составляет 12 лет.
Существование изотопов доказывает, что заряд атомного ядра определяет не все свойства атома, а лишь его химические свойства и те физические свойства, которые зависят от периферии электронной оболочки, например размеры атома. Масса же атома и его радиоактивные свойства не определяются порядковым номером в таблице Д. И. Менделеева.
Открытие нейтрона
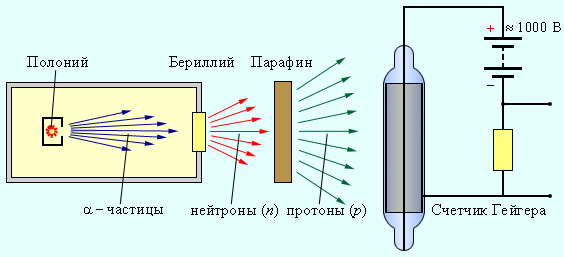
При бомбардировке бериллия α-частицами, испускаемыми нестабильным полонием, возникает сильное проникающее излучение, которое легко преодолевает преграду в виде слоя свинца толщиной до 10–20 см. Это излучение изучали английский физик Чедвик и супруги Жолио-Кюри Ирен и Фредерик из Франции независимо друг от друга примерно в одно и то же время. Ученые предположили, что это излучение создано γ-лучами большой энергии. Но затем выяснилось, что если на пути излучения бериллия поставить пластинку из парафина, то ионизирующая способность излучения резко возрастает.
Было установлено, что излучение бериллия выбивает из парафиновой пластинки протоны, которые в большом количестве имеются в этом веществе. Ученые рассчитали длину свободного пробега протонов в воздухе они оценили энергию γ-квантов, которые сообщают при столкновении с протонами необходимую скорость. Расчеты показали слишком большое значение — 50 МэВ. протонам необходимую скорость. Она оказалась огромной – порядка 50 МэВ. Из-за малой массы γ-кванты не могли обладать такой энергией. Поэтому Чедвик сделал вывод, что из бериллия под действием α-частиц вылетают не безмассовые γ-кванты, а довольно тяжелые частицы. Эти частицы обладали большой проникающей способностью и не ионизировали газ в счетчике Гейгера. Это значит, что такие частицы были электрически нейтральными. Этой частице дали название — нейтрон.
Нуклонная модель атома
Сразу после открытия нейтрона несколько физиков одновременно высказали идею протонно-нейтронной, или нуклонной, модели ядра. Согласно этой модели ядро состоит из протонов и нейтронов. Будучи «кирпичиками», из которых строится ядро, протоны и нейтроны получили общее название — нуклоны.
Нуклоны — общее название для составляющих атомное ядро протонов и нейтронов.
В рамках нуклонной теории о строении ядра атома ему было дано следующее определение:
Атомное ядро — центральная часть атома, состоящая из протонов и нейтронов.
Виды нуклонов:
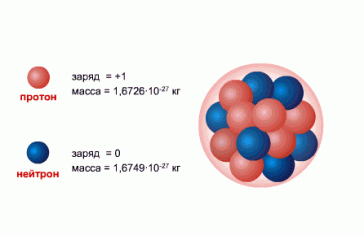
- Протон (от protos — первый, обозначается как p или p+) — стабильная элементарная частица, ядро атома водорода. Заряд протона положительный, по модулю он равен заряду электрона: ep = 1.6∙10−19 Кл. Масса протона: mp = 1.6726231∙10−27 кг = 1.007276470 а. е. м. При расчетах часто используют округленное до целых значение: 1 а. е. м.
- Нейтрон (от лат. neuter — ни тот, ни другой, обозначается как n) — элементарная частица, не имеющая заряда, т. е. нейтральная. Масса нейтрона почти равна (незначительно больше) массе протона: mn = 1.6749286∙10−27 кг=1.0008664902 а. е. м. При расчетах также используют округленное до целых значение: 1 а. е. м.
Массовое число — общее число нуклонов в ядре. Обозначается как A.
Зарядовое число — число протонов в ядре. Обозначается как Z. Зарядовое число всегда соответствует порядковому номеру элемента в периодической таблице Менделеева.
Ядро любого химического в общем виде обозначается так:
AZX
где X — символ химического элемента, Z — число протонов в ядре (порядковый номер элемента в периодической таблице Менделеева), A — массовое число.
Массовое число определяется как сумму протонов и нейтронов, содержащихся в ядре атома:
A=Z+N
N – число нейтронов в ядре.
Пример №1. Пользуясь периодической системой элементов Д.И. Менделеева, определите число протонов и число нейтронов в ядрах атомов серы.
Взглянем на периодическую систему Менделеева и найдем серу:
Порядковый номер серы — 16. Следовательно, зарядовое число, или количество протонов в ядре атома серы — 16. Массовое число составляет 32,066 а. е. м. Округлим до целых и получим 32. Количество нейтронов найдем как разность массового и зарядового чисел:
N=A−Z=32−16=16
Ядерные силы
Ядра атомов обладают устойчивостью, несмотря на то, что между протонами действуют колоссальные силы кулоновского отталкивания. Чем же объясняется это явление? Видимо, между ними существует и другая сила, которая не дает протонам отталкиваться друг от друга. Такие силы назвали ядерными.
Ядерные силы — силы, действующие между протонами и нейтронами.
Ученые установили, что ядерные силы обладают следующими свойствами:
- Ядерные силы заметно проявляются только на расстояниях, сравнимых с размером атомных ядер (10–12–10–13 см). То есть, эти силы являются короткодействующими.
- Ядерные силы примерно в 100 раз превосходят силы электрического взаимодействия. На сегодня это самые мощные силы из всех сил, известных в природе. Именно благодаря им ядра атомов химических элементов сохраняются в устойчивом состоянии.
Энергия связи атомных ядер
Нуклоны в ядре прочно удерживаются ядерными силами. Если совершить работу по их преодолению, придется совершить некоторую работу. Энергию, которую нужно затратить для совершения работы по разделению на отдельные нуклоны, называют энергией связи ядра.
Энергия связи ядра атома — энергия, которая необходима для полного расщепления ядра на отдельные протоны и нейтроны.
На основании закона сохранения энергии можно сделать вывод, что энергия связи равна той энергии, которая выделяется при образовании ядра из отдельных частиц.
В настоящее время рассчитать энергию связи теоретически, подобно тому, как это можно сделать для электронов в атоме, не удается. Выполнить соответствующие расчеты можно, лишь применяя соотношение Эйнштейна между массой и энергией:
Е = mс2
Измерения масс ядер показали, что масса покоя ядра всегда меньше суммы масс входящих в его состав протонов и нейтронов:
Mя< Zmp + Nmn
Mя — масса покоя ядра, Z — число протонов, N — число нейтронов, mp — масса протона, mn — масса нейтрона.
На основании этого был сделан вывод о существовании дефекта (разности масс). Дефект масс определяется разностью суммы масс протонов и нейтронов, входящих в состав ядра, и массы покоя ядра атома:
ΔM=Zmp + Nmn−Mя
ΔM — дефект масс.
Это интересно! Масса ядра атома гелия на 0,75% меньше суммы масс двух протонов и двух нейтронов. Соответственно для гелия в количестве вещества один моль ΔM = 0,03 г.
Уменьшение массы при образовании ядра из нуклонов означает, что при этом уменьшается энергия этой системы нуклонов на значение энергии связи Есв.
Энергия связи — это энергия, которая выделяется при образовании ядра из отдельных частиц, и соответственно это та энергия, которая необходима для расщепления ядра на составляющие его частицы.
Энергия связи определяется формулой:
Eсв=ΔMс2=(Zmp + Nmn−Mя)с2
Это интересно! Энергия связи настолько велика, что образование 4 г гелия сопровождается выделением такой же энергии, что и при сгорании 1,5—2 вагонов каменного угля.
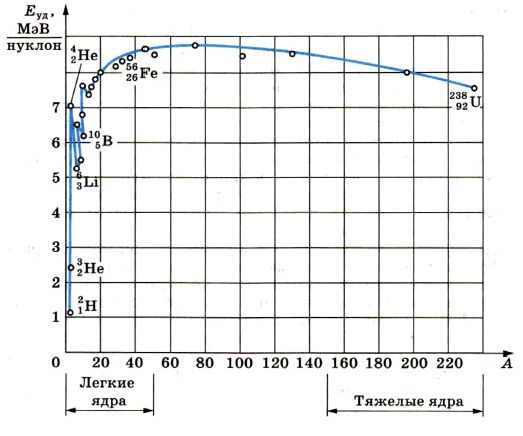
Важную информацию о свойствах ядер содержит зависимость удельной энергии связи от массового числа А.
Удельная энергия связи — энергия связи, приходящаяся на один нуклон ядра.
Удельную энергию связи устанавливают опытным путем. Из рисунка ниже видно, что, не считая самых легких ядер, удельная энергия связи примерно постоянна и равна 8 МэВ/нуклон. Примечательно, что энергия связи электрона и ядра в атоме водорода, равная энергии ионизации, почти в миллион раз меньше этого значения. Кривая на имеет слабо выраженный максимум. Максимальную удельную энергию связи (8,6 МэВ/нуклон) имеют элементы с массовыми числами от 50 до 60, т. е. железо и близкие к нему по порядковому номеру элементы. Ядра этих элементов наиболее устойчивы.
У тяжелых ядер удельная энергия связи уменьшается за счет возрастающей с увеличением Z кулоновской энергии отталкивания протонов. Кулоновские силы стремятся разорвать ядро.
Пример №2. Чему равна энергия связи ядра тяжелого водорода — дейтрона? Атомная масса ядра дейтрона mD = 2,01355 а. е. м, протона mр = 1,00728 а. е. м, нейтрона mn = 1,00866 а. е. м; масса атома углерода mс = 1,995 ∙ 10-26 кг.
Eсв=(Zmp + Nmn−Mя)с2
Зарядовое число водорода — 1. Количество нейтронов — 1. Чтобы найти суммарную массу всех частиц и ядра, нужно их массу в а. е. м. умножить на массу атома углерода в кг и поделить на 12. Это необходимо потому, что 1 а. е. м. равна 1/12 массы атома углерода. Получим:
Переведем в МэВ, учитывая, что 1 МэВ = 1,6∙10–13 Дж:
Задание EF17709
Какая из строчек таблицы правильно отражает структуру ядра 49115 In?
Алгоритм решения
- Установить, чем определяются количество протонов и нейтронов.
- Определить, сколько содержится в атоме протонов.
- Определить, сколько содержится в атоме нейтронов.
Решение
Протоны и нейтроны — нуклоны. Общее их количество является массовым числом A, которое указывается слева от обозначения химического элемента в верхнем индексе. В данном случае A = 115.
Зарядовое число — порядковый номер химического элемента в периодической системе Менделеева. Оно обозначается Z и равно количеству протонов в ядре. В нашем случае Z = 49. Значит, протонов 49.
Чтобы посчитать количество нейтронов, нужно из массового числа вычесть зарядовое число: 115 – 49 = 66. Значит, нейтронов 66. Строка 1 подходит.
Ответ: 1
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17974
Связанная система элементарных частиц содержит 14 нейтронов, 13 протонов и 10 электронов. Эта система частиц является
Ответ:
а) ионом алюминия 1327Al
б) нейтральным атомом кремния 1427Si
в) ионом кремния 1427Si
г) нейтральным атомом алюминия 1327Al
Алгоритм решения
- Определить, перед нами ион или нейтральный атом.
- Установить зарядовое число.
- Установить массовое число.
- Выбрать подходящий ответ.
Решение
Согласно условию задачи, в связанной системе элементарных частиц содержится 14 нейтронов, 13 протонов и 10 электронов. В нейтральном атоме количество электронов равно количеству протонов. В нашем случае электронов на 3 меньше. Значит, перед нами ион.
Зарядовое число соответствует количеству протонов. Их 13.
Массовое число равно сумме количества протонов и электронов: 14 + 13 = 27.
Выходит, перед нами ион алюминия.
Ответ: а
pазбирался: Алиса Никитина | обсудить разбор
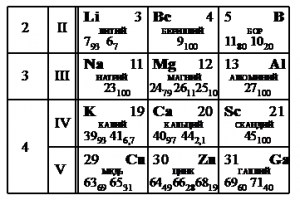
Задание EF18942
На рисунке представлен фрагмент Периодической системы элементов Д.И. Менделеева. Под названием каждого элемента приведены массовые числа его основных стабильных изотопов. При этом нижний индекс около массового числа указывает (в процентах) распространённость изотопа в природе.
Укажите число протонов и число нейтронов в ядре наименее распространённого из указанных стабильных изотопов меди.
Алгоритм решения
- Найти наименее распространенный изотоп меди.
- Выписать для него массовые и зарядовые числа.
- Найти число протонов и нейтронов.
Решения
Наименее распространен изотоп меди Cu-65, поскольку возле его массового числа стоит меньший индекс — 31.
Массовое число этого изотопа — 65. Зарядовое число соответствует порядковому номеру — 29.
Количество протонов соответствует зарядовому числу. Их 29.
Количество нейтронов есть разность массового и зарядовых чисел: 65 – 29 = 36.
Эти числа запишем последовательно: 2936.
Ответ: 2936
pазбирался: Алиса Никитина | обсудить разбор
Алиса Никитина | Просмотров: 1.9k
If you have a given mass of a compound, you can calculate the number of moles. Conversely, if you know how many moles of the compound you have, you can calculate its mass. For either calculation, you need to know two things: the chemical formula of the compound and the mass numbers of the elements that comprise it. An element’s mass number is unique to that element, and it’s listed right underneath the element’s symbol in the periodic table. The mass number of an element is not the same as its atomic number.
TL;DR (Too Long; Didn’t Read)
The atomic mass number of each element appears under its symbol in the periodic table. It’s listed in atomic mass units, which is equivalent to grams/mole.
Atomic Number and Atomic Mass Number
Every element is characterized by a unique number of positively charged protons in its nucleus. For example, hydrogen has one proton, and oxygen has eight. The periodic table is an arrangement of the elements according to increasing atomic number. The first entry is hydrogen, the eighth is oxygen and so on. The place an element occupies in the periodic table is an immediate indication of its atomic number, or the number of protons in its nucleus.
Besides protons, the nuclei of most elements also contains neutrons. These fundamental particles don’t have a charge, but they have roughly the same mass as protons, so they must be included in the atomic mass. The atomic mass number is the sum of all protons and neutrons in the nucleus. The hydrogen atom may contain a neutron, but it usually doesn’t, so the mass number of hydrogen is 1. Oxygen, on the other hand, has an equal number of proteins and neutrons, which raises its mass number to 16. Subtracting an element’s mass number from its atomic mass tells you the number of protons in its nucleus.
Finding the Mass Number
The best place to look for an element’s atomic mass number is in the periodic table. It’s displayed under the symbol for the element. You might be mystified by the fact that in many versions of the periodic table, this number contains a decimal fraction, which you wouldn’t expect if it was derived simply by adding protons and neutrons.
The reason for this is that the number displayed is the relative atomic weight, which is derived from all the naturally occurring isotopes of the element weighted by the percentage of each that occurs. Isotopes are formed when the number of neutrons in an element is more or less than the number of protons. Some of these isotopes, such as carbon-13, are stable, but some are unstable and decay over time to a more stable state. Such isotopes, such as carbon-14, are radioactive.
Virtually all elements have more than one isotope, so each has an atomic mass that contains a decimal fraction. For example, the atomic mass of hydrogen listed in the periodic table is 1.008, that for carbon is 12.011 and that for oxygen is 15.99. Uranium, with an atomic number of 92, has three naturally occurring isotopes. Its atomic mass is 238.029. In practice, scientists usually round mass number to the nearest integer.
Units for Mass
The units for atomic mass have been refined over the years, and today scientists use the unified atomic mass unit (amu, or simply u). It is defined to be equal to exactly one-twelfth the mass of an unbound carbon-12 atom. By definition, the mass of one mole of an element, or Avogadro’s number (6.02 x 1023) of atoms, is equal to its atomic mass in grams. In other words, 1 amu = 1 gram/mole. So if the mass of one hydrogen atom is 1 amu, the mass of one mole of hydrogen is 1 gram. The mass of one mole of carbon is therefore 12 grams, and that of uranium is 238 grams.