Загрузить PDF
Загрузить PDF
Если таблица Менделеева кажется вам сложной для понимания, вы не одиноки! Хотя бывает непросто понять ее принципы, умение работать с ней поможет при изучении естественных наук. Для начала изучите структуру таблицы и то, какую информацию можно узнать из нее о каждом химическом элементе. Затем можно приступить к изучению свойств каждого элемента. Наконец, с помощью таблицы Менделеева можно определить число нейтронов в атоме того или иного химического элемента.
-
1
Таблица Менделеева, или периодическая система химических элементов, начинается в левом верхнем углу и заканчивается в конце последней строки таблицы (в нижнем правом углу). Элементы в таблице расположены слева направо в порядке возрастания их атомного номера. Атомный номер показывает, сколько протонов содержится в одном атоме. Кроме того, с увеличением атомного номера возрастает и атомная масса. Таким образом, по расположению того или иного элемента в таблице Менделеева можно определить его атомную массу.
- Атомная масса увеличивается слева направо и сверху вниз, поскольку в атомах элементов с бо́льшим номером содержится больше протонов и нейтронов. Каждый последующий элемент содержит больше протонов, чем предыдущий, поэтому возрастает и его атомная масса.
- В атомной массе не учитываются электроны, поскольку они весят намного меньше, чем протоны и нейтроны.[1]
-
2
Как видно, каждый следующий элемент содержит на один протон больше, чем предшествующий ему элемент. Это очевидно, если посмотреть на атомные номера. Атомные номера возрастают на один при движении слева направо. Поскольку элементы расположены по группам, некоторые ячейки таблицы остаются пустыми.[2]
- Например, первая строка таблицы содержит водород, который имеет атомный номер 1, и гелий с атомным номером 2. Однако они расположены на противоположных краях, так как принадлежат к разным группам.
-
3
Узнайте о группах, которые включают в себя элементы со схожими физическими и химическими свойствами. Элементы каждой группы располагаются в соответствующей вертикальной колонке. Как правило, они обозначаются одним цветом, что помогает определить элементы со схожими физическими и химическими свойствами и предсказать их поведение.[3]
Все элементы той или иной группы имеют одинаковое число электронов на внешней оболочке.[4]
- Водород можно отнести как к группе щелочных металлов, так и к группе галогенов. В некоторых таблицах его указывают в обеих группах.
- В большинстве случаев группы пронумерованы от 1 до 18, и номера ставятся вверху или внизу таблицы. Номера могут быть указаны римскими (например, IA) или арабскими (например,1A или 1) цифрами.
- При движении вдоль колонки сверху вниз говорят, что вы «просматриваете группу».
-
4
Узнайте, почему в таблице присутствуют пустые ячейки. Элементы упорядочены не только в соответствии с их атомным номером, но и по группам (элементы одной группы обладают схожими физическими и химическими свойствами). Благодаря этому можно легче понять, как ведет себя тот или иной элемент. Однако с ростом атомного номера не всегда находятся элементы, которые попадают в соответствующую группу, поэтому в таблице встречаются пустые ячейки.[5]
- Например, первые 3 строки имеют пустые ячейки, поскольку переходные металлы встречаются лишь с атомного номера 21.
- Элементы с атомными номерами с 57 по 71 относятся к редкоземельным элементам, и обычно их выносят в отдельную подгруппу в нижнем правом углу таблицы.
-
5
Каждая строка таблицы представляет собой период. Все элементы одного периода имеют одинаковое число атомных орбиталей, на которых расположены электроны в атомах. Количество орбиталей соответствует номеру периода. Таблица содержит 7 строк, то есть 7 периодов.[6]
- Например, атомы элементов первого периода имеют одну орбиталь, а атомы элементов седьмого периода — 7 орбиталей.
- Как правило, периоды обозначаются цифрами от 1 до 7 слева таблицы.
- При движении вдоль строки слева направо говорят, что вы «просматриваете период».
-
6
Научитесь различать металлы, металлоиды и неметаллы. Вы лучше будете понимать свойства того или иного элемента, если сможете определить, к какому типу он относится. Для удобства в большинстве таблиц металлы, металлоиды и неметаллы обозначаются разными цветами. Металлы находятся в левой, а неметаллы — в правой части таблицы. Металлоиды расположены между ними.[7]
- Помните, что по свойствам водород можно отнести как к щелочным металлам, так и к галогенам, поэтому он может иметь разный цвет и располагаться в двух ячейках.
- Металлические элементы блестят, являются твердыми при комнатной температуре (за исключением ртути), хорошо проводят тепло и электрический заряд и достаточно пластичны.
- Неметаллы не имеют выраженного блеска, плохо проводят тепло и электрический заряд, обладают низкой пластичностью. Как правило, при комнатной температуре неметаллические элементы представляют собой газ, но при определенных температурах и давлениях они могут принимать жидкое или твердое состояние.
- Металлоиды совмещают в себе свойства металлов и неметаллов.[8]
Реклама
-
1
Каждый элемент обозначается одной или двумя латинскими буквами. Как правило, символ элемента приведен крупными буквами в центре соответствующей ячейки. Символ представляет собой сокращенное название элемента, которое совпадает в большинстве языков. При проведении экспериментов и работе с химическими уравнениями обычно используются символы элементов, поэтому полезно помнить их.[9]
- Обычно символы элементов являются сокращением их латинского названия, хотя для некоторых, особенно недавно открытых элементов, они получены из общепринятого названия. К примеру, гелий обозначается символом He, что близко к общепринятому названию в большинстве языков. В то же время железо обозначается как Fe, что является сокращением его латинского названия.
-
2
Обратите внимание на полное название элемента, если оно приведено в таблице. Это «имя» элемента используется в обычных текстах. Например, «гелий» и «углерод» являются названиями элементов. Обычно, хотя и не всегда, полные названия элементов указываются под их химическим символом.[10]
- Иногда в таблице не указываются названия элементов и приводятся лишь их химические символы.
-
3
Найдите атомный номер. Обычно атомный номер элемента расположен вверху соответствующей ячейки, посередине или в углу. Он может также находиться под символом или названием элемента. Элементы имеют атомные номера от 1 до 118.[11]
- Атомный номер всегда является целым числом.
-
4
Помните о том, что атомный номер соответствует числу протонов в атоме. Все атомы того или иного элемента содержат одинаковое количество протонов. В отличие от электронов, количество протонов в атомах элемента остается постоянным. В противном случае получился бы другой химический элемент![12]
- По атомному номеру элемента можно также определить количество электронов и нейтронов в атоме.
-
5
Обычно количество электронов равно числу протонов. Исключением является тот случай, когда атом ионизирован. Протоны имеют положительный, а электроны — отрицательный заряд. Поскольку атомы обычно нейтральны, они содержат одинаковое количество электронов и протонов. Тем не менее, атом может захватывать электроны или терять их, и в этом случае он ионизируется.[13]
- Ионы имеют электрический заряд. Если в ионе больше протонов, то он обладает положительным зарядом, и в этом случае после символа элемента ставится знак «плюс». Если ион содержит больше электронов, он имеет отрицательный заряд, что обозначается знаком «минус».
- Знаки «плюс» и «минус» не ставятся, если атом не является ионом.
Реклама
-
1
Найдите атомную массу. Обычно атомную массу указывают внизу ячейки, под символом элемента. Атомная масса представляет собой сумму масс частиц, составляющих ядро атома, то есть протонов и нейтронов. Однако элементы имеют изотопы, поэтому атомная масса является средней величиной с учетом их распространенности в природе.[14]
- Поскольку атомная масса представляет собой среднюю величину, для большинства элементов она записывается в виде десятичной дроби.
- Хотя может показаться, что атомная масса всегда возрастает при движении слева направо и сверху вниз, это справедливо не во всех случаях.
-
2
Найдите массовое число конкретного элемента. Поскольку в атомной массе учитываются все изотопы элемента, для определения массового числа достаточно округлить приведенную в таблице атомную массу до ближайшего целого числа.[15]
- Например, атомная масса углерода составляет 12,011, после округления получаем 12. Для железа, атомная масса которого равна 55,847, получаем 56.
-
3
Вычтите из массового числа атома его атомный номер, чтобы найти количество нейтронов. Масса атома представляет сумму масс протонов и нейтронов. Ввиду этого можно легко определить число нейтронов — достаточно вычесть из массового числа атомный номер, то есть количество протонов![16]
- Используйте следующую формулу: Число нейтронов = Массовое число – Число протонов.
- Например, массовое число углерода равно 12, и атом углерода имеет 6 протонов. Поскольку 12 – 6 = 6, атом углерода содержит 6 нейтронов.
- Массовое число железа составляет 56, и его атом содержит 26 протонов. Так как 56 – 26 = 30, в атоме железа содержится 30 нейтронов.
- Изотопы элементов имеют разное количество нейтронов, благодаря чему меняется их атомная масса.
Реклама
Советы
- Многим сложно освоить таблицу Менделеева. Не расстраивайтесь, если столкнетесь с определенными трудностями!
- Хотя цвета могут меняться, они передают одну и ту же информацию.
- Встречаются упрощенные таблицы. Например, в таблице могут содержаться лишь символы элементов и их атомные номера. Выберите такую таблицу, которая подходит для ваших целей.
Реклама
Об этой статье
Эту страницу просматривали 250 814 раз.
Была ли эта статья полезной?
If you have a given mass of a compound, you can calculate the number of moles. Conversely, if you know how many moles of the compound you have, you can calculate its mass. For either calculation, you need to know two things: the chemical formula of the compound and the mass numbers of the elements that comprise it. An element’s mass number is unique to that element, and it’s listed right underneath the element’s symbol in the periodic table. The mass number of an element is not the same as its atomic number.
TL;DR (Too Long; Didn’t Read)
The atomic mass number of each element appears under its symbol in the periodic table. It’s listed in atomic mass units, which is equivalent to grams/mole.
Atomic Number and Atomic Mass Number
Every element is characterized by a unique number of positively charged protons in its nucleus. For example, hydrogen has one proton, and oxygen has eight. The periodic table is an arrangement of the elements according to increasing atomic number. The first entry is hydrogen, the eighth is oxygen and so on. The place an element occupies in the periodic table is an immediate indication of its atomic number, or the number of protons in its nucleus.
Besides protons, the nuclei of most elements also contains neutrons. These fundamental particles don’t have a charge, but they have roughly the same mass as protons, so they must be included in the atomic mass. The atomic mass number is the sum of all protons and neutrons in the nucleus. The hydrogen atom may contain a neutron, but it usually doesn’t, so the mass number of hydrogen is 1. Oxygen, on the other hand, has an equal number of proteins and neutrons, which raises its mass number to 16. Subtracting an element’s mass number from its atomic mass tells you the number of protons in its nucleus.
Finding the Mass Number
The best place to look for an element’s atomic mass number is in the periodic table. It’s displayed under the symbol for the element. You might be mystified by the fact that in many versions of the periodic table, this number contains a decimal fraction, which you wouldn’t expect if it was derived simply by adding protons and neutrons.
The reason for this is that the number displayed is the relative atomic weight, which is derived from all the naturally occurring isotopes of the element weighted by the percentage of each that occurs. Isotopes are formed when the number of neutrons in an element is more or less than the number of protons. Some of these isotopes, such as carbon-13, are stable, but some are unstable and decay over time to a more stable state. Such isotopes, such as carbon-14, are radioactive.
Virtually all elements have more than one isotope, so each has an atomic mass that contains a decimal fraction. For example, the atomic mass of hydrogen listed in the periodic table is 1.008, that for carbon is 12.011 and that for oxygen is 15.99. Uranium, with an atomic number of 92, has three naturally occurring isotopes. Its atomic mass is 238.029. In practice, scientists usually round mass number to the nearest integer.
Units for Mass
The units for atomic mass have been refined over the years, and today scientists use the unified atomic mass unit (amu, or simply u). It is defined to be equal to exactly one-twelfth the mass of an unbound carbon-12 atom. By definition, the mass of one mole of an element, or Avogadro’s number (6.02 x 1023) of atoms, is equal to its atomic mass in grams. In other words, 1 amu = 1 gram/mole. So if the mass of one hydrogen atom is 1 amu, the mass of one mole of hydrogen is 1 gram. The mass of one mole of carbon is therefore 12 grams, and that of uranium is 238 grams.
«Строение атома. Массовое число»
Ключевые слова конспекта: строение атома, элементарные частицы, протоны и электроны в атомах, атомный номер, массовой число, число нейтронов, нуклид, изотопы, ионы, катионы, заряд иона.
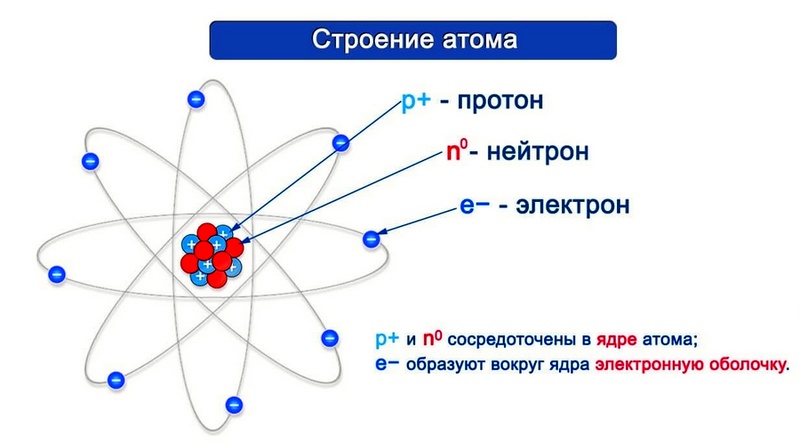
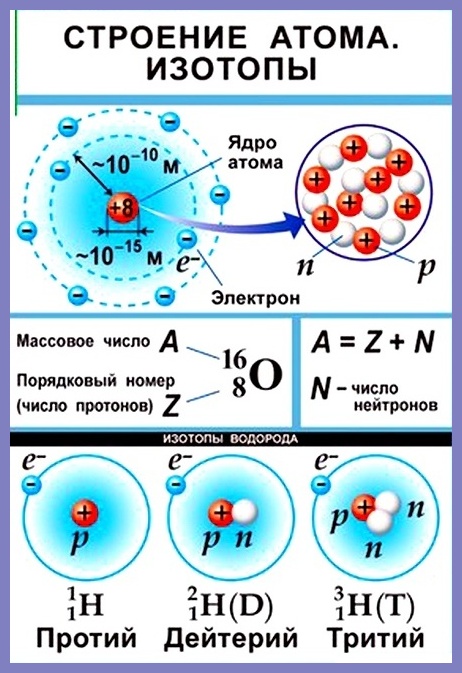
Согласно модели Резерфорда каждый атом состоит из находящегося в его центре ядра и электронной оболочки. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре. Электроны движутся вокруг ядра. Число электронов атома равно положительному заряду ядра.
Диаметр атома 10-10 м, диаметр ядра 10-14 – 10-15 м. Масса атома водорода равна 1,67 • 10-24 г, атома углерода — 1,99 • 10-23 г, атома железа — 9,29 • 10-23 г.
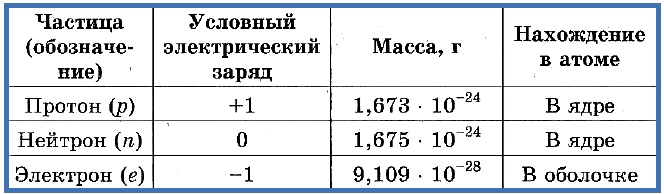
Элементарные частицы — это протоны, электроны и нейтроны, из них состоят все атомы.
Таблица 1. «Элементарные частицы атома»
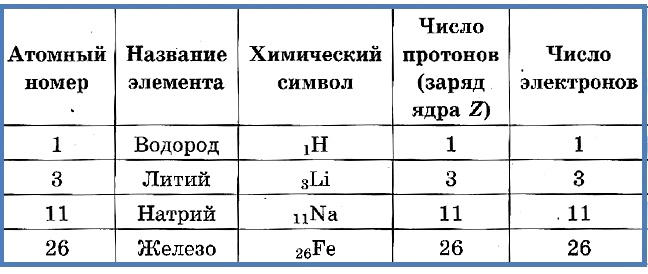
Число протонов разное у атомов различных видов, оно определяет заряд ядра атома и равно атомному номеру элемента в таблице Менделеева. Поскольку атом — электро-нейтральная частица, число электронов в нем равно числу протонов.
Таблица 2. «Протоны и электроны в атомах»
Атомный номер указывают слева внизу от символа элемента, например: 1Н, 26Fe. Обозначение атомного номера — прописная латинская буква Z.
Массовое число атома А — это сумма чисел его протонов и нейтронов в ядре. Массовое число указывают слева вверху от символа элемента или добавляют к названию элемента через дефис, например: 23Na или натрий-23.
Массовое число кислорода, А(16О) = 16 = (8р + 8n).
Число нейтронов N в ядре атома определяют по формуле: N = A — Z. Например, для атома натрия с массовым числом 23, 23Na: А = 23, Z = 11, N = А – Z = 23 — 11 = 12.
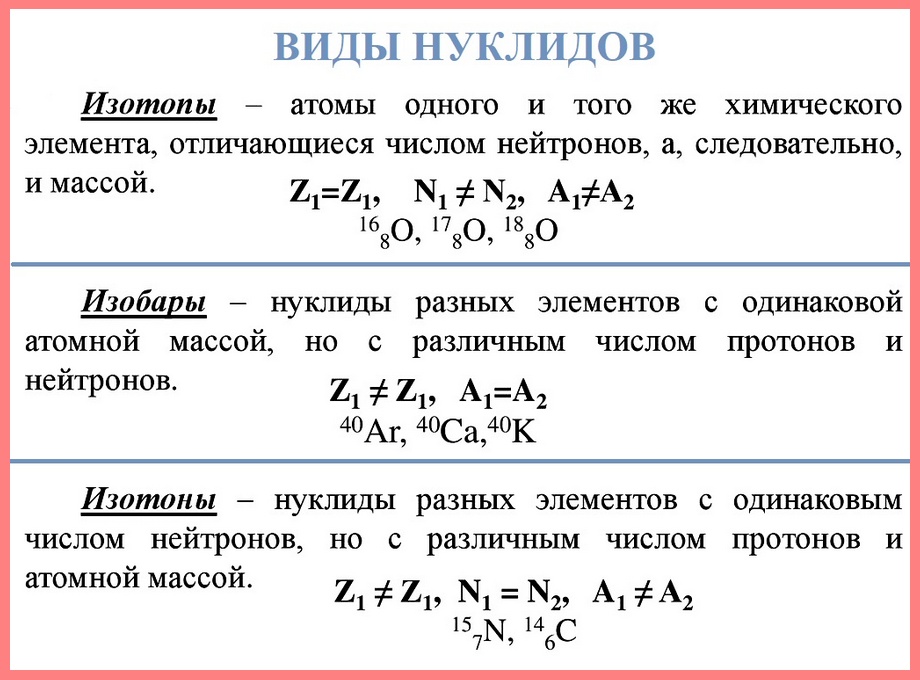
Нуклид — это вид атомов с определенным числом протонов и нейтронов в ядре. Например, в природе встречается три вида нуклидов кислорода: 16О, 17О и 18О.
Изотопы — это атомы одного вида с одинаковым числом протонов, но разным числом нейтронов. Так, атомы 16О, 17О и 18О — это изотопы. Природные изотопы урана — 234U, 235U и 238U.
Ионы — заряженные частицы, образующиеся при отщеплении от нейтральных атомов или присоединении к ним электронов. Ионы образуются также из молекул в результате присоединения протона Н+ (NH3 → NH4+) или отщепления Н+ (HNO3 -> NO3–).
Таблица 3. «Обозначение и название ионов»
Катионы — это положительно заряженные ионы (Na+, Аl3+), анионы — отрицательно заряженные ионы (Cl–, NO3–).
Заряд иона указывают в виде индекса справа вверху от символа химического элемента: Li+ , Са2+. На первом месте пишут цифру, на втором — знак заряда. Цифру 1 не пишут.
Конспект урока по химии «Строение атома».
В уроке 2 «Изотопы элементов» из курса «Химия для чайников» рассмотрим что такое изотопы элементов и как правильно их обозначают; кроме того мы научимся определять массовое число, дефект массы и энергию связи ядра. Данный урок полностью опирается на основы химии, изложенные в первом уроке, в котором мы рассмотрели строение атома и атомного ядра, поэтому настоятельно вам рекомендую его изучить от корки до корки.
Что такое изотоп?
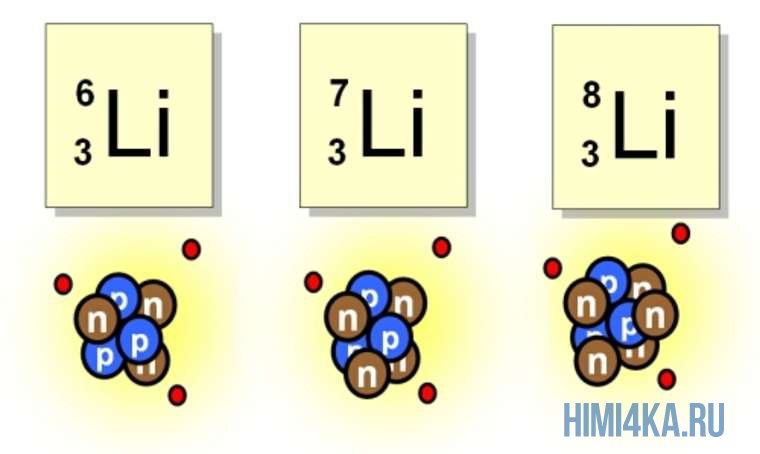
Хотя все атомы одного элемента имеют одинаковое число протонов, эти атомы могут отличаться числом имеющихся у них нейтронов. Такие различные атомы одного и того же элемента называются изотопами. Количество протонов, а также количество электронов у изотопа и исходного элемента совпадает. По этой причине в природе существует гораздо больше химических элементов, чем указано в таблице Менделеева, которая систематизирует элементы по числу протонов (порядковый номер).
Например, все атомы Li имеют 3 протона, но в природе существуют изотопы, содержащие от 3 до 5 нейтронов. Для обозначения изотопа, слева от символа элемента подписывают нижним индексом его порядковый номер, а верхним — массовое число. Массовое число — это суммарное число нуклонов (протонов и нейтронов) в атомном ядре, численно близкое к атомной массе элемента. Нижний индекс, обозначающий порядковый номер элемента, указывать не обязательно, так как все атомы лития имеют в своем ядре по 3 протона. Также, обсуждая эти изотопы, можно пользоваться записью «литий-6» и «литий-8».
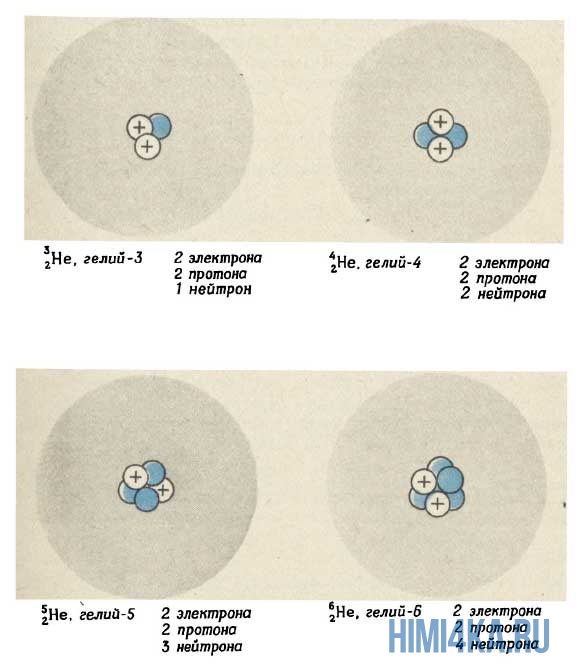
На рисунке выше изображен состав четырех изотопов гелия (Не). Все атомы гелия содержат два протона (и, следовательно, два электрона), но число нейтронов у них может быть разным. В природе большинство атомов гелия имеет два нейтрона (гелий-4) и реже одного раза на миллион встречаются атомы гелия с одним нейтроном (гелий-3). Другие изотопы гелия — гелий-5 , гелий-6 и гелий-8 (не показанный на рисунке) — неустойчивы и обнаруживаются лишь на очень непродолжительное время в ядерных реакциях (подробнее об этом будем говорить еще не скоро). Размеры ядер на рисунке очень сильно увеличены. Если бы они были такими, как это показано на рисунке, диаметр атома должен был достигать примерно 0,5 км.
Пример 1. Сколько протонов, нейтронов и электронов содержится в атоме урана-238? Запишите символ этого изотопа.
Решение: Порядковый номер урана (см. таблицу Менделеева) равен 92, а массовое число изотопа равно 238 (по условию). Следовательно, он содержит 92 протона, 92 электрона и 238 — 92 = 146 нейтронов. Его символ 238U.
Дефект массы и энергия связи ядра
Затронув тему изотопов, нельзя пройти мимо феномена дефект массы ядра. Когда из отдельных нуклонов образуется атомное ядро, часть их массы превращается в энергию. Другими словами, вот взяли вы щепотку протонов и нейтронов, хорошенько их смяли вместе, и получили ядро, но его масса будет меньше массы исходных компонентов. Это и есть дефект масс. Формула для расчета дефекта массы ядра:
- ∆m=(Zmp+Nmn)-Mя
где Mя – масса ядра, Z – число протонов в ядре, N – число нейтронов в ядре, mp – масса протона, mn – масса нейтрона.
Если к атому подвести энергию (которая эквивалентна дефекту масс), то можно разделить его ядро обратно на нуклоны. Эта энергия носит название энергия связи ядра. Формула для расчета энергии связи ядра:
- ∆Eсв=∆mc2
где с — скорость света, ∆m — дефект массы ядра
Проверьте себя, как вы усвоили понятия дефект массы и энергия связи ядра, самостоятельно решив задачу пользуясь формулами выше.
Пример 2. Если образовать атом углерода-12 из субатомных частиц, какое значение будет иметь дефект масс?
Показать
Ответ: 0,0990 а.е.м.
[свернуть]
Теперь нам известно, что каждый изотоп элемента характеризуется порядковым номером (суммарным числом протонов), массовым числом (суммарным числом протонов и нейтронов) и атомной массой (массой атома, выраженной в атомных единицах массы). Поскольку дефект массы при образовании атома очень мал, массовое число обычно совпадает с атомной массой изотопа, округленной до ближайшего целого числа. (Например, атомная масса хлора-37 равна 36,966, что после округления дает 37.) Если в природе встречается несколько изотопов одного элемента, то экспериментально наблюдаемая атомная масса (естественная атомная масса) равна средневзвешенному значению атомных масс отдельных изотопов. Это средневзвешенное значение определяется соответственно относительному содержанию изотопов в природе. Хлор существует в природе в виде смеси из 75,53% хлора-35 (атомная масса 34,97 а.е.м.) и 24,47% хлора-37 (36,97 а.е.м.), поэтому средневзвешенное значение масс этих изотопов равно
- (0,7553·34,97 а.е.м.) + (0,2447·36,97 а.е.м.) = 35,46 а.е.м.
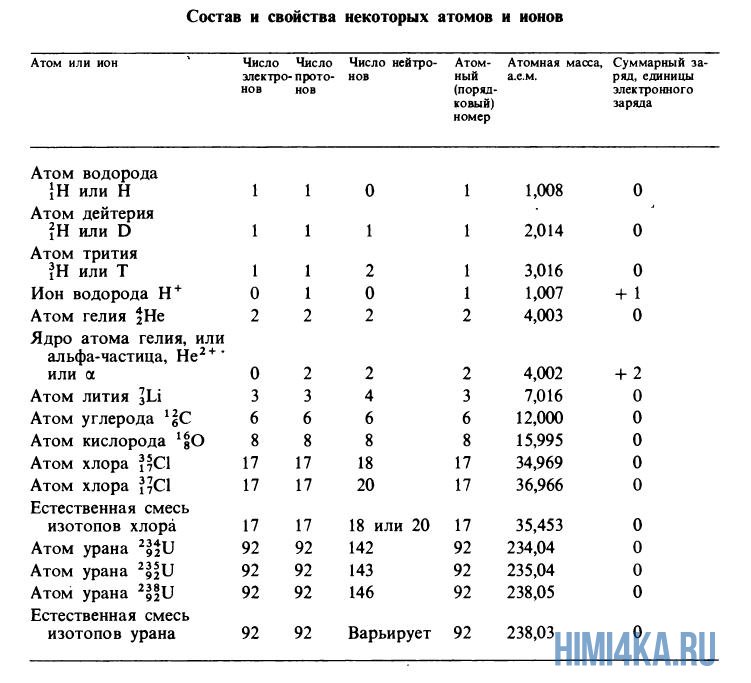
Атомные массы, указанные в таблице Менделеева представляют собой во всех случаях средневзвешенные значения атомных масс изотопов, встречающихся в природе, и именно этими значениями мы будем пользоваться в дальнейшем, за исключением тех случаев, когда будет обсуждаться какой-нибудь конкретный изотоп. Все изотопы одного элемента в химическом отношении ведут себя практически одинаково. На рисунке ниже изображены состав и свойства некоторые атомов, ионов и изотопов элементов.
Пример 3. Магний (Mg) в основном состоит из трех естественных изотопов: 78,70% всех атомов магния имеют атомную массу 23,985 а.е.м., 10,13% — 24,986 а.е.м. и 11,17% — 25,983 а.е.м. Сколько протонов и нейтронов содержится в каждом из этих трех изотопов? Чему равно средневзвешенное значение их атомных масс?
Решение: Все изотопы магния содержат по 12 протонов. Изотоп с атомной массой 23,985 а.е.м. имеет массовое число 24 (суммарное число протонов и нейтронов), следовательно, он имеет 24 — 12 = 12 нейтронов. Символ этого изотопа 24Mg. Аналогично находим, что изотоп с атомным весом 24,986 а.е.м. имеет массовое число 25, содержит 13 нейтронов и имеет символ 25Mg. Третий изотоп (25,983 а.е.м.) имеет массовое число 26, содержит 14 нейтронов и имеет символ 26Mg. Средняя атомная масса магния находится следующим образом:
- (0,7870·23,985 а.е.м.) + (0,1013·24,986 а.е.м.) + (0,1117·25,983 а.е.м.) = 24,31 а.е.м.
Надеюсь урок 2 «Изотопы элементов» помог вам понять что из себя представляют изотопы. Если у вас возникли вопросы, пишите их в комментарии.
найди число атомов каждого элемента в молекуле оксида углерода, если массовая доля углерода в нём равна (42,86) %, а массовая доля кислорода — (57,14) %.
1. Примем массу оксида равной (100) г. Масса углерода в такой порции равна (42,86) г, а масса кислорода — (57,14) г.
2. Находим относительные атомные массы элементов в Периодической таблице:
3. Обозначаем число атомов углерода как (x), а число атомов кислорода — (y), и записываем отношение масс:
.
4. Получаем выражение:
5. Находим отношение (x : y):
.
В молекуле оксида углерода на (1) атом углерода приходится (1) атом кислорода.