Характеристика серы
Положение в ПСХЭ
Сера (S) располагается во 3 периоде, в VI группе, главной подгруппе, имеет порядковый номер 16.
Атомные числа
A (массовое число) = 32
P (число протонов) = 16
N (число нейтронов) = A — Z = 32 — 16 = 16
ē (число электронов) = 16
Электронное строение атома
S
+16
2
8
6
16S 1s2 2s2 2p6 3s2 3p4
Валентные электроны
| 16S | ↑↓ | ↑↓ | ↑ | ↑ | ||||||||
| 3s | 3p | 3d |
| 16S* | ↑↓ | ↑ | ↑ | ↑ | ↑ | |||||||
| 3s | 3p | 3d |
| 16S** | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | ||||||
| 3s | 3p | 3d |
Степени окисления
минимальная: -2
максимальная: +6
Свойства простого вещества
Сера – p-элемент, неметалл.
Высший оксид
SO3 – оксид серы (VI).
Проявляет кислотные свойства:
SO3 + 2NaOH ⟶ Na2SO4 + H2O
Высший гидроксид
H2SO4 – серная кислота.
Проявляет кислотные свойства:
H2SO4 + 2NaOH ⟶ Na2SO4 + 2H2O
Водородное соединение
H2S
Сера — S
Порядковый номер Z=16 и массовое число А= 32, заряд ядра + 16, число протонов =16, нейтронов( N= A-Z= 12) 32 – 16=16 нейтронов, электронов = 16, период – 3, энергетических уровней — 3
16 S ) ) )
Строение электронной оболочки: 16 S 2е; 8е; 6е.
16 S ) ) )
2 8 6
Степень окисления — (-2) и (+ 2; +4; +6)
Окислительные свойства у серы выражены сильнее, чем у селена, но слабее, чем у кислорода, что связано с увеличением радиусов атомов от кислорода к селену
SО 3 – оксид серы является кислотным оксидом и проявляет все характерные свойства оксидов.
Сера образует гидроксид Н2SО4, который проявляет все характерные свойства кислот.
Сера из водородных соединений образует Н2S.
найди число атомов каждого элемента в молекуле оксида углерода, если массовая доля углерода в нём равна (42,86) %, а массовая доля кислорода — (57,14) %.
1. Примем массу оксида равной (100) г. Масса углерода в такой порции равна (42,86) г, а масса кислорода — (57,14) г.
2. Находим относительные атомные массы элементов в Периодической таблице:
3. Обозначаем число атомов углерода как (x), а число атомов кислорода — (y), и записываем отношение масс:
.
4. Получаем выражение:
5. Находим отношение (x : y):
.
В молекуле оксида углерода на (1) атом углерода приходится (1) атом кислорода.
Сера
Сера, Свойства и параметры серы
Сера, Вступление |
|
| Символ | S |
| Латинское название | Sulfur |
| Тип вещества | простой химический элемент |
Основные параметры серы по таблице Менделеева |
|
| Атомный номер Z | 16 |
| Атомная масса | 32.065 |
| Группа | 16 |
| Период | 3 |
| Принадлежность к группе | неметаллы |
Термодинамические свойства серы |
|
| Агрегатное состояние при нормальных условиях | твердое тело |
| Точка плавления по Кельвину | 388.36 (Кельвин) |
| Точка плавления по Цельсию | 115.21 (°C) |
| Точка кипения по Кельвину | 717.87 (Кельвин) |
| Точка кипения по Цельсию | 444.72 (°C) |
Электрические свойства серы |
|
| Тип электрической проводимости | диэлектрик |
Магнитные свойства серы |
|
| Тип магнитной проницаемости | диамагнетик |
Свойства атома серы |
|
| Конфигурация электронного облака | 1s2 | 2s22p63s23p4 |
| Радиус атома | 88 · 10 − 12 (Метр) |
| Число протонов p | 16 |
| Число нейтронов n | 16 |
| Число электронов e | 16 |
| Массовое число A | 32 |
| Атомная структура серы | 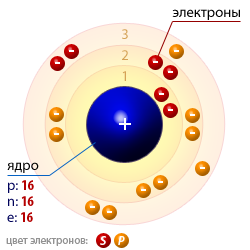 |
Химические свойства серы |
|
| Валентность | 6 |
Распространенность серы |
|
| Вселенная состоит из серы на | 0.05% |
| Солнце состоит из серы на | 0.04% |
| Мировой океан состоит из серы на | 0.093% |
| Человеческое тело состоит из серы на | 0.2% |
Вселенная |
|
| Вселенная состоит из серы на | 0.05% |
Сера, свойства серы |
стр. 793 |
|---|
Сера: химические свойства
Характеристика элемента серы
Сера S – элемент № 16, 3–й период, VIA группа (халькогены). Электронная конфигурация атома серы в стационарном состоянии 1s22s22p63s23p4:
Электронная формула атома серы:
Валентные возможности серы: II – в стационарном состоянии, IV (3s23p33d1) и VI (3s13p33d2) – в возбуждённом состоянии атома.
Наиболее характерными для серы являются следующие степени окисления:
0 – в простых веществах (ромбическая, пластическая сера);
–2 – в сероводороде Н2S и сульфидах (FeS, Na2S);
+4 – в оксиде серы (IV) SO2, сернистой кислоте Н2SO3 и её солях – сульфитах (K2SO3);
+6 – в оксиде серы (VI) S03, серной кислоте Н2SO4 и её солях – сульфатах (K2SO4).
Реже сера проявляет степени окисления:
–1 – в дисульфидах, например FeS2;
+1 – S2C12 – дихлорид дисеры или дихлорид серы (I);
+2 – SC12 – дихлорид серы или хлорид серы (II).
Высшим оксидом серы является оксид серы (VI) SO3 (серный ангидрид), его характер – кислотный. Высшим гидроксидом серы является серная кислота Н2SO4 – сильный электролит, нелетучая, стабильная двухосновная кислота. Водородным соединением серы является сероводород Н2S (газ при обычных условиях), его водный раствор – сероводородная кислота, двухосновная, слабый электролит.
Сера – простое вещество
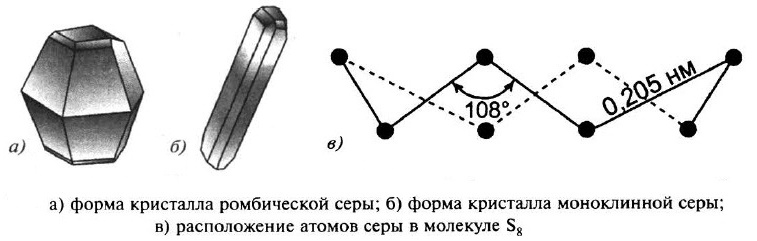
Наиболее прочны молекулы серы S8, имеющие форму короны.
Сeрa образует несколько аллотропных модификаций: ромбическая сера и моноклинная сера. Кристаллическая решётка в обоих случаях молекулярная, в узлах решётки – молекулы S8.
При выливании расплава серы в холодную воду образуется пластичная масса – пластическая сeрa, не имеющая кристаллического строения. Её макромолекулы образованы линейными цепями Sn. При хранении пластическая сера становится хрупкой, изменяет окраску и переходит в ромбическую модификацию.
Если медленно нагреть ромбические кристаллы выше 96 °С, то они превращаются в моноклинную модификацию. В обеих модификациях молекулы серы находятся в форме восьмичленных колец, но упакованы они по–разному. Переход ромбической серы в моноклинную при 96 °С является обратимым. При нагревании до 112 °С сера плавится, а составляющие кристаллическую решётку восьмичленные кольца разрываются, образуя молекулы с открытой цепью.
При обычных условиях сера – твёрдое кристаллическое вещество; кристаллы жёлтого цвета, хрупкие, лёгкие (р ≈ 2 г/см3), легкоплавкие (t0пл ≈ 113°С для ромбической серы).
Для серы характерна окислительно-восстановительная двойственность: по отношению к металлам и водороду сера выступает в роли окислителя.
С водородом сера взаимодействует при нагревании с образованием сероводорода:
При обычных условиях серa взаимодействует со ртутью:
При нагревании сера взаимодействует со многими металлами:
По отношению к неметаллам сeра выступает в роли восстановителя. При нагревании сера сгорает в кислороде:
Сера взаимодействует со всеми галогенами. Фтор окисляет серу до высшей степени окисления.
При температуре примерно 700–800 °С уголь взаимодействует с серой, образуется сероуглерод:
Серa реагирует с концентрированной серной и азотной кислотами:
Сера используется для производства серной кислоты, в реакции вулканизации каучука, для производства инсектицидов, в косметической промышленности.
Конспект урока «Сера: химические свойства».
Следующая тема: «».