найди число атомов каждого элемента в молекуле оксида углерода, если массовая доля углерода в нём равна (42,86) %, а массовая доля кислорода — (57,14) %.
1. Примем массу оксида равной (100) г. Масса углерода в такой порции равна (42,86) г, а масса кислорода — (57,14) г.
2. Находим относительные атомные массы элементов в Периодической таблице:
3. Обозначаем число атомов углерода как (x), а число атомов кислорода — (y), и записываем отношение масс:
.
4. Получаем выражение:
5. Находим отношение (x : y):
.
В молекуле оксида углерода на (1) атом углерода приходится (1) атом кислорода.
В химии массовое отношение, часто называемое «процентным составом по массе», представляет собой долю конкретной молекулы, которая состоит из составляющих ее элементов. Например, вода состоит из 11,1 процента водорода (Н) и 88,9 процента кислорода (О), что означает, что 1000-граммовый образец воды (равный 1 литру по объему) состоит из 111 г Н (0,111 × 1000 = 111) и 889 г О (0,889 × 1000).
Этот принцип порождает закон постоянного состава, выдвинутый Джозефом Прустом в 1800 году: данное соединение всегда имеет одинаковую пропорцию по массе составляющих его элементов. Например, вода всегда имеет ровно 8 грамм кислорода на каждый грамм водорода. Углекислый газ всегда содержит 2,67 г кислорода на каждый грамм углерода.
Рассчитать массовые отношения достаточно просто, если у вас есть доступ к периодической таблице (см. Ресурсы) и средства для выполнения базовой алгебры.
Допустим, вы хотите рассчитать массовое соотношение серной кислоты H2SO4.
Определить молярную массу каждого присутствующего элемента
H2SO4 содержит водород (H), серу (S) и кислород (S). Из таблицы Менделеева вы можете видеть, что молярные массы этих элементов:
H = 1,00
S = 32,06
O = 16,00
Шаг 2: Определите массу каждого отдельного присутствующего элемента
На этом шаге вы умножаете количество атомов в одной молекуле соединения на молярную массу, собранную на шаге 1. Количество атомов — это просто нижний индекс после сокращения элемента в молекулярной формуле с пропуском нижнего индекса, означающего «1.»
Есть два атома Н, один атом S и четыре атома О, поэтому у вас есть:
H = (2) (1,00) = 2 г
S = (1) (32,06 г) = 32,06 г
O = (4) (16,00 г) = 64 г
Шаг 3: Определить молярную массу соединения.
Сложите цифры, которые вы рассчитали на шаге 2:
2 + 32,06 + 64 = 98,06 г
Шаг 4: разделить массу каждого присутствующего элемента на молярную массу
Это означает разделение отдельных масс из шага 2 по результату шага 3.
Для Н, у вас есть 2 ÷ 98,06 = 0,0204 = 2,04 процента водорода
Для S у вас есть 32,06 ÷ 98,06 = 0,3269 = 32,69% серы
Для O, у вас есть 64 ÷ 98,06 = 0,6527 = 65,27 процента кислорода
Совет
Чтобы проверить свою работу, убедитесь, что ваши проценты в сумме равны 100, учитывая незначительные различия в результате округления:
2,04 + 32,69 + 65,27 = 100,0
В химии массовое соотношение, часто называемое «процентным составом по массе», — это доля конкретной молекулы, которая состоит из составляющих элементов каждой молекулы. Например, вода состоит из 11, 1 процента водорода (Н) и 88, 9 процента кислорода (О), что означает, что 1000-граммовый образец воды (равный 1 литру по объему) состоит из 111 г Н (0, 111 × 1000 = 111) и 889 г О (0, 889 × 1000).
Этот принцип порождает закон постоянного состава, выдвинутый Джозефом Прустом в 1800 году: данное соединение всегда имеет одинаковую пропорцию по массе составляющих его элементов. Например, вода всегда имеет ровно 8 грамм кислорода на каждый грамм водорода. Углекислый газ всегда содержит 2, 67 г кислорода на каждый грамм углерода.
Вычислить массовые отношения достаточно просто, если у вас есть доступ к периодической таблице (см. Ресурсы) и средства для выполнения базовой алгебры.
Допустим, вы хотите рассчитать массовое соотношение серной кислоты H 2 SO 4.
-
Определить молярную массу каждого присутствующего элемента
H 2 SO 4 содержит водород (H), серу (S) и кислород (S). Из таблицы Менделеева вы можете видеть, что молярные массы этих элементов:
H = 1, 00
S = 32, 06
O = 16, 00
Шаг 2: Определите массу каждого отдельного присутствующего элемента
На этом этапе вы умножаете количество атомов в одной молекуле соединения на молярную массу, собранную на шаге 1. Количество атомов — это просто нижний индекс после аббревиатуры элемента в молекулярной формуле с пропуском нижнего индекса, означающего «1.»
Есть два атома Н, один атом S и четыре атома О, поэтому у вас есть:
H = (2) (1, 00) = 2 г
S = (1) (32, 06 г) = 32, 06 г
O = (4) (16, 00 г) = 64 г
Шаг 3: Определить молярную массу соединения.
Сложите цифры, которые вы рассчитали на шаге 2:
2 + 32, 06 + 64 = 98, 06 г
Шаг 4: разделите массу каждого присутствующего элемента на молярную массу
Это означает разделение отдельных масс из шага 2 по результату шага 3.
Для Н, у вас есть 2 ÷ 98, 06 = 0, 0204 = 2, 04 процента водорода
Для S у вас есть 32, 06 ÷ 98, 06 = 0, 3269 = 32, 69% серы
Для O, у вас есть 64 ÷ 98, 06 = 0, 6527 = 65, 27 процента кислорода
Чаевые
Чтобы проверить свою работу, убедитесь, что ваши проценты в сумме равны 100, учитывая незначительные различия в результате округления:
2, 04 + 32, 69 + 65, 27 = 100, 0
Алгоритм определения массовых соотношений
элементов в соединении
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
1.Прочитайте текст задачи. |
Определить массовые соотношения |
|
2.Запишите |
Fe2O3
|
|
3.Найдите |
3.Решение: Mr(Fe2O3) = 2Ar(Fe) + |
|
4.Вычислите |
4. |
|
5.Запишите |
Ответ: В |
Алгоритм определения молекулярной формулы
вещества по массовым соотношениям элементов
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
1.Прочитайте текст задачи. |
Химическое соединение содержит по |
|
2.Запишите |
2.Дано:
NaxCryOz= ? |
|
3.Запишите |
3.Решение: Ar(Na) = 23 Ar(Cr) = 52 Ar(O) = 16 |
|
4.Составьте |
4. x : y : z= 0,763 |
|
5. |
x : y : z= 2·1 : |
|
6.Запишите |
Ответ: Простейшая |
Нахождение молекулярной массы вещества.
1.
Найти молярную массу сульфата алюминия. Указать относительную молекулярную
массу вещества.
Дано:
АІ2(SО4)3
Найти:
М[АІ2(SО4)3] -? Мr[АІ2(SО4)3] -?
Решение:
М[АІ2(SО4)3]
= А(АІ) · n(АІ) + А(S) · n(S) + А(О) · n(О)
М[АІ2(SО4)3]
= 27 · 2 + (32 + 16 · 4) · 2 = 54 + 96 · 3 =
=
54 + 288 = 342 г/моль
Мr[АІ2(SО4)3]
= Аr(АІ) · n(АІ) + Аr(S) · n(S) + Аr(О) · n(О)
Мr[АІ2(SО4)3]
= 27 · 2 + (32 + 16 · 4) · 2 = 54 + 96 · 3 =
=
54 + 288 = 342 .
Ответ:
М[АІ2(SО4)3] = 342 г/моль; Мr[АІ2(SО4)3] = 342.
Содержание
- Что значит массовое соотношение
- массовое соотношение
- Смотреть что такое «массовое соотношение» в других словарях:
- Массовая доля
- Что такое массовая доля
- Относительная атомная и молекулярная масса
- Как найти массовую долю элемента в веществе
- Пример 1
- Пример 2
- Как вычислить массовую долю вещества в растворе
- Пример
- Вопросы для самопроверки:
- Как найти соотношение масс
- Меню сайта
- Категории каталога
- Форма входа
- Поиск
- Друзья сайта
- Наш опрос
- Статистика
- Главная > Решение
Что значит массовое соотношение
В химии массовое отношение, часто называемое «процентным составом по массе», представляет собой долю конкретной молекулы, которая состоит из составляющих ее элементов. Например, вода состоит из 11,1 процента водорода (Н) и 88,9 процента кислорода (О), что означает, что 1000-граммовый образец воды (равный 1 литру по объему) состоит из 111 г Н (0,111 × 1000 = 111) и 889 г О (0,889 × 1000).
Этот принцип порождает закон постоянного состава, выдвинутый Джозефом Прустом в 1800 году: данное соединение всегда имеет одинаковую пропорцию по массе составляющих его элементов. Например, вода всегда имеет ровно 8 грамм кислорода на каждый грамм водорода. Углекислый газ всегда содержит 2,67 г кислорода на каждый грамм углерода.
Рассчитать массовые отношения достаточно просто, если у вас есть доступ к периодической таблице (см. Ресурсы) и средства для выполнения базовой алгебры.
Допустим, вы хотите рассчитать массовое соотношение серной кислоты H2SO4.
Определить молярную массу каждого присутствующего элемента
H2SO4 содержит водород (H), серу (S) и кислород (S). Из таблицы Менделеева вы можете видеть, что молярные массы этих элементов:
O = 16,00
Шаг 2: Определите массу каждого отдельного присутствующего элемента
На этом шаге вы умножаете количество атомов в одной молекуле соединения на молярную массу, собранную на шаге 1. Количество атомов — это просто нижний индекс после сокращения элемента в молекулярной формуле с пропуском нижнего индекса, означающего «1.»
Есть два атома Н, один атом S и четыре атома О, поэтому у вас есть:
S = (1) (32,06 г) = 32,06 г
O = (4) (16,00 г) = 64 г
Шаг 3: Определить молярную массу соединения.
Сложите цифры, которые вы рассчитали на шаге 2:
2 + 32,06 + 64 = 98,06 г
Шаг 4: разделить массу каждого присутствующего элемента на молярную массу
Это означает разделение отдельных масс из шага 2 по результату шага 3.
Для Н, у вас есть 2 ÷ 98,06 = 0,0204 = 2,04 процента водорода
Для S у вас есть 32,06 ÷ 98,06 = 0,3269 = 32,69% серы
Для O, у вас есть 64 ÷ 98,06 = 0,6527 = 65,27 процента кислорода
Совет
Чтобы проверить свою работу, убедитесь, что ваши проценты в сумме равны 100, учитывая незначительные различия в результате округления:
Источник
массовое соотношение
Универсальный русско-английский словарь . Академик.ру . 2011 .
Смотреть что такое «массовое соотношение» в других словарях:
массовое соотношение компонентов топлива в ЖРД (камере ЖРД, газогенераторе ЖРД) — соотношение компонентов в двигателе (камере, газогенераторе) Отношение массового расхода окислителя при работе ЖРД (камеры ЖРД, газогенератора ЖРД) к массовому расходу горючего. Обозначение: Km [ГОСТ 17655 89] Тематики двигатели ракетные… … Справочник технического переводчика
Массовое убийство в Адреатинских пещерах — Вход в Ардеатинские пещеры. Массовое убийство в Ардеатинских пещерах (итал. Eccidio delle Fosse Ardeatine) … Википедия
МОЛЕКУЛЯРНО-МАССОВОЕ РАСПРЕДЕЛЕНИЕ — соотношение количеств молекул разл. длины (массы) в данном образце полимера. Одна из важнейших характеристик синтетич. полимеров, определяющая многие их свойства, в частности механич. прочность … Естествознание. Энциклопедический словарь
молекулярно-массовое распределение — соотношение количеств молекул различной длины (массы) в данном образце полимера. Одна из важнейших характеристик синтетических полимеров, определяющая многие их свойства, в частности механическую прочность. * * * МОЛЕКУЛЯРНО МАССОВОЕ… … Энциклопедический словарь
МОЛЕКУЛЯРНО-МАССОВОЕ РАСПРЕДЕЛЕНИЕ — соотношение количеств молекул различной длины (массы) в данном образце полимера. Одна из важнейших характеристик синтетических полимеров, определяющая многие их свойства, в частности механическую прочность … Большой Энциклопедический словарь
МОЛЕКУЛЯРНО-МАССОВОЕ РАСПРЕДЕЛЕНИЕ — (полидисперсность полимеров), соотношение кол в макромолекул различной мол. массы в данном образце полимера. Существование ММР характерно гл. обр. для синтетич. полимеров и обусловлено статистич. характером р ций их образования, деструкции и… … Химическая энциклопедия
ХИМИЯ. ЭЛЕМЕНТЫ И СОЕДИНЕНИЯ — Элементы. Исследование сложного вещества начинается с попыток разложить его на более простые. Простейшая форма материи, в которой сохраняется определенная совокупность физических и химических свойств, называется химическим элементом. Химические… … Энциклопедия Кольера
КАТАЛИТИЧЕСКИЙ КРЕКИНГ — термокаталитич. переработка нефтяного сырья с целью получения продуктов меньшей мол. массы компонентов высокооктановых бензинов, легкого газойля, углеводородных газов С 3 С 4 и др. К. к. один из важнейших процессов, обеспечивающих глубокую… … Химическая энциклопедия
RS-68 — (РС 68) Двигатель RS 68 в ходе испытаний на стенде НАСА в период его разработки. Тип: ЖРД … Википедия
RS-68 (ракетный двигатель) — RS 68 (РС 68) Двигатель RS 68 в ходе испытаний на стенде НАСА в период его разработки. Тип: ЖРД Топливо: водород … Википедия
ЖВ — Бак для жидкого водорода в автомобильном музее (Альтлусхайм, Германия) немецкой химической компании «Linde AG» «Жидкий водород» («ЖВ») жидкое агрегатное состояние водорода, с низкой удельной плотностью 0.07 г/см³ и криогенными свойствами с… … Википедия
Источник
Массовая доля
О чем эта статья:
Что такое массовая доля
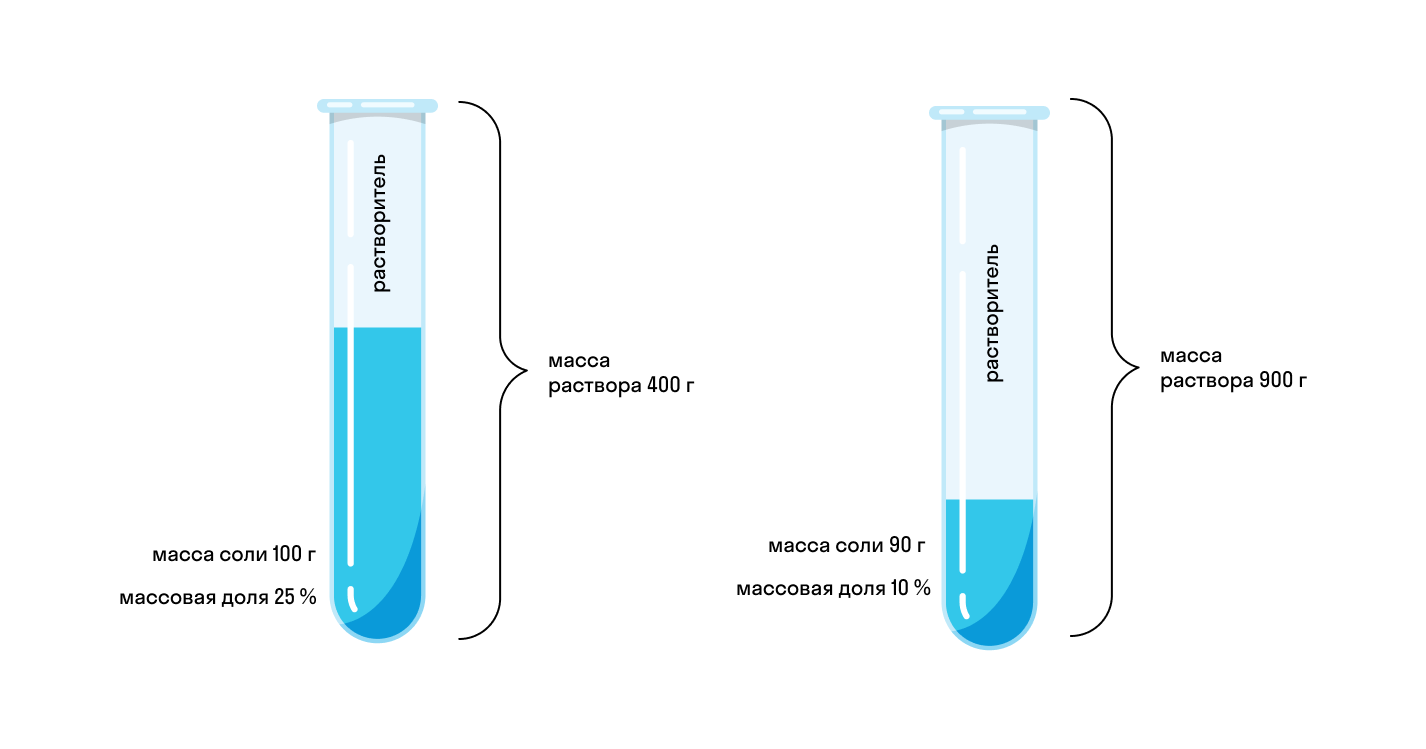
Начнем с примера: допустим, мы приготовили два раствора соли. Первый имеет массу 400 г и для него использовано 100 г соли. Масса второго 900 г и для него использовали 90 г соли. Какой раствор будет более концентрированным? Чтобы это понять, нужно выяснить процент соли в каждом растворе. Можно сказать иначе — нужно определить, какую долю в растворе занимает соль.
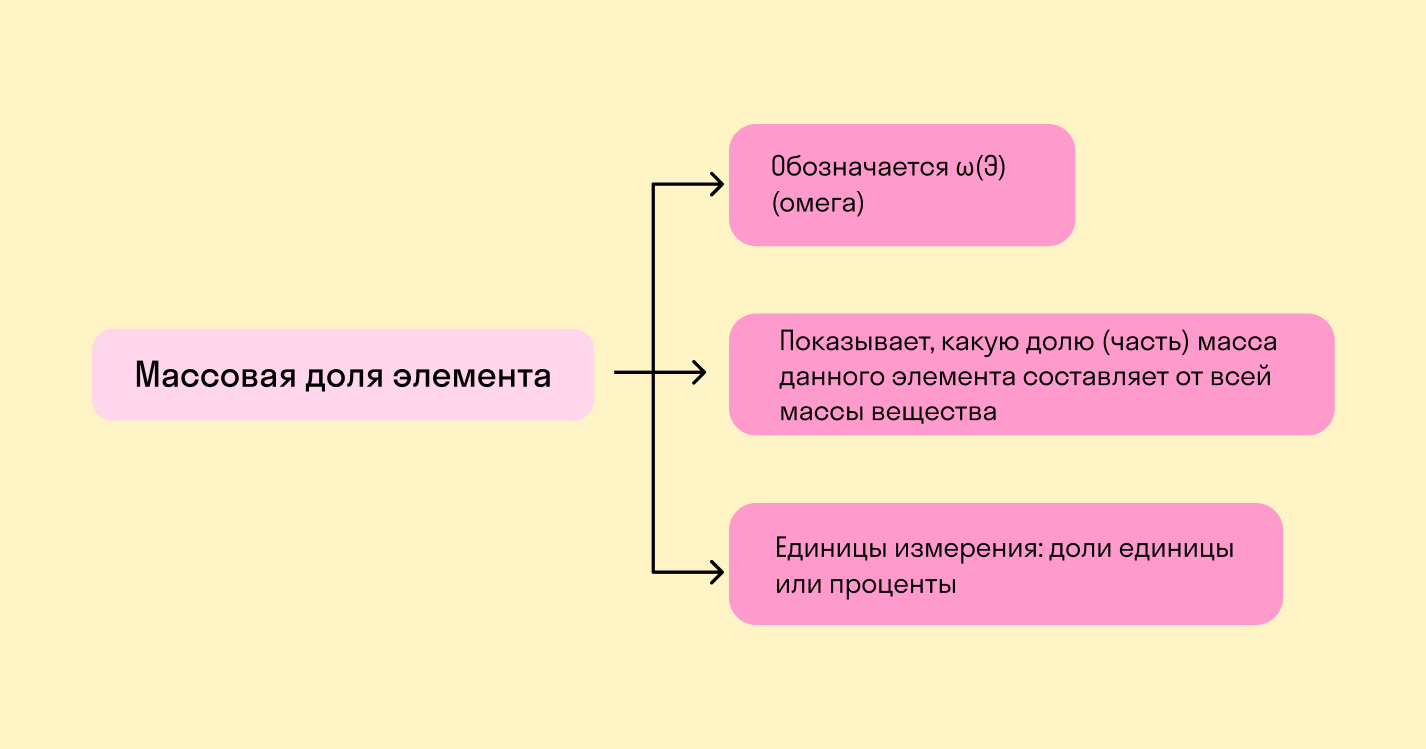
Массовая доля — это отношение растворенного вещества к массе раствора. Она может измеряться в процентах (от 0 до 100%) или в долях от единицы (от 0 до 1).
Как найти массовую долю растворенного вещества, расскажет формула:
где — обозначение массовой доли;
В нашем примере и без формул понятно, что в первом растворе соль занимает 25%, а в то втором — только 10%. А что будет, если в первый раствор добавить еще столько же соли и воды? Очевидно, что на концентрацию это не повлияет. Доля соли останется прежней, пусть даже масса раствора увеличилась.
Массовая доля химического элемента — это отношение между относительной массой его атомов и относительной молекулярной массой соединения, частью которого является данный элемент.
Как видите, фактическая масса сложного вещества или его отдельного компонента не имеет значения. Если мы не знаем этих показателей, для расчетов берутся относительные величины.
Такое определение массовой доли элемента выражается формулой:
В данном случае:
— количество атомов искомого элемента;
— относительная атомная масса элемента;
— относительная молекулярная масса сложного вещества.
Если нужен показатель в процентах, результат надо умножить на 100%.
Относительная атомная и молекулярная масса
В формуле нахождения массовой доли мы видим две важные составляющие: относительную массу атома элемента (Ar) и относительную массу молекулы вещества (Mr). Разберемся, что это такое. И та, и другая величина — это отношение реальной массы к эталонной единице, за которую взята 1/12 массы атома углерода.
Относительная атомная масса элемента (Ar) говорит о том, насколько масса его атома больше 1/12 массы атома углерода. Для каждого элемента эта величина является постоянной и ее можно увидеть в таблице Менделеева.
Относительная молекулярная масса соединения (Mr) складывается из относительных атомных масс всех элементов в составе его молекулы. Она показывает, насколько молекула вещества больше 1/12 массы атома углерода.
Это не измеряемые величины, то есть они не имеют единиц измерения. Буква r в обозначениях относительной атомной и молекулярной массы восходит к английскому слову relative — «относительный».
Как найти массовую долю элемента в веществе
Выше мы рассмотрели формулу для вычисления массовой доли химического элемента в веществе и узнали, откуда берутся ее составляющие. Применим эти знания на практике.
Пример 1
Оксид магния массой 8 г образовался при вступлении 4,8 г магния в реакцию с кислородом. Каковы массовые доли магния и кислорода в полученном оксиде?
Решение:
Для начала вычислим массу кислорода. Согласно закону сохранения массы веществ в соединении можно воспользоваться формулой m(O) = m(MgO) − m(Mg).
m(O) = 8 − 4,8 = 3,2 г
Вспоминаем, как найти массовую долю элемента в веществе: нужно понять, какую часть соединения оно составляет.
Зная массы каждого компонента оксида, сделать расчет несложно:
Ответ: массовые доли магния и кислорода в оксиде магния составляют 60% и 40% соответственно.
Пример 2
Потренируемся находить массовую долю элемента в сложном веществе. Определим, какую часть этилового спирта С2H6O составляет водород.
Решение:
В данном случае у нас нет конкретных указаний на массы элементов или всего вещества. Но мы можем воспользоваться другой формулой массовой доли в химии, которая позволяет работать с относительными величинами:
Согласно таблице Менделеева относительная атомная масса водорода равна единице.
Вычислим относительную молекулярную массу соединения С2H6O, которая складывается из соответствующих масс каждого элемента:
Mr(С2H6O) = 2M(C) + 6M(H) + M(O) = 212 + 6 1 + 16 = 46.
Полученные данные подставим в формулу и определим массовую долю элемента в соединении:
Ответ: в этиловом спирте массовая доля водорода составляет 13%.
Как вычислить массовую долю вещества в растворе
Вспомним, что такое концентрация раствора. Она говорит о том, в каком соотношении находятся растворенное вещество и растворитель, а другими словами — сколько растворенного вещества содержится в единице объема или массы. Концентрация может быть безразмерной величиной и выражаться в процентах, но также ее можно выразить в массовых или в молярных долях.
В случае с растворами применима та же формула:
Если нужно значение в процентах, результат надо умножить на 100%.
Пример
Требуется приготовить 0,5 л раствора карбоната натрия плотностью 1,13 г/мл. Определите массу карбоната натрия при условии, что концентрация раствора должна быть 13%.
Решение:
Вначале нам нужно узнать массу раствора, что легко сделать, когда известны его объем и плотность. Воспользуется формулой m(р–ра) = ρ × V
m(р–ра) = 500 × 1,13 = 565 г.
Дальше вспомним, как находить массовую долю растворенного вещества:
Поскольку концентрация раствора — это и есть массовая доля растворенного вещества, подставим ее в уравнение:
m(Э) = 0,13 × 565 = 73,45 г.
Ответ: для раствора понадобится 73,45 г карбоната натрия.
Вопросы для самопроверки:
Как обозначается массовая доля и в чем она выражается?
В чем разница между молекулярной массой вещества и его молярной массой?
Как найти массовую долю элемента в веществе, если мы знаем массу элемента и массу вещества?
Как рассчитать массовую долю вещества в растворе?
В каких безразмерных и размерных величинах можно выразить концентрацию раствора?
Источник
Как найти соотношение масс
Меню сайта
Категории каталога
| 9 класс [16] |
| 11 класс [5] |
| Лаборатория [7] |
| Переменка [6] |
| Решение задач [9] |
| Учебные пособия [5] |
Форма входа
Приветствую Вас Гость!
Поиск
Друзья сайта
Наш опрос
Статистика
Как вам известно, чтобы написать формулу вещества используют знаки химических элементов и цифры – индексы, которые показывают количество каждого из элементов в 1 моле вещества. Значит, чтобы вывести формулу вещества, необходимо установить, какие элементы входят в его состав и в каком количестве. Поэтому, при установлении формулы находят количество каждого из элементов с помощью данных задачи и определяют их соотношение.
Решим задачу: 10 г кальция сожгли в кислороде. После реакции получился оксид кальция массой 14 г. Рассчитайте формулу оксида.
Исходя из условия, определяем массу кислорода в оксиде:
m (О) = m ( CaO ) — m ( Ca ) = 14г — 10г = 4г
Определяем количества кальция и кислорода, используя формулу для нахождения количества вещества через массу.
n ( Ca ) = 10г/ 40 г/моль = 0,25моль
n ( O ) = 4г / 16 г/моль = 0,25 моль
Следовательно, отношение количества кальция и кислорода в оксиде кальция составляет n ( Ca ): n ( O ) = 0,25 : 0,25, или, в целых числах, 1:1. Значит, химическая формула оксида кальция — СаО.
Ответ: формула оксида кальция СаО.
1. Определите химическую формулу оксида серы, если известно, что в этом оксиде на 8г серы приходится 8г кислорода.
2. Известно, что азот образует несколько оксидов. В лаборатории было получено два оксида азота. Опытным путем установили, что в первом оксиде на 7г азота приходится 4г кислорода, во втором – на ту же массу азота – 16 г. Установите формулы оксидов.
3. Химик провел анализ некоего вещества и установил, что в исследуемом образце содержится 5,4 г алюминия и 21,3 г хлора. Какова химическая формула этого вещества? Дайте ему название.
4. В быту часто употребляют растворитель ацетон, жидкость с характерным запахом. В ацетоне на 9 г углерода приходится 1,5 г водорода и 4 г кислорода. Какова химическая формула ацетона?
Нахождение формулы вещества, если известны массовые доли элементов.
Для расчета количества вещества необходимо знать массу. Чтобы перейти от массовых долей к граммам, примем массу образца за 100 г, тогда числовые значения доли в % совпадут с числовым значением массы элемента в образце. Затем решаем задачу по массовому соотношению элементов.
Решим задачу: Карбонат натрия (сода) содержит 11,3% углерода, 43,4 % натрия и 45,3% кислорода. Определите формулу карбоната натрия.
Wm (С)=11,3% Wm ( Na )=43 ,4%
Примем массу образца карбоната натрия за 100г. Исходя из условия, определяем массы элементов в образце:
Определяем количества вещества каждого химического элемента по формуле n = m / M
n ( Na ) = 43,4 г / 23 г/моль = 1,89 моль
n ( C ) = 11,3 г / 12 г/моль = 0,94 моль
n (О) = 45,3 г/ 16 г/моль = 2,83 моль
Следовательно, отношение количества натрия, углерода и кислорода в карбонате натрия составляет n ( Na ): n ( C ): n ( O ) = 1,89 : 0,94: 2,83, Чтобы выразить соотношение в целых числах, разделим каждое число на наименьшее ( на 0,94).
Значит, химическая формула карбоната натрия — Na 2 CO 3.
В состав перманганата калия (в быту называемого марганцовкой) входит 24,7% калия, 34,8% марганца, 40,5% кислорода. Определите формулу перманганата калия.
Главная > Решение
| Информация о документе |
| Дата добавления: |
| Размер: |
| Доступные форматы для скачивания: |
Типы расчетных задач
I. Вывод химических формул.
I. Нахождение химической формулы вещества по массовым долям элементов
Задача. Элементный состав вещества следующий: массовая доля элемента железа 0.7241 (или 72,41%), массовая доля кислорода 0,2759 (или 27,59%). Выведите химическую формулу.
Решение. 1) Находим отношение числа атомов:
Fe: О =72,41/56 ==27,59/16 1,29:1,72
2) Меньшее число принимаем за единицу и находим следующее отношение:
3) Так как должно быть целое число атомов, то это отношение приводим к целым числам:
Ответ. Химическая формула данного вещества Fе з О 4 .
2. Нахождение химической формулы по отношение масс элементов,
входящих в состав данного вещества.
Задача. Найдите химическую формулу вещества, в состав которого входит 9 мае. ч. алюминия и 8 мае. ч. кислорода.
Решение. Находим отношение числа атомов:
Аl: О = 9/27:8/16 = 0,33:0.5 = 0,99:1,5 2:3
Ответ. Химическая формула данного вещества Аl 2 Оз.
3. Нахождение химической формулы вещества по массовым долям элементов, если указана плотность или относительная плотность данного вещества в газообразном состоянии.
Задача 1. Экспериментально установлено, это элементный состав газообразного вещества следующий: массовая доля углерода 0,8571 (или 85,71%), массовая доля водорода 0,1429 (или 14,29%). Масса 1 л этого газа при нормальных условиях составляет 1,25 г. Найдите химическую формулу данного вещества.
Решение. 1) Находим отношение числа атомов элементов:
С : Н = 85,71/12:14,29/1 = 7,14:14,29 1:2
Следовательно, простейшая формула этого газа СН 2 .
2) Находим молярную массу по простейшей формуле
М (СН 2 ) = 12 + 2 = 14 г/ моль.
Однако отношению чисел атомов 1:2 соответствуют много формул, например С 2 Н 4 , Сз Н 6 и т. д.
3) Чтобы выяснить, какая из этих формул соответствует данному газу находим молярную массу по плотности:
M = V·р =22,4-1,25= 28;
Так как близкая по численному значению молярная масса, равная 28 г, соответствует лишь формуле С 2 Н 4 . то она является истинной формулой этого вещества.
Ответ. Химическая формула исследуемого вещества С 2 Н 4 ( этилен).
Задача 2. При сгорании 2,3 г вещества образуется 4,4 г оксида углерода (IV) и 2,7 г воды. Плотность паров этого вещества по воздуху равна 1,59. Определите молекулярную формулу данного вещества.
Решение. Так как при сгорании данного вещества образуются оксид углерода (IV) и вода. то из этого следует, что в состав данного вещества входят углерод и водород.
1) Находим массу углерода:
: М (С0 2 )=44 г/моль; :
44 г СО 2 содержат 12 г С
44:4,4=12:х 1 ; х 1 = 
2)Находим массу водорода:
М(Н 2 О)= 18 г/моль;
18 г Н 2 О содержат 2г H
2,7 г Н 2 О » х 2
18:2,7 ==2:Х 2 ; X 2 =
3) Если в исследуемом веществе содержится кислород, то его находят по разности массы вещества и суммы масс углерода и водорода:
m (С) + m (Н) =1,2 г + 0,3 г = 1,5 г;
m(0)= 2,3 г — 1,5 г = 0,8 г
4) Находим отношение числа атомов элементов:
С:Н:0 = 1,2/12:0,3/1:0,8/16 = 0,1:0,3:0,05 = 2:6:1
Следовательно, простейшая формула этого вещества С 2 Н 6 О.
5) Находим молярную массу исследуемого вещества по простейшей формуле и по относительной плотности его паров по воздуху:
М(С 2 Н 6 О)=46 г/моль;
М=29·D возд. = 29-1,59= 46,11; М=46,11 г/моль
В данном случае простейшая формула С 2 Н 6 О является истинной.
Ответ. Химическая формула вещества С 2 Н 6 О.
II. Расчеты по химическим формулам.
1. Нахождение отношения масс элементов по химической формуле сложного вещества .
Задача. Найдите отношение масс элементов в гидроксиде кальция.
Решение. 1) Находим молярную массу гидроксида кальция:
М(Са(ОН) 2 )= 40+(16 +1)·2=74; М =74 г/моль
2) Находим отношение масс кальция, кислорода и водорода:
Ответ: отношение масс кальция, кислорода и водорода в гидроксиде кальция равно 20:16:1.
2. Нахождение содержания массовых долей элементов в сложном веществе.
Задача. Вычислите массовые доли элементов в гидроксиде натрия. Решение. 1) Находим молярную массу гидроксида натрия:
M(NaOH)=23+16+l=40; М(NaOH)=40 г/моль
2) Вычисляем массовую долю натрия:
w (Na) = 23/40 =0,575 маc. д., или 57.5%
3) Вычисляем массовую долю кислорода:
w (О) =16/40=0.4 маc. д., или 40%
4) Вычисляем массовую долю водорода:
w (Н)= 1/40=0,025 маc. д, или 2,5%
5) Проверяем правильность вычисления:
0,575+0,4+0,025=1,00 (в мас. д.);
Ответ. Элементный состав NaOH следующий: массовая доля натрия 0,575 (или 57,5%), массовая доля кислорода 0,4 (или 40%) и массовая доля водорода 0,025 (или 2,5%).
Примечание. Содержание водорода можно также вычислить по разности:
w (Na) + w (О) = 0,575 + 0,4 = 0.975;
w (H) = 1,0 — 0,975 = 0,025;
w% (Na) + w% (О) = 57,5 + 40 = 97,5;
w% (H) = 100 — 97,5 = 2,5
3. Нахождение массы элемента по известной массе сложного вещества Задача. Вычислите, сколько алюминия содержат 408 т оксида алюминия.
Решение. 1) Находим молярную массу оксида алюминия:
А1(А1 2 0з)=27,2+16-3=102; М (А1 2 0з)=102 г/моль;
2) вычисляем массу алюминия, содержащуюся и 408 т оксида алюминия:
102 т Аl 2 Оз содержат 54 т А1
408 т Аl 2 Oз >> x
102:408=54:x. x=
(Здесь и далее вычисление ведется и тex единицах массы, которые указаны в условиях задач.)
Вычисление можно производить и так :
m(Al)=m(Al 2 O 3 )

Ответ: 408 т Al 2 O 3 содержат 216 т Al/
Примечание. Если в условии задачи дано вещество с примесью, тогда предварительно вычисляют массу чистого ветества, содержащуюся в смеси. Затем поступают, как указано выше.
4. Нахождение массы сложного вещества но заданной массе элемента.
Задача. В какой массе оксида меди (II) содержится 3,2 т меди?
Р е ш e н и е, I) Находим молярную массу оксида меди (II):
М (CиО)= 64+ 16 =8О, М(CиO)=80 гмоль
2) Вычисляем массу оксида меди (II):
64 т Си содержится в 8О т СиO
64:3,2 =80: х; х=
Ответ. 3,2 т Си содержится в 4 т CuO.
III. Расчеты с использованием понятия «моль».
I. Вычисление количества вещества, соответствующего определенной массе вещества.
Задача I. Дано 32 г меди. Bычислитe количество меди.
Р е ш е н и е. Пользуясь формулой v= 
m — масса вещества, М — молярная масса данного вещества, находим кoличество вещества меди:
v =m/M=3264=0,5 v (Cи) = 0,5 моль
Можно рассуждать и так:
64 г меди составляют 1 моль
64:32=1 : х =
0твет: 32г меди составляют 0,5 моль.
Задача 2. Какое количество вещества cocтавляют 66 г оксида углерода (IV)?
Р е ш е н и е. I) Находим молярную массу оксида углерода (IV)
М (С0 2 ) = 44 г/моль
2) Вычисляем количество вещества оксида углерода (IV);
v = m/М = 64/44 = 1,5; v (CO 2 ) = l,5 моль
О т в ет : 66 г оксида углерода (IV) составляют 1.5 моль.
2. Вычисление массы вещества но известному числу молей вещества .
Задача 1. Дано 0,25 моль серы. Вычислите массу серы.
v= mM; m= v ·М =0,25· 32=8 ; m(S)= 8 г
0 т ве т. 0,25 моль серы соответствуют 8 г серы.
Задача 2. Дано 2 моль серной кислоты. Вычислите массу серной кислоты
Р е ш е н и е I) Вычисляем молярную массу серной кислоты:
М(Н 2 SO 4 ) = 98 г/моль
2) Определяем массу серной кислоты:
v = mM; m = v·M=2·98=196; m(H 2 SO 4 )=196 г
О т в е т. 2 моль серной кислоты соответствуют 196 г серной кислоты.
3. Вычисление числа атомов и молекул, содержащихся в определенной
Задача I. Сколько атомов содержится в 20 г кальция?
Р е ш е н и е. 1 ) Вычисляем количество вещества, cоответствующее 20 г кальция:
v = m/M= 20/40=0,5. v(Ca)=0.5 моль
2) Вычисляем число атомов кальция:
1 моль содержит 6,02·10 23 атомов
0,5 моль » х атомов
1 :0,5=6,02· 10 23 : х ; х = 0,5· 6,02 • 10 23 =3,01 • 10 23 : х= 3,01· 10 23 атомов
Ответ. В 20 г кальция содержится 3,01-10 23 атомов.
Задача 2. Сколько молекул содержится в 36 г boды ?
Р е ш е н и е. Определяем молярную массу воды
M(H 2 O)= 18 г моль
2) Находим количество вещества воды:
v=m/M =36/18=2; v(Н 2 О)=2 моль
3) Определяем число молекул воды:
1 моль Н 2 О содержит 6,02 ∙ 10 23 молекул
2 моль Н 2 О » x
1:2=6,02 ·10 23 : х ; х=2 · 6,02 ·10 23 = 1,204·10 24 ;
х= 1,204·10 24 молекул Н 2 O.
Ответ. В воде массой 36 г содержится 1,204 ·10 24 молекул.
IV. Расчеты, связанные с использованием плотностей, относительных плотностей и молярного объема газов.
1. Нахождение плотности и относительной плотности газа по химической формуле данного газа.
Задача. Вычислите плотность и относительные плотности оксида углерода (IV) по водороду, метану и воздуху (плотность обозначается буквой р, а относительная плотность—буквой D) (I, с. 139).
Решение. 1) Вычисляем молярные массы газов:
M(C0 2 )= 44 г/моль; M(H 2 ) =2 г/моль;
М(СН 4 )= 16 г/моль; M возд =29 г/моль
2) Вычисляем плотности оксида углерода (IV):
р = 44/22,4 =1,96; р(С0 2 )=1,96 г/л;
D(CH 4 ) =44/16=2,75; D ( Н 2 ) = 44/2 =22;
D возд = 44/29=1,52
Ответ. р(С0 2 )=1,96 г/л (масса 1 л при н. у.); D (Н 2 ) = 22;
D(CH 4 )=2,75; D возд = 1,5.
Такого вида расчеты широко применяются на практике, так как часто требуется определить, тяжелее или легче данный газ по отношению к воздуху.
2. Вычисление объема определенной массы газообразного вещества
Задача. Какой объем занимают 48 г кислорода?
Решение. 1) Вычисляем молярную массу кислорода:
2) Находим, какой объем занимают 48 г кислорода:
32 г О 2 занимают объем 22,4 л
32:48=22,4:х; х =
Ответ. Кислород массой 48 г занимает объем 33,6 л.
1) Вычисляем молярную массу кислорода:
2) Находим количество вещества, которому соответствует 48 г кислорода:
v=

3) Рассчитываем объем, который занимают 1,5 моль кислорода (н. у.):
v (0 2 )= 1,5 ·22,4 =33,6 л
Ответ. Кислород массой 48 г занимает объем 33,6 л.
3. Вычисление массы газообразного вещества, занимающего определенный объем
(При расчетах необходимо следить за тем, чтобы единицы измерения разных величин были пропорциональными. Так, если масса газообразного вещества выражена в килограммах, то объем следует выражать в кубических метрах.)
Задача . Вычислите массу газовой смеси, состоящей из 5,6 м 3 метана и 2,24 м 3 оксида углерода (II)
Решение. 1) Вычисляем молярные массы метана и оксида углерода (II):
M(CH 4 )=16 г/моль; M(СО)=28 г/моль
2) Определяем массу 5,6 м 3 метана:
масса 22,4 м 3 СН 4 составляет 16 кг
» 5,6 м 3 СН 4 » х 1
22,4 :5,6= 16 :х 1 ; х 1 = 
3) Определяем массу 2,24 м оксида углерода (II):
масса 22,4 м 3 СО составляет 28 кг
» 2.24 м 3 СО » Х 2
22,4: 22,4=28 :х 2 ; х 2 = 
4) Находим общую массу газовой смеси:
4 кг + 2,8 кг =6.8 кг
Отпет. Общая масса газовой смеси 6,8 кг.
4. Вычисление массы вещества по уравнениям химических реакций, в которых участвуют или образуются газы.
Задача. Какой объем кислорода и воздуха потребуется, чтобы сжечь 224 м 3 оксида углерода (II), если содержание в нем негорючих примесей в объемных долях равно 0,25 (или 25%)?
Решение. 1) Вычисляем, сколько чистого оксида углерода (II) содержится в смеси:
100 м 3 смеси содержат 75 м 3 СО
224 м 3 смеси » х 1
100:224=75:х 1 ; х 1 = 
Вычисление можно провести и так: v (СО)=224м 3 ·0,75=168 м 3 СО.
2) Определяем, какой объем кислорода потребуется, чтобы сжечь 168 м 3 оксида углерода (II):
2СО + О 2 ——— > 2СО 2
2·22,4 м 3 22,4 м 3
44,8:168 = 22,4 😡 2 ; x 2 = 
Если молярные объемы обозначить буквой V, а данные и вычисляемые объемы газов обозначить V 0 , то вычисление можно производить и так:

V 0 (O 2 )=V(O 2 ) 
3) Находим объем воздуха, необходимый для реакции:
100 м 3 воздуха содержат 21 м 3 кислорода
100:х 3 =21:84; х 3 =
Ответ. Потребуется 84 м 3 О 2 или 400 м 3 воздуха.
V . Расчеты, связанные с определением массовой доли растворенного вещества в растворе.
1. Вычисление массы растворенного вещества и растворителя, если известны массовая доля растворенного вещества и масса раствора.
Задача 1. Вычислите массу хлорида натрия и воды, необходимых для приготовления 500 г раствора, в котором массовая доля хлорида натрия равна 0,05 (или 5%).
Решение. 1) Находим, какая масса хлорида натрия необходима для приготовления указанного раствора. При решении можно использовать два подхода.
1 массовая доля соответствует 500 г
1 : 0,05 =500 : х; х=
Рассуждать можно и так:
а) 100 г раствора содержат 5 г NaCI 500 г
100:500=5:х; х=
б) m (NaCI) = 500 г · 0,05 = 25 г
2) Вычисляем, какая масса воды потребуется:
m (Н 2 О) = 500 г — 25 г = 475 г
Ответ. Потребуется 25 г NaCI и 475 г воды.
Задача 2. Какой объем хлороводорода (н. у.) и воды потребуется, чтобы приготовить 1 л раствора (р =1,05 г/см 3 ), в котором массовая доля хлороводорода равна 0,1 (или 10%)?
Решение. 1) Вычисляем массу 1 л раствора, в котором массовая доля хлороводорода равна 0,1 (или 10%).
Вычисление можно провести по известной вам формуле из курса физики:
р = m / V ; m = р · V ,
m раствора = 1000 ·1,05=1050; m раствора = 1050 г
2) Находим массу хлороводорода, содержащегося в 1050 г раствора соляной кислоты указанной концентрации:
1 мае. д. соответствует 1050 г
1:0,1=1050:х 1 ; х 1 =
или m (НС1) = 1050 · 0,1 = 105 г; m = 105 г
3) Вычисляем, какой объем (н. у.) занимают 105 г хлороводорода:
М (НС1) = 36,5 г/моль
36,5 г НC1 занимают объем 22,4 л
105 г НСl » » x 2
36,5 : 105 = 22,4 : x 2 ; x 2 =
4) Находим, сколько потребуется воды для приготовления раствора:
m (Н 2 0)=1050 г — 105 г = 945 г
Ответ. Потребуется 64,44 л НС1 и 945 мл воды.
2. Вычисления, связанные с разбавлением растворов
Задача 1. Какой объем раствора (р =1,80 г/см 3 ), в котором массовая доля H 2 S0 4 равна 0,88, потребуется, чтобы приготовить 1 л раствора, в котором массовая доля H 2 S0 4 будет равна 0,1 (р =1,069 г/см 3 )?
Решение. 1) Вычисляем массу 1 л раствора, в котором массовая доля H 2 S0 4 равна 0,1 (или 10%):
m раствора = 1000 · 1,069 = 1069; m раствора = 1069 г
2) Определяем массу чистой серной кислоты, которая потребуется:
100 г приготовляемого раствора содержат 10 г H 2 S0 4
100 : 1069 = 10 : х 1 ; х 1 = 
или m (H 2 S0 4 ) = 1069 · 0,1 = 106,9, m (H 2 S0 4 ) = 106,9 г
3) Находим, сколько потребуется раствора, д котором массовая доля серной кислоты равна 0,88 (или 88%):
100 г раствора содержат 88 г H 2 S0 4
х 2 » » 106,9 г H 2 S0 4
100 : х 2 = 88 : 106,9; х 2 =
4) Вычисляем, какой объем занимают 121,5 г раствора, в котором массовая доля H 2 S0 4 равна 0,88 (или 88%):
V раствора =121,5/1,80 = 67,5; V раствора =67,5 мл
Ответ. Потребуется 67,5 мл раствора, в котором массовая доля серной кислоты составляет 0,88.
Задача 2. Какой объем воды потребуется для разбавления 200 мл раствора (р =1,4 г/см 3 ), в котором массовая доля НNОз составляет 0,68 (или 68%), чтобы получить раствор, в котором массовая доля НNОз равна 0,1 (или 10%)?
Решение. 1) Находим массу 200 мл разбавляемого раствора азотной кислоты:
m раствора 200 · 1,4 = 280; m раствора =280 г
2) Вычисляем массу чистой азотной кислоты, содержащейся в 280 г разбавляемого раствора:
100 г раствора содержат 68 г НNОз
100 : 280 = 68 : x 1 ,; x 1 = 
или m (НМОз) =280 · 0,68 = 190,4 г
3) Вычисляем, какую массу 10%-ного раствора можно приготовить из 190,4 г чистой азотной кислоты:
100 г раствора содержат 10 г НМОз
x 2 » » 190,4 г НМОз
100:x 2 =10:190,4; x 2 =
или m(НМОз)= 190,4:0,1 =1904 г
4) Находим объем воды, который необходимо прилить для приготовления раствора заданной концентрации:
Патриархом в период правления Василия Шуйского был избран а)митрополит Филаретб)митрополит Макарийв)митрополит Филиппг)митрополит Гермоген
Назовите причины возникновения мегаполисов в США.
Некоторое число разделили в отношении 8:9, при этом разность большей и меньшей частей получилась равной 6. какое число разделили?А)72 Б)54 В)102 Г)98
Источник