ЭКЗАМЕНЫ НЕ ЗА ГОРАМИ
Подготовка к ЕГЭ по химии
Выполнение заданий высокого уровня сложности
Задачи с расчетами по уравнениям
реакций,
происходящих в растворах
При обучении школьников способам решения задач
очень большое значение придаю применению
алгоритмов. Я считаю, что вначале нужно уверенно
овладеть небольшим числом стандартных приемов,
получить представление о возможных типах задач.
Это позволит ученику выйти на творческий уровень
в своем дальнейшем химическом образовании и
самообразовании.
Одно из заданий высокого уровня сложности (оно
входит в третью часть экзаменационной
работы – задание С4) проверяет умение
производить расчеты по уравнениям реакций,
происходящих в растворах.
В учебной литературе недостаточно подробно
объясняются особенности решения таких задач.
Поэтому мы с учениками вначале разбираем все
моменты, на которые нужно обратить внимание,
записываем алгоритмы в общем виде, рассматриваем
решение задач каждого типа, затем отрабатываем
умения на самостоятельном решении целого ряда
подобных задач.
Прежде всего ученик должен усвоить понятие о
массовой доле растворенного вещества, или, иначе,
процентной концентрации раствора. Эта величина
показывает отношение массы растворенного
вещества к массе раствора:
р.в-во
= mр.в-во / mр-р.
Производные формулы:
mр.в-во = mр-р•р.в-во,
mр-р = mр.в-во / р.в-во.
Если в условии задачи указан объем раствора с
определенной плотностью, то прежде всего находят
массу раствора:
mр-р = Vр-р•р-р,
затем – массу растворенного вещества:
mр.в-во = mр-р•р.в-во.
Количество вещества находят по массе
растворенного вещества:
= mр.в-во
/ М.
Рассмотрим некоторые типы задач с расчетами по
уравнениям реакций, происходящих в растворах.
• Нахождение массовых долей веществ в
растворе после реакции.
При решении таких задач прежде всего нужно
найти количества вещества реагентов. Если задача
на избыток и недостаток, то количества вещества
продуктов реакции находят по веществу, которое
дано в недостатке.
Один из важных моментов – это нахождение
массы раствора после реакции (массы
полученного раствора, mр-р получ). Если
какое-либо вещество взаимодействует с веществом,
находящимся в растворе, то складывают массу
вещества и массу раствора; в случае, когда оба
реагирующих вещества даны в виде растворов,
складывают массы двух растворов. Если в
результате реакции образуется осадок или газ, то
из полученной суммы вычитают массу вещества,
ушедшего из раствора в виде осадка или газа:
mр-р получ = mв-во + mр-р –
mосадок (газ),
mр-р получ = mр-р1 + m
р-р2 – mосадок (газ).
При решении задач на избыток и недостаток нужно
помнить о том, что в растворе после реакции будет
находиться в растворенном виде не только продукт
реакции, но и вещество, которое было дано в
избытке.
Чтобы найти количество вещества, которое не
прореагировало – избытка, нужно от исходного
количества вещества отнять количество
прореагировавшего вещества:
изб
= исх –
прор.
Затем найти его массу и массовую долю в
растворе, полученном после реакции.
Задача 1. 4,8 г магния растворили в 200 мл
12%-го раствора серной кислоты ( = 1,05 г/мл). Найти массовую долю
соли в полученном растворе.
| Дано:
m(Mg) = 4,8 г, Vр-р(H2SO4) = 200 мл,
|
Найти: |
Р е ш е н и е
(Мg) = m / M
= 4,8 (г) / 24 (г/моль) = 0,2 моль.
mр-р(H2SO4) = Vр-р• = 200 (мл)•1,05 (г/мл) = 210
г.
mр.в-во(H2SO4) = mр-р•р.в-во = 210•0,12 =
25,2 г.
р.в-во(H2SO4)
= m/M = 25,2 (г) / 98 (г/моль) = 0,26 моль.
В недостатке – Mg. Следовательно:
(MgSO4) = 0,2
моль,
(H2) = 0,2
моль.
mр.в-во(MgSO4) = M• = 120 (г/моль)•0,2 (моль) = 24 г.
m(H2) = M• = 2 (г/моль)•0,2 (моль) = 0,4 г.
mр-р получ = mр-р(H2SO4)
+ m(Mg) – m(H2) = 210 (г) + 4,8 (г) – 0,4 (г) =
214,4 г.
р.в-во(MgSO4)
= mр.в-во(MgSO4) / mр-р получ =
24 (г) / 214,4 (г) = 0,112, или 11,2 %.
О т в е т. р.в-во(MgSO4) = 11,2 %.
Задача 2. Смешали 250 г раствора сульфата
железа(III) с концентрацией 8 % и 50 г раствора
гидроксида натрия с концентрацией 30 %. Найти
концентрацию веществ в получившемся растворе.
| Дано:
mр-р(Fe2(SO4)3)
mр-р(NaOH) = 50 г,
|
Найти: |
Р е ш е н и е
mр.в-во(Fe2(SO4)3) = mр-р•р.в-во = 250
(г)•0,08 = 20 г.
(Fe2(SO4)3)
= m/M = 20 (г) / 400 (г/моль) = 0,05 моль.
mр.в-во(NaOH) = mр-р•р.в-во = 50 (г)•0,3 = 15 г.
(NaOH) = m/M =
15 (г) / 40 (г/моль) = 0,375 моль.
В недостатке – Fe2(SO4)3.
Следовательно:
(Na2SO4)
= 0,05 (моль)•3 = 0,15 моль.
(Fe(OH)3) = 0,05
(моль)•2 = 0,1 моль.
прор(NaOH) =
0,05 (моль)•6 = 0,3 моль.
изб(NaOH) =
исх –
прор = 0,375
(моль) – 0,3 (моль) = 0,075 моль.
m(NaOH) = M• =
40 (г/моль)•0,075 (моль) = 3 г.
m(Na2SO4) = M• = 142 (г/моль)•0,15 (моль) = 21,3 г.
m(Fe(OH)3) = M• = 107 (г/моль)•0,1 (моль) = 10,7 г.
m р-р получ = mр-р(Fe2(SO4)3
+ mр-р(NaOH) – m(Fe(OH)3) = 250 (г) + 50
(г) –10,7 (г) = 289,3 г.
р.в-ва(Na2SO4)
= m / mр-р = 21,3 (г) / 289,3 (г) = 0,074, или 7,4 %.
р.в-ва(NaOH)
= m / mр-р = 3 (г) / 289,3 (г) = 0,01, или 1 %.
О т в е т. р.в-во(Na2SO4) = 7,4 %,
р.в-во(NaOH) = 1 %.
Задача 3. Карбонат кальция массой 10 г
растворили при нагревании в 150 мл
хлороводородной кислоты ( = 1,04 г/мл) с массовой долей 9 %.
Какова массовая доля хлороводорода в
получившемся растворе?
О т в е т. р.в-во(HCl) = 4,2 %.
Задача 4. 5,6 г железа растворили в 100 мл 10%-го
раствора соляной кислоты ( = 1,05 г/мл). Вычислить массовую долю
хлороводорода в полученном растворе.
О т в е т. р.в-во(HCl) = 2,9 %.
Задача 5. 5,6 г железа растворили в 200 мл
раствора соляной кислоты ( = 1,05 г/мл) с массовой долей 10 %. Найти
массовую долю соли в полученном растворе.
О т в е т. р.в-во(FeCl2) = 5,9 %.
Задача 6. Смешали 110,4 г раствора карбоната
калия с концентрацией 25 % и 111 г раствора
хлорида кальция с концентрацией 20 %. Найти
концентрацию вещества в полученном растворе.
О т в е т. р.в-во(KCl) = 14,8 %.
Задача 7. Смешали 320 г раствора сульфата
меди(II) с концентрацией 5 % и 120 г раствора
гидроксида натрия с концентрацией 10 %. Найти
концентрации веществ в полученном растворе.
О т в е т. р.в-во(Na2SO4) = 3,3 %,
р.в-во(NaOH) = 0,9 %.
• Более сложными являются задачи на
нахождение массы (или объема) вещества, которое
нужно добавить к раствору другого вещества для
того, чтобы его концентрация изменилась в
результате произошедшей реакции.
В этом случае алгоритм решения следующий:
1) нужно обозначить за x количество
добавленного вещества – реагента;
2) выразить через х количества
прореагировавшего с реагентом вещества и
полученного в результате реакции газа или
осадка;
3) найти количество растворенного вещества в
исходном растворе и его количество, оставшееся
после реакции (оставш
= 1 –
прор);
4) выразить через х массу оставшегося в
растворе вещества;
5) найти массу раствора, полученного после
реакции:
mр-р получ = mреаг + mр-р1 –
mосадок (газ);
mр-р получ = mр-р1 + mр-р2 –
m осадок (газ).
6) все данные подставить в формулу:
р.в-во2 = mоставш / mр-р получ.
7) найти количество вещества реагента, его массу
или объем.
Задача 8. Найти массу карбоната
кальция, которую следует добавить к 600 г раствора
азотной кислоты с массовой долей 31,5 %, чтобы
массовая доля кислоты уменьшилась до 10,5 %.
| Дано:
mр-р1(HNO3)
|
Найти: m(CaCO3). |
Р е ш е н и е
(СаСО3) = х
моль; (HNO3)прор
= 2х моль;
(СО2) = х
моль, m(CO2) = 44x г;
m(CaCO3) = M• = 100 (г/моль)•х (моль) = 100х г;
mр.в-во1(HNO3) = mр-р1•р.в-во1 = 600
(г)•0,315 = 189 г;
1(HNO3)
= m р.в-во /М = 189 (г) / 63 (г/моль) = 3 моль,
оставш(HNO3)
= 1 –
прор = 3 – 2х
моль,
mоставш(HNO3) = М• = 63 (г/моль)•(3 – 2х) =
(189 – 126х) г;
mр-р получ = m(CaCO3) + mр-р1(HNO3) –
m(CO2) = 100x + 600 – 44x = 600 + 56x,
р.в-во2(HNO3)
= mоставш(HNO3) / mр-р получ.
0,105 = (189 – 126х) / (600 + 56х),
х = 0,955 моль, (СаСО3)
= 0,955 моль,
m(CaCO3) = M• = 100 (г/моль)•0,955 (моль) = 95,5 г.
О т в е т. m(CaCO3) = 95,5 г.
Задача 9. Найти массу кристаллогидрата CaCl2•6H2O,
которую необходимо добавить к 47 мл 25%-го раствора
карбоната натрия ( = 1,08 г/мл), чтобы получить раствор, в
котором массовая доля карбоната натрия
составила бы 10 %.
| Дано:
Vр-р1(Na2CO3)
|
Найти: m(CaCl2•6H2O). |
Р е ш е н и е
(СaCl2•6H2O)
= x моль, (CaCl2)
= x моль,
прор(Na2CO3)
= х моль, (СаСО3)
= х моль;
m(CaCl2•6H2O) = M• = 219 (г/моль)•х (моль) = 219х г;
m(CaCO3) = M• = 100x г;
mр-р1(Na2CO3) = Vр-р1•р-р1 = 47 (мл)• 1,08
(г/мл) = 50,76 г,
mр.в-во1(Na2CO3) = mр-р1• р.в-во1 = 50,76
(г)•0,25 = 12,69 г,
1(Na2CO3)
= mр.в-во1 / M = 12,69 (г) / 106 (г/моль) = 0,12
моль,
оставш(Na2CO3)
= 1 –
прор = 0,12 – х,
mоставш(Na2CO3) = M• = 106(0,12 – x) =
12,69 – 106x;
mр-р получ = m(CaCl2•6H2O) + mр-р1(Na2CO3) –
m(CaCO3),
219x + 50,76 – 100x = 50,76 + 119x,
р.в-во2 = mоставш(Na2CO3)
/ mр-р получ,
0,1 = 12,69 – 106х / 50,76 + 119х,
х = 0,0646 моль.
m(CaCl2•6H2O) = М• = 219 (г/моль)•0,0646 (моль) = 14,14 г.
О т в е т. m(CaCl2•6H2O) = 14,4 г.
Задача 10. Какой объем 30%-го раствора
аммиака ( = 0,892
г/мл) необходимо добавить к 200 мл 40%-го раствора
соляной кислоты ( = 1,198 г/мл), чтобы массовая доля
кислоты уменьшилась вчетверо?
О т в е т. Vр-р(NH3) = 108,2 мл.
Задача 11. Какой объем углекислого газа
нужно добавить к 100 мл 20%-го раствора гидроксида
натрия ( = 4,1
г/мл), чтобы массовая доля гидроксида натрия
уменьшилась вдвое?
О т в е т. V(CO2) = 10,9 л.
Задача 12. Найти объем раствора соляной
кислоты ( = 1,05
г/мл) с массовой долей 10 %, который нужно
добавить к 350 г раствора гидроксида калия с
массовой долей 10,5 %, чтобы концентрация щелочи
составила 3 %.
О т в е т. Vр-р(HCl) = 135,6 мл.
• Внимание: растворенное вещество –
реагент!
При решении задач на растворы нужно помнить о
том, что при обычных условиях с водой реагируют
следующие вещества:
1) щелочные и щелочно-земельные металлы,
например:
2Na + 2H2O = 2NaOH + H2;
2) оксиды щелочных и щелочно-земельных металлов,
например:
СаО + Н2О = Са(ОН)2;
3) оксиды неметаллов, например:
SO3 + H2O = H2SO4;
4) многие бинарные соединения – гидриды,
карбиды, нитриды и другие, например:
KН + Н2О = KОН + Н2.
Растворение вещества-реагента в воде.
Растворенным веществом в данном случае будет
продукт взаимодействия вещества-реагента с
водой. Масса раствора будет складываться из
массы реагента и массы воды:
mр-р = mреаг + mH2O.
Если в результате реакции выделился газ, то
mр-р = mреаг + mH2O –
mгаз.
Задача 13. В каком объеме воды нужно
растворить 11,2 л оксида серы(IV), чтобы получить
раствор сернистой кислоты с массовой долей 1 %?
| Дано:
V(SO2) = 11,2 л,
|
Найти: V(H2O). |
Р е ш е н и е
(SO2) = V / VM
= 11,2 (л) / 22,4 (л/моль) = 0,5 моль, следовательно, (H2SO3) = 0,5
моль.
mр.в-во(H2SO3) = M• = 82 (г/моль)•0,5 (моль) =
41 г,
mр-р(H2SO3) = mр.в-во(H2SO3)
/ р.в-во(H2SO3)
= 41 (г) / 0,01 = 4100 г;
m(H2O) = mр-р(H2SO3) –
m(SO2),
m(SO2) = M• = 64 (г/моль)•0,5 (моль) = 32 г,
m(H2O) = 4100 (г) – 32 (г) = 4068 г,
V(H2O) = m/ = 4068 (г) / 1 (г/мл) = 4068 мл, или 4 л 68 мл.
О т в е т. V(H2O) = 4068 мл.
Задачи, в которых неизвестна масса
вещества-реагента, необходимого для образования
раствора с определенной концентрацией.
Алгоритм решения следующий:
1) принять количество растворенного реагента за
х моль;
2) согласно уравнению реакции выразить через х
количества продуктов реакции;
3) найти через х массы реагента и продуктов
реакции;
4) найти массу раствора;
5) подставить все данные в формулу для расчета
массовой доли вещества в растворе:
р.в-во(продукт)
= mр.в-во(продукт) / mр-р.
Задача 14. Найти массу гидрида лития,
которую нужно растворить в 100 мл воды, чтобы
получить раствор с массовой долей гидроксида
лития 5 %.
| Дано:
V(H2O) = 100 мл,
|
Найти: m(LiH). |
Р е ш е н и е
Пусть (LiH) = x
моль,
тогда (LiOH) = x
моль, (Н2) = х
моль.
m(LiH) = M•
= 8 (г/моль)•х (моль) = 8х (г),
m(LiOH) = M•
= 24 (г/моль)•х (моль) = 24х г,
m(H2) = M• = 2 (г/моль)•х = 2х г.
mр-р = m(LiH) + m(H2O) – m(H2),
m(H2O) = V• = 100 (мл)•1 (г/мл) = 100 г.
mр-р = 8х + 100 – 2х = 6х + 100.
р.в-во(LiOH)
= mр.в-во(LiOH) / mр-р,
0,05 = 24х / (6х + 100); 0,3х + 5 = 24х,
х = 0,21, (LiH) =
0,21 моль.
m(LiH) = M•
= 8 (г/моль)•0,21 (моль) = 1,7 г.
О т в е т. m(LiH) = 1,7 г.
Растворение вещества-реагента в растворе.
В этом случае растворяемое вещество реагирует
с водой, которая присутствует в растворе. Масса
растворенного вещества во втором растворе
складывается из массы вещества в первом растворе
и массы вещества – продукта реакции:
mр.в-во1 = mр-р1•р.в-во1,
mр.в-во2 = mр.в-во1• mр.в-во(прод.),
mр-р2 = mр-р1 + mреаг,
или mр-р2 = mр-р1 + mреаг –
mгаз.
р.в-во2
= mр.в-во2 / mр-р2.
Задача 15. К 200 г 10%-го раствора
ортофосфорной кислоты добавили 28,4 г фосфорного
ангидрида. Найти массовую долю кислоты в
получившемся растворе.
| Дано:
mр-р1(H3PO4)
m(P2O5) = 28,4 г. |
Найти: |
Р е ш е н и е
(P2O5) =
m / M = 28,4 (г) / 142 (г/моль) = 0,2 моль,
прод(Н3РО4)
= 0,2 (моль)•2 = 0,4 моль.
mпрод(Н3РО4) = М• = 98 (г/моль)•0,4 (моль) =
39,2 г,
mр.в-во1(Н3РО4) = mр-р1•р.в-во1 = 200 (г)
•0,1 = 20 г,
mр.в-во2(Н3РО4) = mр.в-во2(Н3РО4)
+ mпрод(Н3РО4) = 20 (г) + 39,2 (г) = 59,2
г;
mр-р2(Н3РО4) = mр-р1(Н3РО4)
+ mреаг(Р2О5) = 200 (г) + 28,4 (г) = 228,4
г.
р.в-во2(Н3РО4)
= mр.в-во2(Н3РО4) / mр-р2(Н3РО4)
= 59,2 (г) / 228,4 (г) = 0,2592, или 25,92 %.
О т в е т: (Н3РО4) = 25,92 %.
Задача 16. Найти массу фосфорного
ангидрида, которую необходимо добавить к 70 г 10%-го
раствора ортофосфорной кислоты, чтобы получить
40%-й раствор.
| Дано:
mр-р1(Н3РО4)
|
Найти: m(P2O5). |
Р е ш е н и е
Пусть (Р2О5)
= х моль,
тогда (Н3РО4)
= 2х моль.
mпрод(Н3РО4) = М• = 98 (г/моль)•2х
(моль) = 196х г.
mреаг(Р2О5) = М• = 142 (г/моль)•х
(моль) = 142х г,
mр.в-во1(Н3РО4) = mр-р1•р.в-во1 = 70 (г)•
0,1 = 7 г,
mр.в-во2(Н3РО4) = mр.в-во1(Н3РО4)
+ mпрод(Н3РО4) = 7 + 196х, 000000
mр-р2(Н3РО4) = mр-р1(Н3РО4)
+ mреаг(Р2О5) = 70 + 142х,
р.в-во2(Н3РО4)
= mр.в-во2(Н3РО4) / mр-р2(Н3РО4),
0,4 = (7 + 196х) / (70 + 142х),
х = 0,15, (Р2О5)
= 0,15 моль.
m(P2O5) = M• = 142 (г/моль)•0,15 (моль) = 21,3 г.
О т в е т. m(P2O5) = 21,3 г.
Задача 17. В 240 мл воды опустили 69 г натрия.
Найти массовую долю продукта в растворе.
О т в е т. прод = 39,2 %.
Задача 18. Найти массовую долю кислоты в
растворе, полученном при растворении 33,6 л
сернистого газа в 320 г 5%-го раствора сернистой
кислоты.
О т в е т. р.в-во2(Н2SО3) = 33,4 %.
Задача 19. Какую массу оксида серы(VI) нужно
растворить в 150 мл воды, чтобы получить 60%-й
раствор серной кислоты?
О т в е т. m(SO3) = 144 г.
Задача 20. Найти массу оксида серы(VI),
которую необходимо растворить в 99 г 40%-й серной
кислоты, чтобы получить 80%-й раствор.
О т в е т. m(SO3) = 93 г.
Задача 21. Какую массу оксида фосфора(V)
нужно растворить в 120 г воды, чтобы получить 40%-й
раствор ортофосфорной кислоты?
О т в е т. m(P2O5) = 49 г.
Задача 22. К 180 г 50%-го раствора
ортофосфорной кислоты добавили 42,6 г оксида
фосфора(V). Найти массовую долю кислоты в
полученном растворе.
О т в е т. р.в-во2(Н3РО4) = 66,8 %.
Задача 23. В 20 г воды растворили 3,5 г оксида
натрия. Вычислите массовую долю растворенного
вещества.
О т в е т. (NaOH) = 19,2 %.
Задача 24. К 120 г 8%-го раствора гидроксида
натрия добавили 18,6 г оксида натрия. Вычислите
массовую долю гидроксида натрия в
образовавшемся растворе.
О т в е т. р.в-во(NaOH) = 24,2 %.
Задача 25. Найти массу оксида серы(VI),
которую нужно добавить к 2 л 8%-го раствора серной
кислоты ( = 1,06
г/мл), чтобы массовая доля серной кислоты стала
равной 20 %.
О т в е т. m(SO3) = 248,2 г.
Задача 26. Какую массу фосфора необходимо
сжечь в кислороде, чтобы, растворив полученный
оксид в 1000 г раствора ортофосфорной кислоты с
массовой долей 50 %, получить раствор этой
кислоты с массовой долей 75 %?
О т в е т. m(P) = 173,2 г.
Задача 27. Какую массу натрия необходимо
растворить в 120 мл воды для получения раствора
щелочи с массовой долей 18 %?
О т в е т. m(Na) = 13,8 г.
Г.С.ОСНОВСКАЯ,
учитель химии средней школы № 7
(г. Великие Луки, Псковская обл.)
ПОДГОТОВКА К ЭКЗАМЕНУ
«Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей»
Алгоритмы решения задач:
Пример 1. Вычисление массовой доли растворенного вещества
Определите массовую долю нитрата калия в растворе, полученном растворением 50 г нитрата калия в 200 г воды.
|
Дано: m(KNO3 ) = 50 г, m(Н2О) = 200 г. |
Решение ω(в-ва) = m(в-ва) / m(р-ра)*100 (%). m(р-ра) = m(в-ва) + m(Н2 О) = = 50 (г) + 200 (г) = 250 г. ω(KNO3 ) = = 50 (г) / 250 (г) * 100 (%) = 20 %. Ответ. ω(KNO3) = 20 %. |
|
ω(KNO3 ) – ? |
Пример 2. Вычисление массы растворенного вещества
Вычислите массу гидроксида калия в растворе объемом 600 мл и плотностью 1,082 г/мл, если массовая доля гидроксида калия составляет 10 %.
|
Дано: V(р-ра) = 600 мл, ρ = 1,082 г/мл, ω(KОН) = 10 %, или 0,1. |
Решение m(в-ва) = ω(в-ва)*m(р-ра). m(р-ра) = ρ*V(р-ра) = = 1,082 (г/мл)*600 (мл) = 649,2 г. m(KОН) = 649,2 (г)*0,1 = 64,92 г. Ответ. m(KОН) = 64,92 г. |
|
m(KОН) – ? |
Пример 3. Смешивание растворов с разными концентрациями одного вещества Смешали 300 г раствора с массовой долей хлорида натрия 20 % и 500 г раствора того же вещества с массовой долей 40 %. Вычислите массовую долю хлорида натрия в полученном растворе.
|
Дано: m1 = 300 г, ω1 = 20 %, или 0,2, m2 = 500 г, ω2 = 40 %, или 0,4. |
Решение m1 *ω1 + m2 *ω2 = m3 *ω3 , где m1 , m2 , m3 – массы растворов. 300 (г)*0,2 + 500 (г)*0,4 = = 800 (г)*ω3 , 60 (г) + 200 (г) = 800 (г)*ω3 , 260 (г) = 800 (г)*ω3 , ω3 = 260 (г) / 800 (г) = 0,325, или 32,5 %. Ответ. ω3 (NaCl) = 32,5 %. |
|
ω3 – ? |
Пример 4. Разбавление водой
ω2 = 0, т.к. в воде не содержится вещество, находящееся в первом растворе.
Какую массу воды надо добавить к раствору гидроксида натрия массой 150 г с массовой долей 10 %, чтобы получить раствор с массовой долей 2 %?
|
Дано: m1 = 150 г, ω1 = 10 %, или 0,1, ω2 = 0, ω3 = 2 %, или 0,02. |
Решение m1 *ω1 + m2 *ω2 = m3 *ω3 . 150 (г)*0,1 + m2 *0 = = (150 (г) + m2 )*0,02, 15 (г) + 0 = 3 (г) + 0,02m2 , 0,02m2 = 12 г, m2 = 12 (г) / 0,02 = 600 г. Ответ. m(Н2О) = 600 г. |
|
m2 – ? |
Пример 5. Концентрирование (добавление твердого вещества)
ω2 = 100 %, или 1, т.к. добавляемое вещество чистое.
Какую массу хлорида бария надо добавить к раствору хлорида бария массой 150 г с массовой долей 10 %, чтобы получить раствор с массовой долей 25 %?
|
Дано: m1 = 150 г, ω1 = 10 %, или 0,1, ω2 = 100 %, или 1, ω3 = 25 %, или 0,25. |
Решение m1 *ω1 + m2 *ω2 = m3 *ω3 . 150 (г)*0,1 + m2 *1 = = (150 (г) + m2 )*0,25, 15 (г) + 1*m2 = 37,5 (г) + 0,25m2 , 0,75m2 = 22,5 г, m2 = 22,5 (г) / 0,75 = 30 г. Ответ. m(BaCl2 ) = 30 г. |
|
m2 – ? |
Пример 6. Упаривание раствора (частичное выпаривание воды)
Вычислите массовую долю хлорида натрия в растворе, если из 200 г 30 %-го раствора испарилось 50 г воды.
|
Дано: m1 = 200 г, ω1 = 30 %, или 0,3, m2 = 50 г, ω2 = 0. |
Решение m1 *ω1 + m2 *ω2 = m3 *ω3 . 200 (г)*0,3 + 50 (г)*0 = = 150 (г)*ω3 , 60 (г) = 150 (г)*ω3 , ω3 = 60 (г) / 150 (г) = 0,4, или 40 %. Ответ. ω3 (NaCl) = 40 % |
|
ω3 – ? |
ПРИМЕРЫ ЗАДАЧ
1. Какая масса карбоната натрия (в граммах) потребуется для приготовления 0,5 л 13%-го раствора плотностью 1,13 г/мл?
а) 73,45; б) 50; в) 72; г) 75.
2. Из раствора хлорида бария массой 100 г с массовой долей соли 3 % выпарили 25 г воды и до- бавили в него 15 г соли. Массовая доля соли (в %) в полученном растворе равна:
а) 12; б) 15; в) 18; г) 20.
3. Смешали 120 г раствора серной кислоты с массовой до лей 20 % и 40 г 50%-го раствора того же вещества. Определите массовую долю кислоты (в %) в полученном растворе.
а) 25; б) 27,5; в) 27; г) 29,5.
4. Какая масса азотной кислоты (в граммах) содержится в 1 л ее 20%-го раствора с плотностью 1,05 г/мл?
а) 105; б) 63; в) 210; г) 176.
5. Какая масса соли (в граммах) вводится в организм человека при вливании 353 г 0,85%-го физиологического раствора?
а) 3; б) 6; в) 4; г) 2 г.
6. К 180 г 8%-го раствора хлорида натрия добавили 20 г NaCl. Найдите массовую долю (в %) хлорида натрия в образовавшемся растворе.
а) 17,2; б) 17,4; в) 18; г) 12,7.
7. К раствору хлорида кальция массой 140 г с массовой долей соли 5 % добавили 10 г этой же соли. Определите массовую долю (в %) хлорида кальция в полученном растворе.
а) 13,1; б) 14; в) 11,3; г) 25.
8. Какую массу соли (в граммах) надо добавить к 60 г раствора с массовой долей этой соли 10 %, чтобы получить раствор с массовой долей 40 %?
а) 15; б) 22; в) 17; г) 30.
9. Смешали 200 г 15%-го раствора нитрата хрома(III) и 300 г 20%-го раствора той же соли. Вычислите массовую долю (в %) ни- трата хрома(III) в полученном растворе.
а) 24; б) 18; в) 17,9; г) 18,1.
10. Из 150 г раствора хлорида натрия с массовой долей 5 % выпарили 10 г воды и добавили 5 г той же соли. Вычислите массовую долю (в %) соли в полученном растворе.
а) 8,4; б) 8,6; в) 9; г) 11,2.
11. Смешали 200 г 5%-го и 400 г 12,5%-го растворов серной кислоты. Найдите массу кислоты в полученном растворе (в граммах).
а) 60; б) 98; в) 49; г) 58.
12. При растворении 16 г гидроксида натрия получили 10%- й раствор. Определите массу (в граммах) взятой для этого воды.
а) 126; б) 144; в) 151; г) 164.
13. К 200 г 10%-го раствора ни- трата калия добавили некоторую порцию нитрата калия и получи- ли 20%-й раствор. Найдите массу (в граммах) добавленной порции твердого вещества. а) 2,5; б) 5; в) 25; г) 15.
14. Найдите массу воды (в граммах), которую нужно добавить к 300 г 8%-го раствора сульфата натрия для получения 5%-го раствора.
а) 90; б) 45; в) 18; г) 180.
15. Какая масса раствора (в граммах) получится при упаривании 200 г 5%-го раствора гидроксида калия до 20%-го раствора?
а) 10; б) 45; в) 100; г) 50.
16. 92 мл 10%-го раствора серной кислоты (плотность 1,066 г/мл) полностью нейтрализовали 40%-м раствором гидроксида натрия. Найдите массу затраченного на нейтрализацию раствора гидроксида натрия (в граммах).
а) 10; б) 55; в) 20; г) 30.
17. Определите, какую массу гидроксида калия (в граммах) нужно добавить к 150 г 20%-го раствора гидроксида калия для получения 40%-го раствора.
а) 5; б) 50; в) 56; г) 78.
18. К 200 г 8%-го раствора хлорида натрия добавили 50 г воды. Вычислите массовую долю (в %) соли в образовавшемся растворе.
а) 6,4; б) 6,5; в) 6,1; г) 6,2.
19. Определите массу воды (в граммах), которую надо добавить к 20 г 70%-го раствора уксусной кислоты для получения 5%-го раствора уксуса.
а) 260; б) 130; в) 26; г) 258.
20. Определите массу сахара (в граммах), необходимую для приготовления 0,5 кг 45%-го раствора.
а) 245; б) 225; в) 345; г) 500.
21. Вычислите массовую долю соляной кислоты (в %) в растворе, полученном при растворении 11,2 л (н.у.) хлороводорода в 1 л воды.
а) 1,3; б) 1,6; в) 1,8; г) 3,6.
22. Вычислите массу 40%-го раствора уксусной кислоты (в граммах), которую необходимо добавить к 500 г воды для получения 15%-го раствора.
а) 29; б) 32; в) 48; г) 300.
23. Массовая доля соли в морской воде составляет 3,5 %. Найдите массу соли (в граммах), которая останется после выпаривания 5 кг морской воды.
а) 175; б) 170; в) 167; г) 163.
24. Смешали 250 г раствора гидроксида натрия с массовой долей 16 % и 300 мл раствора (ρ = 1,2 г/мл) с массовой долей того же вещества 20 %. Рассчитайте массу гидроксида натрия (в граммах) в полученном растворе:
а) 120; б) 112; в) 11; г) 115.
25. Какова масса поваренной соли (в граммах), которую следует растворить в 250 г раствора этой соли с массовой долей 10 % для получения раствора с массовой долей 18 %?
а) 22; б) 42,4; в) 24,4; г) 44.
26. К 50 г раствора хлорида кальция с массовой долей 3,5 % добавили 5 г этой же соли и 20 г воды. Определите массовую долю (в %) соли в полученном растворе.
а) 6; б) 7; в) 8; г) 9.
27. Какая масса серной кисло ты (в граммах) содержится в 0,6 л ее 40%-го раствора с плотностью 1,3 г/мл?
а) 63; б) 26; в) 60; г) 312.
28. Найдите массу хлорида натрия (в граммах), который необходимо растворить в 50 г воды для приготовления раствора с массовой долей соли 20 %.
а) 20; б) 12,5; в) 5; г) 24.
29. К 350 г водного раствора этанола с массовой долей 20 % добавили 120 мл спирта (плотность 0,8 г/мл). Рассчитайте массу спирта (в граммах) в полученном растворе.
а) 167; б) 156; в) 166; г) 170.
30. Из 50 г раствора хлорида натрия с массовой долей 2 % выпарили 10 г воды и добавили 5 г этой же соли. Определите массовую долю соли (в %) в полученном растворе.
а) 6,3; б) 13,3; в) 8,9; г) 9,4
Ответы. 1–а, 2–г, 3–б, 4–в, 5–а, 6–а, 7–в, 8–г, 9–б, 10–б, 11–а, 12–б, 13–в, 14–г, 15–г, 16–в, 17–б, 18–а, 19–а, 20–б, 21–в, 22–г, 23–а, 24–б, 25–в, 26–г, 27–г, 28–б, 29–в, 30–б.
4.3.5. Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси).
Очень часто при проведении реакции между веществами оказывается, что один реагент прореагировал полностью, а другой нет. В таком случае говорят, что вещество, которое полностью израсходовалось, было в недостатке, а то вещество, которое осталось – в избытке. Поскольку избыток реагента не участвует в реакции, количество продукта зависит только от количества вещества, которое было в недостатке.
Предположим, что осуществляется реакция между веществами А и B, которая протекает в соответствии с уравнением:
aA + bB = cC + dD
Для осуществления этой реакции было взято количество вещества A, равное nA, и количество вещества B, равное nB. Определить то, какое вещество в избытке, а какое в недостатке, можно, сравнив выражения:
В зависимости от того, какое выражение окажется меньше, то вещество соответственно и будет в недостатке.
Примечание: распространенной ошибкой является то, что вместо выражений (1) сравнивают просто количества веществ. Так делать категорически не допускается! Если n(A) > n(B), то это еще не значит, что вещество A в избытке!
После того, как будет установлено то, какое вещество было в недостатке, расчеты ведутся по его количеству аналогично рассмотренным в главе 4.3.3.
Пример задачи на избыток и недостаток
Нагрели смесь 54 г алюминия и 80 г серы. Вычислите массу образовавшегося сульфида алюминия.
Решение
Запишем уравнение реакции:
2Al + 3S = Al2S3
Рассчитаем количества веществ алюминия и серы:
n(Al) = m(Al)/M(Al) = 54/27 = 2 моль;
n(S) = m(S)/M(S) = 80/32 = 2,5 моль
Для того чтобы выяснить, какое из исходных веществ в недостатке, разделим количества молей веществ на коэффициенты перед этими веществами в уравнении и сравним рассчитанные выражения:
n(Al)/k(Al) = 2/2 = 1
и n(S)/k(S) = 2,5/3 ≈ 0,833
т.е. n(Al)/k(Al) > n(S)/k(S)
Значит сера в недостатке. Расчеты далее ведем по количеству вещества серы.
Исходя из уравнения реакции
2Al + 3S = Al2S3
следует, что количество прореагировавшей серы и образовавшегося в результате реакции сульфида алюминия связаны выражением:
где 3 и 1 – коэффициенты перед S и Al2S3 соответственно. Отсюда:
n(Al2S3) = n(S)/3 = 2,5/3 ≈ 0,8333 моль
Следовательно, масса сульфида алюминия будет равна:
m(Al2S3) = M(Al2S3) ∙ n(Al2S3) = 150 ∙ 0,8333 = 125 г
Ответ: m(Al2S3) = 125 г
В случае, если в задаче дается масса реагента, содержащего примеси (mр-та с прим.), прежде всего следует рассчитать массу чистого реагента без примесей (mр-та ). Если дается масса реагента с примесями и указана массовая доля этого реагента ωр-та , то масса чистого реагента рассчитывается по формуле:
В случае, если вместо массовой доли чистого вещества дается массовая доля примесей, то учитывая, что:
ωр-та + ωприм. = 100%
мы можем записать, что:
Пример задачи на расчет количества продукта, зная массу реагента с примесями
Какой объем углекислого газа (н.у.) выделится при действии избытка соляной кислоты на технический карбонат кальция массой 150 г, содержащий 10% некарбонатных примесей.
Решение:
Запишем уравнение взаимодействия карбоната кальция с соляной кислотой:
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
Массовая доля примесей в техническом карбонате кальция составляет 10%, значит массовая доля чистого карбоната кальция будет составлять:
ω(CaCO3) = 100% — ω(прим.) = 100% — 10% = 90%.
Масса чистого карбоната кальция будет равна:
m(CaCO3) = ω(CaCO3) ∙ m(CaCO3 техн.)/100% = 90% ∙ 150 г/100% = 135 г,
Следовательно, количество вещества карбоната кальция равно:
n(CaCO3) = m(CaCO3)/M(CaCO3) = 135 г / 100 г/моль = 1,35 моль
В соответствии с уравнением реакции:
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
Количества веществ карбоната кальция и углекислого газа равны (одинаковые коэффициенты в уравнении), следовательно:
n(CO2) = n(CaCO3) = 1,35 моль
Тогда, зная, что один моль любого газа при нормальных условиях занимает объем 22,4 л, мы можем рассчитать объем выделившегося CO2:
V(CO2) = n(CO2) ∙ Vm = 1,35 моль ∙ 22,4 л/моль = 30,24 л
Подготовка к ЕГЭ: выполнение заданий высокого уровня сложности. В статье описаны возможные типы задач с расчётами по уравнениям реакций, происходящих в растворах.
Одно из заданий высокого уровня сложности, оно входит в третью часть экзаменационной работы (задание С4), проверяет умения производить расчёты по уравнениям реакций, происходящих в растворах.
Уважаемые старшеклассники!
Если вы будете иметь представление о возможных типах таких задач, закрепите умения на самостоятельном решении ряда подобных задач, то вам по силам будет справиться с ними и на ЕГЭ.
Прежде всего вы должны усвоить понятие о массовой доле растворённого вещества или процентной концентрации раствора. Эта величина показывает отношение массы растворённого вещества к массе раствора:
р.в. = m р.в. / m р-ра
Производные формулы:
m р.в. = m р-ра р.в.
m р-ра = m р.в. / р.в.
Если в условии задачи указан объём раствора с определённой плотностью, то прежде всего находят массу раствора:
m р-ра = V р-ра ,
затем – массу растворённого вещества:
m р.в. = m р-ра р.в.
Количество вещества находят по массе растворённого вещества:
= m р.в. / М
Рассмотрим некоторые типы задач с расчётами по уравнениям реакций, происходящих в растворах.
Нахождение массовых долей растворённых веществ в растворе
после реакции.
При решении таких задач прежде всего нужно найти количества реагирующих веществ. Если задача на избыток и недостаток, то количества продуктов реакции находят по веществу, которое дано в недостатке.
Один из важных моментов – это нахождение массы раствора после реакции (массы полученного раствора), m р-ра получ. Если вещество взаимодействует с веществом, находящимся в растворе, то складывают массу вещества и массу раствора; в случае, когда оба реагирующих вещества даны в виде растворов, складывают массы двух растворов. Если в результате реакции образуется осадок или газ, то из полученной суммы отнимают массу вещества, ушедшего из раствора в виде осадка или газа.
m р-ра получ. = m в. + m р-ра1 – m осадка (газа)
m р-ра получ. = m р-ра1 + m р-ра2 – m осадка (газа)
При решении задач на избыток и недостаток нужно помнить о том, что в растворе после реакции будет находиться в растворённом виде не только продукт реакции, но и вещество, которое было дано в избытке.
Чтобы найти количество вещества – избытка, нужно от исходного количества вещества отнять количество прореагировавшего вещества:
изб. = исх. — прор.
Затем найти его массу и массовую долю в растворе полученном после реакции.
Задача 1: 4.8 г магния растворили в 200 мл 12 % — го раствора серной кислоты ( = 1, 05 г/мл). Найти массовую долю соли в полученном растворе.
Д
m (Mg) = 4,8 г
V р-ра (H2SO4) = 200 мл Решение:
р-ра (H2SO4) = 1,05 г/мл Mg + H2SO4 = MgSO4 + H2
1 моль 1 моль 1 моль 1 моль

m р-ра (H2SO4) = V р-ра = 200 мл 1,05 г/мл = 210г
р.в. (MgSO4 ) = ? m р.в. (H2SO4) = m р-ра р.в. = 210 0,12 = 25,2 г
р.в. (H2SO4) = m/M = 25,2 г / 98 г/моль = 0,26 моль
В недостатке Mg (MgSO4) = 0,2 моль, (H2) = 0,2 моль
m р.в.(MgSO4) = M = 120 г/моль 0,2 моль = 24 г
m (H2) = M = 2 г/моль 0.2 моль = 0,4 г
m р-ра получ. = m р-ра (H2SO4) + m (Mg) – m (H2) = 210г + 4,8г – 0,4г = 214,4 г
р.в.(MgSO4) = m р.в.(MgSO4) / m р-ра получ. = 24 г / 214,4 г = 0,112 или 11.2 %
Ответ: р.в.(MgSO4) = 11.2 %
Задача 2: Смешали 250 г раствора сульфата железа (III) с концентрацией 8 % и 50 г раствора гидроксида натрия с концентрацией 30 %. Найти концентрацию веществ в получившемся растворе.

Дано:
m р-ра (Fe2(SO4)3) = 250 г Решение:
р.в. (Fe2(SO4)3) = 8 %
m р-ра (NaOH) = 50 г Fe2(SO4)3 + 6NaOH = 2Fe(OH)3 + 3Na2SO4
1 моль 6 моль 2 моль 3 моль

р.в. = ? (Fe2(SO4)3) = m / M = 20г / 400г/моль = 0,05 моль
m р.в.(NaOH) = m р-ра р.в. = 50г 0,3 = 15г
(NaOH) = m / M = 15г / 40г/моль = 0,375 моль
В недостатке Fe2(SO4)3 (Na2SO4) = 0,05 моль 3 = 0,15 моль
(Fe(OH)3) = 0,05 моль 2 = 0,1 моль
(NaOH) прор. = 0,05 моль 6 = 0,3 моль
(NaOH) изб. = — прор. = 0,375 моль – 0,3 моль = 0,075 моль
m(NaOH) = M = 40г / моль = 0,075 моль = 3г
m(Na2SO4) = M = 142г/моль 0,15 моль =
m(Fe(OH)3) = M = 107г/моль 0,1 моль = 10,7г
m р-ра получ. = m р-ра (Fe2(SO4)3 + m р-ра (NaOH) – m (Fe(OH)3) = 250г + 50г – 10,7г = 289,3г
р.в.(Na2SO4) = m / m р-ра = 21,3г / 289,3г = 0,074 или 7,4 %
р.в.(NaOH) = m / m р-ра = 3г / 289,3г = 0,01 или 1 %
Ответ: р.в.(Na2SO4) = 7,4 %,
р.в.(NaOH) = 1 %.
Задача 3: Карбонат кальция массой 10г растворили при нагревании в 150 мл хлороводородной кислоты ( = 1,04 г/мл) с массовой долей 9 %.
Какова массовая доля хлороводорода в получившемся растворе?
Ответ: р.в. (HCl) = 4,2 %.
Задача 4: 5,6г железа растворили в 100 мл 10 % — го раствора соляной кислоты
( = 1,05г/мл). Вычислите массовую долю хлороводорода в полученном растворе.
Ответ: р.в.(HCl) = 2,9 %.
Задача 5: 5,6г железа растворили в 200 мл раствора соляной кислоты ( = 1,05 г/мл) с массовой долей 10 %. Найти массовую долю соли в полученном растворе.
Ответ: р.в. (FeCl2) = 5,9 %.
Задача 6: Смешали 110,4г раствора карбоната калия с концентрацией 25 % и 111г раствора хлорида кальция с концентрацией 20 %. Найти концентрацию вещества в полученном растворе.
Ответ: р.в. (KCl) = 14,8 %.
Задача 7: Смешали 320г раствора сульфата меди (II) с концентрацией 5 % и 120 г раствора гидроксида натрия с концентрацией 10 %. Найти концентрации веществ в полученном растворе.
Ответ: р.в.(Na2SO4) = 3,3 %,
р.в. (NaOH) = 0,9 %.
Более сложными являются задачи на нахождение массы или объёма вещества, которое нужно добавить к раствору другого вещества для того, чтобы изменилась его концентрация в результате произошедшей реакции.
В этом случае:
-
Нужно обозначить за x количество добавленного вещества – реагента.
-
Выразить через х количества прореагировавшего с ним вещества и полученного в результате реакции газа или осадка.
-
Найти количество растворённого вещества в исходном растворе и его количество, оставшееся после реакции: оставш. = 1 — прор.
-
Выразить через х массы реагента, оставшегося в растворе вещества и осадка (газа).
-
Найти массу раствора, полученного после реакции:
m р-ра получ. = m реаг. + m р-ра1 – m осадка (газа)
m р-ра получ. = m р-ра1 + m р-ра2 – m осадка (газа).
-
Все данные подставить в формулу:
р.в.2 = m оставш. / m р-ра получ.
Найти количество вещества – реагента, его массу или объём.
Задача 1: Найти массу карбоната кальция, которую следует добавить к 600г раствора азотной кислоты с массовой долей 31,5 %, чтобы массовая доля кислоты уменьшилась до 10,5 %.
Дано:
m
р.в.1 (HNO3) = 31,5 % CaCО3 + 2HNO3 = Ca(NO3)2 + CO2 + H2O
1 моль 2 моль 1 моль 1 моль
р.в.2 (HNO3) = 10,5 %
m (CaCO3) = ?
(СаСО3) = х моль (HNO3) прор. = 2х моль (СО2) = х моль
m (CaCO3) = M = 100г/моль х моль = 100г m (CO2) = 44x
m р.в.1(HNO3) = m р-ра1 р.в.1 = 600 0,315 = 189г
1(HNO3) = m р.в. / М = 189г / 63г/моль = 3 моль
(HNO3) оставш. = 1 — прор. = 3 – 2х
m (HNO3) оставш. = М = 63г/моль (3 – 2х) = 189 – 126х
m р-ра получ. = m (CaCO3) + m р-ра1(HNO3) – m (CO2) = 100x + 600 – 44x =
= 600 + 56x
р.в.2 (HNO3) = m оставш.(HNO3) / m р-ра получ.
0,105 = 189 – 126х / 600 + 56х
х = 0,96 (СаСО3) = 0,96 моль
m (CaCO3) = M = 100г/моль 0,96 моль = 96г
Ответ: m (CaCO3) = 96г
Задача 2: Найти массу кристаллогидрата CaCl2 6H2O, которую необходимо добавить к 47 мл 25% — ного раствора карбоната натрия ( = 1,08), чтобы получить раствор, в котором массовая доля карбоната натрия составила бы 10 % ?
Д
V р-ра1(Na2CO3) = 47 мл Решение:
р-ра1(Na2CO3) = 1,08 г/мл CaCl2 + Na2CO3 = CaCO3 + 2NaCl
1 моль 1 моль 1 моль
р.в.1(Na2CO3) = 25 %

m(CaCl2 6H2O) = ?
(СaCl2 6H2O) = x моль (CaCl2) = x моль (Na2CO3) прор. = х моль
(СаСО3) = х моль
m(CaCl2 6H2O) = M = 219 г/моль х моль = 219х г
m(CaCO3) = M = 100x г
m р-ра1(Na2CO3) = V р-ра1 р-ра1 = 47 мл 1,08 г/мл = 50,76 г
m р.в.1(Na2CO3) = m р-ра1 р.в.1 = 50,76 г 0,25 = 12,69 г
1(Na2CO3) = m р.в.1 / M = 12,69 г / 106 г/моль = 0,12 моль
оставш.(Na2CO3) = 1 — прор. = 0,12 — х
m оставш.(Na2CO3) = M = 106(0,12 – x) = 12,69 – 106x
m р-ра получ. = m кр-та(CaCL2 6H2O) + m р-ра1(Na2CO3) – m(CaCO3) = 219x + 50,76 – 100x = 50,76 + 119x
р.в.2 = m оставш.(Na2CO3) / m р-ра получ.
0,1 = 12,69 – 106х / 50,76 + 119х х = 0,0646 моль
m кр-та = М = 219 г/моль 0,0646 моль = 14,14 г
Ответ: m кр-та(CaCl2 6H2O) = 14,4 г
Задача 3: Какой объём 30% раствора аммиака ( = 0,892 г/мл) необходимо добавить к 200 мл 40% — ного раствора соляной кислоты ( = 1,198 г/мл), чтобы массовая доля кислоты уменьшилась вчетверо?
Ответ: V р-ра(NH3) = 108,2 мл
Задача 4: Какой объём углекислого газа нужно добавить к 100 мл 20% — ного раствора гидроксида натрия ( = 4,1 г/мл), чтобы массовая доля гидроксида натрия уменьшилась вдвое?
Ответ: V(CO2) = 2,9 л
Задача 5: Найти объём раствора соляной кислоты ( = 1,05 г/мл) с массовой долей 10%, который нужно добавить к 350 г раствора гидроксида калия с массовой долей 105, чтобы концентрация щелочи составила 3%.
Ответ: Vр-ра(HCl) = 128 мл.
Внимание: растворённое вещество – реагент!
При решении задач на растворы нужно помнить о том, что при обычных условиях с водой реагируют:
-
щелочные и щелочно – земельные металлы: 2Na + 2H2O = 2NaOH + H2
-
оксиды щелочных и щелочно – земельных металлов: СаО + Н2О = Са(ОН)2
-
оксиды неметаллов: SO3 + H2O = H2SO4
-
многие бинарные соединения – гидриды, карбиды, нитриды и другие:
КН + Н2О = КОН + Н2
В этих случаях нужно прежде всего составлять уравнения реакций, расчёты производить и по химическому уравнению, и по концентрации раствора.
1 тип: растворение вещества – реагента в воде.
Растворённым веществом в данном случае будет продукт взаимодействия вещества – реагента с водой. Масса раствора будет складываться из массы реагента и массы воды: m р-ра = m реаг. + m H2O
Если в результате реакции выделился газ: m р-ра = m реаг. + m H2O – m газа
р.в.(продукта) = m р.в.(продукта) / m р-ра
Задача 1: В каком объёме воды нужно растворить 11,2л оксида серы (IV), чтобы получить раствор сернистой кислоты смассовой долей 1%?
Д
V(SO2) = 11,2л SO2 + H2O = H2SO3
р.в.(H2SO4) = 1% 1 моль 1 моль

V(H2O) = ? (SO2) = V / Vm = 11,2л / 22,4л/моль = 0,5 моль (H2SO3) = 0,5 моль
m р.в.(H2SO3) = M = 82г/моль 0,5 моль = 41г
m р-ра(H2SO3) = m р.в.(H2SO3) / р.в.(H2SO3) = 41г / 0,01 = 4100г
m(H2O) = m р-ра(H2SO3) – m(SO3)
m(SO3) = M = 80г/моль 0,5 моль = 40г
m(H2O) = 4100г – 40г = 4060г
V(H2O) = m / = 4060г / 1г/мл = 4060мл
Ответ: V(H2O) = 4060мл.
Задачи, в которых неизвестна масса вещества – реагента, необходимого для образования раствора с определённой концентрацией.
-
принять количество растворённого реагента за х моль;
-
согласно уравнения реакции выразить через х количества продуктов реакции;
-
найти через х массы реагента и продуктов реакции;
-
найти массу раствора;
-
подставить все данные в формулу для расчёта массовой доли вещества в растворе: р.в.(продукта) = m р.в.(продукта) / m р-ра.
Задача 2: Найти массу гидрида лития, которую нужно растворить в 100мл воды, чтобы получить раствор с массовой долей гидроксида 5%.
Дано: Решение:
V(H2O) = 100мл
р.в.(LiOH) = 5% LiH + H2O = LiOH + H2

m
Пусть (LiH) = x моль (LiOH) = x моль, (Н2) = х моль
m(LiH) = M = 8г/моль х моль = 8х г
m(LiOH) = M = 24г/моль х моль = 24х г
m(H2) = M = 2г/моль х = 2х г
m р-ра = m(LiH) + m(H2O) – m(H2)
m(H2O) = V = 100мл 1г/моль = 100г
m р-ра = 8х + 100 – 2х = 6х + 100
р.в.(LiOH) = m р.в.(LiOH) / m р-ра
0,05 = 24х / 6х + 100; 0,3х + 5 = 24х
х = 0,21; (LiH) = 0,21моль
m(LiH) = M = 8г/моль 0,21 моль = 1,7г
Ответ: m(LiH) = 1,7г.
2 тип: растворение вещества – реагента в растворе.
В этом случае растворяемое вещество реагирует с водой, которая присутствует в растворе. Масса растворённого вещества во втором растворе складывается из массы вещества в первом растворе и массы вещества – продукта реакции:
m р.в.1 = m р-ра1 р.в.1
m р.в.2 = m р.в.1 + m р.в. (продукта)
m р-ра2 = m р-ра1 + m реаг. или m р-ра2 = m р-ра1 + m реаг. – m газа
р.в.2 = m р.в.2 / m р-ра2
Задача 3: К 200г 10% — ного раствора ортофосфорной кислоты добавили 28,4г фосфорного ангидрида. Найти массовую долю кислоты в получившемся растворе.
Дано: Решение:
m р-ра1(H3PO4) = 200г Р2О5 + 3Н2О = 2Н3РО4
р.в.1(Н3РО4) = 10% 1 моль 2 моль
m

р.в.2(Н3РО4) = ?
(P2O5) = m / M = 28,4г / 142г/моль = 0,2 моль (Н3РО4) =
0,2 моль 2 = 0,4 моль
m прод.(Н3РО4) = М = 98г/моль 0,4 моль = 39,2
m р.в.1(Н3РО4) = m р-ра1 р.в.1 = 200г 0.1 = 20г
m р.в.2(Н3РО4) = m р.в.1(Н3РО4) + m прод.(Н3РО4) = 20 + 39,2 = 59,2
m р-ра2(Н3РО4) = m р-ра1(Н3РО4) + m реаг.(Р2О5) = 200г + 28,4г = 228,4г
р.в.2(Н3РО4) = m р.в.2(Н3РО4) / m р-ра2(Н3РО4) = 59,2г / 228,4г = 0,259
или 26%
Ответ: р.в.2(Н3РО4) = 26%
Задача 4: Найти массу фосфорного ангидрида, который необходимо добавить к 70г 10% — ного раствора ортофосфорной кислоты, чтобы получить 40% — й раствор.
Д
m р-ра1(Н3РО4) = 70г
р.в.1(Н3РО4) = 10% Р2О5 + 3Н2О = 2Н3РО4
р.в.2(Н3РО4) = 40% 1 моль 2 моль

m(P2O5) = ?
Пусть (Р2О5) = х моль (Н3РО4) = 2х моль
m прод.(Н3РО4) = М = 98г/моль 2х = 196х г
m реаг.(Р2О5) = М = 142г/моль х моль = 142х
m р.в.1(Н3РО4) = m р-ра1 р.в.1 = 70г 0,1 = 7г
m р.в.2(Н3РО4) = m р.в.1(Н3РО4) + m прод.(Н3РО4) = 7 + 196х
m р-ра2(Н3РО4) = m р-ра1(Н3РО4) + m реаг.(Р2О5) = 70 + 142х
р.в.2(Н3РО4) = m р.в.2(Н3РО4) / m р-ра2(Н3РО4)
0,4 = 7 + 196х / 70 + 142х
х = 0,15 (Р2О5) = 0,15 моль
m(P2O5) = M = 142г/моль 0,15 моль = 21,4г
Ответ: m(P2O5) = 21,4г
Задача 5:
В 240 мл воды опустили 69г натрия. Найти массовую долю продукта в растворе.
Ответ: 39,2%.
Задача 6:
Найти массовую долю кислоты в растворе, полученном при растворении 33,6л сернистого газа в 320г 5% — ного раствора сернистой кислоты.
Ответ: 33.4%.
Задача 7:
Какую массу оксида серы (VI) нужно растворить в 150 мл воды, чтобы получить 60% — й раствор серной кислоты?
Ответ: m(SO3) = 144г.
Задача 8:
Найти массу оксида серы (VI), который необходимо растворить в 99г 40% серной кислоты, чтобы получить 80% — й раствор.
Ответ: m(SO3) = 93г.
Задача 9:
Какую массу оксида фосфора (V) нужно растворить в 120г воды, чтобы получить 40% — й раствор ортофосфорной кислоты?
Ответ: m(P2O5) = 49г.
Задача 10:
К 180г 12% раствора ортофосфорной кислоты добавили 21г оксида фосфора (V). Найти массовую долю кислоты в полученном растворе.
Ответ: (Н3РО4) = 25,2%.
Задача 11:
В 20г воды растворили 3,5г оксида натрия. Вычислите массовую долю растворённого вещества.
Ответ: (NaOH) = 20,4%.
Задача 12:
К 120г 8% — ного раствора гидроксида натрия добавили 18,6г оксида натрия. Вычислите массовую долю гидроксида натрия в образовавшемся растворе.
Ответ: (NaOH) = 24,2%.
Задача 13:
Найти массу оксида серы (VI), которую нужно добавить к 2л 8% — ного раствора серной кислоты ( = 1,06г/мл), если массовая доля серной кислоты стала равной 20%. Ответ: m(SO3) = 248,2г.

Расчетные задачи типа «Определение выхода продукта реакции в процентах от теоретического»
Признак
В условии задачи встречается слово «выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём, практическая масса или объём» могут быть использованы только для веществ-продуктов.
Доля выхода продукта обозначается буквой
(эта), измеряется в процентах или долях.
Также для расчётов может использоваться количественный выход:
I. Первый тип задач
Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
| 1. Записываем краткое условие задачи |
Дано: m (Mg) = 1,2 г m практическая(MgSO4) = 5,5 г _____________________ Найти: |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(Mg) = 24 г/моль M(MgSO4) = 24 + 32 + 4 · 16 = 120 г/моль |
|
4. Находим количество вещества реагента по формулам |
ν(Mg) = 1,2 г / 24(г/моль) = 0,05 моль |
| 5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
m = ν · M mтеор (MgSO4) = M(MgSO4) · νтеор (MgSO4) = = 120 г/моль · 0,05 моль = 6 г |
|
6. Находим массовую (объёмную) долю выхода продукта по формуле |
Ответ: Выход сульфата магния составляет 91,7% по сравнению с теоретическим |
II. Второй тип задач
Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
|
1. Записываем краткое условие задачи |
Дано: m(CaO) = 16,8 г
___________________ Найти: m практ (CaC2) = ? |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
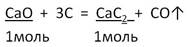 |
|
3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(CaO) = 40 + 16 = 56 г/моль M(CaC2) = 40 + 2 · 12 = 64г/моль |
|
4. Находим количество вещества реагента по формулам |
ν(CaO)=16,8 (г) / 56 (г/моль) = 0,3 моль |
|
5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
|
|
6. Находим массовую (объёмную) долю выхода продукта по формуле |
m практич (CaC2) = 0,8 · 19,2 г = 15,36 г Ответ: m практич (CaC2) = 15,36 г |
III. Третий тип задач
Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
| 1. Записываем краткое условие задачи |
Дано: н. у. Vm = 22,4 л/моль Vпрактич(CO2) = 28,56 л = 85% или 0,85 ____________________ Найти: m(Na2CO3) =? |
| 2. Находим по ПСХЭ молярные массы веществ, если это необходимо | M (Na2CO3) =2·23 + 12 + 3·16 = 106 г/моль |
|
3. Вычисляем теоретически полученный объём (массу) и количество вещества продукта реакции, используя формулы: |
Vтеоретич(CO2) = = 28,56 л / 0,85 = 33,6 л ν(CO2) = 33,6 (л) / 22,4 (л/моль) = 1,5 моль |
|
4. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 5. Находим количество вещества реагента по УХР |
По УХР:
ν(Na2CO3) = ν(CO2) = 1,5 моль |
|
6. Определяем массу (объём) реагента по формуле: m = ν · M V = ν · Vm |
m = ν · M m(Na2CO3) = 106 г/моль · 1,5 моль = 159 г |
IV. Решите задачи
Задача №1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
Задача №2. Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95 %.
Задача №3. Определите, какая масса меди вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3 л (н.у.), если выход оксида серы (IV) составляет 90%.
Задача №4. К раствору, содержащему хлорид кальция массой 4,1 г, прилили раствор, содержащий фосфат натрия массой 4,1 г. Определите массу полученного осадка, если выход продукта реакции составляет 88 %.


