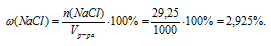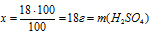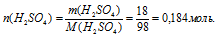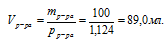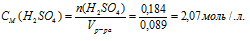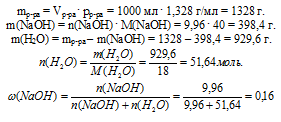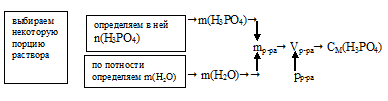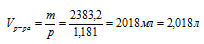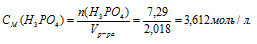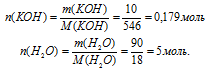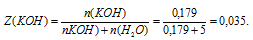Как вычислить массовую долю, если известна плотность
Массовая доля – это величина, показывающая, каково отношение массы какого-либо компонента, входящего в состав раствора или сплава, или смеси к общей массе всех компонентов. Она может выражаться либо в долях единицы, либо в процентах. Легко понять, что чем ближе массовая доля к единице, тем больше содержание этого компонента в растворе, сплаве или смеси.

Инструкция
Давайте рассмотрим пример с веществом – хлоридом натрия, или, по-другому, поваренной солью. Предположим, у вас есть 200 миллилитров водного раствора поваренной соли, и вам надо вычислить ее массовую долю.
Есть разные способы решения этой задачи. Для начала рассмотрите самый простой. Если бы у вас было 200 миллилитров чистой воды, сколько бы весило такое ее количество? Разумеется, 200 граммов или 0,2 килограмма. Ведь плотность пресной воды практически равна единице. А сколько весит раствор поваренной соли? Взвесьте сначала емкость с раствором, желательно на лабораторных весах для большей точности.
Предположим, общий вес составил 320 граммов. Перелейте раствор в какую-то другую посуду, и взвесьте пустую емкость. Оказалось, что она весит ровно 100 граммов. Следовательно, вес раствора соли составит: 320 – 100 = 220 граммов. То есть его плотность равна: 220/200 = 1,1 граммов/мл.
Для простоты вычислений допустим, что при растворении соли в воде ее объем увеличился настолько незначительно, что этим можно пренебречь. Получается, что в 200 миллилитрах раствора содержится: 200 граммов чистой воды и 20 граммов хлористого натрия, составляя суммарно те самые 220 граммов. Какова же массовая доля хлористого натрия? Задача решается в одно действие: 20/220 = 0,909. Или, если считать в процентах, 9,09%. Можно принять округленное значение: 9,1%.
Ну, а если бы вы по какой-то причине не смогли ни измерить объема раствора хлористого натрия, ни узнать его массу? Как тогда определить массовую долю раствора? Очень просто. Сначала вам надо измерить плотность раствора соли специальным прибором – плотномером. А потом с помощью специальных таблиц (они есть во многих химических или физических справочниках) определить, какой процентной концентрации раствора поваренной соли соответствует такая плотность. Процентная же концентрация, как вам известно, одно из выражений массовой доли. Вот так вы нашли ответ на поставленный вопрос.
Источники:
- плотность поваренной соли
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Определение массовой доли, молярности и мольной доли
Задача 4.
Определите массовую долю NаС1 в 0,5 М водном растворе (плотность раствора принять равной 1,000 г/мл).
Дано:
молярная концентрация NаС1 в р-ре: См(NаС1) = 0,5 моль/л.;
плотность раствора: рр-ра = 1,000 г/мл.
Найти:
массовую долю NаС1 в растворе.
Решение:
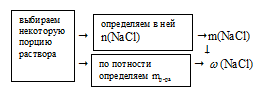
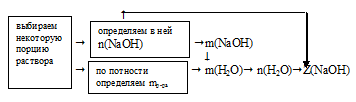
Схематично алгоритм решения можно представить так:
Наиболее удобно выбрать именно объем раствора, т.к. известная концентрация выражена в моль/л. Причем разумнее всего взять объем равный 1 л.
По записи концентрации (0,5 моль/л) видно, что в этом 1 л раствора содержится 0,5 моль чистой соли NаС1.
Определим массу 0,5 моль NаС1:
m(NаС1) = n(NаС1) . М(NаС1) = 0,5 . 58,5 = 29,25 г.
Определим массу раствора:
mр-ра = Vр-ра . pр-ра = 1000мл . 1 г/мл = 1000 г.
Массовую долю NаС1 в растворе определяем, пользуясь соотношением:
Ответ: 
Задача 5.
Определить молярность 18%-ного раствора Н2SО4 в воде (рр-ра = 1,124 г/мл).
Дано:
массовая доля Н2SО4 в растворе: 
плотность раствора: рр-ра = 1,124 г/мл.
Найти:
молярную концентрацию Н2SО4 в растворе.
Решение:
Схематично алгоритм решения можно представить так:
Наиболее удобно выбрать именно массу раствора, т.к. известна массовая доля. Причем разумнее всего взять массу 100 г.
1. Находим массу серной кислоты в выбранной массе раствора:
100 г составляют 100%
х г составляют 18%
в 100 г 18% -ного раствора.
2. Определяем количество вещества в 18 г Н2SО4
3. Используя плотность, находим объем 100 г раствора:
4. Объем переводим в литры, т.к. молярная концентрация измеряется в моль/л: Vр-ра = 89 мл = 0,089 л.
5. Определяем молярную концентрацию:
Ответ: СМ(Н2SО4) = 2,07 моль/л.
Задача 6.
Определите мольную долю NаОН в водном растворе, если его концентрация равна 9,96 моль/л, а плотность 1,328 г/мл.
Дано:
молярная концентрация NаОН в растворе: См(NаОН) = 9,96 моль/л;
плотность раствора: рр-ра = 1,328 г/мл.
Найти:
мольную долю NаОН в растворе.
Решение:
Схематично алгоритм решения можно представить так:
Наиболее удобно выбрать именно объем раствора, т.к. известная концентрация выражена в моль/л. Причем разумнее всего взять объем равный 1 л.
По записи концентрации (9,96 моль/л) видно, что в этом 1 л раствора содержится 9,96 моль чистого NаОН.
Для определения мольной доли NаОН еще необходимо выявить количество вещества (n, моль) воды в выбранной порции раствора (1л). Для этого определим массу раствора и вычтем из нее массу NаОН.
Ответ1: 
Задача 7.
Мольная доля водного раствора Н3РО4 в воде составляет 7,29%(мольн.) Определите молярность этого раствора, если его плотность 1,181 г/мл.
Дано:
мольная доля Н3РО4 в растворе: Z(Н3РО4) = 7,29%;
плотность раствора: рр-ра= 1,181 г/мл.
Найти:
молярную концентрацию Н3РО4 в растворе.
Решение:
Схематично алгоритм решения можно представить так:
Наиболее удобно выбрать такое количество раствора, в котором:
n(Н3РО4) + n(Н2О) = 100 моль.
В этой порции раствора количество вещества Н3РО4 численно совпадает с мольной долей: Z(Н3РО4) = 7,29 моль.
Для определения молярности нам осталось выявить объем выбранной порции раствора. Его можно вычислить, используя плотность раствора. Но для этого необходимо знать его массу. Массу же раствора можно рассчитать исходя из количеств веществ компонентов (Н3РО4 и Н2О) раствора.
1. Выбранная нами порция содержит суммарно 100 моль. Количество вещества Н3РO4 нам известно. Используя эти данные, находим n(Н2О).
п(Н2О) = 100 – 7,29 = 92,71 моль.
2. Определим массу 92,71 моль воды:
m(Н2О) = n(Н2О) . М(Н2О) = 92,71 . 18 = 1669 г.
3. Определим массу 7,29 моль Н3РО4:
m(Н3РO4) = n(Н3РО4) . М(Н3РО4) = 7,29 . 98 = 714,4 г.
4. Находим массу выбранной порции раствора:
mр-ра = m(Н2О) + m(Н3РО4) = 1669 + 714,4 =2383 г.
5. Используя данные о плотности раствора, находим его объем:
6. Теперь определим молярную концентрацию:
Ответ: СМ(Н3РО4) = 3,612моль/л.
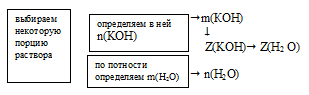
Задача 8.
Определите мольные доли веществ в водном растворе КОН, если массовая доля гидроксида калия в нем составляет 10,00%.
Дано:
массовая доля КОН в растворе: 
Найти:
мольную долю КОН и Н2O(в растворе: Z(КОН) = ?; Z(H2O) = ?
Решение:
Схематично алгоритм решения можно представить так:
Наиболее удобно выбрать именно массу раствора, т.к. известна массовая доля. Причем разумнее всего взять массу 100 г. В этом случае массы каждого компонента совпадут с численным значением массовой доли:
m(КОН) = 10 г, m(Н2О) = 100 – m(КОН) = 100 – 10 = 90 г.
1. Определим количество вещества (n, моль) воды и КОН.
2. Определяем мольную долю КОН
3. Определяем мольную долю воды:
Z(Н2O) = 1 – Z(КОН) = 1 – 0,035 = 0,965.
Ответ: Z(КОН) = 0,035 (доли от 1) или 3,5%(мольн.);
Задача 9.
Определите массовые доли веществ в водном растворе Н2SО4, если мольная доля серной кислоты в нем составляет 2,000%.
Дано:
мольная доля Н2SО4 в растворе: Z (Н2SО4)= 2,000%;
Найти:
массовые доли Н2SО4 и Н2О в растворе: 

Решение:
Схематично алгоритм решения можно представить так:
Наиболее удобно выбрать такое количество раствора, в котором n(Н2SО4) + n(Н2О) = 100 моль. В этой порции раствора количество вещества Н2SО4 численно совпадает с мольной долей: nН2SО4= 2 моль.
1. Находим количество вещества воды в выбранной порции
n(Н2О) = 100 моль – 2 моль = 98 моль.
2. Определяем массы Н2SО4 и Н2О по найденным значениям количеств веществ.
m (Н2SО4) = n(Н2SО4) . М(Н2SО4) = 2 . 98 = 196 г.
m(Н2О) = n(Н2О) . М(Н2О) = 98 . 18 = 1764 г.
3. По массам компонентов раствора находим их массовые доли.
Ответ: 

Комментарии;
1 Мольная доля выражена в долях от единицы.
ЗАДАЧИ на Вычисление массы
растворенного вещества
Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе. Элемент ЕГЭ: 4.3.1. Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе».
Расчёты с использованием понятий «растворимость»,
«массовая доля вещества в растворе»
Раствор — это гомогенная система, состоящая из двух или более веществ, содержание которых можно изменять в определенных пределах без нарушения однородности. Растворы состоят из растворителя (например, воды) и растворенного вещества.
Массовой долей растворенного вещества (ω) называют отношение его массы m(В) к массе раствора m(p).
ω(В) = m(В) : m(p)
Это безразмерная величина, поэтому выражается в долях единицы (изменяется от 0 до 1), но иногда выражается в процентах (тогда изменяется от 0 до 100 %).
Обозначение ω(В) аналогично обозначению ω(р. в-ва) или ω(в-ва);
обозначение m(В) аналогично обозначению m(р. в-ва) или m(в-ва);
обозначение m(р) аналогично обозначению m(р-ра),
где р-ра – сокращение слова «раствора», а р. в-ва и в-ва – сокращения слов «растворенного вещества».
Обратите внимание также на следующие обозначения:
m(в) — масса безводного вещества;
m(р-ля) — масса растворителя.
Соотношения между величинами, характеризующими раствор
Следует учитывать, что любой способ выражения содержания растворенного вещества в растворе дается в расчете на безводное вещество, даже если для приготовления раствора использован кристаллогидрат. Если для приготовления растворов используют не безводное вещество, а его кристаллогидрат, B • nH20, то масса растворителя (воды) рассчитывается по формуле: m(H20) = m(р) – m(кр.), где m(кр.) — масса кристаллогидрата, в граммах. Следует учитывать, что количество (моль) кристаллогидрата равно количеству (моль) безводного вещества, т.е. m(кр.) : М(кр.) = m(в) : М(в).
Молярная концентрация характеризует количество растворенного вещества, выраженное, в молях, содержащееся в 1 л раствора. Молярная концентрация вычисляется по формуле С = v / V, где С — молярная концентрация (измеряется в моль/л), v — количество вещества, V — объем раствора, измеренный в литрах. Часто размерность молярной концентрации обозначают символом М. Например, раствор с концентрацией 1 М (одномолярный раствор) содержит 1 моль растворенного вещества в 1л раствора, 0,1 М (децимолярный раствор) — 0,1 моль растворенного вещества в 1 л раствора и т. д.
Титр (Т) определяет массу растворенного вещества (в г), содержащуюся в 1 мл раствора: T = m / V.
Растворимость характеризует способность вещества растворяться в том или ином растворителе. Растворимость обозначается символом S, она равна концентрации насыщенного при данной температуре раствора. Чаще всего растворимость измеряют числом граммов вещества, способных раствориться в 100 г растворителя при данной температуре. Важно не путать растворимость с массовой долей вещества в растворе, так как растворимость показывает, сколько граммов растворенного вещества содержится в 100 г растворителя, а массовая доля — сколько граммов растворенного вещества содержится в 100 г раствора. Растворимость веществ зависит от температуры. Растворимость твердых веществ при повышении температуры, как правило, увеличивается, растворимость газов — уменьшается.
Приготовление растворов. Способы приготовления растворов: 1) Разбавление раствора водой; 2) Выпаривание воды из раствора; 3) Сливание двух растворов; 4) Выпадение кристаллов.
Способы приготовления растворов в задачах на Вычисление массы растворенного вещества
РЕШЕНИЯ ЗАДАЧ с использованием понятий «растворимость»,
«массовая доля вещества в растворе»
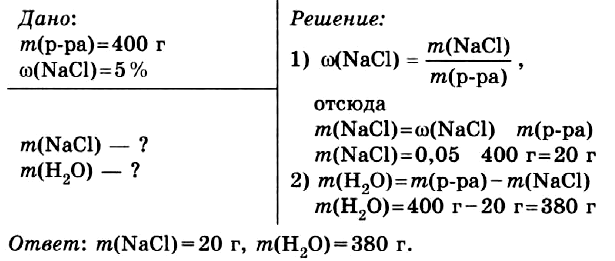
Задача № 1.
Приготовить 400 г водного раствора с массовой долей хлорида натрия в нём 5 %.
Правильный ОТВЕТ: m(NaCl) = 20 г, m(H2O) = 380 г.
Смотреть РЕШЕНИЕ задачи в тетради
Задача № 2.
Найти массовую долю растворённого вещества (в %) в растворе, полученном при смешивании 450 г воды и 50 г сахара.
Правильный ОТВЕТ: ω(сах.) = 10%.
Смотреть РЕШЕНИЕ задачи в тетради
Задача № 3.
Вычислите молярную концентрацию 4%-ного раствора поваренной соли, плотность которого равна 1,027 г/мл.
Правильный ОТВЕТ: C(NaCl) ≈ 0,7 моль/л.
Смотреть РЕШЕНИЯ заданий в тетради

Задача № 4.
Найдите массовую долю гидроксида натрия в растворе, молярная концентрация которого равна 3,08 моль/л, а плотность 1,12 г/мл.
Правильный ОТВЕТ: ω(NaOH) = 11%.
Смотреть РЕШЕНИЯ заданий в тетради

Задача № 5.
При 25 °С растворимость хлорида калия в воде составляет 25 г соли на 100 г воды. Вычислите массовую долю соли в насыщенном растворе и его молярную концентрацию, если плотность насыщенного раствора равна 1,132 г/мл.
Правильный ОТВЕТ: ω(KCl) = 20%, С(KCl) = 3,04 моль/л.
Смотреть РЕШЕНИЯ заданий в тетради
Задача № 6.
Массовая доля соли в растворе, насыщенном при температуре 40 °С, равна 35%. При охлаждении 300 г этого раствора до температуры 10 °С в осадок выпадает 45 г соли. Определите растворимость соли при 10 °С.
Правильный ОТВЕТ: S10°С = 30,77 г.
Смотреть РЕШЕНИЯ заданий в тетради
Задачи с ответами
на Вычисление массы растворенного вещества
Задача № 7.
Масса нитрата калия, которую следует растворить в 150 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%, равна ______. (Записывайте ответ с точностью до десятых.)
Правильный ОТВЕТ: 3,4 г.
Задача № 8.
Плотность 10% -ного раствора хлорида калия составляет 1,063 г/мл. Определите массу (г) хлорида калия, который содержится в 750 мл такого раствора.
Правильный ОТВЕТ: 75,0 г.
Задача № 9.
Рассчитайте массовую долю (%) нитрата натрия в растворе, полученном при смешивании 250 г 10%-ного и 750 г 15%-ного растворов этой соли.
Правильный ОТВЕТ: 13,75 %.
Задача № 10.
Найдите массовую долю гидроксида натрия в растворе, молярная концентрация которого равна 3,08 моль/л, а плотность 1,12 г/мл.
Правильный ОТВЕТ: ω(NaOH) = 11%.
Задача № 11.
В 125 г воды растворили 25 г азотной кислоты. Вычислите титр образовавшегося раствора, если его плотность равна 1,095 г/мл.
Правильный ОТВЕТ: T(HNO3) = 0,182 г/мл.
Задача № 12.
Титр раствора сульфата аммония равен 0,223 г/мл, а его плотность — 1,115 г/мл. Рассчитайте массовую долю сульфата аммония в данном растворе и молярную концентрацию раствора.
Правильный ОТВЕТ: ω((NH4)2SO4) = 20%, C((NH4)2SO4) = 1,689 моль/л.
(с) В учебных целях использованы цитаты из пособий: «Химия / Н. Э. Варавва, О. В. Мешкова. — Москва, Эксмо (ЕГЭ. Экспресс-подготовка)» и «Химия : Новый полный справочник для подготовки к ЕГЭ / Е.В. Савинкина. — Москва, Издательство АСТ».
Вы смотрели Справочник по химии «ЗАДАЧИ на Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе». Выберите дальнейшее действие:
- Перейти к Списку конспектов по химии (по классам)
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
Содержание материала
- В данный момент вы не можете посмотреть или раздать видеоурок ученикам
- Получите невероятные возможности
- Видео
- Нахождение массовой доли вещества в смесях и растворах
- Относительная атомная и молекулярная масса
- Связь с другими способами выражения концентрации
- Вопросы для самопроверки:
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности
1. Откройте доступ ко всем видеоурокам комплекта. 2. Раздавайте видеоуроки в личные кабинеты ученикам. 3. Смотрите статистику просмотра видеоуроков учениками.
Нет, спасибо
Получить доступ
Нахождение массовой доли вещества в смесях и растворах
Массовая доля химического соединения в смеси или растворе определяется по той же формуле, только в числителе будет масса вещества в растворе (смеси), а в знаменателе — масса всего раствора (смеси):
? = (m (в-ва) · m (р-ра)) / 100% .
Следует обратить внимание, что массовая концентрация — это отношение массы вещества к массе всего раствора, а не только растворителя.
Например, растворили 10 г поваренной соли в 200 г воды. Нужно найти процентную концентрацию соли в полученном растворе.
Для определения концентрации соли нам нужна m раствора. Она составляет:
m (р-ра) = m (соли) + m (воды) = 10 + 200 = 210 (г).
Находим массовую долю соли в растворе:
? = ( 10 · 210) / 100% = 4,76%
Таким образом, концентрация поваренной соли в растворе составит 4,76%.
Если в условии задачи дается не m, а объем раствора, то его нужно перевести в массу. Делается это обычно через формулу для нахождения плотности:
p = m / V,
где m — масса вещества (раствора, смеси), а V — его объем.
Такую концентрацию используют чаще всего. Именно ее имеют в виду (если нет отдельных указаний), когда пишут о процентном содержании веществ в растворах и смесях.
Видео
Относительная атомная и молекулярная масса
В формуле нахождения массовой доли мы видим две важные составляющие: относительную массу атома элемента (Ar) и относительную массу молекулы вещества (Mr). Разберемся, что это такое. И та, и другая величина — это отношение реальной массы к эталонной единице, за которую взята 1/12 массы атома углерода.
Относительная атомная масса элемента (Ar) говорит о том, насколько масса его атома больше 1/12 массы атома углерода. Для каждого элемента эта величина является постоянной и ее можно увидеть в таблице Менделеева.
Относительная молекулярная масса соединения (Mr) складывается из относительных атомных масс всех элементов в составе его молекулы. Она показывает, насколько молекула вещества больше 1/12 массы атома углерода.
Это не измеряемые величины, то есть они не имеют единиц измерения. Буква r в обозначениях относительной атомной и молекулярной массы восходит к английскому слову relative — «относительный».
Важно
Численно относительная молекулярная масса вещества равна его молярной массе, что удобно использовать в расчетах. Но путать эти два понятия не стоит. Относительная молекулярная масса характеризует 1 молекулу вещества, в то время как молярная масса — 1 моль вещества.
Связь с другими способами выражения концентрации
Формула перехода от массовой доли к молярности:
где СМ – молярная концентрация раствора моль/л; ρ – плотность раствора, г/л; 
Формула перехода от массовой доли к титру:
где Т – титр раствора г/мл; ρ – плотность раствора, г/мл; 
Вопросы для самопроверки:
-
Как обозначается массовая доля и в чем она выражается?
-
В чем разница между молекулярной массой вещества и его молярной массой?
-
Как найти массовую долю элемента в веществе, если мы знаем массу элемента и массу вещества?
-
Как рассчитать массовую долю вещества в растворе?
-
В каких безразмерных и размерных величинах можно выразить концентрацию раствора?
Теги
Статьи
Линия УМК О. С. Габриеляна. Химия (8-9)
Химия
Массовая доля вещества
Ребятам, впервые пришедшим на урок химии, кажется: «Ух, какой отличный предмет. Столько разноцветных баночек и скляночек в лабораторном ящике. Вот сейчас я как нахимичу, друзья ахнут и выпадут в осадок».
Однако, при виде ровных рядков непонятных формул на доске энтузиазм у ребят испаряется быстрее, чем происходит взгонка кристаллов йода. Если подходить к химии, как к науке, которой нет места в реальной жизни, и просто заучивать ряды формул, то интерес может умереть очень быстро.
10 января 2019
Но все становится намного веселее, если поискать примеры химических реакций вокруг нас.
Костер в летнем походе, сквашивание овощей, изменение вкуса любимых блюд с помощью соли или сахара — это все химия.
Сегодня мы разберем одну из базовых тем «Массовая доля вещества в растворе».
Если хорошо изучить тему и научиться быстро решать задачи, можно не только определить, сколько ложек сахара бабушка добавила в свой чай, но и находить ответы на сложные криминалистические задачи.
Но перед тем, как приступить к практической части, стоит разобраться с теорией.
ОСНОВНЫЕ ТЕРМИНЫ
Основными терминами в этой теме будут:
-
Раствор — однородная смесь различных веществ в жидком виде.
-
Компоненты — вещества, которые подлежат смешиванию для получения раствора.
-
Растворитель — жидкий компонент, к которому добавляют субстанции для получения раствора.
-
Растворенное вещество — твердые или жидкие вещества, которые добавляют к растворителю для получения раствора.
-
Массовая доля — отношение массы вещества к массе раствора, в котором оно содержится.
-
Концентрация — отношение количества растворенного вещества к растворителю, выраженное в процентах.
Когда мы смешиваем между собой жидкости, которые идеально растворяются друг в друге, например воду и спирт, то можем любой из этих компонентов считать растворителем. Однако традиционно в водных растворах вода является растворителем, а второй ингредиент — растворенным веществом.
НЕОБХОДИМЫЕ ФОРМУЛЫ
Массовая доля вещества обозначается буквой греческого алфавита ω — омега. Чтобы ее определить, используется формула для вычисления массовой доли вещества.
ω (в-ва)= m (в-ва)/ m (р-ра) (1)
В этом равенстве массовая доля принимает значение от 0 до 1.
Однако в задачах чаще используется процентное соотношение, которое получается по следующей формуле:
ω (в-ва)= m (в-ва)/ m (р-ра)*100% (2)
Масса раствора равна сумме его компонентов.
m (р-ра)=m (в-ва)+m (р-ля) (3)
В случае двухкомпонентного раствора массовая доля растворенного вещества и массовая доля растворителя в сумме дают 100%
ω (в-ва)+ω (р-ля)=100% (4)
Масса раствора находится сложением масс компонентов, входящих в раствор
m (р-ра)=m (в-ва)+m (р-ля)(5)
Для успешного решения задачи на определение массовой доли вещества в растворе следует вспомнить еще одну формулу, которая связывает массу вещества, его объем и плотность.
m (в-ва)=p(в-ва)*V(в-ва) (6)
Напомним, что плотность воды составляет 1 г/мл. Это значит, что 100 мл воды весит ровно 100 гр.
Если возникает недопонимание теоретической части, более подробно теория изложена в учебнике «Химия. 8 класс» под редакцией О. С. Габриеляна, который можно найти на портале электронных учебников LECTA
#ADVERTISING_INSERT#