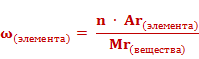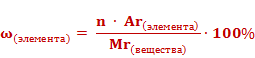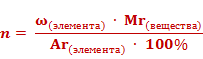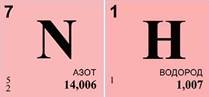Содержание:
- § 1 Массовая доля химического элемента
- § 2 Практическое применение расчетов массовой доли элемента
- § 3 Определение формулы исследуемых веществ
§ 1 Массовая доля химического элемента
Относительную молекулярную массу веществ рассчитывают по химическим формулам, выражающим количественный состав веществ. Используя химические формулы можно также вычислить массовую долю каждого элемента в химическом соединении.
Массовая доля элемента (обозначается латинской буквой ω) показывает, какую часть составляет масса всех атомов данного элемента, содержащихся в одной молекуле вещества,
от общей массы молекулы.
Массовые доли элементов могут быть выражены в долях единицы или в процентах. Формула для расчета массовой доли элемента в веществе выглядит так: массовая доля элемента в веществе (ω) элемента равна отношению произведения числа атомов(n) и относительной атомной массы (Ar) данного элемента к относительной молекулярной массе (Mr) вещества.
Если массовую долю рассчитывать в процентах, то формула приобретет следующий вид.
Используя данную формулу, можно рассчитать массовую долю каждого химического элемента в составе сложного вещества.
Например, попробуем рассчитать массовую долю алюминия в оксиде алюминия (Al2O3).
Для расчетов пользуемся данными периодической системы химических элементов. Определим относительную молекулярную массу оксида алюминия. Она будет равна 102 (сумма двух относительных атомных масс алюминия и трех относительных атомных масс кислорода). Массовая доля алюминия в процентном отношении по формуле составит 53%.
§ 2 Практическое применение расчетов массовой доли элемента
Для чего же нужны такие расчеты? Иногда требуется сравнить содержание элементов в веществах.
Например, геологи открыли два месторождения железа. Первое содержит железо в виде оксида железа FeO, второе – в виде сульфида железа FeS. Какое месторождение богаче железом при прочих одинаковых условиях?
Дано:
Формула оксида железа FeO;
формула сульфида железа – FeS.
Найти:
Массовую долю железа в первом месторождении ω1(Fe) и массовую долю железа во втором месторождении ω2(Fe).
Решение:
1. Записываем формулу для расчета массовой доли железа в первом месторождении: ω1(Fe) в оксиде железа равна отношению произведения числа атомов железа n и относительной атомной массы (Ar) железа к относительной молекулярной массе (Mr) оксида железа, умноженное на 100%.
2. Записываем формулу для расчета массовой доли железа во втором месторождении: ω2(Fe)в сульфиде железа равна отношению произведения числа атомов железа n и относительной атомной массы (Ar) железа к относительной молекулярной массе (Mr) сульфида железа, все умноженное на 100%.
Для расчетов пользуемся данными периодической системы химических элементов.
Число атомов железа, кислорода и серы в обоих соединениях равны 1.
3. Рассчитываем относительную молекулярную массу оксида железа. Она равняется 72.
4. Находим относительную молекулярную массу сульфида железа. Она равняется 88.
5. Массовая доля железа в первом месторождении ω1(Fe) = 78%.
6. Массовая доля железа во втором месторождении ω2(Fe)= 64%.
7. Сравниваем значения массовых долей железа. Массовая доля железа в первом месторождении ω1(Fe) больше, чем массовая доля железа во втором месторождении ω2(Fe).
Ответ: Первое месторождение богаче железом.
§ 3 Определение формулы исследуемых веществ
В химических лабораториях на основе результатов анализа химических соединений определяют формулы исследуемых веществ. При этом решают задачи, обратные предыдущей. Например, можно вывести формулу вещества, зная массовые доли его элементов. Для этого преобразуем формулу массовой доли.
Число атомов элемента (n) равно отношению произведения массовой доли элемента в веществе (ω)элемента и относительной молекулярной массы (Mr) вещества к относительной атомной массе (Ar) данного элемента, умноженной на 100%.
Решим задачу. Экспериментально установлено, что вещество содержит 83% азота и 17% водорода. Какова формула этого вещества, если в результате эксперимента получено значение его относительной атомной массы, равное 17?
Дано:
Массовая доля азота ω(N)=83%, массовая доля водорода ω(Н)=17%, относительная молекулярная масса вещества Mr(NxHy)=17.
Найти:
Формулу вещества NxHy, где «x» — число атомов азота, а «у» – число атомов водорода.
Решение:
1. Найдем число атомов азота — х. Оно равняется отношению произведения массовой доли азота ω(N) и относительной молекулярной массы (Mr) вещества к относительной атомной массе (Ar) азота, умноженной на 100%. Получаем единицу.
2. Найдем число атомов водорода – у. Оно равняется отношению произведения массовой доли водорода ω(Н) и относительной молекулярной массы (Mr) вещества к относительной атомной массе (Ar) водорода, умноженной на 100%. Получаем число 3.
3. Так как х=1, а у=3, то формула вещества — NH3 (индекс 1 не пишется).
Для расчетов пользуемся данными периодической системы химических элементов.
4. Произведем проверку, вычислим относительную молекулярную массу полученного вещества. Она равна сумме относительной атомной массы азота и трех относительных атомных масс водорода. Задача решена правильно.
Ответ:формула вещества — NH3.
Список использованной литературы:
- Н.Е. Кузнецова. Химия. 8 класс. Учебник для общеобразовательных учреждений. – М. Вентана-Граф, 2012.
Утро
большинства людей начинает с чашечки чая или кофе. В чай и кофе они
кладут определённое количество сахара. Содержание растворённого вещества в
растворе в химии называют «концентрацией».
Интересно, что самое большое количество сахара среди овощей и фруктов содержат финики:
на 100 грамм продукта приходится 33,68 грамма белого вещества. Следом, со
значительной разницей, идёт экзотический джекфрут –
9,48 грамм, на третьем месте находится виноград «кишмиш» с 7,2 грамма сахара.
Для выражения
концентрации часто используют массовую долю вещества в растворе.
Масса раствора складывается
из масс растворителя и растворённого вещества:
m (р-ра) = m (р-ля)
+ m (раств. в-ва)
Массовая доля вещества в
растворе равна отношению массы растворённого вещества к массе всего раствора:
Часто понятие
«раствор» мы связываем, прежде всего, с водой, с водными растворами. Есть и
другие растворы, например, спиртовые растворы йода, одеколона, лекарственные
настойки.
Много воды содержится в огурцах,
арбузе; медузы содержат приблизительно 98 % воды, в хлебе – около 40 % воды, а
в молоке – около 75 %.
Выражение нахождения массовой доли очень
похоже на объёмную долю, потому что любая доля – это и есть отношение части к
целому. Массовая доля вещества обозначается буквой ω и в сумме равна 1 или
100 %.
Массовая доля вещества в процентах
численно равна массе растворённого вещества в 100 г раствора. Например, 100 г
5%-го раствора соли означает, что в 100 г раствора
содержится 5 г соли.
Раствор чаще состоит из двух компонентов: растворённого
вещества и растворителя. В жидких растворах растворителем, как
правило, является вода. Растворённым веществом может быть твёрдое вещество,
жидкое и газообразное.
Если в растворе массовая доля
растворённого вещества будет равна 10 %, или 0,1, то массовая доля растворителя
– 90 %, или 0,9.
Решим несколько задач.
Вычислим массовую долю (%) сахара в растворе,
в котором 250 г воды и 50 г сахара.
Из условия задачи известна масса сахара –
растворённого вещества – 50 г и масса воды – растворителя – 250 г. Вычислить
нужно массовую долю сахара. Массовую долю сахара следует находить по отношению
массы растворённого вещества к массе раствора.
Масса раствора складывается из массы
сахара и массы воды, то есть 300 г.
Найдём массовую долю сахара в растворе.
Для этого 50 грамм разделим на 300, получается приблизительно 0,167, или 16,7
%.
Перед посадкой семена томатов
дезинфицируют (протравливают) 1%-м раствором марганцовки. Какую массу такого
раствора можно приготовить из 0,15 г марганцовки?
В условии задачи нам даны массовая доля
марганцовки и масса марганцовки. Найти нужно массу раствора. Зная массу
растворённого вещества и его массовую долю в растворе, можно вычислить массу
раствора. Для этого нужно массу марганцовки разделить на массовую долю, то есть
0,15 г разделить на 0,01.
В медицине широко применяют так называемый
физиологический раствор, который представляет собой раствор поваренной
соли с массовой долей растворённого вещества 0,9 %. Рассчитаем массу соли и
воды, которые необходимо взять для приготовления 1200 г физиологического
раствора.
В условии задачи нам дана массовая доля
растворённого вещества – соли – 0,9 %, или 0,009, масса раствора – 1200 г.
Рассчитать нужно массу соли и воды. Для того, чтобы определить массу соли,
которую нужно взять для приготовления 1200 г физиологического раствора, следует
массу раствора умножить на массовую долю соли.
Определим массу воды, которую необходимо
взять для приготовления раствора. Для этого из массы раствора следует вычесть
массу соли.
Решим ещё одну задачу. Из 250 г 5 %-го раствора питьевой соды выпарили 80 г воды. Найдём
массовую долю соды в полученном растворе.
В условии задачи нам даны масса раствора и
массовая доля растворённого вещества в исходном растворе. А также масса воды,
которую выпарили. Сначала найдём массу питьевой соды, которая была в исходном
растворе, для этого массу раствора следует умножить на массовую долю, то есть
250 умножаем на 0,05, получается 12,5 г.
При выпаривании воды масса растворённого
вещества не изменяется, только уменьшается масса раствора. То есть масса
конечного раствора будет равна 170 г.
Найдём массовую долю питьевой соды в
полученном растворе. Для этого массу вещества разделим на массу полученного
раствора, то есть 12,5 г делим на 170, получаем приблизительно 0,074, или 7,4
%.
Решим более сложную задачу.
Какую массу молока 10%-й жирности и
пломбира 30%-й жирности необходимо взять для приготовления 100 г 20%-го новогоднего коктейля?
В
условии задачи нам даны массовая доля жира в молоке и массовая доля жира в
пломбире, а также масса коктейля и массовая доля жира в нём. Так как масса
конечного раствора (а в нашем случае – это масса коктейля) равна 100 г, пусть
масса молока равна х г, а масса пломбира – (100 – х) г, масса жира в молоке
будет равна 0,1х г, а масса жира в пломбире – 0,3 · (100 – х) г. Чтобы найти
массу жира в коктейле, нужно массу коктейля умножить на массовую долю жира в
нём, значит, 100 умножаем на 0,2, получается 20.
Составляем
следующее выражение, то есть складываем массы жира в молоке и пломбире. При этом
получится суммарная масса жира в коктейле. То есть, решая уравнение, получается
х, равный 50.
То
есть х – это и есть масса молока, а массу пломбира найдём по разности масс
коктейля и молока — также получается 50 г.
Как рассчитать массовую долю вещества видеоурок
Массовая доля элемента в составе вещества
Вычисление массовой доли элементов в веществе
Определение массовых долей элементов в соединениях. 8 класс.
Давайте вспомним ключевые понятия химии, с которыми мы познакомились на предыдущем уроке.
Относительная атомная масса выступает безмерной единицей и отображает, насколько масса атома превышает одну двенадцатую долю массы углерода.
Относительная молекулярная масса является результатом сложения атомных масс элементов, присутствующих в структуре молекул с учетом их индексов.
Химическая формула — фиксация качественного и количественного состава вещества с применением символов элементов.
Задания по химии зачастую требуют расчета количества элемента в веществе или смеси, либо определения доли конкретного элемента.
Доля — отдельная часть от единого. Отображается в виде десятичной дроби либо процента.
При выполнении химических вычислений применяют термин массовая доля. Эта величина характеризует содержание элемента в конкретном веществе.
Массовая доля — значение отношения между массой отдельного элемента и всего вещества.
Отображается греческой буквой ω (омега) и вычисляется по формуле
ω =
Омега соответствует значению массы элемента разделенной на значению массы вещества,
где m(Э) – масса элемента,
m вещества – масса вещества.
Массовая доля является безмерной единицей, ведь в процессе расчета граммы делятся на граммы и сокращаются.
При необходимости отобразить ответ в процентах — следует выполнить умножение полученного значения на 100%. Эта формула используется при отображении исходных данных в граммах.
Массовая доля элемента в веществе равняется значению относительной атомной массы конкретного элемента, перемноженной на численность атомов в молекуле и поделенному на относительную молекулярную массу вещества, помноженному на 100 %.
ω(Э) = * 100%
где ω(Э) — массовая доля элемента,
n — число атомов элемента в молекуле,
Ar — относительная атомная масса элемента,
Mr — относительная молекулярная масса молекулы.
- Определяем относительную молекулярную массу вещества
Молекулярная масса фосфорной кислоты равняется суммарному значению произведения численности атомов водорода, умноженной на относительную атомную массу водорода, численности атомов фосфора, умноженной на относительную атомную массу фосфора и численности атомов кислорода, умноженной на относительную атомную массу кислорода.
Mr(H3PO4) = n(H)*Ar(H)+n(P)*Ar(P)+n(O)*Ar(O)
Mr(H3PO4) = 3*1+1*31+4*16 = 98
Молекулярная масса фосфорной кислоты — 98.
- Рассчитываем массовые доли элементов
ω(Э) = * 100%
Массовая доля элемента рассчитывается как отношение численности атомов отдельного элемента, помноженного на его относительную атомную массу, к относительной молекулярной массе вещества, перемноженной на 100%.
ω(Н) = = *100%
Массовая доля водорода равняется численности атомов водорода в молекуле, перемноженной на относительную атомную массу водорода и разделенной на относительную массу фосфорной кислоты.
Если ответ требуется отобразить в долях, умножать на 100% не нужно.
ω(Н) = *100% = 3,06%
Массовая доля водорода — 3,06 %.
Аналогичным методом определяются массовые доли оставшихся элементов.
Массовая доля фосфора рассчитывается как соотношение численности атомов фосфора в молекуле, перемноженной на относительную атомную массу фосфора к относительной массе фосфорной кислоты.
ω(Р) = = *100% = 31,63%
Массовая доля фосфора — 31,63%
Массовая доля кислорода рассчитывается путем деления произведения численности атомов кислорода в молекуле и относительной атомной массы кислорода на относительную массу фосфорной кислоты.
ω(О) = = *100%= 65,31%
Массовая доля кислорода — 65.31%
- Выполняем проверку — сумма рассчитанных долей элементов должна равняться 100%.
ω(Н)+ ω(Р)+ ω(О) = 100%
3,06%+31,63%+65,31% = 100%
вычисления верны
Ответ: ω=3,06%
ω=31,63%
ω=65,31%