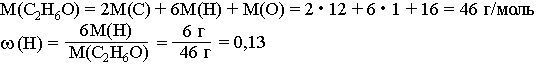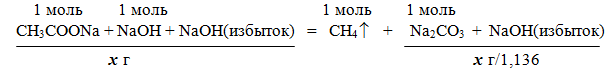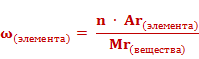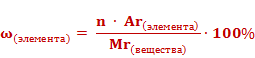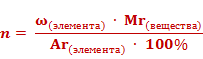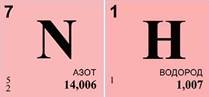Как вычислить массовую долю элемента в веществе
Массовая доля элемента в веществе – это одна из тем, которая входит в курс химии. Навыки и умения по определению этого параметра могут пригодиться при проверке знаний во время контрольных и самостоятельных работ, а также на ЕГЭ по химии.

Вам понадобится
- — периодическая система химических элементов Д.И. Менделеева
Инструкция
Для того что рассчитать массовую долю, необходимо предварительно найдите относительную атомную массу (Ar) искомого элемента, а также относительную молекулярную массу (Mr) вещества. Далее примените формулу, по которой и определяется массовая доля элемента (W)W = Ar (х) / Mr х 100 %, в которойW — массовая доля элемента (измеряется в долях или %);Ar (х) — относительная атомная масса элемента;Mr — относительная молекулярная масса вещества.Для определения относительной атомной и молекулярной массы воспользуйтесь периодической системой химических элементов Д.И. Менделеева. При вычислениях обязательно учитывайте число атомов каждого элемента.
Пример № 1. Определите массовую долю водорода в воде.Найдите по таблице Д.И. Менделеева относительную атомную массу водородаAr (H) = 1. Так как в формуле 2 атома водорода, следовательно, 2Ar (H) = 1 х 2 = 2Вычислите относительную молекулярную массу воды (H2O), которая складывается из 2 Ar (H) и 1 Ar (O).Mr (H2O) = 2Ar (H) + Ar (O)Ar (O) = 16, следовательноMr (H2O) = 1 х 2 + 16 = 18
Запишите общую формулу определения массовой доли элемента W = Ar (х) / Mr х 100 %Теперь запишите формулу, применительно к условию задачиW (H) = 2 Ar (H) / Mr (H2O) х 100 %Сделайте вычисленияW (H) = 2 / 18 х 100 % = 11,1 %
Пример № 2. Определите массовую долю кислорода в сульфате меди (CuSO4).Найдите по таблице Д.И. Менделеева относительную атомную массу кислородаAr (О) = 16. Так как в формуле 4 атома кислорода, следовательно, 4 Ar (О) = 4 х 16 = 64Вычислите относительную молекулярную массу сульфата меди (CuSO4), которая складывается из 1 Ar (Cu), 1 Ar (S) и 4 Ar (O).Mr (CuSO4) = Ar (Cu) + Ar (S) + 4 Ar (O).Ar (Cu) = 64 Ar (S) = 324 Ar (O) = 4 х 16 = 64, следовательноMr (CuSO4) = 64 + 32 + 64 = 160
Запишите общую формулу определения массовой доли элемента W = Ar (х) / Mr х 100 %Теперь запишите формулу, применительно к условию задачиW (О) = 4 Ar (О) / Mr (CuSO4) х 100 %Сделайте вычисленияW (О) = 64 / 160 х 100 % = 40 %
Источники:
- массовая доля элемента в веществе
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Определение массовой доли (ω) вещества
Многие характеристики вещества являются суммой нескольких составляющих, каждая из которых представляет определенную долю от целого.
Математически долю каждой составляющей определяют как частное от деления части на целое (меньшей величины на большую).
Важными характеристиками состава многокомпонентных систем (молекул, смесей веществ, растворов, сополимеровСополимеры – высокомолекулярные соединения, макромолекулы которых содержат два (и более) типа структурных звеньев.) являются массовые, мольные и объёмные доли отдельных компонентов.
Массовая доля компонента (вещества, химического элемента) – содержание компонента в многокомпонентной системе (смеси веществ, растворе, молекуле), определяемое как отношение массы этого компонента к суммарной массе всех компонентов системы.
Таким образом, для нахождения массовой доли вещества в смеси (и решения обратной задачи) служит соотношение:
ω(вещества) = m(вещества) / m(смеси).
Массовую долю элемента в веществе можно определить, используя молярные массы:
ω(элемента) = M(элемента) / M(вещества).
Например, массовая доля водорода ω(H) в этиловом спирте С2Н5ОН вычисляется следующим образом:
Часто долю выражают в процентах. Для этого полученный результат умножают на 100. То есть в данном случае ω(H)=13%. Это означает, что в каждом г (кг, т) С2Н6O содержится 0,13 г (кг, т) водорода или каждые 100 г (кг, т) С2Н6O содержат 13 г (кг, т) водорода.
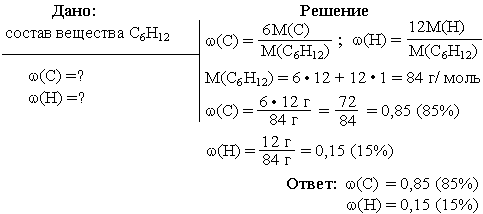
Задача 1. Вычислить массовые доли каждого из элементов, входящих в состав углеводорода, формула которого C6H12.
Задача 2. Из нефти получают бензин (массовая доля его в нефти составляет 25%) и мазут (55%). При дальнейшей переработке мазута получают еще некоторое количество бензина (60% от массы мазута). Рассчитайте массу бензина, который будет получен из нефти массой 200 кг.
Задача 3. Смесь ацетата натрия с избытком гидроксида натрия прокалили. После прокаливания масса сухого остатка оказалась в 1,136 раза меньше массы исходной смеси. Вычислите массовые доли компонентов исходной смеси.
Решение
При сплавлении ацетата натрия CH3COONa с гидроксидом натрия образуется метан CH4 (реакция Дюма).
Уравнение реакции:
Содержание:
- § 1 Массовая доля химического элемента
- § 2 Практическое применение расчетов массовой доли элемента
- § 3 Определение формулы исследуемых веществ
§ 1 Массовая доля химического элемента
Относительную молекулярную массу веществ рассчитывают по химическим формулам, выражающим количественный состав веществ. Используя химические формулы можно также вычислить массовую долю каждого элемента в химическом соединении.
Массовая доля элемента (обозначается латинской буквой ω) показывает, какую часть составляет масса всех атомов данного элемента, содержащихся в одной молекуле вещества,
от общей массы молекулы.
Массовые доли элементов могут быть выражены в долях единицы или в процентах. Формула для расчета массовой доли элемента в веществе выглядит так: массовая доля элемента в веществе (ω) элемента равна отношению произведения числа атомов(n) и относительной атомной массы (Ar) данного элемента к относительной молекулярной массе (Mr) вещества.
Если массовую долю рассчитывать в процентах, то формула приобретет следующий вид.
Используя данную формулу, можно рассчитать массовую долю каждого химического элемента в составе сложного вещества.
Например, попробуем рассчитать массовую долю алюминия в оксиде алюминия (Al2O3).
Для расчетов пользуемся данными периодической системы химических элементов. Определим относительную молекулярную массу оксида алюминия. Она будет равна 102 (сумма двух относительных атомных масс алюминия и трех относительных атомных масс кислорода). Массовая доля алюминия в процентном отношении по формуле составит 53%.
§ 2 Практическое применение расчетов массовой доли элемента
Для чего же нужны такие расчеты? Иногда требуется сравнить содержание элементов в веществах.
Например, геологи открыли два месторождения железа. Первое содержит железо в виде оксида железа FeO, второе – в виде сульфида железа FeS. Какое месторождение богаче железом при прочих одинаковых условиях?
Дано:
Формула оксида железа FeO;
формула сульфида железа – FeS.
Найти:
Массовую долю железа в первом месторождении ω1(Fe) и массовую долю железа во втором месторождении ω2(Fe).
Решение:
1. Записываем формулу для расчета массовой доли железа в первом месторождении: ω1(Fe) в оксиде железа равна отношению произведения числа атомов железа n и относительной атомной массы (Ar) железа к относительной молекулярной массе (Mr) оксида железа, умноженное на 100%.
2. Записываем формулу для расчета массовой доли железа во втором месторождении: ω2(Fe)в сульфиде железа равна отношению произведения числа атомов железа n и относительной атомной массы (Ar) железа к относительной молекулярной массе (Mr) сульфида железа, все умноженное на 100%.
Для расчетов пользуемся данными периодической системы химических элементов.
Число атомов железа, кислорода и серы в обоих соединениях равны 1.
3. Рассчитываем относительную молекулярную массу оксида железа. Она равняется 72.
4. Находим относительную молекулярную массу сульфида железа. Она равняется 88.
5. Массовая доля железа в первом месторождении ω1(Fe) = 78%.
6. Массовая доля железа во втором месторождении ω2(Fe)= 64%.
7. Сравниваем значения массовых долей железа. Массовая доля железа в первом месторождении ω1(Fe) больше, чем массовая доля железа во втором месторождении ω2(Fe).
Ответ: Первое месторождение богаче железом.
§ 3 Определение формулы исследуемых веществ
В химических лабораториях на основе результатов анализа химических соединений определяют формулы исследуемых веществ. При этом решают задачи, обратные предыдущей. Например, можно вывести формулу вещества, зная массовые доли его элементов. Для этого преобразуем формулу массовой доли.
Число атомов элемента (n) равно отношению произведения массовой доли элемента в веществе (ω)элемента и относительной молекулярной массы (Mr) вещества к относительной атомной массе (Ar) данного элемента, умноженной на 100%.
Решим задачу. Экспериментально установлено, что вещество содержит 83% азота и 17% водорода. Какова формула этого вещества, если в результате эксперимента получено значение его относительной атомной массы, равное 17?
Дано:
Массовая доля азота ω(N)=83%, массовая доля водорода ω(Н)=17%, относительная молекулярная масса вещества Mr(NxHy)=17.
Найти:
Формулу вещества NxHy, где «x» — число атомов азота, а «у» – число атомов водорода.
Решение:
1. Найдем число атомов азота — х. Оно равняется отношению произведения массовой доли азота ω(N) и относительной молекулярной массы (Mr) вещества к относительной атомной массе (Ar) азота, умноженной на 100%. Получаем единицу.
2. Найдем число атомов водорода – у. Оно равняется отношению произведения массовой доли водорода ω(Н) и относительной молекулярной массы (Mr) вещества к относительной атомной массе (Ar) водорода, умноженной на 100%. Получаем число 3.
3. Так как х=1, а у=3, то формула вещества — NH3 (индекс 1 не пишется).
Для расчетов пользуемся данными периодической системы химических элементов.
4. Произведем проверку, вычислим относительную молекулярную массу полученного вещества. Она равна сумме относительной атомной массы азота и трех относительных атомных масс водорода. Задача решена правильно.
Ответ:формула вещества — NH3.
Список использованной литературы:
- Н.Е. Кузнецова. Химия. 8 класс. Учебник для общеобразовательных учреждений. – М. Вентана-Граф, 2012.
Напомню общую формулу:
w (э) = x*Ar (э) / Mr (вещества), где
w (э) – массовая доля элемента
x – индекс элемента в формуле вещества
Ar – относительная атомная масса элемента
Mr – относительная молекулярная масса вещества.
w (H) = 2*Ar (H) / Mr (H2O)
Mr (H2O) = 2*Ar (H) + Ar (O) = 2*1 + 16 = 18
w (H) = 2*1 / 18 = 0,1111 = 11,11%
Логично, что w (O) = 100% – w (H)
w (O) = 100 – 11,11 = 88,99 (%)
Ответ: w (H) = 11,11%, w (O) = 88,99%.
1. Почему вода считается самым важным веществом на Земле?
2. Охарактеризуйте физические свойства воды.
3. Укажите правильные ответы. Испарение воды с поверхности рек, озёр, морей это: а) химический процесс; б) физический процесс; в) причина образования облаков; г) причина дождей.
4. Во сколько раз молекула воды тяжелее молекулы водорода и легче молекулы кислорода?
6. Рассчитайте массу воды (кг) в вашем организме, приняв, что её массовая доля в теле человека составляет в среднем 63%.
7. Какие способы вы могли бы предложить для разделения такой однородной смеси, как морская вода?
8. Составьте рассказ на тему «Круговорот воды в природе» по рисунку 97.
9. Какие источник загрязнения природных вод вам известны? Приведите примеры экологических катастроф, вызывающих загрязнение водоёмов.
10. Найдите в учебном пособии два уравнения химических реакций, в результате которых образуется вода. Укажите тип каждой реакции.