Что такое массовая доля в химии? Знаете ли вы ответ? Как находить массовую долю элемента в веществе? Сам процесс вычисления вовсе не так сложен. А вы еще испытываете затруднения в подобных задачах? Тогда вам улыбнулась удача, вы нашли эту статью! Интересно? Тогда скорее читайте, сейчас вы все поймете.
Что такое массовая доля?
Итак, для начала выясним, что такое массовая доля. Как находить массовую долю элемента в веществе, ответит любой химик, так как они часто употребляют этот термин при решении задач или во время пребывания в лаборатории. Конечно, ведь ее расчет — их повседневная задача. Чтобы получить определенное количество того или иного вещества в лабораторных условиях, где очень важен точный расчет и все возможные варианты исхода реакций, необходимо знать всего пару простых формул и понимать суть массовой доли. Поэтому эта тема так важна.
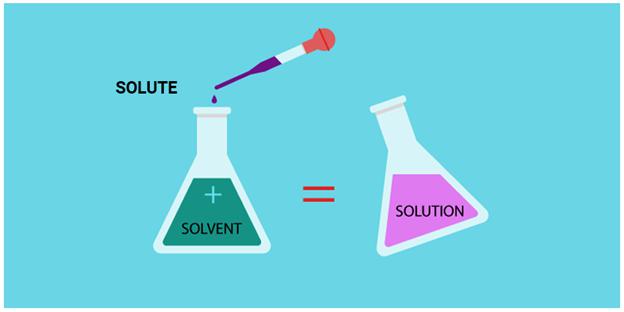
Этот термин обозначается символом “w” и читается как “омега”. Он выражает отношение массы данного вещества к общей массе смеси, раствора или молекулы, выражается дробью или в процентах. Формула расчета массовой доли:
w = m вещества / m смеси.
Преобразуем формулу.
Мы знаем, что m=n*M, где m — масса; n — количество вещества, выраженное в единицах измерения моль; M — молярная масса вещества, выраженная в грамм/моль. Молярная масса численно равна молекулярной. Только молекулярная масса измеряется в атомных единицах масс или а. е. м. Такая единица измерения равна одной двенадцатой доле массы ядра углерода 12. Значение молекулярной массы можно найти в таблице Менделеева.
Количество вещества n нужного объекта в данной смеси, равно индексу, умноженному на коэффициент при данном соединении, что очень логично. Например, чтобы рассчитать количество атомов в молекуле, надо узнать, сколько атомов нужного вещества находится в 1 молекуле = индекс, и умножить это число на количество молекул = коэффициент.
Не стоит бояться таких громоздких определений или формул, в них прослеживается определенная логика, поняв которую, можно даже сами формулы не учить. Молярная масса M равна сумме атомных масс Ar данного вещества. Напомним, что атомная масса — масса 1 атома вещества. То есть исходная формула массовой доли:
w = ( n вещества*M вещества)/m смеси.
Из этого можно сделать вывод, что если смесь состоит из одного вещества, массовую долю которого надо вычислить, то w=1, так как масса смеси и масса вещества совпадают. Хотя смесь априори не может состоять из одного вещества.
Так, с теорией разобрались, но как находить массовую долю элемента в веществе на практике? Сейчас все покажем и расскажем.
Проверка усвоенного материала. Задача легкого уровня
Сейчас мы разберем две задачи: легкого и среднего уровня. Читайте далее!
Необходимо узнать массовую долю железа в молекуле железного купороса FeSO4*7 H2O. Как решить эту задачу? Рассмотрим решение далее.
Решение:
Возьмем 1 моль FeSO4*7 H2O, тогда узнаем количество железа, умножив коэффициент железа на его индекс: 1*1=1. Дан 1 моль железа. Узнаем его массу в веществе: из значения в таблице Менделеева видно, что атомная масса железа 56 а. е. м. = 56 грамм/моль. В данном случае Ar=M. Следовательно, что m железа = n*M = 1 моль* 56 грамм/моль = 56 г.
Теперь нужно найти массу всей молекулы. Она равна сумме масс исходных веществ, то есть 7 моль воды и 1 моль сульфата железа.
m= (n воды* M воды) + (n сульфата железа*M сульфата железа) = (7 моль*(1*2+16) грамм/моль) + (1 моль* (1 моль*56 грамм/моль+1 моль*32 грамм/моль + 4 моль*16 грамм/моль) = 126+152=278 г.
Остается лишь разделить массу железа на массу соединения:
w=56г/278 г=0.20143885~0.2=20%.
Ответ: 20%.
Задача среднего уровня
Решим более сложную задачу. В 500 г воды растворено 34 г нитрата кальция. Нужно найти массовую долю кислорода в полученном растворе.
Решение
Так как при взаимодействии Ca(NO3)2 с водой идет только процесс растворения, а из раствора не выделяются продукты реакции, масса смеси равна сумме масс нитрата кальция и воды.
Нам нужно найти массовую долю кислорода в растворе. Обратим внимание на то, что кислород содержится как в растворенном веществе, так и в растворителе. Найдем количество искомого элемента в воде. Для этого посчитаем моль воды по формуле n=m/M.
n воды=500 г/(1*2+16) грамм/моль=27.7777≈28 моль
Из формулы воды H2O найдем, что количество кислорода = количеству воды, то есть 28 моль.
Теперь найдем количество кислорода в растворенном Ca(NO3)2. Для этого узнаем количество самого вещества:
n Ca(NO3)2=34 г/(40*1+2*(14+16*3)) грамм/моль≈0.2 моль.
n Ca(NO3)2 относится к n O как 1 к 6, что следует из формулы соединения. Значит, n O = 0.2 моль*6 = 1.2 моль. Суммарно количество кислорода равно 1.2 моль+28 моль=29.2 моль
m O= 29.2 моль*16 грамм/моль=467.2 г.
m раствора=m воды + m Ca(NO3)2= 500 г+34 г=534 г.
Осталось только само вычисление массовой доли химического элемента в веществе:
w O=467.2 г /534 г≈0.87=87%.
Ответ: 87%.
Надеемся, что мы понятно объяснили вам то, как находить массовую долю элемента в веществе. Данная тема вовсе не сложная, если в ней хорошо разобраться. Желаем вам удачи и успехов в будущих начинаниях.
1. Массовую долю элемента в веществе рассчитывают по формуле:
.
2. Если имеется (1) моль вещества, то его масса равна
.
3. (1) моль вещества содержит (x) моль элемента. Поэтому масса элемента, содержащегося в веществе, равна
m(эл.)=n(эл.)⋅M(эл.)=xмоль⋅Mг/моль
.
4. Подставив массу элемента и массу вещества в формулу ((1)), получим формулу ((2)), которой и воспользуемся для вычисления:
w(эл.)=xмоль(эл.)⋅Mг/моль(эл.)1моль⋅M г/моль(вещества)⋅100
.
Пример:
таким образом, например, расчёт массовой доли углерода в оксиде углерода((IV)) должен выглядеть так:
1. по формуле вещества видно, что (1) моль
CO2
содержит (1) моль химического элемента (C).
2. Если имеется (1) моль
CO2
, то его масса равна
.
3. А (1) моль элемента (C) имеет массу
.
4. Таким образом, массовая доля элемента (C) в
CO2
равна
27,3
%
.
Статьи
Линия УМК О. С. Габриеляна. Химия (8-9)
Химия
Массовая доля вещества
Ребятам, впервые пришедшим на урок химии, кажется: «Ух, какой отличный предмет. Столько разноцветных баночек и скляночек в лабораторном ящике. Вот сейчас я как нахимичу, друзья ахнут и выпадут в осадок».
Однако, при виде ровных рядков непонятных формул на доске энтузиазм у ребят испаряется быстрее, чем происходит взгонка кристаллов йода. Если подходить к химии, как к науке, которой нет места в реальной жизни, и просто заучивать ряды формул, то интерес может умереть очень быстро.
10 января 2019
Но все становится намного веселее, если поискать примеры химических реакций вокруг нас.
Костер в летнем походе, сквашивание овощей, изменение вкуса любимых блюд с помощью соли или сахара — это все химия.
Сегодня мы разберем одну из базовых тем «Массовая доля вещества в растворе».
Если хорошо изучить тему и научиться быстро решать задачи, можно не только определить, сколько ложек сахара бабушка добавила в свой чай, но и находить ответы на сложные криминалистические задачи.
Но перед тем, как приступить к практической части, стоит разобраться с теорией.
ОСНОВНЫЕ ТЕРМИНЫ
Основными терминами в этой теме будут:
-
Раствор — однородная смесь различных веществ в жидком виде.
-
Компоненты — вещества, которые подлежат смешиванию для получения раствора.
-
Растворитель — жидкий компонент, к которому добавляют субстанции для получения раствора.
-
Растворенное вещество — твердые или жидкие вещества, которые добавляют к растворителю для получения раствора.
-
Массовая доля — отношение массы вещества к массе раствора, в котором оно содержится.
-
Концентрация — отношение количества растворенного вещества к растворителю, выраженное в процентах.
Когда мы смешиваем между собой жидкости, которые идеально растворяются друг в друге, например воду и спирт, то можем любой из этих компонентов считать растворителем. Однако традиционно в водных растворах вода является растворителем, а второй ингредиент — растворенным веществом.
НЕОБХОДИМЫЕ ФОРМУЛЫ
Массовая доля вещества обозначается буквой греческого алфавита ω — омега. Чтобы ее определить, используется формула для вычисления массовой доли вещества.
ω (в-ва)= m (в-ва)/ m (р-ра) (1)
В этом равенстве массовая доля принимает значение от 0 до 1.
Однако в задачах чаще используется процентное соотношение, которое получается по следующей формуле:
ω (в-ва)= m (в-ва)/ m (р-ра)*100% (2)
Масса раствора равна сумме его компонентов.
m (р-ра)=m (в-ва)+m (р-ля) (3)
В случае двухкомпонентного раствора массовая доля растворенного вещества и массовая доля растворителя в сумме дают 100%
ω (в-ва)+ω (р-ля)=100% (4)
Масса раствора находится сложением масс компонентов, входящих в раствор
m (р-ра)=m (в-ва)+m (р-ля)(5)
Для успешного решения задачи на определение массовой доли вещества в растворе следует вспомнить еще одну формулу, которая связывает массу вещества, его объем и плотность.
m (в-ва)=p(в-ва)*V(в-ва) (6)
Напомним, что плотность воды составляет 1 г/мл. Это значит, что 100 мл воды весит ровно 100 гр.
Если возникает недопонимание теоретической части, более подробно теория изложена в учебнике «Химия. 8 класс» под редакцией О. С. Габриеляна, который можно найти на портале электронных учебников LECTA
#ADVERTISING_INSERT#
|
Конечно в вопросе нужно было бы уточнить массовую долю чего и в чем, так как есть много вариантов. Попробую описать основные из них. Находим массовую долю какого-либо вещества: Можно так же найти массовую долю раствора — вот как: автор вопроса выбрал этот ответ лучшим Чтобы понять и уметь находить массовую долю чего бы там не было, следует прежде всего вспомнить что такое доля. Доля — это часть от целого и обычно она считается либо в процентах, либо отношением. Например четверть — это четвертая часть целого, это доля. Если же речь идет о массе, то в этом случае четвертая часть уже будет массовой долью. Например мы хотим найти сколько воды в человеке массой 100 килограмм. Зная, что человеческое тело содержит примерно 90% воды, мы находим что воды в человеке 90/100, или 0.9 — это и есть массовая доля воды в человеческом организме. То есть в общем случае мы имеем формулу: Для растворов она примет вид: Я вам расскажу своими словами, так чтобы вы поняли: Массовая доля вещества — это та часть, которую занимает определенной вещество в общей массе. То есть для примера: торт весит 1 килограмм , а крема в нем 0.5 килограмм, то есть массовая доля крема в тортике равна 50%. Это выходя с того, что массовая доля= масса основного вещества/общая масса всего продукта. Это же относится и к химическим растворам и реактивам. Знаете ответ? |
Как найти массовую долю вещества
Людям в зависимости от рода их профессии приходится сталкиваться с растворами, имеющими строго заданное содержание в них растворенного вещества: приготовление лекарственных растворов, растворение проявителя для фотографий, раствор для аккумулятора с содержанием серной кислоты и т.д. Поэтому на уроках химии школьники с помощью задач учатся рассчитывать массовую долю растворенных веществ – отношение массы растворенного вещества к общей массе раствора.
Инструкция
Прочитайте внимательно задачу. Кратко с левой стороны страницы запишите ее данные с использованием буквенных обозначений и формул химических веществ, если они есть. Определите из вопроса задачи, что нужно найти.
Запишите с правой стороны листа общую формулу массовой доли растворенного вещества
ω = m1 / m,
где m1 – масса растворенного вещества, а m – масса всего раствора.
Если содержание массовой доли растворенного вещества нужно узнать в процентах, умножьте полученное число на 100%:
ω = m1 / m х 100%
В задачах, где нужно вычислить массовые доли каждого из элементов, входящих в состав химического вещества, используйте таблицу Д.И. Менделеева. Например, узнайте массовые доли каждого из элементов, входящих в состав углеводорода, формула которого C6H12
m (C6H12) = 6 х 12 + 12 х 1= 84 г/моль
ω (С) = 6 m1(С) / m (C6H12) х 100% = 6 х 12 г / 84 г/моль х 100% = 85%
ω (Н) = 12 m1(Н) / m (C6H12) х 100% = 12 х 1 г / 84 г/моль х 100% = 15%
Полезный совет
Задачи на нахождение массовой доли вещества после упаривания, разбавления, концентрирования, смешивания растворов решайте с помощью формул, полученных из определения массовой доли. Например, задачу на упаривание можно решить с помощью такой формулы
ω 2= m1 / (m – Dm) = (ω 1• m) / (m – Dm), где ω 2 – массовая доля вещества в упаренном растворе, Dm — разница между массами до нагревания и после.
Источники:
- как определить массовую долю вещества
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.