Расчетные задачи типа «Определение выхода продукта реакции в процентах от теоретического»
Признак
В условии задачи встречается слово «выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём, практическая масса или объём» могут быть использованы только для веществ-продуктов.
Доля выхода продукта обозначается буквой
(эта), измеряется в процентах или долях.
Также для расчётов может использоваться количественный выход:
I. Первый тип задач
Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
| 1. Записываем краткое условие задачи |
Дано: m (Mg) = 1,2 г m практическая(MgSO4) = 5,5 г _____________________ Найти: |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(Mg) = 24 г/моль M(MgSO4) = 24 + 32 + 4 · 16 = 120 г/моль |
|
4. Находим количество вещества реагента по формулам |
ν(Mg) = 1,2 г / 24(г/моль) = 0,05 моль |
| 5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
m = ν · M mтеор (MgSO4) = M(MgSO4) · νтеор (MgSO4) = = 120 г/моль · 0,05 моль = 6 г |
|
6. Находим массовую (объёмную) долю выхода продукта по формуле |
Ответ: Выход сульфата магния составляет 91,7% по сравнению с теоретическим |
II. Второй тип задач
Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
|
1. Записываем краткое условие задачи |
Дано: m(CaO) = 16,8 г
___________________ Найти: m практ (CaC2) = ? |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
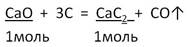 |
|
3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(CaO) = 40 + 16 = 56 г/моль M(CaC2) = 40 + 2 · 12 = 64г/моль |
|
4. Находим количество вещества реагента по формулам |
ν(CaO)=16,8 (г) / 56 (г/моль) = 0,3 моль |
|
5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
|
|
6. Находим массовую (объёмную) долю выхода продукта по формуле |
m практич (CaC2) = 0,8 · 19,2 г = 15,36 г Ответ: m практич (CaC2) = 15,36 г |
III. Третий тип задач
Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
| 1. Записываем краткое условие задачи |
Дано: н. у. Vm = 22,4 л/моль Vпрактич(CO2) = 28,56 л = 85% или 0,85 ____________________ Найти: m(Na2CO3) =? |
| 2. Находим по ПСХЭ молярные массы веществ, если это необходимо | M (Na2CO3) =2·23 + 12 + 3·16 = 106 г/моль |
|
3. Вычисляем теоретически полученный объём (массу) и количество вещества продукта реакции, используя формулы: |
Vтеоретич(CO2) = = 28,56 л / 0,85 = 33,6 л ν(CO2) = 33,6 (л) / 22,4 (л/моль) = 1,5 моль |
|
4. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 5. Находим количество вещества реагента по УХР |
По УХР:
ν(Na2CO3) = ν(CO2) = 1,5 моль |
|
6. Определяем массу (объём) реагента по формуле: m = ν · M V = ν · Vm |
m = ν · M m(Na2CO3) = 106 г/моль · 1,5 моль = 159 г |
IV. Решите задачи
Задача №1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
Задача №2. Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95 %.
Задача №3. Определите, какая масса меди вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3 л (н.у.), если выход оксида серы (IV) составляет 90%.
Задача №4. К раствору, содержащему хлорид кальция массой 4,1 г, прилили раствор, содержащий фосфат натрия массой 4,1 г. Определите массу полученного осадка, если выход продукта реакции составляет 88 %.
Задачи на массовую долю вещества в растворе
13-Фев-2013 | комментария 22 | Лолита Окольнова
Задачи на массовую долю вещества в растворе
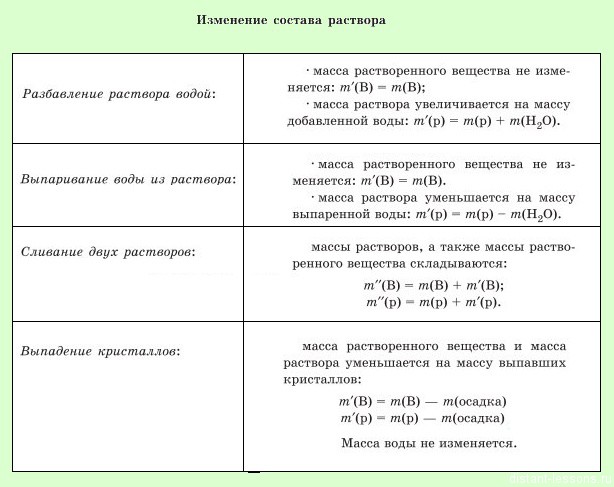
Есть очень простая формула массовой доли — масса части разделить на массу целого, но в задачах на нахождение массовой доли в растворах есть несколько небольших, но очень существенных нюансов.
Давайте рассмотрим несколько примеров задач на эту тему.
1. Выделение газа из среды реакции:
В задачу закралась опечатка — дан нитрат калия, а получают карбонат натрия… давайте сделаем расчет на натрий.
Запишем реакцию: Na2CO3 + 2HNO3 = 2NaNO3 + CO2↑ + H2O
В результате реакции выделяется углекислый газ — CO2. Обозначим массу полученной соли m,
n(NaNO3)= mMr = m 85 моль.
Тогда, по уравнению реакции количество азотной кислоты будет равно количеству соли:
n(HNO3) = n (NaNO3)= m 85 моль.
m(HNO3)= Mr•n = 63 •m 85 г
Это количество вещества, вступившего в реакцию, нам дано, что это количество соответствует 6.3 %, значит, масса 100% — масса раствора азотной кислоты равна 63 •m •100(6.3 •85) г
Формула массовой доли вещества в растворе:
m(вещества)=m(NaNO3)=63 •m 85 гА масса всего раствора будет слагаться из масс реагентов и надо вычесть массу выделившегося газа:
m( раствора HNO3) + m(Na2CO3)- m(CO2)
m(раствора)= 63 •m •100(6.3 •85) + 106• m 2•85 — 44•m 2•85 = 1031•m85 г
w=m(HNO3) m(раствора) =63 •m 1031• m = 0,0611 или 6.11%
Важно понимать, что происходит при протекании заданной реакции — если выделяется газ, то он уходит из среды раствора, значит, при вычислении массовой доли надо вычесть массу газа из массы раствора.
2. Выпадение осадка:
Реакция: NaCl + AgNO3 = AgCl↓ + NaNO3
В ходе реакции выпадает осадок, значит, при расчете массовой доли, надо будет вычесть массу осадка из массы раствора.
m(NaCl)= m(раствора) • w = 117 • 0.05 = 5,85 г
n(NaCl)= mMr=5,8558,5=0.1 моль
m(AgNO3)=m(раствора) • w=127.5 • 0.02 = 2,55 г
n(AgNO3)= mMr=2,55170 = 0,015 моль
Т.к. количество молей двух реагентов не одинаковое, то надо решить, какое вещество дано в недостатке и по этому количеству молей рассчитать количество полученной соли.
NaCl + AgNO3 = AgCl↓ + NaNO3
0.1 моль 0.015 моль -> 0.015 моль
Очевидно, что хлорид натрия у нас в избытке, значит, считаем по нитрату серебра — n(AgCl)=n(AgNO3 )=0.015 моль.
m(AgCl)=n•Mr=0.015•143,5=2,1525 г
Этот осадок уйдет из раствора, поэтому при вычислении массовой доли это число надо вычесть из массы раствора:
m(раствора) = m(раствора NaCl) + m(раствора AgNO3) — m(AgCl) = 117+127.5-2,1525=242,3475 г
Находим массовую долю вещества в растворе:
w=m(NaNO3) m(раствора)=1.275242,3475 = 0,00526 или 0.526%
Обсуждение: «Задачи на массовую долю вещества в растворе»
(Правила комментирования)
Задачи на выход продукта химической реакции. Как решать задачи на выход продукта реакции. Что такое выход продукта химической реакции. Теоретическое и практическое количество продукта химической реакции.
При решении задач на расчеты по уравнениям химических реакций мы принимаем, что в ходе реакции образуется точно рассчитанное количество продукта, исходя из мольного соотношения реагентов и продуктов. Количество продукта реакции, которое должно получится из реагентов согласно стехиометрическим расчетам — это теоретическое количество (масса, объем) или теоретический выход продукта реакции nтеор.
Однако на практике это соотношение не выполняется, и в большинстве случаев образуется меньшее количество продукта реакции, чем было рассчитано — практическое количество (масса, объем) или практический выход продукта реакции nпр.
Практический и теоретический выход не совпадают в силу разных причин — неэффективные соударения реагирующих частиц, побочные процессы, потери в ходе проведения реакции и т.д.
Обратите внимание! Понятия теоретического или практического количества реагента не существует. Ведь мы всегда берем определенное количество реагентов. А вот вступать в реакцию не полностью реагенты могут.
Массовая (мольная, объемная) доля выхода продукта реакции η или ω — это соотношение массы (количества вещества, объема) продукта, которая практически получена в ходе реакции, mпр., к массе (количеству, объему) продукта, которая рассчитана теоретически, mтеор.:
η = mпр./mтеор.
Массовую (мольную, объемную) долю выхода продукта реакции можно выражать в долях, а можно в процентах:
η = mпр./mтеор.·100%
Рассмотрим несколько задач на определение и использование выхода продукта реакции.
1. Какое количество вещества аммиака получится при действии избытка раствора гидроксида натрия на 500 г сульфата аммония, если выход в данной реакции 70%?
Решение.
2NaOH + (NH4)2SO4 = Na2SO4 + 2NH3 + 2H2O
Количество вещества сульфата аммония:
n((NH4)2SO4) = m/M = 500/132 = 3,79 моль
Теоретическое количество аммиака:
nтеор.(NH3) = 2·n((NH4)2SO4) = 2·3,79 = 7,58 моль
Зная мольную долю выхода продукта реакции, определим практический выход аммиака:
nпр.(NH3) = η·nтеор.(NH3) = 0,7·7,58 = 5,3 моль
Ответ: nпр.(NH3) = 5,3 моль
2. При хлорировании метана объемом 112 л (н. у.) получен дихлорметан массой 255 г. Определите долю выхода дихлорметана.
Решение.
CH4 + 2Cl2 = CH2Cl2 + 2HCl
Количество вещества метана:
n(CH4) = V/Vm = 112/22,4 = 5 моль
Теоретическое количество дихлорметана:
nтеор.(CH2Cl2) = n(CH4) = 5 моль
mтеор.(CH2Cl2) = M·nтеор.(CH2Cl2) = 85 г/моль·5 моль = 425 г
Масса дихлорметана, которая приведена в условии задачи — это практический выход дихлорметана.
Доля выхода дихлорметана:
η = mпр./mтеор. = 255/425 = 0,6 или 60%
Ответ: выход продукта реакции 60%
3. Определите массу оксида меди (II), которая потребуется для получения 500 г нитрата меди, если доля выхода в реакции взаимодействия оксида меди с HNO3 составляет 92%?
4. Определите объем (н.у., л) аммиака, который получится при действии избытка раствора гидроксида натрия на 48 г карбоната аммония, если выход в реакции составляет 70%?
5. Определите массу соли, г, которая образуется при растворении в избытке азотной кислоты 80 г оксида меди (II), если выход в реакции составляет 80%?
6. При термическом разложении 1700 г нитрата натрия было получено 174,4 л кислорода (н.у.). Определите массовую долю выхода в этой реакции.
7. Рассчитайте массу оксида магния, которая образуется при разложении гидроксида магния массой 50 г, если реакция разложений прошла с выходом 95,5%.
8. Какая масса бензола (кг) может получиться из 369,6 м3 (н.у.) ацетилена, если доля выхода бензола составила 65% от теоретически возможного?
9. Определите массу спирта, полученного при гидратации 40 л пропилена (н.у.), если доля выхода продукта реакции составляет 65% от теоретически возможного.
10. Определите долю выхода в реакции каталитического окисления аммиака кислородом, если при окислении 10 моль аммиака образуется 200 л оксида азота (II) при н.у.?
11. Пары брома объемом 20 л смешали с избытком водорода, в результате из смеси выделили 32 л бромоводорода. Определите долю выхода, %, если объемы газов измерялись при одинаковых условиях.
12. Оксид кальция массой 0,64 кг нагрели до 1200° С с достаточной массой оксида кремния (IV). Масса образовавшегося силиката кальция оказалась равной 1,024 кг. Определите выход (%) реакции соединения.
13. Из 36 г метанола было получено 24 г диметилового эфира. Рассчитайте выход реакции дегидратации
14. Углекислый газ объемом 6 л (н.у.) пропустили над раскалённым углем, продукт реакции пропустили через избыток известковой воды, после чего собрали 7,2 л (н.у.) газа. Определите степень превращения углекислого газа, %.
15. Определите массу, г нитрата аммония, которая содержалась в растворе, если при действии на этот раствор избытка гидроксида кальция выделилось 6 г аммиака. Реакция прошла с выходом 88,2 %.
16. При термическом разложении не загрязненного примесями карбоната кальция образовалось 20 г оксида кальция. Известно, что реакция прошла с выходом 85%. Вычислите массу карбоната кальция, взятого для проведения реакции разложений и объем (н.у.) образовавшегося углекислого газа.
17. Какой объем пропана (н.у.) потребуется для получения 42 г пропена, если доля выхода продуктов реакции составляет 60% от теоретически возможного?
18. При бромировании пентена-2 массой 8,4 г получен 2,3-дибромпентан массой 24,3 г. Определите долю выхода продукта реакции.
19. Из 69 г этанола получен бутадиен-1,3 массой 36,85 г. Определите массовую долю выхода продукта реакции.
20. При бромировании 5,4 г дивинила избытком брома образуется 28,2 г 1,2,3,4-тетрабромбутана. Определите выход продукта реакции.
21. Определите, какая масса 2-метилбутана необходима для получения 46,24 г изопрена, если доля выхода продукта реакции составляет 85%?
22. Определите объем метана, который потребуется для получения 63 л ацетилена (н.у.), если доля выхода продуктов реакции составляет 70% от теоретически возможного.
23. Определите, какую массу уксусного альдегида можно получить по реакции Кучерова из 11,2 л ацетилена (н. у.), если доля выхода продуктов реакции составляет 80% от теоретически возможного?
24. При действии избытка воды на 48 г технического карбида кальция, содержащего 10% примесей, образовался ацетилен объемом 10,08 л (н.у.). Определите долю выхода продукта реакции.
25. Определите массу технического карбида алюминия, содержащего 7% примесей, необходимого для получения 56 л метана (н.у.), если доля выхода продуктов реакции составляет 70% от теоретически возможного.
26. Из 179,2 л бутана (н.у.) с объемной долей примесей 25% двухстадийным синтезом получен бутанол-2 массой 159,84 г. Доли выхода продуктов на первой и второй стадиях одинаковы. Определите доли выхода продуктов реакций.
27. Циклогексан массой 16 г сожгли в избытке кислорода и полученный углекислый газ пропустили через избыток раствора гидроксида кальция, в результате чего выпал осадок массой 90 г. Определите массовую долю негорючих примесей в циклогексане, если доля выхода продуктов горения составляет 90% от теоретически возможного.
28. При нитровании 46,8 г бензола получен нитробензол массой 66,42 г. Определите выход продуктов реакции.
При обучении учащихся решению расчётных задач
по химии учителя сталкиваются с рядом проблем
- решая задачу, учащиеся не понимают сущности
задач и хода их решения; - не анализируют содержание задачи;
- не определяют последовательность действий;
- неправильно используют химический язык,
математические действия и обозначение
физических величин и др.;
Преодоление этих недостатков является одной из
главных целей, который ставит перед собой
учитель, приступая к обучению решению расчетных
задач.
Задача учителя состоит в том, чтобы научить
учащихся анализировать условия задач, через
составление логической схемы решения конкретной
задачи. Составление логической схемы задачи
предотвращает многие ошибки, которые допускают
учащиеся.
Цели урока:
- формирование умения анализировать условие
задачи; - формирование умения определять тип расчетной
задачи, порядок действий при ее решении; - развитие познавательных, интеллектуальных и
творческих способностей.
Задачи урока:
- овладеть способами решения химических задач с
использованием понятия “массовая доля выхода
продукта реакции от теоретического”; - отработать навыки решения расчетных задач;
- способствовать усвоению материала, имеющего
отношение к производственным процессам; - стимулировать углубленное изучение
теоретических вопросов, интерес к решению
творческих задач.
Ход урока
Определяем причину и сущность ситуации,
которые описываются в задачах “на выход
продукта от теоретического”.
В реальных химических реакциях масса продукта
всегда оказывается меньше расчетной. Почему?
- Многие химические реакции обратимы и не доходят
до конца. - При взаимодействии органических веществ часто
образуются побочные продукты. - При гетерогенных реакциях вещества плохо
перемешиваются, и часть веществ просто не
вступает в реакции. - Часть газообразных веществ может улетучиться.
- При получении осадков часть вещества может
остаться в растворе.
Вывод:
- масса теоретическая всегда больше
практической; - объём теоретический всегда больше объёма
практического.
Теоретический выход составляет 100%,
практический выход всегда меньше 100%.
Количество продукта, рассчитанное по уравнению
реакции, — теоретический выход, соответствует 100%.
Доля выхода продукта реакции ( — “этта”) — это отношение
массы полученного вещества к массе, которая
должна была бы получиться в соответствии с
расчетом по уравнению реакции.
Три типа задач с понятием “выход продукта”:
1. Даны массы исходного вещества и продукта
реакции. Определить выход продукта.
2. Даны массы исходного вещества и выход продукта
реакции. Определить массу продукта.
3. Даны массы продукта и выход продукта.
Определить массу исходного вещества.
Задачи.
1. При сжигании железа в сосуде, содержащем 21,3 г
хлора, было получено 24,3 г хлорида железа (III).
Рассчитайте выход продукта реакции.
2. Над 16 г серы пропустили водород при
нагревании. Определите объем (н.у.) полученного
сероводорода, если выход продукта реакции
составляет 85% от теоретически возможного.
3. Какой объём оксида углерода (II) был взят для
восстановления оксида железа (III), если получено
11,2г железа с выходом 80% от теоретически
возможного.
Анализ задач.
Каждая задача складывается из совокупности
данных (известные вещества) – условия задачи
(“выход” и т.п.) – и вопроса (вещества, параметры
которых требуется найти). Кроме этого, в ней есть
система зависимостей, которые связывают искомое
с данными и данные между собой.
Задачи анализа:
1) выявить все данные;
2) выявить зависимости между данными и
условиями;
3) выявить зависимости между данным и искомым.
Итак, выясняем:
1. О каких веществах идет речь?
2. Какие изменения произошли с веществами?
3. Какие величины названы в условии задачи?
4. Какие данные – практические или
теоретические, названы в условии задачи?
5. Какие из данных можно непосредственно
использовать для расчётов по уравнениям реакций,
а какие необходимо преобразовать, используя
массовую долю выхода?
Алгоритмы решения задач трёх типов:
Определение выхода продукта в % от теоретически
возможного.
1. Запишите уравнение химической реакции и
расставьте коэффициенты.
2. Под формулами веществ напишите количество
вещества согласно коэффициентам.
3. Практически полученная масса известна.
4. Определите теоретическую массу.
5. Определите выход продукта реакции (%), отнеся
практическую массу к теоретической и умножив на
100%.
6. Запишите ответ.
Расчет массы продукта реакции, если известен
выход продукта.
1. Запишите “дано” и “найти”, запишите
уравнение, расставьте коэффициенты.
2. Найдите теоретическое количество вещества
для исходных веществ. n =
3. Найдите теоретическое количество вещества
продукта реакции, согласно коэффициентам.
4. Вычислите теоретические массу или объем
продукта реакции.
m = M * n или V = Vm * n
5. Вычислите практические массу или объем
продукта реакции (умножьте массу теоретическую
или объем теоретический на долю выхода).
Расчет массы исходного вещества, если известны
масса продукта реакции и выход продукта.
1. По известному практическому объёму или массе,
найдите теоретический объём или массу (используя
долю выхода продукта).
2. Найдите теоретическое количество вещества
для продукта.
3. Найдите теоретическое количество вещества
для исходного вещества, согласно коэффициентам.
4. С помощью теоретического количества вещества
найдите массу или объем исходных веществ в
реакции.
Домашнее задание.
Решите задачи:
1. Для окисления оксида серы (IV) взяли 112 л (н.у.)
кислорода и получили 760 г оксида серы (VI). Чему
равен выход продукта в процентах от теоретически
возможного?
2. При взаимодействии азота и водорода получили
95 г аммиака NH3 с выходом 35%. Какие объёмы
азота и водорода были взяты для реакции?
3. 64,8 г оксида цинка восстановили избытком
углерода. Определите массу образовавшегося
металла, если выход продукта реакции равен 65%.
Решение расчётных задач на
тему:
«
Массовая и объёмная доля выхода продукта реакции от теоретически возможного».
При обучении учащихся решению расчётных задач по химии учителя
сталкиваются с рядом проблем
·
решая задачу, учащиеся не понимают сущности задач и
хода их решения;
·
не анализируют содержание задачи;
·
не определяют последовательность действий;
·
неправильно используют химический язык,
математические действия и обозначение физических величин и др.;
Преодоление этих недостатков является одной из главных целей, который
ставит перед собой учитель, приступая к обучению решению расчетных задач.
Задача учителя состоит в том, чтобы научить учащихся анализировать
условия задач, через составление логической схемы решения конкретной задачи.
Составление логической схемы задачи предотвращает многие ошибки, которые
допускают учащиеся.
Цели урока:
·
формирование умения анализировать условие задачи;
·
формирование умения определять тип расчетной
задачи, порядок действий при ее решении;
·
развитие познавательных, интеллектуальных и
творческих способностей.
Задачи урока:
·
овладеть способами решения химических задач с
использованием понятия “массовая доля выхода продукта реакции от
теоретического”;
·
отработать навыки решения расчетных задач;
·
способствовать усвоению материала, имеющего
отношение к производственным процессам;
·
стимулировать углубленное изучение теоретических
вопросов, интерес к решению творческих задач.
Ход урока
Определяем причину и сущность ситуации, которые описываются в задачах
“на выход продукта от теоретического”.
В реальных химических реакциях масса продукта всегда оказывается меньше
расчетной. Почему?
·
Многие химические реакции обратимы и не доходят до
конца.
·
При взаимодействии органических веществ часто
образуются побочные продукты.
·
При гетерогенных реакциях вещества плохо
перемешиваются, и часть веществ просто не вступает в реакции.
·
Часть газообразных веществ может улетучиться.
·
При получении осадков часть вещества может остаться
в растворе.
Вывод:
·
масса теоретическая всегда больше практической;
·
объём теоретический всегда больше объёма
практического.
Теоретический выход составляет 100%, практический выход всегда меньше
100%.
Количество продукта, рассчитанное по уравнению реакции, — теоретический
выход, соответствует 100%.
Доля выхода продукта реакции ( —
“этта”) — это отношение массы полученного вещества к массе, которая должна была
бы получиться в соответствии с расчетом по уравнению реакции.
Три типа задач с понятием “выход продукта”:
1. Даны массы исходного
вещества и продукта реакции. Определить
выход продукта.
2. Даны массы исходного
вещества и выход продукта реакции. Определить массу продукта.
3. Даны массы продукта и выход продукта. Определить массу исходного вещества.
Задачи.
1. При сжигании железа в сосуде, содержащем 21,3
г хлора, было получено 24,3 г хлорида железа (III). Рассчитайте выход продукта
реакции.
2. Над 16 г серы пропустили водород при нагревании. Определите объем
(н.у.) полученного сероводорода, если выход продукта реакции составляет 85% от
теоретически возможного.
3. Какой объём оксида углерода (II) был взят для восстановления оксида
железа (III), если получено 11,2г железа с выходом 80% от теоретически
возможного.
Анализ задач.
Каждая задача складывается из совокупности данных (известные вещества)
– условия задачи (“выход” и т.п.) – и вопроса (вещества, параметры которых
требуется найти). Кроме этого, в ней есть система зависимостей, которые
связывают искомое с данными и данные между собой.
Задачи анализа:
1) выявить все данные;
2) выявить зависимости между данными и условиями;
3) выявить зависимости между данным и искомым.
Итак, выясняем:
1. О каких веществах идет речь?
2. Какие изменения произошли с веществами?
3. Какие величины названы в условии задачи?
4. Какие данные – практические или теоретические, названы в условии
задачи?
5. Какие из данных можно непосредственно использовать для расчётов по
уравнениям реакций, а какие необходимо преобразовать, используя массовую долю
выхода?
Алгоритмы решения задач трёх типов:
Определение выхода продукта в % от теоретически возможного.
1. Запишите уравнение химической реакции и расставьте коэффициенты.
2. Под формулами веществ напишите количество вещества согласно
коэффициентам.
3. Практически полученная масса известна.
4. Определите теоретическую массу.
5. Определите выход продукта реакции (%), отнеся практическую массу к
теоретической и умножив на 100%.
6. Запишите ответ.
Расчет массы продукта реакции, если известен выход продукта.
1. Запишите “дано” и “найти”, запишите уравнение, расставьте
коэффициенты.
2. Найдите теоретическое количество вещества для исходных веществ. n =
3. Найдите теоретическое количество вещества продукта реакции, согласно
коэффициентам.
4. Вычислите теоретические массу или объем продукта реакции.
m = M * n или V = Vm * n
5. Вычислите практические массу или объем продукта реакции (умножьте
массу теоретическую или объем теоретический на долю выхода).
Расчет массы исходного вещества, если известны масса продукта реакции и
выход продукта.
1. По известному практическому объёму или массе, найдите теоретический
объём или массу (используя долю выхода продукта).
2. Найдите теоретическое количество вещества для продукта.
3. Найдите теоретическое количество вещества для исходного вещества,
согласно коэффициентам.
4. С помощью теоретического количества вещества найдите массу или объем
исходных веществ в реакции.
Домашнее задание.
Решите задачи:
1. Для окисления оксида серы (IV) взяли 112
л (н.у.) кислорода и получили 760 г оксида серы (VI). Чему равен выход
продукта в процентах от теоретически возможного?
2. При взаимодействии азота и водорода получили 95
г аммиака NH3 с
выходом 35%. Какие объёмы азота и водорода были взяты для реакции?
3. 64,8 г оксида цинка восстановили избытком углерода. Определите массу
образовавшегося металла, если выход продукта реакции равен 65%.
Сколько литров аммиака (NH3) образуется при взаимодействии 112
килограмм азота (N2) с водородом (H2)? Выход от теоретически
возможного 80% (нормальные условия).
Решение задачи
Запишем уравнение реакции образования аммиака (NH3):
Напомню, что под выходом от теоретически возможногопродукта реакции
понимают отношение массы (объема, числа молей) практически полученного вещества
к массе (объему, числу молей), теоретически рассчитанной по уравнению реакции.
Выход от теоретически возможного. Учитывая, что молярная
масса азота (N2) равна 28 г/моль (смотри таблицу Менделеева), найдем химическое
количество азота (N2) по формуле, устанавливающей связь между химическим
количеством вещества и массой:
Получаем:
n (N2) = 112000 /28 = 4000 (моль) = 4 (кмоль).
По уравнению реакции найдем химическое количество аммиака (NH3)
(теоретическое химическое количество вещества), которое выделяется в ходе реакции
образования аммиака (NH3):
из 1 моль N2 образуется 2 моль NH3
из 4000 моль N2 образуется х моль NH3
Откуда:
Выход от теоретически возможного.
По формуле, устанавливающей связь между химическим количеством вещества
и объемом, вычислим объем аммиака (NH3), который образуется в ходе
реакции:
Получаем:
V теор.( NH3) = 8000 ∙ 22,4 = 179200 (л).
Вычислим объем аммиака (NH3) практический (выход от
теоретически возможного) по формуле:
Выход от теоретически возможного.
Получаем:
V практ. (NH3) = 80 ⋅ 179200 / 100 = 143360 (л) = 143,36
(м3).
Ответ:
объем аммиака (NH3) равен 143,36
м3.