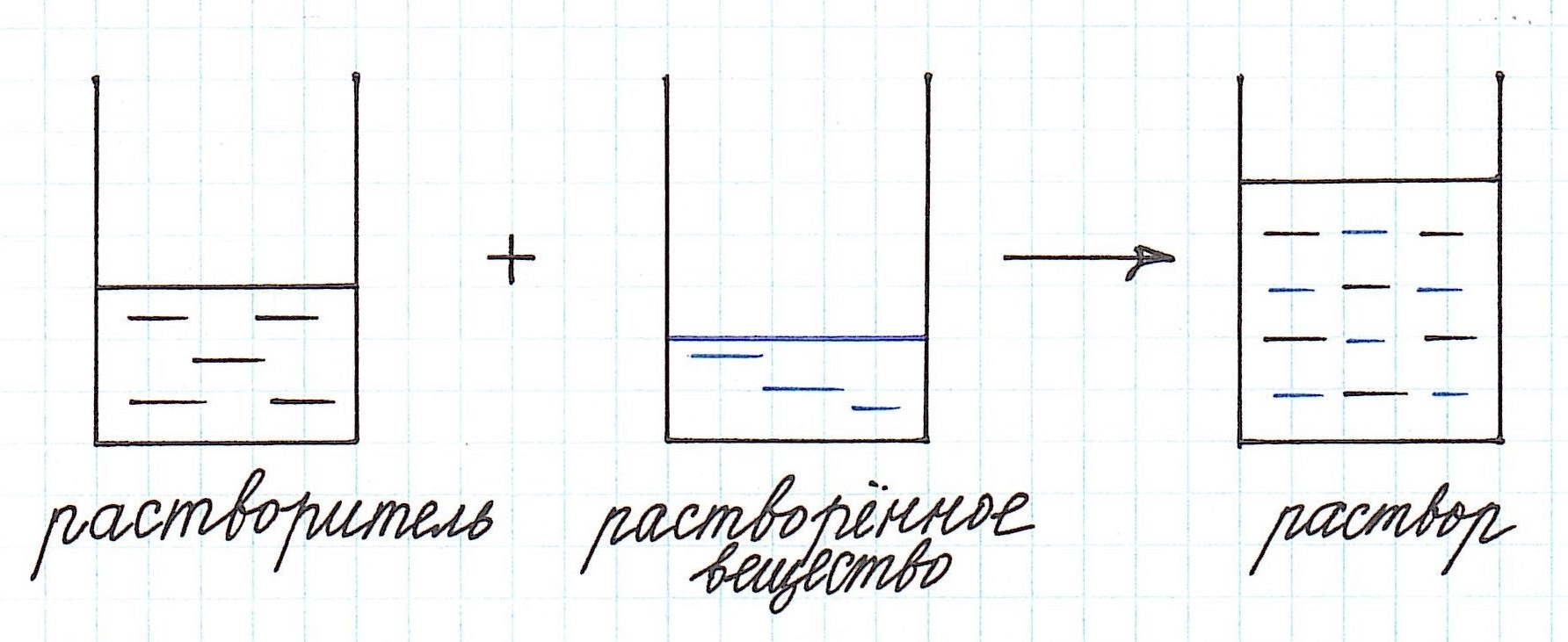
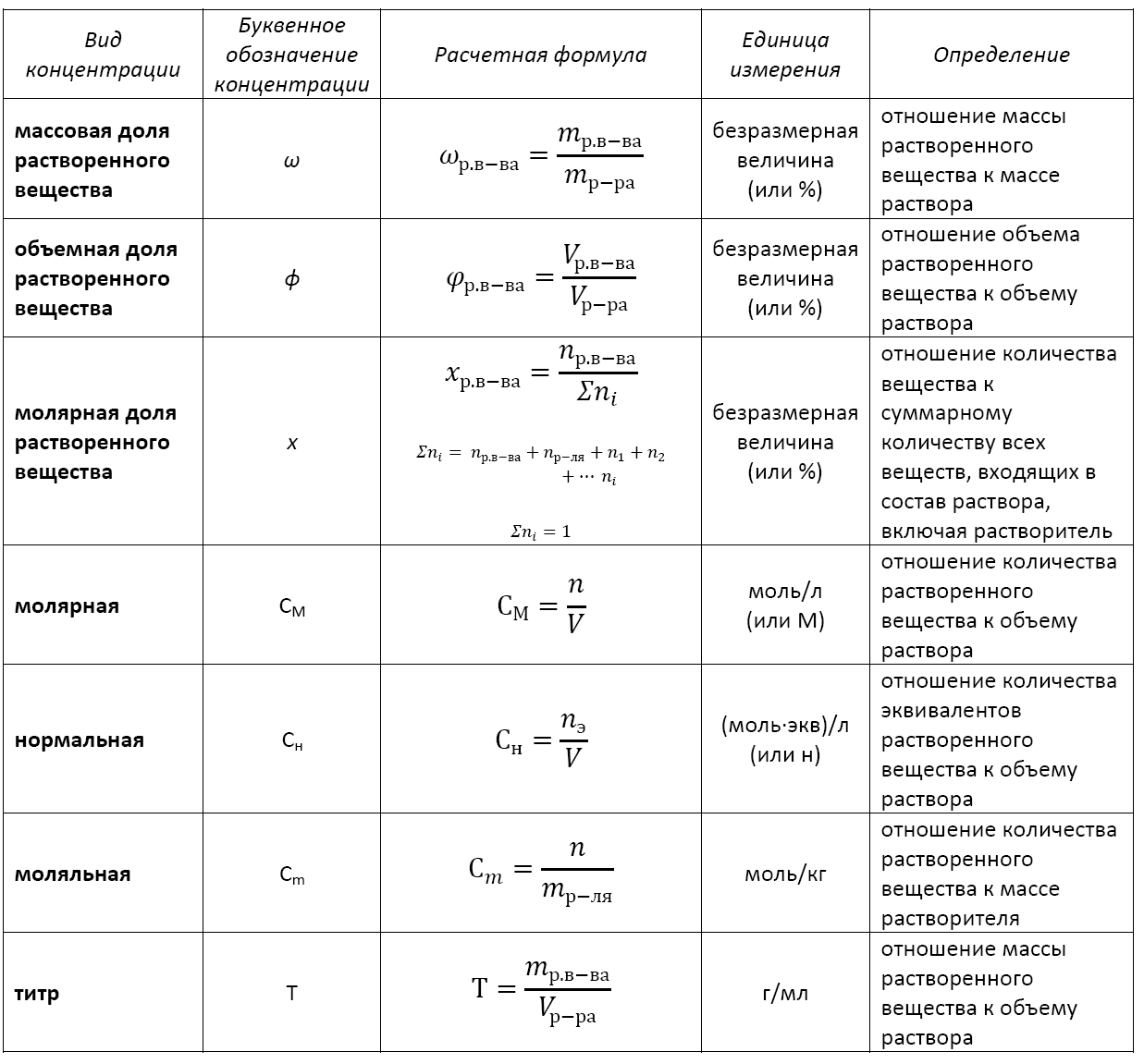
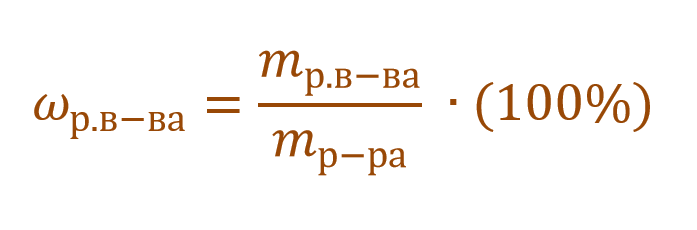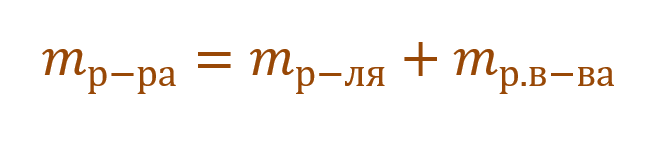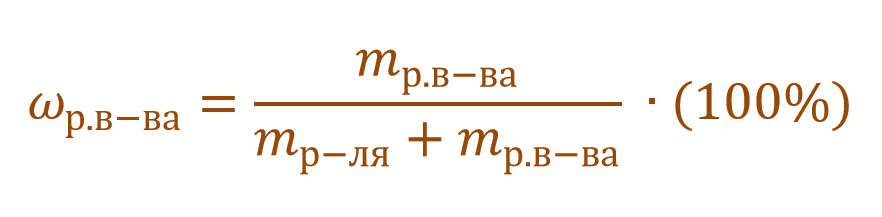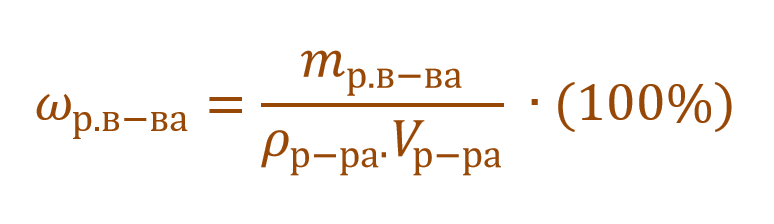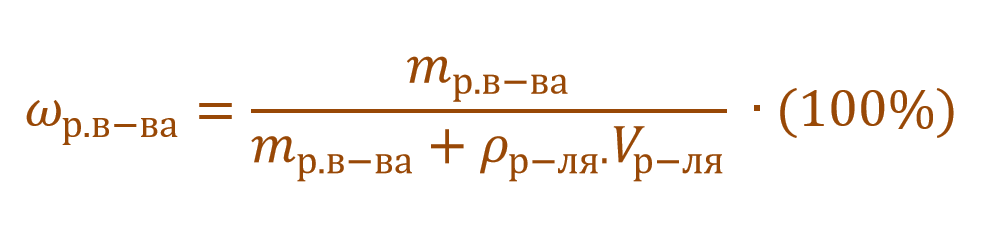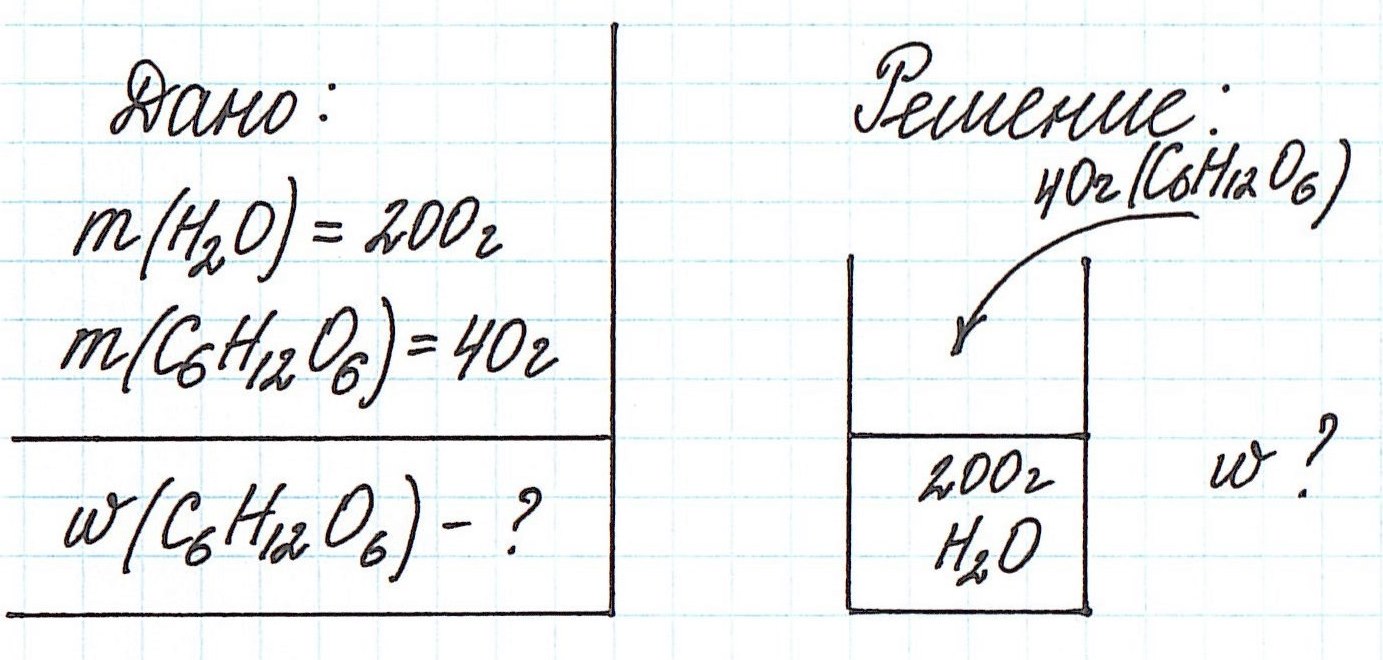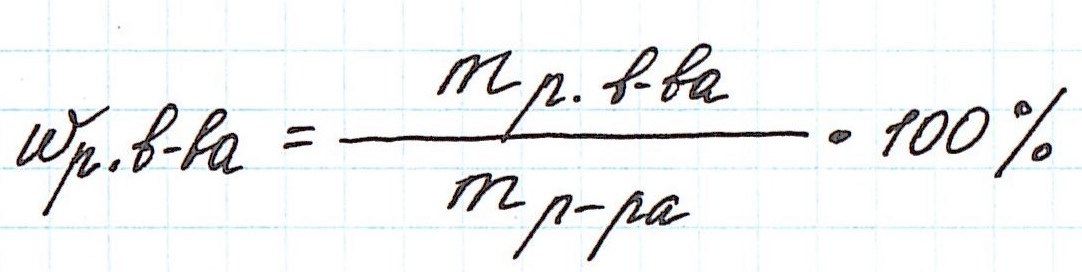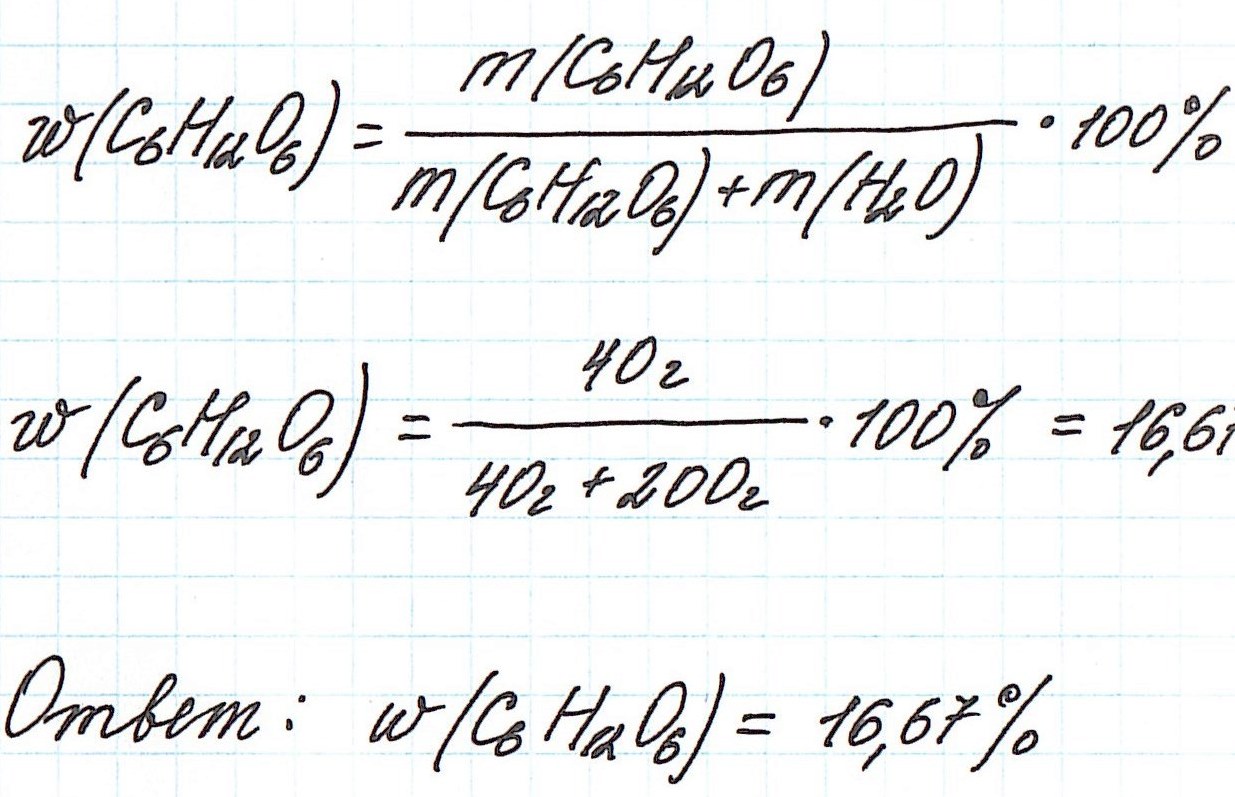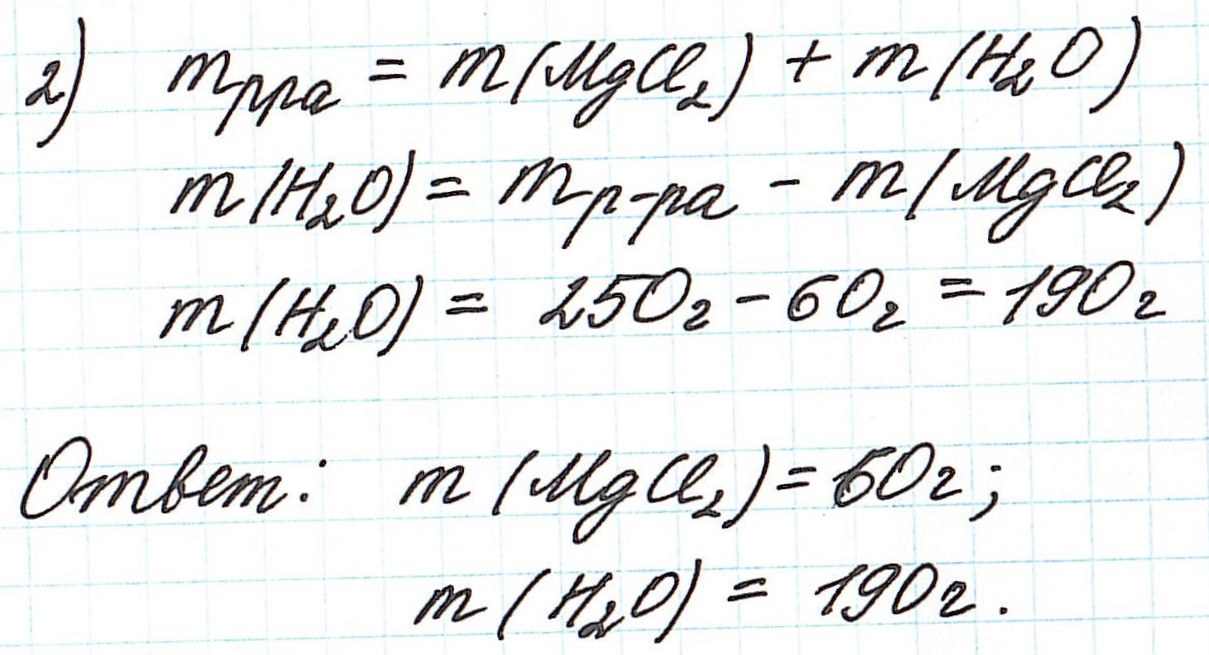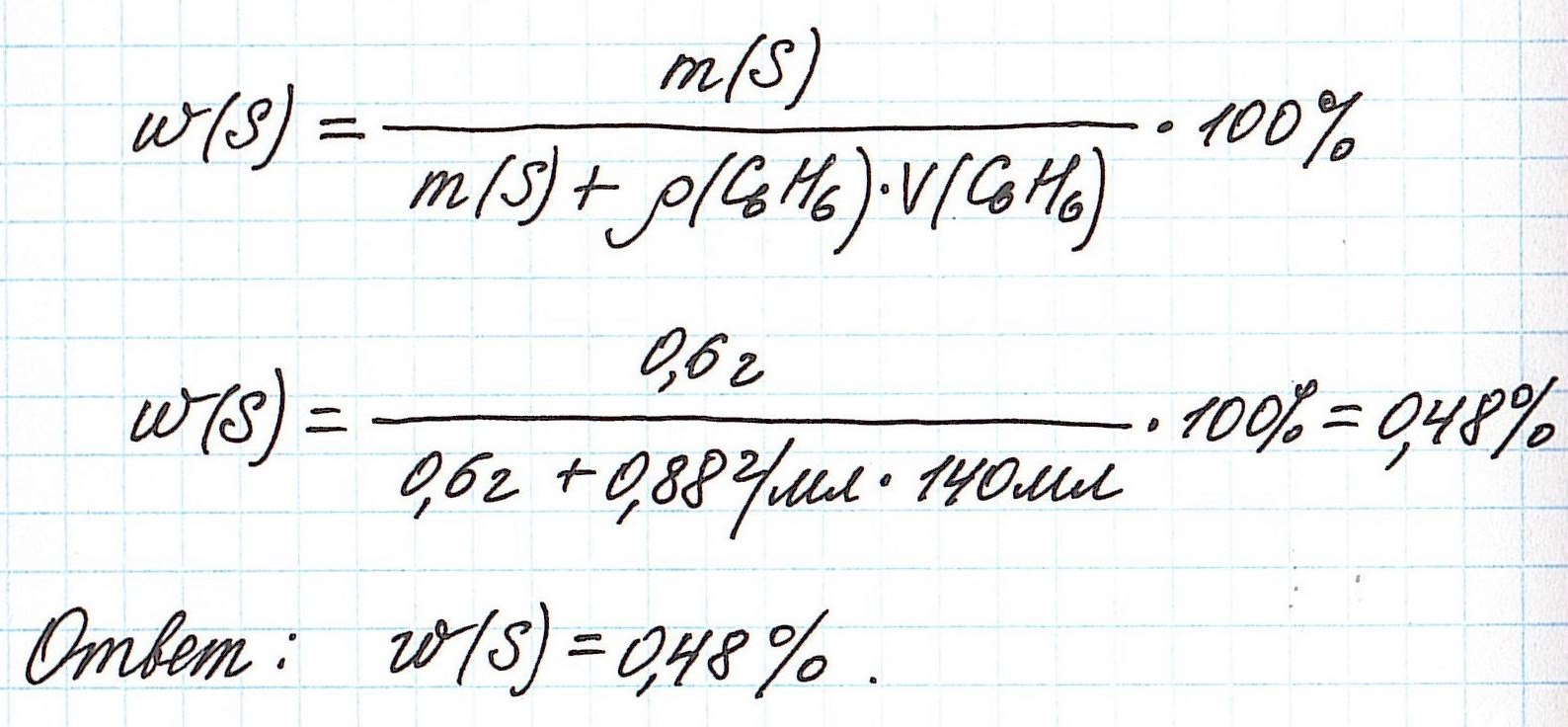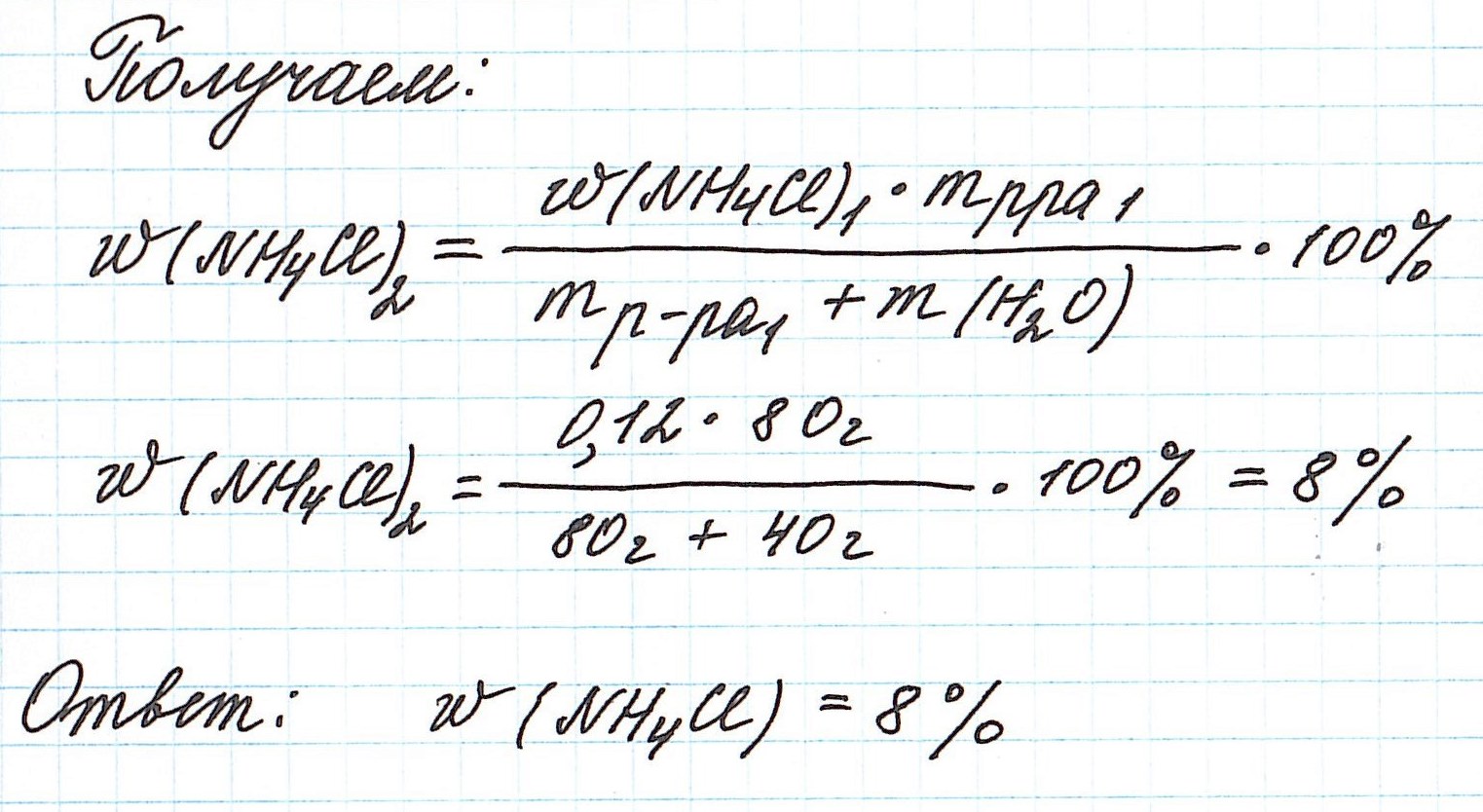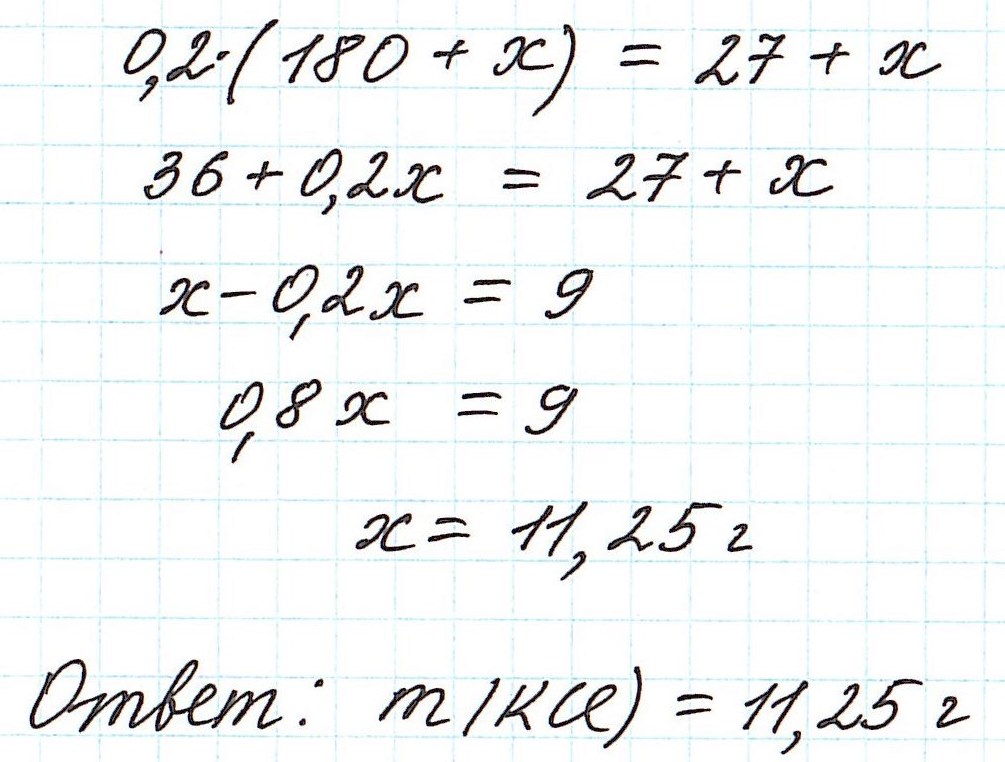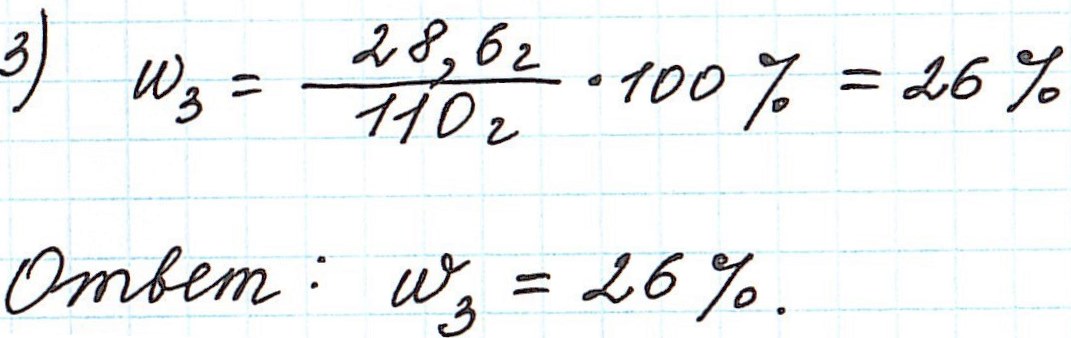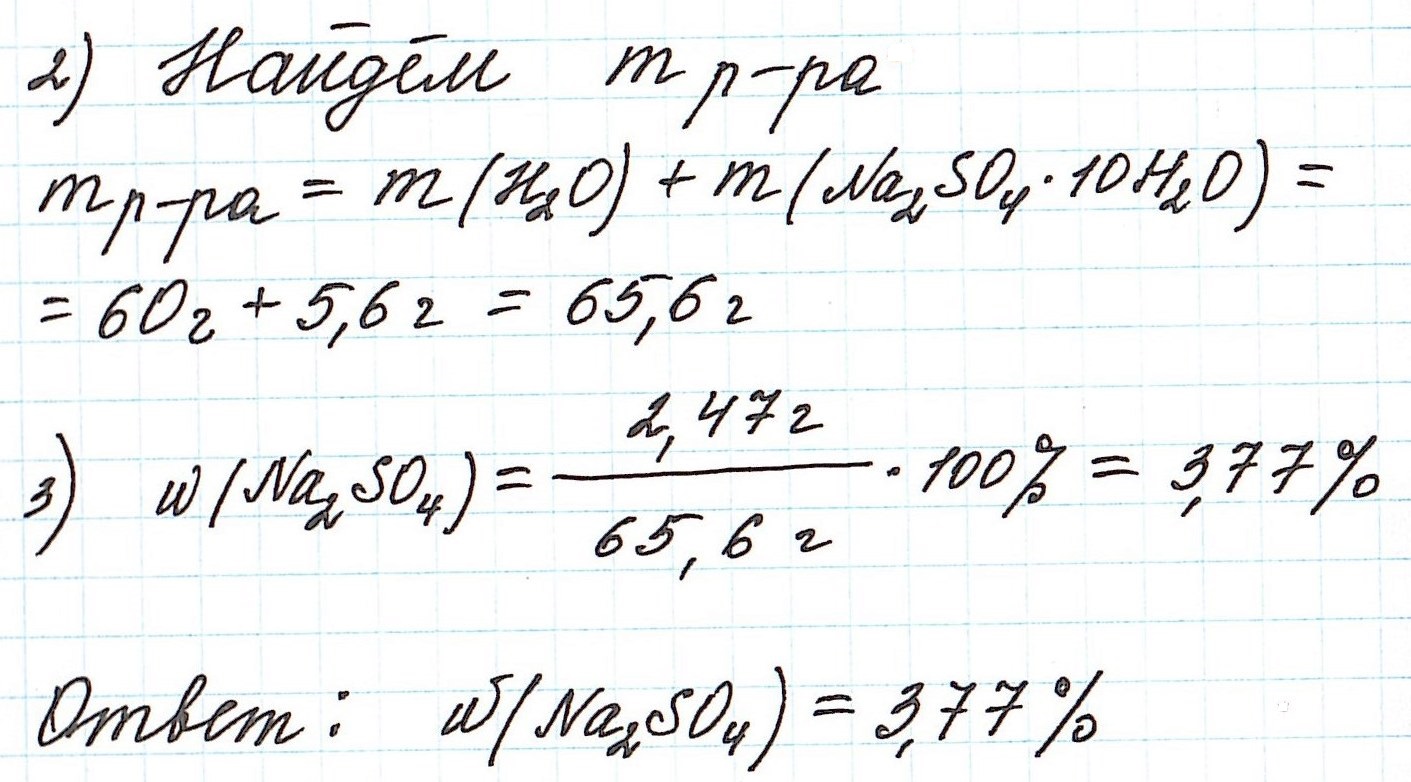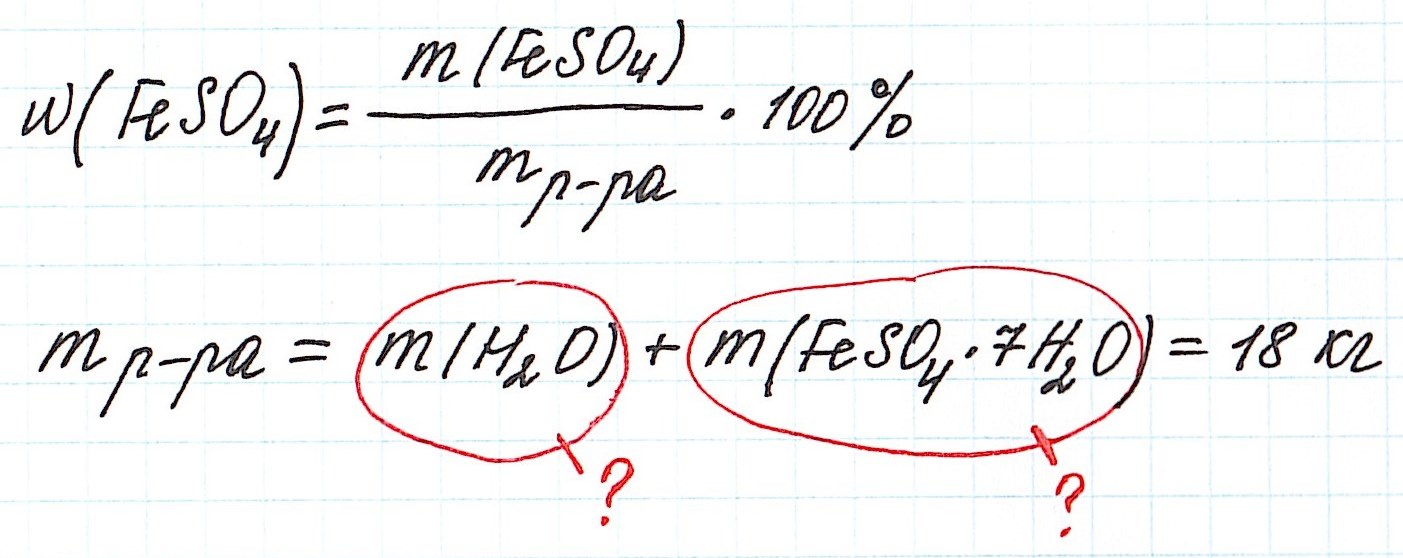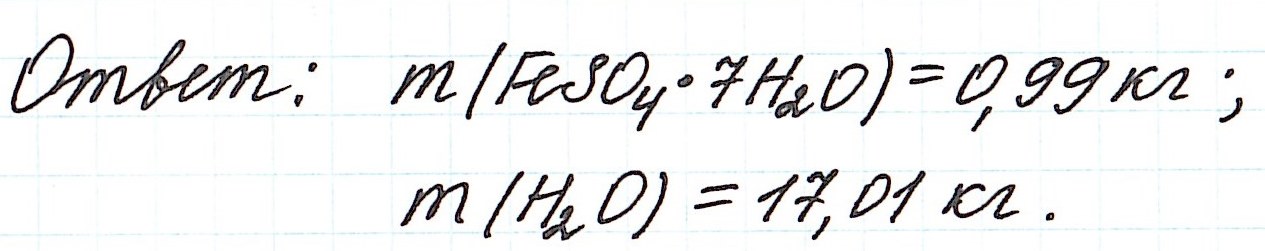Формула концентрации раствора. Их множество. И каждая соответствует тому или иному способу выражения концентрации. А в химии их применяются достаточно: массовая доля растворенного вещества, молярная, нормальная, моляльная, титр и др.
Зачем так много? Ответ на этот вопрос очень прост. Каждый вид концентрации удобен в том или ином случае, когда применение другого вида концентрации неуместно.
Например, при исследовании содержания массы вещества в очень небольшом объеме раствора удобно пользоваться титром. А в каких-то технологиях вообще концентрация заменяется другими количественными характеристиками раствора. Так, в технологии посола рыбы для расчета необходимой концентрации тузлука (раствора поваренной соли) используют не его процентную концентрацию, а плотность.
Содержание:
1. Концентрация – что это такое
2. Формула концентрации раствора: основные виды
3. Массовая доля растворенного вещества и примеры ее вычисления
- разбавление раствора водой
- концентрирование раствора путем упаривания
- концентрирование раствора путем добавления растворенного вещества
- смешивание двух растворов
- применение кристаллогидратов для приготовления раствора (задачи на кристаллогидраты)
4. Правило «креста» в химии растворов как метод решения задач на процентную концентрацию растворов
Концентрация – что это такое
Любой раствор имеет различные характеристики: качественные и количественные. Одной из важнейших количественных характеристик является концентрация раствора.
Концентрация раствора – это количество растворенного вещества, содержащееся в определенном количестве раствора.
Как видно из приведенного определения, основными компонентами раствора являются:
— растворитель;
— растворенное вещество.
Растворенного вещества в растворе всегда меньше, а растворителя больше.
И вот именно с вычислением количественного содержания растворенного вещества чаще всего и связаны все расчеты, основанные на применении формулы концентрации раствора.
Существует несколько видов концентрации раствора:
— массовая доля растворенного вещества;
— объемная доля растворенного вещества;
— молярная доля растворенного вещества;
— молярная (или молярность);
— моляльная (или моляльность);
— нормальная (или эквивалентная);
— титр.
Формула концентрации раствора: основные виды
Применение того или иного вида концентрации уместно в каждом конкретном случае. Не существует какой-то универсальной концентрации или универсальной формулы концентрации раствора.
Кстати, с помощью математических преобразований можно перейти от одной концентрации к другой или найти взаимосвязь между разными их видами.
Основные расчетные формулы концентрации раствора приведены в таблице:
Массовая доля растворенного вещества и примеры ее вычисления
Массовая доля растворенного вещества – это отношение массы растворенного вещества к массе раствора.
Ее расчетная формула выглядит так:
где ωр.в-ва – массовая доля растворенного вещества, mр.в-ва – масса растворенного вещества, mр-ра – масса раствора.
ωр.в-ва представляет собой долю или от единицы или от 100%. Так, например, имеется двухпроцентный раствор NaCl. Его концентрация будет записана в первом случае ω(NaCl) = 0,02, а во втором – ω(NaCl) = 2%. Форма записи основной сути не меняет. Можно записывать и так, и так.
Что же означает выражение ω(NaCl) = 0,02 или ω(NaCl) = 2%? Буквально следующее: в 100 г водного раствора поваренной соли содержится 2 г этой соли и 98 г воды.
Необходимо помнить, что раствор состоит из растворителя и растворенного вещества. Поэтому масса раствора будет состоять из массы растворителя и массы растворенного вещества:
Тогда основную расчетную формулу для массовой доли растворенного вещества можно преобразовать:
Очень часто в расчетах с процентной концентрацией используются плотность и объем раствора:
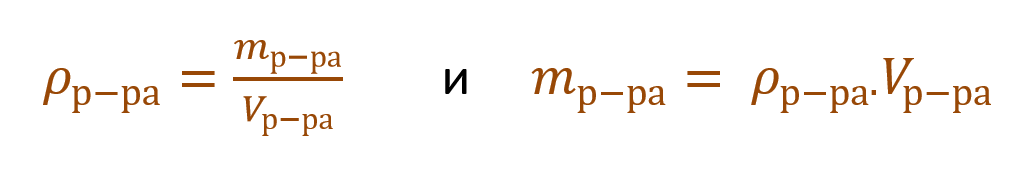
В других ситуациях могут использоваться объем и плотность не раствора, а растворителя. Тогда основная формула для расчета концентрации будет выглядеть так:
На практике бывает необходимо не только приготовить раствор с какой-либо определенной концентрацией, но и увеличить, либо уменьшить ее значение. Это достигается различными приемами:
— упариванием раствора;
— добавлением растворенного вещества;
— добавлением к раствору растворителя (например, воды).
Кроме того, приходится часто смешивать друг с другом растворы разных концентраций.
Разберем все возможные случаи.
Мы рекомендуем задачи, в которых речь идет о растворах, решать с использованием схематических рисунков. Это очень наглядно, особенно, когда речь идет о смешивании растворов.
Начнем с самого простого: вычислим концентрацию раствора.
Пример 1. В 200 г воды растворили 40 г глюкозы. Вычислите массовую долю глюкозы в полученном растворе.
Обратите внимание, что речи о каком-либо химическом взаимодействии не идет! Поэтому записывать уравнения реакций не требуется!
Запишем общую формулу для расчета массовой доли растворенного вещества:
В данной задаче глюкоза (C6H12O6) – растворенное вещество, а вода (H2O) – растворитель. Масса раствора будет складываться из массы глюкозы и массы воды:
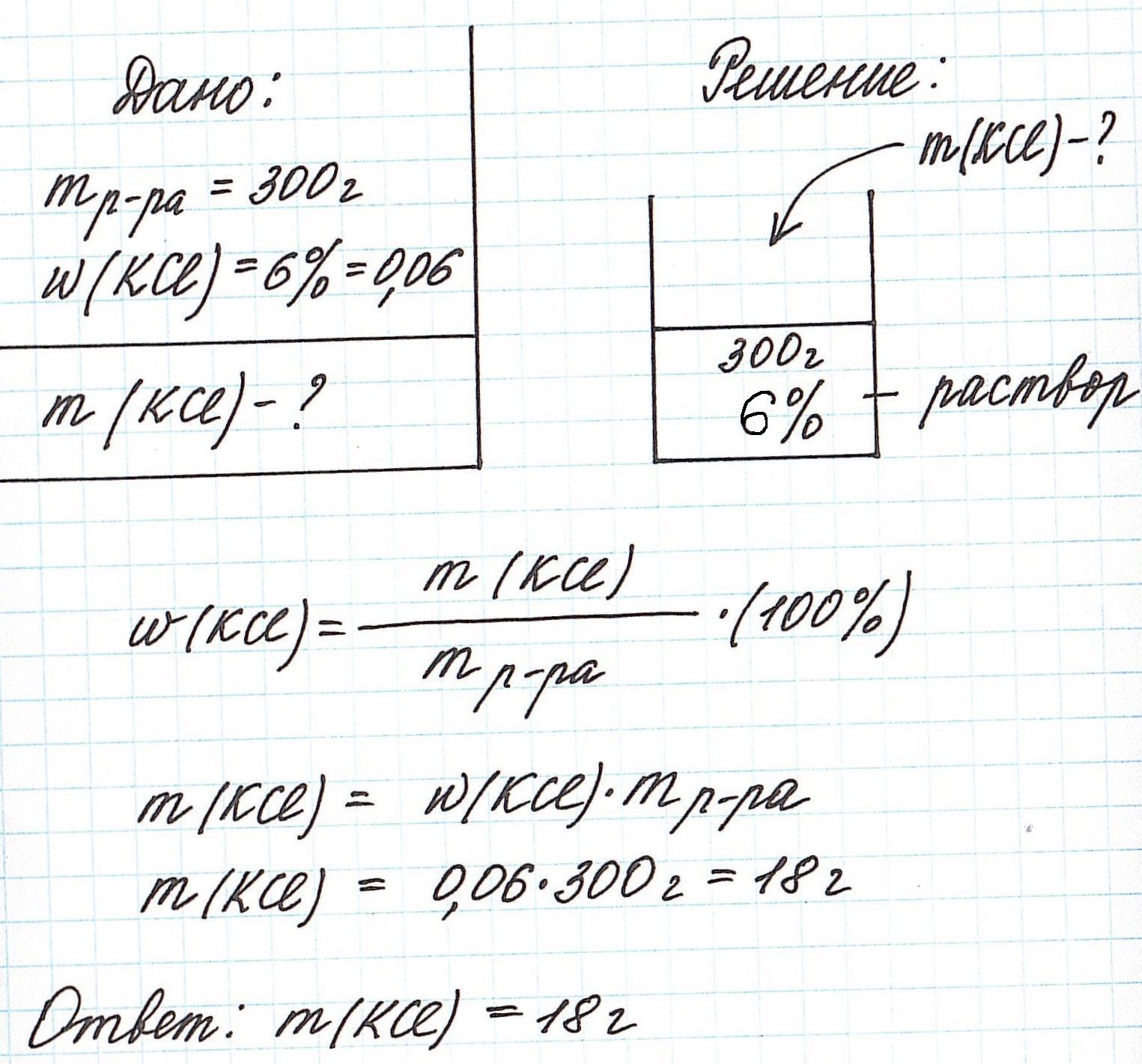
Пример 2. Рассчитайте, сколько потребуется хлорида калия, чтобы приготовить 300 г раствора с массовой долей соли 6%.
Обратите внимание, для того, чтобы расчеты были менее громоздкими, будем использовать выражение концентрации не в %, а в долях от единицы.
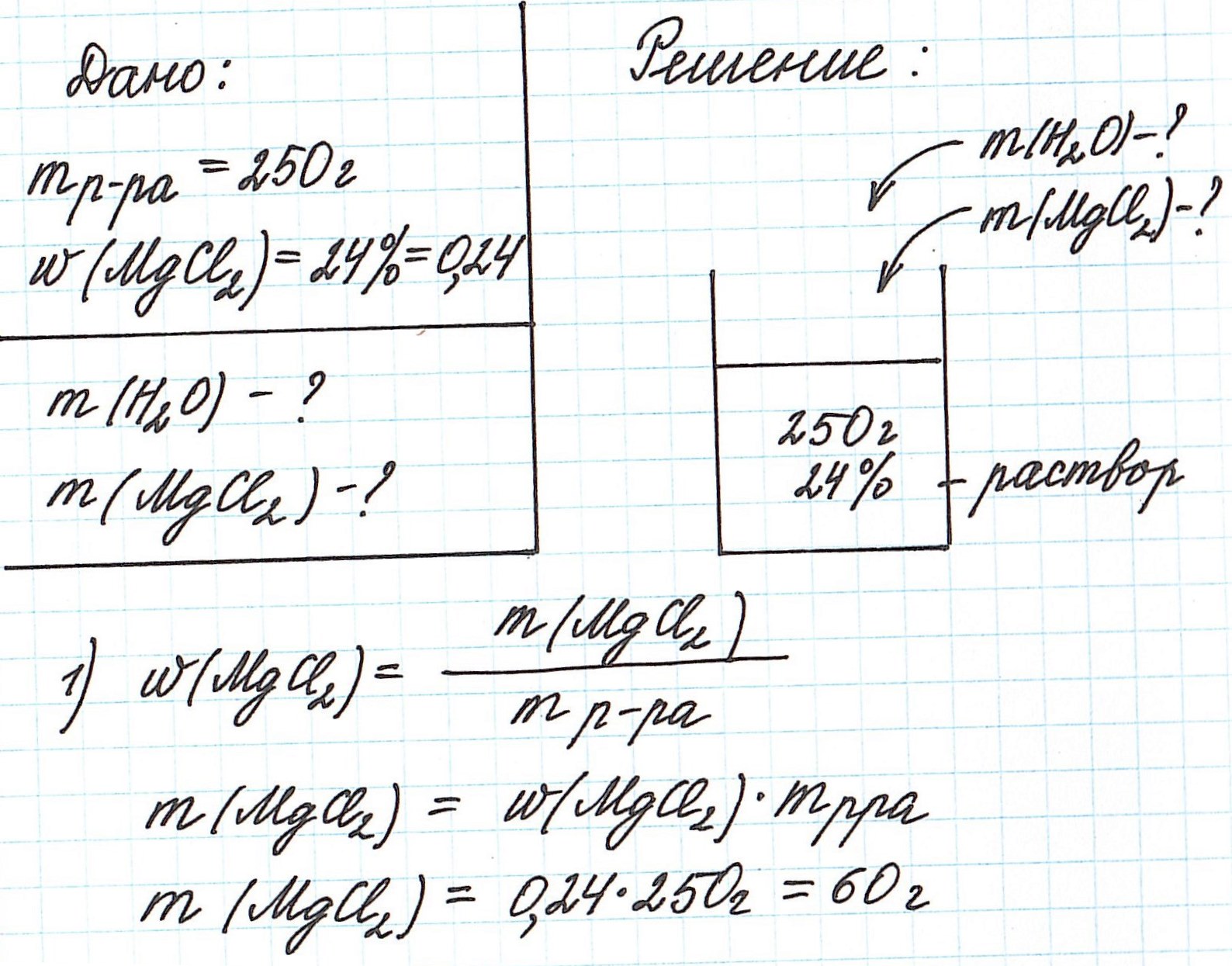
Пример 3. Необходимо приготовить 250 г раствора с массовой долей хлорида магния 24%. Рассчитайте массу требуемых воды и соли.
Так как раствор готовится из хлорида магния и воды, то и масса раствора равна сумме масс хлорида магния и воды:
Рассмотрим задачу, в которой в качестве растворителя выступает не вода, а другое вещество.
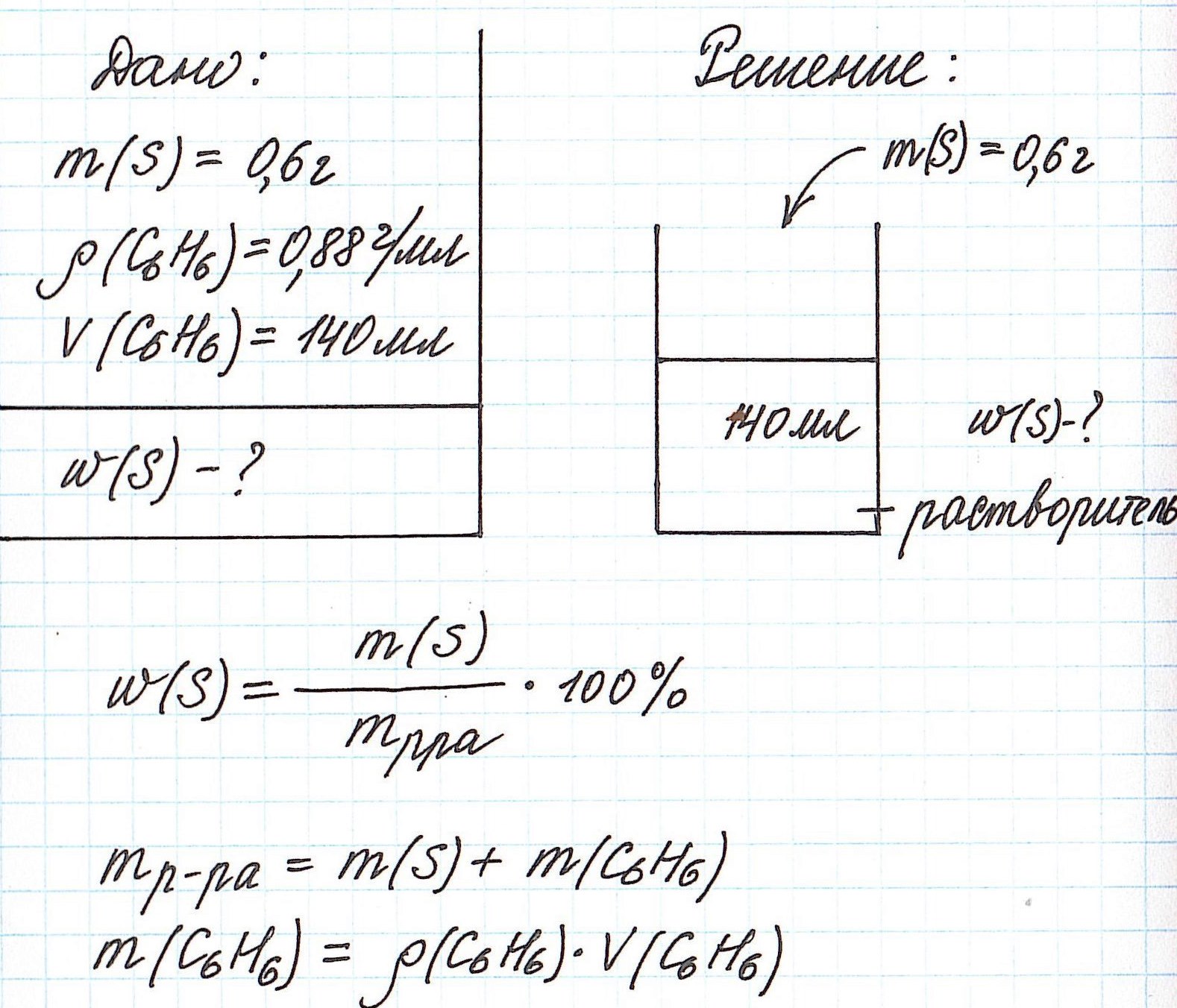
Пример 4. В органическом растворителе бензоле объемом 140 мл растворили серу массой 0,6 г. Вычислите массовую долю серы в полученном растворе, если плотность бензола составляет 0,88 г/мл.
Обратите внимание, что здесь:
— масса раствора не известна;
— масса растворителя (бензола) не известна;
— известны объем и плотность растворителя (бензола), что позволяет нам найти его массу;
— масса раствора состоит из массы растворителя (бензол) и массы растворенного вещества (сера).
Объединим все расчетные формулы в одну и подставим в нее имеющиеся численные значения:
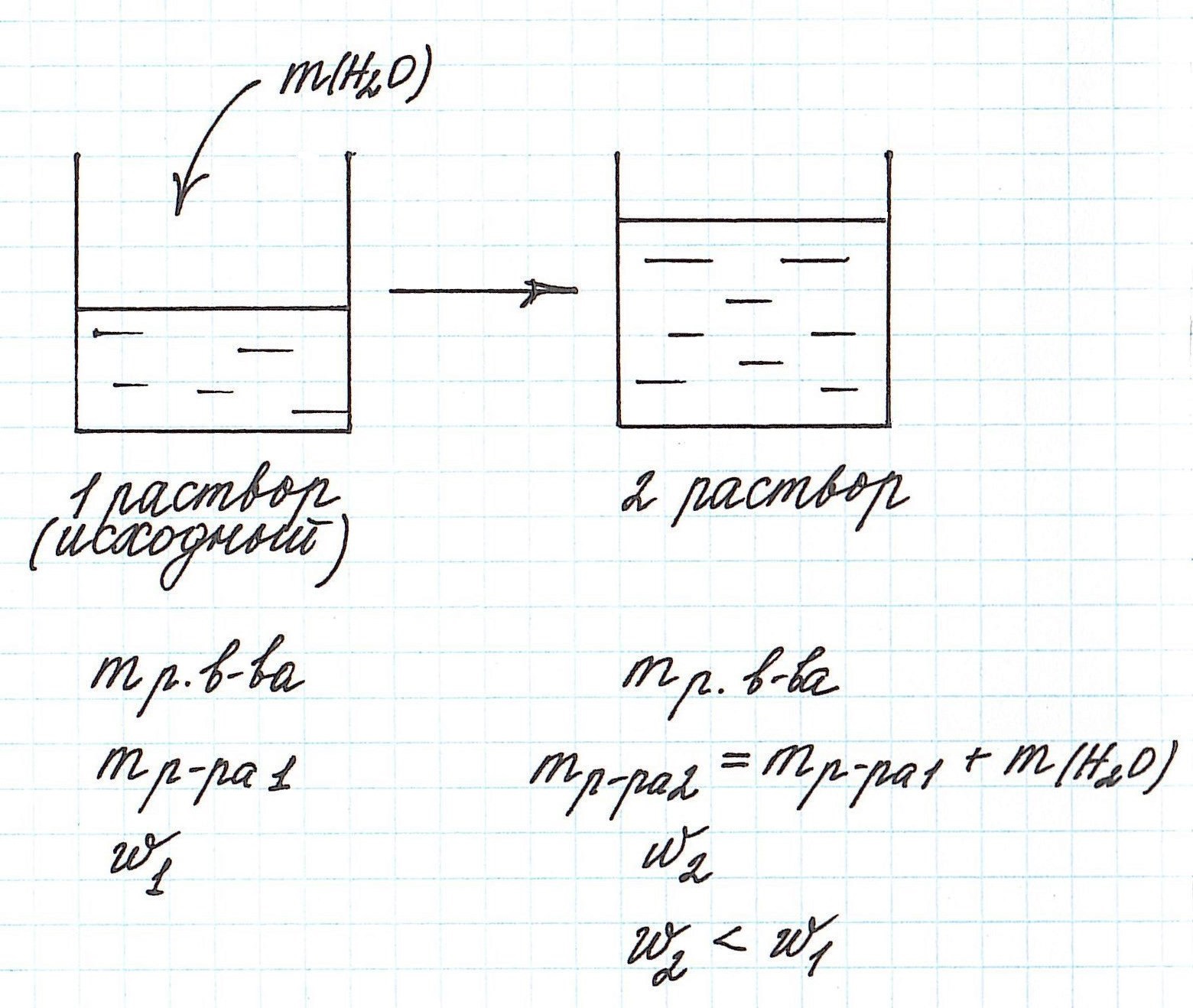
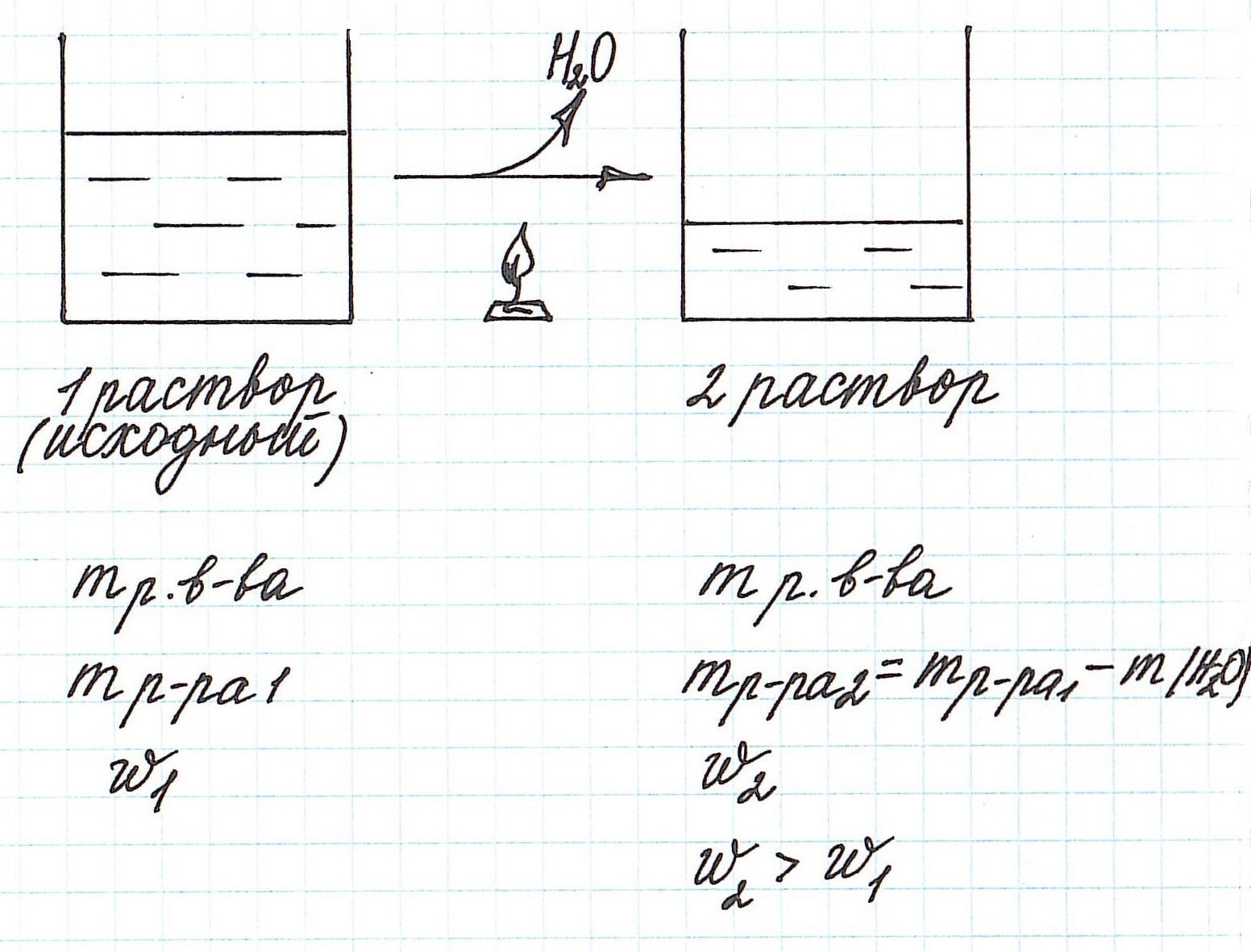
Вычисление массовой доли растворенного вещества при разбавлении раствора водой
Разбавление раствора водой приводит к уменьшению его концентрации.
Запомним, что в таких случаях:
— увеличивается масса раствора;
— увеличивается масса растворителя;
— масса растворенного вещества остается постоянной.
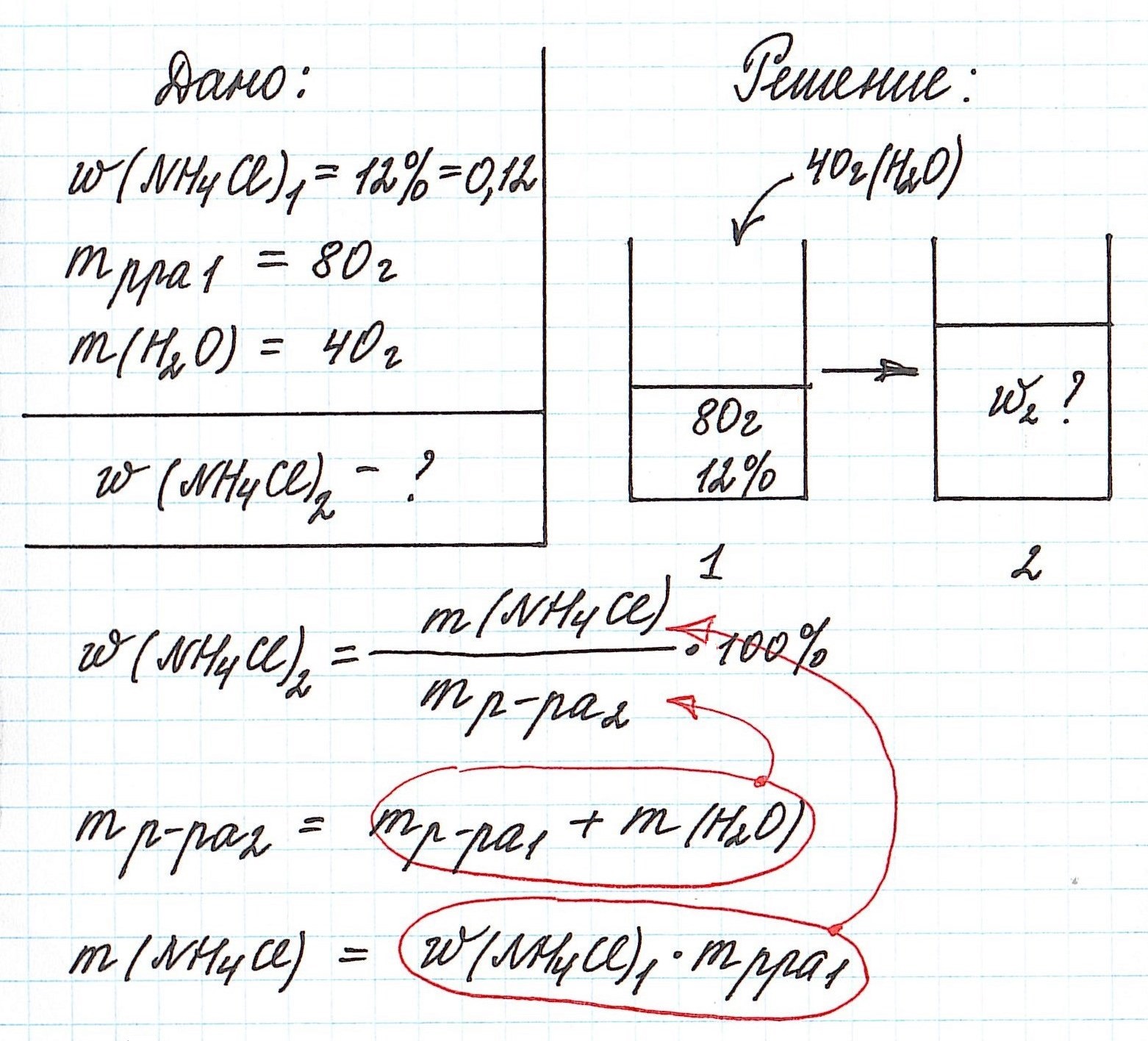
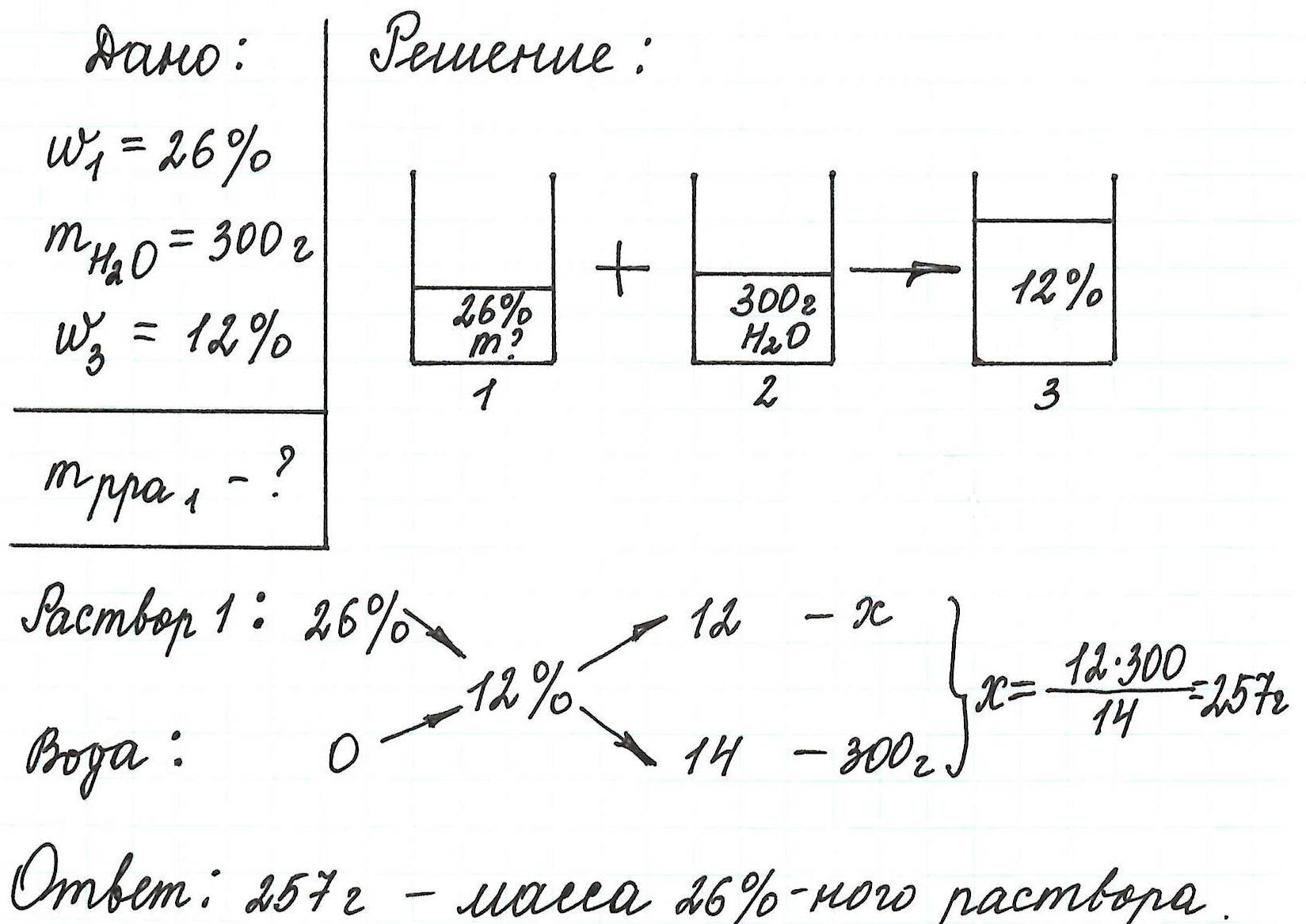
Пример 5. К 80 г раствора с массовой долей NH4Cl 12% добавили 40 г воды. Вычислите массовую долю хлорида аммония в полученном растворе.
Объединим все полученные формулы в одну и подставим имеющиеся данные:
Пример 6. Рассчитайте объем раствора фосфорной кислоты (массовая доля кислоты 12%, плотность 1,065 г/мл), который потребуется для приготовления раствора с массовой долей H3РO4 4% объемом 250 мл (плотность 1,02 г/мл).
В данной задаче речь напрямую о разбавлении раствора не идет. Но судя по тому, что исходный раствор имел концентрацию 12%, а конечный – 4%, становится ясно: последний раствор можно получить путем разбавления первого водой.
Вычисление массовой доли растворенного вещества при концентрировании раствора путем упаривания
Упаривание раствора, т.е. его нагревание, при котором происходит испарение воды, приводит к увеличению концентрации.
Учтите, что при этом:
— уменьшается масса раствора;
— уменьшается масса растворителя;
— масса растворенного вещества остается постоянной (при условии, что растворенное вещество не разлагается при данной температуре).
Пример 7. Из 200 г 27%-ного раствора глюкозы выпарили 20 г воды. Определите массовую долю глюкозы в полученном растворе.
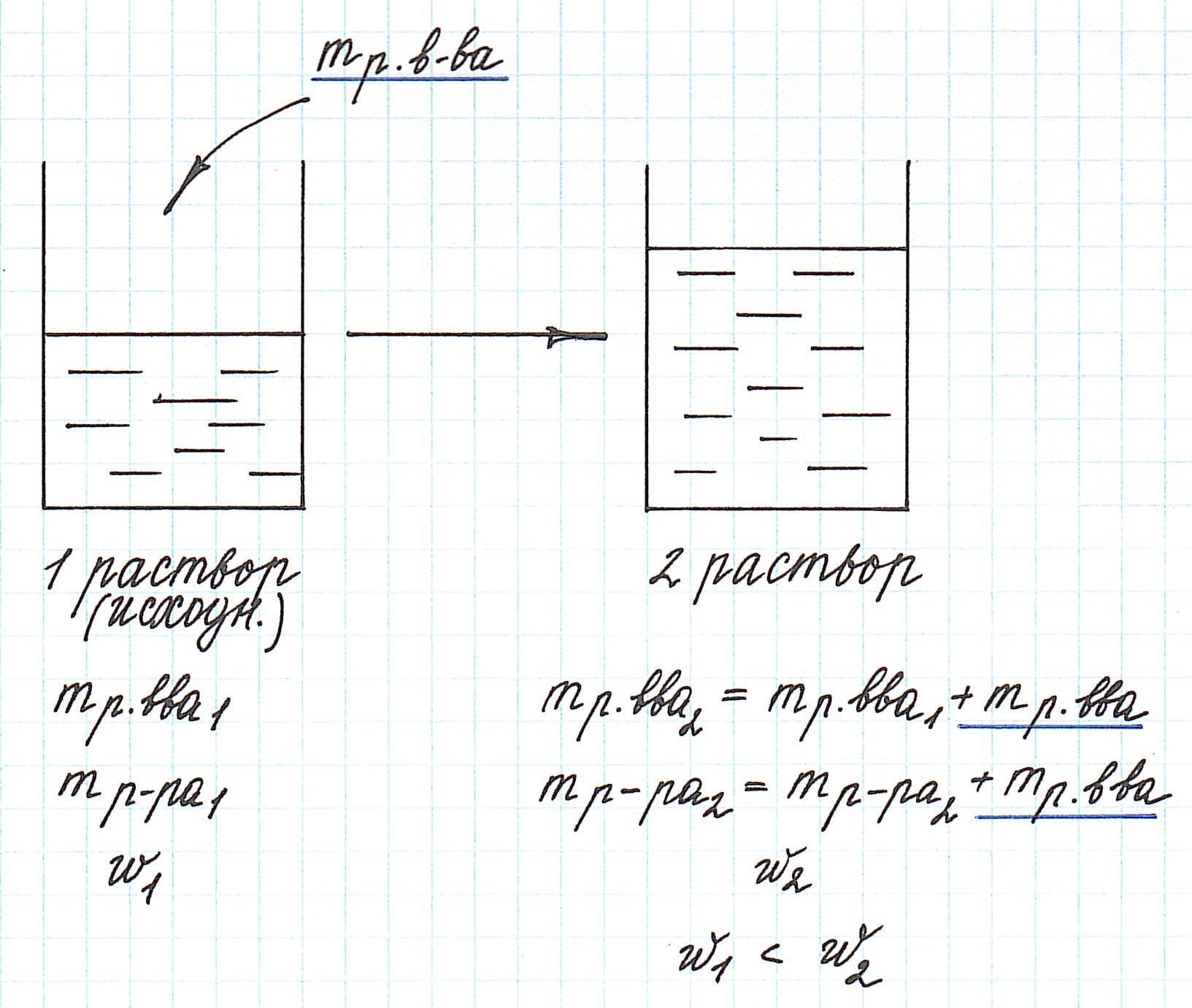
Вычисление массовой доли растворенного вещества при концентрировании раствора путем добавления растворенного вещества
Добавление к уже существующему раствору новой порции растворенного вещества приводит к увеличению концентрации раствора.
Помните, что в таких случаях:
— увеличивается масса раствора;
— увеличивается масса растворенного вещества.
Пример 8. Определите массу хлорида калия, который надо добавить к 180 г 15%-ного раствора этой соли, чтобы получить 20%-ный раствор.
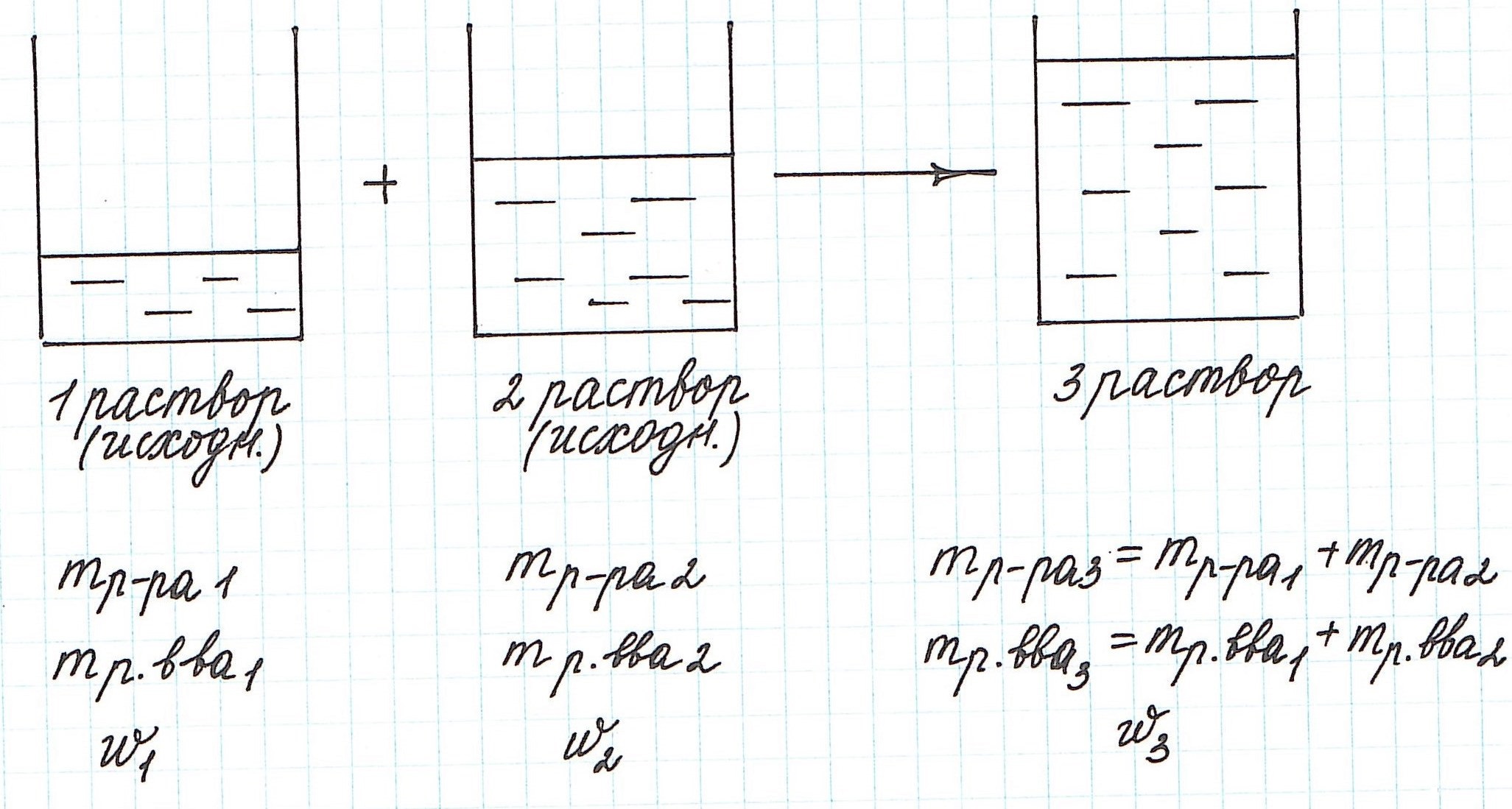
Вычисление массовой доли растворенного вещества при смешивании двух растворов
При смешивании двух растворов (речь о растворах одного и того же вещества конечно же) изменяются все количественные характеристики:
— увеличивается масса раствора;
— увеличивается масса растворенного вещества;
— изменяется массовая доля растворенного вещества.
Пример 9. Смешали 80 г 32%-ного раствора и 30 г 10%-ного раствора нитрата меди (II). Какова концентрация соли в полученном растворе?
Вычисление массовой доли растворенного вещества с применением кристаллогидратов для приготовления раствора
Кристаллогидраты используются для приготовления растворов довольно часто. Кристаллогидраты представляют собой вещества, в состав которых помимо основного вещества входят молекулы воды. Например:
CuSO4·5H2O – кристаллогидрат сульфата меди (II) (или медный купорос);
Na2SO4·10H2O – кристаллогидрат сульфата натрия (или глауберова соль).
Больше примеров здесь.
Вода, входящая в состав кристаллогидрата, называется кристаллизационной.
Кристаллогидраты различаются прочностью связи между основным веществом и кристаллизационной водой. Одни из них теряют воду при комнатной температуре с течением времени и перестают быть кристаллогидратами (например, Na2СO3·10H2O). Другие – обезвоживаются только при сильном нагревании (например, CuSO4·5H2O).
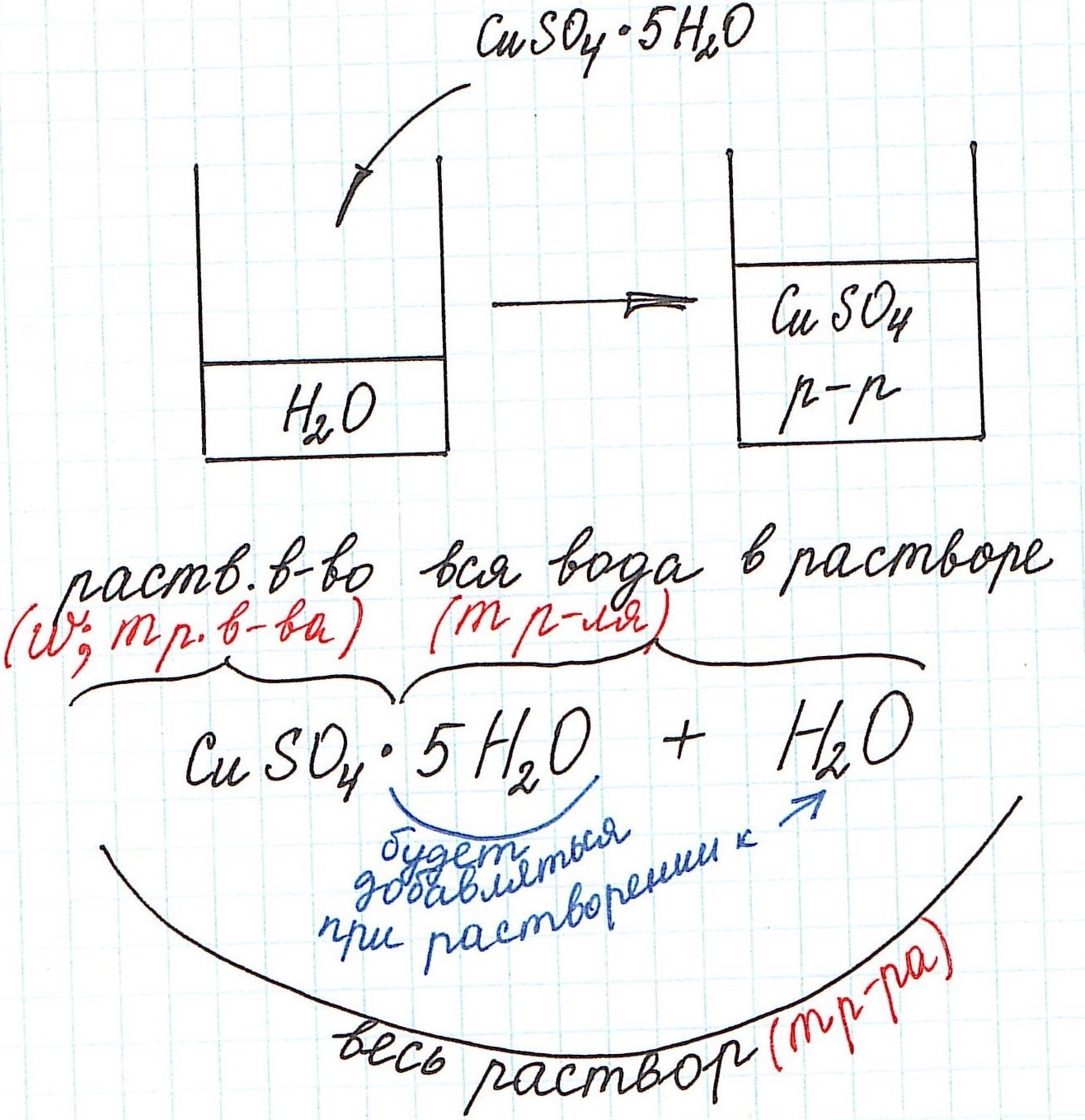
При расчете концентрации с использованием кристаллогидратов для получения растворов часто приходится учитывать и кристаллизационную воду.
Но сначала поясним некоторые нюансы на конкретном примере:
1) Формула CuSO4·5H2O означает, что 1 моль CuSO4·5H2O содержит 1 моль CuSO4 и 5 моль H2O. Это можно было бы записать так:
n(CuSO4) = n(CuSO4·5H2O); n(H2O) = 5n(CuSO4·5H2O)
2) Относительная молекулярная (и численно молярная) масса будет складываться из относительной молекулярной массы вещества и относительной молекулярной массы воды. Например:
Mr(CuSO4·5H2O) = Mr(CuSO4) + 5·Mr(H2O) = 160 + 5·18 = 250 и, соответственно,
M(CuSO4·5H2O) = M(CuSO4) + 5·M(H2O) = 160 + 5·18 = 250 г/моль.
3) Еще одну особенность поясним с помощью рисунка:
Итак, разберем несколько типичных задач.
Пример 10. В 60 г воды растворили глауберову соль Na2SO4·10H2O массой 5,6 г. Какова массовая доля сульфата натрия в полученном растворе?
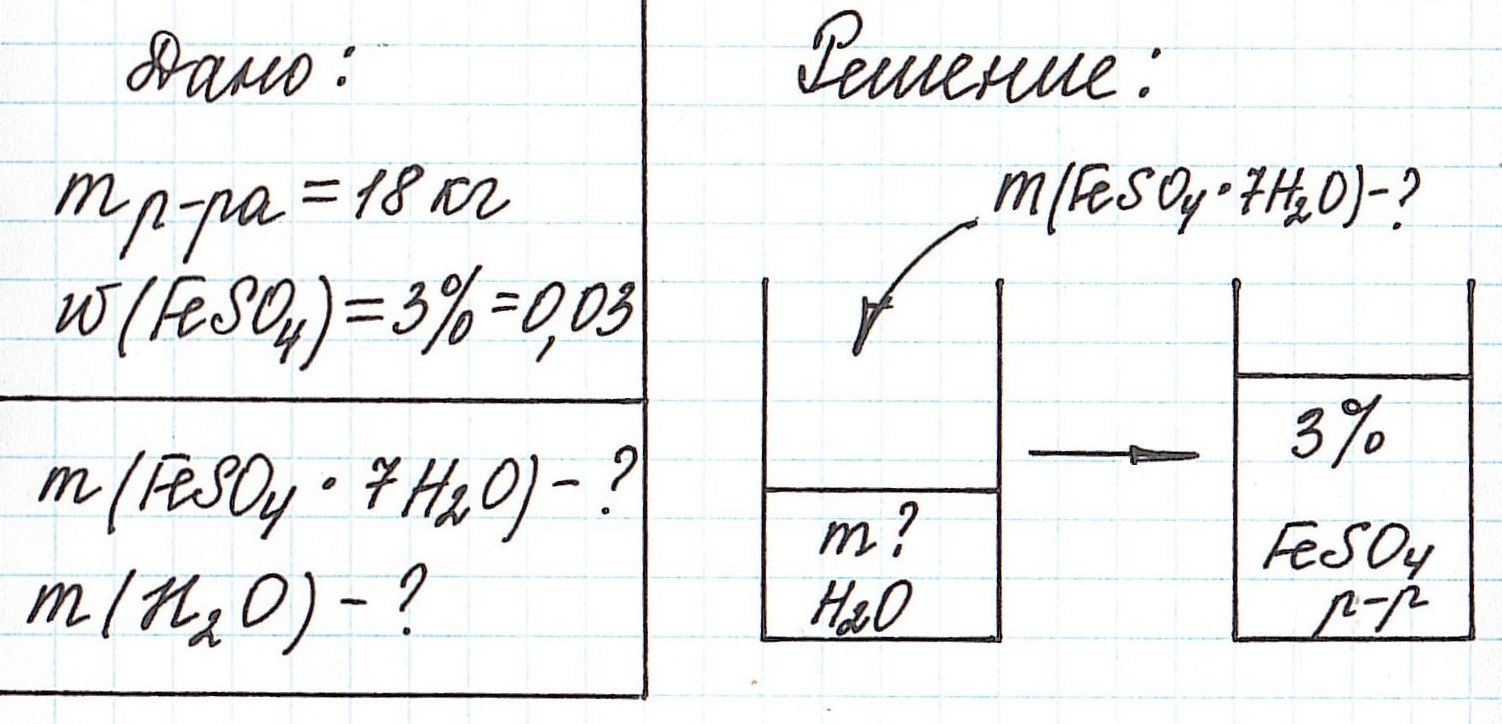
Пример 11. Какая масса железного купороса FeSO4·7H2O и воды потребуется для приготовления 18 кг раствора сульфата железа (II) с массовой долей FeSO4 3%?
Обратите внимание, что масса раствора дана не в граммах (г), а в килограммах (кг). Для того, чтобы привести в ходе расчетов все единицы измерения к единой системе, можно перевести килограммы в граммы и вычислять как обычно.
Но есть более простой способ. Можно считать количество вещества не в моль, а в киломоль (кмоль). Молярную массу вычислять не в г/моль, а в кг/кмоль. В этом случае ответ в задаче мы сразу получим в килограммах.
Пример 12. Вычислите массу кристаллогидрата сульфата никеля NiSO4·7H2O, который надо добавить к 180 г раствора с массовой долей сульфата никеля 1,5%, чтобы получить раствор с массовой долей соли 6%?
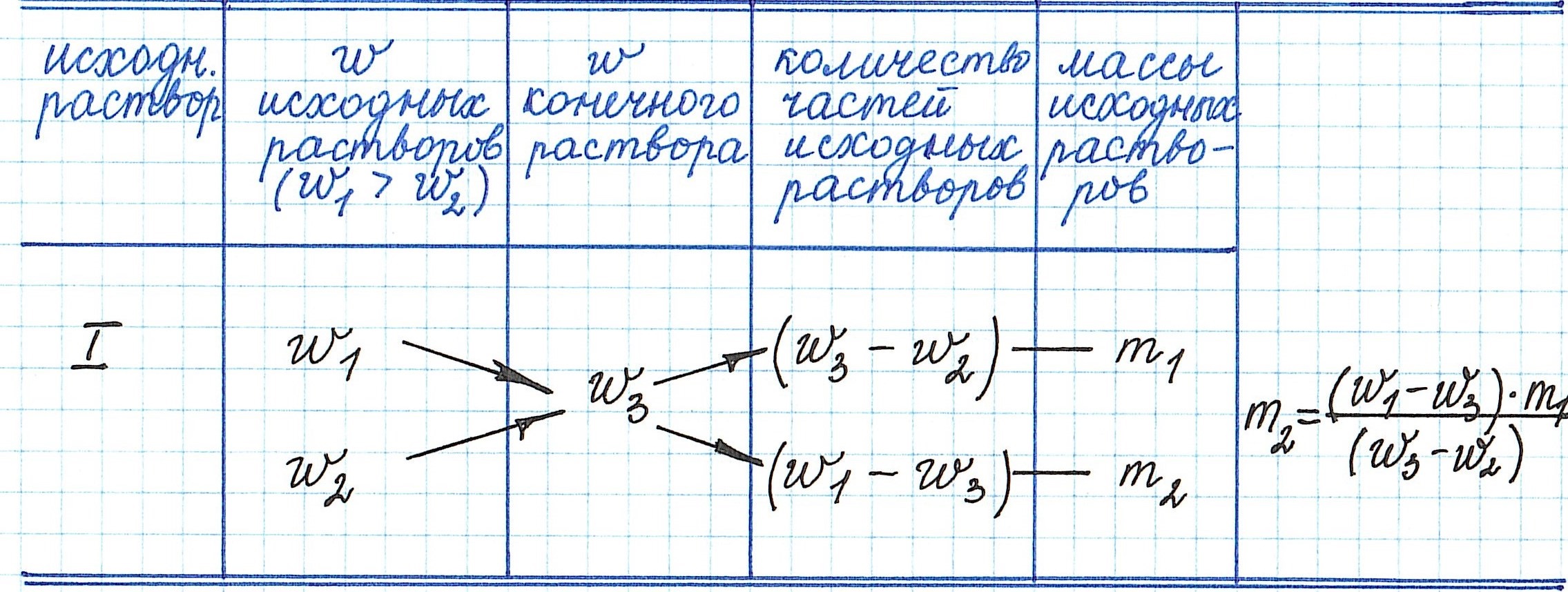
Правило «креста» в химии растворов как метод решения задач на процентную концентрацию растворов
Правилом «креста» (или «квадратом Пирсона») очень удобно пользоваться в расчетах, связанных с разбавлением или смешиванием растворов.
Общая схема вычислений выглядит так:
Пример 13. Какую массу 5%-ного раствора глюкозы надо добавить к 70 г 21%-ного раствора этого же вещества, чтобы получить 12%-ный раствор?
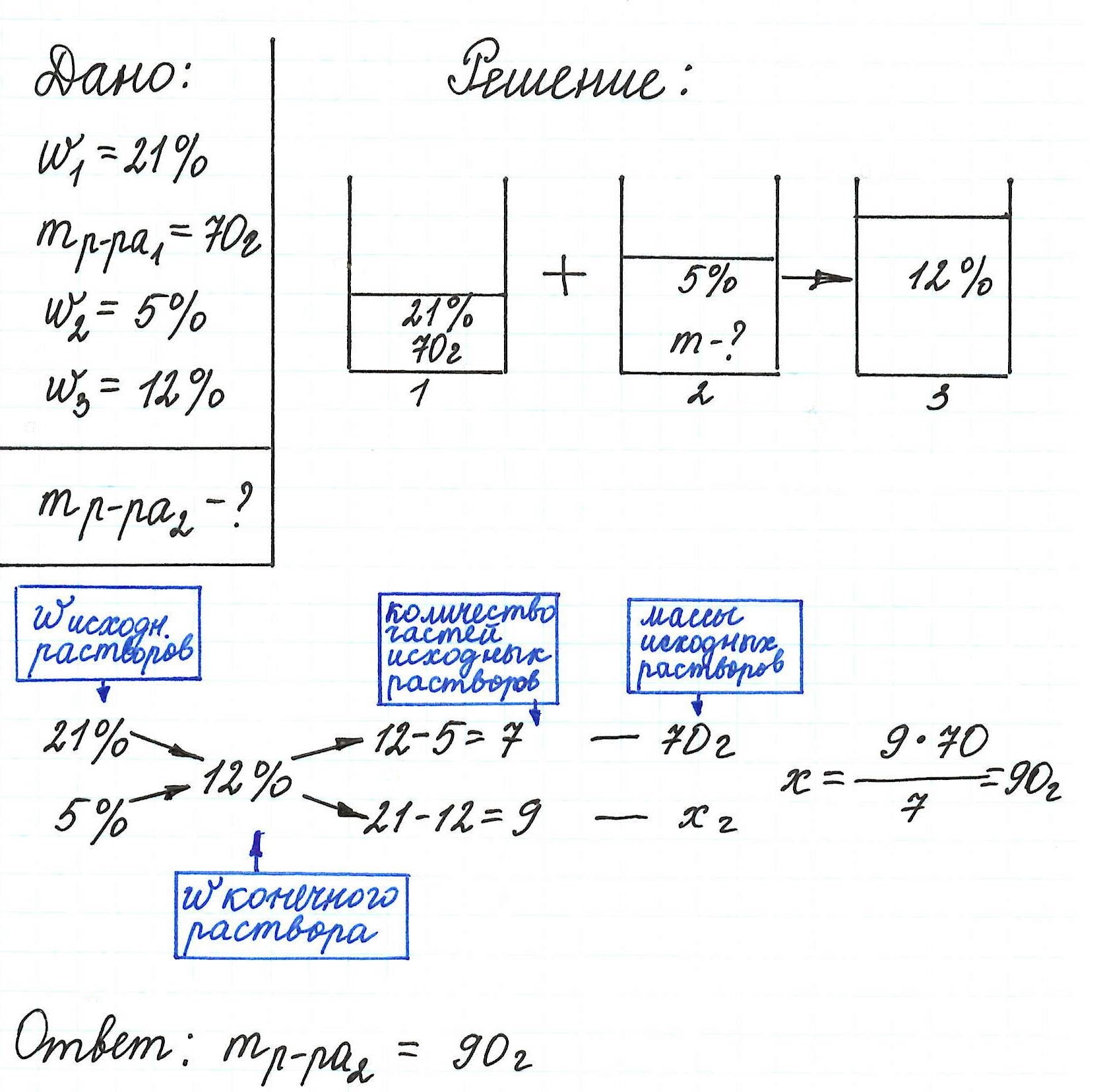
Еще примеры с применением правила «креста» можно посмотреть здесь.
Мы рассмотрели достаточно примеров расчетов, где используется формула такой концентрации раствора как массовая доля растворенного вещества. Как видим, ситуаций, в которых требуется ее применение, множество. Однако, есть достаточно случаев, когда более приемлемыми являются формулы других концентраций (молярной, нормальной, титра и т.д.). Об этом читайте в других статьях.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
или на Одноклассниках
Пожалуйста, оцените публикацию. Большая просьба, если вы оцениваете публикацию от 1 до 3 звезд, обязательно оставьте свой комментарий с указанием того, что не так с этой публикацией. Мы постараемся устранить недостатки.
Ваше мнение для нас важно!
При решении химических задач, при расчётах на работе, да и просто в жизни иногда приходится рассчитывать концентрации. Неважно, будет это школьная теоретическая задача, необходимость приготовить электролит для аккумулятора автомобиля, надобность узнать количество сахара для компота — все расчёты концентраций выполняются по известным формулам, которых не так много. Однако, с этим часто возникают трудности.
Прочитав эту статью, Вы научитесь легко рассчитывать концентрации веществ и при надобности играючи переводить одну концентрацию в другую. В статье приводятся примеры задач с решениями, а в конце приведём справочную табличку с формулами, которую можно распечатать и держать под рукой.
Массовая доля
Начнём с простого, но в то же время нужного способа выражения концентрации компонента в смеси — массовой доли.
Массовая доля есть отношение массы данного компонента к сумме масс всех компонентов. Обозначать её принято буквой w или ω (омега).
Рассчитывается массовая доля по формуле:
Large w_{i}=frac{m_{i}}{m}, ;;;;;(1)
где Large w_{i} — массовая доля компонента i в смеси,
Large m_{i} — масса этого компонента,
m — масса всей смеси.
И сразу разберём на примере:
Задача:
Зимой дороги посыпают песком с солью. Известно, что куча имеет массу 50 кг, и в неё всыпали 1 кг соли и перемешали. Найти массовую долю соли.
Решение:
Масса соли есть Large m_{i} по формуле выше. Масса всей смеси нам пока неизвестна, но найти её легко. Просуммируем массу песка и соли:
Large m = m_{п}+m_{с}= 50 кг + 1 кг = 51 кг
А теперь находим и массовую долю:
Large w_{с} = frac{m_{с}}{m} = 1 кг / 51 кг = 0.0196,
или умножаем на 100% и получаем 1.96%.
Ответ: 0.0196, или 1.96%.
Теперь решим что-то посложнее, и ближе к ЕГЭ.
Задача:
Смешали 200 г раствора глюкозы с массовой концентрацией 25% и 300 г раствора глюкозы с массовой концентрацией 10%. Найти массовую концентрацию полученного раствора, ответ округлить до целых.
Решение:
Обозначим первый и второй растворы соответственно Large m_{1} и Large m_{2}. Массу полученного после смешения раствора обозначим Large m и найдём:
Large m = m_{1} + m_{2} = 200 г + 300 г = 500 г
Массу самой глюкозы в первом и втором растворе обозначим Large m_{гл. 1} и Large m_{гл. 2}. По формуле (1) это будут наши массы компонентов. Массы растворов нам известны, их массовые концентрации тоже. Как найти массу компонента? Очень просто, находим неизвестное делимое умножением (и не забываем, что проценты — это сотые части):
Large m_{гл. 1} = w_{1}cdot m_{1} = 0.25 cdot 200 г = 50 г
Large m_{гл. 2} = w_{2}cdot m_{2} = 0.1 cdot 300 г = 30 г
Таким образом, общая масса глюкозы Large m_{гл}:
Large m_{гл} = m_{гл. 1} + m_{гл. 2} = 50 г + 30 г = 80 г.
Ответ: 80 г.
Задачи на смешение раствором с разными концентрациями одного вещества можно решать с помощью «конверта Пирсона».
Объёмная доля
Часто, когда мы имеем дело с жидкостями и газами, удобно оперировать их объёмами, а не массой. Поэтому, чтобы выражать долю какого-либо компонента в таких смесях (но и в твёрдых тоже вполне можно), пользуются понятием объёмной доли.
Объёмная доля компонента — отношение объёма компонента к сумме объёмов компонентов до смешивания. Объёмная доля измеряется в долях единицы или в процентах. Обычно обозначается греческой буквой φ (фи).
Рассчитывается объёмная доля по формуле:
Large phi_{B}=frac{V_{B}}{sum{V_{i}}}, ; ;;;; (2)
где Large phi_{B} — объёмная доля компонента B;
Large V_{B} — объём компонента B;
Large sum{V_{i}} — сумма объёмов всех компонентов.
Здесь важно понимать, что в формулу по возможности подставляем именно сумму объёмов всех компонентов, а не объём смеси, так как при смешивании некоторых жидкостей суммарный объём уменьшается. Так, если смешать литр воды и литр спирта, два литра аквавита мы не получим — будет примерно 1800 мл. В школьных задачах, как правило, это не так важно, но в уме держим и помним.
Задача:
Смешали 6 объёмов воды и 1 объём серной кислоты. Найти объёмную долю кислоты в полученном растворе.
Решение:
Так как объёмная доля — безразмерная величина, объёмы компонентов в условии задачи могут даваться в любых единицах — литрах, стаканах, баррелях, штофах, сексталях — главное, чтобы в одинаковых. Если не так — переводим одни в другие, если одинаковые — решаем. В нашем условии описаны просто некоторые «объёмы», их и подставляем.
Large phi_{H_{2}SO_{4}} = frac{V_{ H_{2}SO_{4} }} { V_{ H_{2}SO_{4}} + V_{H_{2}O}} = frac{1 : объём}{1 : объём + 6 : объёмов} = frac{1 : объём}{7 : объёмов} = 0.143, : или : 14.3%
Ответ: 14.3 %.
С газами всё обстоит немного интереснее — при не очень больших давлениях и температурах объёмная доля какого-либо газа в газовой смеси равна его мольной доле. (Ведь мы знаем, что молярный объём газов почти равен 22.4 л/моль).
Задача:
Мольная доля кислорода в сухом воздухе составляет 0.21. Найдите объёмную долю азота, если объёмная доля аргона составляет 1%.
Решение:
Внимательный читатель заметил, что мы написали о том, что объёмная и мольная доля для газов в смеси равны. Поэтому, объёмная доля кислорода равна также 0.21, или 21%. Найдём объёмную долю азота:
Large 100% — 21% — 1% = 78%.
Ответ: 78%.
Мольная доля
В тех случаях, когда нам известны количества веществ в смеси, мы можем выразить содержание того или иного компонента с помощью мольной доли.
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы. ИЮПАК рекомендует обозначать мольную долю буквой x (а для газов — y).
Находят мольную долю по формуле:
Large x_{B} = frac{n_{B}}{sum{n_{i}}}, ;;;;;(3)
где Large x_{B} — мольная доля компонента B;
Large n_{B} — количество компонента B, моль;
Large sum{n_{i}} — сумма количеств всех компонентов.
Разберём на примере.
Задача:
При неизвестных условиях смешали 3 кг азота, 1 кг кислорода и 0.5 кг гелия. Найти мольную долю каждого компонента полученной газовой смеси.
Решение:
Сначала находим количество каждого из газов (моль):
Large n_{N_{2}} = frac{ m_{N_{2}}}{M_{N_{2}}} = frac {3000 : г}{28 : ^г/_{моль}} = 107.14 : моль
Large n_{O_{2}} = frac{ m_{O_{2}}}{M_{O_{2}}} = frac {1000 : г}{32 : ^г/_{моль}} = 31.25 : моль
Large n_{He} = frac{ m_{He}}{M_{He}} = frac {500 : г}{4 : ^г/_{моль}} = 125 : моль
Затем считаем сумму количеств:
Large sum {n} = 107.14 : моль + 31.25 : моль + 125 : моль = 263.39 : моль
И находим мольную долю каждого компонента:
Large y_{N_{2}} = frac {107.14 : моль}{263.39 : моль} = 0.4068, : или : 40.68 %;
Large y_{O_{2}} = frac {31.25 : моль}{263.39 : моль} = 0.1186, : или : 11.86 %;
Large y_{He} = frac {125 : моль}{263.39 : моль} = 0.4746, : или : 47.46 %;
Проверяем:
Large 40.68 % + 11.86 % + 47.46 % = 100%.
И радуемся правильному решению.
Ответ: 40.68%, 11.86% , 47.46%.
Молярность (молярная объёмная концентрация)
А сейчас рассмотрим, вероятно, самый часто встречающийся способ выражения концентрации — молярную концентрацию.
Молярная концентрация (молярность, мольность) — количество вещества (число молей) компонента в единице объёма смеси. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л.
Также иногда говорят просто «молярность», и обозначают буквой М. Это значит, что, например, обозначение «0.5 М раствор соляной кислоты» следует понимать как «полумолярный раствор соляной кислоты», или 0.5 моль/л.
Обозначают молярную концентрацию буквой c (латинская «цэ»), или заключают в квадратные скобки вещество, концентрация которого указывается. Например, [Na+] — концентрация катионов натрия в моль/л. Кстати, слово «моль» в обозначениях не склоняют — 5 моль/л, 3 моль/л.
Рассчитывается молярная концентрация по формуле:
Large c_{B} = frac{n_{B}}{V} ; ; ;;; (4)
где Large n_{B} — количество вещества компонента B, моль;
Large V — общий объём смеси, л.
Разберём на примере.
Задача:
В пивную кружку зачем-то насыпали 24 г сахара и до краёв заполнили кипятком. А нам зачем-то нужно найти молярную концентрацию сахарозы в полученном сиропе. И кстати, дело происходило в Британии.
Решение:
Молекулярная масса сахарозы равна 342 (посчитайте, может мы ошиблись — C12H22O11). Найдём количество вещества:
Large n_{сахарозы} = frac{24 : г}{342 : г/моль} = 0.0702 моль
Британская пинта (мера объёма такая) равна 0.568 л. Поэтому молярная концентрация находится так:
Large c_{сахарозы} = frac{0.0702 : моль}{0.568 : л} = 0.1236 моль/л
Ответ: 0.1236 моль/л.
Нормальная концентрация (молярная концентрация эквивалента, «нормальность»)
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре смеси. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов).
Обозначается нормальная концентрация как сн, сN, или даже c(feq B). Рассчитывается нормальная концентрация по формуле:
Large c_{N} = z cdot c_{B} = z cdot frac{n_{B}}{V}= frac{1}{f_{eq}} cdot frac {n_{B}}{V} ; ;;;; (5)
где Large n_{B} — количество вещества компонента В, моль;
V — общий объём смеси, л;
z — число эквивалентности (фактор эквивалентности Large f_{eq} = 1/z ).
Значение нормальной концентрации для растворов записывают как «н» или «N», а говорят «нормальность» или «нормальный». Например, раствор с концентрацией 0.25 н — четвертьнормальный раствор.
Разберём на примере.
Задача:
Рассчитать нормальность раствора объёмом 1 л, если в нём содержится 40 г перманганата калия. Раствор приготовили для последующего проведения реакции в нейтральной среде.
Решение:
В нейтральной среде перманганат калия восстанавливается до оксида марганца (IV). При этом в окислительно-восстановительной реакции 1 атом марганца принимает 3 электрона (проверьте на любой окислительно-восстановительной реакции перманганата калия с образованием оксида, расставив степени окисления), что означает, что число эквивалентности будет равно 3. Для расчёта концентрации по формуле (5) выше нам ещё не хватает количества вещества KMnO4. найдём его:
Large n_{KMnO_{4}}=frac{m _{KMnO_{4}}}{M _{KMnO_{4}} } = frac{40 : г}{158 г/моль}= 0.253 моль
Теперь считаем нормальную концентрацию:
Large c_{N_{KMnO_{4}}}= z cdot frac{n_{KMnO_{4}}}{V} = 3 cdot frac{0.253 : моль}{1 : л} = 0.759 моль-экв/л
Ответ: 0.759 моль-экв/л.
Таким образом, заметим важное на практике свойство — нормальная концентрация больше молярной в z раз.
Мы не будем рассматривать в данной статье особо экзотические способы выражения концентраций, о них вы можете почитать в литературе или интернете. Поэтому расскажем ещё об одном способе, и на нём остановимся — массовая концентрация.
Моляльная концентрация
Моляльная концентрация (моляльность, молярная весовая концентрация) — количество растворённого вещества (число моль) в 1000 г растворителя.
Измеряется моляльная концентрация в молях на кг. Как и с молярной концентрацией, иногда говорят «моляльность», то есть раствор с концентрацией 0.25 моль/кг можно назвать четвертьмоляльным.
Находится моляльная концентрация по формуле:
Large m_{B} = frac{n_{B}}{m_{A}}, ;;;;; (6)
где Large n_{B} — количество вещества компонента B, моль;
Large m_{A} — масса растворителя, кг.
Казалось бы, зачем нужна такая единица измерения для выражения концентрации? Так вот, у моляльной концентрации есть одно важное свойство — она не зависит от температуры, в отличие, например, от молярной. Подумайте, почему?
Массовая концентрация
Массовая концентрация — отношение массы растворённого вещества к объёму раствора. По рекомендации ИЮПАК, обозначается символом γ или ρ.
Находится массовая концентрация по формуле:
Large rho_{B}=frac{m_{B}}{V}, ;;;;; (7)
где Large m_{B} — масса растворенного вещества, г;
Large V — общий объём смеси, л.
В системе СИ выражается в кг/м3.
Разберём на примере.
Задача:
Рассчитать массовую концентрацию перманганата калия по условиям предыдущей задачи.
Решение:
Решение будет совсем простым. Считаем:
Large rho_{ KMnO_{4} }=frac{m_{ KMnO_{4} }}{V} =frac{40 : г}{1 : л} = 40 г/л.
Ответ: 40 г/л.
Также в аналитической химии пользуются понятием титра по растворенному веществу. Титр по растворенному веществу находится так же, как и массовая концентрация, но выражается в г/мл. Легко догадаться, что в задаче выше титр будет равен 0.04 г/мл (для этого надо умножить наш ответ на 0.001 мл/л, проверьте). Кстати, обозначается титр буквой Т.
А теперь, как обещали, табличка с формулами перевода одной концентрации в другую.
Таблица перевода одной концентрации в другую.
В таблице слева — ВО ЧТО переводим, сверху — ЧТО. Если стоит знак «=», то, естественно, эти величины равны.
| Массовая доля, large omega, % | Мольная доля, large x , % | Объёмная доля, large phi, % | Молярная концентрация, large c, моль/л | Нормальная концентрация, large c_{N} , моль-экв/л | Моляльная концентрация, large m, моль/кг | Массовая концентрация, large rho, г/л | |
| Массовая доля, large omega, % | = | large omega_{B}=LARGE frac{x_{B} cdot M(B)}{sum x_{i} cdot M_{i}} | Для газов: omega = LARGE frac{phi_{A} cdot M(A)}{sum (M_{i} cdot phi_{i})} |
large omega_{B}= LARGE frac{c_{B} cdot M(B)}{rho} | large omega_{B}=LARGE frac{c_{N} cdot M(B)}{rho cdot z} | large omega_{B}= LARGE frac{gamma_{B}}{rho} | |
| Мольная доля, large x , % | large x_{B}=LARGE frac{frac{omega_{B}}{M(B)}}{sum frac{omega_{i}}{M_{i}}} | = | large x_{B}=LARGE frac{m_{B}}{m_{B}+frac{1}{M(A)}} | ||||
| Объёмная доля, large phi, % | Для газов: large phi_{A}=LARGE frac{frac{omega_{A}}{M(A)}}{sum frac{omega_{i}}{M_{i}}} |
= | |||||
| Молярная концентрация, large c, моль/л | large c_{B}=LARGE frac{rho cdot omega_{B}}{M(B)} | = | large c_{B}=Large frac{c_{N}}{z} | ||||
| Нормальная концентрация, large c_{N} , моль-экв/л | large c_{N}=LARGE frac{rho cdot omega_{B} cdot z}{M(B)} | large c_{N}=c_{B} cdot z | = | ||||
| Моляльная концентрация, large m, моль/кг | large m_{B}=Large frac{x_{B}}{M(A)(1-x_{B})} | = | |||||
| Массовая концентрация, large gamma, г/л | large gamma_{B}=rho cdot omega_{B} | = |
Таблица будет пополняться.
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Растворы. Способы выражения концентрации растворов
Способы выражения концентрации растворов
Существуют различные способы выражения концентрации растворов.
Массовая доля ω компонента раствора определяется как отношение массы данного компонента Х, содержащегося в данной массе раствора к массе всего раствора m. Массовая доля – безразмерная величина, её выражают в долях от единицы:
ωр.в. = mр.в./mр-ра (0 < ωр.в. < 1) (1)
Массовый процент представляет собой массовую долю, умноженную на 100:
ω(Х) = m(Х)/m · 100% (0% < ω(Х) < 100%) (2)
где ω(X) – массовая доля компонента раствора X; m(X) – масса компонента раствора X; m – общая масса раствора.
Мольная доля χ компонента раствора равна отношению количества вещества данного компонента X к суммарному количеству вещества всех компонентов в растворе.
Для бинарного раствора, состоящего из растворённого вещества Х и растворителя (например, Н2О), мольная доля растворённого вещества равна:
χ(X) = n(X)/(n(X) + n(H2O)) (3)
Мольный процент представляет мольную долю, умноженную на 100:
χ(X), % = (χ(X)·100)% (4)
Объёмная доля φ компонента раствора определяется как отношение объёма данного компонента Х к общему объёму раствора V. Объёмная доля – безразмерная величина, её выражают в долях от единицы:
φ(Х) = V(Х)/V (0 < φ(Х) < 1) (5)
Объёмный процент представляет собой объёмную долю, умноженную на 100.
φ(X), % = (φ(X)·100)%
Молярность (молярная концентрация) C или Cм определяется как отношение количества растворённого вещества X, моль к объёму раствора V, л:
Cм(Х) = n(Х)/V (6)
Основной единицей молярности является моль/л или М. Пример записи молярной концентрации: Cм(H2SO4) = 0,8 моль/л или 0,8М.
Нормальность Сн определяется как отношение количества эквивалентов растворённого вещества X к объёму раствора V:
Cн(Х) = nэкв.(Х)/V (7)
Основной единицей нормальности является моль-экв/л. Пример записи нормальной концентрации: Сн(H2SO4) = 0,8 моль-экв/л или 0,8н.
Титр Т показывает, сколько граммов растворённого вещества X содержится в 1 мл или в 1 см3 раствора:
T(Х) = m(Х)/V (8)
где m(X) – масса растворённого вещества X, V – объём раствора в мл.
Моляльность раствора μ показывает количество растворённого вещества X в 1 кг растворителя:
μ(Х) = n(Х)/mр-ля (9)
где n(X) – число моль растворённого вещества X, mр-ля – масса растворителя в кг.
Мольное (массовое и объёмное) отношение – это отношение количеств (масс и объёмов соответственно) компонентов в растворе.
Необходимо иметь ввиду, что нормальность Сн всегда больше или равна молярности См. Связь между ними описывается выражением:
См = Сн · f(Х) (10)
Для получения навыков пересчёта молярности в нормальность и наоборот рассмотрим табл. 1. В этой таблице приведены значения молярности См, которые необходимо пересчитать в нормальность Сн и величины нормальности Сн, которые следует пересчитать в молярность См.
Пересчёт осуществляем по уравнению (10). При этом нормальность раствора находим по уравнению:
Сн = См/f(Х) (11)
Результаты расчётов приведены в табл. 2.
Таблица 1. К определению молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2 M Na2SO4 | ? | 6 н FeCl3 | ? |
| 1,5 M Fe2(SO4)3 | ? | 0,1 н Ва(ОН)2 | ? | |
| Реакции окисления-восстановления | 0,05 М KMnO4
в кислой среде |
? | 0,03 М KMnO4
в нейтральной среде |
? |
Таблица 2
Значения молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2M Ma2SO4 | 0,4н | 6н FeCl3 | 2М |
| 1,5M Fe2(SO4)3 | 9н | 0,1н Ва(ОН)2 | 0,05М | |
| Реакции окисления-восстановления | 0,05М KMnO4 в кислой среде | 0,25н | 0,03М KMnO4
в нейтральной среде |
0,01М |
Между объёмами V и нормальностями Сн реагирующих веществ существует соотношение:
V1 Сн,1 =V2 Сн,2 (12)
Примеры решения задач
Задача 1. Рассчитайте молярность, нормальность, моляльность, титр, мольную долю и мольное отношение для 40 мас.% раствора серной кислоты, если плотность этого раствора равна 1,303 г/см3.
Решение.
Масса 1 литра раствора равна М = 1000·1,303 = 1303,0 г.
Масса серной кислоты в этом растворе: m = 1303·0,4 = 521,2 г.
Молярность раствора См = 521,2/98 = 5,32 М.
Нормальность раствора Сн = 5,32/(1/2) = 10,64 н.
Титр раствора Т = 521,2/1000 = 0,5212 г/см3.
Моляльность μ = 5,32/(1,303 – 0,5212) = 6,8 моль/кг воды.
Обратите внимание на то, что в концентрированных растворах моляльность (μ) всегда больше молярности (См). В разбавленных растворах наоборот.
Масса воды в растворе: m = 1303,0 – 521,2 = 781,8 г.
Количество вещества воды: n = 781,8/18 = 43,43 моль.
Мольная доля серной кислоты: χ = 5,32/(5,32+43,43) = 0,109. Мольная доля воды равна 1– 0,109 = 0,891.
Мольное отношение равно 5,32/43,43 = 0,1225.
Задача 2. Определите объём 70 мас.% раствора серной кислоты (r = 1,611 г/см3), который потребуется для приготовления 2 л 0,1 н раствора этой кислоты.
Решение.
2 л 0,1н раствора серной кислоты содержат 0,2 моль-экв, т.е. 0,1 моль или 9,8 г.
Масса 70%-го раствора кислоты m = 9,8/0,7 = 14 г.
Объём раствора кислоты V = 14/1,611 = 8,69 мл.
Задача 3. В 5 л воды растворили 100 л аммиака (н.у.). Рассчитать массовую долю и молярную концентрацию NH3 в полученном растворе, если его плотность равна 0,992 г/см3.
Решение.
Масса 100 л аммиака (н.у.) m = 17·100/22,4 = 75,9 г.
Масса раствора m = 5000 + 75,9 = 5075,9 г.
Массовая доля NH3 равна 75,9/5075,9 = 0,0149 или 1,49 %.
Количество вещества NH3 равно 100/22,4 = 4,46 моль.
Объём раствора V = 5,0759/0,992 = 5,12 л.
Молярность раствора См = 4,46/5,1168 = 0,872 моль/л.
Задача 4. Сколько мл 0,1М раствора ортофосфорной кислоты потребуется для нейтрализации 10 мл 0,3М раствора гидроксида бария?
Решение.
Переводим молярность в нормальность:
0,1 М Н3РО4 0,3 н; 0,3 М Ва(ОН)2 0,6 н.
Используя выражение (12), получаем: V(H3P04)=10·0,6/0,3 = 20 мл.
Задача 5. Какой объем, мл 2 и 14 мас.% растворов NaCl потребуется для приготовления 150 мл 6,2 мас.% раствора хлорида натрия?
Плотности растворов NaCl:
| С, мас.% | 2 | 6 | 7 | 14 |
| ρ, г/см3 | 2,012 | 1,041 | 1,049 | 1,101 |
Решение.
Методом интерполяции рассчитываем плотность 6,2 мас.% раствора NaCl:
6,2% =6% + 0,2(7% —6% )/(7 – 6) = 1,0410 + 0,0016 = 1,0426 г/см3.
Определяем массу раствора: m = 150·1,0426 = 156,39 г.
Находим массу NaCl в этом растворе: m = 156,39·0,062 = 9,70 г.
Для расчёта объёмов 2 мас.% раствора (V1) и 14 мас.% раствора (V2) составляем два уравнения с двумя неизвестными (баланс по массе раствора и по массе хлорида натрия):
156,39 = V1 1,012 + V2 1,101 ,
9,70 = V1·1,012·0,02 + V2·1,101·0,14 .
Решение системы этих двух уравнений дает V1 =100,45 мл и V2 = 49,71 мл.
Задачи для самостоятельного решения
3.1. Рассчитайте нормальность 2 М раствора сульфата железа (III), взаимодействующего со щёлочью в водном растворе.
12 н.
3.2. Определите молярность 0,2 н раствора сульфата магния, взаимодействующего с ортофосфатом натрия в водном растворе.
0,1 M.
3.3. Рассчитайте нормальность 0,02 М раствора KMnO4, взаимодействующего с восстановителем в нейтральной среде.
0,06 н.
3.4. Определите молярность 0,1 н раствора KMnO4, взаимодействующего с восстановителем в кислой среде.
0,02 M.
3.5. Рассчитать нормальность 0,2 М раствора K2Cr2O7, взаимодействующего с восстановителем в кислой среде.
1,2 M.
3.6. 15 г CuSO4·5H2O растворили в 200 г 6 мас.% раствора CuSO4. Чему равна массовая доля сульфата меди, а также молярность, моляльность и титр полученного раствора, если его плотность составляет 1,107 г/мл?
0,1; 0,695М; 0,698 моль/кг; 0,111 г/мл.
3.7. При выпаривании 400 мл 12 мас.% раствора KNO3 (плотность раствора 1,076 г/мл) получили 2М раствор нитрата калия. Определить объём полученного раствора, его нормальную концентрацию и титр.
255 мл; 2 н; 0,203 г/мл.
3.8. В 3 л воды растворили 67,2 л хлороводорода, измеренного при нормальных условиях. Плотность полученного раствора равна 1,016 г/мл. Вычислить массовую, мольную долю растворённого вещества и мольное отношение растворённого вещества и воды в приготовленном растворе.
0,035; 0,0177; 1:55,6.
3.9. Сколько граммов NaCl надо добавить к 250 г 6 мас.% раствору NaCl, чтобы приготовить 500 мл раствора хлорида натрия, содержащего 16 мас.% NaCl? Плотность полученного раствора составляет 1,116 г/мл. Определить молярную концентрацию и титр полученного раствора.
74,28 г; 3,05 М; 0,179 г/мл.
3.10. Определить массу воды, в которой следует растворить 26 г ВaCl2·2H2O для получения 0,55М раствора ВaCl2 (плотность раствора 1,092 г/мл). Вычислить титр и моляльность полученного раствора.
192,4 г; 0,111 г/мл; 0,56 моль/кг.
Количество и концентрация вещества. Выражение и пересчеты из одних единиц в другие. Концентрации растворов. Массовая и молярная концентрация, Титр, Моляльность, Мольная, массовая, объемная доли. Нормальная (эквивалентная) концентрация, Фактор эквивалентности, Молярная масса эквивалента вещества.
Масса и количество вещества. Массу вещества (m) измеряют в граммах, а количество вещества (n) в молях. Если обозначить вещество буквой Х, то тогда его масса может быть обозначена как m (X), а количество – n (X).
- Моль–количество вещества, которое содержит столько определенных структурных единиц (молекул, атомов, ионов и т.д.), сколько атомов содержится в 0,012 кг изотопа углерода-12.
- При использовании термина моль следует указывать частицы, к которым относится этот термин. Соответственно, можно говорить «моль молекул», «моль атомов», «моль ионов» и т.д. (например, моль молекул водорода, моль атомов водорода, моль ионов водорода). Так как 0,012 кг углерода-12 содержит ~ 6,022х1023атомов углерода (постоянная Авогадро = число Авогадро), то моль– такое количество вещества, которое содержит 6,022х1023структурных элементов (молекул, атомов, ионов и др.).
- Отношение массы вещества к количеству вещества называют молярной массой.
- M (X) = m (X) / n(X)
- То есть, молярная масса (М) – это масса одного моля вещества. Основной системной (в международной системе единиц СИ) единицей молярной массы является кг/моль, а на практике – г/моль. Например, молярная масса самого легкого металла лития М (Li) = 6,939 г/моль, молярная масса газа метана М (СН4) = 16,043 г/моль. Молярная масса серной кислоты рассчитывается следующим образом M (Н2SО4) = 196 г / 2 моль = 96 г/моль.
- Молярная масса М (Х) — масса одного моля молекул вещества (г/моль). M(X)=mx/n (X), где mx – масса вещества, г; n (X) – количество вещества, моль. Молярная масса вещества Х численно равна относительной молекулярной массе Mr (в случае молекул) или относительной атомной массе (в случае атомов).
- Любое соединение (вещество), кроме молярной массы, характеризуется относительной молекулярной или атомной массой. Существует и эквивалентная масса Е, равная молекулярной, умноженной на фактор эквивалентности (см. далее).
- Относительная молекулярная масса (Mr) –это молярная масса соединения, отнесенная к 1/12 молярной массы атома углерода-12.
- Например,Мr(СН4) = 16,043. Относительная молекулярная масса – величина безразмерная.
- Относительная атомная масса (Ar) –это молярная масса атома вещества, отнесенная к 1/12 молярной массы атома углерода-12.
- Например, Ar(Li) = 6,039.
- Относительная молекулярная масса (Mr) –это молярная масса соединения, отнесенная к 1/12 молярной массы атома углерода-12.
Концентрация. Отношение количества или массы вещества, содержащегося в системе, к объему или массе этой системы называют концентрацией. Известно несколько способов выражения концентрации. В России чаще всего концентрацию обозначают заглавной буквой С, имея в виду прежде всего массовую концентрацию, которая по праву считается наиболее часто применяемой в экологическом мониторинге форма выражения концентрации (именно в ней измеряют величины ПДК).
- Массовая концентрация (С или β) –отношение массы компонента, содержащегося в системе (растворе), к объему этой системы (V). Это самая распространенная у российских аналитиков форма выражения концентрации.
- β(Х) =m (X) / V(смеси)
- Единица измерения массовой концентрации – кг/м3 или г/м3, кг/дм3или г/дм3(г/л), кг/см3, или г/см3 (г/мл), мкг/л или мкг/мл и т.д. Арифметические пересчеты из одних размерностей в другие не представляет большой сложности, но требуют внимательности. Например, массовая концентрация хлористоводородной (соляной) кислотыС(HCl) = 40 г / 1 л = 40 г/л = 0,04 г/мл = 4·10–5мкг/л и т.д. Обозначение массовой концентрации С нельзя путать с обозначением мольной концентрации (с), которая рассматривается далее.
- Типичными являются соотношения β(Х): 1000 мкг/л = 1 мкг/мл = 0,001 мг/мл.
- Массовая концентрация — это отношение массы к объему системы !!!! а отношение массы к массе это — массовая доля
Титр (Т) В объемном анализе (титриметрии) употребляется одна из форм массовой концентрации – титр. Титр раствора (Т) –это масса вещества, содержащегося в одном кубическом сантиметре = в одном миллилитре раствора.
- Единицы измерения титра — кг/см3, г/см3, г/мл и др.
Моляльность (b) —отношение количества растворенного вещества (в молях) к массе растворителя (в кг).
- b(Х) = n(X) / m (растворителя) = n(X) / m (R)
- Единица измерения моляльности —моль/кг. Например,b (HCl/H2O) = 2 моль/кг. Моляльная концентрация применяется в основном для концентрированных растворов.
Мольная (! )доля (х) –отношение количества вещества данного компонента (в молях), содержащегося в системе, к общему количеству вещества (в молях).
- х(Х) =n(X) / n(X) + n(Y)
- Мольнаядоля может быть выражена в долях единицы, процентах (%), промилле (тысячная часть %) и в миллионных (млн–1,ppm), миллиардных (млрд–1,ppb), триллионных (трлн–1,ppt) и др. долях, но единицей измерения все равно является отношение –моль/моль. Например,х(С2Н6) = 2 моль / 2 моль + 3 моль = 0,4 (40 %).
Массовая доля (ω) –отношение массы данного компонента, содержащегося в системе, к общей массе этой системы.
- ω (Х) = m(X) / m(смеси)
- Массовая доля измеряется в отношениях кг/кг (г/г). При этом она может быть выражена в долях единицы, процентах (%), промилле, миллионных, миллиардных и т.д. долях. Массовая доля данного компонента, выраженная в процентах, показывает, сколько граммов данного компонента содержится в 100 г раствора.
- Например, условно ω (KCl) = 12 г / 12 г + 28 г = 0,3 (30%).
Объемная доля (φ) –отношение объема компонента, содержащегося в системе, к общему объему системы.
- φ (Х)=v(X) /v(X)+v(Y)
- Объемная доля измеряется в отношениях л/л или мл/мл и тоже может быть выражена в долях единицы, процентах, промилле, миллионных и т.д. долях. Например, объемная доля кислорода газовой смеси составляет φ (О2)=0,15 л / 0,15 л + 0,56 л.
Молярная (мольная) концентрация (с) –отношение количества вещества (в молях), содержащегося в системе (например, в растворе), к объему V этой системы.
- с(Х) = n(X)/ V(смеси)
- Единица измерения молярной концентрации моль/м3(дольная производная, СИ – моль/л).
- Например,c (H2S04) = 1 моль/л,с(КОН) = 0,5 моль/л.
- Раствор, имеющий концентрацию 1 моль/л, называют молярным раствором и обозначают как 1 М раствор (не надо путать эту букву М, стоящую после цифры, с ранее указанным обозначением молярной массы, т.е. количества вещества М). Соответственно раствор, имеющий концентрацию 0,5 моль/л, обозначают 0,5 М (полумолярный р-р); 0,1 моль/л – 0,1 М (децимолярный р.р); 0,01 моль/л – 0,01 М (сантимолярный р-р) и т.д.
- Эта форма выражения концентрации также очень часто применяется в аналитике.
Нормальная (эквивалентная) концентрация (N), молярная концентрация эквивалента(Сэкв.)– это отношение количества вещества эквивалента в растворе (моль) к объему этого раствора (л).
- N = Сэкв (Х) = n (1/Z X) / V (смеси)
- Количество вещества (в молях), в котором реагирующими частицами являются эквиваленты, называется количеством вещества эквивалента nэ (1/Z X) = nэ (Х).
- Единица измерения нормальной концентрации («нормальности») тоже моль/л (дольная производная, СИ).
- Например, Сэкв.(1/3 АlCl3) = 1 моль/л.
- Раствор, в одном литре которого содержится 1 моль вещества эквивалентов, называют нормальным и обозначают 1 н. Соответственно могут быть 0,5 н («пятидецинормальный»); 0,01 н (сантинормальный») и т.п. растворы.
- Следует отметить, что понятие эквивалентностиреагирующих веществ в химических реакциях является одним из базовых для аналитической химии. Именно на эквивалентности как правило основаны вычисления результатов химического анализа (особенно в титриметрии). Рассмотрим несколько связанных с этим базовых с т.з. теории аналитики понятий.
Фактор эквивалентности (fэкв )– число, обозначающее, какая доля реальной частицы веществ Х (например, молекулы вещества X) эквивалентна одному иону водорода (в данной кислотно-основной реакции) или одному электрону (в данной окислительно-восстановнтельной реакции) Фактор эквивалентности fэкв (Х) рассчитывают на основании стехиометрии (соотношении участвующих частиц) в конкретном химическом процессе:
- fэкв (Х) = 1/Zx
- где Zx.— число замещенных или присоединенных ионов водорода (для кислотно-основных реакций) или число отданных или принятых электронов (для окислительно-восстановительных реакций);
- Х — химическая формула вещества.
- Фактор эквивалентности всегда равен или меньше единицы. Будучи умноженным на относительную молекулярную массу, он дает значение эквивалентной массы (Е).
- Для реакции:
- H2SО4 + 2 NaOH = Na2SО4 + 2 H2
- fэкв (H2SО4) = 1/2,fэкв (NaOH) = 1
- fэкв (H2SО4) = 1/2, т.е. это означает, что ½ молекулы серной кислоты дает для данной реакции 1 ион водорода (Н+), а соответственноfэкв (NaOH) = 1 означает, что одна молекулаNaOHсоединяется в данной реакции с одним ионом водорода.
- H2SО4 + 2 NaOH = Na2SО4 + 2 H2
- Для реакции:
- 10 FeSО4 + 2 KMnО4 + 8 H2SО4 = 5 Fe2(SО4)3 + 2 MnSО4 + K2SО4 + 8 H2О
- 2МпО4— + 8Н++5е—→ Мп2+– 2e—+ 4 Н2О
- 5 Fe2+ – 2e— → Fe3+
- fэкв (KMnО4) = 1/5 (кислая среда), т.е. 1/5 молекулы KMnО4 в данной реакции эквивалентна 1 электрону. При этом fэкв (Fe2+) = 1, т.е. один ион железа (II) также эквивалентен 1 электрону.
- Для реакции:
Эквивалент вещества Х –реальная или условная частица, которая в данной кислотно-основной реакции эквивалентна одному нону водорода или в данной окислительно-восстановительной реакции – одному электрону.
- Форма записи эквивалента: fэкв(Х) Х (см. табл.), или упрощенно Эх, где Х –химическая формула вещества, т.е. [Эх =fэкв(Х) Х]. Эквивалент безразмерен.
- Эквивалент кислоты(или основания) – такая условная частица данного вещества, которая в данной реакции титрования высвобождает один ион водорода или соединяется с ним, или каким-либо другим образом эквивалентна ему.
- Например, для первой из вышеуказанных реакций эквивалент серной кислоты — это условная частица вида ½ H2SО4 т.е. fэкв (H2SО4) = 1/Z= ½; ЭH2SО4 = ½ H2SО4.
- Эквивалент окисляющегося(или восстанавливающегося)вещества— это такая условная частица данного вещества, которая в данной химической реакции может присоединять один электрон или высвобождать его, или быть каким-либо другим образом эквивалентна этому одному электрону.
- Например, при окислении перманганатом в кислой среде эквивалент марганцевокислого калия – это условная частица вида 1/5 КМпО4, т.е. ЭКМпО4 =1/5КМпО4.
- Так как эквивалент вещества может меняться в зависимости от реакции, в которой это вещество участвует, необходимо указывать соответствующую реакцию.
- Например, для реакции Н3РО4+NaOH=NaH2PО4+H2O
- эквивалент фосфорной кислоты Э Н3РО4 == 1 Н3РО4.
- Для реакции Н3РО4+ 2NaOH=Na2HPО4+ 2H2O
- ее эквивалент Э Н3РО4 == ½ Н3РО4,.
- Например, для реакции Н3РО4+NaOH=NaH2PО4+H2O
- Принимая во внимание, что понятие моля позволяет пользоваться любыми видами условных частиц, можно дать понятиемолярной массы эквивалента вещества X. Напомним, что моль– это количество вещества, содержащее столько реальных или условных частиц, сколько атомов содержится в 12 г изотопа углерода12 С (6,02 1023). Под реальными частицами следует понимать атомы, ионы, молекулы, электроны и т.п., а под условными – такие как, например, 1/5 молекулы КМпО4в случае О/В реакции в кислой среде или ½ молекулы H2SО4 в реакции с гидроксидом натрия.
Молярная масса эквивалента вещества – масса одного моля эквивалентов этого вещества, равная произведению фактора эквивалентности fэкв (Х) на молярную массу вещества М (Х)1.
- Молярную массу эквивалента обозначают как М [fэкв (Х) Х] или с учетом равенства Эх = fэкв (Х) Х ее обозначают М [Эх]:
- М (Эх)= fэкв (Х) М (Х); М [Эх] = М (Х) /Z
- Например, молярная масса эквивалента КМпО4
- М (ЭКМпО4) =1/5КМпО4 = М 1/5 КМпО4 = 31,6 г/моль.
- Это означает, что масса одного моля условных частиц вида 1/5КМпО4 составляет 31,6 г/моль. По аналогии молярная масса эквивалента серной кислоты М ½ H2SО4 = 49 г/моль; фосфорной кислоты М ½ H3 РО4 = 49 г/моль и т.д.
- В соответствии с требованиями Международной системы (СИ) именно молярная концентрацияя вляется основным способом выражения концентрации растворов, но как уже отмечалось, на практике чаще применяетсямассовая концентрация.
- Рассмотрим основные формулы и соотношения между способами выражения концентрации растворов (см. табл. 1 и 2).
Таблица 1 Основные способы выражения концентрации растворов
| Термин концентрации (см. выше) | Единица измерения концентрации | Тип единицы концентрации | Формула, виды записи, примеры |
| 1. Массовая концентрация (С или β) | кг/м3 | Производная (СИ) |
|
| кг/дм3 | Дольная производная (СИ) | ||
| кг/л | Производная (внесистемная) | ||
| 2. Титр раствора (Т) | г/см3 | Дольная, производная (СИ) |
|
| г/мл | Дольная, производная (внесистемная) | ||
| 3. Титр раствора А по определяемому компоненту Х | г/см3 | Дольная, производная (СИ) |
|
| г/мл | Дольная, производная (внесистемная) | ||
| 4. Молярная концентрация, молярность(с) | моль/м3 | Производная (СИ) |
|
| моль/дм3 | Дольная производная (СИ) | ||
| моль/л | Производная (внесистемная) | ||
| 5. Молярная концентрация эквивалента (N), нормальность | моль/дм3 | Производная (СИ) |
|
| моль/л | Производная (внесистемная) | ||
| 6. Моляльная концентрация, моляльность (b) | моль/кг | Производная (СИ) |
|
| Термин концентрации (см. выше) | Единица измерения концентрации | Тип единицы концентрации | Формула, виды записи, примеры |
| 7. Мольная доля(х) | Относительная = моль/моль. (или в %, или в млн–1,ppm, в млрд–1 ,ppb, трлн–1,pptили в др. ед. | Безразмерная = 1 моль/моль = 1 = 100% = 106млн-1 = 109млрд-1 = 1012трлн-1 |
|
| 8. Массовая доля (ω) | Относительная = кг / кг. (или в %, или в млн–1,ppm, в млрд–1 ,ppb, трлн–1,ppt или в др. ед. |
Безразмерная = 1 кг/кг =1 г/г= 1 = 100% = 106млн-1 = 109млрд-1 = 1012трлн-1 |
|
| 9. Объемная доля (φ) | Относительная = м3/м3(илил/л, илимл/мл, или в %, или в млн–1,ppm, в млрд–1 ,ppb, или в др. ед. | Безразмерная = 1 кг/кг =1 г/г= 1 = 100% = 106млн-1 = 109млрд-1 = 1012трлн-1 |
|
* В расчетных уравнениях химическую формулу обычно ставят в индексе.
Пересчеты из одной формы выражения концентрации в другую являются достаточно простыми арифметическими задачами, с решениями которых аналитику приходится сталкиваться очень часто – при приготовлении аналитических растворов, при пробоотборе и пробоподготовке, при смешении пробы с аналитическими растворами, а также при статистической обработке и представлении получившихся результатов в цифровой и графической форме. Рассмотрим формулы для пересчета шести наиболее часто применяемых форм выражения концентраций (см. табл. 2).
Таблица 2 Формулы перехода от одних выражений концентраций растворов к другим (процентная, в граммах на грамм растворителя, в граммах на грамм раствора, нормальная, молярная, моляльная) 6
- Обозначения:
- d-плотность раствора,
- W- молекулярный вес (масса) растворенного вещества,
- E- грамм-эквивалентный вес растворенного вещества
- Коровин Н.В., Мингулина Э.И., Рыжова Н.Г.Лабораторные работы по химии.Учеб. пособие для техн. направ. и спец. вузов. /Под ред. Н.В. Коровина. – 2-е изд., перераб. и доп. – М.: Высш. шк., 1998. – с. 21–39.
- Жарский И.М., Кузьменко А.Л., Орехова С.Е.Лабораторный практикум по общей и неорганической химии./Под ред. Г.И. Новикова. – Мн.: Дизайн ПРО, 1998. – с. 3-27 и 46-56.
- Попадич И.А., Траубенберг С.Е, Осташенкова Н.В. и др.. Аналитическая химия.Учебное пособие для техникумов. М.: Химия, 1989. – с. 91-98.
- Зайцев О.С.Исследовательский практикум по общей химии.Учебное пособие. М.: Изд-во МГУ, 1994. – с. 91-98.
- Лурье Ю.Ю.Справочник по аналитической химии.Справ. Изд. – 6-е изд., перераб. и доп. – М.: Химия, 1989. – с. 172-173.