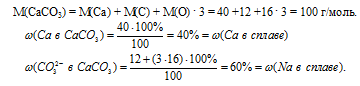-
Типичные заблуждения и ошибки, возникающие при решении задач на смеси.
-
Необходимые теоретические сведения.
-
Способы выражения состава смесей.
-
Электрохимический ряд напряжений металлов.
-
Реакции металлов с кислотами.
-
Продукты восстановления азотной кислоты.
-
Продукты восстановления серной кислоты.
-
Реакции металлов с водой и со щелочами.
-
Примеры решения задач.
-
Решение примера 1.
-
Решение примера 2.
-
Решение примера 4.
-
Решение примера 5.
-
Задачи для самостоятельного решения.
-
1. Несложные задачи с двумя компонентами смеси.
-
2. Задачи более сложные.
-
3. Три металла и сложные задачи.
-
Ответы и комментарии к задачам для самостоятельного решения.
Задачи на смеси — очень частый вид задач в химии. Они требуют чёткого представления о том, какие из веществ вступают в предлагаемую в задаче реакцию, а какие нет.
О смеси мы говорим тогда, когда у нас есть не одно, а несколько веществ (компонентов), «ссыпанных» в одну емкость. Вещества эти не должны взаимодействовать друг с другом.
Типичные заблуждения и ошибки, возникающие при решении задач на смеси.
- Попытка записать оба вещества в одну реакцию.
Получается примерно так:
«Смесь оксидов кальция и бария растворили в соляной кислоте…»
Уравнение реакции составляется так:
СаО + ВаО + 4HCl = СаCl2 + BaCl2 + 2H2O.
Это ошибка, ведь в этой смеси могут быть любые количества каждого оксида.
А в приведенном уравнении предполагается, что их равное количество. - Предположение, что их мольное соотношение соответствует коэффициентам в уравнениях реакций.
Например:
Zn + 2HCl = ZnCl2 + H2
2Al + 6HCl = 2AlCl3 + 3H2
Количество цинка принимается за х, а количество алюминия — за 2х (в соответствии с коэффициентом в уравнении реакции). Это тоже неверно. Эти количества могут быть любыми и они никак между собой не связаны. - Попытки найти «количество вещества смеси», поделив её массу на сумму молярных масс компонентов.
Это действие вообще никакого смысла не имеет. Каждая молярная масса может относиться только к отдельному веществу.
Часто в таких задачах используется реакция металлов с кислотами. Для решения таких задач надо точно знать, какие металлы с какими кислотами взаимодействуют, а какие — нет.
к оглавлению ▴
Необходимые теоретические сведения.
Способы выражения состава смесей.
- Массовая доля компонента в смеси — отношение массы компонента к массе всей смеси. Обычно массовую долю выражают в %, но не обязательно.
ω [«омега»] = mкомпонента / mсмеси
- Мольная доля компонента в смеси — отношение числа моль (количества вещества) компонента к суммарному числу моль всех веществ в смеси. Например, если в смесь входят вещества А, В и С, то:
χ [«хи»] компонента А = nкомпонента А /
(
n(A) + n(B) + n(С)
)
- Мольное соотношение компонентов. Иногда в задачах для смеси указывается мольное соотношение её составляющих. Например:
nкомпонента А : nкомпонента В = 2 : 3
- Объёмная доля компонента в смеси (только для газов) — отношение объёма вещества А к общему объёму всей газовой смеси.
φ [«фи»] = Vкомпонента / Vсмеси
к оглавлению ▴
Электрохимический ряд напряжений металлов.
Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb H Sb Bi Cu Hg Ag Pd Pt Au
Реакции металлов с кислотами.
- С минеральными кислотами, к которым относятся все растворимые кислоты (кроме азотной и концентрированной серной, взаимодействие которых с металлами происходит по-особому), реагируют только металлы, в электрохимическом ряду напряжений находящиеся до (левее) водорода.
- При этом металлы, имеющие несколько степеней окисления (железо, хром, марганец, кобальт), проявляют минимальную из возможных степень окисления — обычно это +2.
- Взаимодействие металлов с азотной кислотой приводит к образованию, вместо водорода, продуктов восстановления азота, а с серной концентрированной кислотой — к выделению продуктов восстановления серы. Так как реально образуется смесь продуктов восстановления, часто в задаче есть прямое указание на конкретное вещество.
к оглавлению ▴
Продукты восстановления азотной кислоты.
| Чем активнее металл и чем меньше концентрация кислоты, тем дальше восстанавливается азот | ||||
| NO2 | NO | N2O | N2 | NH4NO3 |
| Неактивные металлы (правее железа) + конц. кислота Неметаллы + конц. кислота |
Неактивные металлы (правее железа) + разб. кислота | Активные металлы (щелочные, щелочноземельные, цинк) + конц. кислота | Активные металлы (щелочные, щелочноземельные, цинк) + кислота среднего разбавления | Активные металлы (щелочные, щелочноземельные, цинк) + очень разб. кислота |
| Пассивация: с холодной концентрированной азотной кислотой не реагируют: Al, Cr, Fe, Be, Co. |
||||
| Не реагируют с азотной кислотой ни при какой концентрации: Au, Pt, Pd. |
к оглавлению ▴
Продукты восстановления серной кислоты.
| SO2 | S | H2S | H2 |
| Неактивные металлы (правее железа) + конц. кислота Неметаллы + конц. кислота |
Щелочноземельные металлы + конц. кислота | Щелочные металлы и цинк + концентрированная кислота. | Разбавленная серная кислота ведет себя как обычная минеральная кислота (например, соляная) |
| Пассивация: с холодной концентрированной серной кислотой не реагируют: Al, Cr, Fe, Be, Co. |
|||
| Не реагируют с серной кислотой ни при какой концентрации: Au, Pt, Pd. |
к оглавлению ▴
Реакции металлов с водой и со щелочами.
- В воде при комнатной температуре растворяются только металлы, которым соответствуют растворимые основания (щелочи). Это щелочные металлы (Li, Na, K, Rb, Cs), а также металлы IIA группы: Са, Sr, Ba. При этом образуется щелочь и водород. При кипячении в воде также можно растворить магний.
- В щелочи могут раствориться только амфотерные металлы: алюминий, цинк и олово. При этом образуются гидроксокомплексы и выделяется водород.
к оглавлению ▴
Примеры решения задач.
Рассмотрим три примера задач, в которых смеси металлов реагируют с соляной кислотой:
Пример 1. При действии на смесь меди и железа массой 20 г избытком соляной кислоты выделилось 5,6 л газа (н.у.). Определить массовые доли металлов в смеси.
В первом примере медь не реагирует с соляной кислотой, то есть водород выделяется при реакции кислоты с железом. Таким образом, зная объём водорода, мы сразу сможем найти количество и массу железа. И, соответственно, массовые доли веществ в смеси.
к оглавлению ▴
Решение примера 1.
- Находим количество водорода:
n = V / Vm = 5,6 / 22,4 = 0,25 моль. - По уравнению реакции:
0,25 0,25 Fe + 2HCl = FeCl2 + H2 1 моль 1 моль Количество железа тоже 0,25 моль. Можно найти его массу:
mFe = 0,25 • 56 = 14 г. - Теперь можно рассчитать массовые доли металлов в смеси:
ωFe = mFe/mвсей смеси = 14 / 20 = 0,7 = 70%
Ответ: 70% железа, 30% меди.
Пример 2. При действии на смесь алюминия и железа массой 11 г избытком соляной кислоты выделилось 8,96 л газа (н.у.). Определить массовые доли металлов в смеси.
Во втором примере в реакцию вступают оба металла. Здесь уже водород из кислоты выделяется в обеих реакциях. Поэтому прямым расчётом здесь нельзя воспользоваться. В таких случаях удобно решать с помощью очень простой системы уравнений, приняв за х — число моль одного из металлов, а за у — количество вещества второго.
к оглавлению ▴
Решение примера 2.
- Находим количество водорода:
n = V / Vm = 8,96 / 22,4 = 0,4 моль. - Пусть количество алюминия — х моль, а железа у моль. Тогда можно выразить через х и у количество выделившегося водорода:
x 1,5x (мольное соотношение Al:Н2 = 2:3) 2Al + 6HCl = 2AlCl3 + 3H2 y y Fe + 2HCl = FeCl2 + H2 - Нам известно общее количество водорода: 0,4 моль. Значит,
1,5х + у = 0,4 (это первое уравнение в системе). - Для смеси металлов нужно выразить массы через количества веществ.
m = M • n
Значит, масса алюминия
mAl = 27x,
масса железа
mFe = 56у,
а масса всей смеси
27х + 56у = 11 (это второе уравнение в системе). - Итак, мы имеем систему из двух уравнений:
{ 1,5x + y = 0,4 27x + 56y = 11 Решать такие системы гораздо удобнее методом вычитания, домножив первое уравнение на 18:
27х + 18у = 7,2
и вычитая первое уравнение из второго:(56 − 18)у = 11 − 7,2
у = 3,8 / 38 = 0,1 моль (Fe)
х = 0,2 моль (Al) - Дальше находим массы металлов и их массовые доли в смеси:
mFe = n • M = 0,1 • 56 = 5,6 г
mAl = 0,2 • 27 = 5,4 г
ωFe = mFe / mсмеси = 5,6 / 11 = 0,50909 (50,91%),соответственно,
ωAl = 100% − 50,91% = 49,09%
Ответ: 50,91% железа, 49,09% алюминия.
Пример 3. 16 г смеси цинка, алюминия и меди обработали избытком раствора соляной кислоты. При этом выделилось 5,6 л газа (н.у.) и не растворилось 5 г вещества. Определить массовые доли металлов в смеси.
В третьем примере два металла реагируют, а третий металл (медь) не вступает в реакцию. Поэтому остаток 5 г — это масса меди. Количества остальных двух металлов — цинка и алюминия (учтите, что их общая масса 16 − 5 = 11 г) можно найти с помощью системы уравнений, как в примере №2.
Ответ к Примеру 3: 56,25% цинка, 12,5% алюминия, 31,25% меди.
Следующие три примера задач (№4, 5, 6) содержат реакции металлов с азотной и серной кислотами. Главное в таких задачах — правильно определить, какой металл будет растворяться в ней, а какой не будет.
Пример 4. На смесь железа, алюминия и меди подействовали избытком холодной концентрированной серной кислоты. При этом часть смеси растворилась, и выделилось 5,6 л газа (н.у.). Оставшуюся смесь обработали избытком раствора едкого натра. Выделилось 3,36 л газа и осталось 3 г не растворившегося остатка. Определить массу и состав исходной смеси металлов.
В этом примере надо помнить, что холодная концентрированная серная кислота не реагирует с железом и алюминием (пассивация), но реагирует с медью. При этом выделяется оксид серы (IV).
Со щелочью реагирует только алюминий — амфотерный металл (кроме алюминия, в щелочах растворяются ещё цинк и олово, в горячей концентрированной щелочи — ещё можно растворить бериллий).
к оглавлению ▴
Решение примера 4.
- С концентрированной серной кислотой реагирует только медь, число моль газа:
nSO2 = V / Vm = 5,6 / 22,4 = 0,25 моль0,25 0,25 Cu + 2H2SO4 (конц.) = CuSO4 + SO2 + 2H2O (не забудьте, что такие реакции надо обязательно уравнивать с помощью электронного баланса)
Так как мольное соотношение меди и сернистого газа 1:1, то меди тоже 0,25 моль.
Можно найти массу меди:
mCu = n • M = 0,25 • 64 = 16 г. - В реакцию с раствором щелочи вступает алюминий, при этом образуется гидроксокомплекс алюминия и водород:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2Al0 − 3e = Al3+ | 2 2H+ + 2e = H2 3 - Число моль водорода:
nH2 = 3,36 / 22,4 = 0,15 моль,
мольное соотношение алюминия и водорода 2:3 и, следовательно,
nAl = 0,15 / 1,5 = 0,1 моль.
Масса алюминия:
mAl = n • M = 0,1 • 27= 2,7 г - Остаток — это железо, массой 3 г. Можно найти массу смеси:
mсмеси = 16 + 2,7 + 3 = 21,7 г. - Массовые доли металлов:
ωCu = mCu / mсмеси = 16 / 21,7 = 0,7373 (73,73%)
ωAl = 2,7 / 21,7 = 0,1244 (12,44%)
ωFe = 13,83%
Ответ: 73,73% меди, 12,44% алюминия, 13,83% железа.
Пример 5. 21,1 г смеси цинка и алюминия растворили в 565 мл раствора азотной кислоты, содержащего 20 мас. % НNО3 и имеющего плотность 1,115 г/мл. Объем выделившегося газа, являющегося простым веществом и единственным продуктом восстановления азотной кислоты, составил 2,912 л (н.у.). Определите состав полученного раствора в массовых процентах. (РХТУ)
В тексте этой задачи чётко указан продукт восстановления азота — «простое вещество». Так как азотная кислота с металлами не даёт водорода, то это — азот. Оба металла растворились в кислоте.
В задаче спрашивается не состав исходной смеси металлов, а состав получившегося после реакций раствора. Это делает задачу более сложной.
к оглавлению ▴
Решение примера 5.
- Определяем количество вещества газа:
nN2 = V / Vm = 2,912 / 22,4 = 0,13 моль. - Определяем массу раствора азотной кислоты, массу и количество вещества растворенной HNO3:
mраствора = ρ • V = 1,115 • 565 = 630,3 г
mHNO3 = ω • mраствора = 0,2 • 630,3 = 126,06 г
nHNO3 = m / M = 126,06 / 63 = 2 мольОбратите внимание, что так как металлы полностью растворились, значит — кислоты точно хватило (с водой эти металлы не реагируют). Соответственно, надо будет проверить, не оказалась ли кислота в избытке, и сколько ее осталось после реакции в полученном растворе.
- Составляем уравнения реакций (не забудьте про электронный баланс) и, для удобства расчетов, принимаем за 5х — количество цинка, а за 10у — количество алюминия. Тогда, в соответствии с коэффициентами в уравнениях, азота в первой реакции получится х моль, а во второй — 3у моль:
5x x 5Zn + 12HNO3 = 5Zn(NO3)2 + N2 + 6H2O Zn0 − 2e = Zn2+ | 5 2N+5 + 10e = N2 1 10y 3y 10Al + 36HNO3 = 10Al(NO3)3 + 3N2 + 18H2O Al0 − 3e = Al3+ | 10 2N+5 + 10e = N2 3 - Тогда, учитывая, что масса смеси металлов 21,1 г, их молярные массы — 65 г/моль у цинка и 27 г/моль у алюминия, получим следующую систему уравнений:
{ х + 3у = 0,13 (количество азота) 65 • 5х + 27 • 10у = 21,1 (масса смеси двух металлов) Решать эту систему удобно, домножив первое уравнение на 90 и вычитая первое уравнение их второго.
х = 0,04, значит, nZn = 0,04 • 5 = 0,2 моль
у = 0,03, значит, nAl = 0,03 • 10 = 0,3 мольПроверим массу смеси:
0,2 • 65 + 0,3 • 27 = 21,1 г.
- Теперь переходим к составу раствора. Удобно будет переписать реакции ещё раз и записать над реакциями количества всех прореагировавших и образовавшихся веществ (кроме воды):
0,2 0,48 0,2 0,03 5Zn + 12HNO3 = 5Zn(NO3)2 + N2 + 6H2O 0,3 1,08 0,3 0,09 10Al + 36HNO3 = 10Al(NO3)3 + 3N2 + 18H2O - Следующий вопрос: осталась ли в растворе азотная кислота и сколько её осталось?
По уравнениям реакций, количество кислоты, вступившей в реакцию:
nHNO3 = 0,48 + 1,08 = 1,56 моль,
т.е. кислота была в избытке и можно вычислить её остаток в растворе:
nHNO3ост. = 2 − 1,56 = 0,44 моль. - Итак, в итоговом растворе содержатся:
нитрат цинка в количестве 0,2 моль:
mZn(NO3)2 = n • M = 0,2 • 189 = 37,8 г
нитрат алюминия в количестве 0,3 моль:
mAl(NO3)3 = n • M = 0,3 • 213 = 63,9 г
избыток азотной кислоты в количестве 0,44 моль:
mHNO3ост. = n • M = 0,44 • 63 = 27,72 г - Какова масса итогового раствора?
Вспомним, что масса итогового раствора складывается из тех компонентов, которые мы смешивали (растворы и вещества) минус те продукты реакции, которые ушли из раствора (осадки и газы):Масса
нового
раствора= Сумма масс
смешиваемых
растворов и/или веществ— Масса осадков — Масса газов Тогда для нашей задачи:
mнов. раствора = масса раствора кислоты + масса сплава металлов — масса азота
mN2 = n • M = 28 • (0,03 + 0,09) = 3,36 г
mнов. раствора = 630,3 + 21,1 − 3,36 = 648,04 г - Теперь можно рассчитать массовые доли веществ в получившемся растворе:
ωZn(NO3)2 = mв-ва / mр-ра = 37,8 / 648,04 = 0,0583
ωAl(NO3)3 = mв-ва / mр-ра = 63,9 / 648,04 = 0,0986
ωHNO3ост. = mв-ва / mр-ра = 27,72 / 648,04 = 0,0428
Ответ: 5,83% нитрата цинка, 9,86% нитрата алюминия, 4,28% азотной кислоты.
Пример 6. При обработке 17,4 г смеси меди, железа и алюминия избытком концентрированной азотной кислоты выделилось 4,48 л газа (н.у.), а при действии на эту смесь такой же массы избытка хлороводородной кислоты — 8,96 л газа (н.у.). Определите состав исходной смеси. (РХТУ)
При решении этой задачи надо вспомнить, во-первых, что концентрированная азотная кислота с неактивным металлом (медь) даёт NO2, а железо и алюминий с ней не реагируют. Соляная кислота, напротив, не реагирует с медью.
Ответ к примеру 6: 36,8% меди, 32,2% железа, 31% алюминия.
к оглавлению ▴
Задачи для самостоятельного решения.
1. Несложные задачи с двумя компонентами смеси.
1-1. Смесь меди и алюминия массой 20 г обработали 96 %-ным раствором азотной кислоты, при этом выделилось 8,96 л газа (н. у.). Определить массовую долю алюминия в смеси.
1-2. Смесь меди и цинка массой 10 г обработали концентрированным раствором щелочи. При этом выделилось 2,24 л газа (н.y.). Вычислите массовую долю цинка в исходной смеси.
1-3. Смесь магния и оксида магния массой 6,4 г обработали достаточным количеством разбавленной серной кислоты. При этом выделилось 2,24 л газа (н.у.). Найти массовую долю магния в смеси.
1-4. Смесь цинка и оксида цинка массой 3,08 г растворили в разбавленной серной кислоте. Получили сульфат цинка массой 6,44 г. Вычислите массовую долю цинка в исходной смеси.
1-5. При действии смеси порошков железа и цинка массой 9,3 г на избыток раствора хлорида меди (II) образовалось 9,6 г меди. Определите состав исходной смеси.
1-6. Какая масса 20%-ного раствора соляной кислоты потребуется для полного растворения 20 г смеси цинка с оксидом цинка, если при этом выделился водород объемом 4,48 л (н.у.)?
1-7. При растворении в разбавленной азотной кислоте 3,04 г смеси железа и меди выделяется оксид азота (II) объемом 0,896 л (н.у.). Определите состав исходной смеси.
1-8. При растворении 1,11 г смеси железных и алюминиевых опилок в 16%-ном растворе соляной кислоты (ρ = 1,09 г/мл) выделилось 0,672 л водорода (н.у.). Найдите массовые доли металлов в смеси и определите объем израсходованной соляной кислоты.
к оглавлению ▴
2. Задачи более сложные.
2-1. Смесь кальция и алюминия массой 18,8 г прокалили без доступа воздуха с избытком порошка графита. Продукт реакции обработали разбавленной соляной кислотой, при этом выделилось 11,2 л газа (н.у.). Определите массовые доли металлов в смеси.
2-2. Для растворения 1,26 г сплава магния с алюминием использовано 35 мл 19,6%-ного раствора серной кислоты (ρ = 1,1 г/мл). Избыток кислоты вступил в реакцию с 28,6 мл раствора гидрокарбоната калия с концентрацией 1,4 моль/л. Определите массовые доли металлов в сплаве и объем газа (н.у.), выделившегося при растворения сплава.
2-3. При растворении 27,2 г смеси железа и оксида железа (II) в серной кислоте и выпаривании раствора досуха образовалось 111,2 г железного купороса — гептагидрата сульфата железа (II). Определите количественный состав исходной смеси.
2-4. При взаимодействии железа массой 28 г с хлором образовалась смесь хлоридов железа (II) и (III) массой 77,7 г. Вычислите массу хлорида железа (III) в полученной смеси.
2-5. Чему была равна массовая доля калия в его смеси с литием, если в результате обработки этой смеси избытком хлора образовалась смесь, в которой массовая доля хлорида калия составила 80%?
2-6. После обработки избытком брома смеси калия и магния общей массой 10,2 г масса полученной смеси твердых веществ оказалась равной 42,2 г. Эту смесь обработали избытком раствора гидроксида натрия, после чего осадок отделили и прокалили до постоянной массы. Вычислите массу полученного при этом остатка.
2-7. Смесь лития и натрия общей массой 7,6 г окислили избытком кислорода, всего было израсходовано 3,92 л (н.у.). Полученную смесь растворили в 80 г 24,5%-го раствора серной кислоты. Вычислите массовые доли веществ в образовавшемся растворе.
2-8. Сплав алюминия с серебром обработали избытком концентрированного раствора азотной кислоты, остаток растворили в уксусной кислоте. Объемы газов, выделившихся в обеих реакциях измеренные при одинаковых условиях, оказались равными между собой. Вычислите массовые доли металлов в сплаве.
к оглавлению ▴
3. Три металла и сложные задачи.
3-1. При обработке 8,2 г смеси меди, железа и алюминия избытком концентрированной азотной кислоты выделилось 2,24 л газа. Такой же объем газа выделяется и при обработке этой же смеси такой же массы избытком разбавленной серной кислоты (н.у.). Определите состав исходной смеси в массовых процентах.
3-2. 14,7 г смеси железа, меди и алюминия, взаимодействуя с избытком разбавленной серной кислоты, выделяет 5,6 л водорода (н.у.). Определите состав смеси в массовых процентах, если для хлорирования такой же навески смеси требуется 8,96 л хлора (н.у.).
3-3. Железные, цинковые и алюминиевые опилки смешаны в мольном отношении 2:4:3 (в порядке перечисления). 4,53 г такой смеси обработали избытком хлора. Полученную смесь хлоридов растворили в 200 мл воды. Определить концентрации веществ в полученном растворе.
3-4. Сплав меди, железа и цинка массой 6 г (массы всех компонентов равны) поместили в 18,25 % раствор соляной кислоты массой 160 г. Рассчитайте массовые доли веществ в получившемся растворе.
3-5. 13,8 г смеси, состоящей из кремния, алюминия и железа, обработали при нагревании избытком гидроксида натрия, при этом выделилось 11,2 л газа (н.у.). При действии на такую массу смеси избытка соляной кислоты выделяется 8,96 л газа (н.у.). Определите массы веществ в исходной смеси.
3-6. При обработке смеси цинка, меди и железа избытком концентрированного раствора щелочи выделился газ, а масса нерастворившегося остатка оказалась в 2 раза меньше массы исходной смеси. Этот остаток обработали избытком соляной кислоты, объем выделившегося газа при этом оказался равным объему газа, выделившегося в первом случае (объемы измерялись при одинаковых условиях). Вычислите массовые доли металлов в исходной смеси.
3-7. Имеется смесь кальция, оксида кальция и карбида кальция с молярным соотношением компонентов 3:2:5 (в порядке перечисления). Какой минимальный объем воды может вступить в химическое взаимодействие с такой смесью массой 55,2 г?
3-8. Смесь хрома, цинка и серебра общей массой 7,1 г обработали разбавленной соляной кислотой, масса нерастворившегося остатка оказалась равной 3,2 г. Раствор после отделения осадка обработали бромом в щелочной среде, а по окончании реакции обработали избытком нитрата бария. Масса образовавшегося осадка оказалась равной 12,65 г. Вычислите массовые доли металлов в исходной смеси.
к оглавлению ▴
Ответы и комментарии к задачам для самостоятельного решения.
1-1. 36% (алюминий не реагирует с концентрированной азотной кислотой);
1-2. 65% (в щелочи растворяется только амфотерный металл — цинк);
1-3. 37,5%;
1-4. 21,1%;
1-5. 30,1% Fe (железо, вытесняя медь, переходит в степень окисления +2);
1-6. 88,8 г;
1-7. 36,84% Fe (железо в азотной кислоте переходит в +3);
1-8. 75,68% Fe (железо в реакции с соляной кислотой переходит в +2); 12,56 мл раствора HCl.
2-1. 42,55 % Са (кальций и алюминий с графитом (углеродом) образуют карбиды СаС2 и Al4C3; при их гидролизе водой или HCl выделяются, соответственно, ацетилен С2Н2 и метан СН4);
2-2. 74,3 % Mg;
2-3. 61,76% Fe (гептагидрат сульфата железа — FeSO4 • 7H2O);
2-4. 44,7 г;
2-5. 92,7%;
2-6. 4 г;
2-7. 5,9% Li2SO4, 22,9% Na2SO4, 5,47% H2O2 (при окислении кислородом лития образуется его оксид, а при окислении натрия — пероксид Na2O2, который в воде гидролизуется до пероксида водорода и щелочи);
2-8. 14,3 % Al;
3-1. 39% Cu, 3,4% Al;
3-2. 38,1% Fe, 43,5% Cu;
3-3. 1,53% FeCl3, 2,56% ZnCl2, 1,88% AlCl3 (железо в реакции с хлором переходит в степень окисления +3);
3-4. 2,77% FeCl2, 2,565% ZnCl2, 14,86% HCl (не забудьте, что медь не реагирует с соляной кислотой, поэтому её масса не входит в массу нового раствора);
3-5. 2,8 г Si, 5,4 г Al, 5,6 г Fe (кремний — неметалл, он реагирует с раствором щелочи, образуя силикат натрия и водород; с соляной кислотой он не реагирует);
3-6. 6,9% Cu, 43,1% Fe, 50% Zn;
3-7. 32,4 мл;
3-8. 45,1% Ag, 36,6% Cr, 18,3% Zn (хром при растворении в соляной кислоте переходит в хлорид хрома (II), который при действии брома в щелочной среде переходит в хромат; при добавлении соли бария образуется нерастворимый хромат бария)
Спасибо за то, что пользуйтесь нашими материалами.
Информация на странице «Задачи на смеси и сплавы металлов» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать необходимые и поступить в ВУЗ или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из разделов нашего сайта.
Публикация обновлена:
08.05.2023
Формулы для расчета процентного содержания металлов в сплаве приведены под калькулятором.
Процентное содержание металлов в сплаве
Плотность первого металла
Плотность второго металла
Точность вычисления
Знаков после запятой: 2
Процентное содержание первого металла
Процентное содержание второго металла
Расчет процентного содержания металлов в сплаве двух металлов
Пусть нам известны физические характеристики сплава, масса и плотность, их можно просто померять, и плотности металлов, составляющих сплав (например, их можно узнать из справочника).
Имеем следующие очевидные соотношения:
,
где
m — масса сплава,
V — объем сплава,
m₁ — масса первого металла,
V₁ — объем первого металла,
ρ₁ — плотность первого металла,
m₂ — масса второго металла,
V₂ — объем второго металла,
ρ₂ — плотность второго металла.
m₁, V₁, m₂, V₂ — четыре неизвестных на четыре уравнения — существует единственное решение.
Выполнив подстановки, можно получить довольно громоздкие формулы для m₁ и m₂
Процентные соотношения получим, поделив массы металлов на массу сплава.
Решение задач на селективное разделение смеси
Определение массовой доли каждого металла в исходном сплаве
Задача 3.
Образец сплава натрия с кальцием залили большим избытком воды. Получился только прозрачный раствор. Далее к нему добавили избыток раствора карбоната натрия. Определите массовую долю каждого металла в исходном сплаве, если масса выпавшего осадка оказалась равной массе исходного образца.
Дано:
равенство масс исходного образца и осадка: mисх. обр. = mосадка.
Найти:
массовую долю кальция в сплаве: 
массовую долю натрия в сплаве: 
Решение:
Данная задача интересна полным отсутствием конкретных количественных данных. Она имеет достаточно простое и изящное решение.
Проанализируем химические превращения, описанные в условии.
1. С водой взаимодействуют оба компонента сплава. Запишем для каждого из них свое уравнение реакции:
2Nа + 2Н2О = 2NаОН + Н2↑
Са + 2Н2О = Са(ОН)2 + Н2↑
После реакции получается раствор двух гидроксидов. Причем Са(ОН)2 несмотря на свою малую растворимость растворился весь, т.к. в условии сказано, что получился только прозрачный раствор.
2. Nа2СО3 для полученного раствора двух гидроксидов является селективным реактивом. Он будет взаимодействовать с образованием осадка только с Са(ОН)2:
Са(ОН)2 + Nа2СО3 = СаСО3 ↓ + 2NаОН.
При избыточном добавлении Nа2СО3 в осадок в виде СаСО3 переведется весь кальций, который исходно был в гидроксиде кальция, а до этого в сплаве. Следовательно, масса кальция в исходном сплаве равна массе кальция, в выпавшем в осадок карбонате:
m(Са в сплаве) = m(Cа в СаСO3).
В условии же указано, что масса выпавшего осадка равна массе исходного сплава:
m(СаСО3) = m(сплава) = m(Са в сплаве) + m(Nа в сплаве).
Из последнего равенства можно сделать вывод, что масса натрия в сплаве равна массе карбонатных ионов в осадке карбоната кальция.

Следовательно,
(Са в сплаве) = 


Таким образом, чтобы определить массовые доли Са и Nа в исходном сплаве необходимо определить массовые доли ионов Са2+ и (СО3)2– в карбонате кальция.
Ответ: 

Найдите правильный ответ на вопрос ✅ «Вычеслите массовую доли металлов в сплаве, называемом дюралюмином, если известно, что образец такого сплава был получен при сплавлении 15 г …» по предмету 📘 Химия, а если вы сомневаетесь в правильности ответов или ответ отсутствует, то попробуйте воспользоваться умным поиском на сайте и найти ответы на похожие вопросы.
Смотреть другие ответы
Главная » Химия » Вычеслите массовую доли металлов в сплаве, называемом дюралюмином, если известно, что образец такого сплава был получен при сплавлении 15 г меди, 9 г марганца, 3 г магния и 267 г алюминия.
2023-03-04
Сплав железа с хромом — феррохром — получают восстановлением хромистого железняка $Fe(CrO_{2})_{2}$. Определите массовые доли металлов в полученном сплаве, учитывая, что соединения железа и хрома, входящие в состав руды, восстанавливаются полностью, а сплав содержит углерод и другие примеси, массовая доля которых равна 5%.
Решение:
Выбираем для расчетов образец хромистого железняка $Fe(CrO_{2})_{2}$ массой 100 г, т.е. т $m(Fe(CrO_{2})_{2}) = 100 г$. Определяем количество вещества хромистого железняка:
$n(Fe(CrO_{2})_{2}) = frac{m(Fe(CrO_{2})_{2})}{M(Fe(CrO_{2})_{2} )}; n(Fe(CrO_{2})_{2}) = frac{100}{224} моль = 0,4464 моль$.
Из формулы хромистою железняка следует:
$n(Fe) = n(Fe(CrO_{2})_{2}); n(Fe) = 0,4464 моль$;
$n(Cr) = 2n (Fe(CrO_{2})_{2}); n(Cr) = 2 cdot 0,4464 моль = 0,8928 моль$.
Массы железа и хрома, которые могут быть получены, составляют:
$m(Fe) = n(Fe) M(Fe); m(Fe) = 0,4464 cdot 56 г = 25,00 г$;
$m(Cr) = n(Cr) M(Cr); m(Cr) = 0,8929 cdot 52 г = 46,43 г$.
Массовая доля железа и хрома в сплаве составляет:
$omega (Cr) + omega (Fe) = 1 — omega (примесей); omega (Cr) + omega (Fe) = 1 — 0,05 = 0,95$.
Находим массу сплава, который будет получен:
$m(сплава) = frac{m(Fe)+m(Cr)}{ omega(Fe) + omega (Cr)}; m(сплава) = frac{25,00 + 46,43}{0,95} г = 75,19 г$.
Определяем массовые доли железа и хрома в полученном феррохроме:
$omega (Fe) = frac{m(Fe)}{m(сплава)}; omega(Fe) = frac{25,00}{75,19} = 0,3325$, или 33,25%;
$omega (Cr) = frac{m(Cr)}{m(сплава)}; omega(Cr) = frac{46,43}{75,19} = 0,6175$, или 61,75%.