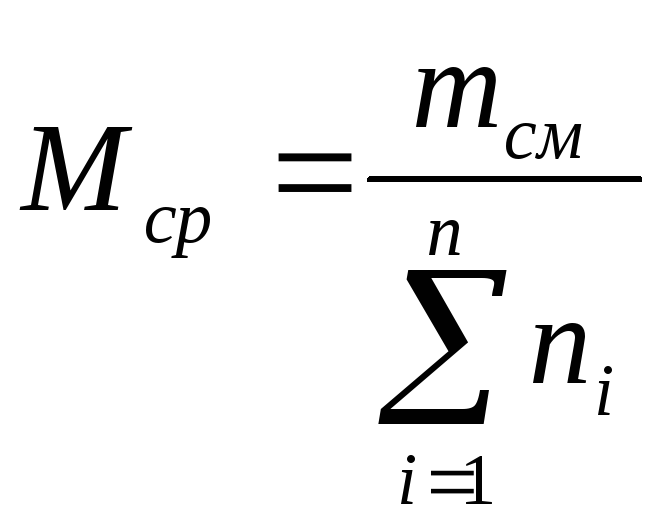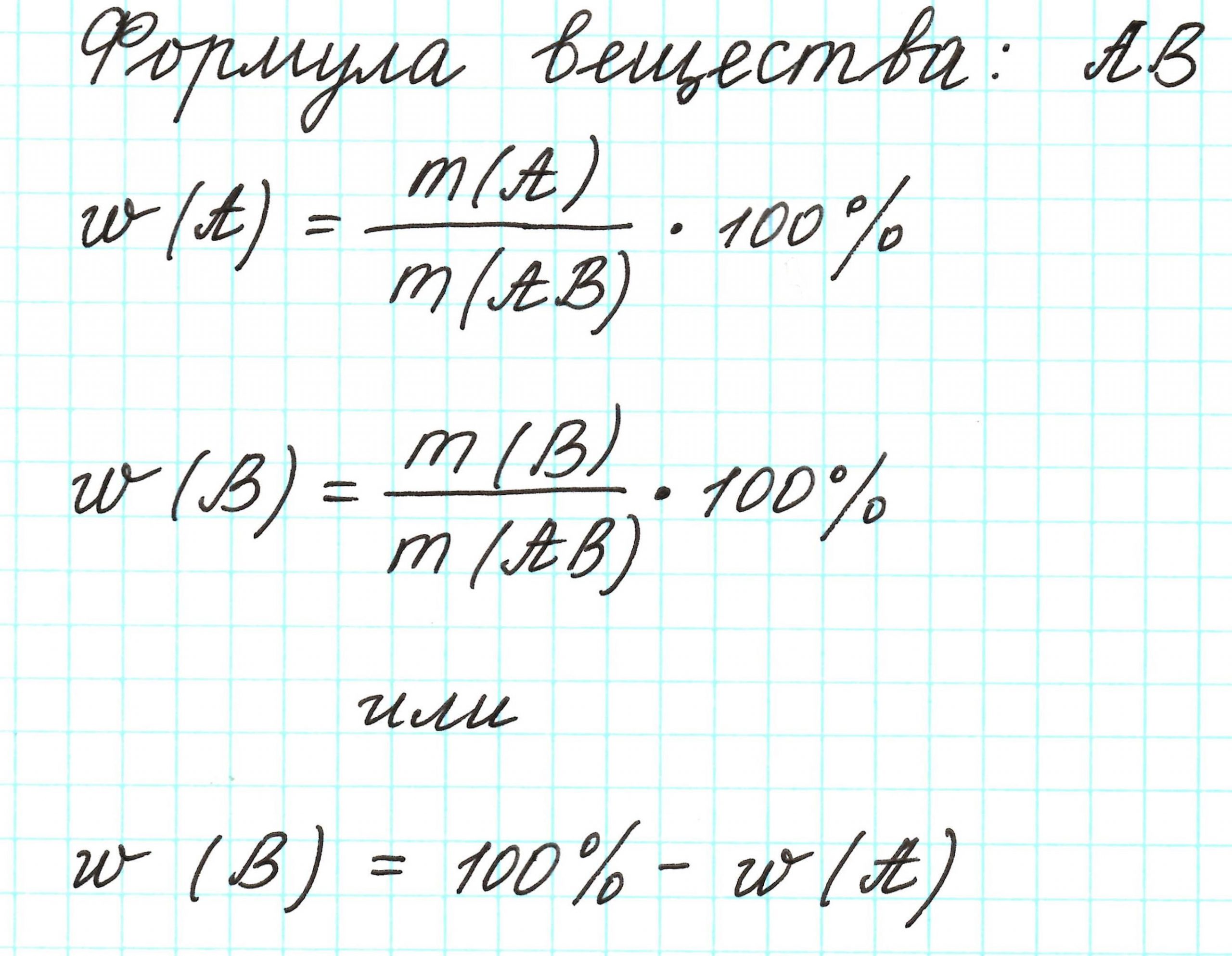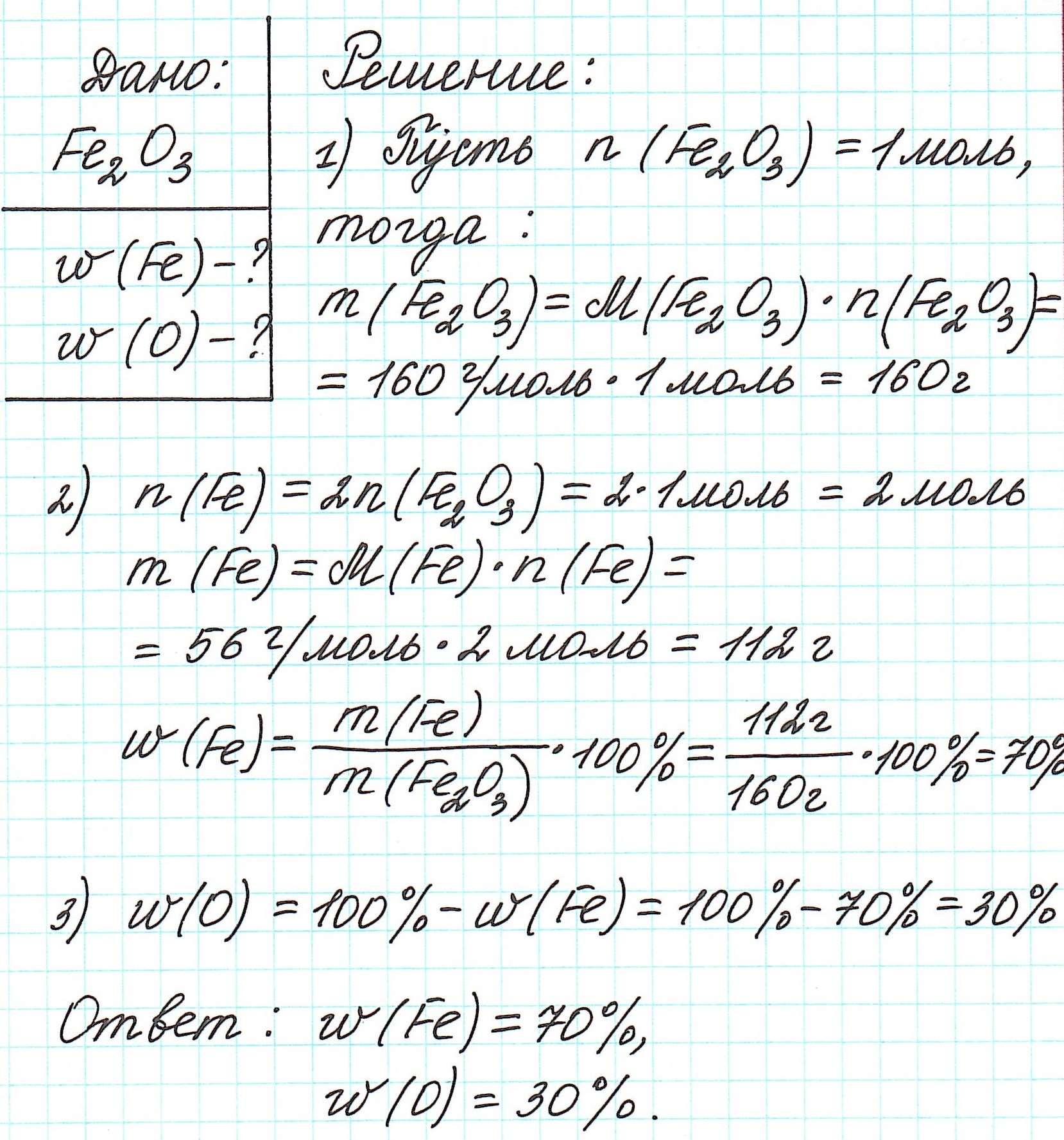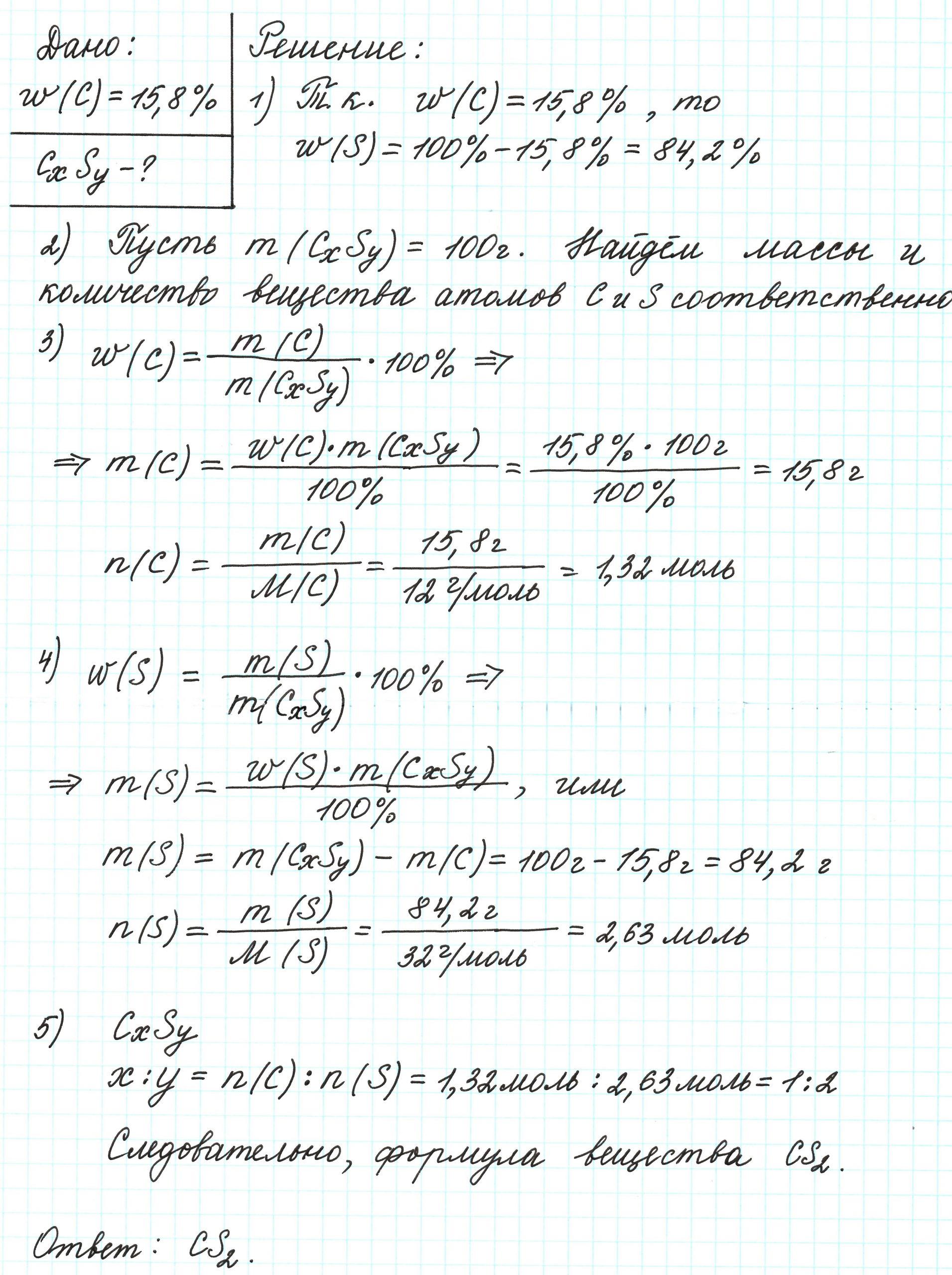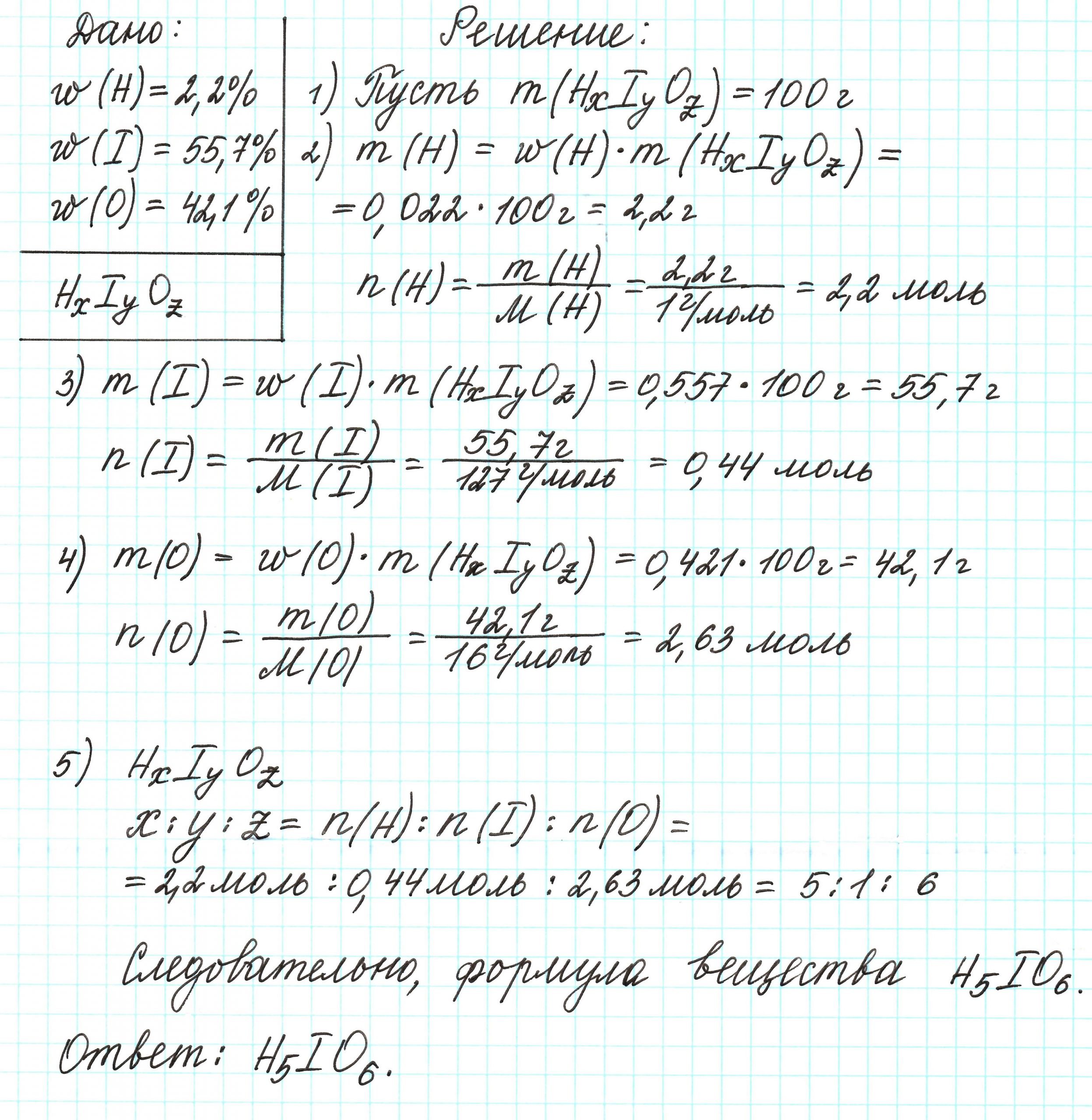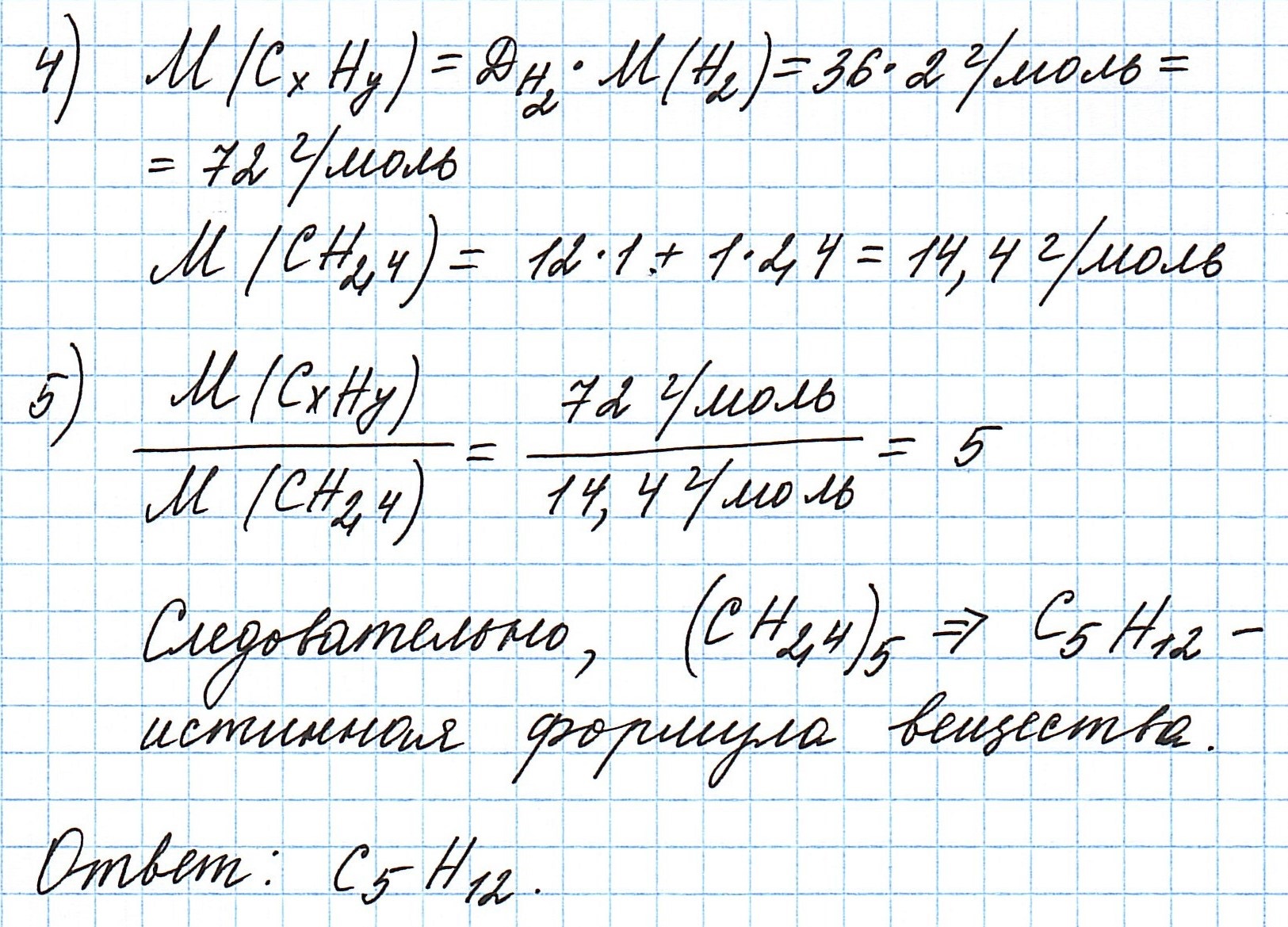Это отработанный пример задачи, показывающий, как рассчитать массовый процентный состав. Процентный состав указывает относительные количества каждого элемента в соединении. Для каждого элемента формула массового процента выглядит следующим образом:
% mass = (масса элемента в 1 моль соединения)/(молярная масса соединения) x 100%
или
массовый процент = (масса растворенного вещества/масса раствора) x 100%
Обычно единицы массы – граммы. Массовый процент также известен как массовый процент или мас./Мас.%. Молярная масса – это сумма масс всех атомов в одном моль соединения. Сумма всех массовых процентов должна составлять в сумме 100%. Следите за ошибками округления в последней значащей цифре, чтобы убедиться, что все проценты складываются.
Содержание
- Ключевые выводы
- Проблема массового процентного состава
- Процентный состав воды
- Массовый процент диоксида углерода
- Массовый процент раствора
- Советы по расчету массового процента
Ключевые выводы
- Состав в массовых процентах описывает относительные количества элементов в химическом соединении.
- Состав в массовых процентах также известен в процентах по массе. Он сокращенно обозначается как мас./Мас.%.
- Для раствора массовый процент равен массе элемента в одном моль соединения, деленной на молярную массу соединения, умноженную на 100%.
Проблема массового процентного состава
Бикарбонат соды (гидрокарбонат натрия) используется во многих коммерческих препаратах. Его формула – NaHCO 3 . Найдите массовые проценты (мас.%) Na, H, C и O в гидрокарбонате натрия.
Раствор
Сначала найдите атомные массы для элементов из Периодической таблицы. Атомные массы оказались следующими:
- Na = 22,99
- H = 1,01
- C – 12,01
- O – 16,00
Затем определите, сколько граммов каждого в одном моль NaHCO 3 :
- 22,99 г (1 моль) Na
- 1,01 г (1 моль) H
- 12,01 г (1 моль) C
- 48,00 г (3 моль x 16,00 грамм на моль) O
Масса одного моля NaHCO 3 составляет:
22,99 г + 1,01 г + 12,01 г + 48,00 г = 84,01 г
И масса процентное содержание элементов составляет
- масс.% Na = 22,99 г/84,01 г x 100 = 27,36%
- % масс H = 1,01 г/84,01 г x 100 = 1,20%
- % масс C = 12,01 г/84,01 г x 100 = 14,30%
- % масс O = 48,00 г /84,01 gx 100 = 57,14%
Ответ
- % масс Na = 27,36%
- % масс H = 1,20%
- массовый% C = 14,30%
- массовый% O = 57,14%
При вычислении массовых процентов всегда рекомендуется проверять, чтобы ваши массовые проценты в сумме составляли 100% (помогает отловить математические ошибки):
27,36 + 14,30 + 1,20 + 57,14 = 100. 00
Процентный состав воды
Другой простой пример – определение массового процентного состава элементов в воде, H 2 O.
Сначала найдите молярную массу воды, сложив атомные массы элементов. Используйте значения из периодической таблицы:
- H составляет 1,01 грамма на моль
- O составляет 16,00 граммов на моль
Получите молярную массу, сложив все массы элементов в соединении. Нижний индекс после водорода (H) указывает на наличие двух атомов водорода. После кислорода (O) нет индекса, что означает, что присутствует только один атом.
- молярная масса = (2 x 1,01) + 16,00
- молярная масса = 18,02
Теперь разделите массу каждого элемента на общую массу, чтобы получить массовые проценты:
масс% H = (2 x 1,01)/18,02 x 100%
масс% H = 11,19%
массовый% O = 16,00/18,02
массовый% O = 88,81%
Массовые проценты водорода и кислорода в сумме составляют 100%.
Массовый процент диоксида углерода
Какова масса процентное содержание углерода и кислорода в диоксиде углерода, CO 2 ?
Массовый процент раствора
Шаг 1: Найдите массу отдельных атомов.
Найдите атомные массы углерода и кислорода из Периодическая таблица. На этом этапе рекомендуется определиться с количеством значащих цифр, которые вы будете использовать. Атомные массы оказались следующими:
- C = 12,01 г/моль
- O = 16,00 г. /моль
Шаг 2: Найдите количество граммов каждого компонента, составляющего один моль CO. 2.
Один моль CO 2 содержит 1 моль атомов углерода и 2 моля атомов кислорода.
- 12,01 г (1 моль) C
- 32,00 г (2 моль x 16,00 грамм на моль) O
Масса одного моля CO 2 составляет:
- 12,01 г + 32,00 г = 44,01 г
Шаг 3: Найдите массовый процент каждого атома.
mass% = (масса компонента/масса всего) x 100
И массовые проценты элементов составляют
Для углерод:
- мас.% C = (масса 1 моля углерода/масса 1 моль CO 2 ) x 100
- мас.% C = (12,01 г/44,01 г) x 100
- массовый% C = 27,29%
Для кислорода:
- мас.% O = (масса 1 моля кислорода/масса 1 моль CO 2 ) x 100
- мас.% O = (32,00 г/44,01 г) x 100
- мас.% O = 72,71%
Ответ
- массовый% C = 27,29%
- массовый% O = 72. 71%
Опять же, убедитесь, что ваши массовые проценты в сумме составляют 100%. Это поможет выявить любые математические ошибки.
- 27,29 + 72,71 = 100,00
Сумма ответов составляет 100%, чего и ожидалось.
Советы по расчету массового процента
- Вам не всегда будет дана общая масса смеси или раствора. Часто вам нужно складывать массы. Это может быть неочевидно. Вам могут быть заданы мольные доли или моль, а затем потребуется преобразовать их в единицу массы.
- Следите за своими значащими цифрами.
- Всегда проверяйте сумму массовых процентов всех компонентов составляет 100%. В противном случае вам нужно вернуться и найти свою ошибку.
найди число атомов каждого элемента в молекуле оксида углерода, если массовая доля углерода в нём равна (42,86) %, а массовая доля кислорода — (57,14) %.
1. Примем массу оксида равной (100) г. Масса углерода в такой порции равна (42,86) г, а масса кислорода — (57,14) г.
2. Находим относительные атомные массы элементов в Периодической таблице:
3. Обозначаем число атомов углерода как (x), а число атомов кислорода — (y), и записываем отношение масс:
.
4. Получаем выражение:
5. Находим отношение (x : y):
.
В молекуле оксида углерода на (1) атом углерода приходится (1) атом кислорода.
Смесь, состоящая из
двух и более компонентов, характеризуется
свойствами и содержанием этих компонентов.
Состав смеси может быть задан массой,
объемом, количеством (числом молей или
килограмм-молей) отдельных компонентов,
а также значениями их концентраций.
Концентрацию компонента в смеси можно
выразить в весовых, мольных и объемных
долях или процентах, а также в других
единицах.
Массовая
доля i
какого-либо компонента определяется
отношением массы mi
данного компонента к массе всей смеси
mсм:
Учитывая,
что суммарная масса смеси равна сумме
масс отдельных компонентов, т.е.
можно написать:
или сокращенно:
Пример
4. Смесь
состоит из двух компонентов: m1
= 500 кг, m2
= 1500 кг. Определить массовую долю каждого
компонента в смеси.
Решение.
Массовая
доля первого компонента:
mсм=
m1
+ m2
= 500 + 1500 = 2000 кг
Массовая доля второго компонента:
Массовую
долю второго компонента можно определить
также, используя равенство:
1
+ 2
= 1
2
= 1 – 1
= 1 – 0,25 = 0,75
Объемная
доля i
компонента в смеси равна отношению
объема Vi
данного компонента к объему всей смеси
V:
Учитывая, что:
можно написать:
Пример
5.
Газ состоит из двух компонентов: V1
= 15,2 м3
метана и V2
= 9,8 м3
этана. Подсчитать объемный состав смеси.
Решение.
Общий объем смеси равен:
V
= V1
+ V2
= 15,2 + 9,8 = 25 м3
Объемная доля в смеси:
метана
этана
v2
= 1 – v1
= 1 – 0,60 = 0,40
Мольная
доля ni
какого-либо компонента смеси определяется
как отношение числа киломолей Ni
данного компонента к общему числу
киломолей N
смеси:
Учитывая,
что:
получим:
Пересчет мольных
долей в массовые можно проводить по
формуле:
Пример
6. Смесь
состоит из 500 кг бензола и 250 кг толуола.
Определить мольный состав смеси.
Решение.
Молекулярный
вес бензола (С6Н6)
равен 78, толуола (С7Н8)
– 92. Число килограмм-молей равно:
бензола
толуола
общее число
килограмм-молей:
N
= N1
+ N2
= 6,41 + 2,72 = 9,13
Мольная доля
бензола равна:
Для толуола мольная
доля может быть найдена из равенства:
n1
+ n2
= 1
откуда: n2= 1 –n1= 1 – 0,70 = 0,30
Среднюю молекулярную
массу смеси можно определить, зная
мольную долю и молекулярную массу
каждого компонента смеси:
(21)
где
ni
— содержание
компонентов в смеси, мол. доли; Mi
— молекулярная
масса компонента смеси.
Молекулярную массу смеси нескольких
нефтяных фракций можно определить по
формуле

или
(23)
где
m1,
m2,…,
mn
— масса
компонентов смеси, кг; M1,
М2,….,.Мп
— молекулярная масса компонентов смеси;
— % масс. компонента.
Молекулярную
массу нефтепродукта можно определить
также по формуле Крэга

Пример
7.
Определить среднюю молекулярную массу
смеси бензола с изооктаном, если мольная
доля бензола составляет 0,51, изооктана
0,49.
Решение.
Молекулярная масса бензола 78, изооктана
114. Подставляя эти значения в формулу
(21), получаем
Мср
= 0,51
78 + 0,48114
= 95,7
Пример
8. Смесь
состоит из 1500кг бензола и 2500кг н-октана.
Определить среднюю молекулярную массу
смеси.
Решение.
Используем формулу (22)
Объемный
молярный состав пересчитывают в массовый
следующим образом. Данный объемный
(молярный) состав в процентах принимают
за 100 молей. Тогда концентрация каждого
компонента в процентах будет выражать
число его молей. Затем число молей
каждого компонента умножают на его
молекулярную массу и получают массу
каждого компонента в смеси. Разделив
массу каждого компонента на общую массу,
получают его массовую концентрацию.
Массовый
состав пересчитывают в объемный
(молярный) следующим образом. Принимают,
что смеси взято 100 (г, кг, т) (если массовый
состав выражен в процентах), массу
каждого компонента делят на его
молекулярную массу. Получают число
молей. Делением числа молей каждого
компонента на их общее число получают
объемные (молярные) концентрации каждого
компонента.
Средняя плотность
газа определяется по формуле:
кг/м3;
г/см3
или, исходя из
объемного состава:
,
или, исходя из
массового состава смеси:

Относительную плотность определяют по
формуле:
Пример 9.Пересчитать массовый
состав газа в объемный и определить его
молекулярную массу, его плотность и
относительную плотность.
|
Компоненты |
М г/моль |
массовый % масс. |
mi |
Число
|
Объемный |
|
|
доли единицы |
% об. |
|||||
|
Метан |
16 |
40 |
40 |
40:16=2,50 |
0,669 |
66,9 |
|
Этан |
30 |
10 |
10 |
10:30=0,33 |
0,088 |
8,8 |
|
Пропан |
44 |
15 |
15 |
15:44=0,34 |
0,091 |
9,1 |
|
Бутан |
58 |
25 |
25 |
25:58=0,43 |
0,115 |
11,5 |
|
Пентан + высшие |
72 |
10 |
10 |
10:72=0,14 |
0,037 |
3,7 |
|
100 |
100 |
3,74 |
1,000 |
100,0 |
Для
простоты расчета примем массу смеси за
100 г, тогда масса каждого компонента
будет численно совпадать с процентным
составом. Найдем число молей ni
каждого компонента. Для этого массу
каждого компонента mi
разделим на мольную массу:
Находим объемный
состав смеси в долях единицы
i(CH4)
= 2,50 : 3,74 = 0,669;
(C2H6)
= 0,33 : 3,74 = 0,088;
(C5H8)
= 0,34 : 3,74 = 0,091;
(C4H10)
= 0,43 : 3,74 = 0,115;
(C5H12)
= 0,14 : 3,74 = 0,037.
Находим
объемный состав смеси в процентах,
умножив данные в долях единицы на 100%.
Все полученные данные заносим в таблицу.
Рассчитываем
среднюю массу смеси.
Мср
= 100 : 3,74 =
26,8 г/моль
Находим
плотность смеси
Находим относительную
плотность:
Пример 10.Пересчитать объемный
состав в массовый и определить его
молекулярную массу, его плотность и
относительную плотность.
|
Компоненты |
М г/моль |
Объемный % об. |
число |
Масса г. |
Весовой |
|
|
доли единицы |
% масс. |
|||||
|
Метан |
16 |
30 |
30 |
3016=480 |
0,117 |
11,7 |
|
Этан |
30 |
15 |
15 |
15·30=450 |
0,109 |
10,9 |
|
Пропан |
44 |
20 |
20 |
20·44=880 |
0,214 |
21,4 |
|
Бутан |
58 |
15 |
15 |
15·58=870 |
0,211 |
21,1 |
|
Пентан + высшие |
72 |
20 |
20 |
20·72=1440 |
0,349 |
34,9 |
|
100 |
100 |
4120 |
1,000 |
100,0 |
(CH4)
= 480 : 4120 = 0,117;
(C2H6)
= 450 : 4120 = 0,109;
(C3H8)
= 880 : 4120 = 0,214;
(C4H10)
= 870 : 4120 = 0,211;
(C5H12)
= 1440 : 4120 = 0,349.
Мср
= 4120 : 100 =
41,2 г/моль.
г/л
Задача 15. Смесь состоит из пяти
компонентов. Определить массовую,
объемную и мольную долю каждого компонента
в смеси, среднюю молекулярную массу
смеси.
|
Компоненты смеси |
Вариант |
|||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
mi |
mi |
mi |
||||||||
|
метан |
5 |
30 |
55 |
80 |
100 |
75 |
50 |
25 |
5 |
30 |
|
этан |
10 |
35 |
60 |
85 |
95 |
70 |
45 |
20 |
10 |
35 |
|
пропан |
15 |
40 |
65 |
90 |
90 |
65 |
40 |
15 |
15 |
40 |
|
н-бутан |
20 |
45 |
70 |
95 |
85 |
60 |
35 |
10 |
20 |
45 |
|
изобутан |
25 |
50 |
75 |
100 |
80 |
55 |
30 |
5 |
25 |
50 |
Задача 16.Пересчитать массовый
состав газа в объемный и определить его
молекулярную массу, плотность и
относительную плотность по воздуху.
|
Компоненты смеси |
ω% массовый |
|||||||||
|
Варианты |
||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
метан |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
50 |
|
этан |
50 |
45 |
40 |
35 |
30 |
25 |
20 |
15 |
10 |
5 |
|
пропан |
5 |
10 |
20 |
10 |
5 |
10 |
15 |
20 |
25 |
30 |
|
бутан |
10 |
10 |
20 |
15 |
30 |
25 |
20 |
15 |
10 |
5 |
|
пентан |
30 |
25 |
5 |
20 |
10 |
20 |
10 |
10 |
10 |
10 |
Задача 17. Пересчитать объемный
состав газа в массовый и определить его
молекулярную массу, плотность и
относительную плотность по воздуху.
|
Компоненты смеси |
объемный состав |
|||||||||
|
Варианты |
||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
метан |
10 |
5 |
20 |
5 |
20 |
10 |
10 |
35 |
40 |
10 |
|
этан |
45 |
50 |
15 |
20 |
25 |
30 |
10 |
20 |
15 |
5 |
|
пропан |
10 |
5 |
10 |
20 |
10 |
5 |
25 |
15 |
20 |
30 |
|
бутан |
10 |
10 |
35 |
40 |
25 |
30 |
10 |
20 |
15 |
5 |
|
пентан |
15 |
30 |
20 |
15 |
30 |
25 |
45 |
10 |
10 |
50 |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
Загрузить PDF
Загрузить PDF
Массовый процент задает процентное соотношение элементов в химическом соединении.[1]
Для нахождения массового процента необходимо знать молярную массу (в граммах на моль) входящих в соединение элементов или количество граммов каждого компонента, необходимое для того, чтобы получить заданный раствор.[2]
Массовый процент вычисляется довольно просто: достаточно поделить массу элемента (или компонента) на массу всего соединения (или раствора).
-
1
Выберите уравнение для определения массового процента химического соединения. Массовый процент находится по следующей формуле: массовый процент = (масса компонента/общая масса соединения) x 100. Для получения процентов результат деления умножается на 100.[3]
- В начале решения задачи запишите равенство: массовый процент = (масса компонента/общая масса соединения) x 100.
- Масса интересующего вас компонента должна быть в условии задачи. Если масса не дана, перейдите к следующему разделу, в котором рассказано о том, как определять массовый процент при неизвестной массе.
- Общая масса химического соединения находится путем сложения масс всех элементов (компонентов), которые входят в состав этого соединения (или раствора).
-
2
Вычислите общую массу соединения. Если вы знаете массы всех составляющих соединение компонентов, просто сложите их, и таким образом вы найдете общую массу получившегося соединения или раствора. Эту массу вы используете в качестве знаменателя в уравнении для массового процента.[4]
- Пример 1: Чему равен массовый процент 5 граммов гидроксида натрия, растворенного в 100 граммах воды?
- Общая масса раствора равна сумме количества гидроксида натрия и воды: 100 г + 5 г дают 105 г.
- Пример 2: Сколько хлорида натрия и воды необходимо для получения 175 граммов 15-процентного раствора?
- В этом примере даны общая масса и необходимый процент, и требуется найти количество вещества, которое необходимо добавить в раствор. При этом общая масса составляет 175 граммов.
- Пример 1: Чему равен массовый процент 5 граммов гидроксида натрия, растворенного в 100 граммах воды?
-
3
Определите массу заданного компонента. Если вас просят вычислить «массовый процент», следует найти, сколько процентов от общей массы вещества составляет масса определенного компонента. Запишите массу заданного компонента. Это будет числитель в формуле для массового процента.[5]
- Пример 1: масса заданного компонента — гидрохлорида натрия — составляет 5 граммов.
- Пример 2: в этом примере масса заданного компонента неизвестна, и ее следует найти.
-
4
Подставьте значения в уравнение для массового процента. После того как вы определите все необходимые величины, подставьте их в формулу.
- Пример 1: массовый процент = (масса компонента/общая масса соединения) x 100 = (5 г/105 г) x 100.
- Пример 2: необходимо преобразовать формулу для массового процента так, чтобы можно было найти неизвестную массу химического компонента: масса компонента = (массовый процент*общая масса соединения)/100 = (15*175)/100.
-
5
Вычислите массовый процент. После подстановки всех значений в формулу для массового процента произведите необходимые вычисления. Поделите массу компонента на общую массу химического соединения или раствора и умножьте на 100. В результате у вас получится массовый процент данного компонента.
- Пример 1: (5/105) x 100 = 0,04761 x 100 = 4,761%. Таким образом, массовый процент 5 граммов гидрохлорида натрия, растворенного в 100 граммах воды, составляет 4,761%.
- Пример 2: переписанное выражение для массового процента компонента имеет вид (массовый процент*общая масса вещества)/100, откуда находим: (15*175)/100 = (2625)/100 = 26,25 граммов хлорида натрия.
- Необходимое количество воды находим путем вычитания массы компонента из общей массы раствора: 175 – 26,25 = 148,75 граммов воды.
Реклама
-
1
Выберите формулу для массового процента химического соединения. Основное уравнение для нахождения массового процента выглядит следующим образом: массовый процент = (молярная масса элемента/общая молекулярная масса соединения) x 100. Молярная масса вещества — это масса одного моля данного вещества, в то время как молекулярная масса представляет собой массу одного моля всего химического соединения.[6]
Чтобы получить проценты, результат деления умножается на 100.[7]
- В начале решения задачи запишите равенство: массовый процент = (молярная масса элемента/общая молекулярная масса соединения) x 100.
- Обе величины измеряются в граммах на моль (г/моль).
- Если вам не даны массы, массовый процент какого-либо элемента в заданном веществе можно найти, используя молярную массу.
- Пример 1: Найти массовый процент водорода в молекуле воды.
- Пример 2: Найти массовый процент углерода в молекуле глюкозы.
-
2
Запишите химическую формулу. Если в примере не даны химические формулы заданных веществ, следует записать их самостоятельно. Если же в задании даны необходимые формулы химических веществ, данный шаг можно пропустить и перейти сразу к следующему шагу (найти массу каждого элемента).
- Пример 1: запишите химическую формулу воды, H2O.
- Пример 2: запишите химическую формулу глюкозы, C6H12O6.
-
3
Найдите массу каждого элемента, входящего в соединение. Определите молярный вес каждого элемента в химической формуле по таблице Менделеева. Как правило, масса элемента указывается под его химическим символом. Выпишите молярные массы всех элементов, которые входят в рассматриваемое соединение.[8]
- Пример 1: найдите молярные массы кислорода (15,9994) и водорода (1,0079).[9]
- Пример 2: найдите молярные массы углерода (12,0107), кислорода (15,9994) и водорода (1,0079).
- Пример 1: найдите молярные массы кислорода (15,9994) и водорода (1,0079).[9]
-
4
Умножьте молярную массу каждого элемента на его мольную долю. Определите, сколько молей каждого элемента содержится в данном химическом веществе, то есть мольные доли элементов. Мольные доли даются числами, стоящими в формуле внизу символов элементов. Умножьте молярную массу каждого элемента на его молярную долю.[10]
- Пример 1: под символом водорода стоит 2, а под символом кислорода 1 (эквивалентно отсутствию числа). Таким образом, молярную массу водорода следует умножить на 2: 1,00794 X 2 = 2,01588; молярную массу кислорода оставляем прежней, 15,9994 (то есть умножаем на 1).
- Пример 2: под символом углерода стоит 6, под водородом 12 и под кислородом 6. Умножая молярные массы элементов на эти числа, находим:
- углерод: (12,0107*6) = 72,0642
- водород: (1,00794*12) = 12,09528
- кислород: (15,9994*6) = 95,9964
-
5
Вычислите общую массу соединения. Сложите найденные массы всех элементов, входящих в данное соединение. Сумма молярных масс элементов, помноженных на мольные доли, даст вам общую массу химического соединения. Это число является делителем в формуле для массового процента.[11]
- Пример 1: прибавьте к 2,01588 г/моль (масса двух молей атомов водорода) 15,9994 г/моль (масса одного моля атомов кислорода), в результате у вас получится 18,01528 г/моль.
- Пример 2: сложите найденные молярные массы: углерод + водород + кислород = 72,0642 + 12,09528 + 95,9964 = 180,156 г/моль.
-
6
Определите массу интересующего вас элемента. Если вас просят найти «массовый процент», значит, следует вычислить массу определенного элемента, входящего в состав соединения, как процентную долю от общей массы всех элементов. Найдите массу заданного элемента и запишите ее. Для этого необходимо умножить молярную массу элемента на его мольную долю. В результате у вас получится величина, стоящая в числителе формулы для массового процента.[12]
- Пример 1: масса водорода в соединении составляет 2,01588 г/моль (масса двух молей атомов водорода).
- Пример 2: масса углерода в соединении составляет 72,0642 г/моль (масса шести молей атомов углерода).
-
7
Подставьте в уравнение для массового процента численные значения. После того, как вы определите значения всех величин, подставьте их в формулу, которая была приведена на первом шаге: массовый процент = (молярная масса элемента/общая молекулярная масса соединения) x 100.
- Пример 1: массовый процент = (молярная масса элемента/общая молекулярная масса соединения) x 100 = (2,01588/18,01528) x 100.
- Пример 2: массовый процент = (молярная масса элемента/общая молекулярная масса соединения) x 100 = (72,0642/180,156) x 100.
-
8
Вычислите массовый процент. После подстановки численных значений выполните необходимые арифметические действия. Поделите массу элемента на общую массу соединения и умножьте на 100. В результате у вас получится массовый процент элемента.
- Пример 1: массовый процент = (молярная масса элемента/общая молекулярная масса соединения) x 100 = (2,01588/18,01528) x 100 = 0,11189 x 100 = 11,18%. Таким образом, массовый процент атомов водорода в молекуле воды равен 11,18%.
- Пример 2: массовый процент = (молярная масса элемента/общая молекулярная масса соединения) x 100 = (72,0642/180,156) x 100 = 0,4000 x 100 = 40,00%. Таким образом, массовый процент атомов углерода в молекуле глюкозы составляет 40,00%.
Реклама
Об этой статье
Эту страницу просматривали 60 829 раз.
Была ли эта статья полезной?
Способов, как определить формулу вещества, достаточно много. Все зависит от исходных данных. Наиболее разнообразны подобные вычисления в органической химии. И это не удивительно, так как органических соединений значительно больше, чем неорганических.
Содержание:
1.Понятие простейшей и истинной формулы вещества
2.Массовая доля химического элемента: что означает и как высчитывается
3.Как определить формулу вещества по массовым долям элементов
4.Как определить формулу органического соединения:
4.1. по общей формуле вещества
4.2. по продуктам сгорания вещества
5. Как определить формулу вещества: комбинированные задачи
1.Понятие простейшей и истинной формулы вещества
В одних задачах на определение формулы вещества необходимо найти его простейшую формулу, а в других – истинную. В чем разница?
Простейшая, или иными словами, эмпирическая формула, указывает на соотношение атомов в молекуле (или в формульной единице, если речь идет о не ковалентном соединении).
Так, например: СН2 – простейшая формула алкена – показывает, что на каждый 1 атом углерода приходится 2 водородных атома. То есть существует соотношение 1:2. Поэтому для нахождения простейшей (эмпирической) формулы вещества важно рассчитать количество вещества атомов, которые входят в его состав, то есть n(C) и n(H).
Истинная формула, или иначе молекулярная, отражает действительное количество атомов всех элементов в молекуле.
Например, для пропилена, относящегося к классу алкенов, истинная (молекулярная) формула будет C3H6. Она говорит о том, что молекула данного вещества включает 3 атома С и 6 атомов Н. Это вполне соответствует простейшей формуле, отвечающей соотношению атомов 1:2. Для нахождения истинной (молекулярной) формулы соединения требуется посчитать его относительную молекулярную (Mr) или молярную массу (M).
2.Массовая доля химического элемента: что означает и как высчитывается
Массовая доля – это отношение массы компонента системы к массе системы, выраженное в процентах или долях от единицы.
Ну, а теперь проще.
Молекула имеет массу. Все атомы в молекуле также имеют свои массы. Атомов одного химического элемента в молекуле может быть 1 или несколько. Важна масса всех атомов одного элемента. Если ее разделить на массу молекулы, то получится массовая доля этого элемента. Ее выражают либо в процентах, которые всегда меньше 100%, либо в долях от единицы, которые всегда меньше 1.
Массовая доля элемента обозначается греческой буквой «омега» — ω. И записывается, например, так: ω(Н), ω(Сl), ω(С) и т.д. и рассчитывается:
Пример 1. Каковы массовые доли элементов в оксиде железа (III) Fe2O3.
3.Как определить формулу вещества по массовым долям элементов
Нахождение формулы вещества по массовым долям элементов применимо как к органическим, так и к неорганическим соединениям.
Пример 2. Сероуглерод содержит 15,8% углерода по массе. Какова простейшая формула этого вещества?
Поскольку речь идет о массовых долях элементов, то необходимо знать массу вещества. В нашем случае – массу сероуглерода. В условии задачи о ней ничего не говорится. Поэтому допускаем, что масса вещества равна 100 г.
Почему 100 г? Это «круглое» число, и его использование облегчает все расчеты. Так как в итоге будем находить соотношения количеств веществ элементов, то какое-то особенное значение массы вещества не играет никакой роли.
Попробуйте ради эксперимента принять массу сероуглерода равной 23 г, 467 г и т.п. Результат будет один и тот же.
Допустим, что атомов углерода в молекуле х, а атомов серы – у. В таком случае формула вещества примет вид: СхSу.
Пример 3. Содержание углерода в углеводороде составляет 83,33%. Плотность паров соединения по водороду – 36. Какова молекулярная формула углеводорода?
Из данных задачи следует, что углеводород может находиться в газообразном состоянии, так как известна плотность его паров. Эта величина всегда требуется для нахождения молярной (относительной молекулярной) массы вещества. Как она находится и что это такое читайте подробнее здесь.
Чтобы не загромождать записи, массовую долю элементов будем считать не в процентах, а в долях от единицы.
Пусть вас не удивляет получившаяся простейшая формула. Ведь, исходя из определения простейшей формулы, на каждый 1 атом углерода приходится 2,4 атома водорода. Это всего лишь соотношение. Соединения с формулой СН2,4 в принципе не существует. Не всегда простейшая и истинная формулы совпадают друг с другом.
А если полученная формула СН2,4 вас все же смущает, вы можете решать задачу и вторым способом. Но это несколько более сложный способ, когда требуется составить и решить уравнение с двумя неизвестными.
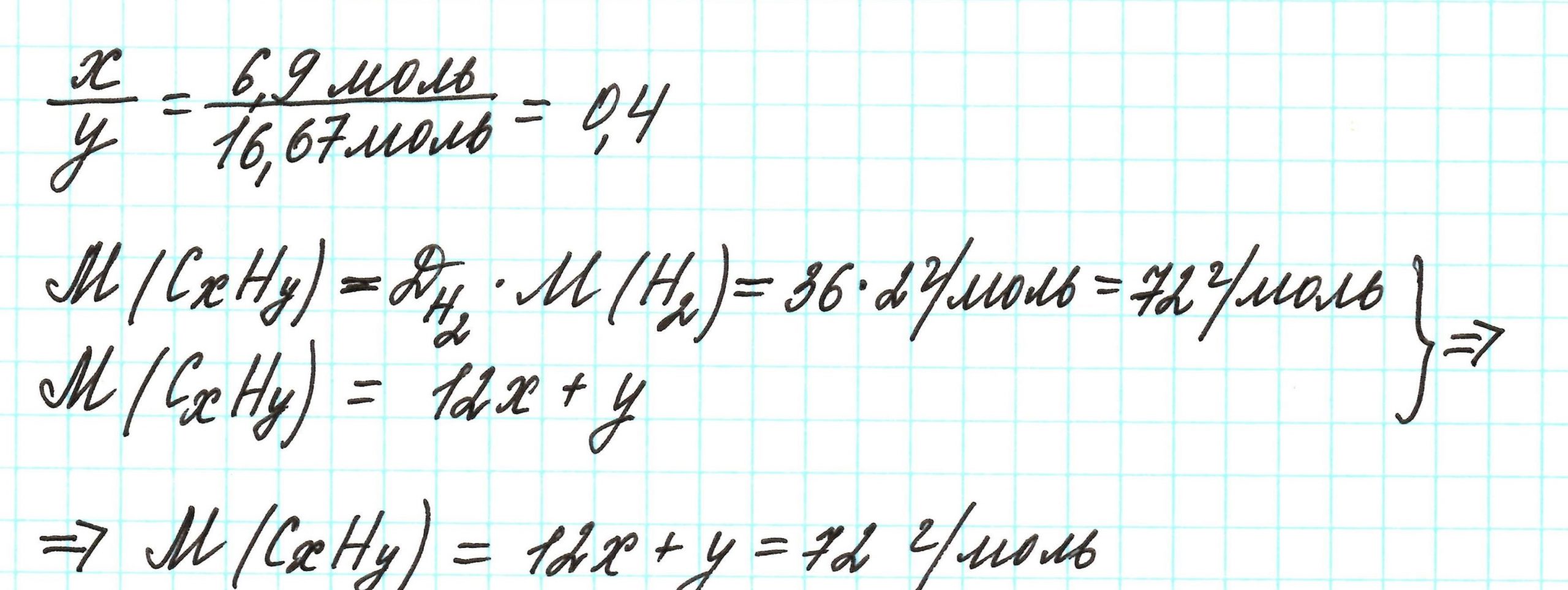
Не все химические вещества являются бинарными, то есть состоят из атомов двух химических элементов. Но в любом случае, алгоритм решения задачи тот же.
Пример 4. Некоторая кислота содержит водород (2,2%), иод (55,7%) и кислород (42,1%). Определите простейшую формулу этой кислоты.
4.Как определить формулу органического соединения
Определить формулу органического вещества можно не только зная массовые доли элементов в его составе.
4.1. Как определить формулу органического соединения
по общей молекулярной формуле вещества
Органические вещества сгруппированы по самостоятельным классам на основе общности строения и свойств. Каждый класс соединений характеризуется своей общей молекулярной формулой. Особенно это наглядно видно на примере углеводородов.
Если другие органические вещества рассматривать как их производные, в молекулы которых введена какая-либо функциональная группа, то и для них также можно составить общую молекулярную формулу.
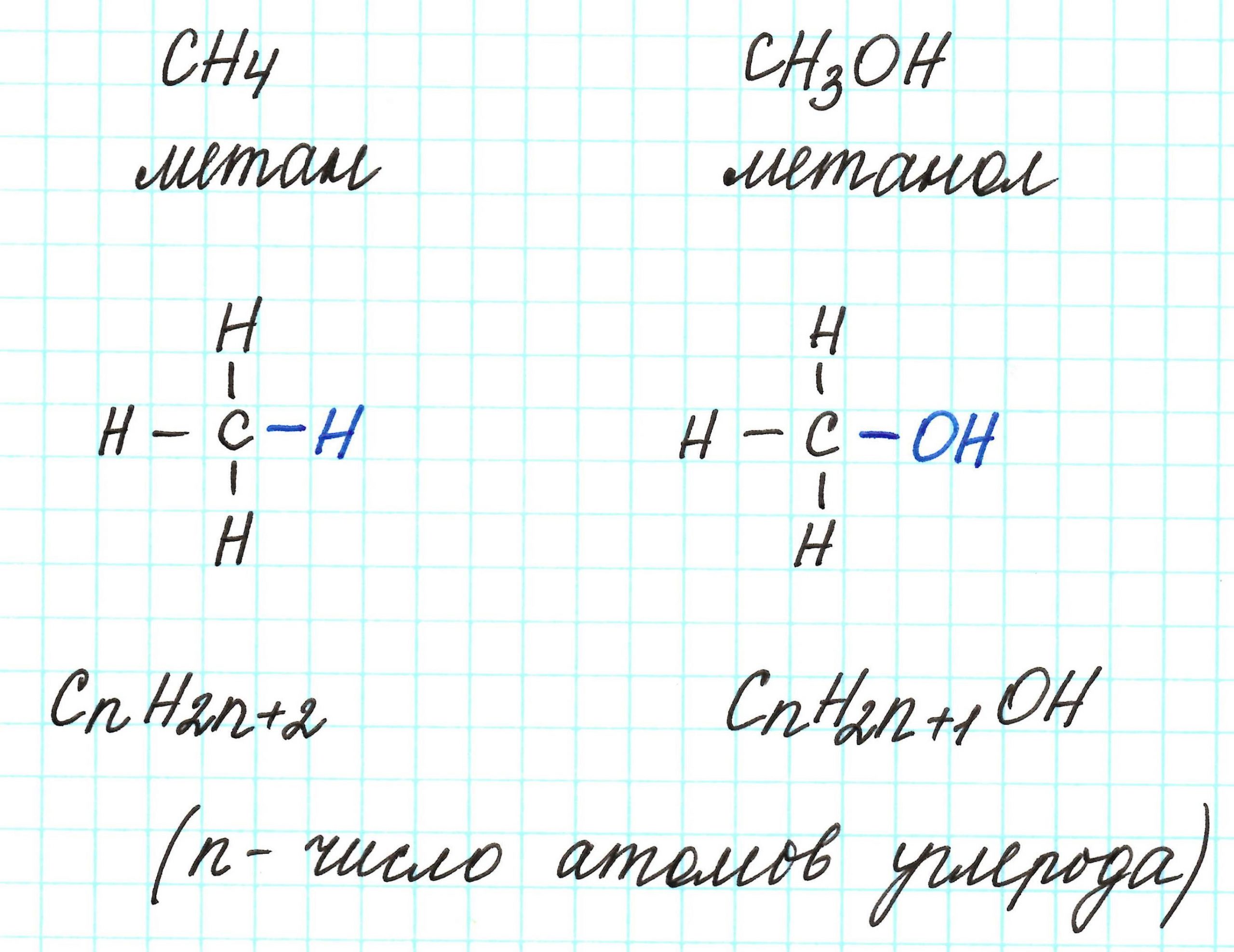
К слову, метан СН4 является представителем алканов, в молекулах которых на n атомов углерода и приходится 2n+2 атомов водорода. Алканы имеют общую молекулярную формулу, отражающую их состав: СnH2n+2.
Предельные одноатомные спирты можно рассматривать как производные алканов, в молекулах которых 1 атом водорода замещен на гидроксильную группа –ОН. Таким образом, их общая молекулярная формула такая: СnH2n+1ОН.
Ниже в таблице приведены общие молекулярные формулы основных классов органических соединений.
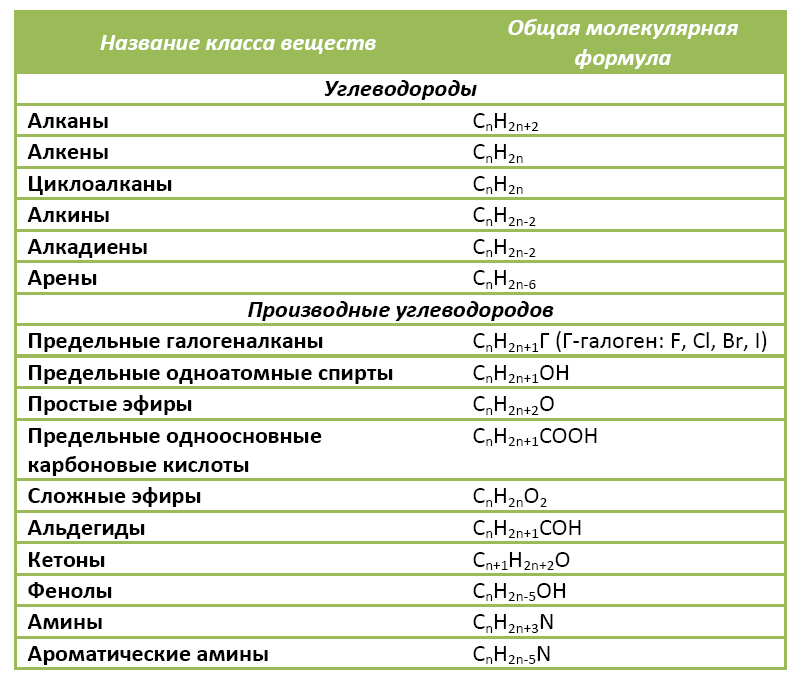
Пример 5. Плотность паров по воздуху некоторого алкана 4,414. Какова формула алкана?

4.2. Как определить формулу органического соединения
по продуктам его сгорания
Это еще один распространенный тип задач на определение формулы органического соединения.
Необходимо запомнить и понять основные моменты:
— так как все органические вещества содержат атомы С, Н, а также атомы О (кислородсодержащие соединения), то всегда при их сгорании выделяется углекислый газ СО2 и образуется вода Н2О;
— все углеродные атомы, входящие в состав органического соединения, окажутся в составе углекислого газа СО2; следовательно, n(С) как в соединении, так и в СО2 – это одна и та же величина;
— все атомы водорода Н, которые имеются в составе вещества, перейдут в состав воды Н2О; следовательно, n(Н) и в данном веществе, и в Н2О – это одна и та же величина;
— при сгорании веществ, включающих в себя азот (например, амины), кроме СО2 и Н2О, образуется еще и N2.
Разберем несколько примеров.
Пример 6. Сожгли 7,2 г углеводорода. Плотность его паров по водороду составляет 36. В результате реакции образовалось 22 г оксида углерода (IV) и 10,8 г воды. Какова молекулярная формула соединения?
Пример 7. В результате сгорания 4,8 г органического соединения выделилось 3,36 л (н.у.) оксида углерода (IV) и образовалось 5,4 г воды. Плотность паров искомого соединения по кислороду равна 1. Вычислите молекулярную формулу вещества.
Пример 8. Результатом сжигания 0,31 г газообразного органического соединения, имеющего плотность 1,384 г/л, стало выделение 0,224 л (с.у.) оксида углерода (IV), 0,112 л азота и образование 0,45 г воды. Вычислите молекулярную формулу этого вещества.

5. Как определить формулу вещества: комбинированные задачи
Наибольший интерес и некоторую трудность представляют комбинированные задачи, сочетающие в себе необходимость найти формулу соединения:
— используя приемы, применяемые в рассмотренных выше задачах;
— используя сведения не только о химических, но и физических свойствах вещества.
Вот несколько примеров.
Пример 9. Какова молекулярная формула предельного углеводорода, при полном сгорании 8,6 г которого выделилось 13, 44 л (н.у.) оксида углерода (IV).
В этой задаче:
1) известен класс вещества, поэтому возможно применить его общую молекулярную формулу;
2) речь идет о сгорании вещества, поэтому количество атомов в составе молекулы будем искать, используя данные о продукте сгорания – СО2.
Пример 10. Алкен нормального строения содержит двойную связь при первом углеродном атоме. Образец этого алкена массой 0,7 г присоединил бром массой 1,6 г. Вычислите формулу алкена и назовите его.
В предлагаемых условиях:
1) известен класс вещества, следовательно, применим его общую молекулярную формулу;
2) речь идет об одном из химических свойств: способности алкенов присоединять галогены по месту разрыва двойной связи.
Пример 11. После полного сжигания в кислороде арена, имевшего массу 0,92 г, выделился оксид углерода (IV). Пропуская газ через избыток раствора щелочи Ca(OH)2, получили 7 грамм осадка. Какова молекулярная формула арена?
В предлагаемой задаче:
1) известен класс вещества;
2) речь идет о сжигании соединения и образовании в качестве продукта горения углекислого газа, который при взаимодействии со щелочью Са(ОН)2 привел к выпадению осадка известной массы.
Следующий пример очень характерен для задач, встречающихся в заданиях второй части ЕГЭ по химии.
Пример 12. Некоторое соединение, образующее альдегид в реакции окисления, взаимодействует с избытком бромоводородной кислоты, образуя 9,84 г продукта (выход составляет 80% от теоретического), имеющего плотность паров по Н2 61,5. Определите строение этого соединения, а также его массу, вступившую в реакцию?
В этой задаче:
1) говорится о химических свойствах искомого соединения; анализируя их, приходим к выводу, что заданным веществом является предельный одноатомный спирт;
2) известна общая молекулярная формула предельных одноатомных спиртов;
3) более подробно говорится о взаимодействии заданного вещества с бромоводородной кислотой; спирт, реагируя с HBr, дает галогеналкан, для которого известны его масса, практический выход и относительная плотность по Н2; именно от этих данных и нужно отталкиваться при решении данной задачи.
Итак, способов, как определить формулу вещества, действительно, множество. Мы рассмотрели лишь основные из них. Важно правильно уяснить понятия «простейшая формула вещества» и «истинная формула вещества», чтобы не путать их.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.