Результаты (отдельно
для катионов и отдельно для анионов)
запишите в соответствующие строки
второй вертикальной колонки таблицы
(рис.9). Суммы катионов и анионов должны
быть равны или могут незначительно
отличаться друг от друга, так как
некоторые ионы (А13+
СОз2+
и другие) не были учтены. Если
суммы катионов (К) и анионов (А) различаются
более чем на 5%, т.е. если 5%,
то допущена ошибка в расчетах или при
переписывании исходных данных.
Эту ошибку необходимо найти и исправить.
Рис 9. Химический
состав той же пробы, что и на рис.8,
пересчитанный в эквивалентную форму
(по Гречину П.И. и др. 2003).
|
Ионы |
мг/л |
мг-экв/л |
%-экв |
|
|
Катионы |
NH4l+ |
– |
– |
|
|
NaI++KI+ |
21,2 |
0,9 |
||
|
Mg2+ |
19,4 |
1,6 |
||
|
Са2+ |
68,0 |
3,4 |
||
|
Fe |
0,1 |
– |
||
|
A13+ |
– |
– |
||
|
Сумма |
108,7 |
5,6 |
||
|
Анионы |
||||
|
CI1– |
6,0 |
0,2 |
||
|
SO42– |
33,2 |
0,7 |
||
|
HCO31– |
298,0 |
4,9 |
||
|
СО22– |
– |
– |
||
|
NO3l– |
0,06 |
– |
||
|
Сумма |
338,1 |
5,8 |
||
|
Общая |
446,7 |
– |
5. Определить
процент-эквивалентное содержание ионов.
Для этого сумму
отдельно катионов (и, соответственно,
отдельно анионов) принимают за 100% и
вычисляют «долю» каждого катиона
(аниона). Точность — до целых единиц. При
одинаковом содержание двух катионов
(или анионов), точность следует повысить
и определить какого иона больше.
Результат записать в третью вертикальную
колонку таблицы (рис.10). Обязательно
проверьте, составляет ли содержание
катионов (анионов) в сумме 100
процент-эквивалентов.
Рис.10. Заполнение
таблицы химического состава воды
(окончание).
|
Ионы |
мг/л |
мг-экв/л |
%-экв |
|
|
Катионы |
NH4l+ |
– |
– |
– |
|
NaI++KI+ |
21,2 |
0,9 |
15 |
|
|
Mg2+ |
19,4 |
1,6 |
27 |
|
|
Са2+ |
68,0 |
3,4 |
58 |
|
|
Fe |
0,1 |
– |
– |
|
|
A13+ |
– |
– |
– |
|
|
Сумма |
108,7 |
5,6 |
100 |
|
|
Анионы |
||||
|
CI1– |
6,0 |
0,2 |
3 |
|
|
SO42– |
33,2 |
0,7 |
12 |
|
|
HCO31– |
298,0 |
4,9 |
85 |
|
|
СО22– |
– |
– |
– |
|
|
NO3l– |
0,06 |
– |
– |
|
|
Сумма |
338,1 |
5,8 |
100 |
|
|
Общая |
446,7 |
– |
– |
Примечание:
по указанию преподавателя при составлении
таблицы кроме основных могут быть учтены
и другие ионы, например F1–.
Задание 2. Составить
формулу Курлова и дать характеристику
воды по
классификации
Алекина.
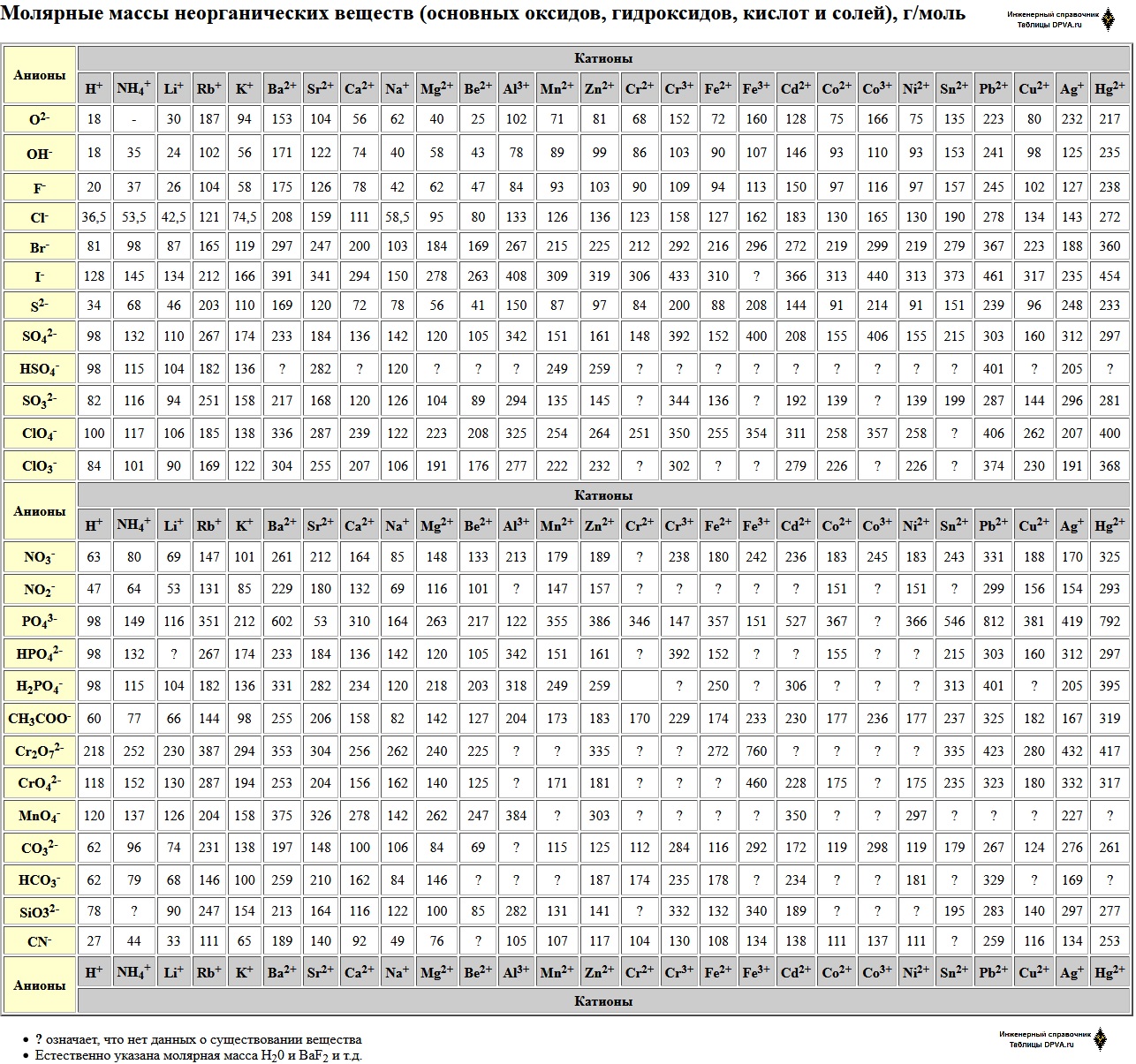
Вычисление молярной массы
To calculate molar mass of a chemical compound enter its formula and click ‘Compute’. В химической формуле, вы можете использовать:
- Любой химический элемент. Capitalize the first letter in chemical symbol and use lower case for the remaining letters: Ca, Fe, Mg, Mn, S, O, H, C, N, Na, K, Cl, Al.
- Функциональные группы:D, Ph, Me, Et, Bu, AcAc, For, Ts, Tos, Bz, TMS, tBu, Bzl, Bn, Dmg
- круглые () и квадратные [] скобки.
- Общие составные имена.
Примеры расчета молярной массы:
NaCl,
Ca(OH)2,
K4[Fe(CN)6],
CuSO4*5H2O,
water,
nitric acid,
potassium permanganate,
ethanol,
fructose.
Molar mass calculator also displays common compound name, Hill formula, elemental composition, mass percent composition, atomic percent compositions and allows to convert from weight to number of moles and vice versa.
Вычисление молекулярной массы (молекулярная масса)
Для того, чтобы рассчитать молекулярную массу химического соединения, введите её формулу, указав его количество массы изотопа после каждого элемента в квадратных скобках.
Примеры молекулярные вычисления веса:
C[14]O[16]2,
S[34]O[16]2.
Определение молекулярной массы, молекулярный вес, молекулярная масса и молярная масса
- Молекулярная масса ( молекулярной массой ) это масса одной молекулы вещества, выражающаяся в атомных единицах массы (и). (1 и равна 1/12 массы одного атома углерода-12)
- Молярная масса ( молекулярной массой ) является масса одного моля вещества и выражается в г / моль.
Массы атомов и изотопов с NIST статью .
См. также: молекулярные массы аминокислот

Таблицы DPVA.ru — Инженерный Справочник
Адрес этой страницы (вложенность) в справочнике dpva.ru: 
Молярные массы неорганических веществ (основных оксидов, гидроксидов, кислот и солей), г/моль
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Поиск в инженерном справочнике DPVA. Введите свой запрос: |
Поиск в инженерном справочнике DPVA. Введите свой запрос:
Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста.
Вложите в письмо ссылку на страницу с ошибкой, пожалуйста.
Коды баннеров проекта DPVA.ru
Начинка: KJR Publisiers
Консультации и техническая
поддержка сайта: Zavarka Team
Free xml sitemap generator
Вычисление масс ионов
По этой ссылке вы найдёте полный курс лекций по математике:
Пример !. Вычислить массу ионов К+ и SOT», содержа-щихся в 1,20 4 2М раствора сульфата калия KjSO*. Решение. Концентрация ионов в растворе равна произведению молярности раствора на степень диссоциации электролита и на число ионов, получаемых при диссоциации молекулы. В математической форме это можно выразить так: где п — число ионов, получаемых при диссоциации одной молекулы. Уравнение диссоциации: KaS04 = 2К+ + SOJ-
Сульфат калия относится к сильным электролитам, диссоциирующим в водном растворе почти полностью. Поэтому степень диссоциации его можно принять равной 1. В соответствии с этим Ск+ = 2М • 2 = 4М; Cso,«- = = 2М . 1 2М- |1К+ = 39 г/ион; psot— = 96 г/ион. Отсюда г/ион • 4 г-ион/л . 1,20 л 155 г т$о- « 96 е/г-ион • 2 г-ион/л • 1,20 л =» 225,2 г Пример 2. Степень диссоциации Н£Оз по первой ступени равна 1%. Вычислить массу ионов Н+ и НСО~ в 2 л 0,006М раствора. Решение.
Вычисление масс ионов цнсо,- =» 61 г/е-ион; тном ртяш.
Возможно вам будут полезны данные страницы:
См • * • п mH+ = 1 г/г-ион • 0,006 е-ион1л • 0,01. 2 л = = 0,00012 г = 12 . 10-* г тнсо-« 61 г/г-ион — 0,006 гчюн/л • 0,01 • 2 л — = 0,00732 г — 7,32 • 10-3 г Вычисление количества ионов, содержащихся в данном объеме раствора. Грамм-ион содержит такое же число ионов, как грамм-молекула-—молекул и грамм-атом — атомов, т. е. 6,02 • 104
Пример. В 1 м9 воды внесли каплю 0,Ш раствора хлорида магния. Определить, сколько ионов оказалось в капле полученного раствора. Принять, что в 1 мл содержится 30 капель. Решение. Сколько молей хлорида магния MgQs содержалось в 1 мл 0,Ш раствора: Сколько молей хлорида магния MgQa содержалось в 1 капле 0,1 М раствора:
Сколько молекул хлорида магния
содержалось в 1 капле 0,1 М раствора: = 6,02 • 10» • 3,33 . 10-« « 20 • 10»’ молекул Сколько молекул хлорида магния содержалось в 1 мл разбавленного раствора: tj= 90[Jf ~ 20, 10″ молекул Сколько молекул содержалось в 1 капле разбавленного раствора: Вычисление масс ионов Сколько ионов Mg®+ и С1- содержалось в 1 капле разбавленного раствора. Так как из одной молекулы хлорида магния MgCla получаются 1 ион Mg*+ и 2 иона С1~, то ионов Mg*+ будет столько же, сколько молекул MgCl,, а ионов Q-в 2 раза больше: