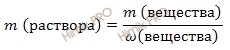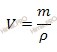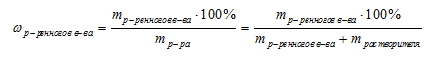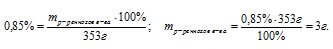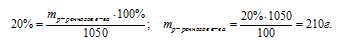Объем раствора азотной кислоты
Какой объем раствора азотной кислоты (HNO3) концентрированного с массовой долей равной 60 % и плотностью раствора 1,37 г/см3 необходимо взять для приготовления 800 см3 раствора с молярной концентрацией вещества, равной 2 моль/л?
Решение задачи
Найдем сколько концентрированной азотной кислоты (HNO3) (в граммах) потребуется для приготовления 800 см3 (или 0,8 л объем раствора азотной кислоты) раствора с молярной концентрацией 2 моль/л. Для расчета будем использовать формулу нахождения молярной концентрации раствора:
где:
CM – молярная концентрация раствора;
n – химическое количество растворенного вещества;
M – молярная масса растворенного вещества;
m – масса растворенного вещества;
V – объем раствора азотной кислоты.
Напомню, что под молярной концентрацией понимают количество (число моль) данного вещества, содержащегося в единице объема раствора. Молярную концентрацию выражают в моль/л или используют сокращение «M».
Из вышеуказанной формулы выразим и рассчитаем массу растворенного вещества:
Учитывая, что молярная масса азотной кислоты (HNO3) равна 63 г/моль (смотри таблицу Менделеева), получаем:
m (HNO3 (конц.)) = 2 моль/л ∙ 63 г/моль ∙ 0,8 л = 100,8 (г).
Используя формулу нахождения массовой доли растворенного вещества:
выразим массу раствора азотной кислоты (HNO3):
Получаем:
m (раствора HNO3 (конц.)) = 100,8 г/ 0,6 = 168 (г).
Если раствор 60-процентный, то массовая доля азотной кислоты (HNO3) в нем 0,6.
Вычислим объем раствора азотной кислоты (HNO3) концентрированного, который потребуется для приготовления 0,8 л раствора с молярной концентрацией 2 моль/л. Будем использовать формулу, устанавливающую связь между объемом раствора азотной кислоты и массой раствора:
Получаем, объем раствора азотной кислоты:
V (раствора HNO3 (конц.)) = 168 г /1,37 г/мл = 122,63 (мл).
Ответ:
объем раствора азотной кислоты концентрированного 122,63 миллилитра.
Похожие задачи
Дано: V (раствора) = 500 мл = 500 см 3 , ω ( HNO 3 ) = 0,4 , ρ (раствора) = 1,25 г / см 3 .
Найти: m ( HNO 3 ) -?
решение:
И способ.
Из формулы ρ (раствора) = m (раствора) / V (раствора) находим массу раствора
m (раствора) = V (раствора) • ρ (раствора) = 500 см 3 • 1,25 г / см 3 = 625 г.
Из формулы ω ( HNO 3 ) = m ( HNO 3 ) / m (раствора находим массу азотной кислоты
m ( HNO 3 ) = ω ( HNO 3 ) • m (раствора) = 0,4 • 625 г = 250 г.
ИИ образом.
Из формулы ρ (раствора) = m (раствора) / V (раствора) находим массу раствора
m (раствора) = V (раствора) • ρ (раствора) = 500 см 3 • 1,25 г / см 3 = 625 г.
Находим массу азотной кислоты. Для этого составляем пропорцию и решаем ее.
То, что массовая доля азотной кислоты составляет 40% означает, что
в 100 г раствора содержится 40 г азотной кислоты, тогда
в 625 г раствора будет содержаться х г азотной кислоты.
100 г / 625 г = 40 г / х г
х г • 100 г = 40 г • 625 г
х = 40 г • 625 г / 100 г = 250 г.
Ответ: m (HNO 3 ) = 250 г.
- Подробности
- Категория: ЕГЭ — химия
Методы решения расчетных задач по химии, связанные с концентрацией растворов
Во всех задачах этой группы присутствуют расчеты, связанные с концентрацией растворов. Причем во всех тестах используется единственный способ выражения концентрации — массовая доля. Поэтому при решении практически всех задач В9 мы будем пользоваться соотношением для определения массовой доли:
Анализ всех задач, предлагавшихся для решения, за последние годы позволяет распределить их на четыре группы:
1. Определение массы растворенного вещества в определенной порции раствора при известной концентрации;
2. Приготовление раствора путем растворения определенного количества вещества в некотором объеме (массе) растворителя;
3. Изменение концентрации уже имеющегося раствора одним из следующих способов:
а) добавлением к раствору того же растворенного вещества;
б) добавлением к раствору растворителя;
в) смешиванием двух различных растворов одного и того же вещества;
г) выпариванием растворителя или растворенного вещества из раствора.
4. Использование химической реакции в процессе приготовления раствора.
В этой статье,рассмотрим задачи 1-й из вышеперечисленных четырех групп.
Определение массы растворенного вещества в растворе
Задача 1.
Масса соли, которая вводиться в организм при вливании 353 г физиологического раствора, содержащего 0,85% (по массе) поваренной соли, равна … г (запишите число с точностью до целых).
Дано:
масса раствора: mр-ра = 353 г;
массовая доля растворенного вещества: 
Найти: массу растворенной соли.
Решение:
Задача решается в одно действие путем непосредственного проставления данных из условия в соотношение для вычисления массовой доли растворенного вещества.
Ответ: масса растворенного вещества равна 3г.
Задача 2.
Какая масса азотной кислоты содержится в 1 л ее 20% раствора с плотностью 1,05 г/мл. Ответ: … г (запишите число с точностью до целых).
Дано:
объем раствора азотной кислоты: Vр-ра — 1 л;
массовая доля HNO3в р-ре : 
плотность раствора: pр-ра = 1,05 г/мл.
Найти: массу азотной кислоты: m(НNO3) = ?
Решение:
В первую очередь необходимо от объема раствора перейти к его массе, используя плотность. При этом следует учесть, что объем указан в литрах, а плотность в г/мл. Переведем значение
объема в единицы измерения, соответствующие плотности.
Vр-ра = 1л = 1000 мл
mр-ра = Vр-ра . рр-ра = 1000 . 1,05 = 1050г.
Далее используем соотношение для определения массовой доли.
Ответ: m(НNO3) 210 г.
Источник:
ЕГЭ. Химия. Расчетные задачи в тестах ЕГЭ. Части А, В, С / Д.Н. Турчен. — М.: Издательство «Экзамен», 2009. — 399 [1]с. (Серия «ЕГЭ. 100 баллов»). I8ВN 978-5-377-02482-8.
Какой объём раствора азотной кислоты с массовой долей HNO3 60% (r=1,37) нужно взять, чтобы приготовить 200 мл раствора с молярной концентрацией HNO3 равной 3 моль/л?
Решение:
Определяем массу азотной кислоты необходимую для приготовления 200 мл раствора с молярной концентрацией 3 моль/л
с(HNO3) =
m(HNO3) = с(HNO3)×M(HNO3)×V(p-pa) = 3 моль/л× 63 г/моль×0,2 л = 37,8 г
Определяем массу раствора с массовой долей HNO3, в котором содержится HNO3 массой 37,8 г.
В 100 г р-ра содержится 60 гHNO3
х г р-ра 37,8 г
m(р-ра) = х = = 63 гV(p-pa) =
=
= 46,2 мл.
Эту задачу можно решить, используя формулу перехода от массовой доли к молярной концентрации.
Найдите правильный ответ на вопрос ✅ «Рассчитайте массу чистой азотной кислоты в растворе азотной кислоты объемом 200 мл плотностью 1,31 г/см в Кубе и массовой долей 50% …» по предмету 📘 Химия, а если вы сомневаетесь в правильности ответов или ответ отсутствует, то попробуйте воспользоваться умным поиском на сайте и найти ответы на похожие вопросы.
Смотреть другие ответы
Главная » Химия » Рассчитайте массу чистой азотной кислоты в растворе азотной кислоты объемом 200 мл плотностью 1,31 г/см в Кубе и массовой долей 50%