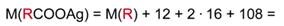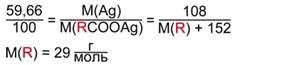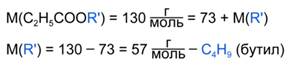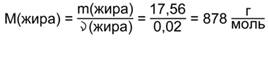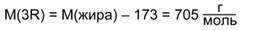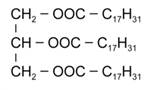1. Составим уравнение реакции:
2 СН3ОН = СН3-О-СН3 + Н2О
По уравнению:
- в реакцию вступает 2 моль метанола;
- образуется 1 моль эфира.
Найдём массу метанола по формуле:
m(СН3ОН) = n*M = 2 моль * (12 + 1*3 + 16 + 1) = 64 г
Найдём массу эфира по формуле:
m(СН3-О-СН3) = n*M = 1 моль * (12 + 1*3 + 16 + 12 +1*3) = 46 г
2. Найдём массу теоретического выхода эфира:
25 г СН3ОН — х г СН3-О-СН3
64 г СН3ОН — 46 г СН3-О-СН3
Отсюда, х = 25*46 / 64 = 18 г
3. Вычислим практический выход эфира:
18 г — теоретический выход — 100%
х г — практический выход — 80%
Отсюда, х = 18*80 / 100 = 14,4 г.
Метод определения простейшей формулы эфира
Некоторые задачи в тестах ЕГЭ представляют собой комбинацию двух более простых задач. Рассмотрим такой пример.
Задача 2.8.
При взаимодействии одноатомного спирта, содержащего 37,5% углерода и 50% кислорода, с органической кислотой образуется вещество, плотность паров которого по аргону равна 2,15. Определите молекулярную формулу образующегося вещества.
Дано:
массовая доля углерода в спирте: 
массовая доля кислорода в спирте: 
относительная плотность паров эфира по аргону: D(Аr) = 2,15.
Найти: молекулярную формулу эфира.
Решение:
Данная задача представляет собой комбинацию двух более простых задач. В первой из них требуется узнать формулу спирта по значениям массовых долей элементов в нем. Во второй части требуется выявить формулу эфира по его молярной массе. Рассмотрим ход решения более подробно.
Шаг 1. Очевидно, что при взаимодействии одноатомного спирта с органической кислотой образуется сложный эфир. Если предположить, что в реакции участвовала карбоновая кислота, то в состав образовавшегося сложного эфира входят углерод, водород и кислород.
Шаг 2. Для составления уравнения реакции необходимо определить формулы спирта и кислоты. В условии указано, что спирт был одноатомным, следовательно, в его состав входил лишь один атом кислорода. Соотношение атомов углерода и водорода в углеводородном радикале нам неизвестно. Поэтому формулу спирта обозначим как СxHyOH.
В отношении карбоновой кислоты в условии нет никакой информации, но небольшое значение молярной массы эфира, рассчитанное по относительной плотности его паров позволяет утверждать, что она была одноосновная. Обозначим ее формулу как СzHkCOOH.
Запишем реакцию этерификации:
Шаг 3. По значениям массовых долей элементов определим соотношение атомов в молекуле спирта.
Сначала определим массовую долю водорода. Так как в состав спирта входит только углерод, кислород и водород, сумма их массовых долей составит 100% :






Теперь необходимо произвольно выбрать некоторый образец, в котором мы будем определять соотношение количеств веществ элементов. В условии указана информация о массовой доле, поэтому удобно выбрать образец массой 100 г. В этом случае числовые значения массовой доли каждого элемента совпадут с его массой в этом стограммовом образце.
Итак, в 100 г искомого вещества содержится 37,5 г углерода, 12,5 г водорода и 50 г кислорода.
Далее вычислим соотношение количеств вещества (n) углерода, водорода и кислорода.
Шаг 4. Находим простейшую формулу.
n(С): n(H) : n(О) = 3,125 : 12,5 : 3,125
Выбираем наименьшее значение (в данном случае «3,125») и делим на него все три числа:
Получили набор наименьших целых чисел. Это дает возможность записать простейшую формулу: СН4О.
Шаг 5. В условии есть указание на одноатомность спирта. Это значит, что его молекула содержит только один атом кислорода. Следовательно, индексы в простейшей формуле увеличивать не надо, она совпадает с истинной. Запишем истинную формулу спирта, выделив в ней гидроксильную группу: СН3ОН.
с учетом найденной формулы спирта будет иметь следующий вид:
По относительной плотности паров по аргону определяем истинную молярную массу эфира:
М(эфира) = D(Аr) . M(Аr) = 2,15 . 40 = 86 г/моль.
Определим вклад в общую молярную массу углеводородного радикала — остатка от карбоновой кислоты:
М(СzHk) = 86 – (12 + 1 . 3 + 16 . 2 + 12) = 27 г/моль.
По значениям молярных масс элементов составляем математическое уравнение с двумя неизвестными:
12 . z + 1 . k = 27
Пренебрегая вкладом массы водорода в общую массу, получаем математическое уравнение, позволяющее оценить количество атомов углерода в молекуле:
Если количество атомов углерода в углеводородном радикале равно 2, то подставляя z = 2 в математическое уравнение с двумя неизвестными получаем:
12 . 2 + 1 . k = 27
k = 8.
Следовательно, углеводородный радикал оставшейся в молекуле эфира от карбоновой кислоты имеет формулу: С2Н3.
Формула эфира для формирования ответа будет иметь вид:
Примеры задач по химии сложных эфиров и жиров
Задача 1
Условие задачи.
Какие исходные кислоты и спирты необходимо взять для синтеза сложных эфиров этилбензоата (с запахом мяты) и бензилацетата (с запахом жасмина)?
Решение
1. Вспомните, как образуется название сложного эфира.
Ответ: сначала указывают название радикала – остатка от спирта, а затем название кислотного остатка.
2. Определим исходные вещества для синтеза этилбензоата и бензилацетата.
«Этил» – остаток этилового спирта, «бензоат» – остаток бензойной кислоты. Следовательно, этилбензоат образуется из бензойной кислоты и этилового спирта. «Бензил» – остаток бензилового спирта, «ацетат» – остаток уксусной кислоты.
Формулы сложных эфиров представлены на рисунке 1.
Рис. 1. Формулы и исходные вещества для синтеза этилбензоата и бензилацетата
Приведенные сложные эфиры между собой являются изомерами, их состав соответствует формуле С9Н10О2 (Рис. 2).
Рис. 2. Изомерные сложные эфиры
Задача 2
Условие задачи
При гидролизе сложного эфира, молярная масса которого равна 130 г/моль, образуются кислота А и спирт Б. Определите строение эфира, если: а)серебряная соль кислоты А содержит 59,66 % серебра, б) спирт Б не окисляется дихроматом калия.
Решение
1. Предположим, что кислота, образующая сложный эфир, одноосновна. Но если задача не будет решена таким образом, то придется рассматривать случаи двух-, трехосновной кислот и так далее.
2. Запишем формулу серебряной соли и рассчитаем молярную массу углеводородного радикала R в кислоте.
RCOOAg – формула серебряной соли кислоты А.
Зная молярные массы серебра, углерода и кислорода, выразим молярную массу RCOOAg:
Известно, что серебро составляет 59,66 % от массы всей соли. Составим пропорцию:
59,66 % – 108 г/моль
100 % – (M(R) + 152) г/моль
Произведем соответствующие вычисления и найдем молярную массу R:
Такая молярная масса соответствует радикалу этилу – С2Н5. Следовательно, кислота, образующая сложный эфир, – пропановая. Тогда, общая формула эфира – С2Н5СООR.
Зная молярную массу эфира С2Н5СООR, можно найти молярную массу радикала R:
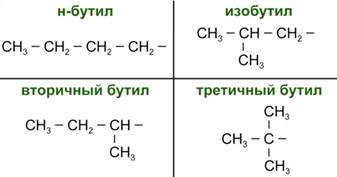
Молярной массе 57 г/моль соответствуют 4 изомерных радикала (Рис. 3).
Рис. 3. Изомеры состава -С4Н9
В условии задачи сказано, что спирт Б не окисляется дихроматом калия, следовательно, этот спирт является третичным.
Таким образом, исходный сложный эфир образован пропановой кислотой и третбутиловым спиртом:
Задача 3
Условие задачи
Растительное масло массой 17,56 г нагрели с 3,36 г гидроксида калия до полного исчезновения масляного слоя. При действии избытка бромной воды на полученный после гидролиза раствор образуется только одно тетрабромпроизводное.
Установите возможную формулу жира.
Решение
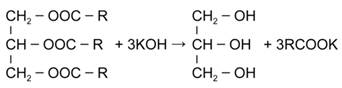
Запишем в общем виде уравнение гидролиза жира:
На 1 моль жира при гидролизе приходится 3 моль гидроксида калия.
Найдем количество вещества гидроксида калия и жира (количество жира втрое меньше):
Зная количество и массу жира, можно найти его молярную массу:
На три углеводородных радикала R кислот приходится 705 г/моль:
Зная, что тетрабромпроизводное получено только одно, можно сделать вывод, что все кислотные остатки одинаковы и содержат по 2 двойные связи. Тогда получаем, что в каждом радикале содержится 17 атомов углерода, это радикал линолевой кислоты:
Возможная формула жира представлена на рисунке 4.
Рис. 4. Формула жира
Вася Иванов
Мореплаватель — имя существительное, употребляется в мужском роде. К нему может быть несколько синонимов.
1. Моряк. Старый моряк смотрел вдаль, думая о предстоящем опасном путешествии;
2. Аргонавт. На аргонавте были старые потертые штаны, а его рубашка пропиталась запахом моря и соли;
3. Мореход. Опытный мореход знал, что на этом месте погибло уже много кораблей, ведь под водой скрывались острые скалы;
4. Морской волк. Старый морской волк был рад, ведь ему предстояло отчалить в долгое плавание.
dgadod
Вопрос по химии:
Как найти массу эфира если известна его масса метилового спирта и масса метиловой кислоты
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
reginanoa385
По избытку-недостатку находишь количество в-ва недостатка. вычисляешь кол-во в-ва сложного эфира. А затем находишь массу.
Знаете ответ? Поделитесь им!
Гость ?
Как написать хороший ответ?
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете
правильный ответ; - Писать подробно, чтобы ответ был исчерпывающий и не
побуждал на дополнительные вопросы к нему; - Писать без грамматических, орфографических и
пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся
уникальные и личные объяснения; - Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не
знаю» и так далее; - Использовать мат — это неуважительно по отношению к
пользователям; - Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует?
Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие
вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи —
смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.