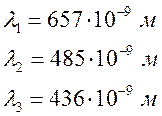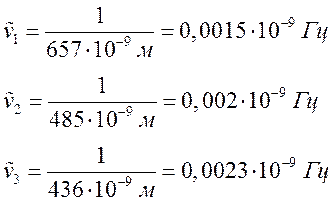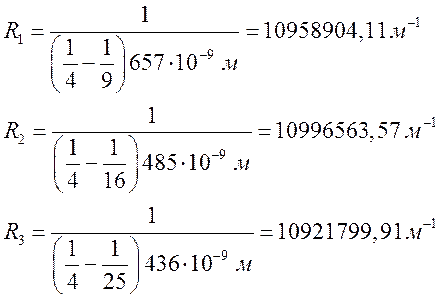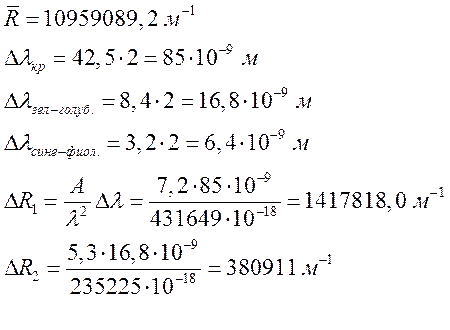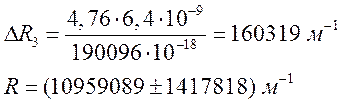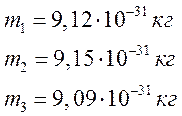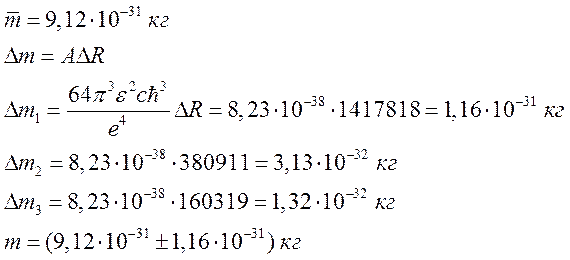Министерство образования Республики Беларусь
Учреждение образования
«Гомельский государственный университет имени
Ф.Скорины»
Физический факультет
Отчет по лабораторной работе
Изучения спектра испускания атомарного водорода.
Определение постоянной Ридберга и массы электрона.
Выполнил:
Студент группы Ф-32
Кухаренко Александр
Гомель 2006
Лабораторная работа
Изучения спектра испускания атомарного водорода.
Определение постоянной Ридберга и массы электрона.
Цель работы: экспериментально
изучить спектры испускания атомов ртути и водорода в видимой области; на
основе спектроскопических измерений рассчитать значения постоянной Ридберга для
водорода, массы электрона и радиуса первой боровской орбиты.
Приборы и оборудование:
монохроматор УМ-2 , ртутная лампа ДРШ-25 с блоком питания, газоразрядная
водородная трубка с блоком питания, атлас спектральных линий ртути.
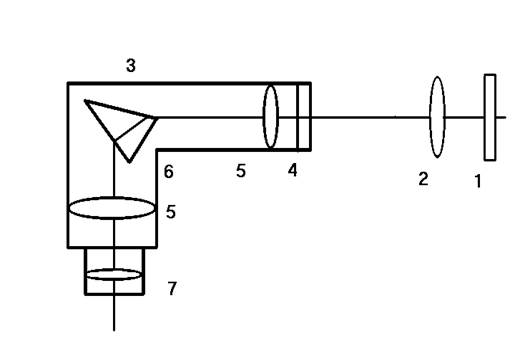
Рисунок.
Схема экспериментальной установки;
1-
ртутная лампа ДРШ- 250; 2-
конденсор; 3- монохроматор УМ- 2;
4- входная щель прибора; 5- объективы коллиматора и
зрительной трубы;
6- диспергирующая призма; 7- окуляр;
Основные формулы:
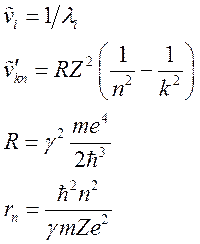
— длина волны
— волновое число
— постоянная Ридберга
— порядковый номер элемента в
периодической
системе элементов Д. И. Менделеева
— стационарные состояния
— масса электрона
— заряд электрона
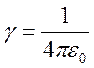
— приведённая постоянная Планка
— радиус орбиты
Выполнение работы.
1.
Проградуировал монохроматор по спектру излучения ртути, составил градуировочную
таблицу и построил градуировочный график:
Таблица 1. Спектр ртути
|
|
|
|
|
|
7081,88 |
3370 |
5405,79 |
2628 |
|
6907,16 |
3322 |
5389,01 |
2616 |
|
6716,17 |
3264 |
5365,06 |
2594 |
|
6234 |
3088 |
5102,42 |
2440 |
|
6123,27 |
3040 |
5025,64 |
2378 |
|
6072,64 |
3018 |
4960,32 |
2300 |
|
5890,16 |
2934 |
4916,03 |
2260 |
|
5872,03 |
2922 |
4358,35 |
1590 |
|
5859,39 |
2916 |
4347 |
1572 |
|
5817,7 |
2890 |
4339,25 |
1558 |
|
5790,65 |
2880 |
4108,06 |
1160 |
|
5769,59 |
2872 |
4077,81 |
1102 |
|
5675,86 |
2818 |
4046,56 |
1032 |
|
5460,74 |
2688 |
Градуировочный
график монохроматора, полученный по спектру излучения ртути
Таблица 2. Спектр водорода
2. По
градуировочной кривой определил длины волн наблюдаемых спектральных линий
водорода:
3. Рассчитал для
определённых длин волн соответствующие им волновые числа.
4.
По формуле 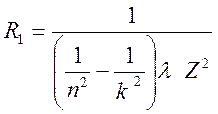
Z=1 для водорода
5.
По формуле 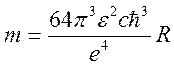
значениям определил величину массы электрона
:
6.
По формуле 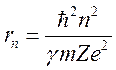
радиус первой боровской орбиты:
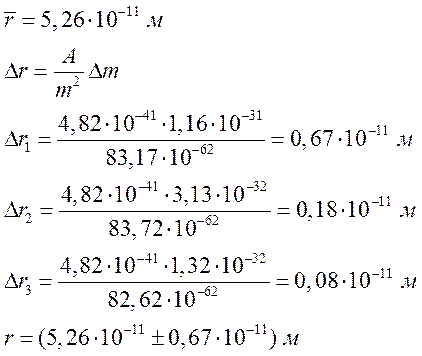
Вывод: В ходе эксперимента мы ознакомились
со спектрами ртути и водорода, вычислили постоянную Ридберга: , массу электрона:
и радиус первой боровской орбиты:
.
Сравнив полученные значения с табличными, сделали
выводы о качестве метода эксперимента и полученных погрешностях, которые
оказались вполне приемлемыми.
Теория
Бора водородоподобных атомов.
Нильс
Бор создал теорию строения атома,
способную объяснить опыты Резерфорда
и спектр излучения паров водорода.
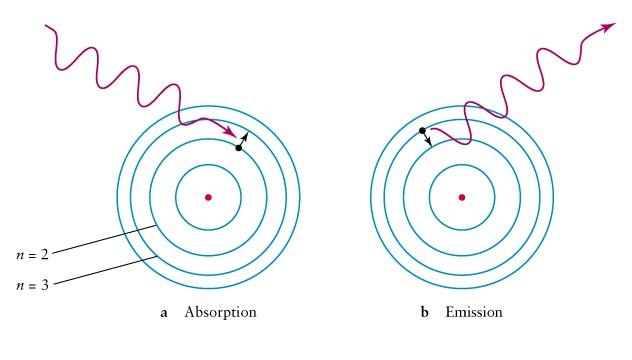
Спектр
характеризует распределение интенсивности
излучения по шкале частот (или по шкале
длин волн).

Постулаты
Бора.
1-й
постулат:
электрон
в атоме может двигаться только по
определенным стационарным орбитам,
находясь на которых, он не излучает и
не поглощает энергию. Момент импульса
электрона на этих орбитах кратен
постоянной Планка:
, (1)
me
– масса электрона,
— скорость электрона на орбите с номером
n,
rn
– радиус орбиты с номером n,
n
=1,2,3,….
Дж·с
– постоянная Планка.
2-й
постулат:
при
переходе электрона с одной стационарной
орбиты на другую излучается или
поглощается фотон, энергия которого
.
(2)
E
n1
и
E
n2
— энергия электрона в состоянии 1 и 2
(т.е. на орбитах 1 и 2),
— частота электромагнитных волн,
—
постоянная Планка.
Радиус
орбиты электрона в атоме водорода.
1-й
постулат Бора,
.
Выразим
скорость электрона:
.
(3)
Рассмотрим
круговые электронные орбиты. На электрон
с зарядом —e
со стороны ядра с зарядом +e
действует сила Кулона F,
сообщая электрону нормальное ускорение,
.
По
2-му закону Ньютона,
.
(4)
Сократим
и подставим скорость из (3):
.
Отсюда

Радиус
первой орбиты электрона (n
= 1), называется радиусом
Бора
,
=
0.53·10-10
м.
Радиус
орбиты электрона в атоме водорода
,
n
=1,2,3,…. – номер орбиты.
Энергия
электрона в атоме водорода.
Энергия
электрона представляет собой сумму
кинетической энергии
и
потенциальной
.
и
.
Потенциальная
энергия – это энергия электрона с
зарядом
в электрическом поле ядра. Из уравнения
(4) видно, что
.
Тогда
на n
–ой
орбите энергия электрона равна
=
=.
Т.е.
кинетическая энергия электрона равна
полной энергии, взятой со знаком «-».
Также
полную энергию можно записать через
потенциальную:
=
, или
.
Подставим
.
Тогда
=
.
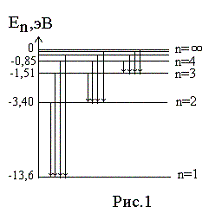
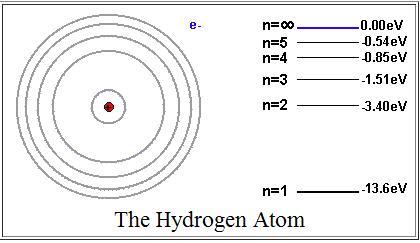
Энергия
на первой орбите (на первом энергетическом
уровне) равна
=
= -13,6 эВ.
Величину
=
13,6 эВ = 2,18∙10-18
Дж
называют
энергией ионизации
(эта энергия необходима, чтобы перевести
электрон, находящийся на первом уровне,
в свободное состояние, т.е. чтобы
ионизовать атом). Окончательно, энергия
электрона на n
–ом
энергетическом уровне (на n
–ой
орбите) записывается как
=
.
Спектр излучения водорода.
Энергия
излучаемого или поглощаемого кванта:
.
Частота
,
длина волны,
— скорость света в вакууме.
=
+
=
,
=
.
=
—
формула Бальмера,
определяет
длины волн в спектре атома водорода.
=
1,1∙107
м-1
— постоянная Ридберга.
и
— номера энергетических состояний
(номера орбит) электрона.
Переходы
электрона с возбужденных энергетических
состояний на основной энергетический
уровень (
= 1) сопровождаются излучением в УФ
области
спектра (серия линий Лаймана),
переходы
на уровень с
= 2 приводят к линиям в
видимой области
(серия Бальмера),
переходы
на уровень с
= 3, 4, 5, … приводят излучению в ИК
области.
Теория
Бора не смогла объяснить строение
сложных атомов. Для объяснения поведения
микрочастиц была развита квантовая
механика.
Она
основана на том, что любая микрочастица,
наряду с корпускулярными, обладает
также волновыми свойствами (гипотеза
де Бройля).
Для
фотона, импульс
.
По
аналогии с фотоном, любую микрочастицу
можно рассматривать как волну с длиной
волны
,
—
длина волны де Бройля.
Гипотеза
де Бройля подтверждена экспериментально
наблюдением дифракции электронов, а
затем и протонов.
Принцип
неопределенностей.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Масса — атом — водород
Cтраница 1
Масса атома водорода равна 1 674 — 10 — 27 кг.
[1]
Масса атома водорода ( протон электрон) 1 00814 а.
[2]
Масса атома водорода равна 1 674 — 10 — 22 кг.
[3]
Масса атома водорода, состоящего из протона и электрона, равна 1 0078 атомной единицы массы. Обычный водород почти полностью состоит из таких атомов, однако наряду с ними он содержит в отношении 1: 5000 более тяжелые атомы водорода. Масса тяжелого атома водорода, или атома дейтерия, составляет 2 0143 атомной единицы массы. Ядро дейтерия называется дейтроном. Он имеет такой же заряд, как и протон, но масса его примерно вдвое превышает массу протона.
[4]
Масса атома водорода равна 1 008 к. Таким образом, масса электрона составляет лишь небольшую часть массы атома водорода.
[6]
Масса атома водорода Н равна 1 00815 а.
[7]
Ин — масса атома водорода.
[8]
УИН — масса атома водорода, ( УИН — Мп) с20 782Л1эв, ядро z A неустойчиво по отношению к электронному распаду ( стр.
[9]
Какую часть массы атома водорода составляет масса электрона.
[10]
Поделив на массу атома водорода / пн 1 67 — 10 — — 4 г, найдем молекулярный вес содержимого ячейки. Но число молекул в ячейке, разумеется, не может быть дробным. Кроме того, во многих случаях соображения симметрии ограничивают возможные числа молекул. Например, в ромбической ячейке число молекул не может быть меньше четырех. Таким образом, измерения ячейки позволяют делать важные суждения о молекулярном весе вещества.
[11]
Поделив на массу атома водорода шн 1 67 — 10 — 24 г, найдем молекулярный вес содержимого ячейки. Но число молекул в ячейке, разумеется, не может быть дробным. Кроме того, во многих случаях соображения симметрии ограничивают возможные числа молекул. Например, в ромбической ячейке число молекул не может быть меньше четырех. Таким образом, измерения ячейки позволяют делать важные суждения о молекулярном весе вещества.
[12]
Таким образом, масса атома водорода, состоящего из одного электрона и одного протона, практически совпадает с массой протона.
[14]
Таким образом, масса атома водорода приблизительно равна массе 1 / 12 части атома углерода, а масса атома кислорода приблизительно в 16 раз больше массы 1 / 12 части атома углерода.
[15]
Страницы:
1
2
3
4
From Wikipedia, the free encyclopedia
| Constant | Values | Units |
|---|---|---|
| me | 9.1093837015(28)×10−31[1] | kg |
| 5.48579909065(16)×10−4[2] | Da | |
| 0.51099895000(15) | MeV/c2 | |
| mec2 | 8.1871057769(25)×10−14 | J |
| 0.51099895000(15)[3] | MeV |
In particle physics, the electron mass (symbol: me) is the mass of a stationary electron, also known as the invariant mass of the electron. It is one of the fundamental constants of physics. It has a value of about 9.109×10−31 kilograms or about 5.486×10−4 daltons, which has an energy-equivalent of about 8.187×10−14 joules or about 0.511 MeV.[3]
Terminology[edit]
The term «rest mass» is sometimes used because in special relativity the mass of an object can be said to increase in a frame of reference that is moving relative to that object (or if the object is moving in a given frame of reference). Most practical measurements are carried out on moving electrons. If the electron is moving at a relativistic velocity, any measurement must use the correct expression for mass. Such correction becomes substantial for electrons accelerated by voltages of over 100 kV.
For example, the relativistic expression for the total energy, E, of an electron moving at speed v is
where
- c is the speed of light;
- γ is the Lorentz factor,
- me is the «rest mass», or more simply just the «mass» of the electron.
This quantity me is frame invariant and velocity independent. However, some texts[which?] group the Lorentz factor with the mass factor to define a new quantity called the relativistic mass, mrelativistic = γme.[citation needed]
Determination[edit]
Since the electron mass determines a number of observed effects in atomic physics, there are potentially many ways to determine its mass from an experiment, if the values of other physical constants are already considered known.
Historically, the mass of the electron was determined directly from combining two measurements. The mass-to-charge ratio of the electron was first estimated by Arthur Schuster in 1890 by measuring the deflection of «cathode rays» due to a known magnetic field in a cathode ray tube. Seven years later J. J. Thomson showed that cathode rays consist of streams of particles, to be called electrons, and made more precise measurements of their mass-to-charge ratio again using a cathode ray tube.
The second measurement was of the charge of the electron. This was determined with a precision of better than 1% by Robert A. Millikan in his oil drop experiment in 1909. Together with the mass-to-charge ratio, the electron mass was determined with reasonable precision. The value of mass that was found for the electron was initially met with surprise by physicists, since it was so small (less than 0.1%) compared to the known mass of a hydrogen atom.
The electron rest mass can be calculated from the Rydberg constant R∞ and the fine-structure constant α obtained through spectroscopic measurements. Using the definition of the Rydberg constant:
thus
where c is the speed of light and h is the Planck constant.[4] The relative uncertainty, 5×10−8 in the 2006 CODATA recommended value,[5] is due entirely to the uncertainty in the value of the Planck constant. With the re-definition of kilogram in 2019, there is no uncertainty by definition left in Planck constant anymore.
The electron relative atomic mass can be measured directly in a Penning trap. It can also be inferred from the spectra of antiprotonic helium atoms (helium atoms where one of the electrons has been replaced by an antiproton) or from measurements of the electron g-factor in the hydrogenic ions 12C5+ or 16O7+.
The electron relative atomic mass is an adjusted parameter in the CODATA set of fundamental physical constants, while the electron rest mass in kilograms is calculated from the values of the Planck constant, the fine-structure constant and the Rydberg constant, as detailed above.[4][5]
Relationship to other physical constants[edit]
The electron mass is used to calculate[citation needed] the Avogadro constant NA:
Hence it is also related to the atomic mass constant mu:
where
- Mu is the molar mass constant (defined in SI);
- Ar(e) is a directly measured quantity, the relative atomic mass of the electron.
Note that mu is defined in terms of Ar(e), and not the other way round, and so the name «electron mass in atomic mass units» for Ar(e) involves a circular definition (at least in terms of practical measurements).
The electron relative atomic mass also enters into the calculation of all other relative atomic masses. By convention, relative atomic masses are quoted for neutral atoms, but the actual measurements are made on positive ions, either in a mass spectrometer or a Penning trap. Hence the mass of the electrons must be added back on to the measured values before tabulation. A correction must also be made for the mass equivalent of the binding energy Eb. Taking the simplest case of complete ionization of all electrons, for a nuclide X of atomic number Z,[4]
As relative atomic masses are measured as ratios of masses, the corrections must be applied to both ions: the uncertainties in the corrections are negligible, as illustrated below for hydrogen 1 and oxygen 16.
| Physical parameter | 1H | 16O |
|---|---|---|
| relative atomic mass of the XZ+ ion | 1.00727646677(10) | 15.99052817445(18) |
| relative atomic mass of the Z electrons | 0.00054857990943(23) | 0.0043886392754(18) |
| correction for the binding energy | −0.0000000145985 | −0.0000021941559 |
| relative atomic mass of the neutral atom | 1.00782503207(10) | 15.99491461957(18) |
The principle can be shown by the determination of the electron relative atomic mass by Farnham et al. at the University of Washington (1995).[6] It involves the measurement of the frequencies of the cyclotron radiation emitted by electrons and by 12C6+ ions in a Penning trap. The ratio of the two frequencies is equal to six times the inverse ratio of the masses of the two particles (the heavier the particle, the lower the frequency of the cyclotron radiation; the higher the charge on the particle, the higher the frequency):
As the relative atomic mass of 12C6+ ions is very nearly 12, the ratio of frequencies can be used to calculate a first approximation to Ar(e), 5.4863037178×10−4. This approximate value is then used to calculate a first approximation to Ar(12C6+), knowing that 
References[edit]
- ^ «2018 CODATA Value: electron mass». The NIST Reference on Constants, Units, and Uncertainty. NIST. 20 May 2019. Retrieved 2019-05-20.
- ^ «2018 CODATA Value: electron mass in u». The NIST Reference on Constants, Units, and Uncertainty. NIST. 20 May 2019. Retrieved 2020-06-21.
- ^ a b «2018 CODATA Value: electron mass energy equivalent in MeV». The NIST Reference on Constants, Units, and Uncertainty. NIST. 20 May 2019. Retrieved 2022-07-11.
- ^ a b c «CODATA Value: electron mass». The NIST Reference on Constants, Units and Uncertainty. May 20, 2019. Retrieved May 20, 2019.
- ^ a b The NIST reference on Constants, Units, and Uncertainty, National Institute of Standards and Technology, 10 June 2009
- ^ Farnham, D. L.; Van Dyck Jr., R. S.; Schwinberg, P. B. (1995), «Determination of the Electron’s Atomic Mass and the Proton/Electron Mass Ratio via Penning Trap Mass Spectroscopy», Phys. Rev. Lett., 75 (20): 3598–3601, Bibcode:1995PhRvL..75.3598F, doi:10.1103/PhysRevLett.75.3598, PMID 10059680