Chem.Family
Микрозадачи на атомистику
Большие задачи на атомистику из второй части состоят на 10% непосредственно из атомистики и на 90% из самых обычных расчетов по типу «избыток-недостаток» или «нахождение массовой доли в растворе»
Поэтому чтобы научиться их решать, не надо в самом начале тратить время на эти 90% долгих элементарных расчетов. Надо прицельно тренировать атомистику
Сначала посмотри разбор микрозадач на атомистику, а потом потренируй их сам. Только не 2-3 штуки, а все. Чтобы ты их решал на автомате. И только потом переходи к полноценным задачам на атомистику. Увидишь насколько они легко зайдут 
Задание №1
Соотношение атомов натрия и кислорода в 98 г водного раствора гидроксида натрия равно 1:5. Вычислите массовую долю гидроксида натрия в растворе.
Источник: ChemFamily
Задание №2
В 260.8 г раствора нитрата калия содержится 7.4648·1024 атомов кислорода. Вычислите массовую долю соли.
Источник: ChemFamily
Задание №3
В 26% растворе хлорида бария содержится 1.806·1023 хлорид-анионов. Вычислите массу раствора.
Источник: ChemFamily
Задание №4
Вычислите массовую долю протонов в 142 г 36%-го раствора гидроксида натрия.
Источник: ChemFamily
Задание №5
Массовая доля протонов в 866 г раствора сульфата меди(II) составляет 54.05%. Вычислите массовую долю сульфата меди(II).
Источник: ChemFamily
Задание №6
Общее число электронов в 396 г смеси оксида кальция и гидроксида кальция в 199 раз больше числа Авогадро. Вычислите массовую долю гидроксида кальция в смеси.
Источник: ChemFamily
Задание №7
В кристаллогидрате сульфата меди(II) массовая доля серы в 2.5 разa меньше массовой доли кислорода. Определите молекулярную массу искомого кристаллогидрата.
Источник: ChemFamily
Задание №8
Смесь цинка и алюминия общей массой 18.25 г растворили в избытке соляной кислоты. Известно, что при этом атомы цинка в общей сложности отдали в 2 раза больше электронов, чем атомы алюминия. Вычислите массовую долю цинка в исходной смеси.
Источник: ChemFamily
Еще один шажочек к решению 34 задач
Задания 34 (2022). Расчет массовой доли химического соединения в смеси.
Задание №1
Смесь меди и оксида меди(II), в которой масса протонов в ядрах всех атомов составляет 46% от общей массы смеси, разделили на две равные части. К первой части добавили избыток разбавленного раствора серной кислоты. При этом образовалось 528 г раствора с массовой долей соли 10%. Ко второй части добавили 700 г разбавленного раствора азотной кислоты, взятого в избытке. Вычислите массовую долю нитрата меди(II) в образовавшемся растворе.
Решение
Ответ: ꞷ(Cu(NO3)2)=12,31 %
Пояснение:
CuO + H2SO4 ⟶ CuSO4 + H2O (I)
3Cu + 8HNO3 ⟶ 3Cu(NO3)2 + 2NO + 4H2O (II)
CuO + 2HNO3 ⟶ Cu(NO3)2 + H2O (III)
1) Исходя из условия, можем сразу найти количество вещества сульфата меди(II):
m(CuSO4) = = 52,8 г
n(CuSO4) = 52,8/160 = 0,33 моль
2) Найдем количество протонов в смеси меди и оксида меди (II), при этом примем количество обоих веществ за 1 моль.
N(p+) в Cu = 29 частиц;
N(p+) в CuO = 29 + 8 = 37 частиц;
3) По условию массовая доля протонов составляет 46% от общей массы. Это значит, что масса протонов составляет 46% (или 0,46) от суммы масс двух веществ. Составим уравнение, зная, что молярная масса одного протона составляет 1 г/моль.
ꞷ(p+) = mp+ / m(Cu) + m(CuO)
4) Пусть n(Cu) = x моль, тогда m(Cu) = 64x г;
m общ.(CuO) = nобщ.(CuO) · M
nобщ.(CuO) = 0,33 · 2 = 0,66 моль – так как смесь разделили на 2 равные части
m общ.(CuO) = 0,66 · 80 = 52,8 г
m(p+) = mCu(p+) + mCuO(p+)
Если в 1 моль меди содержится 29 протонов, то в n(Cu) = x моль, содержится 29x протонов, а значит: m(p+) = (29x моль) · (1 г/моль) = 29x г
Если в 1 моль оксида меди(II) содержится 37 моль протонов, то в n(CuO) = 0,33 моль содержится 0,66 ∙ 37 = 24,42 моль протонов, а значит: m(p+) = 24,42 ∙ 1 = 24,42 г.
5) Подставим под уравнение:
0,46 = (29x + 24,42) / (64x + 52,8)
29,44x + 24,29 = 29x + 24,42
0,44x = 0,13
x = 0,13/0,44 = 0,3 моль – общее количество меди.
0,3/2 = 0,15 моль – количество меди в одной части смеси.
6) По уравнениям реакций найдем m(Cu(NO3)2):
n2(Cu(NO3)2) = n2(Cu) = 0,15 моль
n3(Cu(NO3)2) = n3(CuO) = 0,33 моль
nобщ.(Cu(NO3)2) = 0,15 + 0,33 = 0,48 моль.
mобщ.(Cu(NO3)2) = M·n = 0,48 · 188 = 90,24 г
7) Найдем ꞷ(Cu(NO3)2):
mр—ра(Cu(NO3)2) = m(Cu) + m(CuO) + mр—ра(HNO3) – m(NO)
m(Cu) = M·n = 0,15 · 64 = 9,6 г
m(CuO) = M·n = 0,33 · 80 = 26,4 г
m(NO) = 2/3 · n·M = 2/3 · 0,15 · 30 = 3 г
mр—ра(Cu(NO3)2) = 9,6 + 26,4 + 700 – 3 = 733 г
ꞷ(Cu(NO3)2) = (90,24/733) · 100% = 12,31 %
Задание №2
К 60 г раствора дигидрофосфата натрия, в котором 55% от общей массы раствора составляет масса протонов в ядрах всех атомов, добавили 40 г 15%-ного раствора гидроксида натрия. Затем к образовавшемуся раствору добавили 51 г нитрата серебра. Определите массовую долю нитрата серебра в конечном растворе.
Решение
Ответ: ꞷ(AgNO3) = 13,68 %
Пояснение:
1) Так как при взаимодействии дигидрофосфата натрия со щелочью может образовываться два типа солей: фосфат натрия либо гидрофосфат натрия – необходимо вычислить соотношение реагентов.
m(NaOH) = 0,15 · 40 = 6 г
n(NaOH) = 6/40 = 0,15 моль
2) Известно, что в растворе NaH2PO4 протоны в ядрах всех атомов составляют 55 % от общей массы раствора. Понимая, что раствор состоит из массы самого растворенного вещества и массы воды, примем, что m(NaH2PO4) = x г, а m(H2O) = y г.
Посчитаем массу протонов в каждом из веществ, примем их количество за 1 моль, а молярную массу одного протона за 1 г/моль:
а) mp+(NaH2PO4) = mp+(Na) + 2mp+(H) + mp+(P) + 4mp+(O) = 11+2+15+32 = 60 г
mp+(NaH2PO4) : m(NaH2PO4) = 60 : 120 = 1 : 2
Следовательно, в x г NaH2PO4 содержится 0,5x г протонов.
б) mp+(H2O)=2mp+(H) + mp+(O) = 2+8=10 г — протонов содержится в 1 моль воды (18г).
Следовательно, в y г H2O содержится 10y/18 г протонов.
Найдем общую массу протонов в растворе:
mp+(р-раNaH2PO4) = mр-ра(NaH2PO4) · ꞷp+ = 60 · 0,55 = 33 г
0,5x + 10/18y = 33 (г)
Составим систему уравнений:
Решая которую находим, что:
y = 54
x = 60 – 54 = 6
m(H2O) = 54 г
m(NaH2PO4) = 6 г
3) n(NaH2PO4)= 6/120 = 0,05 моль
Таким образом, мы можем записать, что количества веществ дигидрофосфата натрия и гидроксида натрия относятся друг к другу как:
n(NaH2PO4) : n(NaOH) = 0,05 : 0,15 = 1:3,
следовательно, щелочь в избытке и протекать будут следующие реакции:
NaH2PO4 + 2NaOH ⟶ Na3PO4 + 2H2O (I)
Na3PO4 + 3AgNO3 ⟶ Ag3PO4 + 3NaNO3 (II)
2NaOH + 2AgNO3 ⟶ Ag2O + H2O + 2NaNO3 (III)
Найдем ꞷ(AgNO3) в конечном растворе:
а) nост.(NaOH) = nисх.(NaOH) — n1(NaOH)
n1(NaOH) = 2n(NaH2PO4) = 2 · 0,05 = 0,1 моль
nост.(NaOH) = 0,15 – 0,1 = 0,05 моль
n(Ag3PO4) = n(Na3PO4) = n(NaH2PO4) = 0,05 моль
m(Ag3PO4) = 0,05 · 419 = 20,95 г
n(AgNO3) = 51/170 = 0,3 моль
nост.(NaOH) : n(AgNO3) = 0,05 : 0,3 =1:6 – следовательно, n(AgNO3) в избытке
n(Ag2O) = 0,5nост.(NaOH) = 0,025 моль
m(Ag2O) = 0,025 · 232 = 5,8 г
б) Найдем массу конечного раствора. Помним, что масса раствора – это всё, что смешали, минус образовавшиеся газы и осадки.
mр-ра кон.(AgNO3) = mр-ра(NaH2PO4) + mр-ра(NaOH) + m(AgNO3) – m(Ag3PO4) – m(Ag2O)
mр-ра кон.(AgNO3) = 60 + 40 + 51 – 20,95 – 5,8 = 124,25 г
в) nост.(AgNO3) = 0,3 – n2(AgNO3) – n3(AgNO3) = 0,3 – 3n2(Na3PO4) – n(NaOH) = 0,3 – 0,15 – 0,05 = 0,1 моль
mост. (AgNO3) = 0,1 · 170 = 17 (г)
ꞷ(AgNO3) = 17/124,25 · 100% = 13,68%
Ответ: ꞷ(AgNO3) = 13,68%
Задание №3
Олеум массой 114 г, в котором общее число электронов в 58 раз больше числа Авогадро, растворили в 26 г воды, затем добавили 23,2 г железной окалины и нагрели. Вычислите массовую долю соли в конечном растворе. Возможным образованием кислых солей пренебречь.
Решение
Ответ: ꞷ(Fe2(SO4)3) = 37,5%
Пояснение:
Для решения подобных задач удобнее считать, что олеум – это раствор SO3 в безводной H2SO4, т.е. воды в нем нет.
1) Для начала определим соотношение веществ в олеуме:
а) Пусть n(SO3) = x моль, а n(H2SO4) = y моль, тогда m(SO3) = 80x г, а m(H2SO4) = 98y г. По условию масса олеума составляет 114 г, следовательно: 80x + 98y = 114 г.
б) Найдем количество электронов в обоих веществах. При этом помним, что количество электронов = количеству протонов = порядковому номеру элемента.
n(e) в x моль SO3 равно: 16x + 3·8x = 40x моль;
n(e) в y моль H2SO4 равно: 2·1y + 16y + 4·8y = 50y моль;
По условию известно, что N(e) в 58 раз больше числа Авогадро (NA), вспоминаем формулу:
n(e) = N/NA , где N = 58NA , то есть: n(e) = 58NA/NA = 58 моль ⇒ 40x + 50y = 58 моль
в) Составим систему уравнений:
решая которую, получаем, что:
y = 1, x = 0,2,
n(H2SO4) = 1 моль, n(SO3) = 0,2 моль, следовательно, n(SO3) в недостатке.
Для того чтобы понять какое уравнение следует записать для второй реакции нам следует понять какой концентрации раствор серной кислоты мы получим в результате добавления олеума к воде. Если раствор серной кислоты получится разбавленным — железная окалина растворится в растворе серной кислоты с образованием двух солей (железа (II) и железа (III). Если же раствор серной кислоты окажется концентрированным, реакция железной окалины с серной кислотой приведет к образованию диоксида серы, сульфата железа(III) и воды.
При добавлении олеума к воде протекает следующая реакция:
SO3 + H2O ⟶ H2SO4 (I)
а) nI(H2SO4) = n(SO3) = 0,2 моль;
mI(H2SO4) = 98 + 0,2 = 19,6 г;
б) mр—ра(H2SO4) = m(олеума) + m(H2O);
mр—ра(H2SO4) = 114 + 26 = 140 г;
в) m(H2SO4) = mисх.(H2SO4) + mI(H2SO4);
m(H2SO4) = 98 + 19,6 = 117,6 г;
ꞷ(H2SO4) = 117,6/140 · 100% = 84% — следовательно, образовавшийся раствор кислоты можно считать концентрированным, а значит протекает следующая реакция:
2Fe3O4 + 10H2SO4 = 3Fe2(SO4)3 + SO2 + 10H2O (II)
Определим массовую долю соли в конечном растворе:
а) n(Fe3O4) = 23,2/232 = 0,1 моль;
б) n(Fe2(SO4)3) = 3/2n(Fe3O4) = 3/2 · 0,1 = 0,15 моль;
m(Fe2(SO4)3) = 0,15 · 400 = 60 г;
в) n(SO2) = 1/2n(Fe3O4) = 0,5 · 0,1 = 0,05 моль;
m(SO2) = 0,05 · 64 = 3,2 г;
г) mр—ра(Fe2(SO4)3) = mр—ра(H2SO4) + m(Fe3O4) – m(SO2);
mр—ра(Fe2(SO4)3) = 140 + 23,2 – 3,2 = 160 г;
д) ꞷ(Fe2(SO4)3) = 60/160 · 100% = 37,5%.
Задание №4
Смесь фосфида цинка и нитрида магния общей массой 65,7 г, в которой общее число электронов в 32 раза больше числа Авогадро, растворили в 730 г 30%-ной соляной кислоты. Вычислите массовую долю кислоты в конечном растворе.
Решение
Ответ: ꞷост.(HCl) = 10,18%
Пояснение:
Сразу запишем уравнения реакций:
Zn3P2 + 6HCl = 3ZnCl2 + 2PH3 (I)
Mg3N2 + 8HCl = 3MgCl2 + 2NH4Cl (II)
Для начала можем сразу определить n(HCl), исходя из условия:
а) m(HCl) = 730 · 0,3 = 219 г
n(HCl) = 219/36,5 = 6 моль
2) По условию масса смеси (Zn3P2 и Mg3N2) равна 65,7 г. Составим первое уравнение системы:
Пусть n(Zn3P2) = x моль, тогда m(Zn3P2) = 257x г
Пусть n(Mg3N2) = y моль, тогда m(Mg3N2) = 100y г
Следовательно: 257x + 100y = 65,7 г
3) Далее перейдем к количеству электронов. По условию: общее число электронов в смеси в 32 раза больше числа Авогадро – это можно записать так:
n(e) = N/NA , где N = 32NA , то есть: n(e) = 32NA/NA = 32 моль
Далее найдем количества электронов в веществах смеси отдельно. При этом помним, что количество электронов = количеству протонов = порядковому номеру элемента.
а) Ne(Zn3P2) = 30 ·3 + 15 · 2 = 120 электронов.
Если в 1 моль Zn3P2 содержится 120 · 1 = 120 моль электронов, то в x моль (Zn3P2) содержится 120x моль.
б) Ne(Mg3N2) = 12 · 3 + 7 · 2 = 50 электронов.
Если в 1 моль Mg3N2 содержится 50 · 1 = 50 моль электронов, то в y моль (Zn3P2) содержится 50y моль.
в) Составим второе уравнения системы: 120x + 50y = 32
Решим систему уравнений, найдем x и y:
x = 0,1 (моль) – n(Zn3P2);
y = 0,4 (моль) – n(Mg3N2);
Найдем массу оставшейся в растворе соляной кислоты (логично, что если она осталась, значит была в избытке):
а) n1(HCl) = 6n(Zn3P2) = 0,1 · 6 = 0,6 моль
n2(HCl) = 8n(Mg3N2) = 0,4 · 8 = 3,2 моль
nост.(HCl) = 6 — 3,2 — 0,6 = 2,2 моль
б) mост.(HCl) = 2,2 · 36,5 = 80,3 г
Найдем массу конечного раствора. Помним, что масса раствора – это всё, что смешали, минус образовавшиеся газы и осадки. Из газов у нас только PH3 (никакого NH3 там нет! Он прореагировал с соляной кислотой и перешел в NH4Cl! баллы не теряем).
а) mконечн. р-ра(HCl) = mсмеси + mисх. р-ра (HCl) – m(PH3)
б) n(PH3) = 2n(Zn3P2) = 0,2 моль
m(PH3) = 0,2 · 34 = 6,8 г
в) mконечн. р-ра(HCl) = 65,7 + 730 – 6,8 = 788,9 г
Найдем ꞷост.(HCl):
ꞷост.(HCl) = (80,3/788,9) · 100% = 10,18%
Ответ: ꞷост.(HCl) = 10,18% .
Задание №5
К 125 г раствора аммиака, в котором 56% от общей массы раствора составляет масса протонов в ядрах всех атомов, добавили 40,05 г хлорида алюминия. Через образовавшийся раствор пропустили сернистый газ, при этом прореагировало 2,24 л (н.у.) газа. Вычислите массовые доли солей в конечном растворе. Растворимостью газов в воде пренебречь.
Решение
Ответ: ꞷ(NH4Cl) = 32,5%; ꞷ(NH4HSO3) = 6,69%
Пояснение:
1) Для начала можем сразу записать следующую реакцию:
AlCl3 + 3NH3 + 3H2O = Al(OH)3 + 3NH4Cl (I)
2) Найдем количества веществ, данных в условии:
а) n(AlCl3) = 40,05/133,5 = 0,3 моль;
б) n(SO2) = 2,24/22,4 = 0,1 моль;
3) Далее мы не можем сразу сделать вывод о том какая реакция протекает:
SO2 + NH3 + H2O = NH4HSO3 либо SO2 + 2NH3 + H2O = (NH4)2SO3
Также возможен случай когда образуются сразу две соли одновременно.
Обратим внимание на соотношение реагентов (SO2 и NH3) в двух реакциях: 1:1 и 1:2 соответственно. Чтобы сделать вывод, какая из двух реакций протекает, необходимо провести дальнейшие расчеты.
4) В условии сказано, что масса раствора аммиака составляет 125 г. Раствор состоит из воды и аммиака.
Пусть n(NH3) = x моль, а n(H2O) = y моль. Тогда m(NH3) = 17x г, а m(H2O) = 18y г.
Составим первое уравнение системы: 17x + 18y = 125 г
5) Также известно, что массовая доля протонов в ядрах всех атомов составляет 56% от массы раствора. Найдем количество и массу протонов. При этом помним, что количество протонов = порядковому номеру элемента, а молярная масса одного протона составляет 1г/моль.
а) Np+(NH3) = 7 + 1 · 3 = 10 протонов;
Если в 1 моль NH3 содержится 10 · 1 = 10 моль протонов, то в x моль NH3 содержится 10x моль.
m p+(NH3) = 10x · 1 = 10x г;
б) Np+(H2O) = 1 · 2 + 8 = 10 протонов;
Если в 1 моль H2O содержится 10 · 1 = 10 моль протонов, то в y моль H2O содержится 10y моль.
mp+( H2O) = 10y · 1 = 10y г;
в) Составим второе уравнение системы:
0,56 = (10x + 10y)/125 ⇒ 10x + 10y = 70
Составим систему уравнений:
Решая которую находим, что:
y = 6
x = 1
Следовательно:
n(H2O) = y моль = 6 моль,
n(NH3) = x моль = 1 моль
7) Вернемся к действию 3) и сравним количества веществ, но для этого нам сначала необходимо найти количество оставшегося аммиака, так как его часть ушла на первую реакцию.
а) n1(NH3) = 3n(AlCl3) = 3 · 0,3 = 0,9 моль
nост.(NH3) = 1 – 0,9 = 0,1 моль;
б) n(SO2) : n(NH3) = 0,1 : 0,1 = 1 : 1 – следовательно, реакция протекает до образования кислой соли.
SO2 + NH3 + H2O = NH4HSO3 (II)

а) n(NH4Cl) = 3n(AlCl3) = 3 · 0,3 = 0,9 моль
m(NH4Cl) = 0,9 · 53,5 = 48,15 г;
б) n(NH4HSO3) = n(SO2) = 0,1 моль,
m(NH4HSO3) = 0,1 · 99 = 9,9 г;
9) Напишем уравнение массы конечного раствора. Помним, что масса раствора – это всё, что смешали, минус образовавшиеся газы и осадки.
mконечн. р-ра = mр-ра(NH3) + m(AlCl3) – m(Al(OH)3) + m(SO2)
Вычислим недостающие данные:
а) n(Al(OH)3) = n(AlCl3) = 0,3 моль
m(Al(OH)3) = 0,3 · 78 = 23,4 г;
б) m(SO2) = 0,1 · 64 = 6,4 г;
в) Найдем массу конечного раствора:
mконечн. р-ра = 125 + 40,05 – 23,4 + 6,4 = 148,05 г
Найдем массовую долей солей в образовавшемся растворе:
ꞷ(NH4Cl) = (48,15/148,05) · 100% = 32,5% ;
ꞷ(NH4HSO3) = (9,9/148,05) · 100% = 6,69%
Ответ: ꞷ(NH4Cl) = 32,5%; ꞷ(NH4HSO3) = 6,69% .
Задание №6
Пластинку, сделанную из сплава цинка со свинцом, в которой общее число электронов в атомах металлов в 56 раз больше числа Авогадро, поместили в 100 г раствора хлорида олова(II). После того как хлорид олова(II) прореагировал полностью, пластинку с выделившимся на ней металлом извлекли из раствора. В результате общее число электронов в атомах трёх металлов пластинки увеличилось на 12,5% по сравнению с числом электронов в атомах металлов исходной пластинки. К оставшемуся раствору добавили 480 г 20%-ного раствора гидроксида натрия. Вычислите массовую долю щёлочи в конечном растворе. Процессом гидролиза солей пренебречь.
Решение
Ответ: ꞷост.(NaOH) = 7,13%
Пояснение:
1) Для начала можно записать уравнение первой реакции (понятно, что реагировать из двух металлов пластинки будет цинк, так как он активнее):
Zn + SnCl2 = ZnCl2 + Sn (I)
Уравнение второй реакции сразу записать нельзя, так как она может протекать по двум направлениям:
ZnCl2 + 4NaOH = Na2[Zn(OH)4] + 2NaCl либо ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl
Обратим внимание на соотношение реагентов: 1:4 и 1:2 — и на основании дальнейших расчетов сделаем вывод о том, какая реакция протекает.
По условию, общее число электронов пластинки в 56 раз больше числа Авогадро. Записать это можно следующим образом:
n(e) = N/NA , где N = 56NA , то есть: n(e) = 56NA/NA = 56 моль, то есть общее количество электронов в Zn-Pb пластинке равно 56 моль.
Пусть n(Zn) = x моль, а n(Pb) = y моль. Помним, что количество электронов в атоме химического элемента точно такое же, как и количество протонов и численно равно порядковому номеру элемента.
В таком случае, количество вещества электронов в металлическом цинке будет равно:
ne(Zn) = N(e—)·n(Zn) = 30x моль,
а количество вещества электронов в металлическом свинце будет равно:
ne(Pb) = 82y моль
Тогда, суммарное количество вещества электронов пластинки из цинка и свинца будет равно:
ne(Zn/Pb пластинки) = (30x + 82y) моль,
в то же время мы знаем, что ne(Zn/Pb пластинки) = 56 моль, отсюда следует первое уравнение системы:
30x + 82y = 56
Известно, что общее число электронов в пластинке из трёх металлов на 12,5% по сравнению больше по сравнению с числом электронов в атомах металлов исходной пластинки из двух металлов.
Тогда, изменение количества вещества электронов пластинки после реакции будет равно:
Δne(пластинки) =56 · 0,125 = 7,
а общее количество электронов в пластинке из трех металлов (после реакции):
ne(пластинки Zn-Pb-Sn) = 56 + 7 = 63 – общее количество электронов пластинки после реакции.
Изменение количества электронов пластинки произошло из-за того, что часть цинка с пластинки ушла в раствор, а часть олова из раствора соли выделилась на пластинке.
Количество электронов в исходной пластинке:
Ne исходной пл. = Ne(Pb) + Ne исх.(Zn),
а количество вещества электронов в исходной пластинке:
ne исходной пл. = ne(Pb) + ne исх.(Zn),
Количество электронов в конечной пластинке:
Ne конечной пл. = Ne(Pb) + Ne исх.(Zn) – Ne прореаг.(Zn) + Ne(Sn),
а количество вещества электронов в конечной пластинке:
ne конечной пл. = ne(Pb) + ne исх.(Zn) – ne прореаг.(Zn) + Ne(Sn),
Тогда, разница количества вещества электронов может быть записано как:
Δne(пластинки) = ne конечной пл. — ne исходной пл. = (ne(Pb) + ne исх.(Zn) – ne прореаг.(Zn) + Ne(Sn)) — (ne(Pb) + ne исх.(Zn)) = ne(Pb) + ne исх.(Zn) – ne прореаг.(Zn) + Ne(Sn) — ne(Pb) — ne исх.(Zn) = — ne прореаг.(Zn) + ne(Sn) = ne(Sn) — ne прореаг.(Zn)
т.е. Δne(пластинки) = ne(Sn) — ne прореаг.(Zn)
Из уравнения реакции I можно сделать вывод, что количество вещества осевшего Sn равно количеству прореагировавшего Zn. Пусть n(Sn) = nпрореаг.(Zn) = z моль.
Тогда количество вещества электронов в образовавшемся олове будет равно:
ne(Sn) = 50z моль,
а количество вещества электронов в прореагировавшем цинке будет равно:
ne прореаг.(Zn) = 30z моль.
Таким образом,
Δne(пластинки) = ne(Sn) — ne прореаг.(Zn) = 50z — 30z = 20z моль,
в то же время:
Δne(пластинки) = 7 моль,
следовательно:
7 = 20z
z = 0,35,
а n(Sn) = nпрореаг.(Zn) = n1(ZnCl2) = 0,35 моль,
Перейдем теперь к расчету соотношения щелочи и хлорида цинка.
а) mисх.(NaOH) = 480 · 0,2 = 96 г
nисх.(NaOH) = 96/40 = 2,4 моль;
б) nисх.(NaOH)/n(ZnCl2)= 2,4/0,35 = 6,9
Следовательно, можно сделать вывод, что NaOH находится в избытке, поэтому реакция будет протекать по пути комплексообразования:
ZnCl2 + 4NaOH = Na2[Zn(OH)4] + 2NaCl (II)
Рассчитаем количество вещества и массу непрореагировавшего гидроксида натрия:
а) nпрореаг.(NaOH) = 4n(ZnCl2) = 0,35 · 4 = 1,4 моль
nост.(NaOH) = 2,4 – 1,4 = 1 моль;
б) mост.(NaOH) = 1 · 40 = 40 г
Напишем выражение массы конечного раствора:
mконечн. р-ра = mр-ра(SnCl2) + mушедш.(Zn) – mосевш.(Sn) + mр-ра(NaOH)
mконечн. р-ра = 100 + (65 · 0,35) – (119 · 0,35) + 480 = 561,1 г
Рассчитаем массовую долю щелочи в конечном растворе:
ꞷост.(NaOH)= (40/561,1) · 100% = 7,13%
Ответ: ꞷост.(NaOH) = 7,13%
Задание №7
Смесь фосфида и нитрида лития, в которой масса протонов в ядрах всех атомов составляет 46% от общей массы смеси, растворили в 200 г 36,5%-ной соляной кислоты. При этом выделилось 5,6 л (н.у.) газа. Вычислите массовую долю кислоты в конечном растворе.
Решение
Ответ: ꞷост.(HCl) = 7,766%
Можем сразу записать уравнения реакций:
Li3P + 3HCl = 3LiCl + PH3 (I)
Li3N + 4HCl = 3LiCl + NH4Cl (II)
Найдем количество вещества и массу фосфина:
n(PH3) = 5,6/22,4 = 0,25 моль
m(PH3) = 0,25 · 34 = 8,5 г
По условию, масса протонов в ядрах всех атомов составляет 46%. Напишем уравнение:
ꞷp+ = (mp+(Li3N + Li3P)/ m(Li3N + Li3P)
Найдем недостающие данные.
а) n(Li3P) = n(PH3) = 0,25 моль
m(Li3P) = 0,25 · 52 = 13 г;
б) Пусть n(Li3N) = x моль, тогда m(Li3N) = 35x г
в) Найдем количество и массу протонов в смеси. При этом помним, что количество протонов = порядковому номеру элемента, а молярная масса одного протона составляет 1г/моль.
np+ = Np+ · n(в-ва)
Np+(Li3P) = 3 · 3 + 15 = 24
Np+(Li3N) = 3 · 3 + 7 = 16
np+(Li3P) = 24 · 0,25 = 6 моль, mp+(Li3P) = 6 г;
np+(Li3N) = 16x моль, mp+(Li3N) = 16x г;
Решим уравнение:
0,46 = (6 + 16x)/(35x + 13) ⇒ 16x + 6 = 16,1x + 5,98 ⇒ 0,02 = 0,1x ⇒ x = 0,2 моль — n(Li3N).
Найдем сразу массу нитрида лития: m(Li3N) = 35 · 0,2 = 7 г
Найдем массу и количество оставшейся соляной кислоты:
а) m(HCl) = 200 · 0,365 = 73 г
n(HCl) = 73/36,5 = 2 моль;
б) n1(HCl) = 3n(Li3P) = 3 · 0,25 = 0,75 моль
n2(HCl) = 4n(Li3N) = 4 · 0,2 = 0,8 моль
nобщ.(HCl) = 0,75 + 0,8 = 1,55 моль;
в) nост.(HCl) = 2 – 1,55 = 0,45 моль
mост.(HCl) = 0,45 · 36,5 = 16,425 г
Найдем массу раствора. Помним, что масса раствора – это всё, что смешали, минус образовавшиеся газы и осадки:
mконечн. р-ра = m(Li3N) + m(Li3P) + mр-ра(HCl) – m(PH3)
mконечн. р-ра = 13 + 7 + 200 – 8,5 = 211,5 г
Найдем ꞷост.(HCl):
ꞷост.(HCl) = (16,425/211,5) · 100% = 7,766%
Ответ: ꞷост.(HCl) = 7,766%
Задание №8
В 800 г раствора нитрата серебра, в котором общее число атомов в 110 раз больше числа Авогадро, внесли 16 г порошка меди. К образовавшемуся раствору добавили 200 г 30%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в конечном растворе.
Решение
Ответ: ꞷост.(NaOH) = 2,27%
Пояснение:
Напишем уравнения реакции:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag (I)
Cu(NO3)2 + 2NaOH = Cu(OH)2 + 2NaNO3 (II)
Найдем количества веществ, данных в условии:
а) n(Cu) = 16/64 = 0,25 моль
б) m(NaOH) = 200 · 0,3 = 60 г
n(NaOH) = 60/40 = 1,5 моль
По условию, общее число атомов в 110 раз больше числа Авогадро, это можно записать так:
n(атомов) = N/NA , где N = 110NA , то есть: n(ат.) = 110NA/NA = 110 моль, то есть общее количество атомов равно 110 моль.
Понимаем, что в задаче говорится именно о количестве атомов – это значит, что 1 молекула H2O содержит в сумме 3 атома: 2 атома водорода и 1 атом кислорода.
n(ат.) = n(в-ва) · N
а) Обозначим n(H2O) как x моль, тогда m(H2O) = 18x г.
Если в 1 моль H2O mатомов = (2 ·1 +1) · 1 = 3г, то в x моль H2O mатомов = (2 · 1 + 1) · x = 3x г;
б) Обозначим n(AgNO3) как y моль, тогда m(AgNO3) = 170y г
Если в 1 моль AgNO3 mатомов = (1 + 1 + 3) · 1 = 5г, то в y моль AgNO3 mатомов = (1 + 1 + 3) · y = 5y г.
Составим систему уравнений:
y = 1 моль — n(AgNO3)
x = (110 – 5)/3 = 35 моль – n(H2O)
По реакции I, n(AgNO3) – в избытке, так как n1(AgNO3) = 2n(Cu) = 0,25 · 2 = 0,5 моль
nост.(AgNO3) = 1 – 0,5 = 0,5 моль
Следовательно, будет протекать следующая реакция:
2AgNO3 + 2NaOH = Ag2O + 2NaNO3 + H2O (III)
Найдем количество вещества и массу оставшегося NaOH:
а) n2(NaOH) = 2n(Cu(NO3)2) = 2n1(Cu) = 0,5 моль
n3(NaOH) = n(AgNO3) = 0,5 моль
nост.(NaOH) = 1,5 – 0,5 – 0,5 = 0,5 моль;
б) mост.(NaOH) = 0,5 · 40 = 20 г;
Составим уравнение массы конечного раствора. Помним, что масса раствора – это всё, что смешали, минус образовавшиеся газы и осадки:
mконеч. р-ра = mр-ра(AgNO3) + m(Cu) – m(Ag) + mр-ра(NaOH) – m(Cu(OH)2) – m(Ag2O)
Найдем недостающие данные:
а) n(Ag) = 2n(Cu) = 0,5 моль
m(Ag) = 108 · 0,5 = 54 г;
б) n2(Cu(OH)2) = n(Cu(NO3)2) = 0,25 моль
m(Cu(OH)2) = 0,25 · 98 = 24,5 г;
в) n(Ag2O) = 0,5n3(AgNO3) = 0,5 · 0,5 = 0,25моль
m(Ag2O) = 0,25 · 232 = 58 г;
г) mконеч. р-ра = 800 + 16 – 54 + 200 – 24,5 – 58 = 879,5 г
Найдем ꞷост.(NaOH):
ꞷост.(NaOH) = (20/879,5) · 100% = 2,27%
Ответ: ꞷост.(NaOH) = 2,27%
Задание №9
Смесь нитрата железа(II) и нитрата железа(III), в которой масса протонов в ядрах всех атомов составляет 49,07% от общей массы смеси, прокалили до постоянной массы. Твёрдый остаток растворили в избытке соляной кислоты. При этом образовалось 299 г раствора с массовой долей соли 25%. Вычислите массу исходной смеси нитратов.
Решение
Ответ: mсмеси = 98,92 г
Пояснение:
Запишем уравнения реакций:
4Fe(NO3)2 = 2Fe2O3 + 8NO2 + O2 (I)
4Fe(NO3)3 = 2Fe2O3 + 12NO2 + 3O2 (II)
Fe2O3 + 6HCl = 2FeCl3 + 3H2O (III)
Найдем массу и количество FeCl3. Так как смесь прокалили до постоянной массы, разложение полное и твердый остаток составляет только хлорид железа (III).
m(FeCl3) = 299 · 0,25 = 74,75 г
n(FeCl3) = 74,75/162,5 = 0,46 моль
По условию масса протонов составляет 0,4907 от общей массы смеси, по сути, та же массовая доля протонов. Составим для нее уравнение:
0,4907 = (mp+(Fe(NO3)2 + Fe(NO3)3))/m(Fe(NO3)2 + Fe(NO3)3)
а) Помним, что молярная масса одного протона составляет 1г/моль. Найдем массу протонов в ядрах смеси.
а) Обозначим n(Fe(NO3)3) за x моль, тогда m(Fe(NO3)3) = 242x г. А n(Fe(NO3)2) за y моль, тогда m(Fe(NO3)2) = 180y г.
б) np+ = Np+ · n(в-ва)
Np+(Fe(NO3)3) = 26 + 21 + 72 = 119; Np+(Fe(NO3)2) = 26 + 14 + 48 = 88;
mp+(Fe(NO3)3) = 119x г; mp+(Fe(NO3)2) = 88y г;
в) Составим 1ое уравнение системы:
0,4907 = (119x + 88y)/(242x + 180y) ⇒ 0,4907(242x + 180y) = 119x + 88y
Обратим внимание, что FeCl3 образуется из Fe2O3, который образуется после разложения двух нитратов.
n(Fe2O3) = 2/4n(Fe(NO3)3) + 2/4n(Fe(NO3)2) = 0,5(n(Fe(NO3)3) + n(Fe(NO3)2)) = 0,5(x + y) – моль;
n(FeCl3) = 2n(Fe2O3) = 2 · 0,5(x + y) = x + y = 0,46 моль – 2о-е уравнение системы.
Решим систему уравнений:
y = 0,2, т.е. n(Fe(NO3)2) = 0,2 моль,
x = 0,26, т.е. n(Fe(NO3)3) = 0,26 моль
Найдем массу смеси:
m(Fe(NO3)3) + m(Fe(NO3)2) = 242 · 0,26 + 180 · 0,2 = 62,92 + 36 = 98,92 г
Ответ: mсмеси = 98,92 г
Задание №10
Смесь нитрата натрия и нитрата серебра общей массой 42,5 г, в которой масса протонов в ядрах всех атомов составляет 48% от массы смеси, прокалили до постоянной массы. Выделившуюся смесь газов пропустили через 10 мл воды. Вычислите массовую долю растворённого вещества в образовавшемся растворе.
Решение
Ответ: ꞷ(HNO3) = 40,9%
Пояснение:
2NaNO3 = 2NaNO2 + O2 (I)
2AgNO3 = 2Ag + 2NO2 + O2 (II)
4NO2 + O2 + 2H2O = 4HNO3 (III)
1) По условию, масса смеси составляет 42,5 г, составим 1ое уравнение системы:
Пусть n(NaNO3) = x моль, тогда m(NaNO3) = 85x г;
Пусть n(AgNO3) = y моль, тогда m(AgNO3) = 170y г;
Составим первое уравнение системы: 85x + 170y = 42,5 г
2) Найдем количество и массу протонов в ядрах смеси. При этом помним, что для атома химического элемента количество протонов совпадает с порядковым номером элемента, а молярная масса одного протона составляет 1г/моль.
а) np+ = Np+ · n(в-ва)
Np+(NaNO3) = 11 + 7 + 24 = 42
np+(NaNO3) = 42x моль; mp+(NaNO3) = 42x · 1 = 42x г
Np+(AgNO3) = 47 + 7 + 24 = 78
np+(AgNO3) = 78y моль; mp+(AgNO3) = 78y · 1 = 78y г
б) Составим второе уравнение системы:
0,48 = (mp+(NaNO3 + AgNO3))/m(NaNO3 + AgNO3)
0,48 = (42x + 78y)/(85x + 170y) ⇒ 3y = x
3) Составим и решим систему уравнений:
y = 0,1, т.е. n(AgNO3) = 0,1 моль,
x = 0,3, т.е. n(NaNO3) = 0,3 моль
4) Сравним количества NO2 и O2 в реакции (III):
а) nобщ.(O2) = 0,5n(NaNO3) + 0,5 n(AgNO3) = 0,15 + 0,05 = 0,2 моль
n(NO2) = n(AgNO3) = 0,1 моль;
б) n(NO2)/4 < n(O2)/1 , так как 0,025 < 0,2 – следовательно n(NO2) в недостатке, расчет будем вести по нему.
5) Найдем n(O2), которое израсходовалось в реакции.
n(O2) = 1/4n(NO2) = 1/4 ·0,1 = 0,025 моль
m(O2) = 0,025 · 32 = 0,8 г;
6) Найдем количество и массу HNO3:
n(HNO3) = n(NO2) = 0,1 моль
m(HNO3) = 0,1 · 63 = 6,3 г;
7) Найдем массу раствора:
mконеч. р-ра = m(NO2) + mистр.(O2) + m(H2O)
а) Найдем недостающие данные:
m(NO2) = 0,1 · 46 = 4,6 г
m(H2O) = V(H2O) · ρ(H2O) = 10 · 1 = 10г;
б) mконеч. р-ра = 4,6 + 0,8 + 10 = 15,4 г;

ꞷ(HNO3) = (6,3/15,4) · 100% = 40,9%
Ответ: ꞷ(HNO3) = 40,9%
Задание №11
Смесь нитрата магния и нитрата серебра, в которой масса протонов в ядрах всех атомов составляет 48,32% от общей массы смеси, прокалили до постоянной массы. Выделившуюся смесь газов пропустили через 800 мл воды. При этом объём непоглотившегося газа составил 13,44 л (н.у.). Вычислите массовую долю растворённого вещества в образовавшемся растворе.
Решение
Ответ: ꞷ(HNO3) = 48,1 %
Пояснение:
2Mg(NO3)2 = 2MgO + 4NO2 + O2
2AgNO3 = 2Ag + 2NO2 + O2
4NO2 + O2 + 2H2O = 4HNO3
1) По условию, масса протонов в ядрах всех атомов составляет 46%. Напишем уравнение:
ꞷp+ = (mp+(Mg(NO3)2 + AgNO3)/m(Mg(NO3)2 + AgNO3)
Найдем недостающие данные.
Пусть n(Mg(NO3)2) = x моль, тогда m(Mg(NO3)2) = 148x г
Пусть n(AgNO3) = y моль, тогда m(AgNO3) = 170y г;
2) Найдем количество и массу протонов в смеси. При этом помним, что количество протонов = порядковому номеру элемента, а молярная масса одного протона составляет 1г/моль.
а) np+ = Np+ · n(в-ва)
np+(Mg(NO3)2) = (12 + 14 + 48)x = 74x моль
np+(AgNO3) = (47 + 7 + 24)y = 78y моль
б) mp+ = np+ · 1г/моль
mp+(Mg(NO3)2) = 74x г;
mp+(AgNO3) = 78y г
3) Решим уравнение:
0,4832 = (74x + 78y)/(148x + 170y) ⇒ 2,49x = 4,14y ⇒ x = 1,66y
4) Найдем и сравним количества веществ в 3 реакции, при этом примем x = 1,66y:
а) nобщ.(NO2) = 2n(Mg(NO3)2) + n(AgNO3) = 2x + y = 4,32y моль
nобщ.(O2) = 0,5n(Mg(NO3)2) + 0,5n(AgNO3) = 0,5(x+y) = 1,33y моль
б)n(NO2)/4 < n(O2)/1, так как 1,08y < 1,32y – следовательно, n(NO2) в недостатке, расчет будем вести по нему.
P.S. А вообще можно было бы избежать этих всех расчетов и просто оценить избыток/недостаток по соотношению коэффициентов в реакции. Обратим внимание, что в 3й реакции соотношение
n(NO2) : n(O2) = 4 : 1
В 1о-й реакции соотношение n(NO2) : n(O2) такое же (4 : 1) – это значит, что вещества истратились полностью.
Во 2о-й реакции соотношение n(NO2) : n(O2) = 2 : 1 (или 4 : 2) – это значит, что NO2 истратился полностью, а часть O2 нет, соответственно n(O2) – в избытке.
nост.(O2) = 13,44/22,4 = 0,6 моль
Составим уравнение для nобщ.(O2):
nобщ.(O2) = nреаг.(О2) + nост.(О2)
nреаг.(О2) = 1/4n(NO2) = (2x + y)/4 моль
0,5x + 0,5y = (2x + y)/4 + 0,6 ⇒ y = 2,4 моль – n(AgNO3).
x = 1,66 · 2,4 = 3,98 = 4 моль – n(Mg(NO3)2);
Найдем количество и массу HNO3:
n(HNO3) = n(NO2) = 2 · 4 + 2,4 = 10,4 моль
m(HNO3) = 10,4 · 63 = 655,2 г;
Найдем массу раствора:
mконеч. р-ра = m(NO2) + mистр.(O2) + m(H2O)
а) Найдем недостающие данные:
m(NO2) = 10,4 · 46 = 478,4 г
m(H2O) = V(H2O) · ρ(H2O) = 800 · 1 = 800г;
nреаг.(О2) = 1/4n(NO2) = 2,6 моль
mреаг.(О2) = 2,6 · 32 = 83,2 г
б) mконеч. р-ра = 478,4 + 83,2 + 800 = 1361,6 г;

ꞷ(HNO3) = (655,2/1361,6) · 100% = 48,1%
Ответ: ꞷ(HNO3) = 48,1 %
Задание №12
К 112 г 30%-ного раствора гидроксида калия добавили 13 г цинка. После окончания реакции к образовавшемуся раствору прилили 245 г 20%-ного раствора серной кислоты. Известно, что в условиях, при которых была проведена реакция, растворимость сульфата цинка составляет 57,7 г на 100 г воды, растворимость сульфата калия – 12,0 г на 100 г воды. Вычислите массу выпавшего осадка.
Решение
Ответ: m(K2SO4) = 18 г
Пояснение:
Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2 (I)
1) Найдем количества веществ, данных в условии.
а) m(KOH) = 112 · 0,3 = 33,6 г
n(KOH) = 33,6 / 56 = 0,6 моль
б) n(Zn) = 13 / 65 = 0,2 моль
2) Сравним количества реагентов:
n(Zn)/1 < n(KOH)/2, следовательно n(KOH) – в избытке.
nост.(KOH) = 0,6 – n1(KOH) = 0,6 – 2n(Zn) = 0,6 – 0,4 = 0,2 моль
Дальше к полученному раствору добавляют серную кислоту. Обратим внимание, что протекать у нас могут 2 реакции (так как в растворе осталась и комплексная соль, и щелочь). Однако в первую очередь будет протекать реакция нейтрализации, так как ее скорость выше.
2KOH + H2SO4 = K2SO4 + 2H2O (II)
3) Найдем n(H2SO4):
m(H2SO4) = 245 · 0,2 = 49 г
n(H2SO4) = 49 / 98 = 0,5 моль
4) Сравним количества веществ в реакции 2:
n(KOH)/2 < n(H2SO4)/1 , следовательно n(H2SO4) – в избытке. Найдем nост.(H2SO4):
nост.(H2SO4) = 0,5 – n2(H2SO4) = 0,5 – 1/2n2(KOH) = 0,5 – 0,1 = 0,4 моль
5) Сравним соотношение n(K2[Zn(OH)4]) и n(H2SO4):
n1(K2[Zn(OH)4]) = n(Zn) = 0,2 моль
n(H2SO4)/ n(K2[Zn(OH)4]) = 0,4/0,2 = 2/1– следовательно, n(K2[Zn(OH)4]) : n(H2SO4) = 1 : 2
Значит будет протекать следующая реакция:
K2[Zn(OH)4] + 2H2SO4 = K2SO4 + ZnSO4 + 4H2O (III)
6) В условии просят найти массу выпавшего осадка. Так как в «привычный» осадок в уравнениях реакций ничего не выпадает, а в условии дана растворимость двух солей, приходим к выводу, что в осадок будет выпадать одна или две соли (нужно проверить). Здесь необходимо вспомнить понятие о насыщенном растворе. После того, как содержание соли в растворе превышает значение её растворимости при данной температуре, часть соли кристаллизуется и выпадает в осадок.
7) Найдем количества и массу двух солей:
а) n(K2SO4) = n2(K2SO4) + n3(K2SO4) = 1/2n2(KOH) + n(K2[Zn(OH)4]) = 0,1 + 0,2 = 0,3 моль
m(K2SO4) = 0,3 · 174 = 52,2 г
б) n(ZnSO4) = n(K2[Zn(OH)4]) = 0,2 моль
m(ZnSO4) = 0,2 · 161 = 32,2 г

m(H2O) = mконеч. р—ра – m(K2SO4) –m(ZnSO4)
а) mконеч. р—ра = mр—ра(KOH) + m(Zn) – m(H2) + mр—ра(H2SO4)
Найдем недостающие данные:
n(H2) = n(Zn) = 0,2 моль
m(H2) = 0,2 · 2 = 0,4 г
mконеч. р-ра = 112 + 13 – 0,4 + 245 = 369,6 г
б) m(H2O) = 369,6 – 52,2 – 32,2 = 285,2 г
9) Проанализируем растворимость для двух солей. Составим пропорции:
а) для K2SO4: если в 100 г воды растворяется 12 г соли, то в 285,2 г воды растворяется x г соли:
x = (285,2 · 12)/100 = 34,2 г соли способно раствориться. По расчетам в задаче образовалось 52,2 г соли.
52,2 – 34,2 = 18 г – K2SO4 выпадет в осадок.
б) для ZnSO4: если в 100 г воды растворяется 57,7 г соли, то в 285,2 г воды растворяется y г соли:
y = (285,2 · 57,7)/100 = 164,56 г соли способно раствориться. По расчетам в задаче образовалось 32,2г соли. Масса образовавшейся соли не превышает растворимость, поэтому ZnSO4 в осадок не выпадает.
Ответ: m(K2SO4) = 18 г
Задание №13
Алюминий массой 8,1 г сплавили с 9,6 г серы. Полученную смесь растворили в 96 г насыщенного раствора гидроксида натрия. Вычислите массу выпавшего осадка. Растворимость гидроксида натрия составляет 100 г на 100 г воды, растворимость сульфида натрия в условиях реакции – 20,6 г на 100 г воды.
Решение
Ответ: m(Na2S) = 14,62 г
Пояснение:
1) Для начала сравним количества веществ в 1ой реакции и определим, какое из них находится в избытке.
а) n(Al) = 8,1 / 27 = 0,3 моль
n(S) = 9,6 / 32 = 0,3 моль
б)n(S)/3 < n(Al)/2 , так как 0, 1 < 0,15 – следовательно, n(Al) – избыток, n(S) – недостаток.
Сразу определим nост.(Al) и nобр.(Al2S3)
nост.(Al) = 0,3 – 2/3n(S) = 0,3 – 0,2 = 0,1 моль;
nобр.(Al2S3) = 1/3n(S) = 1/3 · 0,3 = 0,1 моль;
2) Полученную смесь веществ составляют 0,1 моль Al и 0,1 моль Al2S3. Запишем реакции:
Al2S3 + 8NaOH = 2Na[Al(OH)4] + 3Na2S (II)
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2 (III)
3) Найдем количество NaOH. В условии дана его растворимость, а также сказано о том, что раствор насыщенный. По растворимости найдем массу NaOH.
ρ(NaOH) = 100 г на 100 г воды, можно записать это в расчете на массу раствора, то есть 100 г (NaOH) на 200 г раствора NaOH. Составим пропорцию:
Если в 200 г насыщенного раствора растворяется 100 г NaOH, то в 96 г насыщенного раствора растворяется x г NaOH.
x = (100 · 96) / 200 = 48 г – m(NaOH)
n(NaOH) = 48 / 40 = 1,2 моль
4) Найдем nост.(NaOH):
nост.(NaOH) = 1,2 – n2(NaOH) – n3(NaOH) = 1,2 – 8n(Al2S3) – n3(Al) = 1,2 – 0,8 – 0,1 = 0,3 моль
mост.(NaOH) = 40 · 0,3 = 12 г
5) В условии просят найти массу выпавшего осадка. Так как в «привычный» осадок в уравнениях реакций ничего не выпадает, а в условии дана растворимость NaOH и Na2S, приходим к выводу, что в осадок будут выпадать оба вещества или одно из них. Также необходимо вспомнить понятие о насыщенном растворе. После того, как содержание соли в растворе превышает значение её растворимости при данной температуре, часть соли кристаллизуется и выпадает в осадок.
6) Найдем m(Na2S):
n(Na2S) = 3n(Al2S3) = 0,1 · 3 = 0,3 моль
m(Na2S) = 0,3 · 78 = 23,4 г
7) Так как в условии растворимость дается на 100 г воды, необходимо найти массу воды в конечном растворе.
m(H2O) = mконеч. р-ра – m(Na2S) – m(Na[Al(OH)4]) – mост.(NaOH)
а) mконеч. р-ра = m(Al) + m(S) – m(H2) + mр-ра(NaOH)
Найдем недостающие данные:
n(H2) = 3/2n3(Al) = 3/2 · 0,1 = 0,15 моль
m(H2) = 0,15 · 2 = 0,3 г
n(Na[Al(OH)4]) = 2n(Al2S3) + n(A
mконеч. р-ра = 8,1 + 9,6 – 0,3 + 96 = 113,4 г
б) m(H2O) = 113, 4 – 23,4 – 35,4 – 12 = 42,6 г

а) для Na2S: если в 100 г воды растворяется 20,6 г соли, то в 42,6 г воды растворяется x г соли:
x = (20,6 · 42,6)/100 = 8,78 г соли способно раствориться. По расчетам в задаче образовалось 23,4 г соли.
23,4 – 8,78 = 14,62 г – K2SO4 выпадет в осадок.
б) для NaOH: если в 100 г воды растворяется 100 г гидроксида , то в 42,6 г воды растворяется y г NaOH:
y = (42,6 ·100 )/100 = 42,6 г соли способно раствориться. По расчетам в задаче образовалось 12 г NaOH. Масса образовавшегося NaOH не превышает растворимость, поэтому NaOH в осадок не выпадает.
Ответ: m(Na2S) = 14,62 г
Задание №14
Кристаллогидрат нитрата железа(II), в котором массовая доля протонов в ядрах всех атомов составляет 52,05%, прокалили до постоянной массы. Твёрдый остаток растворили в 300 г йодоводородной кислоты, взятой в избытке. Через образовавшуюся смесь пропустили сернистый газ, при этом прореагировало 2,24 л (н.у.) газа. Вычислите массовую долю соли йодоводородной кислоты в конечном растворе и массу исходного кристаллогидрата.
Решение
Ответ: m(Fe(NO3)2 ∙ 9H2O) = 68,4 г; ꞷ(FeI2) = 19,23%
Пояснение:
Записать разложение кристаллогидрата сразу мы не можем, так как нам неизвестно соотношение безводной соли и воды в кристаллогидрате, но мы можем записать его в общем виде для начала. Важно(!) в конце всех расчетов не забыть записать правильное уравнение:
4Fe(NO3)2 ∙ nH2O = 2Fe2O3 + 8NO2 + O2 + 4nH2O (I)
Дальше можем записать остальные уравнения:
Fe2O3 + 6HI = 2FeI2 + I2 + 3H2O (II)
SO2 + I2 + 2H2O = H2SO4 + 2HI (III)
Можем сразу найти n(SO2):
n(SO2) = 2,24 / 22,4 = 0,1 моль
Далее найдем n(I2), n(Fe2O3), так как они взаимосвязаны:
n(I2) = n(SO2) = 0,1 моль
n(Fe2O3) = n(I2) = 0,1 моль
По количеству оксида железа (III) найдем количество безводной соли в кристаллогидрате и заодно ее массу:
n(Fe(NO3)2) = 4/2n(Fe2O3) = 2 · 0,1 = 0,2 моль
m(Fe(NO3)2) = 0,2 · 180 = 36 г
Известно, что массовая доля протонов в ядрах всех атомов кристаллогидрата составляет 52,05%. Составим уравнение для неё:
ꞷp+ = mp+(Fe(NO3)2) · mp+(H2O) / m(Fe(NO3)2 ∙ nH2O)
Пусть n(H2O) = x моль, тогда m(H2O) = 18x г
Найдем количество и массу протонов в ядрах кристаллогидрата. При этом помним, что количество протонов = порядковому номеру элемента, а молярная масса одного протона составляет 1г/моль.
а) np+ = Np+ ∙ n(в-ва)
np+(Fe(NO3)2) = (26 + 14 + 48) · 0,2 = 17,6 моль
np+(H2O) = (2 + 8)x = 10x моль
б) mp+ = np+ · 1г/моль
mp+( Fe(NO3)2) = 17,6 г;
mp+(H2O) = 10x г
Решим уравнение:
0, 5205 = (17,6 + 10x) / (36 + 18x)
18,738 + 9,369x = 17,6 + 10x
1,138 = 0,631x
x = 1,8 моль – n(H2O) в кристаллогидрате, m(H2O) = 1,8 · 18 = 32,4 г
Найдем общую массу кристаллогидрата, а затем его молярную массу, так как зная молярную массу можно вывести его формулу. При этом помним, что количество кристаллогидрата равно количеству его безводной соли, так как в 1 формульной единице кристаллогидрата содержится 1 формульная единица безводной соли.
m(Fe(NO3)2∙nH2O) = m(Fe(NO3)2) + m(H2O) = 36 + 32,4 = 68,4 г
M(Fe(NO3)2∙nH2O) = m/n
M(Fe(NO3)2∙nH2O) = 68,4/0,2 = 342 (г/моль).
Учитывая, что M(Fe(NO3)2∙nH2O) = M(Fe(NO3)2) + M(H2O) – найдем молярную массу воды, а из нее и количество молекул воды в кристаллогидрате.
M(H2O) = 342 – 180 = 162 (г/моль), N(H2O) = 162/18 = 9 молекул воды содержит 1 формульная единица кристаллогидрата.
Формула кристаллогидрата: Fe(NO3)2∙9H2O. Не забываем уравнять 1-ую реакцию(!)
4Fe(NO3)2∙9H2O = 2Fe2O3 + 8NO2 + O2 + 36H2O
Найдем количество и массу соли йодоводородной кислоты – FeI2:
n(FeI2) = 2n(Fe2O3) = 2 · 0,1 = 0,2 моль
m(FeI2) = 0,2 · 310 = 62 г
Найдем массу конечного раствора. При этом помним, что для расчета массы раствора необходимо сложить массы всех добавленных субстанций и вычесть из этого массу всех газов и осадков. Обратим внимание, что выпавший йод в реакции (II), израсходовался в реакции (III). Фактически это означает, что массу йода надо сначала вычесть затем прибавить при расчете массы раствора. То есть при расчете массы раствора массу йода можно не использовать.
mконеч. р-ра = m(Fe2O3) + mр-ра(HI) + m(SO2)
Найдем недостающие данные:
m(SO2) = 0,1 · 64 = 6,4 г
m(Fe2O3) = 0,1 · 160 = 16 г
mконеч. р-ра = 16 + 300 + 6,4 = 322,4 г
Найдем массовую долю FeI2:
ꞷ(FeI2) = (62/322,4) · 100% = 19,23% .
Ответ: m(Fe(NO3)2 ∙ 9H2O) = 68,4 г; ꞷ(FeI2) = 19,23%
Задание №15
Через 440 г раствора нитрата меди(II), в котором 52,5% от общей массы раствора составляет масса протонов в ядрах всех атомов, пропускали электрический ток, используя инертные электроды. После того как на аноде выделилось 6,72 л (н.у.) газа электрический ток отключили, а электроды оставили в растворе. Определите массовую долю всех протонов в растворе после окончания всех реакций.
Решение
Ответ: ꞷp+ = 52,78%
Пояснение:
Запишем уравнение реакции электролиза:
2Cu(NO3)2 + 2H2O = 2Cu + O2 + 4HNO3 (I)
1) По условию, масса протонов в ядрах всех атомов составляет 52,5% от общей массы раствора. Найдем массу протонов:
(440/100) · 52,5 = 231 г
Пусть n(Cu(NO3)2) = x моль, m(Cu(NO3)2) = 188x г.
Пусть n(H2O) = y моль, m(H2O) = 18y г.
Составим первое уравнение системы: 188x + 18y = 440
Найдем количество протонов в ядрах всех атомов. При этом помним, что количество протонов численно равно порядковому номеру элемента в периодической системе, а молярная масса протона составляет 1г/моль.
а) np+ = Np+ ∙ n(в-ва)
np+(Cu(NO3)2) = (29 + 14 + 48) · x = 91x моль
np+(H2O) = (2 + 8)y = 10y моль
б) mp+ = np+ · 1г/моль
mp+(Cu(NO3)2) = 91x г;
mp+(H2O) = 10y г
Составим второе уравнение системы: 91x + 10y = 231
2) Решим систему уравнений:
24,2x = 24,2
x = 1 моль – n(Cu(NO3)2)
y = 14 моль – n(H2O)
3) Дальше необходимо проверить, идет ли далее электролиз воды. Для этого нам необходимо рассчитать количество выделившегося на аноде газа и сравнить его с тем количеством, которое бы выделилось, если бы электролиз соли прошел полностью.
n(газа) = 6,72/22,4 = 0,3 моль
n1(O2) = 0,5n(Cu(NO3)2) = 0,5 · 1 = 0,5 моль
0,3 < 0,5 – из чего делаем вывод, что электролиза воды не было, но электролиз соли прошел не полностью, и часть её осталась в растворе.
4) В условии сказано, что электроды после окончания электролиза оставили в растворе, поэтому кислота из анодного пространства стала растворять медь, образовавшуюся на катоде.
5) Чтобы записать следующую реакцию, необходимо знать концентрацию азотной кислоты, так как реакция может протекать с образованием NO либо NO2.
Обратим внимание, что количество веществ в 1ой реакции дальше нужно считать по количеству выделившегося кислорода, так как он в недостатке.
n(HNO3) = 4n(O2) = 0,3 · 4 = 1,2 моль
m(HNO3) = 1,2 · 63 = 75,6 г
Найдем массу раствора после1ой реакции:
mр—ра 1 = mр—ра(Cu(NO3)2) – m(Cu) – m(O2)
mр-ра 1 = 440 – (2n(O2) ·64) – (0,3 · 32) = 440 – 38,4 – 9,6 = 392 г
Найдем концентрацию HNO3:
ꞷ(HNO3) = (75,6/392) · 100% = 19,28% — следовательно, кислота разбавленная, поэтому растворение меди протекает с образованием NO.
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O (II)
6) Сравним количества меди и азотной кислоты и определим избыток/недостаток.
n(HNO3)/8 < n(Cu)/3 = 1,2/8 < 0,6/3 = 0,15 < 0,2 – следовательно, HNO3 в недостатке.
Найдем количество и массу прореагировавшей меди:
n2(Cu) = 3/8n(HNO3) = 0,45 моль
m2(Cu) = 0,45 · 64 = 28,8 г
7) В задаче просят найти массовую долю протонов в растворе после окончания всех реакций. Для начала нам необходимо определиться с тем, какие вещества остались в растворе. Это: нитрат меди (II) и вода.
а) Найдем общее количество и массу нитрата меди(II):
nобщ.(Cu(NO3)2) = n1 ост.(Cu(NO3)2) + n2 обр.(Cu(NO3)2)
nобщ.(Cu(NO3)2) = (1 – 2n1(O2)) + 3/8n(HNO3) = 1 – 0,6 + 0,45 = 0,85 моль
mобщ.(Cu(NO3)2) = 0,85 · 188 = 159,8 г
б) Найдем общее количество воды:
m(H2O) = mконечн. р-ра – m(Cu(NO3)2)
mконечн. р-ра = mр-ра 1 + mпрореаг.(Cu) – m(NO)
mконечн. р-ра = 392 + 28,8 – (2/8n(HNO3) · 30) = 392 + 28,8 – 9 = 411,8 г
m(H2O) = 411, 8 – 159,8 = 252 г
n(H2O) = 252/18 = 14 моль

а) np+ = Np+ ∙ n(в-ва)
np+(Cu(NO3)2) = (29 + 14 + 48) · 0,85 = 77,35 моль
np+(H2O) = (2 + 
б) mp+ = np+ · 1г/моль
mp+(Cu(NO3)2) = 77,35 г;
mp+(H2O) = 140 г
9) Найдем ꞷp+:
ꞷp+ = (77,35 + 140)/411,8 · 100% = 52,78% .
Ответ: ꞷp+ = 52,78%
Задание №16
Через 526,5 г раствора хлорида натрия, в котором массовая доля протонов в ядрах всех атомов составляет 54,7%, пропускали электрический ток до тех пор, пока на аноде не выделилось 22,4 л (н.у.) газа. К образовавшемуся в результате электролиза раствору добавили 13 г цинка. Определите массовую долю всех протонов в конечном растворе.
Решение
Ответ: ꞷp+ = 54,8%
Пояснение:
2NaCl + 2H2O = H2 + Cl2 + 2NaOH (I)
1) По условию, масса протонов в ядрах всех атомов составляет 54,7% от общей массы раствора. Найдем массу протонов:
(526,5/100) · 54,7 = 288 г
Пусть n(NaCl) = x моль, тогда m(NaCl) = 58,5x г
Пусть n(H2O) = y моль, тогда m(H2O) = 18y г
Составим 1-е уравнение системы: 58,5x + 18y = 526,5
2) Найдем количество протонов в ядрах всех атомов. При этом помним, что количество протонов = порядковому номеру элемента, а молярная масса одного протона составляет 1г/моль.
а) np+ = Np+ ∙ n(в-ва)
np+(NaCl) = (11 + 17) · x = 28x моль
np+(H2O) = (2 + 8)y = 10y моль
б) mp+ = np+ · 1г/моль
mp+(NaCl) = 28x г;
mp+(H2O) = 10y г
Составим второе уравнение системы: 28x + 10y = 288
3) Решим систему уравнений:
8,1x = 8,1
x = 1, т.е. n(NaCl) = 1 моль
y = 26, т.е. n(H2O) = 26 моль
4) Дальше необходимо проверить, идет ли электролиз воды. Для этого нам необходимо рассчитать количество выделившегося на аноде газа и сравнить его с тем количеством, которое бы выделилось, если бы электролиз соли прошел полностью.
n(газа) = 22,4/22,4 = 1 моль
n1(Cl2) = 0,5n(NaCl) = 0,5 · 1 = 0,5 моль
m1(Cl2) = 0,5 · 71 = 35,5 г – выделилось при электролизе соли.
0,5 < 1 – из чего делаем вывод, что помимо электролиза соли также шел и электролиз воды.
Запишем вторую и третью реакцию.
2H2O = 2H2 + O2 (II)
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2 (III)
Найдем сразу количество цинка: n(Zn) = 13/65 = 0,2 моль
5) Из прошлого пункта мы понимаем, что n(газа) = n(Cl2) + n(O2). Можем найти количество и массу кислорода во второй реакции:
n(O2) = 1 – 0,5 = 0,5 моль;
m(O2) = 0,5 · 32 = 16 г
6) В задаче просят найти массовую долю протонов в растворе после окончания всех реакций. Для начала нам необходимо определиться с тем, какие вещества остались в растворе. Это: NaOH, H2O, Na2[Zn(OH)4].
а) Найдем общее количество и массу NaOH:
nост.(NaOH) = nобр.(NaOH) – nистр.(NaOH)
nост.(NaOH) = 2n1(Cl) – 2n(Zn) = 1 – 0,4 = 0,6 моль
mост.(NaOH) = 0,6 · 40 = 24 г
б) Найдем общее количество и массу Na2[Zn(OH)4]:
n(Na2[Zn(OH)4]) = n(Zn) = 0,2 моль
m(Na2[Zn(OH)4]) = 0,2 · 179 = 35,8 г
в) Сразу найти количество и массу H2O нельзя, так как:
m(H2O) = mконечн. р-ра – m(NaOH) – m(Na2[Zn(OH)4])
Поэтому сначала найдем массу конечного раствора. При этом помним, что масса раствора – это всё, что смешали, минус образовавшиеся газы и осадки.
mконечн. р-ра = mр-ра(NaCl) – m1(H2) – m1(Cl2) – m2(H2) – m2(O2) + m(Zn) – m3(H2)
Найдем недостающие данные:
n1(H2) = n1(Cl2) = 0,5 моль; m1(H2) = 0,5 · 2 = 1 г
n2(H2) = 2n2(O2) = 1 моль; m1(H2) = 1 · 2 = 2 г
n3(H2) = n(Zn) = 0,2 моль; m1(H2) = 0,2 · 2 = 0,4 г
Найдем массу конечного раствора:
mконечн. р-ра = 526,5 – 1 – 35,5 – 2 – 16 + 13 – 0,4 = 484,6 г
Теперь мы можем найти количество и массу воды:
m(H2O) = 484,6 – 24 – 35,8 = 424,8 г; n(H2O) = 424,8/18 = 23,6 моль
7) Найдем количество и массу протонов в конечном растворе. При этом помним, что количество протонов = порядковому номеру элемента, а молярная масса одного протона составляет 1г/моль.
а) np+ = Np+ ∙ n(в-ва)
np+(NaOH) = (11 + 8 + 1) · 0,6 = 12 моль
np+(H2O) = (2 + 
np+(Na2[Zn(OH)4]) = (11 · 2 + 30 + 8 ·4 + 4 · 1) · 0,2 = 17,6 моль
б) mp+ = np+ · 1г/моль
mp+(NaOH) = 12 г;
mp+(H2O) = 236 г
mp+( Na2[Zn(OH)4]) = 17,6 г

ꞷp+ = (12 + 236 + 17,6)/484,6 · 100% = 54,8%
Ответ: ꞷp+ = 54,8%
Задание №17
Через 500 г раствора хлорида бария, в котором 53% от общей массы раствора составляет масса протонов в ядрах всех атомов, пропускали электрический ток до тех пор, пока на аноде не выделилось 8,96 л (н.у.) газа. К образовавшемуся в результате электролиза раствору добавили 63,6 г карбоната натрия. Определите массовую долю карбоната натрия в конечном растворе.
Решение
Ответ: ꞷост.(Na2CO3) = 2,43 %
Пояснение:
BaCl2 + 2H2O = H2 + Cl2 + Ba(OH)2 (I)
По условию, масса протонов в ядрах всех атомов составляет 54,7% от общей массы раствора. Найдем массу протонов:
(500/100) · 53 = 265 г
Пусть n(BaCl2) = x моль, тогда m(BaCl2) = 208x г
Пусть n(H2O) = y моль, тогда m(H2O) = 18y г
Составим первое уравнение системы: 208x + 18y = 500
Найдем количество протонов в ядрах всех атомов. При этом помним, что количество протонов равно порядковому номеру элемента, а молярная масса одного протона составляет 1г/моль. Если забыли об этом вспоминаем состав атома водорода — 1 протон и 1 электрон, масса электрона пренебрежимо мала, поэтому можно считать, что масса протона равна массе одного атома водорода.
а) np+ = Np+ ∙ n(в-ва)
np+(BaCl2) = (56 + 17 · 2) · x = 90x моль
np+(H2O) = (2 + 8)y = 10y моль
б) mp+ = np+ · 1г/моль
mp+(BaCl2) = 90x г;
mp+(H2O) = 10y г
Составим 2-е уравнение системы: 90x + 10y = 265 г
Решим систему уравнений:
46x = 23
x = 0,5, т.е. n(BaCl2) = 0,5 моль,
y = 22, т.е. n(H2O) = 22 моль.
Дальше необходимо проверить, идет ли электролиз воды. Для этого нам необходимо рассчитать количество выделившегося на аноде газа и сравнить его с тем количеством, которое бы выделилось, если бы электролиз соли прошел полностью.
n(газа) = 8,96/22,4 = 0,4 моль,
n1(Cl2) = n(BaCl2) = 0,5 моль
0,4 < 0,5 – из чего делаем вывод, что электролиза воды не было и электролиз соли прошел не полностью, и часть её осталась в растворе.
Обратим внимание, что количество веществ в 1ой реакции дальше нужно считать по количеству выделившегося хлора, так как он в недостатке.
Найдем nост.(BaCl2) = 0,5 – n1(BaCl2) = 0,5 – n(Cl2) = 0,5 – 0,4 = 0,1 моль
Запишем следующие реакции:
Ba(OH)2 + Na2CO3 = BaCO3 + 2NaOH (II)
BaCl2 + Na2CO3 = BaCO3 + 2NaCl (III)
Найдем количество добавленного карбоната натрия:
n(Na2CO3) = 63,6 / 106 = 0,6 моль
Далее найдем количество и массу оставшегося карбоната натрия, так как в задаче просят найти его массовую долю:
nост.(Na2CO3) = 0,6 – n2(Na2CO3) – n3(Na2CO3)
n2(Na2CO3) = n(Ba(OH)2) = n(Cl2) = 0,4 моль;
n3(Na2CO3) = nост.(BaCl2) = 0,1 моль;
nост.(Na2CO3) = 0,6 – 0,4 – 0,1 = 0,1 моль
mост.(Na2CO3) = 0,1 · 106 = 10,6 г
Найдем массу конечного раствора. При этом помним, что масса раствора – это всё, что смешали, минус образовавшиеся газы и осадки.
mконечн. р-ра = mр-ра(BaCl2) – m(H2) – m(Cl2) + m(Na2CO3) – mобщ.(BaCO3)
Найдем недостающие данные:
n(H2) = n(Cl2) = 0,4 моль; m(H2) = 0,4 · 2 = 0,8 г
m(Cl2) = 0,4 · 71 = 28,4 г
nобщ.(BaCO3) = n(Ba(OH)2) + nост.(BaCl2) = 0,4 + 0,1 = 0,5 моль;
mобщ.(BaCO3) = 0,5 · 197 = 98,5 г
Теперь мы можем найти массу раствора:
mконечн. р-ра = 500 – 0,8 – 28,4 + 63,6 – 98,5 = 435,9 г
Найдем ꞷост.(Na2CO3):
ꞷост.(Na2CO3) = (10,6/435,9) · 100% = 2,43 %
Ответ: ꞷост.(Na2CO3) = 2,43 %.
Рекомендуемые сообщения
Решение задач по фото за 30 минут! Мы онлайн – кликай!
yuniy_himik
Опубликовано 4 Декабря, 2016 в 12:23
-
- Поделиться
Опубликовано 4 Декабря, 2016 в 12:23
Рассчитайте массу электронов в эквимолярной смеси оксидов углерода (II) и углерода (IV) объемом 28 л (н.у.), если масса одного электрона равна 0.00055 а.е.м.
Ссылка на комментарий
—>
M_GM
Опубликовано 4 Декабря, 2016 в 12:29
-
- Поделиться
Опубликовано 4 Декабря, 2016 в 12:29
(изменено)
Пошел народ из одного гнезда См. здесь >>
Изменено 4 Декабря, 2016 в 12:33 пользователем M_GM
Ссылка на комментарий
Для публикации сообщений создайте учётную запись или авторизуйтесь
Вы должны быть пользователем, чтобы оставить комментарий
Создать учетную запись
Зарегистрируйте новую учётную запись в нашем сообществе. Это очень просто!
Регистрация нового пользователя
Войти
Уже есть аккаунт? Войти в систему.
Войти
Подписчики
0
Как найти число протонов, нейтронов и электронов
Соавтор(ы): Meredith Juncker, PhD. Мередит Джанкер — аспирантка, работает над получением степени PhD по биохимии и молукулярной биологии в Медицинском центре Университета штата Луизиана. Ее исследования посвящены белкам и нейродегенеративным заболеваниям.
Количество источников, использованных в этой статье: 8. Вы найдете их список внизу страницы.
Количество просмотров этой статьи: 922 593.
Протоны, нейтроны и электроны – основные частицы, из которых состоит атом. Протоны заряжены положительно, электроны – отрицательно, а нейтроны и вовсе не имеют заряда. [1] X Источник информации Масса электронов очень мала, а масса протонов и нейтронов практически одинакова. [2] X Источник информации На самом деле, найти в атоме количество протонов, нейтронов и электронов довольно просто, нужно только научиться ориентироваться по периодической таблице химических элементов Д.И.Менделеева.
Нахождение числа нейтронов, протонов и электронов в атоме .
Атом состоит из ядра и вращающихся вокруг ядра электронов.
Ядро состоит из протонов и нейтронов
Протон- положительно заряженная частица
масса протона равна единице, заряд протона равен единице
Нейтрон-нейтральная частица
масса нейтрона равна единице, заряд нейтрона равен нулю
Электрон- отрицательно заряженная частица
Заряд электрона равен -1, а масса электрона равна нулю
Порядковый номер элемента в таблице Менделеева указывает на число электронов в атоме
Количество протонов в атоме равно количеству электронов , так как атом электрически нейтрален
Масса атома складывается из числа протонов и числа нейтронов, масса электрона не учитывается
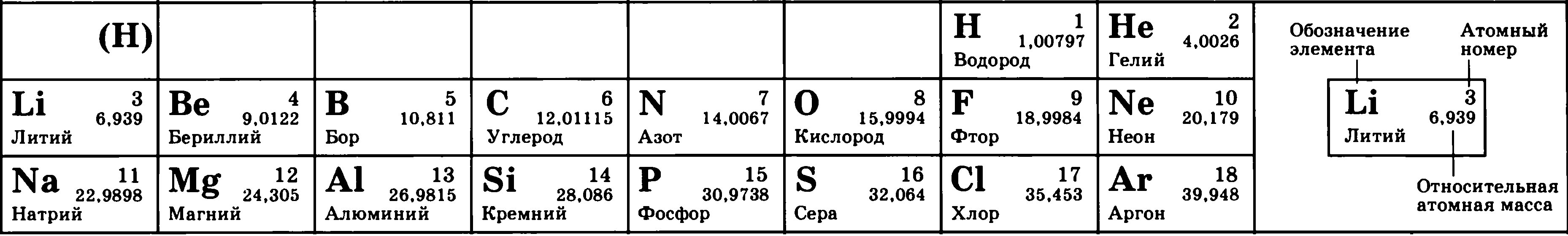
Рассмотрим фрагмент таблицы Менделеева и найдем количество протонов, нейтронов и электронов в атоме водорода
После чего начертим модель атома водорода
Порядковый номер атома водорода равен единице, значит атом имеет:
1 электрон
1 протон
Для нахождения количества нейтронов нужно из массы вычесть число протонов
Масса атома водорода равна единице
В атоме водорода нет нейтронов
Модель атома водорода:
Рассмотрим фрагмент таблицы Менделеева и найдем количество протонов, нейтронов и электронов в атоме гелия
После чего начертим модель атома гелия
Порядковый номер атома гелия равен 2, значит атом имеет:
2 электрона
2 протона
Для нахождения количества нейтронов нужно из массы вычесть число протонов
Масса атома гелия равна 4
В атоме гелия 2 нейтрона
Модель атома гелия:
С помощью фрагмента таблицы Менделеева найти количество протонов, нейтронов и электронов в атоме лития
Массу атома округлить до 7.
Какое количество электронов будет иметь массу 1 мг
N = m / m1, где N — искомое количество электронов, m — общая масса электронов ( m = 1 мг = 1 * 10-6 кг ), m1 — масса одного электрона ( m1 = 9,1 * 10-31 кг ).
Рассчитаем количество электронов:
N = m / m1 = 1 * 10-6 / 9,1 * 10-31 = ( 1 / 9,1 ) * 1025 = 0,11 * 1025 электронов.
Ответ: Массу 1 мг составляют 0,11 * 1025 электронов.
Масса одного электрона
Масса покоя электрона me невообразимо мала. Она небольшая даже в относительных атомных единицах массы, и равна примерно 0,000548 а. е. м., то есть примерно в 1800 раз меньше массы протона. Масса электрона в килограммах me = 9,109*10 -31 кг.
Никаких сверхточных весов для взвешивания столь легких объектов нет. Массу элеткрона физики определили косвенными методами.
Один миллиграмм электронов
Решаем поставленную в условии задачу:
- вспоминаем, что 1 мг = 0,001 кг;
- применяем формулу n = m / me, где m заданная масса электронов;
- подставляем в формулу численные значения и находим, что n = m / me = 0,001 кг / 9,109*10 -31 кг = 1,0978 * 10 27 .
Практически собрать в небольшом объеме такое огромное число электронов не удастся. Ведь их суммарный заряд составляет примерно 1,7 * 10 8 К, и невозможно найти силу, которая была бы способна преодолеть силу электростатического отталкивания.
В связанном с атомами состоянии 1 мг электронов легко уживается в четырех килограммах меди.
Чтобы поделиться, нажимайте
На самом деле, понятия «атомистика» не существует, но в интернете стали так говорить, поэтому и я не буду исключением.
Задачи на «атомистику» — это задачи на соотношения частиц (атомов, молекул, ионов и т.д.) в гомогенных и гетерогенных системах (растворах, твердых и газообразных смесях). Это могут быть массовые соотношения (например, массовая доля элемента в смеси), мольные соотношения (например, соотношение числа атомов водорода и кислорода или мольная доля), объемные соотношения (объемная доля и др.).
Задачи разделены по уровню сложности: от простых до сложных. А также предлагаю вам порешать задачи на удобрения, в которых без «атомистики» не обойтись. Как показывает моя практика, если вы умеете решать задачи на удобрения, то вы полностью понимаете тему «атомистика».
И, конечно же, после каждой задачи вы найдёте подробные видео-объяснения, а ответы в конце страницы.
- Простые задачи
- Задачи средней сложности
- Сложные задачи
- Задачи на удобрения
- Задачи из реального ЕГЭ 2020 на атомистику
Простые задачи
-
Укажите число атомов водорода в одной формульной единице гидросульфита аммония NH4HSO3.
-
Рассчитайте химическое количество азота в порции простого вещества, содержащей 6,02∙1025 молекул.
-
Имеется сосуд, в котором содержится 8,428∙1022 молекул некоторого газа. Укажите объём сосуда (в литрах).
-
Рассчитайте химическое количество (моль) поваренной соли, в которой содержится такое же химическое количество натрия, как и в карбонате натрия химическим количеством 4 моль.
-
В каком объёме (л) бурого газа содержится столько же атомов, сколько и в аргоне объёмом 2 л (объёмы измерены при одинаковых условиях)?
-
Рассчитайте количество (моль) CO2, в котором содержится столько же атомов углерода, сколько их содержится в СО массой 1,4 г.
-
Рассчитайте количество (моль) атомов водорода в аммиаке, объёмом (н.у.) 32,48 л.
-
Укажите объём (л) порции метана СН4 (н.у.), в которой содержится 0,1 моль атомов углерода.
-
Рассчитайте объём оксида азота (IV) (л, н.у.), в котором содержится столько же атомов азота и кислорода в сумме, как и общее число атомов в азотной кислоте массой 56,7 г.
-
Рассчитайте массу (г) порции азотной кислоты, содержащей столько же атомов водорода, сколько в аммиаке объёмом 3,36 л (н.у.).
-
Укажите число атомов водорода в образце дигидата ацетата цинка ((CH3COO)2Zn∙2H2O) массой 131,4 г.
-
Вычислите число атомов в образце фтора (н.у.) объёмом 30,24 дм3.
-
Укажите количество (моль) оксида серы (VI), содержащего столько же атомов кислорода, как и в оксиде серы (IV) массой 76,8 г.
-
Вычислите число атомов азота в порции гидросульфата аммония массой 16,1.
-
Рассчитайте массу (г) соли Na2S, содержащей столько же атомов серы, сколько их содержится в сероводороде массой 48,96 г.
-
Укажите число моль воды в 1 моль кристаллогидрата сульфата натрия с Mr равной 322.
-
Каков объём кислорода (л, н.у.), содержащего столько же атомов кислорода, сколько их содержится в алебастре массой 87 г?
-
Рассчитайте количество (моль) ионов в навеске селенида калия массой 39,25.
-
В порции газа массой 26,4 г содержится 3,612∙1023 молекул. Укажите относительную плотность этого газа по водороду.
-
Вычислите количество (моль) всех анионов, содержащихся в Ca3(PO4)2 массой 372 г.
-
Какое число электронов содержится в образце массой 6,4 г, состоящем из нуклида меди-64?
Задачи средней сложности
-
Образец сплава железа-56 с медью-63 содержит электроны и нейтроны химическим количеством 2,77 моль и 3,21 моль соответственно. Рассчитайте массовую долю (%) меди в сплаве.
-
Какую массу (г) гидросульфата аммония надо добавить к гидросульфиту натрия массой 15,6 г для получения смеси, содержащей равное число атомов водорода и кислорода?
-
Какую массу (г) сульфата натрия следует добавить к сульфиду натрия массой 3,9 г, чтобы в полученной смеси массовая доля натрия стала равной 51,9%?
-
В порции кристаллогидрата сульфата железа (II) содержится 1,204∙1024 атомов железа и 1,3244∙1025 атомов кислорода. Укажите число атомов водорода в данной порции кристаллогидрата.
-
В смеси оксида железа (II) и оксида железа (III) на 4 атома железа приходится 5 атомов кислорода. Вычислите массовую долю (%) оксида железа (II) в такой смеси.
-
Газовая смесь содержит 6,02∙1022 молекул и имеет массу 2,3 г. Укажите относительную плотность этой газовой смеси по кислороду.
-
Для получения бронзы массой 567 г (массовая доля меди 79,01%) использовали минералы медный блеск Cu2S и касситерит SnO2. Укажите общую массу (г) израсходованных минералов, если считать, что минералы не содержали примесей.
-
Образец минерала браунита массой 100 состоит из вещества, формула которого 3Mn2O3∙MnCO3, и примесей, которые не содержат в своём составе металлы. Массовая доля этих примесей 1,5%. Вычислите массу (г) марганца в исходном образце минерала.
-
Одна таблетка биологически активных добавок (БАВ) к пище содержит медь массой 2 мг, где медь находится в форме ацетата меди (II). Укажите массу (г) ацетата меди (II), который поступает в организм за неделю при ежедневном приёме 1 таблетки БАВ.
-
Алюминиевая руда (боксит) состоит из оксида алюминия и других веществ, не содержащих алюминий. Массовая доля алюминия в боксите составляет 21,6%. Вычислите массу (г) оксида алюминия в образце боксита массой 100 г.
Сложные задачи
-
Для анализа смеси массой 3,125 г, состоящей из хлорида калия и бромида калия, её растворили в воде и к полученному раствору добавили раствор нитрата серебра (I) массой 42,5 г с массовой долей соли 20%. В результате чего образовался осадок массой 5,195 г. Рассчитайте массовую долю (%) ионов калия в исходной смеси.
-
Твёрдое вещество массой 116 г, состоящее из атомов железа и кислорода, восстановили избытком углерода при нагревании. После полного завершения реакции получили смесь оксидов углерода общим объёмом 33,6 л с массовой долей кислорода 64%. Рассчитайте массу (г) железа в исходном веществе.
-
Сера, содержащаяся в неизвестном веществе массой 51,2 г, была полностью переведена в соль сульфит натрия массой 100,8 г. Укажите массовую долю (%) серы в неизвестном веществе
-
Массовая доля трёхвалентного металла в смеси, состоящей из его оксида и гидроксида, составляет 45%. Химические количества веществ равны между собой. Укажите молярную массу (г/моль) металла.
-
Укажите число электронов, переходящих к окислителю от восстановителя при полном разложении нитрата хрома и нитрита аммония общим химическим количеством 0,2 моль.
-
Кусочек цинка погрузили в концентрированный раствор гидроксида натрия. В результате образовалась соль массой 1074 г. Рассчитайте химическое количество электронов, которые атомы цинка отдали атомам водорода в результате описанного взаимодействия.
-
При взаимодействии цинка с избытком концентрированного раствора гидроксида калия от атомов цинка к атомам водорода перешло 4 моль электронов. Укажите массу (г) образовавшейся при этом соли.
-
Имеется твёрдый образец массой 291,195 г, содержащий только элементы Cu и O. Этот образец полностью восстановили углеродом, в результате чего получили смесь СО и СО2 объёмом 40,32 л (н.у.) с массовой долей кислорода 65,82%. Рассчитайте массу восстановленной меди.
-
Некоторый металл массой 11,8 г прокалили на воздухе, в результате чего образовалась смесь оксидов массой 16,067 г. Затем эти оксиды растворили в соляной кислоте. Через образовавшийся раствор пропустили газообразный хлор массой 2,345 г, который полностью поглотился. Затем раствор выпарили и получили единственный кристаллогидрат, представляющий собой гексагидрат хлорида металла в степени окисления +3. Рассчитайте массу кристаллогидрата.
-
В карбоновую трубку поместили порошок металла Х массой 15,36 г и пропустили по трубке ток очищенного хлора при нагревании до 700С и повышенном давлении. Через некоторое время металл полностью прореагировал, а в конце трубки накопились коричневые кристаллы вещества Y массой 26,72 г. Длительное нагревание Y в токе водорода приводит к образованию X и газа Z, который при растворении в воде даёт сильную неорганическую кислоту. Вещество Y состоит из пятиатомных молекул, содержащих один атом металла. Укажите химический символ металла X.
-
Имеется вещество, состоящее из атомов четырёх химических элементов. Массовые доли серы, водорода и кислорода соответственно равны 13,4%, 5,03% и 67,04%. Порцию этого вещества массой 71,6 г растворили в воде массой 100 г. Массовая доля воды в полученном растворе составила 77,16%. Затем к полученному раствору добавили избыток раствора нитрата бария. В результате этого образовался осадок массой 69,9 г. Укажите относительную молекулярную (формульную) массу неизвестного элемента, входящего в состав исходного вещества.
-
Имеется смесь оксида кобальта (II), оксида кобальта (III) и оксида кобальта (II, III). Эту смесь массой 0,782 г полностью восстановили водородом, в результате чего было получено твёрдое вещество массой 0,590 г. Эту же смесь массой 1,564 г полностью растворили в бромоводородной кислоте массой 48,6 г с массовой долей растворённого вещества 10%. Рассчитайте максимальную массу кобальта (мг), которую можно ещё растворить в полученном растворе, чтобы в нём содержалась только одна соль.
Задачи на удобрения
-
Потребность редиски в химическом элементе азот составляет в среднем 195 кг/га. Масса аммиачной селитры (кг), которую необходимо внести на 3 га почвы для подкормки редиски азотом, равна
-
Для подкормки растений на 1 м2 почвы необходимо внести азот массой 4,2 г и натрий массой 4,6 г. Укажите массу (г) смеси, состоящей из аммиачной селитры и чилийской селитры, которая потребуется, чтобы растения получили необходимое количество азота и натрия на приусадебном участке площадью 10 м2.
-
При поглощении аммиака объёмом (н.у.) 1,2 м3 азотной кислотой с выходом 86% получено удобрение под названием аммиачная селитра. Учитывая, что для удобрения 1 га почвы необходим азот массой 28 г, рассчитайте количество гектаров, которые можно удобрить, используя полученную селитру.
-
На одном дачном участке использовалось удобрение чилийская селитра массой 136 г, содержащая 6,25% примесей. Рассчитайте массу (г) аммиачной селитры, не содержащей примесей, которую нужно внести на другой такой же по размеру дачный участок, чтобы в почву поступило такое же количество азота, что и на первый дачный участок.
-
Имеется смесь кальциевой селитры и аммофоски (массовая доля оксида фосфора (V) составляет 23%) в таком количестве, чтобы при внесении в почву поступило по 10 кг калия, азота и оксида фосфора (V). Определите массу (кг) исходной смеси удобрений (примесями пренебречь, округления производить до четырех знаков после запятой).
-
На дачный участок было внесено 10 кг золы, в которой массовая доля поташа 13,8%. Вычислите массу (кг) органического удобрения, содержащего калий в виде примесей представленных хлоридом калия, которое необходимо дополнительно внести в почву, чтобы втрое увеличить содержание калия в почве. Учтите, что массовая доля хлорида калия в органическом удобрении всего лишь 0,4%.
-
Имеется смесь нитрата аммония и нитрата калия, которая необходима для удобрения территории площадью 10 м2. Рассчитайте массу этой смеси, если известно, что в почву необходимо внести азот массой 4,368 г и калий массой 5,616 г в расчёте на м2.
-
Вычислите массу (г) смеси, состоящей из аммиачной селитры и аммофоса, которая потребуется для удобрения участка для выращивания льна площадью 100 м2, если массовая доля оксида фосфора (V) в аммофосе составляет 59,97%, а на 1 м2 почвы требуется 1,55 г фосфора и 4,2 г азота.
Задачи из реального ЕГЭ 2020 на атомистику
-
52. Железную пластину полностью растворили в 500г раствора азотной кислоты. При этом выделилась смесь оксида азота(II) и оксида азота (IV) общим объемом 20,16л. Соотношение атомов кислорода к атомам азота в этой газовой смеси соответственно равно 5:3. Вычислите массовую долю соли в полученном растворе.
-
53. Смесь оксида алюминия и сульфида алюминия, в которой массовая доля алюминия составляет 50%, растворили в избытке 700г соляной кислоты. Выделившийся газ полностью поглотили 240 г 20% раствора сульфата меди (II), причём исходные вещества прореагировали без остатка. Вычислите массовую долю соли, образовавшейся при взаимодействии исходной твёрдой смеси с соляной кислотой.
-
54. Смесь меди и оксида меди (II), в которой массовая доля атомов меди составляет 96%, растворили в концентрированной серной кислоте массой 472 г, взятой в избытке. Полученный газ растворили в минимальном количестве раствора гидроксида натрия массой 200 г с массовой долей щёлочи 10%. Вычислите массовую долю соли в растворе, полученном после реакции исходной смеси с кислотой.
-
55. К смеси пероксида и оксида бария, где отношение количества атомов бария к количеству атомов кислорода равно 5:9, добавили 490г холодного 20%-го раствора серной кислоты. В результате соединения бария прореагировали полностью, а полученный раствор оказался нейтральным. Найдите массовую долю воды в образовавшемся растворе.
-
56. Смесь цинка и карбоната цинка, в которой соотношение атомов цинка и кислорола 5:6, обработали 500 г раствора разбавленной серной кислоты. В результате исходная смесь и кислота прореагировали без остатка и выделилось 2,24 л газов (н.у.). К получившемуся раствору прилили 500 г раствора гидроксида натрия с массовой долей 40%. Найдите массовую долю сульфата натрия в получившемся растворе.
-
57. Смесь твёрдых сульфата железа (II) и сульфата железа (III), в которой соотношение атомов серы и железа 4:3, добавили в подкисленный 5% раствор перманганата калия массой 126,4 г. Все вещества, участвовавшие в окислительно-восстановительной реакции, прореагировали полностью. Расчитайте максимальную массу 20%-го раствора гидроксида натрия, который прореагирует с полученным раствором.
-
58. В холодный раствор серной кислоты добавили пероксид бария, при этом вещества прореагировали полностью. В полученном растворе соотношение атомов водорода к кислороду составило 9 к 5. Затем к этому раствору добавили каталитическое количество оксида марганца (IV), в результате масса раствора уменьшилась на 6,4 г. Вычислите массовую долю серной кислоты в исходном растворе.
-
59. Смесь кальция и карбоната кальция, в которой массовая доля атомов кальция равна 50%, растворили в избытке соляной кислоты массой 300 г. После завершения всех реакций масса раствора составила 330 г, а выделившуюся газовую смесь пропустили через 200 г 8%-ного раствор гидроксида натрия. В результате чего один из газов полностью поглотился. Определите массовую долю соли в конечном растворе.
-
60. Смесь оксида кальция и карбоната кальция, в которой массовая доля кальция 62,5%, растворили в 300 г соляной кислоты, которая была в избытке. Масса раствора стала 361,6 г. Выделившийся газ пропустили через 80 г 10%-ного раствора гидроксида натрия. Вычислите массовую долю соли в конечном растворе.
-
61. Смесь карбида кальция и карбида алюминия, в которой массовая доля углерода 30%, растворили в 547,5 г соляной кислоты, взятой в необходимом стехиометрическом количестве. В полученный раствор добавляли 1260 г 8%-ного раствора гидрокарбоната натрия до завершения реакции. Найдите массовую долю хлороводорода в растворе, в котором растворяли смесь карбидов.
-
62. Смесь железной окалины и оксида железа (III), в которой отношение числа атомов железа к числу атомов кислорода 7/10, полностью растворили в 500 г концентрированной азотной кислоты. Для поглощения полученного газа необходимо 20 г 20%-ного раствора гидроксида натрия. Найдите массовую долю соли железа в растворе, полученном после растворения смеси оксидов в кислоте.
-
63. Смесь оксида и пероксида натрия, в которой соотношение атомов натрия к атомам кислорода равна 3:2, нагрели с избытком углекислого газа. Образовавшееся вещество растворили в воде и получили раствор массой 600 г. К полученному раствору добавили 229,6 г раствора хлорида железа (III). При этом получился раствор массой 795 г, а массовая доля карбоната натрия в этом растворе составила 4%. Найдите массу оксида натрия в исходной смеси.
-
64. В смеси оксида магния и фосфида магния массовая доля атомов магния составляет 54,4%. Для полного растворения этой смеси потребовалось 365 г 34% соляной кислоты. К полученному раствору добавили 232 г 30% раствора фторида калия. Найдите массовую долю хлорида калия в конечном растворе.
-
65. Смесь оксида лития и нитрида лития с массовой долей атомов лития 56%, растворили в 365 г 20% соляной кислоты, причём все вещества полностью прореагировали. Затем к образовавшемуся раствору добавили 410г 20% раствора фосфата натрия. Найдите массовую долю хлорида натрия в конечном растворе.
-
66. В растворе хлоридов железа (II) и (III) на 3 иона железа приходится 8 хлорид-ионов. Через 200 г этого раствора пропустили хлор до прекращения реакции. К полученному раствору добавили раствор гидроксида натрия, в результате чего вещества прореагировали без остатка и получили 526,5 г 20% раствора соли. Рассчитайте массовую долю щёлочи в добавленном растворе.
Ответы:
- 5
- 100
- 3,136
- 8
- 0,672
- 0,05
- 4,35
- 2,24
- 34
- 28,35
- 3,612∙1024
- 1,625∙1024
- 0,8
- 8,4∙1022
- 112,32
- 10
- 30
- 0,75
- 22
- 2,4
- 2∙1024
- 27
- 35
- 1,415
- 2∙1025
- 47
- 0,72
- 711
- 64,3
- 0,04
- 40,8
- 37,44
- 84
- 50
- 27
- 3,612∙1023
- 12
- 422
- 250
- 54,71
- Ir
- 52
- 590
- 1671
- 210
- 46
- 60
- 62,78
- 745
- 213
- 1552
- 24,6
- 27,52
- 20
- 93,57
- 1,4
- 376
- 40,5
- 15,44
- 18,92
- 10
- 30,77
- 24,8
- 14,88
- 11,96
- 18,8
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ и ЦТ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Просмотреть задания ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Больше заданий РТ вы можете найти здесь, нажав на эту строку
- Больше заданий ЦТ вы можете найти здесь, нажав на эту строку
- Посмотреть все пробные варианты ЦТ вы можете здесь, нажав на эту строку
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
- Если вы сдаёте ЦТ по химии, то посмотреть видео-объяснения каждого задания ЦТ, РТ и ДРТ всех лет вы можете получив полный доступ к сайту кликнув здесь «Получить все материалы сайта»