Условие задачи:
Определить массу электрона, если он движется со скоростью, равной 50% скорости света.
Задача №11.5.3 из «Сборника задач для подготовки к вступительным экзаменам по физике УГНТУ»
Дано:
(upsilon = 0,5c), (m-?)
Решение задачи:
Релятивистскую массу электрона (m), т.е. массу электрона, движущегося относительно наблюдателя с некоторой скоростью (upsilon), можно определить по формуле:
[m = frac{{{m_е}}}{{sqrt {1 – frac{{{upsilon ^2}}}{{{c^2}}}} }}]
Здесь (m_е) – масса покоя электрона, равная 9,1·10-31 кг, (upsilon) – скорость движения частицы относительно наблюдателя, (c) – скорость света в вакууме, равная 3·108 м/с.
По условию задачи электрон движется со скоростью, равной 50% скорости света, то есть (upsilon = 0,5c), поэтому:
[m = frac{{{m_e}}}{{sqrt {1 – frac{{{{left( {0,5c} right)}^2}}}{{{c^2}}}} }}]
[m = frac{{{m_e}}}{{sqrt {1 – frac{{0,25{c^2}}}{{{c^2}}}} }}]
[m = frac{{{m_e}}}{{sqrt {1 – 0,25} }}]
[m = frac{{{m_e}}}{{sqrt {0,75} }}]
[m = {0,75^{ – frac{1}{2}}}{m_e}]
Произведем вычисления:
[m = {0,75^{ – frac{1}{2}}} cdot 9,1 cdot {10^{ – 31}} = 10,5 cdot {10^{ – 31}};кг]
Ответ: 10,5·10-31 кг.
Если Вы не поняли решение и у Вас есть какой-то вопрос или Вы нашли ошибку, то смело оставляйте ниже комментарий.
Смотрите также задачи:
11.5.2 На сколько увеличится масса тела, если дополнительно сообщить ему 9*10^12 Дж энергии?
11.5.4 Частица движется со скоростью 0,75 скорости света для неподвижного наблюдателя
11.5.5 Определить скорость частицы, при движении с которой её динамическая масса превышает
Тема: Найти массу и скорость электрона (Прочитано 2682 раз)
0 Пользователей и 1 Гость просматривают эту тему.
Найти массу и скорость электрона, полная энергия которого 10 МэВ.
Записан
В релятивисткой механике скорость электрона будет равна
[W=frac{m_{0} cdot c^{2} }{sqrt{1-frac{upsilon ^{2} }{c^{2} } } } ,; ; 1-frac{upsilon ^{2} }{c^{2} } =left(frac{m_{0} cdot c^{2} }{W} right)^{2} ,; ; upsilon =ccdot sqrt{1-left(frac{m_{0} cdot c^{2} }{W} right)^{2} } ,]
где m0 = 9,1∙10–31 кг — масса покоя электрона, 10 МэВ = 1,6∙10–12 Дж. Тогда
υ = 2,996∙108 м/с.
Масса электрона равна
[m=frac{m_{0} }{sqrt{1-frac{upsilon ^{2} }{c^{2} } } } ,]
m = 1,78∙10–29 кг.
PS Лет 15 назад в теории СТО убрали зависимость массы от скорости. Сейчас считается, что масса от скорости не зависит. Эта задача взята из старого сборника.
« Последнее редактирование: 09 Мая 2015, 08:29 от alsak »
Записан
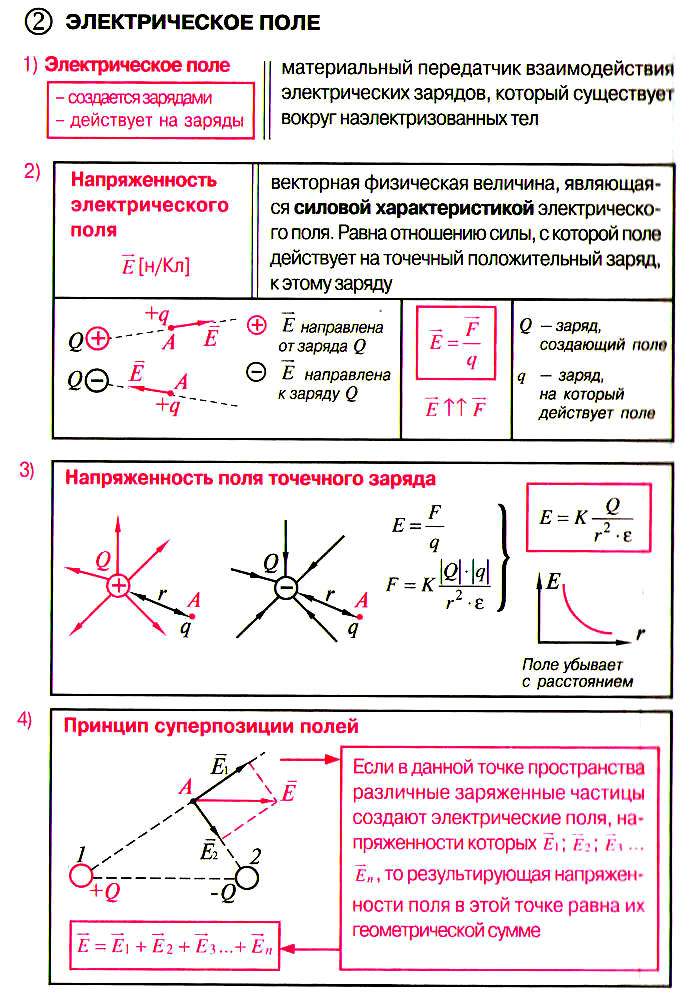
Электрическое поле. ЗАДАЧИ с решениями
Формулы, используемые на уроках по теме «Электрическое поле. ЗАДАЧИ» в 10-11 классах при подготовке к ЕГЭ.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача № 1.
Электрон движется без начальной скорости вдоль силовой линии однородного электрического поля напряженностью Е = 2 • 104 Н/Кл. Какой путь S он пролетит прежде, чем его скорость станет v = 100 км/с ? Среда — воздух. Модуль заряда электрона е = 1,6 • 10–19 Кл, его масса me = 9,1 • 10–31 кг.
Задача № 2.
Пылинка с зарядом q = 1 нКл неподвижно висит в однородном электрическом поле напряженностью Е = 2 • 104 Н/Кл, вектор напряженности которого направлен вверх (рис. 2-9). Найти массу пылинки т. Сколько избыточных электронов N содержит пылинка?
Смотреть решение и ответ
Задача № 3.
Заряженный шар диаметром D находится в равновесии в жидком диэлектрике плотностью р1 с диэлектрической проницаемостью ε (рис. 2-10). Найти поверхностную плотность зарядов на шаре σ, если плотность вещества шара р2. Напряженность электрического поля в диэлектрике Е, вектор напряженности направлен вверх.
Смотреть решение и ответ

Задача № 4.
На каком расстоянии г2 от точечного заряда напряженность электрического поля этого заряда в жидком диэлектрике с диэлектрической проницаемостью ε2 = 81 (вода) такая же, как на расстоянии r1 = 9 см от этого заряда в воздухе?
Смотреть решение и ответ

Задача № 5.
Электрон влетает в однородное электрическое поле со скоростью v0, направленной перпендикулярно вектору напряженности Е (рис. 2-11). Под каким углом φ к линиям вектора напряженности будет направлен вектор его скорости через время t полета в поле? Чему будет равна работа сил поля А за это время? Чему будет равна кинетическая энергия электрона Wк через время t ? Напряженность поля Е. Масса электрона те и его заряд е известны.
Задача № 6.
Тонкая металлическая пластинка массой m падает вертикально вниз равноускоренно так, что ее плоскость остается горизонтальной. Падению пластинки противодействует сила сопротивления среды Fсоnp. Найти напряженность электрического поля Е, возникающего внутри пластинки вследствие инерции свободных электронов. Масса электрона me, его заряд е.
Задача № 7.
К бесконечной, вертикальной, равномерно заряженной плоскости прикреплена одним кондом невесомая нить, на другом конце которой находится одноименно с нитью заряженный шарик радиусом R = 0,5 см, несущий заряд q = 1 • 10–10 Кл. Плотность вещества шарика р = 2 • 103 кг/м3. Натяжение нити Fн = 4,9 • 10–2 Н. Какой угол а образует с плоскостью нить, на которой висит шарик (рис. 2-12)? Среда – воздух. Чему равна поверхностная плотность σ зарядов на плоскости?
Задача № 8.
Сфера радиусом R = 1 см равномерно заряжена. Поверхностная плотность зарядов на сфере σ = 10 нКл/см2. Найти напряженность Е1 электрического поля на расстоянии r1 = 10 см от центра сферы (рис. 2-13). Построить график зависимости напряженности Е от расстояния r в пределах от r0 = 0 до r1 = 10 см. Среда — воздух.
Задача № 9.
Заряды q1 = 20 нКл и q2 = 10 нКл расположены на расстоянии r = 10 см друг от друга. Найти напряженность электрического поля Е1, созданного этими зарядами в точке 1, расположенной на расстоянии r1 = 4 см от заряда q1 и напряженность Е2 в точке 2, расположенной на расстоянии г2 = 2 см от заряда q2 (рис. 2-15). Среда — вакуум.
Задача № 10.
Два одноименных точечных заряда q и 4q расположены на расстоянии r друг от друга. На каком расстоянии r1 от заряда q находится точка М, в которой напряженность поля этих зарядов Е = 0? На каком расстоянии r2 от заряда q находится такая точка, если эти заряды разноименные?
Задача № 11.
На расстоянии г = 3 см от поверхности шара радиусом R = 2 см находится точечный отрицательный заряд q = –2 нКл. Шар заряжен положительно с поверхностной плотностью зарядов σ = 2 нКл/м2. Найти напряженность поля Е, созданного заряженным шаром и точечным зарядом, в точке, расположенной на расстоянии r1 = 4 см от центра шара, и г2 = 3 см от заряда q. Среда — воздух.
Задача № 12.
В вершинах равностороннего треугольника со стороной а находятся заряды q, –q и q. Найти напряженность поля Е, созданного этими зарядами в центре треугольника. Среда — воздух.
(с) В учебных целях использованы цитаты из учебного пособия «Новый репетитор по физике для подготовки к ЕГЭ : задачи и методы их решения / И.Л. Касаткина; под ред. Т.В. Шкиль. — Ростов н /Д : Феникс».
Это конспект по теме «Электрическое поле. ЗАДАЧИ с решениями». Выберите дальнейшие действия:
- Вернуться к списку конспектов по Физике.
- Проверить свои знания по Физике.
Задания 34 (2022). Расчет массовой доли химического соединения в смеси.
Задание №1
Смесь меди и оксида меди(II), в которой масса протонов в ядрах всех атомов составляет 46% от общей массы смеси, разделили на две равные части. К первой части добавили избыток разбавленного раствора серной кислоты. При этом образовалось 528 г раствора с массовой долей соли 10%. Ко второй части добавили 700 г разбавленного раствора азотной кислоты, взятого в избытке. Вычислите массовую долю нитрата меди(II) в образовавшемся растворе.
Решение
Ответ: ꞷ(Cu(NO3)2)=12,31 %
Пояснение:
CuO + H2SO4 ⟶ CuSO4 + H2O (I)
3Cu + 8HNO3 ⟶ 3Cu(NO3)2 + 2NO + 4H2O (II)
CuO + 2HNO3 ⟶ Cu(NO3)2 + H2O (III)
1) Исходя из условия, можем сразу найти количество вещества сульфата меди(II):
m(CuSO4) = = 52,8 г
n(CuSO4) = 52,8/160 = 0,33 моль
2) Найдем количество протонов в смеси меди и оксида меди (II), при этом примем количество обоих веществ за 1 моль.
N(p+) в Cu = 29 частиц;
N(p+) в CuO = 29 + 8 = 37 частиц;
3) По условию массовая доля протонов составляет 46% от общей массы. Это значит, что масса протонов составляет 46% (или 0,46) от суммы масс двух веществ. Составим уравнение, зная, что молярная масса одного протона составляет 1 г/моль.
ꞷ(p+) = mp+ / m(Cu) + m(CuO)
4) Пусть n(Cu) = x моль, тогда m(Cu) = 64x г;
m общ.(CuO) = nобщ.(CuO) · M
nобщ.(CuO) = 0,33 · 2 = 0,66 моль – так как смесь разделили на 2 равные части
m общ.(CuO) = 0,66 · 80 = 52,8 г
m(p+) = mCu(p+) + mCuO(p+)
Если в 1 моль меди содержится 29 протонов, то в n(Cu) = x моль, содержится 29x протонов, а значит: m(p+) = (29x моль) · (1 г/моль) = 29x г
Если в 1 моль оксида меди(II) содержится 37 моль протонов, то в n(CuO) = 0,33 моль содержится 0,66 ∙ 37 = 24,42 моль протонов, а значит: m(p+) = 24,42 ∙ 1 = 24,42 г.
5) Подставим под уравнение:
0,46 = (29x + 24,42) / (64x + 52,8)
29,44x + 24,29 = 29x + 24,42
0,44x = 0,13
x = 0,13/0,44 = 0,3 моль – общее количество меди.
0,3/2 = 0,15 моль – количество меди в одной части смеси.
6) По уравнениям реакций найдем m(Cu(NO3)2):
n2(Cu(NO3)2) = n2(Cu) = 0,15 моль
n3(Cu(NO3)2) = n3(CuO) = 0,33 моль
nобщ.(Cu(NO3)2) = 0,15 + 0,33 = 0,48 моль.
mобщ.(Cu(NO3)2) = M·n = 0,48 · 188 = 90,24 г
7) Найдем ꞷ(Cu(NO3)2):
mр—ра(Cu(NO3)2) = m(Cu) + m(CuO) + mр—ра(HNO3) – m(NO)
m(Cu) = M·n = 0,15 · 64 = 9,6 г
m(CuO) = M·n = 0,33 · 80 = 26,4 г
m(NO) = 2/3 · n·M = 2/3 · 0,15 · 30 = 3 г
mр—ра(Cu(NO3)2) = 9,6 + 26,4 + 700 – 3 = 733 г
ꞷ(Cu(NO3)2) = (90,24/733) · 100% = 12,31 %
Задание №2
К 60 г раствора дигидрофосфата натрия, в котором 55% от общей массы раствора составляет масса протонов в ядрах всех атомов, добавили 40 г 15%-ного раствора гидроксида натрия. Затем к образовавшемуся раствору добавили 51 г нитрата серебра. Определите массовую долю нитрата серебра в конечном растворе.
Решение
Ответ: ꞷ(AgNO3) = 13,68 %
Пояснение:
1) Так как при взаимодействии дигидрофосфата натрия со щелочью может образовываться два типа солей: фосфат натрия либо гидрофосфат натрия – необходимо вычислить соотношение реагентов.
m(NaOH) = 0,15 · 40 = 6 г
n(NaOH) = 6/40 = 0,15 моль
2) Известно, что в растворе NaH2PO4 протоны в ядрах всех атомов составляют 55 % от общей массы раствора. Понимая, что раствор состоит из массы самого растворенного вещества и массы воды, примем, что m(NaH2PO4) = x г, а m(H2O) = y г.
Посчитаем массу протонов в каждом из веществ, примем их количество за 1 моль, а молярную массу одного протона за 1 г/моль:
а) mp+(NaH2PO4) = mp+(Na) + 2mp+(H) + mp+(P) + 4mp+(O) = 11+2+15+32 = 60 г
mp+(NaH2PO4) : m(NaH2PO4) = 60 : 120 = 1 : 2
Следовательно, в x г NaH2PO4 содержится 0,5x г протонов.
б) mp+(H2O)=2mp+(H) + mp+(O) = 2+8=10 г — протонов содержится в 1 моль воды (18г).
Следовательно, в y г H2O содержится 10y/18 г протонов.
Найдем общую массу протонов в растворе:
mp+(р-раNaH2PO4) = mр-ра(NaH2PO4) · ꞷp+ = 60 · 0,55 = 33 г
0,5x + 10/18y = 33 (г)
Составим систему уравнений:
Решая которую находим, что:
y = 54
x = 60 – 54 = 6
m(H2O) = 54 г
m(NaH2PO4) = 6 г
3) n(NaH2PO4)= 6/120 = 0,05 моль
Таким образом, мы можем записать, что количества веществ дигидрофосфата натрия и гидроксида натрия относятся друг к другу как:
n(NaH2PO4) : n(NaOH) = 0,05 : 0,15 = 1:3,
следовательно, щелочь в избытке и протекать будут следующие реакции:
NaH2PO4 + 2NaOH ⟶ Na3PO4 + 2H2O (I)
Na3PO4 + 3AgNO3 ⟶ Ag3PO4 + 3NaNO3 (II)
2NaOH + 2AgNO3 ⟶ Ag2O + H2O + 2NaNO3 (III)
Найдем ꞷ(AgNO3) в конечном растворе:
а) nост.(NaOH) = nисх.(NaOH) — n1(NaOH)
n1(NaOH) = 2n(NaH2PO4) = 2 · 0,05 = 0,1 моль
nост.(NaOH) = 0,15 – 0,1 = 0,05 моль
n(Ag3PO4) = n(Na3PO4) = n(NaH2PO4) = 0,05 моль
m(Ag3PO4) = 0,05 · 419 = 20,95 г
n(AgNO3) = 51/170 = 0,3 моль
nост.(NaOH) : n(AgNO3) = 0,05 : 0,3 =1:6 – следовательно, n(AgNO3) в избытке
n(Ag2O) = 0,5nост.(NaOH) = 0,025 моль
m(Ag2O) = 0,025 · 232 = 5,8 г
б) Найдем массу конечного раствора. Помним, что масса раствора – это всё, что смешали, минус образовавшиеся газы и осадки.
mр-ра кон.(AgNO3) = mр-ра(NaH2PO4) + mр-ра(NaOH) + m(AgNO3) – m(Ag3PO4) – m(Ag2O)
mр-ра кон.(AgNO3) = 60 + 40 + 51 – 20,95 – 5,8 = 124,25 г
в) nост.(AgNO3) = 0,3 – n2(AgNO3) – n3(AgNO3) = 0,3 – 3n2(Na3PO4) – n(NaOH) = 0,3 – 0,15 – 0,05 = 0,1 моль
mост. (AgNO3) = 0,1 · 170 = 17 (г)
ꞷ(AgNO3) = 17/124,25 · 100% = 13,68%
Ответ: ꞷ(AgNO3) = 13,68%
Задание №3
Олеум массой 114 г, в котором общее число электронов в 58 раз больше числа Авогадро, растворили в 26 г воды, затем добавили 23,2 г железной окалины и нагрели. Вычислите массовую долю соли в конечном растворе. Возможным образованием кислых солей пренебречь.
Решение
Ответ: ꞷ(Fe2(SO4)3) = 37,5%
Пояснение:
Для решения подобных задач удобнее считать, что олеум – это раствор SO3 в безводной H2SO4, т.е. воды в нем нет.
1) Для начала определим соотношение веществ в олеуме:
а) Пусть n(SO3) = x моль, а n(H2SO4) = y моль, тогда m(SO3) = 80x г, а m(H2SO4) = 98y г. По условию масса олеума составляет 114 г, следовательно: 80x + 98y = 114 г.
б) Найдем количество электронов в обоих веществах. При этом помним, что количество электронов = количеству протонов = порядковому номеру элемента.
n(e) в x моль SO3 равно: 16x + 3·8x = 40x моль;
n(e) в y моль H2SO4 равно: 2·1y + 16y + 4·8y = 50y моль;
По условию известно, что N(e) в 58 раз больше числа Авогадро (NA), вспоминаем формулу:
n(e) = N/NA , где N = 58NA , то есть: n(e) = 58NA/NA = 58 моль ⇒ 40x + 50y = 58 моль
в) Составим систему уравнений:
решая которую, получаем, что:
y = 1, x = 0,2,
n(H2SO4) = 1 моль, n(SO3) = 0,2 моль, следовательно, n(SO3) в недостатке.
Для того чтобы понять какое уравнение следует записать для второй реакции нам следует понять какой концентрации раствор серной кислоты мы получим в результате добавления олеума к воде. Если раствор серной кислоты получится разбавленным — железная окалина растворится в растворе серной кислоты с образованием двух солей (железа (II) и железа (III). Если же раствор серной кислоты окажется концентрированным, реакция железной окалины с серной кислотой приведет к образованию диоксида серы, сульфата железа(III) и воды.
При добавлении олеума к воде протекает следующая реакция:
SO3 + H2O ⟶ H2SO4 (I)
а) nI(H2SO4) = n(SO3) = 0,2 моль;
mI(H2SO4) = 98 + 0,2 = 19,6 г;
б) mр—ра(H2SO4) = m(олеума) + m(H2O);
mр—ра(H2SO4) = 114 + 26 = 140 г;
в) m(H2SO4) = mисх.(H2SO4) + mI(H2SO4);
m(H2SO4) = 98 + 19,6 = 117,6 г;
ꞷ(H2SO4) = 117,6/140 · 100% = 84% — следовательно, образовавшийся раствор кислоты можно считать концентрированным, а значит протекает следующая реакция:
2Fe3O4 + 10H2SO4 = 3Fe2(SO4)3 + SO2 + 10H2O (II)
Определим массовую долю соли в конечном растворе:
а) n(Fe3O4) = 23,2/232 = 0,1 моль;
б) n(Fe2(SO4)3) = 3/2n(Fe3O4) = 3/2 · 0,1 = 0,15 моль;
m(Fe2(SO4)3) = 0,15 · 400 = 60 г;
в) n(SO2) = 1/2n(Fe3O4) = 0,5 · 0,1 = 0,05 моль;
m(SO2) = 0,05 · 64 = 3,2 г;
г) mр—ра(Fe2(SO4)3) = mр—ра(H2SO4) + m(Fe3O4) – m(SO2);
mр—ра(Fe2(SO4)3) = 140 + 23,2 – 3,2 = 160 г;
д) ꞷ(Fe2(SO4)3) = 60/160 · 100% = 37,5%.
Задание №4
Смесь фосфида цинка и нитрида магния общей массой 65,7 г, в которой общее число электронов в 32 раза больше числа Авогадро, растворили в 730 г 30%-ной соляной кислоты. Вычислите массовую долю кислоты в конечном растворе.
Решение
Ответ: ꞷост.(HCl) = 10,18%
Пояснение:
Сразу запишем уравнения реакций:
Zn3P2 + 6HCl = 3ZnCl2 + 2PH3 (I)
Mg3N2 + 8HCl = 3MgCl2 + 2NH4Cl (II)
Для начала можем сразу определить n(HCl), исходя из условия:
а) m(HCl) = 730 · 0,3 = 219 г
n(HCl) = 219/36,5 = 6 моль
2) По условию масса смеси (Zn3P2 и Mg3N2) равна 65,7 г. Составим первое уравнение системы:
Пусть n(Zn3P2) = x моль, тогда m(Zn3P2) = 257x г
Пусть n(Mg3N2) = y моль, тогда m(Mg3N2) = 100y г
Следовательно: 257x + 100y = 65,7 г
3) Далее перейдем к количеству электронов. По условию: общее число электронов в смеси в 32 раза больше числа Авогадро – это можно записать так:
n(e) = N/NA , где N = 32NA , то есть: n(e) = 32NA/NA = 32 моль
Далее найдем количества электронов в веществах смеси отдельно. При этом помним, что количество электронов = количеству протонов = порядковому номеру элемента.
а) Ne(Zn3P2) = 30 ·3 + 15 · 2 = 120 электронов.
Если в 1 моль Zn3P2 содержится 120 · 1 = 120 моль электронов, то в x моль (Zn3P2) содержится 120x моль.
б) Ne(Mg3N2) = 12 · 3 + 7 · 2 = 50 электронов.
Если в 1 моль Mg3N2 содержится 50 · 1 = 50 моль электронов, то в y моль (Zn3P2) содержится 50y моль.
в) Составим второе уравнения системы: 120x + 50y = 32
Решим систему уравнений, найдем x и y:
x = 0,1 (моль) – n(Zn3P2);
y = 0,4 (моль) – n(Mg3N2);
Найдем массу оставшейся в растворе соляной кислоты (логично, что если она осталась, значит была в избытке):
а) n1(HCl) = 6n(Zn3P2) = 0,1 · 6 = 0,6 моль
n2(HCl) = 8n(Mg3N2) = 0,4 · 8 = 3,2 моль
nост.(HCl) = 6 — 3,2 — 0,6 = 2,2 моль
б) mост.(HCl) = 2,2 · 36,5 = 80,3 г
Найдем массу конечного раствора. Помним, что масса раствора – это всё, что смешали, минус образовавшиеся газы и осадки. Из газов у нас только PH3 (никакого NH3 там нет! Он прореагировал с соляной кислотой и перешел в NH4Cl! баллы не теряем).
а) mконечн. р-ра(HCl) = mсмеси + mисх. р-ра (HCl) – m(PH3)
б) n(PH3) = 2n(Zn3P2) = 0,2 моль
m(PH3) = 0,2 · 34 = 6,8 г
в) mконечн. р-ра(HCl) = 65,7 + 730 – 6,8 = 788,9 г
Найдем ꞷост.(HCl):
ꞷост.(HCl) = (80,3/788,9) · 100% = 10,18%
Ответ: ꞷост.(HCl) = 10,18% .
Задание №5
К 125 г раствора аммиака, в котором 56% от общей массы раствора составляет масса протонов в ядрах всех атомов, добавили 40,05 г хлорида алюминия. Через образовавшийся раствор пропустили сернистый газ, при этом прореагировало 2,24 л (н.у.) газа. Вычислите массовые доли солей в конечном растворе. Растворимостью газов в воде пренебречь.
Решение
Ответ: ꞷ(NH4Cl) = 32,5%; ꞷ(NH4HSO3) = 6,69%
Пояснение:
1) Для начала можем сразу записать следующую реакцию:
AlCl3 + 3NH3 + 3H2O = Al(OH)3 + 3NH4Cl (I)
2) Найдем количества веществ, данных в условии:
а) n(AlCl3) = 40,05/133,5 = 0,3 моль;
б) n(SO2) = 2,24/22,4 = 0,1 моль;
3) Далее мы не можем сразу сделать вывод о том какая реакция протекает:
SO2 + NH3 + H2O = NH4HSO3 либо SO2 + 2NH3 + H2O = (NH4)2SO3
Также возможен случай когда образуются сразу две соли одновременно.
Обратим внимание на соотношение реагентов (SO2 и NH3) в двух реакциях: 1:1 и 1:2 соответственно. Чтобы сделать вывод, какая из двух реакций протекает, необходимо провести дальнейшие расчеты.
4) В условии сказано, что масса раствора аммиака составляет 125 г. Раствор состоит из воды и аммиака.
Пусть n(NH3) = x моль, а n(H2O) = y моль. Тогда m(NH3) = 17x г, а m(H2O) = 18y г.
Составим первое уравнение системы: 17x + 18y = 125 г
5) Также известно, что массовая доля протонов в ядрах всех атомов составляет 56% от массы раствора. Найдем количество и массу протонов. При этом помним, что количество протонов = порядковому номеру элемента, а молярная масса одного протона составляет 1г/моль.
а) Np+(NH3) = 7 + 1 · 3 = 10 протонов;
Если в 1 моль NH3 содержится 10 · 1 = 10 моль протонов, то в x моль NH3 содержится 10x моль.
m p+(NH3) = 10x · 1 = 10x г;
б) Np+(H2O) = 1 · 2 + 8 = 10 протонов;
Если в 1 моль H2O содержится 10 · 1 = 10 моль протонов, то в y моль H2O содержится 10y моль.
mp+( H2O) = 10y · 1 = 10y г;
в) Составим второе уравнение системы:
0,56 = (10x + 10y)/125 ⇒ 10x + 10y = 70
Составим систему уравнений:
Решая которую находим, что:
y = 6
x = 1
Следовательно:
n(H2O) = y моль = 6 моль,
n(NH3) = x моль = 1 моль
7) Вернемся к действию 3) и сравним количества веществ, но для этого нам сначала необходимо найти количество оставшегося аммиака, так как его часть ушла на первую реакцию.
а) n1(NH3) = 3n(AlCl3) = 3 · 0,3 = 0,9 моль
nост.(NH3) = 1 – 0,9 = 0,1 моль;
б) n(SO2) : n(NH3) = 0,1 : 0,1 = 1 : 1 – следовательно, реакция протекает до образования кислой соли.
SO2 + NH3 + H2O = NH4HSO3 (II)

а) n(NH4Cl) = 3n(AlCl3) = 3 · 0,3 = 0,9 моль
m(NH4Cl) = 0,9 · 53,5 = 48,15 г;
б) n(NH4HSO3) = n(SO2) = 0,1 моль,
m(NH4HSO3) = 0,1 · 99 = 9,9 г;
9) Напишем уравнение массы конечного раствора. Помним, что масса раствора – это всё, что смешали, минус образовавшиеся газы и осадки.
mконечн. р-ра = mр-ра(NH3) + m(AlCl3) – m(Al(OH)3) + m(SO2)
Вычислим недостающие данные:
а) n(Al(OH)3) = n(AlCl3) = 0,3 моль
m(Al(OH)3) = 0,3 · 78 = 23,4 г;
б) m(SO2) = 0,1 · 64 = 6,4 г;
в) Найдем массу конечного раствора:
mконечн. р-ра = 125 + 40,05 – 23,4 + 6,4 = 148,05 г
Найдем массовую долей солей в образовавшемся растворе:
ꞷ(NH4Cl) = (48,15/148,05) · 100% = 32,5% ;
ꞷ(NH4HSO3) = (9,9/148,05) · 100% = 6,69%
Ответ: ꞷ(NH4Cl) = 32,5%; ꞷ(NH4HSO3) = 6,69% .
Задание №6
Пластинку, сделанную из сплава цинка со свинцом, в которой общее число электронов в атомах металлов в 56 раз больше числа Авогадро, поместили в 100 г раствора хлорида олова(II). После того как хлорид олова(II) прореагировал полностью, пластинку с выделившимся на ней металлом извлекли из раствора. В результате общее число электронов в атомах трёх металлов пластинки увеличилось на 12,5% по сравнению с числом электронов в атомах металлов исходной пластинки. К оставшемуся раствору добавили 480 г 20%-ного раствора гидроксида натрия. Вычислите массовую долю щёлочи в конечном растворе. Процессом гидролиза солей пренебречь.
Решение
Ответ: ꞷост.(NaOH) = 7,13%
Пояснение:
1) Для начала можно записать уравнение первой реакции (понятно, что реагировать из двух металлов пластинки будет цинк, так как он активнее):
Zn + SnCl2 = ZnCl2 + Sn (I)
Уравнение второй реакции сразу записать нельзя, так как она может протекать по двум направлениям:
ZnCl2 + 4NaOH = Na2[Zn(OH)4] + 2NaCl либо ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl
Обратим внимание на соотношение реагентов: 1:4 и 1:2 — и на основании дальнейших расчетов сделаем вывод о том, какая реакция протекает.
По условию, общее число электронов пластинки в 56 раз больше числа Авогадро. Записать это можно следующим образом:
n(e) = N/NA , где N = 56NA , то есть: n(e) = 56NA/NA = 56 моль, то есть общее количество электронов в Zn-Pb пластинке равно 56 моль.
Пусть n(Zn) = x моль, а n(Pb) = y моль. Помним, что количество электронов в атоме химического элемента точно такое же, как и количество протонов и численно равно порядковому номеру элемента.
В таком случае, количество вещества электронов в металлическом цинке будет равно:
ne(Zn) = N(e—)·n(Zn) = 30x моль,
а количество вещества электронов в металлическом свинце будет равно:
ne(Pb) = 82y моль
Тогда, суммарное количество вещества электронов пластинки из цинка и свинца будет равно:
ne(Zn/Pb пластинки) = (30x + 82y) моль,
в то же время мы знаем, что ne(Zn/Pb пластинки) = 56 моль, отсюда следует первое уравнение системы:
30x + 82y = 56
Известно, что общее число электронов в пластинке из трёх металлов на 12,5% по сравнению больше по сравнению с числом электронов в атомах металлов исходной пластинки из двух металлов.
Тогда, изменение количества вещества электронов пластинки после реакции будет равно:
Δne(пластинки) =56 · 0,125 = 7,
а общее количество электронов в пластинке из трех металлов (после реакции):
ne(пластинки Zn-Pb-Sn) = 56 + 7 = 63 – общее количество электронов пластинки после реакции.
Изменение количества электронов пластинки произошло из-за того, что часть цинка с пластинки ушла в раствор, а часть олова из раствора соли выделилась на пластинке.
Количество электронов в исходной пластинке:
Ne исходной пл. = Ne(Pb) + Ne исх.(Zn),
а количество вещества электронов в исходной пластинке:
ne исходной пл. = ne(Pb) + ne исх.(Zn),
Количество электронов в конечной пластинке:
Ne конечной пл. = Ne(Pb) + Ne исх.(Zn) – Ne прореаг.(Zn) + Ne(Sn),
а количество вещества электронов в конечной пластинке:
ne конечной пл. = ne(Pb) + ne исх.(Zn) – ne прореаг.(Zn) + Ne(Sn),
Тогда, разница количества вещества электронов может быть записано как:
Δne(пластинки) = ne конечной пл. — ne исходной пл. = (ne(Pb) + ne исх.(Zn) – ne прореаг.(Zn) + Ne(Sn)) — (ne(Pb) + ne исх.(Zn)) = ne(Pb) + ne исх.(Zn) – ne прореаг.(Zn) + Ne(Sn) — ne(Pb) — ne исх.(Zn) = — ne прореаг.(Zn) + ne(Sn) = ne(Sn) — ne прореаг.(Zn)
т.е. Δne(пластинки) = ne(Sn) — ne прореаг.(Zn)
Из уравнения реакции I можно сделать вывод, что количество вещества осевшего Sn равно количеству прореагировавшего Zn. Пусть n(Sn) = nпрореаг.(Zn) = z моль.
Тогда количество вещества электронов в образовавшемся олове будет равно:
ne(Sn) = 50z моль,
а количество вещества электронов в прореагировавшем цинке будет равно:
ne прореаг.(Zn) = 30z моль.
Таким образом,
Δne(пластинки) = ne(Sn) — ne прореаг.(Zn) = 50z — 30z = 20z моль,
в то же время:
Δne(пластинки) = 7 моль,
следовательно:
7 = 20z
z = 0,35,
а n(Sn) = nпрореаг.(Zn) = n1(ZnCl2) = 0,35 моль,
Перейдем теперь к расчету соотношения щелочи и хлорида цинка.
а) mисх.(NaOH) = 480 · 0,2 = 96 г
nисх.(NaOH) = 96/40 = 2,4 моль;
б) nисх.(NaOH)/n(ZnCl2)= 2,4/0,35 = 6,9
Следовательно, можно сделать вывод, что NaOH находится в избытке, поэтому реакция будет протекать по пути комплексообразования:
ZnCl2 + 4NaOH = Na2[Zn(OH)4] + 2NaCl (II)
Рассчитаем количество вещества и массу непрореагировавшего гидроксида натрия:
а) nпрореаг.(NaOH) = 4n(ZnCl2) = 0,35 · 4 = 1,4 моль
nост.(NaOH) = 2,4 – 1,4 = 1 моль;
б) mост.(NaOH) = 1 · 40 = 40 г
Напишем выражение массы конечного раствора:
mконечн. р-ра = mр-ра(SnCl2) + mушедш.(Zn) – mосевш.(Sn) + mр-ра(NaOH)
mконечн. р-ра = 100 + (65 · 0,35) – (119 · 0,35) + 480 = 561,1 г
Рассчитаем массовую долю щелочи в конечном растворе:
ꞷост.(NaOH)= (40/561,1) · 100% = 7,13%
Ответ: ꞷост.(NaOH) = 7,13%
Задание №7
Смесь фосфида и нитрида лития, в которой масса протонов в ядрах всех атомов составляет 46% от общей массы смеси, растворили в 200 г 36,5%-ной соляной кислоты. При этом выделилось 5,6 л (н.у.) газа. Вычислите массовую долю кислоты в конечном растворе.
Решение
Ответ: ꞷост.(HCl) = 7,766%
Можем сразу записать уравнения реакций:
Li3P + 3HCl = 3LiCl + PH3 (I)
Li3N + 4HCl = 3LiCl + NH4Cl (II)
Найдем количество вещества и массу фосфина:
n(PH3) = 5,6/22,4 = 0,25 моль
m(PH3) = 0,25 · 34 = 8,5 г
По условию, масса протонов в ядрах всех атомов составляет 46%. Напишем уравнение:
ꞷp+ = (mp+(Li3N + Li3P)/ m(Li3N + Li3P)
Найдем недостающие данные.
а) n(Li3P) = n(PH3) = 0,25 моль
m(Li3P) = 0,25 · 52 = 13 г;
б) Пусть n(Li3N) = x моль, тогда m(Li3N) = 35x г
в) Найдем количество и массу протонов в смеси. При этом помним, что количество протонов = порядковому номеру элемента, а молярная масса одного протона составляет 1г/моль.
np+ = Np+ · n(в-ва)
Np+(Li3P) = 3 · 3 + 15 = 24
Np+(Li3N) = 3 · 3 + 7 = 16
np+(Li3P) = 24 · 0,25 = 6 моль, mp+(Li3P) = 6 г;
np+(Li3N) = 16x моль, mp+(Li3N) = 16x г;
Решим уравнение:
0,46 = (6 + 16x)/(35x + 13) ⇒ 16x + 6 = 16,1x + 5,98 ⇒ 0,02 = 0,1x ⇒ x = 0,2 моль — n(Li3N).
Найдем сразу массу нитрида лития: m(Li3N) = 35 · 0,2 = 7 г
Найдем массу и количество оставшейся соляной кислоты:
а) m(HCl) = 200 · 0,365 = 73 г
n(HCl) = 73/36,5 = 2 моль;
б) n1(HCl) = 3n(Li3P) = 3 · 0,25 = 0,75 моль
n2(HCl) = 4n(Li3N) = 4 · 0,2 = 0,8 моль
nобщ.(HCl) = 0,75 + 0,8 = 1,55 моль;
в) nост.(HCl) = 2 – 1,55 = 0,45 моль
mост.(HCl) = 0,45 · 36,5 = 16,425 г
Найдем массу раствора. Помним, что масса раствора – это всё, что смешали, минус образовавшиеся газы и осадки:
mконечн. р-ра = m(Li3N) + m(Li3P) + mр-ра(HCl) – m(PH3)
mконечн. р-ра = 13 + 7 + 200 – 8,5 = 211,5 г
Найдем ꞷост.(HCl):
ꞷост.(HCl) = (16,425/211,5) · 100% = 7,766%
Ответ: ꞷост.(HCl) = 7,766%
Задание №8
В 800 г раствора нитрата серебра, в котором общее число атомов в 110 раз больше числа Авогадро, внесли 16 г порошка меди. К образовавшемуся раствору добавили 200 г 30%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в конечном растворе.
Решение
Ответ: ꞷост.(NaOH) = 2,27%
Пояснение:
Напишем уравнения реакции:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag (I)
Cu(NO3)2 + 2NaOH = Cu(OH)2 + 2NaNO3 (II)
Найдем количества веществ, данных в условии:
а) n(Cu) = 16/64 = 0,25 моль
б) m(NaOH) = 200 · 0,3 = 60 г
n(NaOH) = 60/40 = 1,5 моль
По условию, общее число атомов в 110 раз больше числа Авогадро, это можно записать так:
n(атомов) = N/NA , где N = 110NA , то есть: n(ат.) = 110NA/NA = 110 моль, то есть общее количество атомов равно 110 моль.
Понимаем, что в задаче говорится именно о количестве атомов – это значит, что 1 молекула H2O содержит в сумме 3 атома: 2 атома водорода и 1 атом кислорода.
n(ат.) = n(в-ва) · N
а) Обозначим n(H2O) как x моль, тогда m(H2O) = 18x г.
Если в 1 моль H2O mатомов = (2 ·1 +1) · 1 = 3г, то в x моль H2O mатомов = (2 · 1 + 1) · x = 3x г;
б) Обозначим n(AgNO3) как y моль, тогда m(AgNO3) = 170y г
Если в 1 моль AgNO3 mатомов = (1 + 1 + 3) · 1 = 5г, то в y моль AgNO3 mатомов = (1 + 1 + 3) · y = 5y г.
Составим систему уравнений:
y = 1 моль — n(AgNO3)
x = (110 – 5)/3 = 35 моль – n(H2O)
По реакции I, n(AgNO3) – в избытке, так как n1(AgNO3) = 2n(Cu) = 0,25 · 2 = 0,5 моль
nост.(AgNO3) = 1 – 0,5 = 0,5 моль
Следовательно, будет протекать следующая реакция:
2AgNO3 + 2NaOH = Ag2O + 2NaNO3 + H2O (III)
Найдем количество вещества и массу оставшегося NaOH:
а) n2(NaOH) = 2n(Cu(NO3)2) = 2n1(Cu) = 0,5 моль
n3(NaOH) = n(AgNO3) = 0,5 моль
nост.(NaOH) = 1,5 – 0,5 – 0,5 = 0,5 моль;
б) mост.(NaOH) = 0,5 · 40 = 20 г;
Составим уравнение массы конечного раствора. Помним, что масса раствора – это всё, что смешали, минус образовавшиеся газы и осадки:
mконеч. р-ра = mр-ра(AgNO3) + m(Cu) – m(Ag) + mр-ра(NaOH) – m(Cu(OH)2) – m(Ag2O)
Найдем недостающие данные:
а) n(Ag) = 2n(Cu) = 0,5 моль
m(Ag) = 108 · 0,5 = 54 г;
б) n2(Cu(OH)2) = n(Cu(NO3)2) = 0,25 моль
m(Cu(OH)2) = 0,25 · 98 = 24,5 г;
в) n(Ag2O) = 0,5n3(AgNO3) = 0,5 · 0,5 = 0,25моль
m(Ag2O) = 0,25 · 232 = 58 г;
г) mконеч. р-ра = 800 + 16 – 54 + 200 – 24,5 – 58 = 879,5 г
Найдем ꞷост.(NaOH):
ꞷост.(NaOH) = (20/879,5) · 100% = 2,27%
Ответ: ꞷост.(NaOH) = 2,27%
Задание №9
Смесь нитрата железа(II) и нитрата железа(III), в которой масса протонов в ядрах всех атомов составляет 49,07% от общей массы смеси, прокалили до постоянной массы. Твёрдый остаток растворили в избытке соляной кислоты. При этом образовалось 299 г раствора с массовой долей соли 25%. Вычислите массу исходной смеси нитратов.
Решение
Ответ: mсмеси = 98,92 г
Пояснение:
Запишем уравнения реакций:
4Fe(NO3)2 = 2Fe2O3 + 8NO2 + O2 (I)
4Fe(NO3)3 = 2Fe2O3 + 12NO2 + 3O2 (II)
Fe2O3 + 6HCl = 2FeCl3 + 3H2O (III)
Найдем массу и количество FeCl3. Так как смесь прокалили до постоянной массы, разложение полное и твердый остаток составляет только хлорид железа (III).
m(FeCl3) = 299 · 0,25 = 74,75 г
n(FeCl3) = 74,75/162,5 = 0,46 моль
По условию масса протонов составляет 0,4907 от общей массы смеси, по сути, та же массовая доля протонов. Составим для нее уравнение:
0,4907 = (mp+(Fe(NO3)2 + Fe(NO3)3))/m(Fe(NO3)2 + Fe(NO3)3)
а) Помним, что молярная масса одного протона составляет 1г/моль. Найдем массу протонов в ядрах смеси.
а) Обозначим n(Fe(NO3)3) за x моль, тогда m(Fe(NO3)3) = 242x г. А n(Fe(NO3)2) за y моль, тогда m(Fe(NO3)2) = 180y г.
б) np+ = Np+ · n(в-ва)
Np+(Fe(NO3)3) = 26 + 21 + 72 = 119; Np+(Fe(NO3)2) = 26 + 14 + 48 = 88;
mp+(Fe(NO3)3) = 119x г; mp+(Fe(NO3)2) = 88y г;
в) Составим 1ое уравнение системы:
0,4907 = (119x + 88y)/(242x + 180y) ⇒ 0,4907(242x + 180y) = 119x + 88y
Обратим внимание, что FeCl3 образуется из Fe2O3, который образуется после разложения двух нитратов.
n(Fe2O3) = 2/4n(Fe(NO3)3) + 2/4n(Fe(NO3)2) = 0,5(n(Fe(NO3)3) + n(Fe(NO3)2)) = 0,5(x + y) – моль;
n(FeCl3) = 2n(Fe2O3) = 2 · 0,5(x + y) = x + y = 0,46 моль – 2о-е уравнение системы.
Решим систему уравнений:
y = 0,2, т.е. n(Fe(NO3)2) = 0,2 моль,
x = 0,26, т.е. n(Fe(NO3)3) = 0,26 моль
Найдем массу смеси:
m(Fe(NO3)3) + m(Fe(NO3)2) = 242 · 0,26 + 180 · 0,2 = 62,92 + 36 = 98,92 г
Ответ: mсмеси = 98,92 г
Задание №10
Смесь нитрата натрия и нитрата серебра общей массой 42,5 г, в которой масса протонов в ядрах всех атомов составляет 48% от массы смеси, прокалили до постоянной массы. Выделившуюся смесь газов пропустили через 10 мл воды. Вычислите массовую долю растворённого вещества в образовавшемся растворе.
Решение
Ответ: ꞷ(HNO3) = 40,9%
Пояснение:
2NaNO3 = 2NaNO2 + O2 (I)
2AgNO3 = 2Ag + 2NO2 + O2 (II)
4NO2 + O2 + 2H2O = 4HNO3 (III)
1) По условию, масса смеси составляет 42,5 г, составим 1ое уравнение системы:
Пусть n(NaNO3) = x моль, тогда m(NaNO3) = 85x г;
Пусть n(AgNO3) = y моль, тогда m(AgNO3) = 170y г;
Составим первое уравнение системы: 85x + 170y = 42,5 г
2) Найдем количество и массу протонов в ядрах смеси. При этом помним, что для атома химического элемента количество протонов совпадает с порядковым номером элемента, а молярная масса одного протона составляет 1г/моль.
а) np+ = Np+ · n(в-ва)
Np+(NaNO3) = 11 + 7 + 24 = 42
np+(NaNO3) = 42x моль; mp+(NaNO3) = 42x · 1 = 42x г
Np+(AgNO3) = 47 + 7 + 24 = 78
np+(AgNO3) = 78y моль; mp+(AgNO3) = 78y · 1 = 78y г
б) Составим второе уравнение системы:
0,48 = (mp+(NaNO3 + AgNO3))/m(NaNO3 + AgNO3)
0,48 = (42x + 78y)/(85x + 170y) ⇒ 3y = x
3) Составим и решим систему уравнений:
y = 0,1, т.е. n(AgNO3) = 0,1 моль,
x = 0,3, т.е. n(NaNO3) = 0,3 моль
4) Сравним количества NO2 и O2 в реакции (III):
а) nобщ.(O2) = 0,5n(NaNO3) + 0,5 n(AgNO3) = 0,15 + 0,05 = 0,2 моль
n(NO2) = n(AgNO3) = 0,1 моль;
б) n(NO2)/4 < n(O2)/1 , так как 0,025 < 0,2 – следовательно n(NO2) в недостатке, расчет будем вести по нему.
5) Найдем n(O2), которое израсходовалось в реакции.
n(O2) = 1/4n(NO2) = 1/4 ·0,1 = 0,025 моль
m(O2) = 0,025 · 32 = 0,8 г;
6) Найдем количество и массу HNO3:
n(HNO3) = n(NO2) = 0,1 моль
m(HNO3) = 0,1 · 63 = 6,3 г;
7) Найдем массу раствора:
mконеч. р-ра = m(NO2) + mистр.(O2) + m(H2O)
а) Найдем недостающие данные:
m(NO2) = 0,1 · 46 = 4,6 г
m(H2O) = V(H2O) · ρ(H2O) = 10 · 1 = 10г;
б) mконеч. р-ра = 4,6 + 0,8 + 10 = 15,4 г;

ꞷ(HNO3) = (6,3/15,4) · 100% = 40,9%
Ответ: ꞷ(HNO3) = 40,9%
Задание №11
Смесь нитрата магния и нитрата серебра, в которой масса протонов в ядрах всех атомов составляет 48,32% от общей массы смеси, прокалили до постоянной массы. Выделившуюся смесь газов пропустили через 800 мл воды. При этом объём непоглотившегося газа составил 13,44 л (н.у.). Вычислите массовую долю растворённого вещества в образовавшемся растворе.
Решение
Ответ: ꞷ(HNO3) = 48,1 %
Пояснение:
2Mg(NO3)2 = 2MgO + 4NO2 + O2
2AgNO3 = 2Ag + 2NO2 + O2
4NO2 + O2 + 2H2O = 4HNO3
1) По условию, масса протонов в ядрах всех атомов составляет 46%. Напишем уравнение:
ꞷp+ = (mp+(Mg(NO3)2 + AgNO3)/m(Mg(NO3)2 + AgNO3)
Найдем недостающие данные.
Пусть n(Mg(NO3)2) = x моль, тогда m(Mg(NO3)2) = 148x г
Пусть n(AgNO3) = y моль, тогда m(AgNO3) = 170y г;
2) Найдем количество и массу протонов в смеси. При этом помним, что количество протонов = порядковому номеру элемента, а молярная масса одного протона составляет 1г/моль.
а) np+ = Np+ · n(в-ва)
np+(Mg(NO3)2) = (12 + 14 + 48)x = 74x моль
np+(AgNO3) = (47 + 7 + 24)y = 78y моль
б) mp+ = np+ · 1г/моль
mp+(Mg(NO3)2) = 74x г;
mp+(AgNO3) = 78y г
3) Решим уравнение:
0,4832 = (74x + 78y)/(148x + 170y) ⇒ 2,49x = 4,14y ⇒ x = 1,66y
4) Найдем и сравним количества веществ в 3 реакции, при этом примем x = 1,66y:
а) nобщ.(NO2) = 2n(Mg(NO3)2) + n(AgNO3) = 2x + y = 4,32y моль
nобщ.(O2) = 0,5n(Mg(NO3)2) + 0,5n(AgNO3) = 0,5(x+y) = 1,33y моль
б)n(NO2)/4 < n(O2)/1, так как 1,08y < 1,32y – следовательно, n(NO2) в недостатке, расчет будем вести по нему.
P.S. А вообще можно было бы избежать этих всех расчетов и просто оценить избыток/недостаток по соотношению коэффициентов в реакции. Обратим внимание, что в 3й реакции соотношение
n(NO2) : n(O2) = 4 : 1
В 1о-й реакции соотношение n(NO2) : n(O2) такое же (4 : 1) – это значит, что вещества истратились полностью.
Во 2о-й реакции соотношение n(NO2) : n(O2) = 2 : 1 (или 4 : 2) – это значит, что NO2 истратился полностью, а часть O2 нет, соответственно n(O2) – в избытке.
nост.(O2) = 13,44/22,4 = 0,6 моль
Составим уравнение для nобщ.(O2):
nобщ.(O2) = nреаг.(О2) + nост.(О2)
nреаг.(О2) = 1/4n(NO2) = (2x + y)/4 моль
0,5x + 0,5y = (2x + y)/4 + 0,6 ⇒ y = 2,4 моль – n(AgNO3).
x = 1,66 · 2,4 = 3,98 = 4 моль – n(Mg(NO3)2);
Найдем количество и массу HNO3:
n(HNO3) = n(NO2) = 2 · 4 + 2,4 = 10,4 моль
m(HNO3) = 10,4 · 63 = 655,2 г;
Найдем массу раствора:
mконеч. р-ра = m(NO2) + mистр.(O2) + m(H2O)
а) Найдем недостающие данные:
m(NO2) = 10,4 · 46 = 478,4 г
m(H2O) = V(H2O) · ρ(H2O) = 800 · 1 = 800г;
nреаг.(О2) = 1/4n(NO2) = 2,6 моль
mреаг.(О2) = 2,6 · 32 = 83,2 г
б) mконеч. р-ра = 478,4 + 83,2 + 800 = 1361,6 г;

ꞷ(HNO3) = (655,2/1361,6) · 100% = 48,1%
Ответ: ꞷ(HNO3) = 48,1 %
Задание №12
К 112 г 30%-ного раствора гидроксида калия добавили 13 г цинка. После окончания реакции к образовавшемуся раствору прилили 245 г 20%-ного раствора серной кислоты. Известно, что в условиях, при которых была проведена реакция, растворимость сульфата цинка составляет 57,7 г на 100 г воды, растворимость сульфата калия – 12,0 г на 100 г воды. Вычислите массу выпавшего осадка.
Решение
Ответ: m(K2SO4) = 18 г
Пояснение:
Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2 (I)
1) Найдем количества веществ, данных в условии.
а) m(KOH) = 112 · 0,3 = 33,6 г
n(KOH) = 33,6 / 56 = 0,6 моль
б) n(Zn) = 13 / 65 = 0,2 моль
2) Сравним количества реагентов:
n(Zn)/1 < n(KOH)/2, следовательно n(KOH) – в избытке.
nост.(KOH) = 0,6 – n1(KOH) = 0,6 – 2n(Zn) = 0,6 – 0,4 = 0,2 моль
Дальше к полученному раствору добавляют серную кислоту. Обратим внимание, что протекать у нас могут 2 реакции (так как в растворе осталась и комплексная соль, и щелочь). Однако в первую очередь будет протекать реакция нейтрализации, так как ее скорость выше.
2KOH + H2SO4 = K2SO4 + 2H2O (II)
3) Найдем n(H2SO4):
m(H2SO4) = 245 · 0,2 = 49 г
n(H2SO4) = 49 / 98 = 0,5 моль
4) Сравним количества веществ в реакции 2:
n(KOH)/2 < n(H2SO4)/1 , следовательно n(H2SO4) – в избытке. Найдем nост.(H2SO4):
nост.(H2SO4) = 0,5 – n2(H2SO4) = 0,5 – 1/2n2(KOH) = 0,5 – 0,1 = 0,4 моль
5) Сравним соотношение n(K2[Zn(OH)4]) и n(H2SO4):
n1(K2[Zn(OH)4]) = n(Zn) = 0,2 моль
n(H2SO4)/ n(K2[Zn(OH)4]) = 0,4/0,2 = 2/1– следовательно, n(K2[Zn(OH)4]) : n(H2SO4) = 1 : 2
Значит будет протекать следующая реакция:
K2[Zn(OH)4] + 2H2SO4 = K2SO4 + ZnSO4 + 4H2O (III)
6) В условии просят найти массу выпавшего осадка. Так как в «привычный» осадок в уравнениях реакций ничего не выпадает, а в условии дана растворимость двух солей, приходим к выводу, что в осадок будет выпадать одна или две соли (нужно проверить). Здесь необходимо вспомнить понятие о насыщенном растворе. После того, как содержание соли в растворе превышает значение её растворимости при данной температуре, часть соли кристаллизуется и выпадает в осадок.
7) Найдем количества и массу двух солей:
а) n(K2SO4) = n2(K2SO4) + n3(K2SO4) = 1/2n2(KOH) + n(K2[Zn(OH)4]) = 0,1 + 0,2 = 0,3 моль
m(K2SO4) = 0,3 · 174 = 52,2 г
б) n(ZnSO4) = n(K2[Zn(OH)4]) = 0,2 моль
m(ZnSO4) = 0,2 · 161 = 32,2 г

m(H2O) = mконеч. р—ра – m(K2SO4) –m(ZnSO4)
а) mконеч. р—ра = mр—ра(KOH) + m(Zn) – m(H2) + mр—ра(H2SO4)
Найдем недостающие данные:
n(H2) = n(Zn) = 0,2 моль
m(H2) = 0,2 · 2 = 0,4 г
mконеч. р-ра = 112 + 13 – 0,4 + 245 = 369,6 г
б) m(H2O) = 369,6 – 52,2 – 32,2 = 285,2 г
9) Проанализируем растворимость для двух солей. Составим пропорции:
а) для K2SO4: если в 100 г воды растворяется 12 г соли, то в 285,2 г воды растворяется x г соли:
x = (285,2 · 12)/100 = 34,2 г соли способно раствориться. По расчетам в задаче образовалось 52,2 г соли.
52,2 – 34,2 = 18 г – K2SO4 выпадет в осадок.
б) для ZnSO4: если в 100 г воды растворяется 57,7 г соли, то в 285,2 г воды растворяется y г соли:
y = (285,2 · 57,7)/100 = 164,56 г соли способно раствориться. По расчетам в задаче образовалось 32,2г соли. Масса образовавшейся соли не превышает растворимость, поэтому ZnSO4 в осадок не выпадает.
Ответ: m(K2SO4) = 18 г
Задание №13
Алюминий массой 8,1 г сплавили с 9,6 г серы. Полученную смесь растворили в 96 г насыщенного раствора гидроксида натрия. Вычислите массу выпавшего осадка. Растворимость гидроксида натрия составляет 100 г на 100 г воды, растворимость сульфида натрия в условиях реакции – 20,6 г на 100 г воды.
Решение
Ответ: m(Na2S) = 14,62 г
Пояснение:
1) Для начала сравним количества веществ в 1ой реакции и определим, какое из них находится в избытке.
а) n(Al) = 8,1 / 27 = 0,3 моль
n(S) = 9,6 / 32 = 0,3 моль
б)n(S)/3 < n(Al)/2 , так как 0, 1 < 0,15 – следовательно, n(Al) – избыток, n(S) – недостаток.
Сразу определим nост.(Al) и nобр.(Al2S3)
nост.(Al) = 0,3 – 2/3n(S) = 0,3 – 0,2 = 0,1 моль;
nобр.(Al2S3) = 1/3n(S) = 1/3 · 0,3 = 0,1 моль;
2) Полученную смесь веществ составляют 0,1 моль Al и 0,1 моль Al2S3. Запишем реакции:
Al2S3 + 8NaOH = 2Na[Al(OH)4] + 3Na2S (II)
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2 (III)
3) Найдем количество NaOH. В условии дана его растворимость, а также сказано о том, что раствор насыщенный. По растворимости найдем массу NaOH.
ρ(NaOH) = 100 г на 100 г воды, можно записать это в расчете на массу раствора, то есть 100 г (NaOH) на 200 г раствора NaOH. Составим пропорцию:
Если в 200 г насыщенного раствора растворяется 100 г NaOH, то в 96 г насыщенного раствора растворяется x г NaOH.
x = (100 · 96) / 200 = 48 г – m(NaOH)
n(NaOH) = 48 / 40 = 1,2 моль
4) Найдем nост.(NaOH):
nост.(NaOH) = 1,2 – n2(NaOH) – n3(NaOH) = 1,2 – 8n(Al2S3) – n3(Al) = 1,2 – 0,8 – 0,1 = 0,3 моль
mост.(NaOH) = 40 · 0,3 = 12 г
5) В условии просят найти массу выпавшего осадка. Так как в «привычный» осадок в уравнениях реакций ничего не выпадает, а в условии дана растворимость NaOH и Na2S, приходим к выводу, что в осадок будут выпадать оба вещества или одно из них. Также необходимо вспомнить понятие о насыщенном растворе. После того, как содержание соли в растворе превышает значение её растворимости при данной температуре, часть соли кристаллизуется и выпадает в осадок.
6) Найдем m(Na2S):
n(Na2S) = 3n(Al2S3) = 0,1 · 3 = 0,3 моль
m(Na2S) = 0,3 · 78 = 23,4 г
7) Так как в условии растворимость дается на 100 г воды, необходимо найти массу воды в конечном растворе.
m(H2O) = mконеч. р-ра – m(Na2S) – m(Na[Al(OH)4]) – mост.(NaOH)
а) mконеч. р-ра = m(Al) + m(S) – m(H2) + mр-ра(NaOH)
Найдем недостающие данные:
n(H2) = 3/2n3(Al) = 3/2 · 0,1 = 0,15 моль
m(H2) = 0,15 · 2 = 0,3 г
n(Na[Al(OH)4]) = 2n(Al2S3) + n(A
mконеч. р-ра = 8,1 + 9,6 – 0,3 + 96 = 113,4 г
б) m(H2O) = 113, 4 – 23,4 – 35,4 – 12 = 42,6 г

а) для Na2S: если в 100 г воды растворяется 20,6 г соли, то в 42,6 г воды растворяется x г соли:
x = (20,6 · 42,6)/100 = 8,78 г соли способно раствориться. По расчетам в задаче образовалось 23,4 г соли.
23,4 – 8,78 = 14,62 г – K2SO4 выпадет в осадок.
б) для NaOH: если в 100 г воды растворяется 100 г гидроксида , то в 42,6 г воды растворяется y г NaOH:
y = (42,6 ·100 )/100 = 42,6 г соли способно раствориться. По расчетам в задаче образовалось 12 г NaOH. Масса образовавшегося NaOH не превышает растворимость, поэтому NaOH в осадок не выпадает.
Ответ: m(Na2S) = 14,62 г
Задание №14
Кристаллогидрат нитрата железа(II), в котором массовая доля протонов в ядрах всех атомов составляет 52,05%, прокалили до постоянной массы. Твёрдый остаток растворили в 300 г йодоводородной кислоты, взятой в избытке. Через образовавшуюся смесь пропустили сернистый газ, при этом прореагировало 2,24 л (н.у.) газа. Вычислите массовую долю соли йодоводородной кислоты в конечном растворе и массу исходного кристаллогидрата.
Решение
Ответ: m(Fe(NO3)2 ∙ 9H2O) = 68,4 г; ꞷ(FeI2) = 19,23%
Пояснение:
Записать разложение кристаллогидрата сразу мы не можем, так как нам неизвестно соотношение безводной соли и воды в кристаллогидрате, но мы можем записать его в общем виде для начала. Важно(!) в конце всех расчетов не забыть записать правильное уравнение:
4Fe(NO3)2 ∙ nH2O = 2Fe2O3 + 8NO2 + O2 + 4nH2O (I)
Дальше можем записать остальные уравнения:
Fe2O3 + 6HI = 2FeI2 + I2 + 3H2O (II)
SO2 + I2 + 2H2O = H2SO4 + 2HI (III)
Можем сразу найти n(SO2):
n(SO2) = 2,24 / 22,4 = 0,1 моль
Далее найдем n(I2), n(Fe2O3), так как они взаимосвязаны:
n(I2) = n(SO2) = 0,1 моль
n(Fe2O3) = n(I2) = 0,1 моль
По количеству оксида железа (III) найдем количество безводной соли в кристаллогидрате и заодно ее массу:
n(Fe(NO3)2) = 4/2n(Fe2O3) = 2 · 0,1 = 0,2 моль
m(Fe(NO3)2) = 0,2 · 180 = 36 г
Известно, что массовая доля протонов в ядрах всех атомов кристаллогидрата составляет 52,05%. Составим уравнение для неё:
ꞷp+ = mp+(Fe(NO3)2) · mp+(H2O) / m(Fe(NO3)2 ∙ nH2O)
Пусть n(H2O) = x моль, тогда m(H2O) = 18x г
Найдем количество и массу протонов в ядрах кристаллогидрата. При этом помним, что количество протонов = порядковому номеру элемента, а молярная масса одного протона составляет 1г/моль.
а) np+ = Np+ ∙ n(в-ва)
np+(Fe(NO3)2) = (26 + 14 + 48) · 0,2 = 17,6 моль
np+(H2O) = (2 + 8)x = 10x моль
б) mp+ = np+ · 1г/моль
mp+( Fe(NO3)2) = 17,6 г;
mp+(H2O) = 10x г
Решим уравнение:
0, 5205 = (17,6 + 10x) / (36 + 18x)
18,738 + 9,369x = 17,6 + 10x
1,138 = 0,631x
x = 1,8 моль – n(H2O) в кристаллогидрате, m(H2O) = 1,8 · 18 = 32,4 г
Найдем общую массу кристаллогидрата, а затем его молярную массу, так как зная молярную массу можно вывести его формулу. При этом помним, что количество кристаллогидрата равно количеству его безводной соли, так как в 1 формульной единице кристаллогидрата содержится 1 формульная единица безводной соли.
m(Fe(NO3)2∙nH2O) = m(Fe(NO3)2) + m(H2O) = 36 + 32,4 = 68,4 г
M(Fe(NO3)2∙nH2O) = m/n
M(Fe(NO3)2∙nH2O) = 68,4/0,2 = 342 (г/моль).
Учитывая, что M(Fe(NO3)2∙nH2O) = M(Fe(NO3)2) + M(H2O) – найдем молярную массу воды, а из нее и количество молекул воды в кристаллогидрате.
M(H2O) = 342 – 180 = 162 (г/моль), N(H2O) = 162/18 = 9 молекул воды содержит 1 формульная единица кристаллогидрата.
Формула кристаллогидрата: Fe(NO3)2∙9H2O. Не забываем уравнять 1-ую реакцию(!)
4Fe(NO3)2∙9H2O = 2Fe2O3 + 8NO2 + O2 + 36H2O
Найдем количество и массу соли йодоводородной кислоты – FeI2:
n(FeI2) = 2n(Fe2O3) = 2 · 0,1 = 0,2 моль
m(FeI2) = 0,2 · 310 = 62 г
Найдем массу конечного раствора. При этом помним, что для расчета массы раствора необходимо сложить массы всех добавленных субстанций и вычесть из этого массу всех газов и осадков. Обратим внимание, что выпавший йод в реакции (II), израсходовался в реакции (III). Фактически это означает, что массу йода надо сначала вычесть затем прибавить при расчете массы раствора. То есть при расчете массы раствора массу йода можно не использовать.
mконеч. р-ра = m(Fe2O3) + mр-ра(HI) + m(SO2)
Найдем недостающие данные:
m(SO2) = 0,1 · 64 = 6,4 г
m(Fe2O3) = 0,1 · 160 = 16 г
mконеч. р-ра = 16 + 300 + 6,4 = 322,4 г
Найдем массовую долю FeI2:
ꞷ(FeI2) = (62/322,4) · 100% = 19,23% .
Ответ: m(Fe(NO3)2 ∙ 9H2O) = 68,4 г; ꞷ(FeI2) = 19,23%
Задание №15
Через 440 г раствора нитрата меди(II), в котором 52,5% от общей массы раствора составляет масса протонов в ядрах всех атомов, пропускали электрический ток, используя инертные электроды. После того как на аноде выделилось 6,72 л (н.у.) газа электрический ток отключили, а электроды оставили в растворе. Определите массовую долю всех протонов в растворе после окончания всех реакций.
Решение
Ответ: ꞷp+ = 52,78%
Пояснение:
Запишем уравнение реакции электролиза:
2Cu(NO3)2 + 2H2O = 2Cu + O2 + 4HNO3 (I)
1) По условию, масса протонов в ядрах всех атомов составляет 52,5% от общей массы раствора. Найдем массу протонов:
(440/100) · 52,5 = 231 г
Пусть n(Cu(NO3)2) = x моль, m(Cu(NO3)2) = 188x г.
Пусть n(H2O) = y моль, m(H2O) = 18y г.
Составим первое уравнение системы: 188x + 18y = 440
Найдем количество протонов в ядрах всех атомов. При этом помним, что количество протонов численно равно порядковому номеру элемента в периодической системе, а молярная масса протона составляет 1г/моль.
а) np+ = Np+ ∙ n(в-ва)
np+(Cu(NO3)2) = (29 + 14 + 48) · x = 91x моль
np+(H2O) = (2 + 8)y = 10y моль
б) mp+ = np+ · 1г/моль
mp+(Cu(NO3)2) = 91x г;
mp+(H2O) = 10y г
Составим второе уравнение системы: 91x + 10y = 231
2) Решим систему уравнений:
24,2x = 24,2
x = 1 моль – n(Cu(NO3)2)
y = 14 моль – n(H2O)
3) Дальше необходимо проверить, идет ли далее электролиз воды. Для этого нам необходимо рассчитать количество выделившегося на аноде газа и сравнить его с тем количеством, которое бы выделилось, если бы электролиз соли прошел полностью.
n(газа) = 6,72/22,4 = 0,3 моль
n1(O2) = 0,5n(Cu(NO3)2) = 0,5 · 1 = 0,5 моль
0,3 < 0,5 – из чего делаем вывод, что электролиза воды не было, но электролиз соли прошел не полностью, и часть её осталась в растворе.
4) В условии сказано, что электроды после окончания электролиза оставили в растворе, поэтому кислота из анодного пространства стала растворять медь, образовавшуюся на катоде.
5) Чтобы записать следующую реакцию, необходимо знать концентрацию азотной кислоты, так как реакция может протекать с образованием NO либо NO2.
Обратим внимание, что количество веществ в 1ой реакции дальше нужно считать по количеству выделившегося кислорода, так как он в недостатке.
n(HNO3) = 4n(O2) = 0,3 · 4 = 1,2 моль
m(HNO3) = 1,2 · 63 = 75,6 г
Найдем массу раствора после1ой реакции:
mр—ра 1 = mр—ра(Cu(NO3)2) – m(Cu) – m(O2)
mр-ра 1 = 440 – (2n(O2) ·64) – (0,3 · 32) = 440 – 38,4 – 9,6 = 392 г
Найдем концентрацию HNO3:
ꞷ(HNO3) = (75,6/392) · 100% = 19,28% — следовательно, кислота разбавленная, поэтому растворение меди протекает с образованием NO.
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O (II)
6) Сравним количества меди и азотной кислоты и определим избыток/недостаток.
n(HNO3)/8 < n(Cu)/3 = 1,2/8 < 0,6/3 = 0,15 < 0,2 – следовательно, HNO3 в недостатке.
Найдем количество и массу прореагировавшей меди:
n2(Cu) = 3/8n(HNO3) = 0,45 моль
m2(Cu) = 0,45 · 64 = 28,8 г
7) В задаче просят найти массовую долю протонов в растворе после окончания всех реакций. Для начала нам необходимо определиться с тем, какие вещества остались в растворе. Это: нитрат меди (II) и вода.
а) Найдем общее количество и массу нитрата меди(II):
nобщ.(Cu(NO3)2) = n1 ост.(Cu(NO3)2) + n2 обр.(Cu(NO3)2)
nобщ.(Cu(NO3)2) = (1 – 2n1(O2)) + 3/8n(HNO3) = 1 – 0,6 + 0,45 = 0,85 моль
mобщ.(Cu(NO3)2) = 0,85 · 188 = 159,8 г
б) Найдем общее количество воды:
m(H2O) = mконечн. р-ра – m(Cu(NO3)2)
mконечн. р-ра = mр-ра 1 + mпрореаг.(Cu) – m(NO)
mконечн. р-ра = 392 + 28,8 – (2/8n(HNO3) · 30) = 392 + 28,8 – 9 = 411,8 г
m(H2O) = 411, 8 – 159,8 = 252 г
n(H2O) = 252/18 = 14 моль

а) np+ = Np+ ∙ n(в-ва)
np+(Cu(NO3)2) = (29 + 14 + 48) · 0,85 = 77,35 моль
np+(H2O) = (2 + 
б) mp+ = np+ · 1г/моль
mp+(Cu(NO3)2) = 77,35 г;
mp+(H2O) = 140 г
9) Найдем ꞷp+:
ꞷp+ = (77,35 + 140)/411,8 · 100% = 52,78% .
Ответ: ꞷp+ = 52,78%
Задание №16
Через 526,5 г раствора хлорида натрия, в котором массовая доля протонов в ядрах всех атомов составляет 54,7%, пропускали электрический ток до тех пор, пока на аноде не выделилось 22,4 л (н.у.) газа. К образовавшемуся в результате электролиза раствору добавили 13 г цинка. Определите массовую долю всех протонов в конечном растворе.
Решение
Ответ: ꞷp+ = 54,8%
Пояснение:
2NaCl + 2H2O = H2 + Cl2 + 2NaOH (I)
1) По условию, масса протонов в ядрах всех атомов составляет 54,7% от общей массы раствора. Найдем массу протонов:
(526,5/100) · 54,7 = 288 г
Пусть n(NaCl) = x моль, тогда m(NaCl) = 58,5x г
Пусть n(H2O) = y моль, тогда m(H2O) = 18y г
Составим 1-е уравнение системы: 58,5x + 18y = 526,5
2) Найдем количество протонов в ядрах всех атомов. При этом помним, что количество протонов = порядковому номеру элемента, а молярная масса одного протона составляет 1г/моль.
а) np+ = Np+ ∙ n(в-ва)
np+(NaCl) = (11 + 17) · x = 28x моль
np+(H2O) = (2 + 8)y = 10y моль
б) mp+ = np+ · 1г/моль
mp+(NaCl) = 28x г;
mp+(H2O) = 10y г
Составим второе уравнение системы: 28x + 10y = 288
3) Решим систему уравнений:
8,1x = 8,1
x = 1, т.е. n(NaCl) = 1 моль
y = 26, т.е. n(H2O) = 26 моль
4) Дальше необходимо проверить, идет ли электролиз воды. Для этого нам необходимо рассчитать количество выделившегося на аноде газа и сравнить его с тем количеством, которое бы выделилось, если бы электролиз соли прошел полностью.
n(газа) = 22,4/22,4 = 1 моль
n1(Cl2) = 0,5n(NaCl) = 0,5 · 1 = 0,5 моль
m1(Cl2) = 0,5 · 71 = 35,5 г – выделилось при электролизе соли.
0,5 < 1 – из чего делаем вывод, что помимо электролиза соли также шел и электролиз воды.
Запишем вторую и третью реакцию.
2H2O = 2H2 + O2 (II)
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2 (III)
Найдем сразу количество цинка: n(Zn) = 13/65 = 0,2 моль
5) Из прошлого пункта мы понимаем, что n(газа) = n(Cl2) + n(O2). Можем найти количество и массу кислорода во второй реакции:
n(O2) = 1 – 0,5 = 0,5 моль;
m(O2) = 0,5 · 32 = 16 г
6) В задаче просят найти массовую долю протонов в растворе после окончания всех реакций. Для начала нам необходимо определиться с тем, какие вещества остались в растворе. Это: NaOH, H2O, Na2[Zn(OH)4].
а) Найдем общее количество и массу NaOH:
nост.(NaOH) = nобр.(NaOH) – nистр.(NaOH)
nост.(NaOH) = 2n1(Cl) – 2n(Zn) = 1 – 0,4 = 0,6 моль
mост.(NaOH) = 0,6 · 40 = 24 г
б) Найдем общее количество и массу Na2[Zn(OH)4]:
n(Na2[Zn(OH)4]) = n(Zn) = 0,2 моль
m(Na2[Zn(OH)4]) = 0,2 · 179 = 35,8 г
в) Сразу найти количество и массу H2O нельзя, так как:
m(H2O) = mконечн. р-ра – m(NaOH) – m(Na2[Zn(OH)4])
Поэтому сначала найдем массу конечного раствора. При этом помним, что масса раствора – это всё, что смешали, минус образовавшиеся газы и осадки.
mконечн. р-ра = mр-ра(NaCl) – m1(H2) – m1(Cl2) – m2(H2) – m2(O2) + m(Zn) – m3(H2)
Найдем недостающие данные:
n1(H2) = n1(Cl2) = 0,5 моль; m1(H2) = 0,5 · 2 = 1 г
n2(H2) = 2n2(O2) = 1 моль; m1(H2) = 1 · 2 = 2 г
n3(H2) = n(Zn) = 0,2 моль; m1(H2) = 0,2 · 2 = 0,4 г
Найдем массу конечного раствора:
mконечн. р-ра = 526,5 – 1 – 35,5 – 2 – 16 + 13 – 0,4 = 484,6 г
Теперь мы можем найти количество и массу воды:
m(H2O) = 484,6 – 24 – 35,8 = 424,8 г; n(H2O) = 424,8/18 = 23,6 моль
7) Найдем количество и массу протонов в конечном растворе. При этом помним, что количество протонов = порядковому номеру элемента, а молярная масса одного протона составляет 1г/моль.
а) np+ = Np+ ∙ n(в-ва)
np+(NaOH) = (11 + 8 + 1) · 0,6 = 12 моль
np+(H2O) = (2 + 
np+(Na2[Zn(OH)4]) = (11 · 2 + 30 + 8 ·4 + 4 · 1) · 0,2 = 17,6 моль
б) mp+ = np+ · 1г/моль
mp+(NaOH) = 12 г;
mp+(H2O) = 236 г
mp+( Na2[Zn(OH)4]) = 17,6 г

ꞷp+ = (12 + 236 + 17,6)/484,6 · 100% = 54,8%
Ответ: ꞷp+ = 54,8%
Задание №17
Через 500 г раствора хлорида бария, в котором 53% от общей массы раствора составляет масса протонов в ядрах всех атомов, пропускали электрический ток до тех пор, пока на аноде не выделилось 8,96 л (н.у.) газа. К образовавшемуся в результате электролиза раствору добавили 63,6 г карбоната натрия. Определите массовую долю карбоната натрия в конечном растворе.
Решение
Ответ: ꞷост.(Na2CO3) = 2,43 %
Пояснение:
BaCl2 + 2H2O = H2 + Cl2 + Ba(OH)2 (I)
По условию, масса протонов в ядрах всех атомов составляет 54,7% от общей массы раствора. Найдем массу протонов:
(500/100) · 53 = 265 г
Пусть n(BaCl2) = x моль, тогда m(BaCl2) = 208x г
Пусть n(H2O) = y моль, тогда m(H2O) = 18y г
Составим первое уравнение системы: 208x + 18y = 500
Найдем количество протонов в ядрах всех атомов. При этом помним, что количество протонов равно порядковому номеру элемента, а молярная масса одного протона составляет 1г/моль. Если забыли об этом вспоминаем состав атома водорода — 1 протон и 1 электрон, масса электрона пренебрежимо мала, поэтому можно считать, что масса протона равна массе одного атома водорода.
а) np+ = Np+ ∙ n(в-ва)
np+(BaCl2) = (56 + 17 · 2) · x = 90x моль
np+(H2O) = (2 + 8)y = 10y моль
б) mp+ = np+ · 1г/моль
mp+(BaCl2) = 90x г;
mp+(H2O) = 10y г
Составим 2-е уравнение системы: 90x + 10y = 265 г
Решим систему уравнений:
46x = 23
x = 0,5, т.е. n(BaCl2) = 0,5 моль,
y = 22, т.е. n(H2O) = 22 моль.
Дальше необходимо проверить, идет ли электролиз воды. Для этого нам необходимо рассчитать количество выделившегося на аноде газа и сравнить его с тем количеством, которое бы выделилось, если бы электролиз соли прошел полностью.
n(газа) = 8,96/22,4 = 0,4 моль,
n1(Cl2) = n(BaCl2) = 0,5 моль
0,4 < 0,5 – из чего делаем вывод, что электролиза воды не было и электролиз соли прошел не полностью, и часть её осталась в растворе.
Обратим внимание, что количество веществ в 1ой реакции дальше нужно считать по количеству выделившегося хлора, так как он в недостатке.
Найдем nост.(BaCl2) = 0,5 – n1(BaCl2) = 0,5 – n(Cl2) = 0,5 – 0,4 = 0,1 моль
Запишем следующие реакции:
Ba(OH)2 + Na2CO3 = BaCO3 + 2NaOH (II)
BaCl2 + Na2CO3 = BaCO3 + 2NaCl (III)
Найдем количество добавленного карбоната натрия:
n(Na2CO3) = 63,6 / 106 = 0,6 моль
Далее найдем количество и массу оставшегося карбоната натрия, так как в задаче просят найти его массовую долю:
nост.(Na2CO3) = 0,6 – n2(Na2CO3) – n3(Na2CO3)
n2(Na2CO3) = n(Ba(OH)2) = n(Cl2) = 0,4 моль;
n3(Na2CO3) = nост.(BaCl2) = 0,1 моль;
nост.(Na2CO3) = 0,6 – 0,4 – 0,1 = 0,1 моль
mост.(Na2CO3) = 0,1 · 106 = 10,6 г
Найдем массу конечного раствора. При этом помним, что масса раствора – это всё, что смешали, минус образовавшиеся газы и осадки.
mконечн. р-ра = mр-ра(BaCl2) – m(H2) – m(Cl2) + m(Na2CO3) – mобщ.(BaCO3)
Найдем недостающие данные:
n(H2) = n(Cl2) = 0,4 моль; m(H2) = 0,4 · 2 = 0,8 г
m(Cl2) = 0,4 · 71 = 28,4 г
nобщ.(BaCO3) = n(Ba(OH)2) + nост.(BaCl2) = 0,4 + 0,1 = 0,5 моль;
mобщ.(BaCO3) = 0,5 · 197 = 98,5 г
Теперь мы можем найти массу раствора:
mконечн. р-ра = 500 – 0,8 – 28,4 + 63,6 – 98,5 = 435,9 г
Найдем ꞷост.(Na2CO3):
ꞷост.(Na2CO3) = (10,6/435,9) · 100% = 2,43 %
Ответ: ꞷост.(Na2CO3) = 2,43 %.