Как найти массу вещества
Окружающее нас пространство наполнено разными физическими телами, которые состоят из разных веществ с различной массой. Школьные курсы химии и физики, ознакомляющие с понятием и методом нахождения массы вещества, прослушали и благополучно забыли все, кто учился в школе. Но между тем теоретические знания, приобретенные когда-то, могут понадобиться в самый неожиданный момент.
1
Вычисление массы вещества с помощью удельной плотности вещества. Пример – имеется бочка на 200 литров. Нужно заполнить бочку любой жидкостью, скажем, светлым пивом. Как найти массу наполненной бочки? Используя формулу плотности вещества p=m/V, где p – удельная плотность вещества, m – масса, V – занимаемый объем, найти массу полной бочки очень просто:
- Меры объемов – кубические сантиметры, метры. То есть бочка на 200 литров имеет объем 2 м³.
- Мера удельной плотности находится с помощью таблиц и является постоянной величиной для каждого вещества. Измеряется плотность в кг/м³, г/см³, т/м³. Плотность пива светлого и других алкогольных напитков можно посмотреть на сайте. Она составляет 1025,0 кг/м³.
- Из формулы плотности p=m/V => m=p*V: m = 1025,0 кг/м³* 2 м³=2050 кг.
Бочка объемом 200 литров, полностью наполненная светлым пивом, будет иметь массу 2050 кг.
2
Нахождение массы вещества с помощью молярной массы. M (x)=m (x)/v (x) – это отношение массы вещества к его количеству, где M (x) – это молярная масса X, m (x) – масса X, v (x) – количество вещества X. Если в условии задачи прописывается только 1 известный параметр – молярная масса заданного вещества, то нахождение массы этого вещества не составит труда. Например, необходимо найти массу йодида натрия NaI количеством вещества 0,6 моль.
- Молярная масса исчисляется в единой системе измерений СИ и измеряется в кг/моль, г/моль. Молярная масса йодида натрия – это сумма молярных масс каждого элемента: M (NaI)=M (Na)+M (I). Значение молярной массы каждого элемента можно вычислить по таблице, а можно с помощью онлайн-калькулятора на сайте: M (NaI)=M (Na)+M (I)=23+127=150 (г/моль).
- Из общей формулы M (NaI)=m (NaI)/v (NaI) => m (NaI)=v (NaI)*M (NaI)= 0,6 моль*150 г/моль=90 грамм.
Масса йодида натрия (NaI) с массовой долей вещества 0,6 моль составляет 90 грамм.
3
Нахождение массы вещества по его массовой доле в растворе. Формула массовой доли вещества ω=[m (вещества)/m (раствора)]*100%, где ω – массовая доля вещества, а m (вещества) и m (раствора) – массы, измеряемые в граммах, килограммах. Общая доля раствора всегда принимается за 100%, иначе будут погрешности в вычислении. Несложно из формулы массовой доли вещества вывести формулу массы вещества: m (вещества)=[ω*m (раствора)] /100%. Однако есть некоторые особенности изменения состава раствора, которые нужно учитывать при решении задач на эту тему:
- Разбавление раствора водой. Масса вещества растворенного X не изменяется m (X)=m’(X). Масса раствора увеличивается на массу добавленной воды m’ (р)=m (р)+m (H2O).
- Выпаривание воды из раствора. Масса растворенного вещества X не изменяется m (X)=m’ (X). Масса раствора уменьшается на массу выпаренной воды m’ (р)=m (р)-m (H2O).
- Сливание двух растворов. Массы растворов, а также массы растворенного вещества X при смешивании складываются: m’’ (X)=m (X)+m’ (X). m’’ (р)=m (р)+m’ (р).
- Выпадение кристаллов. Массы растворенного вещества X и раствора уменьшаются на массу выпавших кристаллов: m’ (X)=m (X)-m (осадка), m’ (р)=m (р)-m (осадка).
4
Алгоритм нахождения массы продукта реакции (вещества), если известен выход продукта реакции. Выход продукта находится по формуле η=[m (x практическая)/m (x теоретическая)]*100%, где m (x практическая) – масса продукта х, которая получена в результате практического процесса реакции, m (x теоретическая) – рассчитанная масса вещества х. Отсюда m (x практическая)=[η*m (x теоретическая)]/100% и m (x теоретическая)=[m (x практическая)*100%]/η. Теоретическая масса получаемого продукта всегда больше практической, в связи с погрешностью реакции, и составляет 100%. Если в задаче не дается масса продукта, полученного в практической реакции, значит, она принимается за абсолютную и равна 100%.
Варианты нахождение массы вещества – небесполезный курс школьного обучения, а вполне применяемые на практике способы. Каждый сможет без труда найти массу необходимого вещества, применяя вышеперечисленные формулы и пользуясь предлагаемыми таблицами. Для облегчения задания прописывайте все реакции, их коэффициенты.
Как найти массу из объёма
Масса тела — это одна из важнейших его физических характеристик, которая показывает его гравитационные свойства. Зная объем вещества, а также его плотность, можно без труда вычислить и массу тела, в основе которого и лежит это вещество.

Вам понадобится
- Объем вещества V, его плотность p.
Инструкция
Пускай нам дано неоднородное вещество с массой V и массой m. Тогда его плотность можно будет рассчитать по формуле:
p = m/V.
Из этой формулы следует, что для того, чтобы рассчитать массу вещества, можно воспользоваться ее следствием:
m = p*V. Рассмотрим пример:Пусть нам дан платиновый брусок. Его объем равен 6 кубическим метрам. Найдем его массу.
Задача решается в 2 действия:
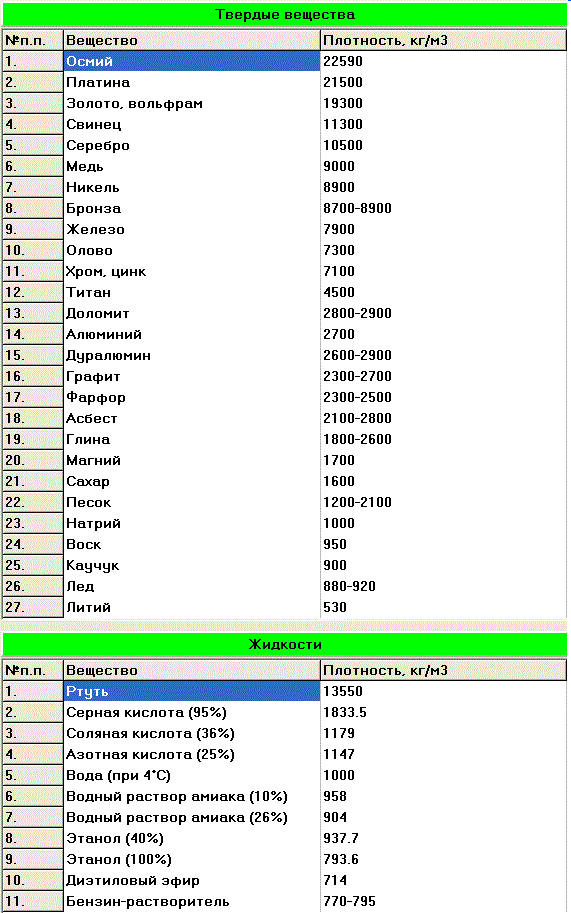
1) Согласно таблице плотности различных веществ, плотность платины составляет 21500 кг/куб. метров.
2) Тогда, зная плотность и объем этого вещества, рассчитаем его массу:
6*21500 = 129000 кг, или 129 тонн.
Видео по теме
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Многие из нас в школьное время задавались вопросом: «Как найти массу тела»? Сейчас мы попытаемся ответить на этот вопрос.
Нахождение массы через его объем
Допустим, в вашем распоряжении есть бочка на двести литров. Вы намерены целиком заполнить ее дизельным топливом, используемом вами для отопления своей небольшой котельной. Как найти массу этой бочки, наполненной соляркой? Давайте попробуем решить эту простейшую на первый взгляд задачу вместе с вами.
Решить задачу, как найти массу вещества через его объем, довольно легко. Для этого следует применить формулу удельной плотности вещества
p = m/v,
где p является удельной плотностью вещества;
m — его массой;
v — занимаемым объемом.
В качестве меры массы будут использоваться граммы, килограммы и тонны. Меры объёмов: сантиметры кубические, дециметры и метры. Удельная плотность будет вычисляться в кг/дм³, кг/м³, г/см³, т/м³.
Таким образом, в соответствии с условиями задачи в нашем распоряжении есть бочка объемом двести литров. Это значит, что ее объем равняется 2 м³.
Но вы хотите узнать, как найти массу. Из вышеназванной формулы она выводится так:
m = p*v
Сначала нам требуется найти значение р – удельной плотности дизельного топлива. Найти данное значение можно, используя справочник.
В книге мы находим, что р = 860,0 кг/м³.
Затем полученные значения мы подставляем в формулу:
m = 860*2 = 1720,0 (кг)
Таким образом, ответ на вопрос, как найти массу, был найден. Одна тонна и семьсот двадцать килограммов – это вес двухсот литров летнего дизтоплива. Затем вы можете точно так же сделать приблизительный расчет общего веса бочки и мощности стеллажа под бочку с соляром.
Нахождение массы через плотность и объем
Очень часто в практических заданиях по физике можно встретить такие величины, как масса, плотность и объем. Для того чтобы решить задачу, как найти массу тела, вам требуется знать его объем и плотность.
Предметы, которые вам будут нужны:
1) Рулетка.
2) Калькулятор (компьютер).
3) Емкость для измерения.
4) Линейка.
Известно, что у предметов с равным объемом, но изготовленных из различных материалов, будет разная масса (например, металл и дерево). Массы тел, которые изготовлены из определенного материала (без пустот), прямо пропорциональны объему рассматриваемых предметов. В противном случае, константа – это отношение массы к объему предметы. Этот показатель называется «плотностью вещества». Мы будем его обозначать буквой d.
Теперь требуется решить задачу, как найти массу в соответствии с формулой d = m/V, где
m является массой предмета (в килограммах),
V является его объемом (в метрах кубических).
Таким образом, плотность вещества является массой единицы его объема.
Если вам необходимо найти плотность материала, из которого создан предмет, то следует воспользоваться таблицей плотностей, которую можно найти в стандартном учебнике по физике.
Объем предмета вычисляется по формуле V = h * S, где
V – объем (м³),
H – высота предмета (м),
S – площадь основания предмета (м²).
В том случае, если вы не можете четко измерить геометрические параметры тела, то вам следует прибегнуть к помощи законов Архимеда. Для этого вам понадобится сосуд, у которого есть шкала, служащая для измерений объема жидкостей и опустить предмет в воду, то есть в сосуд, на котором есть деления. Тот объем, на который будет увеличено содержимое сосуда, является объемом тела, которое погружено в него.
Зная объем V и плотность d предмета, вы можете легко найти его массу по формуле m = d * V. Перед тем, как вычислить массу, требуется привести все измерительные единицы в единую систему, например, в систему СИ, являющуюся интернациональной измерительной системой.
В соответствии с вышеназванными формулами можно сделать следующий вывод: для нахождения требуемой величины массы с известным объемом и известной плотностью требуется умножить значение плотности материала, из которого изготовлено тело, на объем тела.
Наверно так)
Через плотность:
m=V*ρ
Масса вещества равна произведению плотности этого вещества на объём этого вещества. Есть специальные справочные таблицы плотностей.
Обычно масса и объём вещества численно не равны между собой, потому что плотности веществ обычно отличаются от единицы!
Но масса (в граммах) и объём (в миллилитрах) воды численно равны между собой, т. к. плотность воды при обычных условиях приблизительно равна 1 г/мл.
Физика — наука невероятно увлекательная, если разобраться, что там к чему. А формулы в ней отражают реальные физические процессы, только в цифрах. И если вы будете понимать, почему формула именно такова, то учиться будет много легче. Но все сразу рассказать невозможно, и сегодня мы разберемся, как произвести нахождение массы через плотность и объём.
Прежде, чем приступить к изучению формул массы, плотности и объёма, следует уточнить некоторые детали:
- Во-первых, объём вещества зависит от температуры. При нагревании твёрдое вещество расширяется, при низкой температуре уменьшается. Есть также особые моменты, как в случае с жидким водородом. Он не может существовать при высокой температуре, потому что превратится в газ.
- Во-вторых, разные организации и страны имеют свои стандарты условий, при которых проводятся измерения. Иными словами, числовой показатель плотности одного и того же вещества в разных странах будет отличаться. Поэтому, прежде чем утверждать, что показатели неверные или правильные, следует уточнить условия, при которых эти показатели были получены.
- В-третьих, помимо температуры, на фактор объёма могут влиять и такие показатели, как атмосферное давление. Оно особо важно при измерении плотности газов, так как на твёрдые вещества это практически не влияет.
Что это такое?
Прежде чем приводить формулы массы в физике, дадим ей определение. Этим термином называется физическая величина, которая пропорциональна количеству материи, заключенной в данном теле. Следует не путать ее с количеством вещества, которое выражается в молях. Масса в СИ вычисляется в килограммах. Другими ее единицами являются тонны и граммы.
Вам будет интересно:Слово «кворум». Значение и происхождение термина. Нюансы определения
Масса бывает двух важных видов:
- инерционная;
- гравитационная.
Первый вид рассматриваемой физической величины характеризует инерционные свойства тела, то есть способность некоторой силы изменять скорость тела, а также кинетическую энергию, которой оно обладает.
Канал ДНЕВНИК ПРОГРАММИСТА
Жизнь программиста и интересные обзоры всего. Подпишись, чтобы не пропустить новые видео.
Гравитационная масса связана с интенсивностью притяжения между любыми телами. Она играет важную роль в космосе, поскольку благодаря притяжению между звездами и планетами существует наша галактика и наша Солнечная система. Однако гравитационная масса проявляет себя и в повседневной жизни в виде наличия у всех тел некоторого веса.
Понятие объема тела
Объем является физическим свойством материи, которое определяет занимаемое ею пространство. В Международной системе единиц он измеряется в метрах кубических, но также часто используют другие единицы измерения: кубические сантиметры и литры.
В зависимости от состояния вещества применяют различные методы измерения объема:
- Для жидких тел используют специальные градуированные прозрачные емкости (цилиндры, пробирки, пипетки и другие).
- Для твердых тел, которые сохраняют свою форму, объем измеряется исходя из их линейных размеров с применением соответствующей математической формулы. Например, параллелепипеда объем равен произведению его длины, ширины и высоты.
- Газообразные тела не сохраняют свой объем, в отличие от жидкостей и твердых тел, поэтому он для газов всегда равен объему сосуда, в котором находится газ.
Формулы для инерции
В физике формула нахождения массы инерционной имеет следующий вид:
m = F / a
Здесь F — сила, которая на тело действует и вызывает появление у него ускорения a. Формула показывает, что чем больше будет действующая сила и чем меньше она сообщит ускорение телу, тем больше инерционная масса m.
Помимо записанного выражения, следует привести еще одну формулу нахождения массы в физике, которая связана с явлением инерции. Эта формула имеет вид:
m = p / v
Здесь p — количество движения (импульс), v — скорость тела. Чем большим количеством движения обладает тело и чем меньше его скорость, тем большую инерционную массу оно имеет.
Рассмотрим более сложный пример расчета
Слиток из двух металлов с плотностями ρ1 и ρ2 , имеет массу m и объём V. Определить объём этих металлов в слитке.
Решение. Пусть V1 объём первого металла, V2 объём второго металла. Тогда V1 + V2 = V; V1 = V V2; ρ1V1 + p2V2 = ρ1V1 + ρ2 (V V1) = m
Решив это уравнение относительно V1 , получаем:
V1= (m ρ2V)/(ρ1 ρ2)
Теперь найдём V2:
V2= V — (m ρ2V)/(ρ1 ρ2)
Ответ: объём первого тела равен (m ρ2V)/(ρ1 ρ2), второго V — (m ρ2V)/( ρ1 ρ2). Заметим, однако, что при ρ1 = ρ2 задача не имеет однозначного решения.
Формула для гравитации
Математическое описание явления гравитации стало возможным благодаря многочисленным наблюдениям за движением космических тел. Результаты всех этих наблюдений в XVII веке обобщил Исаак Ньютон в рамках закона всемирного тяготения. Согласно этому закону, два тела, которые имеют массы m1 и m2, друг к другу притягиваются с такой силой F:
F = G * m1 * m2 / r2
Где r — расстояние между телами, G — некоторая постоянная.
Если в данное выражение подставить значение массы нашей планеты и ее радиус, тогда мы получим следующую формулу массы в физике:
m = F / g
Здесь F — сила тяжести, g — ускорение, с которым тела падают на землю вблизи ее поверхности.
Как известно, наличие силы тяжести обуславливает то, что все тела имеют вес. Многие путают вес и массу, полагая, что это одна и та же величина. Обе величины действительно связаны через коэффициент g, однако вес — величина изменчивая (она зависит от ускорения, с которым движется система). Кроме того, вес измеряется в ньютонах, а масса в килограммах.
Весы, которыми человек пользуется в быту (механические, электронные), показывают массу тела, однако измеряют его вес. Перевод между этими величинами является лишь вопросом калибровки прибора.
Тренировочные задания
1. К 300 г раствора нитрата бария прибавили избыток раствора сульфата натрия. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
2. К 150 г раствора сульфата натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
3. К 300 г раствора силиката натрия прибавили избыток раствора нитрата кальция. Масса выпавшего осадка составила 12,0 г. Определите концентрацию соли в исходном растворе.
4. К 150 г раствора карбоната калия прибавили избыток раствора соляной кислоты. При этом выделился газ объёмом 3,36 л (н. у.). Определите концентрацию соли в исходном растворе.
5. К 250 г раствора гидрокарбоната натрия прибавили избыток раствора бромоводородной кислоты. При этом выделился газ объёмом 5,6 л. Определите концентрацию соли в исходном растворе.
6. К 50 г раствора карбоната натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
7. К 200 г раствора хлорида бария прибавили избыток раствора карбоната калия. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
8. К 200 г раствора хлорида железа (II) прибавили избыток раствора гидроксида калия. Масса выпавшего осадка составила 18,0 г. Определите концентрацию соли в исходном растворе.
9. К 400 г раствора нитрата свинца прибавили избыток раствора йодида натрия. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
10. К 300 г раствора йодида натрия прибавили избыток раствора нитрата свинца. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
11. Определите массу осадка, который выпадет при взаимодействии 150 г 14,8%-ного раствора хлорида кальция с избытком раствора карбоната натрия.
12. Определите объём газа (н. у.), который выделится при взаимодействии 120 г 8,8%-ного раствора карбоната натрия с избытком раствора соляной кислоты.
13. Определите массу соли, которая выпадет в осадок при взаимодействии 140 г 13,5%-ного раствора нитрата цинка с избытком раствора сульфида натрия.
14. Определите массу осадка, который выделится при взаимодействии 200 г 18,8%-ного раствора нитрата меди с избытком раствора сульфида натрия.
15. Определите массу осадка, который выпадет при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора хлорида цинка.
16. Определите массу осадка, который выделится при взаимодействии 200 г 12,7%-ного раствора хлорида железа (II) с избытком раствора сульфида натрия.
17. Определите массу осадка, который выделится при взаимодействии 50 г 17%-ного раствора нитрата серебра с избытком раствора бромида калия.
18. Определите массу осадка, который образуется при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора нитрата кальция.
19. Определите массу осадка, который образуется при взаимодействии 50 г 5,8%-ного раствора хлорида магния с избытком раствора фосфата натрия.
20. Определите объём газа, который выделится при взаимодействии 200 г 6,9%-ного раствора карбоната калия с избытком раствора соляной кислоты.
21. Оксид фосфора (V) массой 21,3 г растворили в растворе гидроксида калия, в результате чего был получен раствор средней соли массой 500 г. Определите концентрацию фосфата калия в конечном растворе.
22. Раствор хлорида железа (II) полностью прореагировал со 120 г раствора гидроксида натрия, в результате чего образовалось 6,0 г осадка. Определите массовую долю гидроксида натрия в исходном растворе.
23. Какой объём аммиака (н. у.) может полностью прореагировать со 150 г 20%-ного раствора серной кислоты с образованием средней соли?
24. В 200 г 20%-ного раствора соляной кислоты растворили магний до прекращения выделения газа. Определите объём выделившегося при этом водорода (н. у.).
25. Аммиак объёмом 10 л (н. у.) пропустили через раствор серной кислоты с массовой долей 8% до образования средней соли. Определите массу исходного раствора.
26. Определите объём сероводорода (н. у.), который необходимо пропустить через 130 г 6%-ного раствора хлорида меди (II) до полного осаждения сульфида меди (II).
27. Сероводород объёмом 3,36 л (н. у.) пропустили через раствор гидроксида натрия, в результате чего получили 180 г раствора сульфида натрия. Определите массовую долю соли в полученном растворе.
28. Алюминий массой 8,1 г может нацело прореагировать с 250 г раствора серной кислоты. Определите массовую долю серной кислоты в исходном растворе.
29. К 250 г раствора нитрата серебра добавили раствор хлорида калия до прекращения выделения осадка, масса которого составила 14,35 г. Определите массовую долю нитрата серебра в исходном растворе.
30. К 300 г 5%-ного раствора хлорида магния добавили избыток раствора фосфата калия. Вычислите массу выпавшего при этом осадка.
Плотность и объем
Как было отмечено, масса — это неотъемлемое свойство материи, поэтому ее можно вычислить с помощью других физических характеристик тел. Этими характеристиками являются объем и плотность.
Объем представляет собой некоторую часть пространства, которая ограничена поверхностью тела. Измеряется он в кубических единицах длины, например, в м3.
Плотность — это свойство вещества, которое отражает количество материи, помещенной в единице объема.
Формула массы вещества через объем и плотность записывается так:
m = ρ * V
Чем больше объем тела и чем выше его плотность, тем большей массой оно обладает. В связи с этим фактом полезно вспомнить знаменитую загадку про то, что имеет большую массу: 1 тонна пуха или 1 тонна железа. В отсутствии выталкивающей архимедовой силы массы обоих веществ равны. Пух имеет гораздо меньшую плотность, чем железо, однако разница в плотности компенсируется аналогичной разницей в объеме.
Таблица плотности некоторых веществ
Плотность многих веществ известна заранее и легко находится по соответствующей таблице.
В работе с ней важно обращать внимание на размерности и не забывать о том, что все данные собраны при нормальных условиях: комнатной температуре в 20 градусов Цельсия, а также определенном давлении, влажности воздуха и так далее.
Плотности других, более редких веществ можно найти онлайн.
Как минимум одно из значений плотности стоит запомнить, так как оно часто появляется в задачах. Это плотность воды – 1000 кг/м3 или 1 г/см3.
Относительная
Понятие об относительной массе применяется в атомной физике и в химии. Поскольку массы атомов и молекул имеют очень маленькие значения (≈10-27 кг), то оперировать ими на практике при решении задач оказывается крайне неудобно. Поэтому сообществом ученых было решено использовать так называемую относительную массу, то есть рассматриваемая величина выражается в единицах массы по отношению к массе известного эталона. Этим эталоном стала 1/12 массы атома углерода, которая равна 1,66057*10-27 кг. Соответствующая относительная величина получила название атомной единицы (а. е. м.).
Формулу относительной массы M можно записать так:
M = ma / (1 / 12 * mC)
Где ma — масса атома в килограммах, mC — масса атома углерода в килограммах. Например, если в это выражение подставить значение массы атома кислорода, то его а. е. м. будет равна:
M = 26,5606 * 10-27 / (1,66057 * 10-27) = 15,9949.
Поскольку а. е. м. является относительной величиной, то она не имеет размерности.
Удобство применения этого термина на практике заключается не только в небольших и целых значениях этой единицы измерения. Дело в том, что значение а. е. м. совпадает по величине с молярной массой, выраженной в граммах. Последняя представляет собой массу одного моль вещества.
Зачем и кому нужно знать эти формулы
В любой стране есть стандарты, по которым производится продукция. Неважно, какая это отрасль – пищевая, химическая или другая. Стандарты также могут быть мировыми. Так вот для того чтобы выпускаемая на заводах продукция соответствовала этим стандартам и нужны знания о плотности, массе и объёме.
Но зачем кому-то придерживаться чьих-то правил? Для начала, эти правила взяты не с потолка. К этому пришли разные бизнесмены со всего мира и нашли оптимальное решение, удовлетворяющее как производителей, так и конечных пользователей продукта. Если бы все выпускали продукцию как им вздумается, то людям было бы очень тяжело выбрать производителя. Ведь даже сейчас, со всеми стандартами и ГОСТами выбор просто огромный.
Кроме того, игнорируя физику и математику, можно выработать продукцию себе же в убыток или сделать продукцию, которая не оправдает ожиданий и будет выглядеть не так, как задумывал производитель. Есть и другие ситуации, где необходимы знания подобного рода – при подсчёте планируемого объёма, который займёт продукция на складе; вес продукции, которую нужно будет перевести и т.д.
Эти знания могут потребоваться инженерам, технологам, конструкторам и прочим профессиям, чья деятельность связана с физическими материалами. Конечно, для простого обывателя эти знания могут и не пригодиться. Однако, стоит вспомнить про случай с Архимедом и тогда вы поймёте, что знания – защита от обмана и настоящая сила!
Примеры решения задач
Задача 1
Условие:
имеется алюминиевый брусок со сторонами 3, 5 и 7 сантиметров. Какова его масса?
Найдем объем бруска:
V = 3 * 5 * 7 = 105 см 3 ;
Табличное значение плотности алюминия: 2800 кг/м 3 или 2,8 г/см 3 ;
Вычислим массу бруска:
m = 105 * 2,8 = 294 г.
Задача 2
Задача по смежной теме.
Условие:
сколько энергии потребуется для того, чтобы довести воду комнатной температуры (20 градусов Цельсия) из стакана (ёмкость 200 мл) до температуры кипения?
Весы для измерения массы
Весы напольные, электронные, ручные, используемые для измерения массы тела в физике, откалиброваны специальным образом. Они показывают сразу килограммы. То есть, пересчитывают вес в массу по формуле, представленной в пункте выше. Вот так устроены эти приборы.
Другим способом измерения массы являются весы с двумя плечами рычага. Для определения рассматриваемой величины с помощью таких устройств используют набор эталонных гирь. Ими стараются уравновесить измеряемое тело.
Как рассчитать массу равнополочного уголка, швеллера, двутавра
Масса метра погонного углового металлопроката зависит от ширины и толщины полок.
Внимание! Рассчитанный по геометрической формуле или определённый по таблице вес уголка может сильно отличаться от фактического. Это связано с тем, что некоторые производители в целях удешевления продукции снижают толщину полки уголка в местах, где не предусматриваются проверочные замеры. Такая разница может значительно превышать допуски, предусмотренные ГОСТом.
Вес погонного метра наиболее распространённого сортамента равнополочного уголка
| Ширина полки, мм | Толщина полки, мм | Вес 1 м уголка, кг | Ширина полки, мм | Толщина полки, мм | Вес 1 м уголка, кг |
| 20 | 3 | 0,89 | 40 | 3 | 1,85 |
| 20 | 4 | 1,15 | 40 | 4 | 2,42 |
| 25 | 3 | 1,12 | 45 | 3 | 2,08 |
| 25 | 4 | 1,46 | 45 | 4 | 2,73 |
| 32 | 3 | 1,46 | 50 | 3 | 2,32 |
| 32 | 4 | 1,91 | 50 | 4 | 3,05 |
| 36 | 3 | 1,65 | 63 | 4 | 3,9 |
| 36 | 4 | 2,16 | 63 | 5 | 4,81 |
Самостоятельно просчитать массу швеллера и двутавра затруднительно из-за сложной формы сечения. В данном случае пользуются таблицами.
Таблица весов швеллера
| Номер профиля | Вес 1 м, кг | Номер профиля | Вес 1 м, кг | Номер профиля | Вес 1 м, кг |
| 5 | 4,84 | 12 | 10,4 | 20 | 18,4 |
| 6,5 | 5,9 | 14 | 12,3 | 22 | 21,0 |
| 8 | 7,05 | 16 | 14,2 | 24 | 24 ,0 |
| 10 | 8,59 | 18 | 16,3 | 27 | 27,7 |
Таблица весов двутавра
| Номер профиля | Вес 1 м, кг | Номер профиля | Вес 1 м, кг | Номер профиля | Вес 1 м, кг |
| 10 | 9,46 | 18 | 18,4 | 27 | 31,5 |
| 12 | 11,5 | 20 | 21,0 | 30 | 36,5 |
| 14 | 13,7 | 22 | 24,0 | 33 | 42,2 |
| 16 | 15,9 | 24 | 27,3 | 36 | 48,6 |