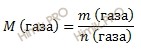4.3.3. Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ.
На данный момент задачи по этой теме кодификатора идут в КИМе ЕГЭ под номером 29.
Для их решения можно воспользоваться следующим алгоритмом:
1) записать уравнение реакции, о которой идет речь в задаче, и убедиться в правильности расставленных коэффициентов;
2) рассчитать количество молей вещества, масса или объем которого указаны в условии.
Если указана масса некого вещества A, то расчет количества вещества для него следует вести по формуле:
где mA – масса вещества А, а MA – молярная масса вещества А.
Если указан объем газообразного вещества А:
где VA – объем газообразного вещества А, а Vm – молярный объем, одинаковый для всех газов и при н.у. равный 22,4 л/моль.
Иногда вместо массы или объема вещества дается его количество вещества (моль). В таком случае действия по его нахождению не требуются.
3) далее от молей вещества А нужно перейти к молям вещества, массу или объем которого спрашивают в условии.
Допустим спрашивают объем или массу вещества B. Тогда для перехода от количества моль вещества А к количеству моль вещества B следует пользоваться тем правилом, что для любого вещества его количество, деленное на его коэффициент, в уравнении реакции одно и то же. Т.е. количества веществ А и В связаны друг с другом через коэффициенты в уравнении следующим образом:
где n(A) и n(B) – количества вещества А и В соответственно, а k(A) и k(B) – коэффициенты в уравнении перед этими веществами.
Из этого выражения следует, что количество вещества В равно:
4) далее, зная количество вещества B, мы можем найти его массу по формуле:
Если же вещество B является газом и спрашивают его объем, то рассчитать его можно следующим образом:
В общем, последовательность решения таких задач можно изобразить следующей схемой:
1) Зная массу или объем вещества A, рассчитываем его количество вещества.
2) Зная количество вещества A, рассчитываем количество вещества B по формуле:
где n(A) и n(B) – количества веществ А и В соответственно, а k(A) и k(B) – коэффициенты в уравнении перед этими веществами.
3) В зависимости от того, требуется найти массу вещества В или объем газа В, умножаем его количество либо на молярную массу, либо на молярный объем газа:
Пример
Какая масса сульфида алюминия потребуется для того, чтобы в результате его взаимодействия с избытком соляной кислоты образовался газ объемом 33,6 л (н.у.).
Решение:
1) Запишем уравнение реакции:
2) Рассчитываем количество вещества, для которого известна его масса или объем (в случае газа). Нам известен объем сероводорода, рассчитаем его количество вещества:
3) Отношение количества вещества любого фигуранта реакции к его коэффициенту в уравнении этой реакции всегда одно и то же. Т.е. для сульфида алюминия и сероводорода мы можем записать, что:
где k(Al2S3) и k(H2S) – коэффициенты перед Al2S3 и H2S соответственно.
Из этого выражения выразим n(Al2S3):
Подставим известные значения n(H2S) и коэффициентов перед H2S и Al2S3:
Тогда масса сульфида алюминия будет равна:
Задачи с реальных экзаменов ЕГЭ на тему «Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ» можно порешать здесь.
В этой статье мы собираемся проанализировать, как найти массу из молей и молярной массы.
Найти массу из молей и молярной массы очень просто. Это можно сделать, используя приведенное ниже соотношение:
Где,

n = количество молей (моль)
m = масса в граммах (г)
M = молярная масса (г/моль)
Мы можем лучше понять это, решив несколько примеров:
Как найти массу из молей и молярной массы Примеры:
1. Рассчитайте массу О2, если молярная масса равна 10.2 моль.
Решение:
Молярная масса = O2 = 16×2 = 32 г/моль
n = 10.2 моль
m = n × M = 10.2 моль × 32 г/моль = 326.4 г
2. На пляже XYZ в песке много минералов. SiO2 был одним из них, который был оценен, и у него было 12.5 молей, так какова масса SiO2 ?
Решение:
Молярная масса = SiO2 = 28 + 16×2 = 60 г.
n = 12.5 моль
m = n × M = 12.5 моль × 60 г/моль = 750 г
3. Рассчитайте массу 7.86 моль Хлорид кальция?
Решение:
Мы знаем, что формула хлорида кальция CaCl2.
Молярная масса = CaCl2 = 40 + 35.45×2 = 110.90 г/моль
n = 7.86 моль
m = n × M = 7.86 моль × 110.90 г/моль = 871.674 г
4. Студент в лаборатории приготовил 6.8 моль KNO3 и использовал его для титрования, поэтому для проведения расчетов какова будет его масса?
Решение:
Молярная масса = KNO3 = 39 + 14 + 3×16 = 110 г/моль
n = 6.8 моль
m = n×M = 6.8 моль × 110 г/моль = 748 г
5. Рассчитайте массу FeCl3 с числом молей, равным 5.7 моля.
Решение:
Молярная масса = FeCl3 = 55.845 +35.453×3 = 162.204 г/моль
n = 5.7 моль
m = n × M = 5.7 × 162.204 = 924.562 г
6. Рассчитайте массу 2.7 молей сульфата бария.
Решение:
Молярная масса = BaSO4 = 137.33 + 32.06 + 64 = 233.39 г/моль
n = 2.7 моль
м = п × М = 2.7 × 233.39 = 630.153 г
7. Рассчитайте массу 3.98 моль хлорида стронция.
Решение:
Молярная масса = SrCl2 = 87.62 + 35.453 + 35.453 = 158.52 г/моль.
n = 3.98 моль
м = п × М = 3.98 × 158.52 = 630.90 г
8. Рассчитайте массу 4.32 моля фосфата аммония.
Решение:
Молярная масса = (NH4)3PO4 = 14.01 × 3 + 12 + 30.97 + 16 = 149.12 г/моль.
n = 4.32 моль
м = п × М = 4.32 × 149.12 = 644.198 г
9. Рассчитайте массу 3.7 молей нитрата магния.
Решение:
Молярная масса = Mg(NO3)2 = 24 + 2×14 + 6×16 = 148 г/моль
n = 3.7 моль
м = п × М = 3.7 × 148 = 547.6 г
10.Рассчитайте массу 4.24 моль гидроксида алюминия.
Решение:
Молярная масса = Al(OH)3 = 27 + 16×3 + 3 = 78 г/моль
n = 4.24 моль
m = n × M = 4.24 × 78 = 330.72 г
11. Рассчитайте массу 1.49 моль йодида свинца (II).
Решение:
Молярная масса = PbI2 = 207.2 + 253.80 = 461 г/моль
n = 1.49 моль
m = n × M = 1.49 × 461 = 686.89 г
12. Рассчитайте массу 5.34 молей карбоната магния.
Решение:
Молярная масса = МгСО3 = 24 +12 + 16×3 =84 г/моль
n = 5.34 моль
m = n×M = 5.34 + 84 = 448.56 г
13.Рассчитайте массу 6.136 молей мышьяковой кислоты.
Решение:
Молярная масса = H3AsO4 = 3 + 74.9 + 3×16 = 141.9 г/моль
n = 6.136 моль
m = n × M = 6.136 × 141.9 = 870.69 г
14. Рассчитайте массу 4.59 моль карбоната лития.
Молярная масса = Li2CO3 = 13.88 + 12 + 3×16 = 73.89 г/моль
n = 4.59 моль
m = n × M = 4.59 × 73.89 = 339.15 г
15. Рассчитайте массу 4.999 молей бытового отбеливателя.
Решение:
Молярная масса = NaOCl = 23 + 16 + 35.4 = 74.4 г/моль
n = 4.999 моль
m = n × M = 4.99 × 74.4 = 371.92 г
16. Рассчитайте массу 2.156 моль дихромата калия.
Решение:
Молярная масса = K2Cr2O7 = 78 + 104 + 112 = 294 г/моль
n = 2.156 моль
m = n × M = 2.156 × 294 = 633.96 г
Узнайте больше о: Как Чтобы найти молярную массу из молярности: подробное объяснение
Как рассчитать молярную массу без массы ?
Обычно наиболее распространенным методом нахождения молярной массы является использование формулы M = m/n, которая подробно обсуждалась в предыдущем разделе.
Используя метод коллигативных свойств, мы можем вычислить молярную массу, не вдаваясь в картину. Давайте проанализируем, как в следующем разделе:
Бензол используется для растворения вещества (неизвестного вещества, молярная масса которого должна быть оценена) и доводится до 1.55 % (% массы неизвестной смеси к бензолу). Температура кипения бензола повышается примерно на 2.3%.
Учитывая коллигативные свойства:
Фактическая температура кипения бензола = 80 градусов по Цельсию.
ΔT = изменение температура кипения (1.84 градуса) 80×0.023
I = Вант-Гофф (коэффициент), для бензола считается быть одним, поскольку это не электролит.
m = моляльность
K = константа для бензола (точка кипения) составляет около 2.53.
Теперь,

= 1.84/1× 2.53
m = 0.728 моль (неизвестно)/кг бензола
Мы взяли смесь 1.55%.
Таким образом, на 1.55 г раствора приходится 1.55% массы, что означает 100 г неизвестного вещества.
Следовательно, неизвестная молярная масса будет отношением:
Молярная масса = рассчитанная из бензольного метода/ 0.728 моль
Молярная масса газа
Определить молярную массу газа (мольную), если масса его 500 миллилитров при нормальных условиях равна 0,625 грамм.
Решение задачи
Молярная масса газа связывает между собой две физические величины: массу вещества и химическое количество вещества.
Зная объем порции газа, определим химическое количество вещества этой порции газа по формуле, устанавливающей связь между химическим количеством и объемом газа:
Учитывая, что 500 мл = 0,5 л, получаем:
n (газа) = 0,5 / 22,4 = 0,022 (моль).
А затем, зная массу газа и количество вещества, вычислим молярную массу газа по формуле, устанавливающей связь между массой газа и химическим количеством:
M (газа) = 0,625 / 0,022 = 28 (г/моль).
Ответ:
молярная масса газа равна 28 г/моль.
Как найти массу вещества если известен его объём?
При нормальных условиях молярный объём газа равен 22,4 л/моль.
…
Массу вещества можно найти несколькими способами:
- Умножив количество вещества на молярную массу: m (г) = n (моль)×M (г/моль).
- Произведением объёма раствора и его плотности: m = V (л) ×ρ (г/л).
- Перемножив массовую долю с массой раствора: m = m(р—ра) × ω.
Как найти массу если есть объём?
Вес можно рассчитать по формуле: m=V*p, где р – плотность, V – объем материала. Например, 10 м3 речного песка весят 13 тонн. Если известна масса материала, то объем можно узнать по формуле: V = m/ p.
Как найти объём газа в химии зная массу?
Единица измерения молярного объёма газа : л/моль. При нормальных условиях Vм = 22,4 л/моль. Из определения для Vм следует, что Vв = Vм *nв = Vм *mв Mв. Это выражение позволяет рассчитывать по массе газа его объём.
Как найти количество вещества Если дан объём?
Выразим из формулы молярного объёма n : n ( X ) = V ( X ) V m — химическое количество газа можно вычислить, если его объём разделить на молярный объём.
Как найти массу вещества в реакции?
И наоборот, массу вещества определяют как произведение молярной массы на количество вещества: m = n . M. Так, масса 0,1 моля Na составляет 0,1 моль×23 г/моль = 2,3 Молярная масса численно всегда совпадает с молекулярной массой (или атомной массой — если вещество состоит не из молекул, а из атомов).
Как можно найти массу вещества?
m ( X ) = n ( X ) ⋅ M ( X ) — масса вещества равна произведению его количества на молярную массу.
Как найти массу?
Масса тела выражается через плотность и объем следующей формулой: Масса тела — есть произведение плотности вещества из которого состоит тело на его объем. … m — масса тела, (килограмм), ρ — плотность вещества, (кг/м³).
Как найти массу растворенного вещества?
Массу растворённого вещества вычислим по формуле: m ( в − ва ) = w ( в − ва ) ⋅ m ( р − ра ) ; m ( H 2 SO 4 ) = w ( H 2 SO 4 ) ⋅ m ( р − ра ) = 0,64 ⋅ 200 = 128
Что такое 22 4 в химии?
Итак, 22,4 л – МОЛЯРНЫЙ ОБЪЕМ ГАЗОВ при нормальных условиях. Это очень важная величина, которую следует запомнить. … Остается выяснить, как была определена постоянная Авогадро – число молекул газа в 22,4 л газа и в 1 моле любого вещества.
Как найти массу газа?
Расчет массы газа.
Расчет массы газа проводится также с помощью уравнения состояния идеального газа. mг=(V⋅P⋅M)/(T⋅R), где P — давление газа в сосуде, M — молярная масса газа, T — температура газа в сосуде, R — универсальная газовая постоянная.
Как найти количество вещества через концентрацию?
Количество растворенного вещества : = c•V, где c – молярная концентрация растворенного вещества в моль/л, V – объем раствора в л.
Как найти объем с помощью количества вещества?
Объем твердого вещества определяется по формуле V = m/плотность. Объем газа вычисляется по формуле V = n*Vm , где молярное количество n = m/M.
Как вычислить объём кислорода?
V = RTM/mP. Как видите, если у вас имеются необходимые для расчетов данные (температура, масса и давление кислорода), вычислить его объем очень просто. Поскольку значения R (8,31) и m (32) вам и так известны.
Как вычислить массу одной молекулы газа
Молекула, хоть размеры ее и ничтожны, имеет массу, которую можно определить. Вы можете выразить массу одной молекулы газа как в относительных атомных единицах, так и в граммах.
Относительная молекулярная масса – это безразмерная величина, показывающая массу молекулы относительно 1/12 массы атома углерода, измеряется в относительных атомных единицах.
Пример 1: Определите относительную молекулярную массу СО2. Одна молекула углекислого газа состоит из одного атома углерода и двух атомов кислорода. Найдите в таблице Менделеева значения атомных масс для этих элементов и запишите их, округлив до целого числа: Ar(C) = 12; Ar(O) = 16.
Вычислите относительную массу молекулы СО2, сложив массы атомов, ее составляющих: Мr(CO2) = 12 + 2*16 = 44.
Пример 2. Как выразить массу одной молекулы газа в граммах рассмотрите на примере того же углекислого газа. Возьмите 1 моль СО2. Молярная масса СО2 численно равна молекулярной: М(СО2) = 44 г/моль. Один мольлюбого вещества содержит 6,02*10^23 молекул. Это число называется постоянной Авогадро и обозначается символом Na. Найдите массу одной молекулы углекислого газа: m(CO2) = M(CO2)/Na = 44/6,02*10^23 = 7,31*10^(-23) грамм.
Пример 3. Вам дан газ с плотностью 1,34 г/л. Требуется найти массу одной молекулы газа. По закону Авогадро нормальных условиях один моль любого газа занимает объем 22,4 литра. Определив массу 22,4 литров, вы найдете молярную массу газа: Mг = 22,4*1,34 = 30 г/моль
Теперь, зная массу одного моля, вычислите массу одной молекулы аналогично примеру 2: m = 30/6,02*10^23 = 5*10^(-23) грамм.