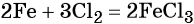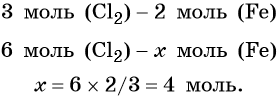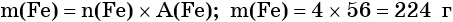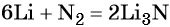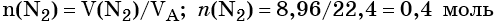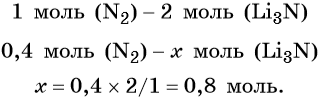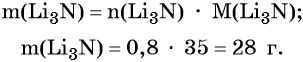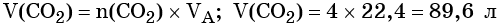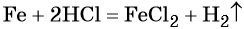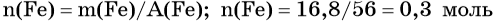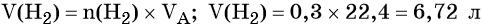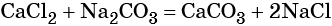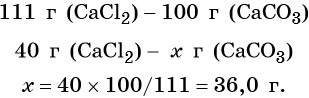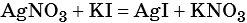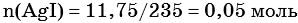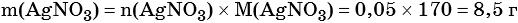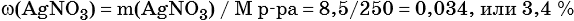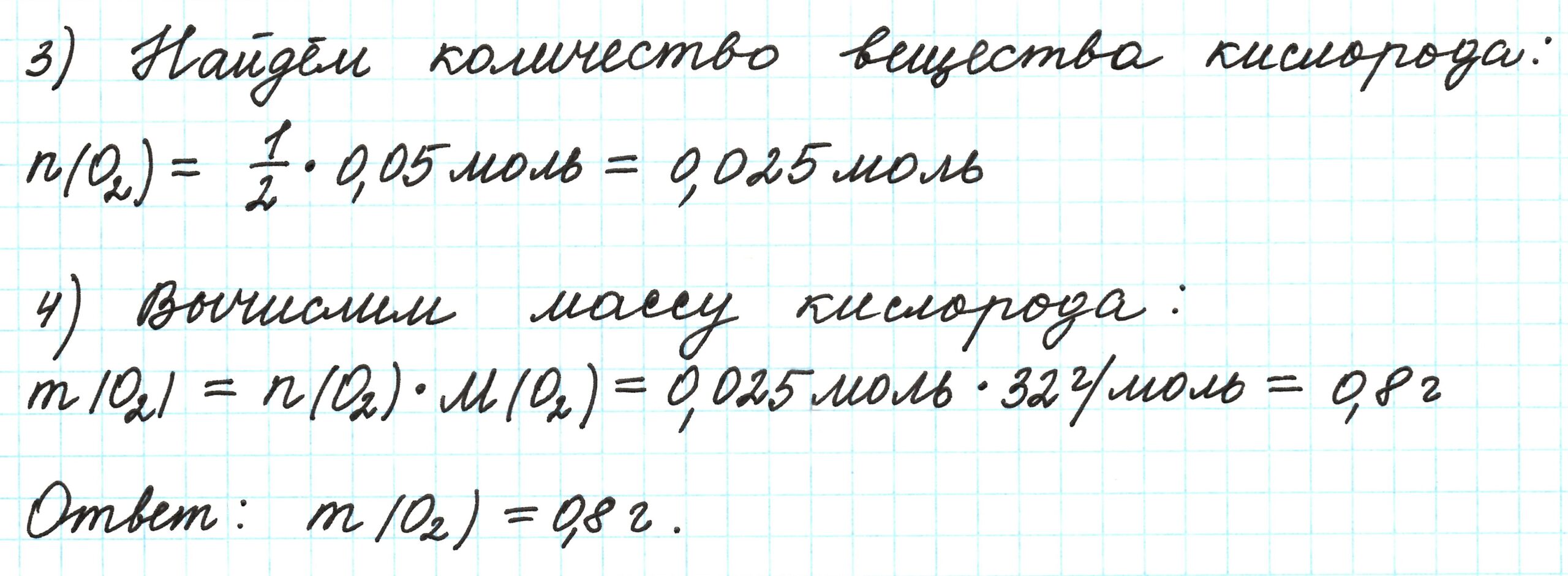Решение расчетных задач на вычисление массы или количества продукта реакции, если один из реагентов взят в избытке
В условиях задач такого типа указаны массы или объёмы двух реагирующих веществ, одно из которых дано в избытке, поэтому при решении таких задач нужно определить, какое вещество взято в избытке. Расчёт массы или объёма продукта реакции ведётся по данным вещества взятого в недостатке.
I. Алгоритм решения задачи: «Вычисление массы или количества продукта реакции, если один из реагентов взят в избытке»
Пример 1. Смешали два раствора, содержащих соответственно 33,3г хлорида кальция и 16,4г фосфата натрия. Вычислите массу осадка.
|
Последовательность выполнения действий |
Оформление решения задачи |
|
1. Записываем условие задачи |
Дано: m(CaCl2)=33,3г m(Na3PO4)=16,4г _______________ Найти: m(Ca3(PO4)2) =? |
|
2. Вычислим молярные массы для формул, записанных вдано |
M(CaCl2)=111г/моль M(Na3PO4)=164г/моль M(Ca3(PO4)2) =310г/моль |
|
3. Вычислим количества веществ, масса которых дана в условии |
ν(CaCl2)=m/M=33,3г/111г/моль=0,3моль ν(Na3PO4)=16,4г/164г/моль=0,1моль |
|
4. Запишем УХР. Расставим коэффициенты. Под формулами напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
|
5. Определим, какой из реагентов взят в избытке. Для этого сравним дроби. |
CaCl2 – взят в избытке, расчёт ведём по недостатку, т.е. поNa3PO4. |
|
6. Вычислим количество вещества, массу которого нужно найт |
По УХР: ν(Ca3(PO4)2)= (0,1моль∙1моль)/2моль=0,05моль |
|
7.Вычислим искомую массу |
m(Ca3(PO4)2)= ν(Ca3(PO4)2 )∙ M(Ca3(PO4)2) = 0,05моль ∙ 310г/моль =15,5г |
|
8. Запишем ответ |
Ответ: m(Ca3(PO4)2) =15,5г |
Пример 2. Вычислите объём водорода (н.у.), который образуется при взаимодействии 6,5 г цинка с соляной кислотой массой 7,5 г.
|
Последовательность выполнения действий |
Оформление решения задачи |
|
1. Записываем условие задачи |
Дано: m(Zn)=6,5г m(HCl)=7,5г Vm=22,4л/моль _______________ Найти: V(H2) =? |
|
2. Вычислим молярные массы для веществ с известной массой, записанных в дано |
M(Zn)=65г/моль M(HCl)=36,5г/моль |
|
3. Вычислим количества веществ, масса которых дана в условии |
ν(Zn) = m/M= 6,5/65г/моль=0,1моль ν(HCl)=7,5г/36,5г/моль=0,205моль |
|
4. Запишем УХР. Расставим коэффициенты. Под формулами напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
|
5. Определим, какой из реагентов взят в избытке. Для этого сравним дроби. |
НCl – взят в избытке, расчёт ведём по недостатку, т.е. по Zn. |
|
6. Вычислим количество вещества, объём которого нужно найти |
По УХР: ν(H2) = ν(Zn)=0,1моль |
|
7.Вычислим искомый объём |
V(H2)= ν(H2)∙ Vm = 0,1моль ∙ 22,4л/моль =2,24л |
|
8. Запишем ответ |
Ответ: V(H2)= 2,24л |
II. Алгоритм решения задач на «Избыток — недостаток» (в общем виде)
Расчёты по уравнению реакции, если один из реагентов взят в избытке
Дано: m (ν, V, W) реагентов
Найти: m (ν, V, W) продукта
Решение:
1. Составляем уравнение реакции
2. Нахождение количества вещества реагентов ν(А) и ν(В):
ν = m/M;
ν = V/Vm;
Wвещества = (mвещества •100%)/mраствора;
mвещества= (Wвещества• mраствора)/100%
3. Сравнение дробей – нахождение недостатка:
Если, ν(А)/a > ν(В)/b, то вещество В в недостатке, расчёт ν(С) ведём по ν(В)
Если, ν(А)/a < ν(В)/b, то вещество А в недостатке, расчёт ν(С) ведём по ν(А)
Если, ν(А)/a = ν(В)/b, то расчёт ν(С) ведём по ν(В) или ν(А)
4. Определение ν(С) по УХР путём составления и решения пропорции:
ν(В)/b = ν(С)/с или ν(А)/a = ν(С)/с
5. Нахождение величин, требуемых по условию:
m = ν•M;
V = ν• Vm;
Wвещества = (mвещества •100%)/mраствора
Здесь,
m — масса вещества (г)
ν — количество вещества (моль)
V — объём (л)
W — массовая доля вещества (%)
III. Решите следующие задачи
- Вычислите массу осадка, образующегося при взаимодействии 160 г сульфата железа (III) и 41,6 г хлорида бария.
- Вычислите объем углекислого газа, который можно получить при взаимодействии карбоната кальция массой 7 г с соляной кислоты массой 6 г.
Расчёты по уравнениям химических реакций
Расчёты по уравнениям химических реакций (стехиометрические расчёты) основаны на законе сохранения массы. Уравнение химической реакции показывает:
1) в каких количественных соотношениях реагируют и образуются вещества;
2) в каких отношениях масс реагируют и образуются вещества.
Если в реакции участвуют газообразные и парообразные вещества, то химическое уравнение реакции показывает, в каких объёмных соотношениях они реагируют и образуются.
Пользуясь уравнением химической реакции, можно производить вычисления, имеющие большое значение в лабораторной практике и на производстве. На основе химических уравнений вычисляют количество вещества реагирующих или полученных веществ, массу, объём (для газообразных веществ).
Уравнение химической реакции содержит обычно больше информации, чем нужно для решения задачи. Поэтому, прочитав условие задачи и написав уравнение химической реакции, надо обратить внимание на то, какая величина является данной и какая искомой. Далее надо определить, в каких единицах должен быть дан ответ (в единицах количества вещества, массы или объёма). Необходимо стремиться к наиболее рациональным вычислениям, что может быть достигнуто использованием различных единиц массы и объёма.
Расчёты количественных величин искомого вещества по уравнению химической реакции основываются на данных об известном веществе, которые могут быть указаны с использованием разных величин (массы, объёма, количества вещества).
В задачах данного вида исходное вещество содержится в растворе, поэтому найти массу растворённого вещества можно по формуле:
`m_((«р».»в».))=m_((«р-ва»))*omega_((«р».»в».))`.
Если заданы объём и плотность раствора, то массу растворённого вещества можно найти по формуле:
`m_((«р».»в».))=V*rho*omega_((«р».»в».))`.
Массовую долю вещества в смеси или растворе вычисляют как отношение массы вещества, входящего в состав смеси, к массе всей смеси. Выражают либо в долях единицы, либо в процентах (чаще всего).
$$ {omega }_{mathrm{в}-mathrm{ва}}={displaystyle frac{{m}_{mathrm{в}-mathrm{ва}}}{{m}_{mathrm{раствора}}}}·100%, {omega }_{mathrm{в}-mathrm{ва}}={displaystyle frac{{m}_{mathrm{в}-mathrm{ва}}}{{m}_{mathrm{смеси}}}}·100%$$.
По уравнениям химических реакций можно рассчитывать количество вещества, массу или объём реагирующих веществ и продуктов реакции. Количества вещества соединений, вступающих в химическую реакцию и образующихся в результате реакции, пропорциональны друг другу и относятся как коэффициенты перед формулами этих соединений в уравнении реакции.
Зная количество вещества одного из реагентов, можно найти количества вещества других участников данной реакции, а по количеству вещества достаточно легко выйти на массу или объём.
Вещества реагируют друг с другом в строго определенных количественных соотношениях. Для проведения химической реакции исходные вещества могут быть взяты в любых количествах, причём одно из реагирующих веществ может быть взято в избытке, другое – в недостатке. Главная задача — определить, какое из реагирующих веществ было взято в избытке, а какое в недостатке. Определив это, дальнейший расчёт задачи вести строго по тому веществу, которое было взято в недостатке. Это можно объяснить тем, что вещество, находящееся в недостатке, прореагирует полностью, и количество вещества данного реагента будет точно известно.
Для того чтобы определить, какое из реагирующих веществ будет в избытке, а какое – в недостатке, необходимо вычислить количества вещества реагентов и сравнить их. Если количества вещества реагентов, участвующих в химической реакции, одинаковы, то в избытке будет то вещество, количество которого больше в соответствии с условиями задачи. Если же вещества реагируют в неравных количествах, то для расчёта избытка и недостатка следует учитывать коэффициенты в уравнении реакции.
При проведении расчётов по уравнениям химических реакций полагают, что исходные вещества полностью превратились в продукты реакции и что количества веществ, образующихся в результате реакции, строго соответствуют количествам вступивших в реакцию веществ.
Расчёты по уравнению химической реакции основаны на законе сохранения массы вещества. Осуществляя расчёты по химическому уравнению, мы получаем теоретический `100 %`-ный выход продукта реакции.
На самом деле масса образующихся продуктов часто бывает меньше той, которая должна образоваться в соответствии с расчётом по уравнению химической реакции. Это связано, прежде всего, с неполным протеканием реакций в реальных химических процессах и с некоторыми потерями веществ.
Выход продукта реакции – это отношение массы практически полученного продукта к массе вещества, которая должна получиться теоретически:
`eta=m_»практ»/m_»теор»*100%`.
Зная массу исходного вещества и долю выхода продукта реакции, можно рассчитать практическую массу образующегося в результате реакции вещества. Для этого вычисляют теоретические значения этих величин, а затем с использованием формул вычисляют их практические значения:
$$ {m}_{mathrm{практ}}={displaystyle frac{{m}_{mathrm{теор}}·eta }{100%}}$$.
В случае газообразных веществ рассчитывают объёмную долю выхода продукта.
Объёмная доля выхода продукта – это отношение объёма практически полученного газообразного продукта к объёму газообразного вещества, который должен получиться теоретически:
`varphi=V_»практ»/V_»теор»*100%`.
Вычисление количества вещества, массы или объема вещества по количеству веществ, массе или объему одного из реагентов или продуктов реакции
Основой для проведения количественных расчётов в химии является закон сохранения массы. Согласно этому закону масса реагентов равна массе продуктов реакции.
Отсюда следует, что для любой химической реакции массы реагентов и продуктов реакции относятся между собой как молярные массы веществ, умноженные на их стехиометрические коэффициенты.
Для расчёта по химическим уравнениям можно использовать два эквивалентных способа: через количество вещества или через пропорцию. Подчеркнём ещё раз: официального запрета на использование метода пропорций при решении задач на ОГЭ и ЕГЭ нет!
Для определения массы (или количества вещества) продуктов реакции или исходных веществ по уравнениям химических реакций вначале составляют уравнение химической реакции и устанавливают стехиометрические коэффициенты; затем определяют молярную массу, массу и количество вещества известных реагентов химической реакции; составляют и решают пропорцию, в которую в зависимости от условий задачи вводят числовые значение величин: молярные массы, массы, количества веществ или их объёмы (для газов).
При этом в одном столбце пропорций должны находиться одинаковые характеристики вещества с одной и той же размерностью.
Пример 1. Масса железа, вступившего в реакцию с 6 моль хлора, равна _________ г. (Ответ запишите с точностью до целого числа.)
Решение. Составляем уравнение химической реакции:
Из этого уравнения следует, что 3 моль Cl2 реагируют с 2 моль Fe, т. е.:
Определяем массу железа:
Пример 2. Масса нитрида лития, образовавшегося в результате его реакции с азотом объёмом 8,96 л, равна_______________ г.
Решение. Составляем уравнение химической реакции:
Определяем количество вещества азота, вступившего в реакцию:
Из уравнения реакции следует, что из 1 моль N2 образуется 2 моль Li3N, т. е.:
Определим массу Li3N:
Пример 3. Объём углекислого газа, образовавшегося в результате разложения карбоната магния количеством вещества 4 моль избытком соляной кислоты, равен________ л.
Решение. Составляем уравнение химической реакции:
Из этого уравнения следует, что количество вещества углекислого газа и карбоната магния равны между собой, т. е. n(CO2) = 4 моль.
Определим V(CO2):
Пример 4. Объём водорода, который выделится при растворении 16,8 г железа в избытке разбавленной соляной кислоты, равен _________ л.
Решение. Составляем уравнение химической реакции:
Определим количество вещества железа:
Количество вещества железа и водорода в данном уравнении реакции равны между собой. Следовательно, количество вещества водорода также равно 0,3 моль.
Вычислим объём водорода:
Пример 5. Масса осадка, который образуется в результате взаимодействия 40,0 г хлорида кальция с избытком карбоната натрия, равна _________г.
Решение. Составляем уравнение реакции:
Согласно уравнению химической реакции составим пропорцию и решим её:
Пример 6. 250 г раствора нитрата серебра смешали с избытком раствора йодида калия. Выпал осадок массой 11,75 г. Вычислите массовую долю нитрата серебра в исходном растворе.
Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла)
1) Составлено уравнение химической реакции:
2) По массе осадка йодида серебра рассчитано его количество вещества, а затем в соответствии с уравнением реакции — количество вещества и масса нитрата серебра, содержащегося в исходном растворе:
Из уравнения реакции следует, что n(AgI) = n(AgNO3) = 0,05 моль, тогда:
3) Вычислена массовая доля нитрата серебра в исходном растворе:
| Критерии оценивания | Баллы |
| Ответ правильный и полный, включает все названные элементы | 3 |
| Правильно записаны два первых элемента из названных выше | 2 |
| Правильно записан один из названных выше элементов (1-й или 2-й) | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 3 |
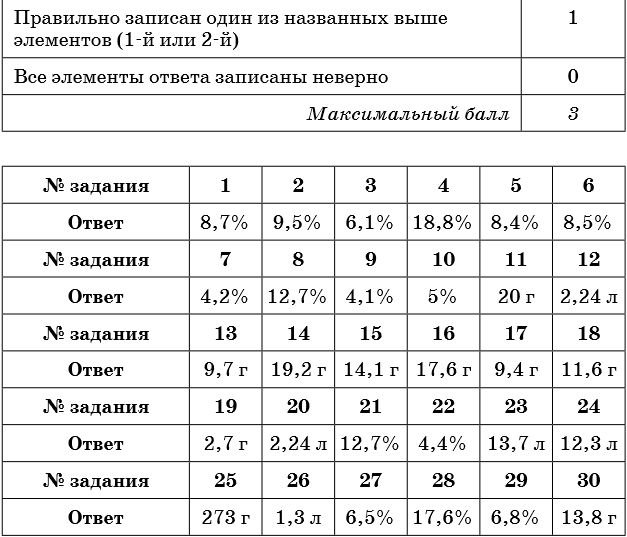
Тренировочные задания
1. К 300 г раствора нитрата бария прибавили избыток раствора сульфата натрия. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
2. К 150 г раствора сульфата натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
3. К 300 г раствора силиката натрия прибавили избыток раствора нитрата кальция. Масса выпавшего осадка составила 12,0 г. Определите концентрацию соли в исходном растворе.
4. К 150 г раствора карбоната калия прибавили избыток раствора соляной кислоты. При этом выделился газ объёмом 3,36 л (н. у.). Определите концентрацию соли в исходном растворе.
5. К 250 г раствора гидрокарбоната натрия прибавили избыток раствора бромоводородной кислоты. При этом выделился газ объёмом 5,6 л. Определите концентрацию соли в исходном растворе.
6. К 50 г раствора карбоната натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
7. К 200 г раствора хлорида бария прибавили избыток раствора карбоната калия. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
8. К 200 г раствора хлорида железа (II) прибавили избыток раствора гидроксида калия. Масса выпавшего осадка составила 18,0 г. Определите концентрацию соли в исходном растворе.
9. К 400 г раствора нитрата свинца прибавили избыток раствора йодида натрия. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
10. К 300 г раствора йодида натрия прибавили избыток раствора нитрата свинца. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
11. Определите массу осадка, который выпадет при взаимодействии 150 г 14,8%-ного раствора хлорида кальция с избытком раствора карбоната натрия.
12. Определите объём газа (н. у.), который выделится при взаимодействии 120 г 8,8%-ного раствора карбоната натрия с избытком раствора соляной кислоты.
13. Определите массу соли, которая выпадет в осадок при взаимодействии 140 г 13,5%-ного раствора нитрата цинка с избытком раствора сульфида натрия.
14. Определите массу осадка, который выделится при взаимодействии 200 г 18,8%-ного раствора нитрата меди с избытком раствора сульфида натрия.
15. Определите массу осадка, который выпадет при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора хлорида цинка.
16. Определите массу осадка, который выделится при взаимодействии 200 г 12,7%-ного раствора хлорида железа (II) с избытком раствора сульфида натрия.
17. Определите массу осадка, который выделится при взаимодействии 50 г 17%-ного раствора нитрата серебра с избытком раствора бромида калия.
18. Определите массу осадка, который образуется при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора нитрата кальция.
19. Определите массу осадка, который образуется при взаимодействии 50 г 5,8%-ного раствора хлорида магния с избытком раствора фосфата натрия.
20. Определите объём газа, который выделится при взаимодействии 200 г 6,9%-ного раствора карбоната калия с избытком раствора соляной кислоты.
21. Оксид фосфора (V) массой 21,3 г растворили в растворе гидроксида калия, в результате чего был получен раствор средней соли массой 500 г. Определите концентрацию фосфата калия в конечном растворе.
22. Раствор хлорида железа (II) полностью прореагировал со 120 г раствора гидроксида натрия, в результате чего образовалось 6,0 г осадка. Определите массовую долю гидроксида натрия в исходном растворе.
23. Какой объём аммиака (н. у.) может полностью прореагировать со 150 г 20%-ного раствора серной кислоты с образованием средней соли?
24. В 200 г 20%-ного раствора соляной кислоты растворили магний до прекращения выделения газа. Определите объём выделившегося при этом водорода (н. у.).
25. Аммиак объёмом 10 л (н. у.) пропустили через раствор серной кислоты с массовой долей 8% до образования средней соли. Определите массу исходного раствора.
26. Определите объём сероводорода (н. у.), который необходимо пропустить через 130 г 6%-ного раствора хлорида меди (II) до полного осаждения сульфида меди (II).
27. Сероводород объёмом 3,36 л (н. у.) пропустили через раствор гидроксида натрия, в результате чего получили 180 г раствора сульфида натрия. Определите массовую долю соли в полученном растворе.
28. Алюминий массой 8,1 г может нацело прореагировать с 250 г раствора серной кислоты. Определите массовую долю серной кислоты в исходном растворе.
29. К 250 г раствора нитрата серебра добавили раствор хлорида калия до прекращения выделения осадка, масса которого составила 14,35 г. Определите массовую долю нитрата серебра в исходном растворе.
30. К 300 г 5%-ного раствора хлорида магния добавили избыток раствора фосфата калия. Вычислите массу выпавшего при этом осадка.
Ответы
РАСЧЕТЫ ПО ХИМИЧЕСКИМ УРАВНЕНИЯМ, или Как вычислить массу вещества (или объем газа) по известному количеству вещества одного из вступающих в реакцию или образующихся в результате нее веществ
Расчеты по химическим уравнениям являются одними из самых широко используемых в химии.
Это самый простой тип расчетных задач, в основе которых лежит химическое уравнение.
Содержание
Особенности задач с расчетами по химическим уравнениям
Основной алгоритм расчетов с использованием химических уравнений
Расчеты по химическим уравнениям: примеры
Особенности задач с расчетами по химическим уравнениям
В задачах с расчетами по химическим уравнениям речь идет о каком-либо химическом превращении (например, разложении) одного какого-то вещества или химическом взаимодействии двух или нескольких веществ. Причем:
- Масса или объем одного из них известны. Требуется найти массу или объем продукта реакции – вещества (или одного из веществ), образующегося в результате взаимодействия.
- Либо, наоборот, известны масса или объем образовавшегося вещества, требуется найти массу или объем исходного вещества.
- Либо известны масса или объем одного из реагентов, необходимо вычислить массу или объем второго реагента.
Прежде, чем приступить к вычислениям, важно составить уравнение реакции взаимодействия и правильно расставить коэффициенты.
Необходимо помнить, что коэффициенты, стоящие перед формулами веществ в уравнении реакции, показывают, в каких эквивалентных (достаточных, необходимых, пропорциональных) количествах реагируют вещества. Эти количества называют «количествами вещества по уравнению реакции» и записывают под формулами соответствующих веществ в уравнении.
Те количества вещества, которые находят, используя данные задачи, называют «количествами вещества по условию задачи» и в уравнение не записывают.
В ходе решения сравнивают «количества вещества по уравнению реакции» для того, чтобы узнать, в каком соотношении находятся вещества, о которых идет речь в задаче. Используя данные об этом соотношении, определяют «количества вещества по условию задачи». А затем, применяя основную расчетную формулу, вычисляют искомые массу или объем вещества.
Основной алгоритм расчетов с использованием химических уравнений
Основные шаги, которые необходимо сделать при решении задач с использованием химических уравнений, можно отобразить в виде схемы:
Расчеты по химическим уравнениям: примеры
Приведем несколько примеров с расчетами по химическим уравнениям.
Пример 1. В избытке воды растворили 11,5 г металлического натрия. Какой объем водорода выделился при этом?
- Так как в задаче говорится о химическом процессе: натрий реагирует с водой, — то запишем уравнение реакции.
- Над формулами веществ в уравнении реакции расставим данные условия задачи.
- Под формулами веществ в уравнении реакции расставим количества вещества (они соответствуют коэффициентам, стоящим перед формулами веществ, это эквивалентные количества), молярную массу натрия (смотрим по таблице Менделеева) и молярный объем для водорода (так как требуется найти объем этого газа, а не массу).
- В условии говорится, что натрий реагирует с избытком воды. Это означает только то, что её будет достаточно для взаимодействия с металлом.
Пример 2. Кальций массой 2 г прореагировал с кислородом. Какая масса кислорода вступила в реакцию?
- Так как в задаче говорится о химическом процессе: кальций реагирует с кислородом, — то запишем уравнение реакции.
- Над формулами веществ в уравнении реакции расставим данные условия задачи.
- Под формулами веществ в уравнении реакции расставим количества вещества (они соответствуют коэффициентам, стоящим перед формулами веществ, это эквивалентные количества), молярные массы (смотрим и считаем по таблице Менделеева).
Пример 3. Смесь, состоящую из 3 г магния и 3,9 г цинка, сплавили с серой, которая находилась в избытке. Рассчитайте массу полученной смеси сульфидов металлов.
- В составе смеси два металла: магний и цинк. Однако каждый из них прореагирует с серой самостоятельно. Поэтому запишем два уравнения реакции и решим фактически две задачи в одной.
- Над формулами веществ в уравнениях реакций расставим данные условия задачи.
- Под формулами веществ в уравнениях реакций расставим количества веществ (они соответствуют коэффициентам, стоящим перед формулами веществ, это эквивалентные количества), молярные массы (смотрим и считаем по таблице Менделеева).
- Поскольку требуется найти массу смеси образовавшихся сульфидов, то рассчитаем массу каждого из них из соответствующего уравнения. Укажем это в уравнениях над формулами сульфидов.
- Избыток серы говорит только о том, что ее будет достаточно для полного реагирования как магния, так и цинка.
Итак, при расчетах по химическим уравнениям важно правильно записать уравнение реакции и расставить коэффициенты.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
АЛГОРИТМЫ РЕШЕНИЯ ЗАДАЧ ПО ХИМИИ
- Физические величины, используемые при решении задач
- Алгоритм вычисления массы (объёма) продукта реакции по известной массе или объёму исходного вещества, содержащего примеси
- Алгоритм определения массовой доли элемента в соединении
- Алгоритм определения массовых соотношений элементов в соединении
- Алгоритм определения молекулярной формулы вещества по массовым соотношениям элементов
- Алгоритм расчёта выхода продукта реакции от теоретически возможного
- Алгоритм решения задачи на расчёт по уравнению реакции, если одно из реагирующих веществ дано в избытке
- Алгоритм решения задачи на определение молекулярной формулы вещества по продуктам сгорания
- Алгоритм определения массовой доли примесей по массе (объёму) продуктов реакции
- Алгоритм определения молекулярной формулы кристаллогидрата
- Алгоритм вычисления количества вещества продукта реакции по массовой доле исходного вещества в растворе
- Алгоритм составления термохимического уравнения реакции (ТХУ)
- Алгоритм расчёта по термохимическим уравнениям реакций
- Алгоритм определения состава смеси
- Алгоритм вычисления относительной плотности газа
- Алгоритм вычисления объёма вещества по известной массе вещества
- Алгоритм решения задач по уравнению химической реакции
- Алгоритм решения задач на концентрацию растворов
Физические величины, используемые при решении задач
|
наименование величины |
обозначение |
единица измерения |
пример формы записи |
можно найти по формулам |
|
масса вещества |
m |
мг; г; кг |
m (H2O) = 15 г |
m= М· ν m= ρ · М m= N/ NA · М m= V/ Vm· М mраств. в-ва= ω · mраствора mраствора = mраств. в-ва/ ω m = V · ρ |
|
относительная атомная масса |
Ar |
безразмерная |
Ar (C) = 12 |
Ar смотрим в таблице Менделеева |
|
относительная молекулярная масса |
Mr |
безразмерная |
Mr(H2O) = 18 |
Mr(H2O) = 2 Ar(H) + Ar(O) = 2 · 1 + 16 = 18 |
|
количество вещества |
ν (ню) или n |
моль |
ν(CH4) = 1,2 моль |
ν = m/ М ν = V/ Vm ν = N/ NA |
|
молярная масса (численно равна относительной молекулярной масса) |
М |
г/моль; кг/моль |
M(H2O) =18г/моль |
М = m/ ν |
|
объём вещества (1 моль любого газа при нормальных условиях занимает 22,4 л) |
V |
мл; л; м3 |
V(O2) = 10 л |
V = Vm· ν V=(m/ М) · Vm V = m/ ρ |
|
молярный объём (нормальные условия) |
Vm |
л/моль; м3/моль |
Vm= 22,4 л/моль |
Vm= V/ ν Vm= М/ ρ Vm= V· (М/ m) |
|
плотность вещества |
ρ (ро) |
г/мл; г/см3; кг/м3 |
ρ(H2O) = 1 г/мл |
ρ = m/ V ρ = М/ Vm ρгаза = Мгаза/ Vm |
|
относительная плотность |
D |
безразмерная |
D H2 = 16 |
Dгаза по H2 = Мгаза/ 2 г/моль Dгаза по воздуху = Мгаза/ 29 г/моль |
|
массовая доля вещества в растворе или в смеси |
ω (омега) |
безразмерная или в % |
ω (С) = 0,45 или 45% |
ω = mраств. в-ва/ mраствора |
|
массовая доля элемента в соединении (веществе) |
ω (омега) |
безразмерная или в % |
ω (С) = 0,45 или 45% |
ω = n Ar/ Mr, где n – число атомов элемента в соединении |
|
объёмная доля газа в смеси |
φ (фи) |
безразмерная или в % |
φ (H2O) = 0,15 или 15% |
φ = V раств. в-ва/ V раствора |
|
массовая доля выхода вещества в реакции |
η (эта) |
безразмерная или в % |
η (СО2) = 0,25 или 25% |
η = mпракт.вых/ mтеор. η = νпракт.вых/ νтеор. η = Vпракт.вых/ Vтеор. |
|
число Авогадро |
NA |
число частиц (атомов, молекул) |
NA = 6,02 · 1023 |
NA = N/ ν |
|
число частиц вещества |
N |
атомы, молекулы |
N(NaOH) = 3,01 · 1023 |
|
|
массовая доля чистого вещества |
ω (омега) |
безразмерная или в % |
ω (СО2) = 0,25 или 25% |
ωчист.в-ва = mчист.в-ва/ mсмеси |
Алгоритм вычисления массы (объёма) продукта реакции по известной массе или объёму исходного вещества, содержащего примеси
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
количественный метод |
|
|
1.Прочитайте текст задачи. |
1.Сколько граммов оксида кальция можно получить из 400г известняка, содержащего 20% примесей? |
|
2.Запишите условие и требование задачи с помощью общепринятых обозначений. |
2.Дано: m(CаСO3) = 400 г ω прим.= 20% (0,2) m(CаO)=? |
|
3.Составьте уравнение химической реакции. |
3.Решение: CаСO3 = CаО + СO2 |
|
4.Массу чистого вещества (как и объём) можно вычислить двумя способами 1 способ: ω (чист.вещ-ва)= 100% — ω прим. ω (чист.вещ-ва) = m (чист.вещества) / m (смеси) Отсюда: m (чист.вещ-ва) = m (смеси) · ω (чист.вещ-ва) 2 способ: m (примеси) = m (смеси) · ω (примеси) m (чист.вещества) = m (смеси) — m (примеси) |
4.Решение: 1 способ: ω (чист.вещества) CаСO3= 100% — 20% = 80% или 0,8 m (чист.вещества) CаСO3= 400г · 0,8 = 320 г 2 способ: m (примеси) = 400 г · 0,2 = 80 г m (чист.вещества) CаСO3= 400 г – 80 г = 320 г Выбирай понятный для тебя способ решения! |
|
5.В уравнении одной чертой подчеркните формулы веществ, о которых идёт речь в задаче. |
5.CаСO3 = CаО + СO2 |
|
6.Вычислите молярные массы этих веществ. |
6. М(CаСO3) = 40 + 12 + 16·3 = 100 г/моль М(СaO) = 40 + 16 = 56 г/моль |
|
7.Массу чистого вещества, полученную в пункте 4, переведите в количество вещества по формуле ν= m/М |
7.ν(CаСO3)= 320 г/100 г/моль = 3,2 моль |
|
8.Над подчёркнутой формулой известного вещества укажите величину, полученную в пункте 7, — показывает количество взятого реагента по условию задачи, над формулой вещества, массу которого надо найти, поставим Х моль. |
8. 3,2 моль Х моль CаСO3 = CаО + СO2 |
|
9. Под подчёркнутыми формулами исходного и образующегося веществ укажите количество вещества (число молей) согласно уравнению реакции (это будут коэффициенты, стоящие перед формулами веществ в уравнении реакции) — показывают необходимые количества исходного и образующегося веществ. |
9. 3,2 моль Х моль CаСO3 = CаО+ СO2 1моль 1моль |
|
10.Составить и решить пропорцию. |
10. 3,2 моль Х моль Х = 3,2 моль · 1 моль = 3,2 моль 1 моль 1 моль 1 моль ν (CаО) = 3,2 моль. |
|
11.Вычислите массу продукта реакции m(вещества)= ν( вещества) · М(вещества) |
11. m(СаО) =3,2 моль · 56 г/моль = 179,2 г |
|
12.Запишите ответ. |
12.Ответ: m(CаО) = 179,2 г. |
|
метод пропорций |
|
|
1. Повторить действия пунктов 1 – 6 количественного метода |
|
|
2. По формуле m= М · ν (где ν – коэффициент перед соответствующей формулой вещества в уравнении реакции) найдите массу вещества |
m= М · ν m(CаСO3) = 100 г/моль · 1 моль = 100 г m(СaO) = 56 г/моль · 1 моль = 56 г |
|
3. Над подчёркнутой формулой известного вещества укажите массу, полученную в пункте 4 количественного метода, над формулой вещества, массу которого надо найти, поставим Х г |
3. 320 г Х г CаСO3 = CаО+ СO2 |
|
4. Под соответствующей формулой записать массу, полученную в пункте 3 |
4. 320 г Х г CаСO3 = CаО+ СO2 100 г 56 г |
|
5. Составить и решить пропорцию |
5. 320 г = Х г Х = 320 г · 56 г = 179,2 г 100 г 56 г 100 г |
|
6.Запишите ответ. |
6.Ответ: m(CаО) = 179,2 г. |
Алгоритм определения массовой доли элемента в соединении
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
1.Прочитайте текст задачи. |
Вычислите массовую долю кислорода в перманганате калия. |
|
2.Запишите условие и требование задачи с помощью общепринятых обозначений. |
2.Дано: KMnO4 ω (О)=? |
|
3.Найдите молекулярную массу перманганата калия KMnO4 |
3.Решение: Mr(KMnO4) = Ar(K) + Ar(Mn) + 4Ar(O) = 39 + 55 + 4 · 16 = 142 |
|
4. По формуле |
4. |
|
5.Запишите ответ. |
Ответ: |
Алгоритм определения массовых соотношений элементов в соединении
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
1.Прочитайте текст задачи. |
Определить массовые соотношения железа и кислорода в оксиде железа (III) |
|
2.Запишите условие и требование задачи с помощью общепринятых обозначений. |
2.Дано: Fe2O3 |
|
3.Найдите относительную молекулярную массу оксида железа (III) |
3.Решение: Mr(Fe2O3) = 2Ar(Fe) + 3Ar(O) = 2 · 56 + 3 · 16 = 112 + 48 |
|
4. Вычислите простейшие массовые отношения, для чего сократите массы элементов на одно и то же число. |
4. |
|
5.Запишите ответ. |
Ответ: В оксиде железа (III) на 7 г атомов железа приходится 3 г атомов кислорода |
Алгоритм определения молекулярной формулы вещества по массовым соотношениям элементов
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
1.Прочитайте текст задачи. |
Химическое соединение содержит по массе 17,56% натрия, 39,69% хрома и 42,75% кислорода. Определите простейшую формулу соединения |
|
2.Запишите условие и требование задачи с помощью общепринятых обозначений. |
2.Дано:
NaxCryOz = ? |
|
3.Запишите относительные атомные массы для каждого элемента |
3.Решение: Ar(Na) = 23 Ar(Cr) = 52 Ar(O) = 16 |
|
4. Составьте пропорции соотношения массовой доли элемента к его относительной атомной массе |
4. x : y : z = 0,763 : 0,763 : 2,672 = 1 : 1 : 3,5 |
|
5. Если получается десятичная дробь, то необходимо избавиться от десятичной дроби. Для этого полученные цифры увеличиваем в 2 раза |
x : y : z = 2·1 : 2·1 : 2·3,5 = 2 : 2 : 7 |
|
6.Запишите ответ. |
Ответ: Простейшая формула вещества Na2Cr2O7 |
Алгоритм расчёта выхода продукта реакции от теоретически возможного
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
1.Прочитайте текст задачи. |
Определите объём (н.у.) оксида азота (II), образовавшегося при окислении 100 г аммиака в присутствии платинового катализатора, если выход продукта реакции составляет 85% |
|
2.Запишите условие и требование задачи с помощью общепринятых обозначений. |
2.Дано: m (NH3) = 100 г η (NO) = 85% = 0,85 V (NO) = ? |
|
3.Запишите уравнение реакции |
3.Решение: 4NH3 + O2 → 4NO + 6H2O |
|
4. Над формулами соответствующих веществ запишите то, что дано в условии задачи, и то, что надо найти |
100 г х л 4NH3 + O2 → 4NO + 6H2O |
|
5. Под уравнением записываем то, что следует из уравнения реакции с учётом условий задачи (массу аммиака и объём оксида азот (П) |
Mr (NH3) = Ar(N) + 3Ar(H) = 14 + 3 · 1 = 17 M (NH3) = 17 г/моль m (NH3) = 4 моль · 17 г/моль = 68 г V (NO) = ν (NO) · Vm = 4 моль · 22,4 л/моль = 89,6 л 100 г х л 4NH3 + O2 → 4NO + 6H2O 68 г 89,6 л |
|
6. Составьте пропорции и определите теоретически возможный объём оксида азота (П) |
|
|
7. По формуле находим практический объём оксида азота (П) |
Vпрактический = 0,85 · 132 л = 112,2 л |
|
8.Запишите ответ. |
Ответ: Vпрактический (NO) = 112,2 л |
Алгоритм решения задачи на расчёт по уравнению реакции, если одно из реагирующих веществ дано в избытке
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
1.Прочитайте текст задачи. |
Определите массу соли, образующейся при взаимодействии 10 г гидроксида натрия и 10 г азотной кислоты |
|
2.Запишите условие и требование задачи с помощью общепринятых обозначений. |
2.Дано: m (NaOH) = 10 г m(HNO3) = 10 г m (NaNO3) = ? |
|
3.Запишите уравнение реакции |
3.Решение: NaOH + HNO3 = NaNO3 + H2O |
|
4. Вычислить молярные массы веществ |
Mr(NaOH) = Ar(Na) + Ar(O) + Ar(H) = 23 + 16 + 1 = 40 M(NaOH) = 40 г/моль Mr(HNO3) = Ar(H) + Ar(N) + 3Ar(O) = 1 + 14 + 3 · 16 = 63 M(HNO3) = 63 г/моль Mr (NaNO3) = Ar(Na) + Ar(N) + 3Ar(O) = 23 + 14 + 3 · 16 = 85 M (NaNO3) = 85 г/моль |
|
5. Определим, какое вещество дано в избытке, какое – в недостатке по формуле |
0,25 |
|
6. Расчёты производим по веществу, которое дано в недостатке |
|
|
метод пропорций |
|
|
7. Над формулами соответствующих веществ запишите то, что дано в условии задачи (над веществом, данным в недостатке), и то, что надо найти |
10 г Х г NaOH + HNO3 = NaNO3 + H2O |
|
8. Под уравнением записываем то, что следует из уравнения реакции с учётом условий задачи (массу азотной кислоты и нитрата натрия) |
m(HNO3) = ν · M = 1 моль · 63 г/моль = 63 г m(NaNO3) = ν · M = 1 моль · 85 г/моль = 85 г 10 г Х г NaOH + HNO3 = NaNO3 + H2O 63 г 85 г |
|
9. Составьте пропорции и определите массу соли |
|
|
количественный метод |
|
|
Выполняем пункты 1 — 6 |
|
|
7. Над формулами соответствующих веществ запишите то, что дано в условии задачи (над веществом, данным в недостатке), и то, что надо найти |
0,159 моль Х г NaOH + HNO3 = NaNO3 + H2O |
|
8. Под уравнением записываем то, что следует из уравнения реакции с учётом условий задачи (количество азотной кислоты и массу нитрата натрия) |
0,159 моль Х г NaOH + HNO3 = NaNO3 + H2O 1 моль 85 г |
|
9. Составьте пропорции и определите массу соли |
|
|
10.Запишите ответ. |
Ответ: m(NaNO3) = 13,5 г |
Алгоритм решения задачи на определение молекулярной формулы вещества по продуктам сгорания
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
1.Прочитайте текст задачи. |
При сгорании 8,6 г бескислородного углеводорода образовалось 26,4 г оксида углерода (IV) и 12,6 г воды. Плотность углеводорода по воздуху равна 2,966. Определите молекулярную формулу углеводорода. |
|
2.Запишите условие и требование задачи с помощью общепринятых обозначений. |
2.Дано: m (CO2) = 26,4 г m(H2O) = 12,6 г m(вещества) = 8,6 г Dвозд. = 2,966 СхHy = ? |
|
3.Запишите уравнение реакции |
3.Решение: CxHy + O2 = CO2 + H2O |
|
4. Вычислить молярные массы веществ |
Mr(CO2) = Ar(C) + 2Ar(O) = 12 + 2 · 16 = 44 M(CO2) = 44 г/моль Mr(H2O) = 2Ar(H) + Ar(O) = 2 · 1 + 16 = 18 M(H2O) = 18 г/моль |
|
5. Определим, сколько грамм углерода содержится в 26,4 г углекислого газа |
44 г CO2 содержит 12 г С 26,4 г CO2 содержит Х г С |
|
6. Определим, сколько грамм водорода содержится в 12,6 г воды |
18 г H2O содержит 2 г Н 12,6 г H2O содержит Y г H |
|
7. Находим количество вещества углерода и водорода |
|
|
8. Составляем пропорцию |
Х : Y = 0,6 : 1,4 |
|
9. Избавляемся от десятичной дроби, умножив на 10 |
Х : Y = 6 : 14 |
|
10. Записать предполагаемую формулу вещества |
С6H14 |
|
11. Рассчитать молярную массу предполагаемого вещества |
Mr(С6H14) = 6Ar(C) + 14Ar(Н) = 6 · 12 + 14 · 1 = 86 M(С6H14) = 86 г/моль |
|
12. Рассчитать молярную массу вещества по плотности воздуха |
М(вещества) = Dвозд. · 29 = 2,966 · 29 = 86 г/моль |
|
13. Сравнить полученные результаты |
М(вещества) = M(С6H14) 86 г/моль = 86 г/моль |
|
14. Записать ответ |
Ответ: формула вещества С6H14 |
Алгоритм определения массовой доли примесей по массе (объёму) продуктов реакции
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
1.Прочитайте текст задачи. |
Определите массовую долю примесей в техническом образце карбида кальция, если из 200 г его получили 56 л ацетилена. |
|
2.Запишите условие и требование задачи с помощью общепринятых обозначений. |
2.Дано: m (CaC2) = 200 г V (C2H2) = 56 л ωпримесей = ? |
|
3.Запишите уравнение реакции |
3.Решение: CaC2 + 2Н2О = С2Н2 + Са(ОН)2 |
|
4. Пусть Х – масса чистого карбида кальция. Над формулой ацетилена запишите то, что дано в условии задачи |
Х г 56 л CaC2 + 2Н2О = С2Н2 + Са(ОН)2 |
|
5. Под уравнением записываем то, что следует из уравнения реакции с учётом условий задачи (массу аммиака и объём оксида азот (П) |
Mr (CaC2) = Ar(Ca) + 2Ar(C) = 40 + 2 · 12 = 64 M (CaC2) = 64 г/моль m (CaC2) = 1 моль · 64 г/моль = 64 г V (С2Н2) = ν (С2Н2) · Vm = 1 моль · 22,4 л/моль = 22,4 л Х г 56 л CaC2 + 2Н2О = С2Н2 + Са(ОН)2 64 г 22,4 л |
|
6. Составьте пропорции и определите практическую массу карбида кальция . |
|
|
7. Определяем массу примесей |
m(примесей) = 200 г – 160 г = 40 г |
|
8. Определяем массовую долю примесей |
|
|
9.Запишите ответ. |
Ответ: |
Алгоритм определения молекулярной формулы кристаллогидрата
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
1.Прочитайте текст задачи. |
Определите формулу мирабилита, являющегося кристаллогидратом сульфата натрия, если после прокаливания навески массой 193,2 г она стала весить 85,2 г. |
|
2.Запишите условие и требование задачи с помощью общепринятых обозначений. |
2.Дано: mкристаллогидрата = 193,2 г mсоли = 85,2 г Na2SO4 · X H2O = ? |
|
3.Запишите уравнение реакции (прокаливание ведёт к испарению воды) |
3.Решение: Кристаллогидрат прокаливание сульфат натрия Na2SO4 · X H2O t0 Na2SO4 |
|
4. Над формулами записать, что известно по условию задачи |
193,2 г 85,2 г Na2SO4 · X H2O → Na2SO4 |
|
5. Под уравнением записываем то, что следует из уравнения реакции с учётом условий задачи (находим массу сульфата натрия). Масса кристаллогидрата неизвестна, принимаем за Х |
Mr (Na2SO4) = 2Ar(Na) + Ar(S) + 4Ar(O) = 2 · 23 + 32 + 4 · 16 = 142 M (Na2SO4) = 142 г/моль m (Na2SO4) = 1 моль · 142 г/моль = 142 г 193,2 г 85,2 г Na2SO4 · X H2O → Na2SO4 Х г 142 г |
|
6. Составьте пропорции и определите массу кристаллогидрата . |
|
|
7. Вычислить массу воды, которая содержится в кристаллогидрате |
m(воды) = m(кристаллогидрата) — m(сульфата натрия) = 322 – 142 = 180 г Mr (H2O) = 2Ar(Н) + Ar(O) = 2 · 1 + 16 = 18 M (H2O) = 18 г/моль |
|
8. Определить количество воды в кристаллогидрате |
Mr (H2O) = 2Ar(Н) + Ar(O) = 2 · 1 + 16 = 18 M (H2O) = 18 г/моль |
|
9. Запишите ответ. |
Ответ: Na2SO4 · 10 H2O |
Алгоритм вычисления количества вещества продукта реакции по массовой доле исходного вещества в растворе
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
1.Прочитайте текст задачи. |
Рассчитайте количество водорода, выделившегося при взаимодействии 730 г 30%-ого раствора соляной кислоты с цинком. |
|
2.Запишите условие и требование задачи с помощью общепринятых обозначений. |
2.Дано: mраствора = 730 г
ν (Н2) = ? |
|
3.Запишите уравнение реакции |
3.Решение: Zn + 2HCl = ZnCl2 + H2↑ |
|
4. Пользуясь формулой, рассчитайте массу чистого вещества. |
mвещ. = mраствора · ω m (HCl) = 730 г · 0,3 = 219 г |
|
метод пропорций |
|
|
5. Над формулами записать, что известно по условию задачи |
219 г Х моль Zn + 2HCl = ZnCl2 + H2↑ |
|
6. Под уравнением записываем то, что следует из уравнения реакции с учётом условий задачи (находим массу соляной кислоты и количество водорода, которое равно коэффициенту перед формулой водорода). |
Mr (HCl) = Ar(H) + Ar(Cl) = 1 + 35,5 = 36,5 M (HCl) = 36,5 г/моль m (HCl) = 2 моль · 36,5 г/моль = 73 г 219 г Х моль Zn + 2HCl = ZnCl2 + H2↑ 73 г 1моль |
|
7. Составьте пропорции и определите количество водорода . |
|
|
количественный метод |
|
|
выполняем пункты 1 — 4 |
|
|
5. Рассчитать молярную массу соляной кислоты |
Mr (HCl) = Ar(H) + Ar(Cl) = 1 + 35,5 = 36,5 M (HCl) = 36,5 г/моль |
|
6. Рассчитать количество соляной кислоты |
|
|
7. Над формулами записать, что известно по условию задачи и произведённых расчётов |
6 моль Х моль Zn + 2HCl = ZnCl2 + H2↑ |
|
8. Под формулами записываем, что следует из уравнения реакции (количество соляной кислоты и водорода, которые равны коэффициентам перед соответствующими формулами); составляем пропорцию |
6 моль Х моль Zn + 2HCl = ZnCl2 + H2↑ 2 моль 1 моль |
|
алгебраический способ |
|
|
выполняем пункты 1 — 3 |
|
|
4. По формуле находим количество водорода |
Zn + 2HCl = ZnCl2 + H2↑ 2 моль 1 моль ν (HCl) = 2 моль HCl – 1 моль H2, следовательно ν (H2) = |
|
5. Находим молярную массу соляной кислоты |
Mr (HCl) = Ar(H) + Ar(Cl) = 1 + 35,5 = 36,5 M (HCl) = 36,5 г/моль |
|
6. Подставляем в формулу величины, производим расчёт |
ν (H2) = |
|
Запишите ответ. |
Ответ: ν (Н2) = 3 моль |
Алгоритм составления термохимического уравнения реакции (ТХУ)
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
1.Прочитайте текст задачи. |
При сжигании 6 г магния выделяется 152 кДж тепла. Составить термохимическое уравнение образования оксида магния. |
|
2.Запишите условие и требование задачи с помощью общепринятых обозначений. |
2.Дано: m (Mg) = 6 г Q = 152 кДж ТХУ = ? |
|
3.Запишите уравнение реакции |
3.Решение: 2Mg + O2 = 2MgO + Х кДж |
|
4. Над формулами записать, что известно по условию задачи |
6 г 152 кДж 2Mg + O2 = 2MgO + Х кДж |
|
5. Под уравнением записываем то, что следует из уравнения реакции с учётом условий задачи (находим массу магния). |
Mr (Mg) = Ar(Mg) = 24 M (Mg) = 24 г/моль m (Mg) = 2 моль · 24 г/моль = 48 г 6 г 152 кДж 2Mg + O2 = 2MgO + Х кДж 48 г |
|
6. Составьте пропорции и определите количество выделившейся теплоты . |
|
|
количественный метод |
|
|
выполняем пункты 1 — 3 |
|
|
4. Рассчитать количество магния |
Mr (Mg) = Ar(Mg) = 24 M (Mg) = 24 г/моль |
|
5. Над формулами записать известные величины и расчётное количество магния, под формулой количество магния по уравнению реакции (коэффициент перед формулой); составить и решить пропорцию |
0,25 моль 152 кДж 2Mg + O2 = 2MgO + Х кДж 2 моль |
|
Запишите ответ. |
Ответ: 2Mg + O2 = 2MgO + 1216 кДж |
Алгоритм расчёта по термохимическим уравнениям реакций
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
1.Прочитайте текст задачи. |
Вычислить, какое количество теплоты выделится при сгорании 6,2 г фосфора. Термохимическое уравнение реакции горения фосфора: 4Р+5O2 = 2Р2O5+3010кДж. |
|
2.Запишите условие и требование задачи с помощью общепринятых обозначений. |
2.Дано: m (Р) = 6,2 г Q = ? |
|
3.Запишите уравнение реакции |
3.Решение: 4Р+5O2 = 2Р2O5+3010кДж |
|
4. Над формулами записать, что известно по условию задачи |
6,2 г Х кДж 4Р+5O2 = 2Р2O5+3010кДж. |
|
5. Под уравнением записываем то, что следует из уравнения реакции с учётом условий задачи (находим массу магния). |
Mr (Р) = Ar(Р) = 31 M (Р) = 31 г/моль m (Р) = 4 моль · 31 г/моль = 124 г 6,2 г Х кДж 4Р+5O2 = 2Р2O5+3010кДж. 124 г |
|
6. Составьте пропорции и определите количество выделившейся теплоты . |
|
|
количественный метод |
|
|
выполняем пункты 1 — 3 |
|
|
4. Рассчитать количество фосфора |
Mr (Р) = Ar(Р) = 31 M (Р) = 31 г/моль |
|
5. Над формулами записать известные величины и расчётное количество фосфора, под формулой количество фосфора по уравнению реакции (коэффициент перед формулой); составить и решить пропорцию |
0,2 моль Х кДж 4Р+5O2 = 2Р2O5+3010кДж. 4 моль |
|
Запишите ответ. |
Ответ: Q = 150,5 кДж |
Алгоритм определения состава смеси
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
1.Прочитайте текст задачи. |
Смесь кальция и оксида кальция массой 5 г обработала водой. В результате реакции выделилось 1,68 л газа (н.у.). Определите массовую долю оксида кальция в исходной смеси. |
|
2.Запишите условие и требование задачи с помощью общепринятых обозначений. |
2.Дано: mсмеси = 5 г Vгаза = 1,68 л (н.у.) ω (CaO) = ? |
|
3. Составьте уравнения химических реакций. Оба компонента смеси взаимодействуют с водой, но только при взаимодействии кальция с водой выделяется газ (водород). Поэтому расчёт производим по уравнению 1. |
3.Решение: 1) Са + 2Н2О = Са(OН)2 + Н2↑ 2) CаO + Н2О = Са(OН)2 |
|
4. Над формулами записать, что известно по условию задачи |
Х г 1,68 л Са + 2Н2О = Са(OН)2 + Н2↑ |
|
5. Под уравнением записываем то, что следует из уравнения реакции с учётом условий задачи (находим массу кальция). |
Mr (Са) = Ar(Са) = 40 M (Са) = 40 г/моль m (Са) = 1 моль · 40 г/моль = 40 г Х г 1,68 л Са + 2Н2О = Са(OН)2 + Н2↑ 40 г 22,4 л |
|
6. Составьте пропорции и определите массу кальция в смеси . |
|
|
7. Рассчитать массу оксида кальция в смеси |
m (CaO) = m (смеси) — m (Са) = 5 г – 3 г = 2 г |
|
8. Рассчитать массовую долю оксида кальция в смеси |
|
|
количественный метод |
|
|
выполняем пункты 1 — 3 |
|
|
4. Рассчитать количество газообразного вещества – водорода, зная, что Vm — величина постоянная для любого газа (н.у.) 22,4 л/моль |
|
|
5. Над формулами записать известные величины и расчётное количество фосфора, под формулой количество фосфора по уравнению реакции (коэффициент перед формулой); составить и решить пропорцию |
Х моль 0,075 моль Са + 2Н2О = Са(OН)2 + Н2↑ 1 моль 1 моль |
|
6. Рассчитать массу кальция в смеси |
Mr (Са) = Ar(Са) = 40 M (Са) = 40 г/моль |
|
7. Рассчитать массу оксида кальция в смеси |
m (CaO) = m (смеси) — m (Са) = 5 г – 3 г = 2 г |
|
8. Рассчитать массовую долю оксида кальция в смеси |
|
|
Запишите ответ. |
Ответ: |
Алгоритм вычисления относительной плотности газа
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
1.Прочитайте текст задачи. |
Рассчитать относительную плотность оксида серы (IV) по азоту. |
|
2.Запишите условие и требование задачи с помощью общепринятых обозначений. |
2.Дано: SO2 D(N2) =? |
|
3. Запишите формулу расчёта относительной плотности: |
3.Решение: |
|
4. Вычислить относительные молекулярные массы оксида серы (IV) и азота |
Mr (SO2) = Ar(S) + 2Ar(O) = 32 + 2 · 16 = 64 Mr (N2) = 2Ar(N) = 2 · 14 = 28 |
|
5. Вставить полученные значения в формулу |
|
|
Записать ответ |
Ответ: D (N2) = 2,29 |
Алгоритм вычисления объёма вещества по известной массе вещества
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
1.Прочитайте текст задачи. |
Вычислить, какой объём (при н.у.) занимают 42 г азота N2 |
|
2.Запишите условие и требование задачи с помощью общепринятых обозначений. |
2.Дано: m (N2) = 42 г Vгаза (н.у.) = ? |
|
3. Вычислить молярную массу азота |
3.Решение: Mr (N2) = 2Ar(N) = 2 · 14 = 28 М (N2) = 28 г/моль |
|
4. Вычислить количество азота |
|
|
5. Рассчитать объём азота по формуле, зная, что Vm — величина постоянная для любого газа (н.у.) 22,4 л/моль |
V = ν · Vm V = 1,5 моль · 22,4 л/моль = 33,6 л |
|
Запишите ответ |
Ответ: V = 33,6 л |
Алгоритм расчёта по химическому уравнению реакции объёмных отношений газов
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
1.Прочитайте текст задачи. |
Вычислите объем кислорода, необходимого для сжигания порции ацетилена объемом 50 л |
|
2.Запишите условие и требование задачи с помощью общепринятых обозначений. |
2.Дано: V (C2H2) = 50 л V(O2) = ? |
|
3. Запишите уравнение реакции |
3.Решение: 2C2H2 + 5O2 = 4CO2 + 2H2O |
|
4. Над формулами записать, что известно по условию задачи |
50 л Х л 2C2H2 + 5O2 = 4CO2 + 2H2O |
|
5. Под уравнением записываем то, что следует из уравнения реакции с учётом условий задачи (находим объёмы ацетилена и кислорода). ν – коэффициенты перед соответствующими веществами |
Vm = 22,4 л/моль V = ν · Vm V(C2H2) = 2 моль · 22,4 л/моль = 44,8 л V (O2) = 5 моль · 22,4 л/моль = 112 л 50 л Х л 2C2H2 + 5O2 = 4CO2 + 2H2O 44,8 л 112 л |
|
6. Составляем пропорцию и производим расчёт |
|
|
или методом стехиометрического соотношения |
|
|
выполняем пункты 1 — 4 |
|
|
5. Над формулами веществ запишем данные об объемах газообразных веществ, известные из условия задачи, а под формулами — стехиометрические соотношения, отображаемые уравнением реакции, которые для газов, согласно закону Авогадро, равны их объемным отношениям |
50 л Х л 2C2H2 + 5O2 = 4CO2 + 2H2O 2 моль 5 моль 50 : Х = 2 : 5 |
|
6. Составить пропорцию и решить |
|
|
Запишите ответ |
Ответ: V = 125 л |
Алгоритм решения задач по уравнению химической реакции
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
на нахождение массы вещества |
|
|
метод пропорций |
|
|
1.Прочитайте текст задачи. |
Какая масса гидроксида натрия необходима для реакции с 68,6 г ортофосфорной кислоты с образованием средней соли? |
|
2.Запишите условие и требование задачи с помощью общепринятых обозначений. |
2.Дано: m (H3PO4) = 68,6 г m (NaOH) = ? |
|
3. Запишите уравнение реакции |
3.Решение: 3NaOH + H3PO4 = Na3PO4 + 3H2O |
|
4. Над формулами записать, что известно по условию задачи |
Х г 68,6 г 3NaOH + H3PO4 = Na3PO4 + 3H2O |
|
5. Под уравнением записываем то, что следует из уравнения реакции с учётом условий задачи (находим массы гидроксида натрия и ортофосфорной кислоты). (ν – коэффициенты перед соответствующими веществами) |
Mr (NaOH) = Ar(Na) + Ar(O) + Ar(H) = 23 + 16 + 1 = 40 M (NaOH) = 40 г/моль m (NaOH) = ν · M = 3 моль · 40 г/моль = 120 г Mr (H3PO4) = 3Ar(H) + Ar(P) + 4Ar(O) = 3 · 1 + 31 + 4 · 16 = 98 M (H3PO4) = 98 г/моль m (H3PO4) = ν · M = 1 моль · 98 г/моль = 98 г Х г 68,6 г 3NaOH + H3PO4 = Na3PO4 + 3H2O 120 г 98 г |
|
6. Составляем пропорцию и производим расчёт |
|
|
количественный метод |
|
|
выполнить пункты 1 — 3 |
|
|
4. Рассчитать молярные массы гидроксида натрия и ортофосфорной кислоты |
Mr (NaOH) = Ar(Na) + Ar(O) + Ar(H) = 23 + 16 + 1 = 40 M (NaOH) = 40 г/моль Mr (H3PO4) = 3Ar(H) + Ar(P) + 4Ar(O) = 3 · 1 + 31 + 4 · 16 = 98 M (H3PO4) = 98 г/моль |
|
5. Рассчитать количество ортофосфорной кислоты по формуле |
|
|
6. Записать в уравнении данные по условию уравнения и полученные величины над формулами, под формулам — количество данных веществ (ν – коэффициенты перед соответствующими веществами) |
Х моль 0,7 моль 3NaOH + H3PO4 = Na3PO4 + 3H2O 3 моль 1 моль |
|
7. Составить и решить пропорцию |
|
|
8. По формуле найти массу гидроксида натрия |
m (NaOH) = ν · M = 2,1 моль · 40 г/моль = 84 г |
|
Записать ответ |
Ответ: m (NaOH) = 84 г |
|
на нахождение объёма вещества |
|
|
1.Прочитайте текст задачи. |
Какой объём газа выделится при взаимодействии 6,5 г цинка с избытком раствора серной кислоты? |
|
2.Запишите условие и требование задачи с помощью общепринятых обозначений. |
2.Дано: m (Zn) = 6,5 г V(Н2) = ? |
|
3. Запишите уравнение реакции |
3.Решение: Zn + H2SO4 = ZnSO4 + H2↑ |
|
4. Над формулами записать, что известно по условию задачи |
6,5 г Х л Zn + H2SO4 = ZnSO4 + H2↑ |
|
5. Вычислить массу цинка и объём водорода по уравнению реакции |
Mr (Zn) = Ar(Zn) = 65 M (Zn) = 65 г/моль m (Zn) = ν · M = 1 моль · 65 г/моль = 65 г V = ν · Vm = 1 моль · 22,4 л/моль = 22,4 л |
|
6. Полученные величины записать под соответствующими формулами |
6,5 г Х л Zn + H2SO4 = ZnSO4 + H2↑ 65 г 22,4 л |
|
7. Составить и решить пропорцию |
|
|
количественный метод |
|
|
выполнить 1 – 3 |
|
|
4. Рассчитать количество цинка |
Mr (Zn) = Ar(Zn) = 65 M (Zn) = 65 г/моль |
|
5. Полученную величину записать в уравнение над формулой цинка, под формулами количество вещества по уравнению реакции (коэффициенты перед формулами) |
0,1 моль Х моль Zn + H2SO4 = ZnSO4 + H2↑ 1 моль 1 моль |
|
6. Составить пропорцию и решить |
|
|
7. По формуле найти объём выделившегося газа |
Vm = 22,4 л/моль V = ν · Vm V(H2) = 0,1 моль · 22,4 л/моль = 2,24 л |
|
Записать ответ |
Отсвет: V(H2) = 2,24 л |
|
на нахождение количества вещества |
|
|
1.Прочитайте текст задачи. |
Какое количество вещества алюминия реагировало с избытком соляной кислоты, если в ходе реакции выделилось 13,44 л (н.у.) водорода? |
|
2.Запишите условие и требование задачи с помощью общепринятых обозначений. |
2.Дано: V (Н2) = 13,44 л н.у. ν (Al) = ? |
|
3. Запишите уравнение реакции |
3 Решение: Al + HCl = AlCl3 + H2↑ |
|
4. Над формулами записать, что известно по условию задачи |
Х моль 13,44 л 2Al + 6HCl = 2AlCl3 + 3H2↑ |
|
5. По формуле вычислите объём водорода (по уравнению реакции) |
V = ν · Vm V(H2) = 3 моль · 22,4 л/моль = 67,2 л |
|
6. Под формулами записать рассчитанный объём водорода и количество алюминия по уравнению реакции (коэффициент перед формулой) |
Х моль 13,44 л 2Al + 6HCl = 2AlCl3 + 3H2↑ 2 моль 67,2 л |
|
7. Составить пропорцию и решить |
|
|
количественный метод |
|
|
выполнить пункты 1 — 3 |
|
|
4. Рассчитать количество водорода |
|
|
5. Над формулами записать, что известно и что надо найти |
Х моль 0,6 моль 2Al + 6HCl = 2AlCl3 + 3H2↑ |
|
6. Под формулами записать количество водорода и количество алюминия по уравнению реакции (коэффициент перед формулой) |
Х моль 0,6 моль 2Al + 6HCl = 2AlCl3 + 3H2↑ 2 моль 3 моль |
|
7. Составить пропорцию и решить |
|
|
Записать ответ |
Ответ: ν (Al) = 0,4 моль |
Алгоритм решения задач на концентрацию растворов
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
расчёт массовой доли растворённого вещества |
|
|
1.Прочитайте текст задачи. |
Рассчитать массовую долю хлорида натрия в растворе, полученном при смешивании 28г соли и 252г воды. |
|
2.Запишите условие и требование задачи с помощью общепринятых обозначений. |
2.Дано: mсоли = 28 г mводы = 252 г ω (NaCl) = ? |
|
3. Рассчитать массу раствора |
3.Решение: mраствора = mсоли + mводы mраствора = 28 г + 252 г = 280 г |
|
4. По формуле рассчитать массовую долю растворённого вещества |
|
|
5 Записать ответ |
Ответ: |
|
вычисление массы вещества в растворе по массе раствора и массовой доле растворенного вещества (приготовление растворов) |
|
|
1.Прочитайте текст задачи. |
Вычислите массы гидроксида натрия и воды, необходимых для приготовления 400 г 20%-го раствора гидроксида натрия |
|
2.Запишите условие и требование задачи с помощью общепринятых обозначений. |
2.Дано: mр-ра = 400 г ω (NaОН) = 20% = 0,2 m(NaOH) = ? mводы = ? |
|
3. Рассчитать массу гидроксида натрия в растворе (растворённое вещество) |
|
|
4. Рассчитайте массу воды |
mраствора = mсоли + mводы mводы = mраствора — mсоли mводы = 400 – 80 = 320 г |
|
Записать ответ |
Ответ: mводы = 320 г; m(NaOH) = 80 г |
|
решение задач на упаривание раствора |
|
|
при упаривании испаряется растворитель, а масса растворённого вещества остаётся неизменной; концентрация раствора увеличивается |
|
|
1.Прочитайте текст задачи. |
100 г 25%-ного раствора соли упарили до 80 г. Вычислите массовую долю растворённого вещества в полученном растворе |
|
2.Запишите условие и требование задачи с помощью общепринятых обозначений. |
2.Дано: mр-ра 1 = 100 г mр-ра 2 = 80 г ω1 = 25% или 0,25 ω2 = ? |
|
3. Вычислить массу растворённого вещества в первом растворе по формуле |
|
|
4. Вычислить массовую долю вещества во втором растворе |
|
|
5.Записать ответ |
Ответ: ω2 = 0,3125 или 31,25% |
|
решение задач на концентрирование раствора |
|
|
при концентрировании в раствор добавляется дополнительная масса растворённого вещества; концентрация повышается |
|
|
1.Прочитайте текст задачи. |
К 250 г 5%-ного раствора соли добавили 23 г соли. Вычислите массовую долю полученного раствора |
|
2.Запишите условие и требование задачи с помощью общепринятых обозначений. |
2.Дано: mр-ра 1 = 250 г mсоли = 23 г ω1 = 5% или 0,05 ω2 = ? |
|
3. Вычислить массу растворённого вещества в первом растворе по формуле |
|
|
4. Вычислить массу растворённого вещества по формуле |
|
|
5. Вычислить массу полученного раствора по формуле |
|
|
6. Вычислить массовую долю вещества во втором растворе |
|
|
7.Записать ответ |
Ответ: ω2 = 0,1243 или 12,43% |
|
решение задач на разбавление раствора |
|
|
к раствору добавляется определённая масса растворителя; концентрация уменьшается |
|
|
1.Прочитайте текст задачи. |
К 180 г 10% — ного раствора кислоты добавили 20 г воды. Вычислите массовую долю полученного раствора |
|
2.Запишите условие и требование задачи с помощью общепринятых обозначений. |
2.Дано: mр-ра 1 = 180 г mводы = 20 г ω1 = 10% или 0,1 ω2 = ? |
|
3. Вычислить массу растворённого вещества в первом растворе по формуле |
|
|
4. Вычислить массу полученного раствора по формуле |
|
|
5. Вычислить массовую долю вещества во втором растворе |
|
|
6. Записать ответ |
Ответ: ω2 = 0,09 или 9% |
|
решение задач на смешивание растворов |
|
|
1.Прочитайте текст задачи. |
К 230 г 30%-ного раствора щёлочи добавили 100 г 6%- ного раствора щёлочи. Вычислите массовую долю полученного раствора |
|
2.Запишите условие и требование задачи с помощью общепринятых обозначений. |
2.Дано: mр-ра 1 = 230 г ω1 = 30% или 0,3 m р-ра 2 = 100 г ω2 = 6% или 0,06 ω3 = ? |
|
3. Вычислить массы растворённого вещества в растворах по формуле |
|
|
4. Вычислить массу полученного раствора по формуле |
|
|
5. Вычислить массовую долю вещества в полученном растворе |
|
|
6. Записать ответ |
Ответ: ω3 = 0,227 или 22,7% |