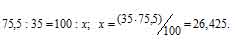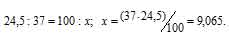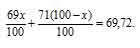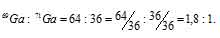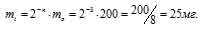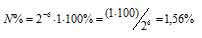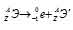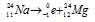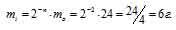В уроке 2 «Изотопы элементов» из курса «Химия для чайников» рассмотрим что такое изотопы элементов и как правильно их обозначают; кроме того мы научимся определять массовое число, дефект массы и энергию связи ядра. Данный урок полностью опирается на основы химии, изложенные в первом уроке, в котором мы рассмотрели строение атома и атомного ядра, поэтому настоятельно вам рекомендую его изучить от корки до корки.
Что такое изотоп?
Хотя все атомы одного элемента имеют одинаковое число протонов, эти атомы могут отличаться числом имеющихся у них нейтронов. Такие различные атомы одного и того же элемента называются изотопами. Количество протонов, а также количество электронов у изотопа и исходного элемента совпадает. По этой причине в природе существует гораздо больше химических элементов, чем указано в таблице Менделеева, которая систематизирует элементы по числу протонов (порядковый номер).
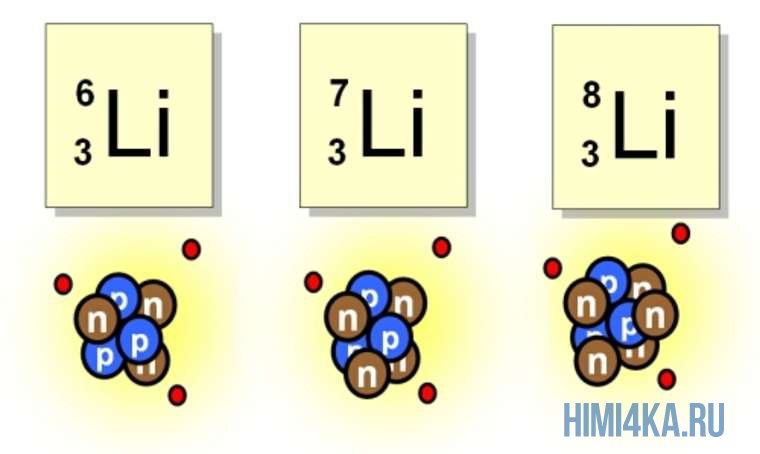
Например, все атомы Li имеют 3 протона, но в природе существуют изотопы, содержащие от 3 до 5 нейтронов. Для обозначения изотопа, слева от символа элемента подписывают нижним индексом его порядковый номер, а верхним — массовое число. Массовое число — это суммарное число нуклонов (протонов и нейтронов) в атомном ядре, численно близкое к атомной массе элемента. Нижний индекс, обозначающий порядковый номер элемента, указывать не обязательно, так как все атомы лития имеют в своем ядре по 3 протона. Также, обсуждая эти изотопы, можно пользоваться записью «литий-6» и «литий-8».
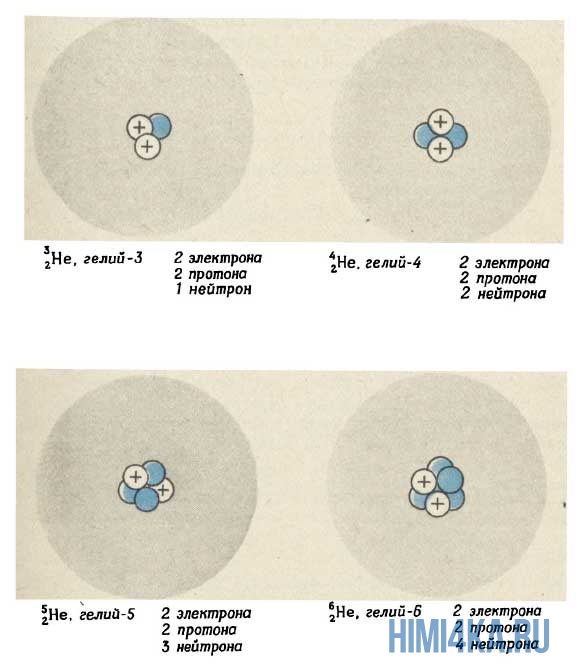
На рисунке выше изображен состав четырех изотопов гелия (Не). Все атомы гелия содержат два протона (и, следовательно, два электрона), но число нейтронов у них может быть разным. В природе большинство атомов гелия имеет два нейтрона (гелий-4) и реже одного раза на миллион встречаются атомы гелия с одним нейтроном (гелий-3). Другие изотопы гелия — гелий-5 , гелий-6 и гелий-8 (не показанный на рисунке) — неустойчивы и обнаруживаются лишь на очень непродолжительное время в ядерных реакциях (подробнее об этом будем говорить еще не скоро). Размеры ядер на рисунке очень сильно увеличены. Если бы они были такими, как это показано на рисунке, диаметр атома должен был достигать примерно 0,5 км.
Пример 1. Сколько протонов, нейтронов и электронов содержится в атоме урана-238? Запишите символ этого изотопа.
Решение: Порядковый номер урана (см. таблицу Менделеева) равен 92, а массовое число изотопа равно 238 (по условию). Следовательно, он содержит 92 протона, 92 электрона и 238 — 92 = 146 нейтронов. Его символ 238U.
Дефект массы и энергия связи ядра
Затронув тему изотопов, нельзя пройти мимо феномена дефект массы ядра. Когда из отдельных нуклонов образуется атомное ядро, часть их массы превращается в энергию. Другими словами, вот взяли вы щепотку протонов и нейтронов, хорошенько их смяли вместе, и получили ядро, но его масса будет меньше массы исходных компонентов. Это и есть дефект масс. Формула для расчета дефекта массы ядра:
- ∆m=(Zmp+Nmn)-Mя
где Mя – масса ядра, Z – число протонов в ядре, N – число нейтронов в ядре, mp – масса протона, mn – масса нейтрона.
Если к атому подвести энергию (которая эквивалентна дефекту масс), то можно разделить его ядро обратно на нуклоны. Эта энергия носит название энергия связи ядра. Формула для расчета энергии связи ядра:
- ∆Eсв=∆mc2
где с — скорость света, ∆m — дефект массы ядра
Проверьте себя, как вы усвоили понятия дефект массы и энергия связи ядра, самостоятельно решив задачу пользуясь формулами выше.
Пример 2. Если образовать атом углерода-12 из субатомных частиц, какое значение будет иметь дефект масс?
Показать
Ответ: 0,0990 а.е.м.
[свернуть]
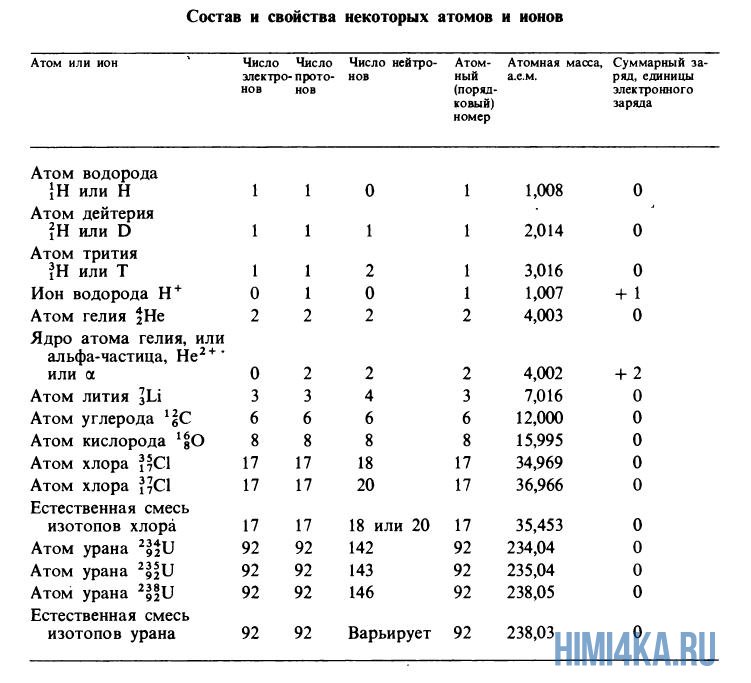
Теперь нам известно, что каждый изотоп элемента характеризуется порядковым номером (суммарным числом протонов), массовым числом (суммарным числом протонов и нейтронов) и атомной массой (массой атома, выраженной в атомных единицах массы). Поскольку дефект массы при образовании атома очень мал, массовое число обычно совпадает с атомной массой изотопа, округленной до ближайшего целого числа. (Например, атомная масса хлора-37 равна 36,966, что после округления дает 37.) Если в природе встречается несколько изотопов одного элемента, то экспериментально наблюдаемая атомная масса (естественная атомная масса) равна средневзвешенному значению атомных масс отдельных изотопов. Это средневзвешенное значение определяется соответственно относительному содержанию изотопов в природе. Хлор существует в природе в виде смеси из 75,53% хлора-35 (атомная масса 34,97 а.е.м.) и 24,47% хлора-37 (36,97 а.е.м.), поэтому средневзвешенное значение масс этих изотопов равно
- (0,7553·34,97 а.е.м.) + (0,2447·36,97 а.е.м.) = 35,46 а.е.м.
Атомные массы, указанные в таблице Менделеева представляют собой во всех случаях средневзвешенные значения атомных масс изотопов, встречающихся в природе, и именно этими значениями мы будем пользоваться в дальнейшем, за исключением тех случаев, когда будет обсуждаться какой-нибудь конкретный изотоп. Все изотопы одного элемента в химическом отношении ведут себя практически одинаково. На рисунке ниже изображены состав и свойства некоторые атомов, ионов и изотопов элементов.
Пример 3. Магний (Mg) в основном состоит из трех естественных изотопов: 78,70% всех атомов магния имеют атомную массу 23,985 а.е.м., 10,13% — 24,986 а.е.м. и 11,17% — 25,983 а.е.м. Сколько протонов и нейтронов содержится в каждом из этих трех изотопов? Чему равно средневзвешенное значение их атомных масс?
Решение: Все изотопы магния содержат по 12 протонов. Изотоп с атомной массой 23,985 а.е.м. имеет массовое число 24 (суммарное число протонов и нейтронов), следовательно, он имеет 24 — 12 = 12 нейтронов. Символ этого изотопа 24Mg. Аналогично находим, что изотоп с атомным весом 24,986 а.е.м. имеет массовое число 25, содержит 13 нейтронов и имеет символ 25Mg. Третий изотоп (25,983 а.е.м.) имеет массовое число 26, содержит 14 нейтронов и имеет символ 26Mg. Средняя атомная масса магния находится следующим образом:
- (0,7870·23,985 а.е.м.) + (0,1013·24,986 а.е.м.) + (0,1117·25,983 а.е.м.) = 24,31 а.е.м.
Надеюсь урок 2 «Изотопы элементов» помог вам понять что из себя представляют изотопы. Если у вас возникли вопросы, пишите их в комментарии.
All atoms of an element have the same number of protons in their nuclei; different isotopes, however, have different numbers of neutrons in their nuclei. Hydrogen, for example, has only one proton in its nucleus, but an isotope of hydrogen called deuterium has a neutron in addition to the proton. Isotopes are generally designated by the mass number, which is the number of protons and neutrons in a nucleus of that isotope. The binding energy of the nucleons in the nucleus causes the actual mass of the atom to be slightly different from the mass number, so the actual mass can only be determined experimentally. You can determine the mass number, however, merely by adding up the number of neutrons and protons.
- Calculator
- Periodic table
Write down the number of protons in the nucleus of the element you are studying. The number of protons is the same as the atomic number of the element on the periodic table. Carbon, for example, has atomic number 6 and hence six protons in its nucleus.
Write down the number of neutrons. This depends on the isotope you chose to study. Carbon-13, for example, has seven neutrons.
Add the number of neutrons to the number of protons to find the nominal mass or mass number. The mass number of carbon-13, for example, is 13. Keep in mind that owing to the binding energy for nucleons, the actual mass of carbon-13 will be very slightly different from the nominal mass. For most calculations the nominal mass should be sufficient.
Look up the exact atomic mass in the table at the National Institute of Standards and Technology Atomic Weights Web page if you need the exact atomic mass. This figure can only be determined experimentally.
Things You’ll Need
Мы знаем, что масса атома определяется массой ядра. Ядро состоит из протонов и нейтронов, относительные массы которых равны (1). Масса ядра равна сумме масс протонов и нейтронов. Число протонов определяем по порядковому номеру элемента. Значит, число нейтронов в ядре можно найти, если от относительной атомной массы отнять порядковый номер.
Пример:
фтор — элемент № (9). Его относительная атомная масса равна (19).
В ядре атома фтора — (9) протонов и (19) (–) (9) (=) (10) нейтронов.
Рубидий — элемент № (37). Его относительная атомная масса равна (85).
В ядре атома рубидия — (37) протонов и (85) (–) (37) (=) (48) нейтронов.
Нуклиды
Вид атомов с определённым числом протонов и нейтронов в ядре называется нуклидом.
Нуклид обозначается следующим образом: внизу слева записывается число протонов (Z) (порядковый номер), вверху слева указывается массовое число (A) (сумма чисел протонов и нейтронов) —
RZA
, например:
C612
,
Se3479
.
Для обозначения нуклидов используют и другие способы записи:
углерод — (12),
C
— (12),
C12
;
селен — (79),
Se
— (79),
Se79
.
Изотопы
Атомы одного и того же химического элемента могут иметь разные массы. Существуют атомы водорода с массами (1), (2) и (3), атомы хлора с массами (35) и (37) и т. д.
Разновидности атомов одного химического элемента, имеющие разные атомные массы, называют изотопами.
С учётом знаний о строении ядра это определение можно сформулировать по-другому.
Изотопы — разновидности атомов с одинаковым числом протонов в ядре (зарядом ядра), но разным числом нейтронов.
Значит, изотопы отличаются только числом нейтронов.
Рис. (1). Изотопы водорода
Протоны определяют свойства атома, то есть придают ему индивидуальность. А нейтроны не влияют на свойства атома, а отражаются на его массе. Поэтому все изотопы одного и того же элемента химически неотличимы.
Химический элемент — это вид атомов с определённым зарядом ядра.
Относительная атомная масса элемента
Большинство химических элементов существуют в виде смеси изотопов. Приведённая в Периодической таблице относительная атомная масса элемента — это средняя величина атомных масс всех его изотопов.
Пример:
определим относительную атомную массу хлора. (25) % его атомов — это атомы с массой (37), а (75) % — с массой (35). Найдём среднее значение:
·25+35
·75)100
= 35,5.
Источники:
Рис. 1. Изотопы водорода © ЯКласс
Все атомы элемента имеют одинаковое количество протонов в своих ядрах; Однако разные изотопы имеют разное количество нейтронов в своих ядрах. Водород, например, имеет только один протон в своем ядре, но изотоп водорода, называемый дейтерием, имеет нейтрон в дополнение к протону. Изотопы обычно обозначаются массовым числом, которое является числом протонов и нейтронов в ядре этого изотопа. Энергия связи нуклонов в ядре приводит к тому, что фактическая масса атома немного отличается от массового числа, поэтому фактическая масса может быть определена только экспериментально. Вы можете определить массовое число, просто сложив число нейтронов и протонов.
Запишите количество протонов в ядре изучаемого элемента. Количество протонов совпадает с атомным номером элемента в периодической таблице. Например, углерод имеет атомный номер 6 и, следовательно, шесть протонов в своем ядре.
Запишите количество нейтронов. Это зависит от того, какой изотоп вы выбрали для изучения. Например, в углероде-13 содержится семь нейтронов.
Добавьте число нейтронов к числу протонов, чтобы найти номинальную массу или массовое число. Массовое число углерода-13, например, равно 13. Имейте в виду, что из-за энергии связи для нуклонов фактическая масса углерода-13 будет очень незначительно отличаться от номинальной массы. Для большинства расчетов номинальная масса должна быть достаточной.
Посмотрите точную атомную массу в таблице на веб-странице Национального института стандартов и технологий по атомным весам, если вам нужна точная атомная масса. Эта цифра может быть определена только экспериментально.
Запись символов изотопов элементов. Расчет количественного соотношения изотопов
Задача 206.
Символ одного из изотопов элемента 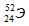
Решение:
Заряд ядра атома искомого элемента 24 численно совпадает с порядковым номером элемента в периодической системе химических элементов. Элемент №24 – хром (Cr).
Число нейтронов в ядре данного элемента равно 28:
N = A — Z = 28, где
N — число нейтронов в ядре, A — массовое число элемента (округленная масса атома), Z — заряд ядра.
Число электронов равно заряду ядра; в данном случае число электронов равно 24.
Ответ: Cr
Задача 207.
Ядро атома некоторого элемента содержит 16 нейтронов, а электронная оболочка этого атома — 15 электронов. Назвать элемент, изотопом которого является данный атом. Привести запись его символа с указанием заряда ядра и массового числа.
Решение:
Количество электронов в атоме численно равно заряду атома. В данном случае заряд ядра атома равен +15. Заряд ядра атома искомого элемента 15 численно совпадает с номером элемента в периодической системе химических элементов. Элемент №15 – фосфор — символ – Р.
Массовое число данного изотопа фосфора равно:
A = N + Z = 16 + 15 + 31
Символ изотопа фосфора будет иметь вид: 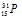
Ответ: 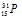
Задача 208.
Массовое число атома некоторого элемента равно 181, в электронной оболочке атома содержится 73 электрона. Указать число протонов и нейтронов в ядре атома и название элемента.
Решение:
Количество электронов в атоме равно количеству протонов. В данном случае число протонов равно 73. Число нейтронов в данном ядре равно 108:
N = A — Z = 181 — 73 = 108, где
N — число нейтронов, A — массовое число атома, Z — заряд ядра.
Заряд ядра атома искомого элемента 73 численно совпадает с порядковым номером элемента в периодической системе химических элементов. Элемент №73 –тантал, символ – +73Ta.
Ответ: +73Та.
Задача 209.
В природных соединениях хлор находится в виде изотопов 35Cl [75,5% (масс.)] и 37Cl [24,5% (масс.)]. Вычислить среднюю атомную массу природного хлора.
Решение:
Рассчитаем содержание 35Cl в природном хлоре, т.е. долю его в атомной массе из пропорции:
Теперь рассчитаем массу 37Cl, содержащуюся в природном хлоре из пропорции:
Вычисляем среднюю массу природного хлора, состоящего из двух изотопов
214,5 + 9,065 = 35,49.
Ответ: 35,49.
Задача. 210.
Природный магний состоит из изотопов: 24Mg, 25Mg, 26Mg. Вычислить среднюю атомную массу природного магния, если содержание отдельных изотопов в атомных процентах соответственно равно 78,6, 10,1 и 11,3.
Решение:
Вычислим атомную массу изотопов, содержащихся в природном магнии
а) (24 . 78,6)/100 = 18,864;
б) (25 . 10,1)/100 = 2,525;
в) (26 . 11,3)/100 = 2,938.
Находим среднюю массу атома магния:
18,864 + 2,525 + 2,938 = 24, 327.
Ответ: Ar(Mg) = 24,327.
Задача 211.
Природный галлий состоит из изотопов 71Ga, 69Ga. В каком количественном соотношении находятся между собой числа атомов этих изотопов, если средняя атомная масса галлия равна 69,72.
Решение:
Для решения задач применим алгебраический метод расчёта:
Обозначим процентное содержание изотопа 69Ga через x. Тогда процентное содержание изотопа 71Ga будет равно 100 – x. масса изотопа 69Ga в атоме будет составлять 69 . (x/100). Масса изотопа 71Ga будет составлять 71 . (x/100).
В сумме масса обоих изотопов будет равняться атомной массе галлия:
Освобождаемся от знаменателя и получим уравнение:
69x — 71x + 7100 = 69,72
Решаем его и, получаем:
-2x = -128x; x = 64
Значит, процент изотопа 69Ga составляет 64%, а процент изотопа 71Ga – 36% (100 – 64 = 100).
Теперь находим, в каком количественном соотношении находятся эти изотопы в природном галлии:
Ответ: 1,8 : 1.
Задача 212.
Найти массу изотопа 81Sr(T1/2 = 8,5ч), оставшуюся через 25,5 ч хранения, если первоначальная масса его составляла 200 мг.
Решение:
За время хранения радиоактивного изотопа прошло 3 периода полураспада (25,5/8,5 = 32). Массу нераспавшегося изотопа, оставшаяся после 25,5ч хранения, рассчитаем из уравнения:
mi = 2-n – m0, где
mi — масса изотопа, оставшаяся после хранения, m0 — исходная масса изотопа, n — период полураспада.
Тогда
Ответ: 25мг.
Задача 213.
Вычислить процент атомов изотопа 128I(T1/2 = 25ч), оставшихся не распавшимися после его хранения в течение 2,5 ч.
Решение:
За время хранения радиоактивного изотопа прошло 6 периодов полураспада [(2,5 . 60)/25 = 6)]. Тогда процент атомов изотопа, оставшихся после радиоактивного распада, находим из формулы:
N% = 2-n . N0 . 100%, где
N% — процент атомов изотопа, N0 — первоначальное число ядер изотопа, n — число периодов полураспада.
Отсюда
Ответ: 1,56%.
Задача 214.
Период полураспада 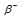
Решение:
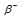
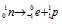
при испускании электрона заряд ядра увеличивается на единицу, а массовое число не изменяется. Дочернее ядро – изобар исходного — принадлежит элементу, стоящему следующим после исходного в таблице периодической системы химических элементов:
Уравнение радиоактивного распада должны удовлетворять правилу равенства сумм индексов.
Запишем уравнение реакции распада:
За время хранения 24Na прошло 2 периода полураспада (29,6/14,2 = 2). Массу не распавшегося изотопа, оставшуюся после 14,8ч хранения находим по формуле:
mi = 2-n – m0, где
mi — масса изотопа, оставшаяся после хранения, m0 — исходная масса изотопа, n — период полураспада.
Тогда
Таким образом, радиоактивному распаду подверглось 18г 24Na и столько же образовалось 24Mg (24 – 6 = 18).
Ответ: 18 г.