В уроке 2 «Изотопы элементов» из курса «Химия для чайников» рассмотрим что такое изотопы элементов и как правильно их обозначают; кроме того мы научимся определять массовое число, дефект массы и энергию связи ядра. Данный урок полностью опирается на основы химии, изложенные в первом уроке, в котором мы рассмотрели строение атома и атомного ядра, поэтому настоятельно вам рекомендую его изучить от корки до корки.
Что такое изотоп?
Хотя все атомы одного элемента имеют одинаковое число протонов, эти атомы могут отличаться числом имеющихся у них нейтронов. Такие различные атомы одного и того же элемента называются изотопами. Количество протонов, а также количество электронов у изотопа и исходного элемента совпадает. По этой причине в природе существует гораздо больше химических элементов, чем указано в таблице Менделеева, которая систематизирует элементы по числу протонов (порядковый номер).
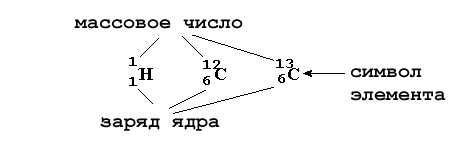
Например, все атомы Li имеют 3 протона, но в природе существуют изотопы, содержащие от 3 до 5 нейтронов. Для обозначения изотопа, слева от символа элемента подписывают нижним индексом его порядковый номер, а верхним — массовое число. Массовое число — это суммарное число нуклонов (протонов и нейтронов) в атомном ядре, численно близкое к атомной массе элемента. Нижний индекс, обозначающий порядковый номер элемента, указывать не обязательно, так как все атомы лития имеют в своем ядре по 3 протона. Также, обсуждая эти изотопы, можно пользоваться записью «литий-6» и «литий-8».
На рисунке выше изображен состав четырех изотопов гелия (Не). Все атомы гелия содержат два протона (и, следовательно, два электрона), но число нейтронов у них может быть разным. В природе большинство атомов гелия имеет два нейтрона (гелий-4) и реже одного раза на миллион встречаются атомы гелия с одним нейтроном (гелий-3). Другие изотопы гелия — гелий-5 , гелий-6 и гелий-8 (не показанный на рисунке) — неустойчивы и обнаруживаются лишь на очень непродолжительное время в ядерных реакциях (подробнее об этом будем говорить еще не скоро). Размеры ядер на рисунке очень сильно увеличены. Если бы они были такими, как это показано на рисунке, диаметр атома должен был достигать примерно 0,5 км.
Пример 1. Сколько протонов, нейтронов и электронов содержится в атоме урана-238? Запишите символ этого изотопа.
Решение: Порядковый номер урана (см. таблицу Менделеева) равен 92, а массовое число изотопа равно 238 (по условию). Следовательно, он содержит 92 протона, 92 электрона и 238 — 92 = 146 нейтронов. Его символ 238U.
Дефект массы и энергия связи ядра
Затронув тему изотопов, нельзя пройти мимо феномена дефект массы ядра. Когда из отдельных нуклонов образуется атомное ядро, часть их массы превращается в энергию. Другими словами, вот взяли вы щепотку протонов и нейтронов, хорошенько их смяли вместе, и получили ядро, но его масса будет меньше массы исходных компонентов. Это и есть дефект масс. Формула для расчета дефекта массы ядра:
- ∆m=(Zmp+Nmn)-Mя
где Mя – масса ядра, Z – число протонов в ядре, N – число нейтронов в ядре, mp – масса протона, mn – масса нейтрона.
Если к атому подвести энергию (которая эквивалентна дефекту масс), то можно разделить его ядро обратно на нуклоны. Эта энергия носит название энергия связи ядра. Формула для расчета энергии связи ядра:
- ∆Eсв=∆mc2
где с — скорость света, ∆m — дефект массы ядра
Проверьте себя, как вы усвоили понятия дефект массы и энергия связи ядра, самостоятельно решив задачу пользуясь формулами выше.
Пример 2. Если образовать атом углерода-12 из субатомных частиц, какое значение будет иметь дефект масс?
Показать
Ответ: 0,0990 а.е.м.
[свернуть]
Теперь нам известно, что каждый изотоп элемента характеризуется порядковым номером (суммарным числом протонов), массовым числом (суммарным числом протонов и нейтронов) и атомной массой (массой атома, выраженной в атомных единицах массы). Поскольку дефект массы при образовании атома очень мал, массовое число обычно совпадает с атомной массой изотопа, округленной до ближайшего целого числа. (Например, атомная масса хлора-37 равна 36,966, что после округления дает 37.) Если в природе встречается несколько изотопов одного элемента, то экспериментально наблюдаемая атомная масса (естественная атомная масса) равна средневзвешенному значению атомных масс отдельных изотопов. Это средневзвешенное значение определяется соответственно относительному содержанию изотопов в природе. Хлор существует в природе в виде смеси из 75,53% хлора-35 (атомная масса 34,97 а.е.м.) и 24,47% хлора-37 (36,97 а.е.м.), поэтому средневзвешенное значение масс этих изотопов равно
- (0,7553·34,97 а.е.м.) + (0,2447·36,97 а.е.м.) = 35,46 а.е.м.
Атомные массы, указанные в таблице Менделеева представляют собой во всех случаях средневзвешенные значения атомных масс изотопов, встречающихся в природе, и именно этими значениями мы будем пользоваться в дальнейшем, за исключением тех случаев, когда будет обсуждаться какой-нибудь конкретный изотоп. Все изотопы одного элемента в химическом отношении ведут себя практически одинаково. На рисунке ниже изображены состав и свойства некоторые атомов, ионов и изотопов элементов.
Пример 3. Магний (Mg) в основном состоит из трех естественных изотопов: 78,70% всех атомов магния имеют атомную массу 23,985 а.е.м., 10,13% — 24,986 а.е.м. и 11,17% — 25,983 а.е.м. Сколько протонов и нейтронов содержится в каждом из этих трех изотопов? Чему равно средневзвешенное значение их атомных масс?
Решение: Все изотопы магния содержат по 12 протонов. Изотоп с атомной массой 23,985 а.е.м. имеет массовое число 24 (суммарное число протонов и нейтронов), следовательно, он имеет 24 — 12 = 12 нейтронов. Символ этого изотопа 24Mg. Аналогично находим, что изотоп с атомным весом 24,986 а.е.м. имеет массовое число 25, содержит 13 нейтронов и имеет символ 25Mg. Третий изотоп (25,983 а.е.м.) имеет массовое число 26, содержит 14 нейтронов и имеет символ 26Mg. Средняя атомная масса магния находится следующим образом:
- (0,7870·23,985 а.е.м.) + (0,1013·24,986 а.е.м.) + (0,1117·25,983 а.е.м.) = 24,31 а.е.м.
Надеюсь урок 2 «Изотопы элементов» помог вам понять что из себя представляют изотопы. Если у вас возникли вопросы, пишите их в комментарии.

Таблицы DPVA.ru — Инженерный Справочник
Адрес этой страницы (вложенность) в справочнике dpva.ru: 
Распространенность изотопов в природе и их масса, точная таблица.
Распространенность изотопов в природе и их масса, точная таблица.
Ted Pella Inc, USA — продукты для микроскопии |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Поиск в инженерном справочнике DPVA. Введите свой запрос: |
Поиск в инженерном справочнике DPVA. Введите свой запрос:
Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста.
Вложите в письмо ссылку на страницу с ошибкой, пожалуйста.
Коды баннеров проекта DPVA.ru
Начинка: KJR Publisiers
Консультации и техническая
поддержка сайта: Zavarka Team
Free xml sitemap generator
Атомная масса (атомный вес) природного элемента. Изотопный состав элементов. Дефект массы.
В
природе элементы за редким исключением
существуют в виде смесей из нескольких
изотопов. Это ведет к тому, что атомный
вес природного
элемента несколько отличается от
атомного веса любого из его чистых
изотопов. Легче всего это понять из
таблицы 2-2, где приведены атомные веса
природных элементов и их изотопный
состав.
Таблица 2-2. Символы,
названия, атомные веса и природный
изотопный состав некоторых химических
элементов.
|
Элемент и его символ |
Латинское (как читается) |
Атомный вес природного |
Атомный вес изотопов |
Содержание изотопов |
|
Водород 11H 21H |
Hydrogenium (гидрогениум) |
1,0079 |
…… 1,0078 2,0140 |
…… 99,984 0,0156 |
|
Углерод 126C 136C |
Carboneum (карбониум) |
12,011 |
…… 12,00000 13,00335 |
…… 98,892 1,108 |
|
Азот 147N 157N |
Nitrogenium (нитрогениум) |
14,0067 |
…… 14,00307 15,00011 |
…… 99,635 0,365 |
|
Кислород 168O 178O 188O |
Oxygenium (оксигениум) |
15,9994 |
…… 15,99491 16,9991 17,9992 |
…… 99,759 0,037 0,204 |
|
Натрий 2311Na |
Natrium (натриум) |
22,9898 |
…… 22,9898 |
…… 100 |
|
Хлор 3517Cl 3717Cl |
Chlorum (хлорум) |
35,453 |
…… 34,96885 36,9658 |
…… 75,53 24,47 |
Из таблицы видно,
что средний измеренный атомный вес
найденного в природе элемента зависит
от того, сколько в нем содержится разных
изотопов.
Итак,
в первой колонке таблицы 2-2 приведено
русское название элемента. Ниже —
латинский символ
элемента, связанный обычно с его латинским
названием. Слева вверху от символа
элемента указываются массовое число
(сумма протонов и нейтронов в ядре), а
слева внизу — заряд ядра атома (количество
протонов). Например:
Как видно из таблицы
2-2, атомные веса элементов, найденных в
природе в виде единственного изотопа
(например, натрия), в точности равны
атомному весу этого изотопа. Иначе
обстоит дело с элементами, которые
существуют на Земле в виде нескольких
изотопов (например, хлор, кислород): их
атомный вес зависит от того, какой изотоп
этого элемента наиболее распространен
и сколько в нем «примесей» других
изотопов этого элемента.
Атомный вес
элемента равен среднему значению из
атомных весов всех его природных изотопов
с учетом их распространенности.
Например, элемент
хлор в природе находится в виде двух
изотопов: хлор-35 и хлор-37. Их содержание
составляет 75,53% и 24,47% (см. табл. 2-2). Если
общее содержание двух изотопов хлора
в сумме принять за единицу, то одного
из них — примерно 0,75 и другого — примерно
0,25 (в долях единицы). Тогда атомный вес
природной смеси двух изотопов хлора
округленно равен:
34,97
0,75 + 36,96
0,25 = 35,5.
Можно решать и
обратную задачу. Допустим, точно известно,
что природный хлор состоит из двух
изотопов 35Cl
и 37Cl.
Найденный в эксперименте атомный вес
природного хлора составил 35,5. Сколько
каждого изотопа содержится в природном
хлоре? Если принять сумму изотопов за
единицу, а содержание, например, 35Cl
за x, то содержание изотопа 37Cl
составит (1 — x). Тогда: 35x + 37(1 — x) = 35,5. Решив
это простое уравнение, получим содержание
изотопа 35Cl
равным 0,75 или 75%.
Есть еще один
важный фактор, влияющий (хотя и в меньшей
степени) на атомный вес элемента — дефект
массы.
Внимательный читатель мог заметить
некоторые «странности» в табл. 2-2.
Например, атомная масса единственного
изотопа натрия 2311Na
немного меньше, чем 23 а.е.м. Массы
протона и нейтрона чуть больше 1 а.е.м.
Почему же атом натрия, содержаший в
своем ядре 11 протонов и 12 нейтронов
имеет массу меньше 23 (22,9898 а.е.м.)? То же
явление хорошо заметно для изотопов
кислорода и хлора (см. табл. 2-2). Дело в
том, что связывание между собой одноименно
заряженных протонов в ядрах атомов
требует больших затрат энергии. Нейтроны
тоже участвуют в этом связывании,
выполняя роль своеобразного ядерного
«клея». При этом часть массы протонов
и нейтронов переходит в энергию связывания
нуклонов в ядре. Такая потеря массы
протонов и нейтронов, возникающая в
результате их связывания, называется
дефектом
массы.
Дефект массы
— уменьшение массы атома по сравнению
с суммарной массой всех отдельно взятых
составляющих его элементарных частиц,
обусловленное энергией их связи в атоме.
Если «разобрать»
ядро атома на отдельные протоны и
нейтроны (например, с помощью ядерной
реакции), то их масса вновь примет именно
те значения, которые нам уже известны:
1,00728 а.е.м. для протона и 1,00867 а.е.м. для
нейтрона.
Дефект массы
является следствием универсального
соотношения E
= Mc2,
вытекающего из теории относительности
А. Эйнштейна, где E
— полная энергия системы, c
= 3.1010
см/сек — скорость света в пустоте, M
— масса системы (в нашем случае — атома).
Тогда M
= Е/c2,
где M
— дефект массы, а E
— энергия связи нуклонов в ядре, т.е.
энергия, которую необходимо затратить
для разделения ядра атома на отдельные
протоны и нейтроны. Таким образом, чем
больше дефект массы, тем больше энергия
связывания нуклонов в ядре и тем
устойчивее ядро атома элемента. С
увеличением числа протонов в ядре (и
массового числа) дефект массы сначала
возрастает от нуля (для 1H)
до максимума (у 64Ni),
а затем постепенно убывает для более
тяжелых элементов.
Нет
никакой необходимости запоминать
изотопный состав, заряд ядра, массовые
числа и атомные веса разных элементов.
Эти значения всегда можно найти в
справочниках. Важно понимать физический
смысл этих величин. В
химии традиционно используются не
абсолютные значения атомных масс, а
относительные.
Относительной
атомной массой Аr
химического элемента называется
величина, равная отношению средней
массы атома естественного изотопического
состава элемента к 1/12 массы атома
углерода-12. Относительной
молекулярной массой
Мr
химического вещества называется
величина, равная отношению средней
массы молекулы естественного изотопического
состава вещества к 1/12 массы атома
углерода-12.
Любое химическое
вещество характеризуется количеством
вещества. Количество
вещества
– это число структурных элементов
(атомов, молекул, ионов и др.) в системе.
Единицей измерения количества вещества
является моль. Моль
– количество
вещества системы, которое содержит
столько структурных элементов (молекул,
атомов, ионов, электронов и т.д.), сколько
атомов содержится в 0,012 кг углерода-12.
Массу одного моля называют молярной
массой.
Единица измерения – г/моль или кг/моль.
Познание
химии как одной из важнейших фундаментов
естественных наук необходимо для
формирования научного мировоззрения.
Изучение химии играет важную роль
образного мышления в творческом росте
будущих специалистов. Важную роль играет
химия в жизни каждого человека, в его
практической деятельности. Особенно
велико значение науки о веществе в
технике, развитие которой немыслимо
без понимания процессов превращения
веществ. Глубокое понимание законов
химии, их применение позволяют как
совершенствовать существующие, так и
создавать новые процессы, машины,
установки и приборы. Химизация народного
хозяйства является одним из важнейших
путей интенсификации его развития.
Химические реакции
широко используются во многих
производственных процессах. Они
(например, процессы окисления, коррозии
и др.) протекают при работе установок,
машин и приборов. Получение электроэнергии,
топлива, металлов, различных материалов,
продуктов питания и т.п. непосредственно
связано с химическими реакциями. В
настоящее время, например, электрическую
и механическую энергии получают, в
основном, преобразованием химической
энергии природного топлива. В процессе
преобразования происходят сложные
химические реакции: горения, взаимодействия
воды и ее примесей с металлами и т.п. Без
понимания этих процессов невозможно
обеспечить эффективную работу
электростанций и двигателей внутреннего
сгорания.
Использование
химических реакций в ряде производственных
процессов позволяет резко повышать
производительность труда и качество
продукции, получать новые материалы.
Понимание
законов химии и их использование
исключительно важно при решении проблемы
повышения эффективности производства
и качества продукции, так как ухудшение
качества и надежности продукции во
многих случаях вызывается нежелательными
химическими процессами, например
коррозией металлов, старением полимеров
и т.п. Изучение механизмов химических
реакций позволяет выбрать рациональные
методы охраны окружающей среды, создавать
новые безвредные процессы. Химизация
любой отрасли народного хозяйства
приносит большой экономический эффект.
Возросла роль
химии в развитии электротехники,
микроэлектроники, радиотехники,
космической техники, автоматики и
вычислительной техники. Для развития
новой техники необходимы материалы с
особыми свойствами, которых нет в
природе: сверхчистые, сверхтвердые,
сверхпроводящие, жаростойкие и т.п.
Такие материалы поставляет современная
химическая промышленность, поэтому
можно понять важность изучения химии
для любой специальности. В электротехнической
промышленности, более 80 % продукции
выпускается с применением полимерных
материалов.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Every atom has a certain number of protons, electrons and neutrons. Protons carry a positive charge, electrons carry a negative charge and neutrons do not carry a charge. Protons and neutrons make up the nucleus or central part of the atom. Electrons orbit around the nucleus. Most atoms have isotopes that occur naturally. An isotope is an atom with a different number of neutrons, but the same number of protons and electrons. Each element has a standard number of neutrons that can be found by looking at a periodic table. From the periodic table, you will get the atomic number on the top left corner of the box. This is the number of protons. The atomic weight of the element can be found on the bottom of the box on the periodic table.
How to Find the Most Common Isotope
-
It is helpful to write out each step and clearly label each value so that if you find you have made an error, it will be easier to check your work.
-
Finding the most common isotope is a fairly simple calculation. It is also possible to reverse the process and use the isotope values to find the atomic weight.
••• Michael Gann/Demand Media
Find the element on the periodic table. Record the atomic weight (on the bottom) and the atomic number (top left).
••• Michael Gann/Demand Media
Round the atomic weight to the nearest whole number. If the decimal is .5 or higher, round up, if it is .49 or lower, round down.
••• Michael Gann/Demand Media
Subtract the atomic number (the number of protons) from the rounded atomic weight. This gives you the number of neutrons in the most common isotope.
••• Michael Gann/Demand Media
Use the interactive periodic table at The Berkeley Laboratory Isotopes Project to find what other isotopes of that element exist.
Tips
Warnings
Количество протонов в атоме определяет, что это за элемент, но атомы могут иметь разное количество нейтронов, чтобы придать ему разную массу. Когда два атома одного и того же элемента имеют разное количество нейтронов, их называют изотопами. Некоторые изотопы встречаются в природе, и можно рассчитать процентное содержание двух изотопов в природе, если атомные массы и средняя атомная масса элемента уже известны.
Определите атомные массы изотопов, а также среднюю атомную массу элемента. Единицы этих значений будут в а.е.м., что означает «атомная единица массы». Один а.е.м. — это примерно масса одного протона. Например, бор имеет два встречающихся в природе изотопа: B-10 с массой 10,013 а.е.м. и B-11 с массой 11,009 а.е.м. Средняя атомная масса бора, согласно периодической таблице, составляет 10,811 а.е.м.
Введите значения в следующую формулу: a = b (x) + c (1 — x). В уравнении «a» — средняя атомная масса, «b» — атомная масса одного изотопа, «c» — атомная масса другого изотопа, а «x» — содержание первого изотопа. Например, 10,811 = 10,013 (x) + 11,009 (1 — x).
Добавьте отрицательный коэффициент x к обеим сторонам уравнения. Например, 10,811 + 11,009x = 10,013x + 11,009 — 11,009x + 11,009x, что сокращается до 10,811 + 11,009x = 10,013x + 11,009.
Вычтите фактор без x из обеих частей уравнения. Например, 10,811 + 11,009x — 10,811 = 10,013x + 11,009 — 10,811, что сокращается до 11,009x = 10,013x — 0,198.
Вычтем 10,013x из обеих частей уравнения. Например, 11,009x — 10,013x = 10,013x — 0,198 — 10,013x, что сокращается до 0,996x = 0,198.
Разделите обе стороны на коэффициент x-фактора. Например, 0,996x / 0,996 = 0,198 / 0,996, что сокращается до x = 0,1988. Это изобилие B-10.
Вычтите это значение из 100 процентов, чтобы найти содержание другого изотопа. Например, 100 — 19,88 = 80,12 процента. Это процентное содержание B-11.
об авторе
Кевин Карр пишет для различных торговых точек и компаний с 1991 года. Он участвовал в разработке учебников McGraw-Hill для средней и старшей школы, написанных для Newspaper Network of Центральный Огайо и был признанным кинокритиком для интернет-изданий, включая 7M Pictures и Film School. Отклоняет. Карр имеет степень бакалавра педагогических наук.