Рекомендуемые сообщения
Решение задач по фото за 30 минут! Мы онлайн – кликай!
-
- Поделиться
Как рассчитывают концентрацию ионов в растворах солей? Поясните на примере, пожалуйста: рассчитать концентрацию катионов в 0,2 М растворе Na2SO4
Ссылка на комментарий
—>
- Решение
- Решение
-
- Поделиться
Вы рассчитываете массу катиона (в данном случае Na+) относительно всего раствора.
Ссылка на комментарий
- Автор
-
- Поделиться
Вы рассчитываете массу катиона (в данном случае Na+) относительно всего раствора.
спасибо
Ссылка на комментарий
-
- Поделиться
В 0,2 молярном растворе содержиться 142×0.2=28.4 грамма.
142-28.4
46-х=9.2
9.2-х ~0.65моль/литр.
28.4 — 0.2 моль
Ответ 0.65 моль/литр
Ссылка на комментарий
- Автор
-
- Поделиться
В 0,2 молярном растворе содержиться 142×0.2=28.4 грамма.
142-28.4
46-х=9.2
9.2-х ~0.65моль/литр.
28.4 — 0.2 моль
Ответ 0.65 моль/литр
Я рассчитывала так:
Na2SO4 —> 2Na+ + SO4 2-
C [Na+] = Cм * 2 = 0,2 * 2 = 0,4 моль/л
Получается, неверный ход решения?
Ссылка на комментарий
-
- Поделиться
0.2 моль/литр концентрация всего сульфата. Нужна отдельно массу катиона — два натрия 23×2=46
46-х=0,65
142-0.2
Более просто и короче
Ссылка на комментарий
- Автор
-
- Поделиться
0.2 моль/литр концентрация всего сульфата. Нужна отдельно массу катиона — два натрия 23×2=46
46-х=0,65
142-0.2
Более просто и короче
поняла, спасибо за помощь)
Ссылка на комментарий
-
- Поделиться
Я рассчитывала так:
Na2SO4 —> 2Na+ + SO4 2-
C [Na+] = Cм * 2 = 0,2 * 2 = 0,4 моль/л
Получается, неверный ход решения?
Верный.
Для чего находить массу, и строить какие-то дикие пропорции, если вам нужна молярная концентрация,
когда ответ виден сразу из формулы соли — непонятно
Изменено 10 Апреля, 2016 в 12:45 пользователем M_GM
Ссылка на комментарий
-
- Поделиться
Черт! Я решал как процентную концентрацию!
Например. Берем 20 % раствор сульфата натрия. Определяем конц ионов натрия по верхним 《диким пропорциям》 и вуаля процентная конц катиона равна 6.2%.
Извиняюсь за дезинформацию.
Ссылка на комментарий
Для публикации сообщений создайте учётную запись или авторизуйтесь
Вы должны быть пользователем, чтобы оставить комментарий
Войти
Уже есть аккаунт? Войти в систему.
Войти
находите массу самого натрий хлорида (т. к. раствор) катионы весят прибл. одинаково с не кат. т. е. молярная масса натрия прибл=( можем считать, что =)мол. массе натрий+ находим кол-во вещества соли, кол-во вещ-ва натрия= к. в. хлора = к. в. соли находим массы всех катионов натрия и всех анионов хлора кол-во ионов одининаковое химия была давно).
Vlad0957:
Можешь пожалуйста помочь з задачей такой???
Результаты (отдельно
для катионов и отдельно для анионов)
запишите в соответствующие строки
второй вертикальной колонки таблицы
(рис.9). Суммы катионов и анионов должны
быть равны или могут незначительно
отличаться друг от друга, так как
некоторые ионы (А13+
СОз2+
и другие) не были учтены. Если
суммы катионов (К) и анионов (А) различаются
более чем на 5%, т.е. если 5%,
то допущена ошибка в расчетах или при
переписывании исходных данных.
Эту ошибку необходимо найти и исправить.
Рис 9. Химический
состав той же пробы, что и на рис.8,
пересчитанный в эквивалентную форму
(по Гречину П.И. и др. 2003).
|
Ионы |
мг/л |
мг-экв/л |
%-экв |
|
|
Катионы |
NH4l+ |
– |
– |
|
|
NaI++KI+ |
21,2 |
0,9 |
||
|
Mg2+ |
19,4 |
1,6 |
||
|
Са2+ |
68,0 |
3,4 |
||
|
Fe |
0,1 |
– |
||
|
A13+ |
– |
– |
||
|
Сумма |
108,7 |
5,6 |
||
|
Анионы |
||||
|
CI1– |
6,0 |
0,2 |
||
|
SO42– |
33,2 |
0,7 |
||
|
HCO31– |
298,0 |
4,9 |
||
|
СО22– |
– |
– |
||
|
NO3l– |
0,06 |
– |
||
|
Сумма |
338,1 |
5,8 |
||
|
Общая |
446,7 |
– |
5. Определить
процент-эквивалентное содержание ионов.
Для этого сумму
отдельно катионов (и, соответственно,
отдельно анионов) принимают за 100% и
вычисляют «долю» каждого катиона
(аниона). Точность — до целых единиц. При
одинаковом содержание двух катионов
(или анионов), точность следует повысить
и определить какого иона больше.
Результат записать в третью вертикальную
колонку таблицы (рис.10). Обязательно
проверьте, составляет ли содержание
катионов (анионов) в сумме 100
процент-эквивалентов.
Рис.10. Заполнение
таблицы химического состава воды
(окончание).
|
Ионы |
мг/л |
мг-экв/л |
%-экв |
|
|
Катионы |
NH4l+ |
– |
– |
– |
|
NaI++KI+ |
21,2 |
0,9 |
15 |
|
|
Mg2+ |
19,4 |
1,6 |
27 |
|
|
Са2+ |
68,0 |
3,4 |
58 |
|
|
Fe |
0,1 |
– |
– |
|
|
A13+ |
– |
– |
– |
|
|
Сумма |
108,7 |
5,6 |
100 |
|
|
Анионы |
||||
|
CI1– |
6,0 |
0,2 |
3 |
|
|
SO42– |
33,2 |
0,7 |
12 |
|
|
HCO31– |
298,0 |
4,9 |
85 |
|
|
СО22– |
– |
– |
– |
|
|
NO3l– |
0,06 |
– |
– |
|
|
Сумма |
338,1 |
5,8 |
100 |
|
|
Общая |
446,7 |
– |
– |
Примечание:
по указанию преподавателя при составлении
таблицы кроме основных могут быть учтены
и другие ионы, например F1–.
Задание 2. Составить
формулу Курлова и дать характеристику
воды по
классификации
Алекина.
+++Расчёт концентрации ионов в растворе
-
Kirill09
- Сообщения: 206
- Зарегистрирован: Сб янв 23, 2010 5:20 pm
+++Расчёт концентрации ионов в растворе
Доброго времени суток, Уважаемые коллеги!
Меня интересует следующий вопрос. Мне необходимо приготовить раствор модельной минеральной (пластовой) воды с заданными параметрами (концентрациями ионов Кальция,Хлора и Магния). Существует ли какая-нибудь взаимосвязь между массой растворяемой соли (CaCl2, MgCl2) и концентрацией ионов (хлора, магния и кальция) в полученном растворе? Можно ли, хотя бы примерно просчитать концентрацию вышеперечисленных ионов в моделируемом растворе??
Меня интересует выражение концентрации либо Мг/л, в крайнем случае (мг-экв/л), по аналогии с жёсткостью воды!
Заранее спасибо!
Последний раз редактировалось Kirill09 Ср янв 22, 2014 7:11 pm, всего редактировалось 1 раз.
-
antabu
- Сообщения: 4988
- Зарегистрирован: Пн май 25, 2009 7:00 pm
Re: Расчёт концентрации ионов в растворе
Сообщение
antabu » Пт янв 17, 2014 7:32 am
Я не вижу здесь никаких подвохов, кроме как: исходные навески солей могут содержать различное количество влаги в зависимости от условий хранения. Несколько точнее будет приготовить исходные крепкие растворы, определить их плотности и найти концентрации по табличкам, отмерять объёмы. А так — школьный уровень.
«Я не видел людей страшней, чем толпа цвета хаки»
-
Kirill09
- Сообщения: 206
- Зарегистрирован: Сб янв 23, 2010 5:20 pm
Расчёт концентрации ионов в растворе
Сообщение
Kirill09 » Пт янв 17, 2014 7:22 pm
К сожалению, что-то не могу найти и сообразить как же всё-таки рассчитать массу (хлористого кальция) вещества для получения раствора с концентрацией ионов кальция 4208 мг/л…либо просто подбирать возможные вариации, если нет уникальной связывающей формулы?!
-
Commander L
- Сообщения: 2308
- Зарегистрирован: Вс ноя 11, 2012 4:00 pm
Re: Расчёт концентрации ионов в растворе
Сообщение
Commander L » Пт янв 17, 2014 7:55 pm
Коллега, простите за грубость, но Вам бы отдохнуть или учебник по химии какой (подоидет даже за 8 класс школы) полистать что ли…
У Вас есть концентрация ионов в растворе, что мешает рассчитать массу навески? Вещество хорошо растворимо (примерно 75 г на 100 мл воды, если верить вики), диссоциирует нацело, до точки насыщения не доидете.
Alea jacta est.
«О, утраченный, ветром оплаканный призрак! Вернись!! Вернись!!» Т.Вулф
«Я боюсь стать таким, как взрослые, которым ничто не интересно, кроме цифр.» А. де Сент-Экзюпери
-
himdim2012
- Сообщения: 977
- Зарегистрирован: Сб фев 04, 2012 4:20 pm
Re: Расчёт концентрации ионов в растворе
Сообщение
himdim2012 » Пт янв 17, 2014 8:54 pm
antabu писал(а):Я не вижу здесь никаких подвохов, кроме как: исходные навески солей могут содержать различное количество влаги в зависимости от условий хранения.
учитывая минерализацию пластовых вод, сим фактом можно пренебречь
antabu писал(а): А так — школьный уровень.
Согласен на 100%
Kirill09 писал(а):Меня интересует выражение концентрации либо Мг/л, в крайнем случае (мг-экв/л)
ну обычно минерализация пластовых вод измеряется в г/л.
А учитывая уровень ТС в аналитической химии, проще набрать этой самой пластовой воды из какой нибудь скважины т.к. в пластовых водах растворено пол таблицы Менделеева. И от скважины к скважине состав их меняется даже на территории одного месторождения. Это к тому что приготовление модельного раствора пластовой воды бесполезная затея.
— Вас Кузьмой зовут?
— Кузенькой, можно Кузькой, маленький я ещё, семь веков всего, восьмой пошел.
Из м/ф «Домовенок Кузя»
-
Kirill09
- Сообщения: 206
- Зарегистрирован: Сб янв 23, 2010 5:20 pm
Расчёт концентрации ионов в растворе
Сообщение
Kirill09 » Пт янв 17, 2014 10:17 pm
Т.е. как я понимаю, мы даже приблизительно не сможем приготовить модельную пластовую воду?! Неужели вообще нет никаких формул связывающих концентрацию ионов в растворе, с массой навески (заведомо растворяемой соли)…эх..очень жаль!
-
Гесс
- Сообщения: 12777
- Зарегистрирован: Ср фев 15, 2012 11:19 pm
Re: Расчёт концентрации ионов в растворе
Сообщение
Гесс » Пт янв 17, 2014 10:48 pm
То ли, я то ли вы чего то непонимаете.
Если вы растворите 58,4 грамма поваренной соли в 1 литре воды у вас будет концентрация натрия 22,9 грамма на литр и хлора 35,5 граммов на литр.
Это собственно то за чем вас пытаются в учебники 8 класса послать.
А приготовление модельной пластовой воды невозможно не в силу отсутствия формулы а в силу того что написал himdim2012
А ну да, легендарная формула!
m навески = m катиона + m аниона
количество вещества = m навески / молекулярная масса
количество катионов = количество вещества * число атомов катиона в соли.
m катиона = количество катионов * молярную (атомную) массу катиона
Концентрация катиона = m катиона / обьем воды
-
antabu
- Сообщения: 4988
- Зарегистрирован: Пн май 25, 2009 7:00 pm
Re: Расчёт концентрации ионов в растворе
Сообщение
antabu » Сб янв 18, 2014 9:13 am
Гесс писал(а):
m навески = m катиона + m аниона
Хлорид магния чаще приобретают в виде гидрата.
«Я не видел людей страшней, чем толпа цвета хаки»
-
Kirill09
- Сообщения: 206
- Зарегистрирован: Сб янв 23, 2010 5:20 pm
Расчёт концентрации ионов в растворе
Сообщение
Kirill09 » Сб янв 18, 2014 9:39 am
Спасибо большое за помощь, уважаемые коллеги…видимо я не правильно выразился…в лабораторных условиях методом подбора я довёл концентрацию ионов Кальция до 4150 мг/л (добавлением к 100 мл. дистил. воды примерно 1,235-1,237 гр хлористого кальция), а концентрацию ионов магния я довёл до 265 мг/л (добавлением к 100 мл. дистил. воды примерно 0.207-0.21 гр шестиводного хлорида магния или Бишофита).
Концентрации ионов кальция я нахожу по формуле, титрованием Трилоном Б, с введением мурексида для наглядности (перехода окраски из малиново-красной в фиолетовую): [Ca2+] = 500 * V(израсходованного Трилона Б).
Концентрации ионов магния я нахожу по формуле, титрованием Трилоном Б, с введением аммиачного р-ра Эриохромадля наглядности (перехода окраски из винно-малиновой в сине-зелёную): [Mg2+] = 300 * V1(израсходованный объём пошедший на титрование Mg+Ca)- V(объём израсходованного Трилона Б пошедший на титрование Кальция).
Но к сожалению я смог добиться искомой концентрации лишь с помощью эксперимента…теоретических формул для предварительного подсчёта я не нашёл.
-
avor
- Сообщения: 12650
- Зарегистрирован: Пн янв 24, 2005 1:13 pm
-
MONSTA
- Сообщения: 2010
- Зарегистрирован: Вт фев 20, 2007 11:36 am
Re: Расчёт концентрации ионов в растворе
Сообщение
MONSTA » Пн янв 20, 2014 2:11 pm
К сожалению, используемые хлоридные соли-кристаллогидраты практически никогда в банке не имеют того состава, который прописан в формуле. Реальный состав определяется только химическим анализом. Так что практические проблемы при приготовлении неких растворов с заданной концентрацией, пусть даже реактив брали из банки с надписью ОСЧ, они определенно будут. Топикстартер показал, что он понимает эти проблемы, и решает их практически титрованием с Эриохромом. Возможно, тут лучше был бы другой индикатор. Ибо, там начинаются вопросы, где лучше использовать Эриохром, а где — его цинковую соль (обычный продажный реактив). С мурексидом вроде проблем меньше.
Так что давайте не смайлики рисовать кучами, а давать конкретные рекомендации. Я, правда, признаюсь, что я в этой области мало копенгаген.
-
avor
- Сообщения: 12650
- Зарегистрирован: Пн янв 24, 2005 1:13 pm
Re: Расчёт концентрации ионов в растворе
Сообщение
avor » Вт янв 21, 2014 5:31 am
На счет гидратированных форм было сказано в первом же сообщении, между прочим. Хлорид кальция существует и в плавленном(безводном) виде, для сушки растворителей такой используют, гарантийный срок у него по моему год в невскрытой таре. Для целей топик стартера вполне себе применим. Так же есть фарм форма Хлорида кальция 10%вес/объемная концентрация. И нормальный аналитик не в смесях будет концентрации измерять, а отдельно отитрует концентрированные растворы индивидуальных веществ, из которых и будет впоследствии готовить нужную ему смесь. Как- то так. А формулы во всех этих случаях все же придется применять тертические.
Концентрация ионов натрия в растворе хлорида натрия
Вычислите концентрацию ионов натрия (Na+) (в моль/л) в 1,17-процентном растворе хлорида натрия (NaCl), приняв плотность раствора равной 1 г/см3.
Решение задачи
Вычислим массу раствора хлорида натрия по формуле, устанавливающей связь между массой и объемом:
Получаем:
m = 1000 мл ∙ 1 г/мл = 1000 (г).
Найдем массу хлорида натрия (NaCl), содержащегося в 1 л раствора, для этого составим пропорцию:
в 100 г раствора содержится 1,17 г NaCl
в 1000 г раствора содержится г NaCl
Откуда:
Учитывая, что молярная масса хлорида натрия (NaCl) равна 58,5 г/моль, рассчитаем химическое количество хлорида натрия (NaCl), используя формулу, устанавливающую связь между химическим количеством вещества и массой:
Получаем:
Из уравнения диссоциации хлорида натрия (NaCl) (отмечу, что соли в разбавленных растворах диссоциируют полностью):
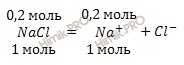
Найдем молярную концентрацию ионов натрия по формуле:
Получаем:
Ответ: концентрацию ионов натрия 0,2 моль/л.



