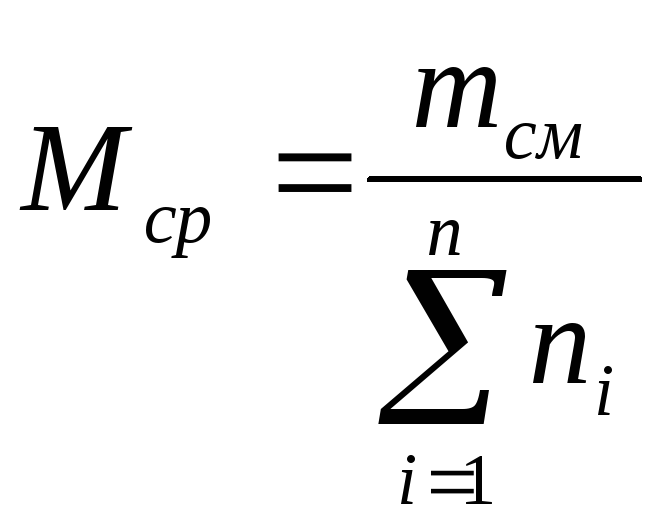Воронежская
область
Нижнедевицкий
район
МКОУ
«Вязноватовская СОШ имени Пенькова С.В.»
ВЫЧЕСЛЕНИЕ МАССЫ КОМПОНЕНТОВ В СМЕСИ
подготовил:
учитель химии Носов А.В.
В
части С задач по химии в рамках ЕГЭ встречаются задачи разной направленности и
разной степени трудности. Приведем примеры решения задач на взаимодействие
смеси веществ с одним реагентом.
Предлагаю
решение задач словесно-логическим методом. Использование данного метода
развивает в первую очередь логику и помогает решать задачи как по химии, так и
по другим предметам.
Разберем
вариант, когда в смеси взаимодействует с реагентом только один компонент.
Смесь
веществ А и В, массой х, обработали реагентом, при этом выделился газ.
Определить массовые доли компонентов в исходной смеси.
Записываем
уравнение взаимодействия одного из веществ с реагентом.
А
+ Р(реагент) → СД + Г(газ)
Находим
массу газа и записываем над Г. Проводим вспомогательные расчеты. Решаем пропорцию
по нахождению массы А. Затем рассчитываем массовую долю в исходной смеси.
Записываем ответ.
Например(демоверсии по
химии):
1. Определите массовые
доли ( в %) сульфата железа( II)
и сульфида алюминия в смеси, если при обработке 25 г. этой смеси водой
выделился газ, который полностью прореагировал с 960 г 5% раствора сульфата
меди.
Запишем уравнения
реакций:
1)
FeSO4
+ H2O
→ реакция не идет
2)
Al2S3
+ 6H2O → 2Al(OH)3 + 3H2S↑
Определили, что
выделившийся газ H2S.
Определим массу сульфата меди.
|
Дано |
Решение |
|||
|
w(CuSO4)=5% |
Составим пропорцию |
|||
|
m(р-ра)= |
960 — 100% |
|||
|
Найти |
х — 5% |
|||
|
m(CuSO4)-? |
||||
Определим массу газа.
|
Дано |
Решение |
||||||
|
m(CuSO4)=48г. |
х |
48 |
|||||
|
найти |
H2S |
+ CuSO4 |
→ CuS↓ + H2SO4 |
||||
|
m(H2S)-? |
34 |
160 |
|||||
|
Решаем пропорцию по |
|||||||
Решаем второе уравнение:
|
Дано |
Решение |
|||||
|
m(H2S)= |
х |
10,2 |
||||
|
Найти |
Al2S3 |
+ 6H2O → |
3H2S↑ |
|||
|
m(Al2S3)-? |
150 |
102 |
||||
|
Решаем пропорцию по |
||||||
Получаем m(Al2S3)=15г.
Соответственно m(FeSO4)=25-15=10г.
Произведя несложные
расчеты, получаем ответ: w(Al2S3)=60%,
w(FeSO4)=40%.
2.Смесь алюминия и меди
массой 9 г обработали хлороводородной кислотой. После окончания реакции собрали
5,6 л газа. Определите массовую долю (в %) меди в смеси.
Запишем уравнения
реакций:
Cu
+ HCl →
реакция не идет
2Al
+ 6HCl
→ 2AlCl3
+ 3H2
Переведём 5,6 л газа
(водорода) в граммы. Получим 0,5г.
Определим массу алюминия:
|
Дано |
Решение |
|
m(H2)=0.5г |
|
|
найти |
2Al |
|
m(Al)=? |
|
Находим х=4,5
Вычисляем массу m(Cu)=9-4,5=4,5
Соответственно вычисляем
правильный ответ w(Cu)=50%.
Литература:
1.
Лидин Р.А. Полный сборник
задач для школьников и поступающих в вузы /М. : Дрофа. 2007.
2.
Киреев В.А. Курс физической
химии. Изд.3-е, перераб. и доп. М., «Химия»1975г.
3.
Глинка П.Л. Общая химия.
Госхимиздат 1955 г.
Смесь, состоящая из
двух и более компонентов, характеризуется
свойствами и содержанием этих компонентов.
Состав смеси может быть задан массой,
объемом, количеством (числом молей или
килограмм-молей) отдельных компонентов,
а также значениями их концентраций.
Концентрацию компонента в смеси можно
выразить в весовых, мольных и объемных
долях или процентах, а также в других
единицах.
Массовая
доля i
какого-либо компонента определяется
отношением массы mi
данного компонента к массе всей смеси
mсм:
Учитывая,
что суммарная масса смеси равна сумме
масс отдельных компонентов, т.е.
можно написать:
или сокращенно:
Пример
4. Смесь
состоит из двух компонентов: m1
= 500 кг, m2
= 1500 кг. Определить массовую долю каждого
компонента в смеси.
Решение.
Массовая
доля первого компонента:
mсм=
m1
+ m2
= 500 + 1500 = 2000 кг
Массовая доля второго компонента:
Массовую
долю второго компонента можно определить
также, используя равенство:
1
+ 2
= 1
2
= 1 – 1
= 1 – 0,25 = 0,75
Объемная
доля i
компонента в смеси равна отношению
объема Vi
данного компонента к объему всей смеси
V:
Учитывая, что:
можно написать:
Пример
5.
Газ состоит из двух компонентов: V1
= 15,2 м3
метана и V2
= 9,8 м3
этана. Подсчитать объемный состав смеси.
Решение.
Общий объем смеси равен:
V
= V1
+ V2
= 15,2 + 9,8 = 25 м3
Объемная доля в смеси:
метана
этана
v2
= 1 – v1
= 1 – 0,60 = 0,40
Мольная
доля ni
какого-либо компонента смеси определяется
как отношение числа киломолей Ni
данного компонента к общему числу
киломолей N
смеси:
Учитывая,
что:
получим:
Пересчет мольных
долей в массовые можно проводить по
формуле:
Пример
6. Смесь
состоит из 500 кг бензола и 250 кг толуола.
Определить мольный состав смеси.
Решение.
Молекулярный
вес бензола (С6Н6)
равен 78, толуола (С7Н8)
– 92. Число килограмм-молей равно:
бензола
толуола
общее число
килограмм-молей:
N
= N1
+ N2
= 6,41 + 2,72 = 9,13
Мольная доля
бензола равна:
Для толуола мольная
доля может быть найдена из равенства:
n1
+ n2
= 1
откуда: n2= 1 –n1= 1 – 0,70 = 0,30
Среднюю молекулярную
массу смеси можно определить, зная
мольную долю и молекулярную массу
каждого компонента смеси:
(21)
где
ni
— содержание
компонентов в смеси, мол. доли; Mi
— молекулярная
масса компонента смеси.
Молекулярную массу смеси нескольких
нефтяных фракций можно определить по
формуле

или
(23)
где
m1,
m2,…,
mn
— масса
компонентов смеси, кг; M1,
М2,….,.Мп
— молекулярная масса компонентов смеси;
— % масс. компонента.
Молекулярную
массу нефтепродукта можно определить
также по формуле Крэга

Пример
7.
Определить среднюю молекулярную массу
смеси бензола с изооктаном, если мольная
доля бензола составляет 0,51, изооктана
0,49.
Решение.
Молекулярная масса бензола 78, изооктана
114. Подставляя эти значения в формулу
(21), получаем
Мср
= 0,51
78 + 0,48114
= 95,7
Пример
8. Смесь
состоит из 1500кг бензола и 2500кг н-октана.
Определить среднюю молекулярную массу
смеси.
Решение.
Используем формулу (22)
Объемный
молярный состав пересчитывают в массовый
следующим образом. Данный объемный
(молярный) состав в процентах принимают
за 100 молей. Тогда концентрация каждого
компонента в процентах будет выражать
число его молей. Затем число молей
каждого компонента умножают на его
молекулярную массу и получают массу
каждого компонента в смеси. Разделив
массу каждого компонента на общую массу,
получают его массовую концентрацию.
Массовый
состав пересчитывают в объемный
(молярный) следующим образом. Принимают,
что смеси взято 100 (г, кг, т) (если массовый
состав выражен в процентах), массу
каждого компонента делят на его
молекулярную массу. Получают число
молей. Делением числа молей каждого
компонента на их общее число получают
объемные (молярные) концентрации каждого
компонента.
Средняя плотность
газа определяется по формуле:
кг/м3;
г/см3
или, исходя из
объемного состава:
,
или, исходя из
массового состава смеси:

Относительную плотность определяют по
формуле:
Пример 9.Пересчитать массовый
состав газа в объемный и определить его
молекулярную массу, его плотность и
относительную плотность.
|
Компоненты |
М г/моль |
массовый % масс. |
mi |
Число
|
Объемный |
|
|
доли единицы |
% об. |
|||||
|
Метан |
16 |
40 |
40 |
40:16=2,50 |
0,669 |
66,9 |
|
Этан |
30 |
10 |
10 |
10:30=0,33 |
0,088 |
8,8 |
|
Пропан |
44 |
15 |
15 |
15:44=0,34 |
0,091 |
9,1 |
|
Бутан |
58 |
25 |
25 |
25:58=0,43 |
0,115 |
11,5 |
|
Пентан + высшие |
72 |
10 |
10 |
10:72=0,14 |
0,037 |
3,7 |
|
100 |
100 |
3,74 |
1,000 |
100,0 |
Для
простоты расчета примем массу смеси за
100 г, тогда масса каждого компонента
будет численно совпадать с процентным
составом. Найдем число молей ni
каждого компонента. Для этого массу
каждого компонента mi
разделим на мольную массу:
Находим объемный
состав смеси в долях единицы
i(CH4)
= 2,50 : 3,74 = 0,669;
(C2H6)
= 0,33 : 3,74 = 0,088;
(C5H8)
= 0,34 : 3,74 = 0,091;
(C4H10)
= 0,43 : 3,74 = 0,115;
(C5H12)
= 0,14 : 3,74 = 0,037.
Находим
объемный состав смеси в процентах,
умножив данные в долях единицы на 100%.
Все полученные данные заносим в таблицу.
Рассчитываем
среднюю массу смеси.
Мср
= 100 : 3,74 =
26,8 г/моль
Находим
плотность смеси
Находим относительную
плотность:
Пример 10.Пересчитать объемный
состав в массовый и определить его
молекулярную массу, его плотность и
относительную плотность.
|
Компоненты |
М г/моль |
Объемный % об. |
число |
Масса г. |
Весовой |
|
|
доли единицы |
% масс. |
|||||
|
Метан |
16 |
30 |
30 |
3016=480 |
0,117 |
11,7 |
|
Этан |
30 |
15 |
15 |
15·30=450 |
0,109 |
10,9 |
|
Пропан |
44 |
20 |
20 |
20·44=880 |
0,214 |
21,4 |
|
Бутан |
58 |
15 |
15 |
15·58=870 |
0,211 |
21,1 |
|
Пентан + высшие |
72 |
20 |
20 |
20·72=1440 |
0,349 |
34,9 |
|
100 |
100 |
4120 |
1,000 |
100,0 |
(CH4)
= 480 : 4120 = 0,117;
(C2H6)
= 450 : 4120 = 0,109;
(C3H8)
= 880 : 4120 = 0,214;
(C4H10)
= 870 : 4120 = 0,211;
(C5H12)
= 1440 : 4120 = 0,349.
Мср
= 4120 : 100 =
41,2 г/моль.
г/л
Задача 15. Смесь состоит из пяти
компонентов. Определить массовую,
объемную и мольную долю каждого компонента
в смеси, среднюю молекулярную массу
смеси.
|
Компоненты смеси |
Вариант |
|||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
mi |
mi |
mi |
||||||||
|
метан |
5 |
30 |
55 |
80 |
100 |
75 |
50 |
25 |
5 |
30 |
|
этан |
10 |
35 |
60 |
85 |
95 |
70 |
45 |
20 |
10 |
35 |
|
пропан |
15 |
40 |
65 |
90 |
90 |
65 |
40 |
15 |
15 |
40 |
|
н-бутан |
20 |
45 |
70 |
95 |
85 |
60 |
35 |
10 |
20 |
45 |
|
изобутан |
25 |
50 |
75 |
100 |
80 |
55 |
30 |
5 |
25 |
50 |
Задача 16.Пересчитать массовый
состав газа в объемный и определить его
молекулярную массу, плотность и
относительную плотность по воздуху.
|
Компоненты смеси |
ω% массовый |
|||||||||
|
Варианты |
||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
метан |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
50 |
|
этан |
50 |
45 |
40 |
35 |
30 |
25 |
20 |
15 |
10 |
5 |
|
пропан |
5 |
10 |
20 |
10 |
5 |
10 |
15 |
20 |
25 |
30 |
|
бутан |
10 |
10 |
20 |
15 |
30 |
25 |
20 |
15 |
10 |
5 |
|
пентан |
30 |
25 |
5 |
20 |
10 |
20 |
10 |
10 |
10 |
10 |
Задача 17. Пересчитать объемный
состав газа в массовый и определить его
молекулярную массу, плотность и
относительную плотность по воздуху.
|
Компоненты смеси |
объемный состав |
|||||||||
|
Варианты |
||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
метан |
10 |
5 |
20 |
5 |
20 |
10 |
10 |
35 |
40 |
10 |
|
этан |
45 |
50 |
15 |
20 |
25 |
30 |
10 |
20 |
15 |
5 |
|
пропан |
10 |
5 |
10 |
20 |
10 |
5 |
25 |
15 |
20 |
30 |
|
бутан |
10 |
10 |
35 |
40 |
25 |
30 |
10 |
20 |
15 |
5 |
|
пентан |
15 |
30 |
20 |
15 |
30 |
25 |
45 |
10 |
10 |
50 |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
Задачи на определение количественного состава смеси – частые гости на экзаменах или контрольных любых уровней и классов. Многие из этих задач имеют схожую идею решения, поэтому, поняв основные принципы и методы, можно с легкостью решить задачу любой сложности на эту тематику.
Воздействие на смесь химическими реактивами
Первой идеей, или типом задач, являются те, где на смесь действуют определенными химическими реактивами. Эти вещества взаимодействуют только с одним компонентов смеси, что позволяет рассчитать его массу. Необходимым для решения являются знания характерных химических реакций, ведь без этого, попросту нереально написать соответствующие уравнения реакций. Рассмотрим это на таком примере.
Пример 1
Смесь, масса которой 41,8 г, которая содержит натрий карбонат, натрий нитрат и натрий сульфат, поместили в раствор H2SO4, масса которого равна 98 г, а массовая часть кислоты – 10%, и нагрели. Выделилось 2,24 л газа. К полученному раствору добавили избыток барий хлорида и получили 46,6 г осадка. Определите массовую часть натрий нитрата в исходной смеси.
Решение
Итак, первое, что нужно определить: какой газ выделяется при растворении в сульфатной кислоте? Это только карбонат натрия, другие компоненты не взаимодействуют с сульфатной кислотой. Тогда:
Na2CO3 + H2SO4 →rightarrow Na2SO4 + CO2 ↑uparrow + H2O
Тогда найдем количество моль газа и карбоната натрия:
nCO2=V/V0=2,24/22,4=0,1 моль
Далее в раствор добавляют хлорид бария. Как известно, ионы бария взаимодействую с сульфат-ионами и выпадает осадок сульфата бария.
Ba2+ + SO42- →rightarrow BaSO4
Стоит быть внимательным, т.к. в растворе есть два источника сульфат-ионов – сульфат натрия и сульфатная кислота. Можем найти, сколько было сульфата натрия:
nBaSO4=m/Mr=46,6/(233)=0,2 моль
nH2SO4=m/Mr=mр-ра ⋅cdot W/Mr=98 ⋅cdot 0,1/98=0,1 моль
Таким образом, nNa2SO4=nBaSO4 – nH2SO4 = 0,2 – 0,1=0,1 моль
Теперь, зная сколько было натрий сульфата и карбоната, можем найти массу натрий нитрата:
mNa2SO4=n ⋅cdot Mr=0,1 ⋅cdot 142=14,2 г
mNa2CO3=n ⋅cdot Mr=0,1 ⋅cdot 106=10,6 г
mNaNO3=m- mNa2CO3 — mNa2SO4=41,8-14,2-10,6=17 г
WNaNO3=mNaNO3/m=17/41,8 ⋅cdot 100%=40,67%
Нахождение состава смеси по плотности
Другим типом задач является нахождение состава смеси по известной плотности. Для решения таких задач требуется умение составления и решения несложных уравнений. Рассмотрим этот тип задач на таком примере
Пример 2
Смесь водорода и аммиака имеет плотность в 12,57 раза меньше плотности углекислого газа. Определите объемную часть водорода в смеси.
Решение
Сначала найдем, какую плотность имеет смесь. Как известно, плотность прямо пропорциональна молярной массе, поэтому молярная масса смеси
Mrсмеси=MrCO2/12,57=44/12,57=3,5 г/моль
Далее, пусть x – объемная доля водорода в смеси, тогда (1-х) – объемная доля аммиака. Тогда, составим такое уравнение:
MrH2 ⋅cdot x+MrNH3 ⋅cdot (1-x)=Mrсмеси
2 ⋅cdot x + 17 ⋅cdot (1-x)=3,5
15x=13,5
x=0,9
Или 90% водорода в смеси.
Взаимодействие реагента с обоими компонентами смеси
Далее рассмотрим тип задач, в которых реагент взаимодействует с обоими компонентами смеси. Для решения таких задач нужно составить уравнение. Рассмотрим такой пример.
Пример 3
На 25 г смеси алюминия и меди подействовали концентрированной азотной кислотой и нагрели. Получили 33,6 л газа. Определите массовую часть алюминия в смеси.
Решение
Первое, что нужно сделать – написать уравнения реакций:
Cu + 4HNO3 →rightarrow Cu(NO3)2 + 2NO2 + 2H2O
Al + 6HNO3 →rightarrow Al(NO3)3 + 3NO2 + 3H2O
Стоит отметить, что здесь азотная кислота реагирует с алюминием, поскольку взята горячая кислота.
Заметим, что на один моль меди приходится 2 моль газа, а на 1 моль алюминия – 3 моль газа.
Найдем количество газа:
n=V/V0=33,6/22,4=1,5 моль
Далее составим такой уравнение:
Пусть x г – масса алюминия в смеси, тогда (25-х) г – масса меди.
Тогда:
(nAl) ⋅cdot 3+(nCu) ⋅cdot 2=0,5
Или x/MrAl ⋅cdot 3+(25-x)/MrCu ⋅cdot 2=1,5
(x/27) ⋅cdot 3+(25-x) ⋅cdot 2/64=1,5
Решая, получаем х=9 г
Или W=m/mсмеси=9/25 ⋅cdot 100%=36%
В итоге, имеем, что для успешной борьбы с задачами на определение количественного состава смеси, важно иметь знания как в химии, так и обладать определенными математическими навыками.
Задачи на смеси и сплавы на ЕГЭ по химии
-
Типичные заблуждения и ошибки при решении задач на смеси.
-
Необходимые теоретические сведения.
-
Электрохимический ряд напряжений металлов.
-
Реакции металлов с кислотами.
-
Продукты восстановления азотной кислоты.
-
Продукты восстановления серной кислоты.
-
Реакции металлов с водой и со щелочами.
-
Примеры решения задач.
-
Решение примера 1.
-
Решение примера 2.
-
Решение примера 4.
-
Решение примера 5.
-
Задачи для самостоятельного решения.
-
1. Несложные задачи с двумя компонентами смеси.
-
2. Задачи более сложные.
-
3. Три металла и сложные задачи.
-
Ответы и комментарии к задачам для самостоятельного решения.

Задачи на смеси и сплавы — очень частый вид задач на ЕГЭ по химии. Они требуют чёткого представления о том, какие из веществ вступают в предлагаемую в задаче реакцию, а какие нет.
О смеси мы говорим тогда, когда у нас есть не одно, а несколько веществ (компонентов), «ссыпанных» в одну емкость. Вещества эти не должны взаимодействовать друг с другом.
к оглавлению ▴
Типичные заблуждения и ошибки при решении задач на смеси.
- Попытка записать оба вещества в одну реакцию. Вот одна из распространенных ошибок:
«Смесь оксидов кальция и бария растворили в соляной кислоте…»Многие выпускники пишут уравнение реакции так:Это ошибка. Ведь в этой смеси могут быть любые количества каждого оксида!
А в приведенном уравнении предполагается, что их равное количество. - Предположение, что их мольное соотношение соответствует коэффициентам в уравнениях реакций. Например:
Количество цинка принимается за
, а количество алюминия — за
(в соответствии с коэффициентом в уравнении реакции). Это тоже неверно. Эти количества могут быть любыми и они никак между собой не связаны.
- Попытки найти «количество вещества смеси», поделив её массу на сумму молярных масс компонентов.Это действие вообще никакого смысла не имеет. Каждая молярная масса может относиться только к отдельному веществу.
Часто в таких задачах используется реакция металлов с кислотами. Для решения таких задач надо точно знать, какие металлы с какими кислотами взаимодействуют, а какие — нет.
к оглавлению ▴
Необходимые теоретические сведения.
Способы выражения состава смесей.
- Массовая доля компонента в смеси— отношение массы компонента к массе всей смеси. Обычно массовую долю выражают в %, но не обязательно.
где
– «омега», массовая доля компонента в смеси,
– масса компонента,
– масса смеси
- Мольная доля компонента в смеси — отношение числа моль (количества вещества) компонента к суммарному числу моль всех веществ в смеси. Например, если в смесь входят вещества
,
и
, то:
где
– «хи», мольная доля компонента в смеси,
– число моль (количество вещества) компонента А
- Мольное соотношение компонентов.Иногда в задачах для смеси указывается мольное соотношение её составляющих. Например:
- Объёмная доля компонента в смеси (только для газов)— отношение объёма вещества А к общему объёму всей газовой смеси.
где
– «фи», объёмная доля компонента в смеси,
– объём вещества А,
– общий объём всей газовой смеси
к оглавлению ▴
Электрохимический ряд напряжений металлов.
Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb H Sb Bi Cu Hg Ag Pd Pt Au
Реакции металлов с кислотами.
- С минеральными кислотами, к которым относятся все растворимые кислоты (кроме азотной и концентрированной серной, взаимодействие которых с металлами происходит по-особому), реагируют только металлы, в электрохимическом ряду напряжений находящиеся до (левее) водорода.
- При этом металлы, имеющие несколько степеней окисления (железо, хром, марганец, кобальт), проявляют минимальную из возможных степень окисления — обычно это
.
- Взаимодействие металлов с азотной кислотой приводит к образованию, вместо водорода, продуктов восстановления азота, а с серной концентрированной кислотой — к выделению продуктов восстановления серы. Так как реально образуется смесь продуктов восстановления, часто в задаче есть прямое указание на конкретное вещество.
к оглавлению ▴
Продукты восстановления азотной кислоты.
| Чем активнее металл и чем меньше концентрация кислоты, тем дальше восстанавливается азот | ||||
| Неактивные металлы (правее алюминия включительно) + конц. Кислота; Неметаллы + конц. Кислота |
Активные металлы (левее Mg включительно) + конц. Кислота | Активные металлы (левее Mg включительно) + разб Кислота | Металлы от алюминия до железа включительно + разб. кислота | Неактивные металлы (правее кобальта включительно) + разб. Кислота |
| Пассивация: с холодной концентрированной азотной кислотой не реагируют:
|
||||
| Не реагируют с азотной кислотой ни при какой концентрации:
|
к оглавлению ▴
Продукты восстановления серной кислоты.
| Неактивные металлы (правее железа) + конц. кислота Неметаллы + конц. Кислота |
Щелочные металлы до магния включительно + концентрированная кислота. |
| Пассивация: с холодной концентрированной серной кислотой не реагируют:
|
|
| Не реагируют с серной кислотой ни при какой концентрации:
|
к оглавлению ▴
Реакции металлов с водой и со щелочами.
- В воде при комнатной температуре растворяются только металлы, которым соответствуют растворимые основания (щелочи). Это щелочные металлы (
), а также металлы IIA группы:
. При этом образуется щелочь и водород. При кипячении в воде также можно растворить магний.
- В щелочи могут раствориться только амфотерные металлы: алюминий, цинк и олово. При этом образуются гидроксокомплексы и выделяется водород.
Внимание! Многие ошибки в решении задач ЕГЭ по химии связаны с тем, что школьники плохо владеют математикой. Специально для вас — материал о том, как решать задачи на проценты, сплавы и смеси.
к оглавлению ▴
Примеры решения задач.
Рассмотрим три примера задач, в которых смеси металлов реагируют с соляной кислотой:
Пример 1. При действии на смесь меди и железа массой 20 г избытком соляной кислоты выделилось 5,6 л газа (н.у.). Определить массовые доли металлов в смеси.
В первом примере медь не реагирует с соляной кислотой, то есть водород выделяется при реакции кислоты с железом. Таким образом, зная объём водорода, мы сразу сможем найти количество и массу железа. И, соответственно, массовые доли веществ в смеси.
к оглавлению ▴
Решение примера 1.
- Находим количество водорода:
моль.
- По уравнению реакции:
Количество железа тоже 0,25 моль. Можно найти его массу:
г.
- Теперь можно рассчитать массовые доли металлов в смеси:
Пример 2. При действии на смесь алюминия и железа массой 11 г избытком соляной кислоты выделилось 8,96 л газа (н.у.). Определить массовые доли металлов в смеси.
Во втором примере в реакцию вступают оба металла. Здесь уже водород из кислоты выделяется в обеих реакциях. Поэтому прямым расчётом здесь нельзя воспользоваться. В таких случаях удобно решать с помощью очень простой системы уравнений, приняв за — число моль одного из металлов, а за
— количество вещества второго.
к оглавлению ▴
Решение примера 2.
- Находим количество водорода:
моль.
- Пусть количество алюминия —
моль, а железа
моль. Тогда можно выразить через
и
количество выделившегося водорода:
- Нам известно общее количество водорода:
моль. Значит,
(это первое уравнение в системе).
- Для смеси металлов нужно выразить массычерез количества веществ.
Значит, масса алюминия
масса железа
а масса всей смеси
(это второе уравнение в системе).
- Итак, мы имеем систему из двух уравнений:
Решать такие системы гораздо удобнее методом вычитания, домножив первое уравнение на 18:и вычитая первое уравнение из второго:
- Дальше находим массы металлов и их массовые доли в смеси:
соответственно,
Пример 3. 16 г смеси цинка, алюминия и меди обработали избытком раствора соляной кислоты. При этом выделилось 5,6 л газа (н.у.) и не растворилось 5 г вещества. Определить массовые доли металлов в смеси.
В третьем примере два металла реагируют, а третий металл (медь) не вступает в реакцию. Поэтому остаток 5 г — это масса меди. Количества остальных двух металлов — цинка и алюминия (учтите, что их общая масса 16 − 5 = 11 г) можно найти с помощью системы уравнений, как в примере №2.
Ответ к Примеру 3: 56,25% цинка, 12,5% алюминия, 31,25% меди.
Следующие три примера задач (№4, 5, 6) содержат реакции металлов с азотной и серной кислотами. Главное в таких задачах — правильно определить, какой металл будет растворяться в ней, а какой не будет.
Пример 4. На смесь железа, алюминия и меди подействовали избытком холодной концентрированной серной кислоты. При этом часть смеси растворилась, и выделилось 5,6 л газа (н.у.). Оставшуюся смесь обработали избытком раствора едкого натра. Выделилось 3,36 л газа и осталось 3 г не растворившегося остатка. Определить массу и состав исходной смеси металлов.
В этом примере надо помнить, что холодная концентрированная серная кислота не реагирует с железом и алюминием (пассивация), но реагирует с медью. При этом выделяется оксид серы (IV).
Со щелочью реагирует только алюминий — амфотерный металл (кроме алюминия, в щелочах растворяются ещё цинк и олово, в горячей концентрированной щелочи — ещё можно растворить бериллий).
к оглавлению ▴
Решение примера 4.
- С концентрированной серной кислотой реагирует только медь, число моль газа:
моль
(конц.)
(не забудьте, что такие реакции надо обязательно уравнивать с помощью электронного баланса)Так как мольное соотношение меди и сернистого газа
, то меди тоже
моль.
Можно найти массу меди:г.
- В реакцию с раствором щелочи вступает алюминий, при этом образуется гидроксокомплекс алюминия и водород:
- Число моль водорода:
моль,мольное соотношение алюминия и водорода
и, следовательно,
моль.
Масса алюминия:
г
- Остаток — это железо, массой 3 г. Можно найти массу смеси:
г.
- Массовые доли металлов:
Пример 5. 21,1 г смеси цинка и алюминия растворили в 565 мл раствора азотной кислоты, содержащего 20 мас. % НNО3 и имеющего плотность 1,115 г/мл. Объем выделившегося газа, являющегося простым веществом и единственным продуктом восстановления азотной кислоты, составил 2,912 л (н.у.). Определите состав полученного раствора в массовых процентах. (РХТУ)
В тексте этой задачи чётко указан продукт восстановления азота — «простое вещество». Так как азотная кислота с металлами не даёт водорода, то это — азот. Оба металла растворились в кислоте.
В задаче спрашивается не состав исходной смеси металлов, а состав получившегося после реакций раствора. Это делает задачу более сложной.
к оглавлению ▴
Решение примера 5.
- Определяем количество вещества газа:
моль.
- Определяем массу раствора азотной кислоты, массу и количество вещества растворенной
:
Обратите внимание, что так как металлы полностью растворились, значит — кислоты точно хватило (с водой эти металлы не реагируют). Соответственно, надо будет проверить, не оказалась ли кислота в избытке, и сколько ее осталось после реакции в полученном растворе.
- Составляем уравнения реакций (не забудьте про электронный баланс) и, для удобства расчетов, принимаем за
— количество цинка, а за
— количество алюминия. Тогда, в соответствии с коэффициентами в уравнениях, азота в первой реакции получится
моль, а во второй —
моль:
- Тогда, учитывая, что масса смеси металлов
г, их молярные массы —
г/моль у цинка и
г/моль у алюминия, получим следующую систему уравнений:
– количество азота
– масса смеси двух металлов
Решать эту систему удобно, домножив первое уравнение на 90 и вычитая первое уравнение их второго.
значит,
моль
значит,
моль
Проверим массу смеси:
г.
- Теперь переходим к составу раствора. Удобно будет переписать реакции ещё раз и записать над реакциями количества всех прореагировавших и образовавшихся веществ (кроме воды):
- Следующий вопрос: осталась ли в растворе азотная кислота и сколько её осталось?По уравнениям реакций, количество кислоты, вступившей в реакцию:
моль,т.е. кислота была в избытке и можно вычислить её остаток в растворе:
моль.
- Итак, в итоговом растворесодержатся:
нитрат цинка в количестве
моль:
г
нитрат алюминия в количестве
моль:
г
избыток азотной кислоты в количестве
моль:
г
- Какова масса итогового раствора?Вспомним, что масса итогового раствора складывается из тех компонентов, которые мы смешивали (растворы и вещества) минус те продукты реакции, которые ушли из раствора (осадки и газы):
Масса
нового
раствора= Сумма масс
смешиваемых
растворов и/или веществ— Масса осадков — Масса газов Тогда для нашей задачи:
= масса раствора кислоты + масса сплава металлов — масса азота
г
г
- Теперь можно рассчитать массовые доли веществ в получившемся растворе:
Пример 6. При обработке г смеси меди, железа и алюминия избытком концентрированной азотной кислоты выделилось
л газа (н.у.), а при действии на эту смесь такой же массы избытка хлороводородной кислоты —
л газа (н.у.). Определите состав исходной смеси. (РХТУ)
При решении этой задачи надо вспомнить, во-первых, что концентрированная азотная кислота с неактивным металлом (медь) даёт , а железо и алюминий с ней не реагируют. Соляная кислота, напротив, не реагирует с медью.
к оглавлению ▴
Задачи для самостоятельного решения.
1. Несложные задачи с двумя компонентами смеси.
1-1. Смесь меди и алюминия массой г обработали
-ным раствором азотной кислоты, при этом выделилось
л газа (н. у.). Определить массовую долю алюминия в смеси.
1-2. Смесь меди и цинка массой г обработали концентрированным раствором щелочи. При этом выделилось
л газа (н.y.). Вычислите массовую долю цинка в исходной смеси.
1-3. Смесь магния и оксида магния массой г обработали достаточным количеством разбавленной серной кислоты. При этом выделилось
л газа (н.у.). Найти массовую долю магния в смеси.
1-4. Смесь цинка и оксида цинка массой г растворили в разбавленной серной кислоте. Получили сульфат цинка массой
г. Вычислите массовую долю цинка в исходной смеси.
1-5. При действии смеси порошков железа и цинка массой г на избыток раствора хлорида меди (II) образовалось
г меди. Определите состав исходной смеси.
1-6. Какая масса -ного раствора соляной кислоты потребуется для полного растворения
г смеси цинка с оксидом цинка, если при этом выделился водород объемом
л (н.у.)?
1-7. При растворении в разбавленной азотной кислоте г смеси железа и меди выделяется оксид азота (II) объемом
л (н.у.). Определите состав исходной смеси.
1-8. При растворении г смеси железных и алюминиевых опилок в
-ном растворе соляной кислоты (
г/мл) выделилось
л водорода (н.у.). Найдите массовые доли металлов в смеси и определите объем израсходованной соляной кислоты.
к оглавлению ▴
2. Задачи более сложные.
2-1. Смесь кальция и алюминия массой г прокалили без доступа воздуха с избытком порошка графита. Продукт реакции обработали разбавленной соляной кислотой, при этом выделилось
л газа (н.у.). Определите массовые доли металлов в смеси.
2-2. Для растворения г сплава магния с алюминием использовано
мл
-ного раствора серной кислоты (
г/мл). Избыток кислоты вступил в реакцию с
мл раствора гидрокарбоната калия с концентрацией
моль/л. Определите массовые доли металлов в сплаве и объем газа (н.у.), выделившегося при растворения сплава.
2-3. При растворении г смеси железа и оксида железа (II) в серной кислоте и выпаривании раствора досуха образовалось
г железного купороса — гептагидрата сульфата железа (II). Определите количественный состав исходной смеси.
2-4. При взаимодействии железа массой г с хлором образовалась смесь хлоридов железа (II) и (III) массой
г. Вычислите массу хлорида железа (III) в полученной смеси.
2-5. Чему была равна массовая доля калия в его смеси с литием, если в результате обработки этой смеси избытком хлора образовалась смесь, в которой массовая доля хлорида калия составила ?
2-6. После обработки избытком брома смеси калия и магния общей массой г масса полученной смеси твердых веществ оказалась равной
г. Эту смесь обработали избытком раствора гидроксида натрия, после чего осадок отделили и прокалили до постоянной массы. Вычислите массу полученного при этом остатка.
2-7. Смесь лития и натрия общей массой г окислили избытком кислорода, всего было израсходовано
л (н.у.). Полученную смесь растворили в
г
-го раствора серной кислоты. Вычислите массовые доли веществ в образовавшемся растворе.
2-8. Сплав алюминия с серебром обработали избытком концентрированного раствора азотной кислоты, остаток растворили в уксусной кислоте. Объемы газов, выделившихся в обеих реакциях измеренные при одинаковых условиях, оказались равными между собой. Вычислите массовые доли металлов в сплаве.
к оглавлению ▴
3. Три металла и сложные задачи.
3-1. При обработке г смеси меди, железа и алюминия избытком концентрированной азотной кислоты выделилось
л газа. Такой же объем газа выделяется и при обработке этой же смеси такой же массы избытком разбавленной серной кислоты (н.у.). Определите состав исходной смеси в массовых процентах.
3-2. г смеси железа, меди и алюминия, взаимодействуя с избытком разбавленной серной кислоты, выделяет
л водорода (н.у.). Определите состав смеси в массовых процентах, если для хлорирования такой же навески смеси требуется
л хлора (н.у.).
3-3. Железные, цинковые и алюминиевые опилки смешаны в мольном отношении (в порядке перечисления).
г такой смеси обработали избытком хлора. Полученную смесь хлоридов растворили в
мл воды. Определить концентрации веществ в полученном растворе.
3-4. Сплав меди, железа и цинка массой г (массы всех компонентов равны) поместили в
раствор соляной кислоты массой
г. Рассчитайте массовые доли веществ в получившемся растворе.
3-5. г смеси, состоящей из кремния, алюминия и железа, обработали при нагревании избытком гидроксида натрия, при этом выделилось
л газа (н.у.). При действии на такую массу смеси избытка соляной кислоты выделяется
л газа (н.у.). Определите массы веществ в исходной смеси.
3-6. При обработке смеси цинка, меди и железа избытком концентрированного раствора щелочи выделился газ, а масса нерастворившегося остатка оказалась в раза меньше массы исходной смеси. Этот остаток обработали избытком соляной кислоты, объем выделившегося газа при этом оказался равным объему газа, выделившегося в первом случае (объемы измерялись при одинаковых условиях). Вычислите массовые доли металлов в исходной смеси.
3-7. Имеется смесь кальция, оксида кальция и карбида кальция с молярным соотношением компонентов (в порядке перечисления). Какой минимальный объем воды может вступить в химическое взаимодействие с такой смесью массой
г?
3-8. Смесь хрома, цинка и серебра общей массой г обработали разбавленной соляной кислотой, масса нерастворившегося остатка оказалась равной
г. Раствор после отделения осадка обработали бромом в щелочной среде, а по окончании реакции обработали избытком нитрата бария. Масса образовавшегося осадка оказалась равной
г. Вычислите массовые доли металлов в исходной смеси.
к оглавлению ▴
Ответы и комментарии к задачам для самостоятельного решения.
1-1. (алюминий не реагирует с концентрированной азотной кислотой);
1-2. (в щелочи растворяется только амфотерный металл — цинк);
1-3. ;
1-4. ;
1-5. (железо, вытесняя медь, переходит в степень окисления
);
1-6. г;
1-7. (железо в азотной кислоте переходит в
);
1-8. (железо в реакции с соляной кислотой переходит в
);
мл раствора
.
2-1. (кальций и алюминий с графитом (углеродом) образуют карбиды
и
; при их гидролизе водой или
выделяются, соответственно, ацетилен
и метан
);
2-2. ;
2-3. (гептагидрат сульфата железа —
);
2-4. г;
2-5. ;
2-6. г;
2-7. (при окислении кислородом лития образуется его оксид, а при окислении натрия — пероксид
, который в воде гидролизуется до пероксида водорода и щелочи);
2-8. ;
3-1. ;
3-2. ;
3-3. (железо в реакции с хлором переходит в степень окисления
);
3-4. (не забудьте, что медь не реагирует с соляной кислотой, поэтому её масса не входит в массу нового раствора);
3-5. г
г
г
(кремний — неметалл, он реагирует с раствором щелочи, образуя силикат натрия и водород; с соляной кислотой он не реагирует);
3-6. ;
3-7. мл;
3-8. (хром при растворении в соляной кислоте переходит в хлорид хрома (II), который при действии брома в щелочной среде переходит в хромат; при добавлении соли бария образуется нерастворимый хромат бария)
Благодарим за то, что пользуйтесь нашими статьями.
Информация на странице «Задачи на смеси и сплавы на ЕГЭ по химии» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать необходимые и поступить в ВУЗ или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из разделов нашего сайта.
Публикация обновлена:
08.05.2023
При решении химических задач, при расчётах на работе, да и просто в жизни иногда приходится рассчитывать концентрации. Неважно, будет это школьная теоретическая задача, необходимость приготовить электролит для аккумулятора автомобиля, надобность узнать количество сахара для компота — все расчёты концентраций выполняются по известным формулам, которых не так много. Однако, с этим часто возникают трудности.
Прочитав эту статью, Вы научитесь легко рассчитывать концентрации веществ и при надобности играючи переводить одну концентрацию в другую. В статье приводятся примеры задач с решениями, а в конце приведём справочную табличку с формулами, которую можно распечатать и держать под рукой.
Массовая доля
Начнём с простого, но в то же время нужного способа выражения концентрации компонента в смеси — массовой доли.
Массовая доля есть отношение массы данного компонента к сумме масс всех компонентов. Обозначать её принято буквой w или ω (омега).
Рассчитывается массовая доля по формуле:
Large w_{i}=frac{m_{i}}{m}, ;;;;;(1)
где Large w_{i} — массовая доля компонента i в смеси,
Large m_{i} — масса этого компонента,
m — масса всей смеси.
И сразу разберём на примере:
Задача:
Зимой дороги посыпают песком с солью. Известно, что куча имеет массу 50 кг, и в неё всыпали 1 кг соли и перемешали. Найти массовую долю соли.
Решение:
Масса соли есть Large m_{i} по формуле выше. Масса всей смеси нам пока неизвестна, но найти её легко. Просуммируем массу песка и соли:
Large m = m_{п}+m_{с}= 50 кг + 1 кг = 51 кг
А теперь находим и массовую долю:
Large w_{с} = frac{m_{с}}{m} = 1 кг / 51 кг = 0.0196,
или умножаем на 100% и получаем 1.96%.
Ответ: 0.0196, или 1.96%.
Теперь решим что-то посложнее, и ближе к ЕГЭ.
Задача:
Смешали 200 г раствора глюкозы с массовой концентрацией 25% и 300 г раствора глюкозы с массовой концентрацией 10%. Найти массовую концентрацию полученного раствора, ответ округлить до целых.
Решение:
Обозначим первый и второй растворы соответственно Large m_{1} и Large m_{2}. Массу полученного после смешения раствора обозначим Large m и найдём:
Large m = m_{1} + m_{2} = 200 г + 300 г = 500 г
Массу самой глюкозы в первом и втором растворе обозначим Large m_{гл. 1} и Large m_{гл. 2}. По формуле (1) это будут наши массы компонентов. Массы растворов нам известны, их массовые концентрации тоже. Как найти массу компонента? Очень просто, находим неизвестное делимое умножением (и не забываем, что проценты — это сотые части):
Large m_{гл. 1} = w_{1}cdot m_{1} = 0.25 cdot 200 г = 50 г
Large m_{гл. 2} = w_{2}cdot m_{2} = 0.1 cdot 300 г = 30 г
Таким образом, общая масса глюкозы Large m_{гл}:
Large m_{гл} = m_{гл. 1} + m_{гл. 2} = 50 г + 30 г = 80 г.
Ответ: 80 г.
Задачи на смешение раствором с разными концентрациями одного вещества можно решать с помощью «конверта Пирсона».
Объёмная доля
Часто, когда мы имеем дело с жидкостями и газами, удобно оперировать их объёмами, а не массой. Поэтому, чтобы выражать долю какого-либо компонента в таких смесях (но и в твёрдых тоже вполне можно), пользуются понятием объёмной доли.
Объёмная доля компонента — отношение объёма компонента к сумме объёмов компонентов до смешивания. Объёмная доля измеряется в долях единицы или в процентах. Обычно обозначается греческой буквой φ (фи).
Рассчитывается объёмная доля по формуле:
Large phi_{B}=frac{V_{B}}{sum{V_{i}}}, ; ;;;; (2)
где Large phi_{B} — объёмная доля компонента B;
Large V_{B} — объём компонента B;
Large sum{V_{i}} — сумма объёмов всех компонентов.
Здесь важно понимать, что в формулу по возможности подставляем именно сумму объёмов всех компонентов, а не объём смеси, так как при смешивании некоторых жидкостей суммарный объём уменьшается. Так, если смешать литр воды и литр спирта, два литра аквавита мы не получим — будет примерно 1800 мл. В школьных задачах, как правило, это не так важно, но в уме держим и помним.
Задача:
Смешали 6 объёмов воды и 1 объём серной кислоты. Найти объёмную долю кислоты в полученном растворе.
Решение:
Так как объёмная доля — безразмерная величина, объёмы компонентов в условии задачи могут даваться в любых единицах — литрах, стаканах, баррелях, штофах, сексталях — главное, чтобы в одинаковых. Если не так — переводим одни в другие, если одинаковые — решаем. В нашем условии описаны просто некоторые «объёмы», их и подставляем.
Large phi_{H_{2}SO_{4}} = frac{V_{ H_{2}SO_{4} }} { V_{ H_{2}SO_{4}} + V_{H_{2}O}} = frac{1 : объём}{1 : объём + 6 : объёмов} = frac{1 : объём}{7 : объёмов} = 0.143, : или : 14.3%
Ответ: 14.3 %.
С газами всё обстоит немного интереснее — при не очень больших давлениях и температурах объёмная доля какого-либо газа в газовой смеси равна его мольной доле. (Ведь мы знаем, что молярный объём газов почти равен 22.4 л/моль).
Задача:
Мольная доля кислорода в сухом воздухе составляет 0.21. Найдите объёмную долю азота, если объёмная доля аргона составляет 1%.
Решение:
Внимательный читатель заметил, что мы написали о том, что объёмная и мольная доля для газов в смеси равны. Поэтому, объёмная доля кислорода равна также 0.21, или 21%. Найдём объёмную долю азота:
Large 100% — 21% — 1% = 78%.
Ответ: 78%.
Мольная доля
В тех случаях, когда нам известны количества веществ в смеси, мы можем выразить содержание того или иного компонента с помощью мольной доли.
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы. ИЮПАК рекомендует обозначать мольную долю буквой x (а для газов — y).
Находят мольную долю по формуле:
Large x_{B} = frac{n_{B}}{sum{n_{i}}}, ;;;;;(3)
где Large x_{B} — мольная доля компонента B;
Large n_{B} — количество компонента B, моль;
Large sum{n_{i}} — сумма количеств всех компонентов.
Разберём на примере.
Задача:
При неизвестных условиях смешали 3 кг азота, 1 кг кислорода и 0.5 кг гелия. Найти мольную долю каждого компонента полученной газовой смеси.
Решение:
Сначала находим количество каждого из газов (моль):
Large n_{N_{2}} = frac{ m_{N_{2}}}{M_{N_{2}}} = frac {3000 : г}{28 : ^г/_{моль}} = 107.14 : моль
Large n_{O_{2}} = frac{ m_{O_{2}}}{M_{O_{2}}} = frac {1000 : г}{32 : ^г/_{моль}} = 31.25 : моль
Large n_{He} = frac{ m_{He}}{M_{He}} = frac {500 : г}{4 : ^г/_{моль}} = 125 : моль
Затем считаем сумму количеств:
Large sum {n} = 107.14 : моль + 31.25 : моль + 125 : моль = 263.39 : моль
И находим мольную долю каждого компонента:
Large y_{N_{2}} = frac {107.14 : моль}{263.39 : моль} = 0.4068, : или : 40.68 %;
Large y_{O_{2}} = frac {31.25 : моль}{263.39 : моль} = 0.1186, : или : 11.86 %;
Large y_{He} = frac {125 : моль}{263.39 : моль} = 0.4746, : или : 47.46 %;
Проверяем:
Large 40.68 % + 11.86 % + 47.46 % = 100%.
И радуемся правильному решению.
Ответ: 40.68%, 11.86% , 47.46%.
Молярность (молярная объёмная концентрация)
А сейчас рассмотрим, вероятно, самый часто встречающийся способ выражения концентрации — молярную концентрацию.
Молярная концентрация (молярность, мольность) — количество вещества (число молей) компонента в единице объёма смеси. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л.
Также иногда говорят просто «молярность», и обозначают буквой М. Это значит, что, например, обозначение «0.5 М раствор соляной кислоты» следует понимать как «полумолярный раствор соляной кислоты», или 0.5 моль/л.
Обозначают молярную концентрацию буквой c (латинская «цэ»), или заключают в квадратные скобки вещество, концентрация которого указывается. Например, [Na+] — концентрация катионов натрия в моль/л. Кстати, слово «моль» в обозначениях не склоняют — 5 моль/л, 3 моль/л.
Рассчитывается молярная концентрация по формуле:
Large c_{B} = frac{n_{B}}{V} ; ; ;;; (4)
где Large n_{B} — количество вещества компонента B, моль;
Large V — общий объём смеси, л.
Разберём на примере.
Задача:
В пивную кружку зачем-то насыпали 24 г сахара и до краёв заполнили кипятком. А нам зачем-то нужно найти молярную концентрацию сахарозы в полученном сиропе. И кстати, дело происходило в Британии.
Решение:
Молекулярная масса сахарозы равна 342 (посчитайте, может мы ошиблись — C12H22O11). Найдём количество вещества:
Large n_{сахарозы} = frac{24 : г}{342 : г/моль} = 0.0702 моль
Британская пинта (мера объёма такая) равна 0.568 л. Поэтому молярная концентрация находится так:
Large c_{сахарозы} = frac{0.0702 : моль}{0.568 : л} = 0.1236 моль/л
Ответ: 0.1236 моль/л.
Нормальная концентрация (молярная концентрация эквивалента, «нормальность»)
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре смеси. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов).
Обозначается нормальная концентрация как сн, сN, или даже c(feq B). Рассчитывается нормальная концентрация по формуле:
Large c_{N} = z cdot c_{B} = z cdot frac{n_{B}}{V}= frac{1}{f_{eq}} cdot frac {n_{B}}{V} ; ;;;; (5)
где Large n_{B} — количество вещества компонента В, моль;
V — общий объём смеси, л;
z — число эквивалентности (фактор эквивалентности Large f_{eq} = 1/z ).
Значение нормальной концентрации для растворов записывают как «н» или «N», а говорят «нормальность» или «нормальный». Например, раствор с концентрацией 0.25 н — четвертьнормальный раствор.
Разберём на примере.
Задача:
Рассчитать нормальность раствора объёмом 1 л, если в нём содержится 40 г перманганата калия. Раствор приготовили для последующего проведения реакции в нейтральной среде.
Решение:
В нейтральной среде перманганат калия восстанавливается до оксида марганца (IV). При этом в окислительно-восстановительной реакции 1 атом марганца принимает 3 электрона (проверьте на любой окислительно-восстановительной реакции перманганата калия с образованием оксида, расставив степени окисления), что означает, что число эквивалентности будет равно 3. Для расчёта концентрации по формуле (5) выше нам ещё не хватает количества вещества KMnO4. найдём его:
Large n_{KMnO_{4}}=frac{m _{KMnO_{4}}}{M _{KMnO_{4}} } = frac{40 : г}{158 г/моль}= 0.253 моль
Теперь считаем нормальную концентрацию:
Large c_{N_{KMnO_{4}}}= z cdot frac{n_{KMnO_{4}}}{V} = 3 cdot frac{0.253 : моль}{1 : л} = 0.759 моль-экв/л
Ответ: 0.759 моль-экв/л.
Таким образом, заметим важное на практике свойство — нормальная концентрация больше молярной в z раз.
Мы не будем рассматривать в данной статье особо экзотические способы выражения концентраций, о них вы можете почитать в литературе или интернете. Поэтому расскажем ещё об одном способе, и на нём остановимся — массовая концентрация.
Моляльная концентрация
Моляльная концентрация (моляльность, молярная весовая концентрация) — количество растворённого вещества (число моль) в 1000 г растворителя.
Измеряется моляльная концентрация в молях на кг. Как и с молярной концентрацией, иногда говорят «моляльность», то есть раствор с концентрацией 0.25 моль/кг можно назвать четвертьмоляльным.
Находится моляльная концентрация по формуле:
Large m_{B} = frac{n_{B}}{m_{A}}, ;;;;; (6)
где Large n_{B} — количество вещества компонента B, моль;
Large m_{A} — масса растворителя, кг.
Казалось бы, зачем нужна такая единица измерения для выражения концентрации? Так вот, у моляльной концентрации есть одно важное свойство — она не зависит от температуры, в отличие, например, от молярной. Подумайте, почему?
Массовая концентрация
Массовая концентрация — отношение массы растворённого вещества к объёму раствора. По рекомендации ИЮПАК, обозначается символом γ или ρ.
Находится массовая концентрация по формуле:
Large rho_{B}=frac{m_{B}}{V}, ;;;;; (7)
где Large m_{B} — масса растворенного вещества, г;
Large V — общий объём смеси, л.
В системе СИ выражается в кг/м3.
Разберём на примере.
Задача:
Рассчитать массовую концентрацию перманганата калия по условиям предыдущей задачи.
Решение:
Решение будет совсем простым. Считаем:
Large rho_{ KMnO_{4} }=frac{m_{ KMnO_{4} }}{V} =frac{40 : г}{1 : л} = 40 г/л.
Ответ: 40 г/л.
Также в аналитической химии пользуются понятием титра по растворенному веществу. Титр по растворенному веществу находится так же, как и массовая концентрация, но выражается в г/мл. Легко догадаться, что в задаче выше титр будет равен 0.04 г/мл (для этого надо умножить наш ответ на 0.001 мл/л, проверьте). Кстати, обозначается титр буквой Т.
А теперь, как обещали, табличка с формулами перевода одной концентрации в другую.
Таблица перевода одной концентрации в другую.
В таблице слева — ВО ЧТО переводим, сверху — ЧТО. Если стоит знак «=», то, естественно, эти величины равны.
| Массовая доля, large omega, % | Мольная доля, large x , % | Объёмная доля, large phi, % | Молярная концентрация, large c, моль/л | Нормальная концентрация, large c_{N} , моль-экв/л | Моляльная концентрация, large m, моль/кг | Массовая концентрация, large rho, г/л | |
| Массовая доля, large omega, % | = | large omega_{B}=LARGE frac{x_{B} cdot M(B)}{sum x_{i} cdot M_{i}} | Для газов: omega = LARGE frac{phi_{A} cdot M(A)}{sum (M_{i} cdot phi_{i})} |
large omega_{B}= LARGE frac{c_{B} cdot M(B)}{rho} | large omega_{B}=LARGE frac{c_{N} cdot M(B)}{rho cdot z} | large omega_{B}= LARGE frac{gamma_{B}}{rho} | |
| Мольная доля, large x , % | large x_{B}=LARGE frac{frac{omega_{B}}{M(B)}}{sum frac{omega_{i}}{M_{i}}} | = | large x_{B}=LARGE frac{m_{B}}{m_{B}+frac{1}{M(A)}} | ||||
| Объёмная доля, large phi, % | Для газов: large phi_{A}=LARGE frac{frac{omega_{A}}{M(A)}}{sum frac{omega_{i}}{M_{i}}} |
= | |||||
| Молярная концентрация, large c, моль/л | large c_{B}=LARGE frac{rho cdot omega_{B}}{M(B)} | = | large c_{B}=Large frac{c_{N}}{z} | ||||
| Нормальная концентрация, large c_{N} , моль-экв/л | large c_{N}=LARGE frac{rho cdot omega_{B} cdot z}{M(B)} | large c_{N}=c_{B} cdot z | = | ||||
| Моляльная концентрация, large m, моль/кг | large m_{B}=Large frac{x_{B}}{M(A)(1-x_{B})} | = | |||||
| Массовая концентрация, large gamma, г/л | large gamma_{B}=rho cdot omega_{B} | = |
Таблица будет пополняться.