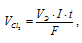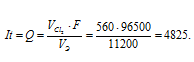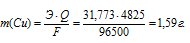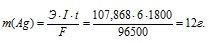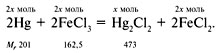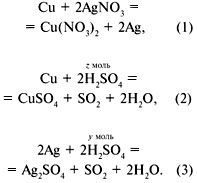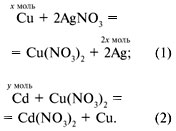Как рассчитать массу металла, выделившегося на электроде при электролизе его соли
Задача 696.
Никель в ряду напряжений стоит до водорода. Объяснить, почему возможно электролитическое выделение никеля из водных растворов его солей.
Решение:
Никель имеет стандартный электродный потенциал равный -0,250 В, что больше, чем электродный потенциал водородного электрода в нейтральной среде (-0,41 В), но меньше, чем для водородного электрода в кислой среде, то в зависимости от рН раствора, плотно-сти тока, концентрации ионов металла, возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода. На-пример, если рН раствора соли будет близка нейтральной, то разряжаться будет никель, так как его потенциал значительно положительнее потенциала водородного электрода (-0,41 В), а если раствор соли имеет кислую среду, то разряжаться будет водород, так как его потенциал (0,00 В) значительно положительнее потенциала металла (-0,250 В).
Задача 697.
Неочищенная медь содержит примеси серебра и цинка. Что произойдет с этими примесями при электролитическом рафиниронии меди?
Решение:
При электролитическом рафинировании меди применяют сульфат меди – наиболее дешёвая и распространённая соль меди. Неочищенные примеси в металлической меди, состоящие из цинка и серебра можно разделить на две группы: Zn – металл, имеющий значительно более отрицательный электродный потенциал (-0,763 В), чем медь (+0,337 В). Поэтому он анодно растворяется вместе с медью, но не осаждается на катоде, а накапливается в электролите у катодного пространства. В связи с этим электролит нужно периодически очищать от цинка.
Ag – благородный металл, не претерпевает анодного растворения, и в ходе процесса электролиза оседает у анода, образуя вместе с другими примесями анодный шлам, который можно извлечь.
Задача 698.
При электролизе раствора CuCl2 на аноде выделилось 560 мл газа (условия нормальные). Найти массу меди, выделившейся на катоде.
Решение:
Для расчета количества электричества используем формулу:
Получим
Теперь рассчитаем массу меди, выделившейся на катоде по формуле:
Здесь Э – эквивалентная масса меди равная 31,773г/моль; F – постоянная Фарадея (96500 Кл/моль), т.е. количество электричества, необходимое для осуществления превращения одного эквивалента вещества; t – время, с; I – сила тока; VЭ – эквивалентный объём газа, для хлора он равен 11200 мл/моль; V – объём выделившегося газа, m – масса выделившегося вещества.
Ответ: 1,59г.
Задача 699.
Вычислить массу серебра, выделившегося на катоде при пропускании тока силой 6 А через раствор нитрата серебра в течение 30 мин.
Решение:
Схема электрохимического процесса: Ag+ — 1
Здесь Э – эквивалентная масса серебра; F – постоянная Фарадея (96500 Кл/моль), т. е. количество электричества, необходимое для осуществления превращения одного эквивалента вещества; t – время, с; I – сила тока; m – масса выделившегося вещества.
Ответ: 12 г
В ПОМОЩЬ МОЛОДОМУ
УЧИТЕЛЮ
Из опыта работы
» В РАСТВОР ПОГРУЖЕНА ПЛАСТИНКА…»
Пучки расчетных задач
Продолжение. См. № 44, 46, 48/2003;
9, 14, 21, 39, 44/2004
В настоящем пучке задач представлен
весьма широкий спектр методических приемов. В
задачах рассмотрено:
а) изменение массы пластинки (И-1, И-5, И-6, И-7);
б) нарушение равновесия весов в связи с
массопереносом в системе металл–раствор
(И-2);
в) химический анализ состава раствора над
металлом (И-3);
г) установление природы металла пластинки (И-4)
или металла соли в растворе (И-12);
д) расчет массы металла, выделившегося на
пластинке (И-8, И-11, И-13);
е) нахождение массовой доли соли в растворе (И-9).
Пучок ЗАДАЧ И
И-1. В раствор, содержащий 14,1 г нитрата
меди(II) и 14,6 г нитрата ртути(II), погрузили
кадмиевую пластинку массой 50 г. На сколько
процентов увеличилась масса пластинки после
полного выделения меди и ртути из раствора [1]?
И-2. На пластмассовых чашках весов
уравновешены куски двух металлов, на левой чашке
– цинка, на правой – кадмия. Одновременно левую
чашку весов помещают в раствор сульфата олова(II),
а правую – в раствор сульфата меди(II). Нарушится
ли равновесие весов [2]?

CuSO4•xH2O голубого цвета массой 100 г
растворили в воде и в полученный раствор бросили
железный гвоздь (следов ржавчины на нем не
наблюдалось). Через некоторое время гвоздь
вынули, промыли и высушили. Масса гвоздя
увеличилась на 0,375 г. К полученному после этой
реакции раствору добавили кальцинированную соду
до полного выпадения осадка. Осадок
отфильтровали, промыли водой, высушили и
прокалили, постепенно повышая температуру от
200 °С до 1400 °С. Масса образца после
прокаливания составила 30 г. Выведите
молекулярную формулу исходного вещества и
напишите уравнения всех происходящих в условии
задачи реакций [3].
И-4. Металлическая пластинка массой 50 г
после пребывания в растворе соляной кислоты
уменьшилась в массе на 1,68%, при этом выделилось
0,336 л газа (н.у.). Из какого металла была
изготовлена пластинка [4]?
И-5. Металлическую ртуть массой 24,06 г
погрузили в 79,8 г раствора трихлорида железа с
массовой долей соли 0,3. Через некоторый
промежуток времени ртуть отфильтровали от
раствора, при этом оказалось, что массовая доля
трихлорида железа стала равной массовой доле
образовавшейся соли ртути – каломели Hg2Cl2.
Определите массу ртути после того, как ее
извлекли из раствора*.
И-6. В два раствора нитратов меди(II) и
свинца(II) одинаковой нормальной концентрации
погрузили одинаковые по массе цинковые
пластинки. Через достаточно длительное время
оказалось, что масса первой пластинки
уменьшилась на 0,05 г. На сколько изменилась масса
второй пластинки
[5, 6]?
И-7. При выдерживании в водном растворе
нитрата серебра первоначальная масса медного
стержня 38,4 г увеличилась на 15,8 г. Стержень
промыли водой, высушили и растворили в 93%-й серной
кислоте ( = 1,81 г/мл).
Определите объем кислоты, необходимый для
полного растворения стержня [7].
И-8. К раствору нитрата ртути(I) массой
264 г с массовой долей соли 20% добавили цинковые
опилки. Через некоторое время массовая доля
нитрата ртути(I) в растворе составила 6%.
Рассчитайте массу выделившейся ртути [8].
И-9. Смесь нитратов серебра и меди
растворили в воде и в полученный раствор
погрузили медную пластинку. После окончания
реакции масса пластинки увеличилась на а г. В
образовавшийся раствор погрузили кадмиевую
пластинку. После завершения реакции ее масса
уменьшилась на b г. Определите массовые доли
(%) нитратов меди и серебра в исходном растворе [9].
И-10. Согласно одному из старинных
рецептов, серебрение металлических предметов
можно производить следующим образом: «Готовится
серебрильная жидкость:
углесеребряная соль – 10 г,
серноватисто-натриевая соль – 100 г,
вода – 100 г.
После растворения в воде сливают насыщенный
раствор с оставшегося осадка углесеребряной
соли. К погруженным в этот раствор предметам
прикасаются цинковой палочкой (контактное
серебрение)».
1. Какие реакции могут происходить в процессе
приготовления раствора?
2. Для чего нужна цинковая палочка?
3. Что будет происходить, если в соответствии с
этим рецептом посеребрить деталь из магниевого
сплава [10]?
И-11. В раствор сульфата меди(II)
погрузили железную пластинку массой 61,3 г. После
того как пластинку вынули из раствора, промыли
дистиллированной водой, просушили и взвесили, ее
масса оказалась равной 62,9 г. Объясните
происходящие в растворе процессы. Запишите
уравнения соответствующих реакций и вычислите
массу выделившегося на пластинке металла [11].
И-12. Железную пластинку массой 10 г
погрузили в раствор дихлорида неизвестного
металла, после чего ее масса стала 10,1 г. В точно
такой же раствор погрузили затем пластинку из
кадмия массой 10 г, после окончания реакции ее
масса стала 9,6 г. Определите неизвестный металл
[12].
И-13. В 200 мл раствора, содержащего в 1 л
0,1 моль нитрата свинца и столько же нитрата
серебра, был погружен кусок железа массой 1,12 г.
Сколько каждого металла по массе было вытеснено
из раствора [13, 14]?
Решения и ответы
И-1. Привес массы пластинки в процентах
– 0,8%.
И-2.
Zn + SnSO4 = ZnSO4 + Sn, (1)
Cd + CuSO4 = CdSO4 + Cu. (2)
Для мольных количеств веществ изменение в
первом случае составит:
–65 + 119 = 54 г,
а во втором случае:
–112 + 64 = –48 г,
следовательно, равновесие весов нарушится.
И-3.
СuSО4 + Fe = FeSО4 + Сu,
СuSО4 + Na2CO3 = Na2SО4
+ CuCO3,
FeSО4 + Na2CO3 = Na2SО4
+ FeCO3,
СuCО3 = CuО + СO2,
FeCО3 = FeO + CO2,
4CuO =2Cu2O + O2,
4FeO + O2 = 2Fe2O3.
Разница масс, соответствующая молярным массам
металлов:
mтеор =
(64 – 56) = 8 г/моль.
mпракт =
0,375 г;
(Cu) =
0,375/8 = 0,047 моль.
Определим m(СuSO4), прореагировавшего с
Fe:
(Cu) =
(CuSO4) =0,047 моль;
m(CuSO4) = 0,047•160 = 7,52 г.
Найдем массы оксидов после прокаливания:
(Cu) =
(FeSO4) =
(FeO) = 0,047 моль,
(FeO) :
(Fe2O3) = 2 : 1.
Следовательно,
(Fe2O3)
= 0,047/2 = 0,0235 моль.
m(Fe2O3) = 0,0235•160 = 3,76 г,
m(Сu2O) = 30 – 3,76 = 26,24 г,
(Сu2O)
= 26,24/143 = 0,18 моль.
Найдем массу и количество вещества CuSO4,
вступившего в реакцию с Nа2СО3:
(СuO) :
(Сu2O) = 2 : 1,
поэтому (СuO)
= (СuSO4) = 0,36
моль;
m(СuSO4) = 0,36•160 = 57,6 г.
Найдем массу и количество вещества всего CuSO4
в исходном растворе:
m(СuSO4)общ = 57,6 + 7,52 = 65,12 г;
(СuSO4)
= 65,12/160 = 0,4 моль.
Определим M(СuSO4•nH2O):
(СuSO4)
= (СuSO4•nH2O),
поэтому
М(СuSO4•nH2O) = 100/0,4 = 250
г/моль.
Найдем формулу кристаллогидрата:
160 + 18n = 250,
n = 5.
Формула кристаллогидрата –
СuSO4•5H2O.
И-4. Сначала вычислим массу
растворившегося металла:
50•0,0168 = 0,84 г.
Предположим, что валентность искомого металла
равна I. Тогда уравнение его реакции с кислотой:
М + НСl = МСl + 0,5Н2. (1)
Количество вещества выделившегося водорода
определим так:
0,336/22,4 = 0,015 моль.
Количество вещества металла будет вдвое
больше, т.е. 0,03 моль. Теперь можно найти молярную
массу металла:
M(М) = m/ = 0,84/0,03 = 28 г/моль.
Металла с такой молекулярной массой нет.
Проведем аналогичные рассуждения для
двухвалентного металла:
М + 2НСl = МСl2 + Н2. (2)
Расчеты показывают, что в этом случае
количество вещества металла равно 0,015 моль.
Молярная масса металла:
M(М) = 0,84/0,015 = 56 г/моль.
Искомый металл – железо.
Проверим наши рассуждения и для трехвалентного
металла:
2М + 6НСl = 2МСl3 + 3Н2. (3)
В этом случае количество вещества металла
равно 0,01 моль, что близко по молярной массе
(M = 84 г/моль) металлу рубидию, но рубидий не
трехвалентный металл. Следовательно, ответ один:
металл пластинки – железо.
И-5. Запишем уравнение протекающей
реакции:
Обозначим количество вещества каломели Hg2Cl2
через х моль, а всех остальных веществ –
через 2х. Тогда масса образовавшейся каломели
m(Hg2Cl2) = 473x.
Масса FeCl3 в исходном растворе:
m(FeCl3) = •m(р-ра) = 0,3•79,8 = 23,94 г.
Масса оставшегося после реакции трихлорида
железа составляет (23,94 – 325х) г.
По условию задачи:
23,94 – 325х = 473х.
Отсюда х = 0,03 моль.
Следовательно, масса ртути после реакции
составит:
24,06 – 201•0,06 = 12 г.
И-6. Увеличилась на 7,1 г.
И-7. В данной задаче следует
рассмотреть три происходящие реакции:
Если обозначить за х количеcтво вещества
меди, вступившей в реакцию, то можно составить
следующее равенство:
–64х + 108•2х = 15,8
(см. уравнение (1)), отсюда
х = 0,104 моль.
Вычислим массу растворившейся меди и массу
выделившегося на пластинке серебра:
m(Cu) = 0,104•64 = 6,66 г,
m(Ag) = 0,208•108 = 22,46 г.
Найдем состав пластинки после завершения
реакции:
m(Cu) = 38,4 – 6,66 = 31,74 г,
(Cu) =
31,74/64 = 0,50 моль;
m(Ag) = 22,46 г,
(Ag) =
22,46/108 = 0,208 моль.
Из уравнений (2) и (3) вычислим количество
вещества и массу 100%-й серной кислоты:
(H2SO4)
= z + y = 0,50•2 + 0,208 = 1,208 моль,
m(H2SO4) = 1,208•98 = 118,4 г.
Далее найдем массу 93%-й серной кислоты,
необходимой для этой реакции:
m(93%-й H2SO4) = m(100%-й H2SO4)•100/ = 118,4•100/93 = 127,3 г.
Теперь можно вычислить объем серной кислоты:
V(H2SO4) = 127,3/1,81 = 70,3 мл.
И-8.
Hg2(NO3)2 + Zn = Zn(NO3)2
+ 2Hg.
Используя данное уравнение, вычислим массу
ртути, выделившейся на пластинке, путем
следующих рассуждений:
1) (Нg2(NO3)2)
= 20 – 6 = 14%;
2) m(Нg2(NO3)2) = 0,14•264 = 36,96 г;
3) (Нg2(NO3)2)
= 36,96/526 = 0,07 моль;
4) (Нg) = 0,14 моль;
5) m(Нg)= 28,14 г.
И-9.
Для уравнения (1) можно составить следующее
соотношение:
–64х + 216х = а,
х = a/152 моль.
Отсюда
m(АgNO3) = (2a/152)•170 = 2,24a.
Для уравнения (2) изменения массы можно записать
так:
–112у + 64у = –b,
y = b/48 моль.
Вычислим количество вещества нитрата меди(II) в
исходном растворе:
(Сu(NО3)2)
= у – х = b/48 – a/152 моль.
Найдем массу нитрата меди(II) в исходном
растворе:
m(Сu(NО3)2) = 188(b/48 – a/152)
= 3,92b – 1,24a г.
Считая, что масса исходного раствора 100 г,
получим сразу доли веществ в массовых процентах:
(АgNО3)
= 2,24а%,
(Cu(NО3)2)
= (3,92b – 1,24a)%.
И-10. Углесеребряная соль – это
нерастворимый в воде карбонат серебра Ag2СО3,
серноватисто-натриевая соль – это тиосульфат
натрия Nа2S2О3. Ионы серебра
переходят в раствор благодаря образованию
комплексов различного состава –
от Nа2S2О3•3Аg2S2O3
до 3Nа2S2О3•Аg2S2O3.
Одно из возможных уравнений реакции:
Аg2СO3 + 4Nа2S2O3
= Nа2СО3 + Na6[Ag2(S2О3)4].
Цинковая палочка нужна для создания
гальванической пары, т.к. цинк вытесняет серебро
из раствора:
Zn0 + 2Ag+ = Zn2+ + 2Ag0.
При этом цинк переходит в раствор, а палочка
покрывается плотным слоем серебра.
Если попытаться посеребрить контактным
способом деталь из магниевого сплава, то
растворяться начнет магний (как более активный
металл с меньшей электроотрицательностью), а
серебро будет осаждаться на цинковой палочке.
И-11. m(Cu) = 12,8 г.
И-12. Это медь.
И-13. m(Pb) = 2,07 г, m(Ag) = 2,16 г.
* Эта задача составлена Ильдаром
Кутумовым. Он в 2001/02 учебном году победил на
зональной олимпиаде по химии для учащихся 11-х
классов.
ЛИТЕРАТУРА
1. Кузьменко Н.Е., Еремин В.В. Химия. 2400 задач
для школьников и поступающих в вузы. М., 1999, 560 с.
2. Малякин А.М. Решение задач по химии. СПб., 1995,
415 с.
3. Сидельникова В.И. Сборник задач повышенной
трудности и упражнений по химии. Тюмень, 1994, 151 с.
4. Сорокин В.В., Загорский В.В., Свитанько И.В.
Задачи химических олимпиад. М., 1989, 254 с.
5. Адамович Т.П., Васильева Г.И., Попкович Г.А.,
Улазова А.Р. Сборник упражнений и усложненных
задач с решениями по химии. Минск, 1970, 160 с.
6. Адамович Т.П., Васильева Г.И., Попкович Г.А.,
Улазова А.Р. Сборник упражнений и усложненных
задач с решениями по химии. Минск, 1979, 253 с.
7. Тюменская медицинская академия. Вступительный
экзамен 2000 г. Вариант 2. Тюмень, 2000.
8. Николаенко В.К. Сборник задач по химии
повышенной трудности. М., 1996, 191 с.
9. Чуранов С.С. Химические олимпиады в школе.
М., 1982, 191 с.
10. Четвертая Соросовская олимпиада школьников
1997–1998. М., 1999, 511 с.
11. Польские химические олимпиады (сборник задач).
Под ред. С.С.Чуранова. М., 1980, 532 с.
12. Слета Л.А., Холин Ю.В., Черный А.В. Конкурсные
задачи по химии с решениями. Харьков, 1998, 96 с.
13. Абкин Г.Л. Задачи и упражнения по химии. М.,
1967, 88 с.
14. Абкин Г.Л. Задачи и упражнения по химии. М.,
1972, 100 с.
С.В.ТЕЛЕШОВ,
учитель химии,
И.КУТУМОВ,
(г. Нефтеюганск)
-
Типичные заблуждения и ошибки, возникающие при решении задач на смеси.
-
Необходимые теоретические сведения.
-
Способы выражения состава смесей.
-
Электрохимический ряд напряжений металлов.
-
Реакции металлов с кислотами.
-
Продукты восстановления азотной кислоты.
-
Продукты восстановления серной кислоты.
-
Реакции металлов с водой и со щелочами.
-
Примеры решения задач.
-
Решение примера 1.
-
Решение примера 2.
-
Решение примера 4.
-
Решение примера 5.
-
Задачи для самостоятельного решения.
-
1. Несложные задачи с двумя компонентами смеси.
-
2. Задачи более сложные.
-
3. Три металла и сложные задачи.
-
Ответы и комментарии к задачам для самостоятельного решения.
Задачи на смеси — очень частый вид задач в химии. Они требуют чёткого представления о том, какие из веществ вступают в предлагаемую в задаче реакцию, а какие нет.
О смеси мы говорим тогда, когда у нас есть не одно, а несколько веществ (компонентов), «ссыпанных» в одну емкость. Вещества эти не должны взаимодействовать друг с другом.
Типичные заблуждения и ошибки, возникающие при решении задач на смеси.
- Попытка записать оба вещества в одну реакцию.
Получается примерно так:
«Смесь оксидов кальция и бария растворили в соляной кислоте…»
Уравнение реакции составляется так:
СаО + ВаО + 4HCl = СаCl2 + BaCl2 + 2H2O.
Это ошибка, ведь в этой смеси могут быть любые количества каждого оксида.
А в приведенном уравнении предполагается, что их равное количество. - Предположение, что их мольное соотношение соответствует коэффициентам в уравнениях реакций.
Например:
Zn + 2HCl = ZnCl2 + H2
2Al + 6HCl = 2AlCl3 + 3H2
Количество цинка принимается за х, а количество алюминия — за 2х (в соответствии с коэффициентом в уравнении реакции). Это тоже неверно. Эти количества могут быть любыми и они никак между собой не связаны. - Попытки найти «количество вещества смеси», поделив её массу на сумму молярных масс компонентов.
Это действие вообще никакого смысла не имеет. Каждая молярная масса может относиться только к отдельному веществу.
Часто в таких задачах используется реакция металлов с кислотами. Для решения таких задач надо точно знать, какие металлы с какими кислотами взаимодействуют, а какие — нет.
к оглавлению ▴
Необходимые теоретические сведения.
Способы выражения состава смесей.
- Массовая доля компонента в смеси — отношение массы компонента к массе всей смеси. Обычно массовую долю выражают в %, но не обязательно.
ω [«омега»] = mкомпонента / mсмеси
- Мольная доля компонента в смеси — отношение числа моль (количества вещества) компонента к суммарному числу моль всех веществ в смеси. Например, если в смесь входят вещества А, В и С, то:
χ [«хи»] компонента А = nкомпонента А /
(
n(A) + n(B) + n(С)
)
- Мольное соотношение компонентов. Иногда в задачах для смеси указывается мольное соотношение её составляющих. Например:
nкомпонента А : nкомпонента В = 2 : 3
- Объёмная доля компонента в смеси (только для газов) — отношение объёма вещества А к общему объёму всей газовой смеси.
φ [«фи»] = Vкомпонента / Vсмеси
к оглавлению ▴
Электрохимический ряд напряжений металлов.
Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb H Sb Bi Cu Hg Ag Pd Pt Au
Реакции металлов с кислотами.
- С минеральными кислотами, к которым относятся все растворимые кислоты (кроме азотной и концентрированной серной, взаимодействие которых с металлами происходит по-особому), реагируют только металлы, в электрохимическом ряду напряжений находящиеся до (левее) водорода.
- При этом металлы, имеющие несколько степеней окисления (железо, хром, марганец, кобальт), проявляют минимальную из возможных степень окисления — обычно это +2.
- Взаимодействие металлов с азотной кислотой приводит к образованию, вместо водорода, продуктов восстановления азота, а с серной концентрированной кислотой — к выделению продуктов восстановления серы. Так как реально образуется смесь продуктов восстановления, часто в задаче есть прямое указание на конкретное вещество.
к оглавлению ▴
Продукты восстановления азотной кислоты.
| Чем активнее металл и чем меньше концентрация кислоты, тем дальше восстанавливается азот | ||||
| NO2 | NO | N2O | N2 | NH4NO3 |
| Неактивные металлы (правее железа) + конц. кислота Неметаллы + конц. кислота |
Неактивные металлы (правее железа) + разб. кислота | Активные металлы (щелочные, щелочноземельные, цинк) + конц. кислота | Активные металлы (щелочные, щелочноземельные, цинк) + кислота среднего разбавления | Активные металлы (щелочные, щелочноземельные, цинк) + очень разб. кислота |
| Пассивация: с холодной концентрированной азотной кислотой не реагируют: Al, Cr, Fe, Be, Co. |
||||
| Не реагируют с азотной кислотой ни при какой концентрации: Au, Pt, Pd. |
к оглавлению ▴
Продукты восстановления серной кислоты.
| SO2 | S | H2S | H2 |
| Неактивные металлы (правее железа) + конц. кислота Неметаллы + конц. кислота |
Щелочноземельные металлы + конц. кислота | Щелочные металлы и цинк + концентрированная кислота. | Разбавленная серная кислота ведет себя как обычная минеральная кислота (например, соляная) |
| Пассивация: с холодной концентрированной серной кислотой не реагируют: Al, Cr, Fe, Be, Co. |
|||
| Не реагируют с серной кислотой ни при какой концентрации: Au, Pt, Pd. |
к оглавлению ▴
Реакции металлов с водой и со щелочами.
- В воде при комнатной температуре растворяются только металлы, которым соответствуют растворимые основания (щелочи). Это щелочные металлы (Li, Na, K, Rb, Cs), а также металлы IIA группы: Са, Sr, Ba. При этом образуется щелочь и водород. При кипячении в воде также можно растворить магний.
- В щелочи могут раствориться только амфотерные металлы: алюминий, цинк и олово. При этом образуются гидроксокомплексы и выделяется водород.
к оглавлению ▴
Примеры решения задач.
Рассмотрим три примера задач, в которых смеси металлов реагируют с соляной кислотой:
Пример 1. При действии на смесь меди и железа массой 20 г избытком соляной кислоты выделилось 5,6 л газа (н.у.). Определить массовые доли металлов в смеси.
В первом примере медь не реагирует с соляной кислотой, то есть водород выделяется при реакции кислоты с железом. Таким образом, зная объём водорода, мы сразу сможем найти количество и массу железа. И, соответственно, массовые доли веществ в смеси.
к оглавлению ▴
Решение примера 1.
- Находим количество водорода:
n = V / Vm = 5,6 / 22,4 = 0,25 моль. - По уравнению реакции:
0,25 0,25 Fe + 2HCl = FeCl2 + H2 1 моль 1 моль Количество железа тоже 0,25 моль. Можно найти его массу:
mFe = 0,25 • 56 = 14 г. - Теперь можно рассчитать массовые доли металлов в смеси:
ωFe = mFe/mвсей смеси = 14 / 20 = 0,7 = 70%
Ответ: 70% железа, 30% меди.
Пример 2. При действии на смесь алюминия и железа массой 11 г избытком соляной кислоты выделилось 8,96 л газа (н.у.). Определить массовые доли металлов в смеси.
Во втором примере в реакцию вступают оба металла. Здесь уже водород из кислоты выделяется в обеих реакциях. Поэтому прямым расчётом здесь нельзя воспользоваться. В таких случаях удобно решать с помощью очень простой системы уравнений, приняв за х — число моль одного из металлов, а за у — количество вещества второго.
к оглавлению ▴
Решение примера 2.
- Находим количество водорода:
n = V / Vm = 8,96 / 22,4 = 0,4 моль. - Пусть количество алюминия — х моль, а железа у моль. Тогда можно выразить через х и у количество выделившегося водорода:
x 1,5x (мольное соотношение Al:Н2 = 2:3) 2Al + 6HCl = 2AlCl3 + 3H2 y y Fe + 2HCl = FeCl2 + H2 - Нам известно общее количество водорода: 0,4 моль. Значит,
1,5х + у = 0,4 (это первое уравнение в системе). - Для смеси металлов нужно выразить массы через количества веществ.
m = M • n
Значит, масса алюминия
mAl = 27x,
масса железа
mFe = 56у,
а масса всей смеси
27х + 56у = 11 (это второе уравнение в системе). - Итак, мы имеем систему из двух уравнений:
{ 1,5x + y = 0,4 27x + 56y = 11 Решать такие системы гораздо удобнее методом вычитания, домножив первое уравнение на 18:
27х + 18у = 7,2
и вычитая первое уравнение из второго:(56 − 18)у = 11 − 7,2
у = 3,8 / 38 = 0,1 моль (Fe)
х = 0,2 моль (Al) - Дальше находим массы металлов и их массовые доли в смеси:
mFe = n • M = 0,1 • 56 = 5,6 г
mAl = 0,2 • 27 = 5,4 г
ωFe = mFe / mсмеси = 5,6 / 11 = 0,50909 (50,91%),соответственно,
ωAl = 100% − 50,91% = 49,09%
Ответ: 50,91% железа, 49,09% алюминия.
Пример 3. 16 г смеси цинка, алюминия и меди обработали избытком раствора соляной кислоты. При этом выделилось 5,6 л газа (н.у.) и не растворилось 5 г вещества. Определить массовые доли металлов в смеси.
В третьем примере два металла реагируют, а третий металл (медь) не вступает в реакцию. Поэтому остаток 5 г — это масса меди. Количества остальных двух металлов — цинка и алюминия (учтите, что их общая масса 16 − 5 = 11 г) можно найти с помощью системы уравнений, как в примере №2.
Ответ к Примеру 3: 56,25% цинка, 12,5% алюминия, 31,25% меди.
Следующие три примера задач (№4, 5, 6) содержат реакции металлов с азотной и серной кислотами. Главное в таких задачах — правильно определить, какой металл будет растворяться в ней, а какой не будет.
Пример 4. На смесь железа, алюминия и меди подействовали избытком холодной концентрированной серной кислоты. При этом часть смеси растворилась, и выделилось 5,6 л газа (н.у.). Оставшуюся смесь обработали избытком раствора едкого натра. Выделилось 3,36 л газа и осталось 3 г не растворившегося остатка. Определить массу и состав исходной смеси металлов.
В этом примере надо помнить, что холодная концентрированная серная кислота не реагирует с железом и алюминием (пассивация), но реагирует с медью. При этом выделяется оксид серы (IV).
Со щелочью реагирует только алюминий — амфотерный металл (кроме алюминия, в щелочах растворяются ещё цинк и олово, в горячей концентрированной щелочи — ещё можно растворить бериллий).
к оглавлению ▴
Решение примера 4.
- С концентрированной серной кислотой реагирует только медь, число моль газа:
nSO2 = V / Vm = 5,6 / 22,4 = 0,25 моль0,25 0,25 Cu + 2H2SO4 (конц.) = CuSO4 + SO2 + 2H2O (не забудьте, что такие реакции надо обязательно уравнивать с помощью электронного баланса)
Так как мольное соотношение меди и сернистого газа 1:1, то меди тоже 0,25 моль.
Можно найти массу меди:
mCu = n • M = 0,25 • 64 = 16 г. - В реакцию с раствором щелочи вступает алюминий, при этом образуется гидроксокомплекс алюминия и водород:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2Al0 − 3e = Al3+ | 2 2H+ + 2e = H2 3 - Число моль водорода:
nH2 = 3,36 / 22,4 = 0,15 моль,
мольное соотношение алюминия и водорода 2:3 и, следовательно,
nAl = 0,15 / 1,5 = 0,1 моль.
Масса алюминия:
mAl = n • M = 0,1 • 27= 2,7 г - Остаток — это железо, массой 3 г. Можно найти массу смеси:
mсмеси = 16 + 2,7 + 3 = 21,7 г. - Массовые доли металлов:
ωCu = mCu / mсмеси = 16 / 21,7 = 0,7373 (73,73%)
ωAl = 2,7 / 21,7 = 0,1244 (12,44%)
ωFe = 13,83%
Ответ: 73,73% меди, 12,44% алюминия, 13,83% железа.
Пример 5. 21,1 г смеси цинка и алюминия растворили в 565 мл раствора азотной кислоты, содержащего 20 мас. % НNО3 и имеющего плотность 1,115 г/мл. Объем выделившегося газа, являющегося простым веществом и единственным продуктом восстановления азотной кислоты, составил 2,912 л (н.у.). Определите состав полученного раствора в массовых процентах. (РХТУ)
В тексте этой задачи чётко указан продукт восстановления азота — «простое вещество». Так как азотная кислота с металлами не даёт водорода, то это — азот. Оба металла растворились в кислоте.
В задаче спрашивается не состав исходной смеси металлов, а состав получившегося после реакций раствора. Это делает задачу более сложной.
к оглавлению ▴
Решение примера 5.
- Определяем количество вещества газа:
nN2 = V / Vm = 2,912 / 22,4 = 0,13 моль. - Определяем массу раствора азотной кислоты, массу и количество вещества растворенной HNO3:
mраствора = ρ • V = 1,115 • 565 = 630,3 г
mHNO3 = ω • mраствора = 0,2 • 630,3 = 126,06 г
nHNO3 = m / M = 126,06 / 63 = 2 мольОбратите внимание, что так как металлы полностью растворились, значит — кислоты точно хватило (с водой эти металлы не реагируют). Соответственно, надо будет проверить, не оказалась ли кислота в избытке, и сколько ее осталось после реакции в полученном растворе.
- Составляем уравнения реакций (не забудьте про электронный баланс) и, для удобства расчетов, принимаем за 5х — количество цинка, а за 10у — количество алюминия. Тогда, в соответствии с коэффициентами в уравнениях, азота в первой реакции получится х моль, а во второй — 3у моль:
5x x 5Zn + 12HNO3 = 5Zn(NO3)2 + N2 + 6H2O Zn0 − 2e = Zn2+ | 5 2N+5 + 10e = N2 1 10y 3y 10Al + 36HNO3 = 10Al(NO3)3 + 3N2 + 18H2O Al0 − 3e = Al3+ | 10 2N+5 + 10e = N2 3 - Тогда, учитывая, что масса смеси металлов 21,1 г, их молярные массы — 65 г/моль у цинка и 27 г/моль у алюминия, получим следующую систему уравнений:
{ х + 3у = 0,13 (количество азота) 65 • 5х + 27 • 10у = 21,1 (масса смеси двух металлов) Решать эту систему удобно, домножив первое уравнение на 90 и вычитая первое уравнение их второго.
х = 0,04, значит, nZn = 0,04 • 5 = 0,2 моль
у = 0,03, значит, nAl = 0,03 • 10 = 0,3 мольПроверим массу смеси:
0,2 • 65 + 0,3 • 27 = 21,1 г.
- Теперь переходим к составу раствора. Удобно будет переписать реакции ещё раз и записать над реакциями количества всех прореагировавших и образовавшихся веществ (кроме воды):
0,2 0,48 0,2 0,03 5Zn + 12HNO3 = 5Zn(NO3)2 + N2 + 6H2O 0,3 1,08 0,3 0,09 10Al + 36HNO3 = 10Al(NO3)3 + 3N2 + 18H2O - Следующий вопрос: осталась ли в растворе азотная кислота и сколько её осталось?
По уравнениям реакций, количество кислоты, вступившей в реакцию:
nHNO3 = 0,48 + 1,08 = 1,56 моль,
т.е. кислота была в избытке и можно вычислить её остаток в растворе:
nHNO3ост. = 2 − 1,56 = 0,44 моль. - Итак, в итоговом растворе содержатся:
нитрат цинка в количестве 0,2 моль:
mZn(NO3)2 = n • M = 0,2 • 189 = 37,8 г
нитрат алюминия в количестве 0,3 моль:
mAl(NO3)3 = n • M = 0,3 • 213 = 63,9 г
избыток азотной кислоты в количестве 0,44 моль:
mHNO3ост. = n • M = 0,44 • 63 = 27,72 г - Какова масса итогового раствора?
Вспомним, что масса итогового раствора складывается из тех компонентов, которые мы смешивали (растворы и вещества) минус те продукты реакции, которые ушли из раствора (осадки и газы):Масса
нового
раствора= Сумма масс
смешиваемых
растворов и/или веществ— Масса осадков — Масса газов Тогда для нашей задачи:
mнов. раствора = масса раствора кислоты + масса сплава металлов — масса азота
mN2 = n • M = 28 • (0,03 + 0,09) = 3,36 г
mнов. раствора = 630,3 + 21,1 − 3,36 = 648,04 г - Теперь можно рассчитать массовые доли веществ в получившемся растворе:
ωZn(NO3)2 = mв-ва / mр-ра = 37,8 / 648,04 = 0,0583
ωAl(NO3)3 = mв-ва / mр-ра = 63,9 / 648,04 = 0,0986
ωHNO3ост. = mв-ва / mр-ра = 27,72 / 648,04 = 0,0428
Ответ: 5,83% нитрата цинка, 9,86% нитрата алюминия, 4,28% азотной кислоты.
Пример 6. При обработке 17,4 г смеси меди, железа и алюминия избытком концентрированной азотной кислоты выделилось 4,48 л газа (н.у.), а при действии на эту смесь такой же массы избытка хлороводородной кислоты — 8,96 л газа (н.у.). Определите состав исходной смеси. (РХТУ)
При решении этой задачи надо вспомнить, во-первых, что концентрированная азотная кислота с неактивным металлом (медь) даёт NO2, а железо и алюминий с ней не реагируют. Соляная кислота, напротив, не реагирует с медью.
Ответ к примеру 6: 36,8% меди, 32,2% железа, 31% алюминия.
к оглавлению ▴
Задачи для самостоятельного решения.
1. Несложные задачи с двумя компонентами смеси.
1-1. Смесь меди и алюминия массой 20 г обработали 96 %-ным раствором азотной кислоты, при этом выделилось 8,96 л газа (н. у.). Определить массовую долю алюминия в смеси.
1-2. Смесь меди и цинка массой 10 г обработали концентрированным раствором щелочи. При этом выделилось 2,24 л газа (н.y.). Вычислите массовую долю цинка в исходной смеси.
1-3. Смесь магния и оксида магния массой 6,4 г обработали достаточным количеством разбавленной серной кислоты. При этом выделилось 2,24 л газа (н.у.). Найти массовую долю магния в смеси.
1-4. Смесь цинка и оксида цинка массой 3,08 г растворили в разбавленной серной кислоте. Получили сульфат цинка массой 6,44 г. Вычислите массовую долю цинка в исходной смеси.
1-5. При действии смеси порошков железа и цинка массой 9,3 г на избыток раствора хлорида меди (II) образовалось 9,6 г меди. Определите состав исходной смеси.
1-6. Какая масса 20%-ного раствора соляной кислоты потребуется для полного растворения 20 г смеси цинка с оксидом цинка, если при этом выделился водород объемом 4,48 л (н.у.)?
1-7. При растворении в разбавленной азотной кислоте 3,04 г смеси железа и меди выделяется оксид азота (II) объемом 0,896 л (н.у.). Определите состав исходной смеси.
1-8. При растворении 1,11 г смеси железных и алюминиевых опилок в 16%-ном растворе соляной кислоты (ρ = 1,09 г/мл) выделилось 0,672 л водорода (н.у.). Найдите массовые доли металлов в смеси и определите объем израсходованной соляной кислоты.
к оглавлению ▴
2. Задачи более сложные.
2-1. Смесь кальция и алюминия массой 18,8 г прокалили без доступа воздуха с избытком порошка графита. Продукт реакции обработали разбавленной соляной кислотой, при этом выделилось 11,2 л газа (н.у.). Определите массовые доли металлов в смеси.
2-2. Для растворения 1,26 г сплава магния с алюминием использовано 35 мл 19,6%-ного раствора серной кислоты (ρ = 1,1 г/мл). Избыток кислоты вступил в реакцию с 28,6 мл раствора гидрокарбоната калия с концентрацией 1,4 моль/л. Определите массовые доли металлов в сплаве и объем газа (н.у.), выделившегося при растворения сплава.
2-3. При растворении 27,2 г смеси железа и оксида железа (II) в серной кислоте и выпаривании раствора досуха образовалось 111,2 г железного купороса — гептагидрата сульфата железа (II). Определите количественный состав исходной смеси.
2-4. При взаимодействии железа массой 28 г с хлором образовалась смесь хлоридов железа (II) и (III) массой 77,7 г. Вычислите массу хлорида железа (III) в полученной смеси.
2-5. Чему была равна массовая доля калия в его смеси с литием, если в результате обработки этой смеси избытком хлора образовалась смесь, в которой массовая доля хлорида калия составила 80%?
2-6. После обработки избытком брома смеси калия и магния общей массой 10,2 г масса полученной смеси твердых веществ оказалась равной 42,2 г. Эту смесь обработали избытком раствора гидроксида натрия, после чего осадок отделили и прокалили до постоянной массы. Вычислите массу полученного при этом остатка.
2-7. Смесь лития и натрия общей массой 7,6 г окислили избытком кислорода, всего было израсходовано 3,92 л (н.у.). Полученную смесь растворили в 80 г 24,5%-го раствора серной кислоты. Вычислите массовые доли веществ в образовавшемся растворе.
2-8. Сплав алюминия с серебром обработали избытком концентрированного раствора азотной кислоты, остаток растворили в уксусной кислоте. Объемы газов, выделившихся в обеих реакциях измеренные при одинаковых условиях, оказались равными между собой. Вычислите массовые доли металлов в сплаве.
к оглавлению ▴
3. Три металла и сложные задачи.
3-1. При обработке 8,2 г смеси меди, железа и алюминия избытком концентрированной азотной кислоты выделилось 2,24 л газа. Такой же объем газа выделяется и при обработке этой же смеси такой же массы избытком разбавленной серной кислоты (н.у.). Определите состав исходной смеси в массовых процентах.
3-2. 14,7 г смеси железа, меди и алюминия, взаимодействуя с избытком разбавленной серной кислоты, выделяет 5,6 л водорода (н.у.). Определите состав смеси в массовых процентах, если для хлорирования такой же навески смеси требуется 8,96 л хлора (н.у.).
3-3. Железные, цинковые и алюминиевые опилки смешаны в мольном отношении 2:4:3 (в порядке перечисления). 4,53 г такой смеси обработали избытком хлора. Полученную смесь хлоридов растворили в 200 мл воды. Определить концентрации веществ в полученном растворе.
3-4. Сплав меди, железа и цинка массой 6 г (массы всех компонентов равны) поместили в 18,25 % раствор соляной кислоты массой 160 г. Рассчитайте массовые доли веществ в получившемся растворе.
3-5. 13,8 г смеси, состоящей из кремния, алюминия и железа, обработали при нагревании избытком гидроксида натрия, при этом выделилось 11,2 л газа (н.у.). При действии на такую массу смеси избытка соляной кислоты выделяется 8,96 л газа (н.у.). Определите массы веществ в исходной смеси.
3-6. При обработке смеси цинка, меди и железа избытком концентрированного раствора щелочи выделился газ, а масса нерастворившегося остатка оказалась в 2 раза меньше массы исходной смеси. Этот остаток обработали избытком соляной кислоты, объем выделившегося газа при этом оказался равным объему газа, выделившегося в первом случае (объемы измерялись при одинаковых условиях). Вычислите массовые доли металлов в исходной смеси.
3-7. Имеется смесь кальция, оксида кальция и карбида кальция с молярным соотношением компонентов 3:2:5 (в порядке перечисления). Какой минимальный объем воды может вступить в химическое взаимодействие с такой смесью массой 55,2 г?
3-8. Смесь хрома, цинка и серебра общей массой 7,1 г обработали разбавленной соляной кислотой, масса нерастворившегося остатка оказалась равной 3,2 г. Раствор после отделения осадка обработали бромом в щелочной среде, а по окончании реакции обработали избытком нитрата бария. Масса образовавшегося осадка оказалась равной 12,65 г. Вычислите массовые доли металлов в исходной смеси.
к оглавлению ▴
Ответы и комментарии к задачам для самостоятельного решения.
1-1. 36% (алюминий не реагирует с концентрированной азотной кислотой);
1-2. 65% (в щелочи растворяется только амфотерный металл — цинк);
1-3. 37,5%;
1-4. 21,1%;
1-5. 30,1% Fe (железо, вытесняя медь, переходит в степень окисления +2);
1-6. 88,8 г;
1-7. 36,84% Fe (железо в азотной кислоте переходит в +3);
1-8. 75,68% Fe (железо в реакции с соляной кислотой переходит в +2); 12,56 мл раствора HCl.
2-1. 42,55 % Са (кальций и алюминий с графитом (углеродом) образуют карбиды СаС2 и Al4C3; при их гидролизе водой или HCl выделяются, соответственно, ацетилен С2Н2 и метан СН4);
2-2. 74,3 % Mg;
2-3. 61,76% Fe (гептагидрат сульфата железа — FeSO4 • 7H2O);
2-4. 44,7 г;
2-5. 92,7%;
2-6. 4 г;
2-7. 5,9% Li2SO4, 22,9% Na2SO4, 5,47% H2O2 (при окислении кислородом лития образуется его оксид, а при окислении натрия — пероксид Na2O2, который в воде гидролизуется до пероксида водорода и щелочи);
2-8. 14,3 % Al;
3-1. 39% Cu, 3,4% Al;
3-2. 38,1% Fe, 43,5% Cu;
3-3. 1,53% FeCl3, 2,56% ZnCl2, 1,88% AlCl3 (железо в реакции с хлором переходит в степень окисления +3);
3-4. 2,77% FeCl2, 2,565% ZnCl2, 14,86% HCl (не забудьте, что медь не реагирует с соляной кислотой, поэтому её масса не входит в массу нового раствора);
3-5. 2,8 г Si, 5,4 г Al, 5,6 г Fe (кремний — неметалл, он реагирует с раствором щелочи, образуя силикат натрия и водород; с соляной кислотой он не реагирует);
3-6. 6,9% Cu, 43,1% Fe, 50% Zn;
3-7. 32,4 мл;
3-8. 45,1% Ag, 36,6% Cr, 18,3% Zn (хром при растворении в соляной кислоте переходит в хлорид хрома (II), который при действии брома в щелочной среде переходит в хромат; при добавлении соли бария образуется нерастворимый хромат бария)
Спасибо за то, что пользуйтесь нашими материалами.
Информация на странице «Задачи на смеси и сплавы металлов» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать необходимые и поступить в ВУЗ или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из разделов нашего сайта.
Публикация обновлена:
08.05.2023
Как найти массу растворенного вещества
Бывает, что возникает такая задача: как найти массу вещества, содержащегося в том или ином объеме раствора? Ход ее решения зависит от того, какими исходными данными вы располагаете. Оно может быть и очень простым, буквально в одно действие, и более сложным.

Инструкция
Например, вам надо узнать, какое количество поваренной соли содержится в 150 миллилитрах 25%-го раствора. Решение: 25%-й раствор – это значит, что в 100 миллилитрах раствора содержится 25 грамм растворенного вещества (в данном случае поваренной соли). В 150 миллилитрах, соответственно, в полтора раза больше. Произведите умножение: 25* 1,5 = 37,5. Вот и ответ: 37,5 грамм поваренной соли.
Немного видоизмените условия задачи. Предположим, вам даны те же 150 миллилитров раствора поваренной соли. Но вместо массовой концентрации известна молярная – 1 М. Сколько поваренной соли содержится в растворе в этом случае? И здесь нет ничего сложного. Прежде всего, вспомните химическую формулу поваренной соли: NaCl. Заглянув в таблицу Менделеева, уточните атомные массы (округленные) элементов, составляющих это вещество: натрия – 23, хлора – 35,5. Следовательно, молярная масса поваренной соли – 58,5 г/моль.
А что такое молярная концентрация? Это – количество молей растворенного вещества в 1 1 литре 1-молярного раствора поваренной соли содержалось бы 58,5 грамм этого вещества. Сколько же его содержится в 150 миллилитрах? Произведя умножение, получите: 58,5* 0,15 = 8,775 г. Если вам не нужна высокая точность, можно принять результат за 8,78 грамм или за 8,8 грамм.
Предположим, вам известен точный объем раствора и его плотность, но неизвестна концентрация вещества. Как в таком случае определить его количество в растворе? Тут решение займет немного больше времени, но опять-таки не вызовет затруднений. Надо лишь найти любой справочник, где есть таблицы плотностей растворов. Для каждого показателя плотности там приведены соответствующие значения его массовой и молярной концентраций.
Например: даны 200 миллилитров водного раствора вещества Х, с плотностью 1,15 г/мл. По таблице растворимости вы выяснили, что такая плотность соответствует 30%-й концентрации раствора. Сколько вещества Х находится в растворе? Решение: если в 100 миллилитрах раствора содержалось бы 30 грамм вещества Х, то в 200 миллилитрах: 30*2 = 60 грамм.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.