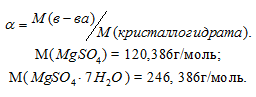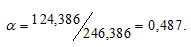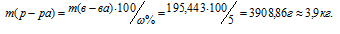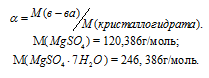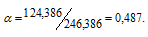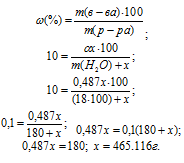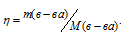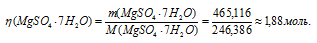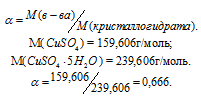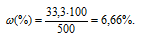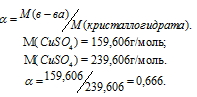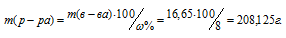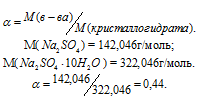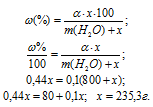Вычисление молярной массы
To calculate molar mass of a chemical compound enter its formula and click ‘Compute’. В химической формуле, вы можете использовать:
- Любой химический элемент. Capitalize the first letter in chemical symbol and use lower case for the remaining letters: Ca, Fe, Mg, Mn, S, O, H, C, N, Na, K, Cl, Al.
- Функциональные группы:D, Ph, Me, Et, Bu, AcAc, For, Ts, Tos, Bz, TMS, tBu, Bzl, Bn, Dmg
- круглые () и квадратные [] скобки.
- Общие составные имена.
Примеры расчета молярной массы:
NaCl,
Ca(OH)2,
K4[Fe(CN)6],
CuSO4*5H2O,
water,
nitric acid,
potassium permanganate,
ethanol,
fructose.
Molar mass calculator also displays common compound name, Hill formula, elemental composition, mass percent composition, atomic percent compositions and allows to convert from weight to number of moles and vice versa.
Вычисление молекулярной массы (молекулярная масса)
Для того, чтобы рассчитать молекулярную массу химического соединения, введите её формулу, указав его количество массы изотопа после каждого элемента в квадратных скобках.
Примеры молекулярные вычисления веса:
C[14]O[16]2,
S[34]O[16]2.
Определение молекулярной массы, молекулярный вес, молекулярная масса и молярная масса
- Молекулярная масса ( молекулярной массой ) это масса одной молекулы вещества, выражающаяся в атомных единицах массы (и). (1 и равна 1/12 массы одного атома углерода-12)
- Молярная масса ( молекулярной массой ) является масса одного моля вещества и выражается в г / моль.
Массы атомов и изотопов с NIST статью .
См. также: молекулярные массы аминокислот
Molar mass of MgSO4.7H2O = 246.47456 g/mol
Convert grams MgSO4.7H2O to moles
or
moles MgSO4.7H2O to grams
Molecular weight calculation:
24.305 + 32.065 + 15.9994*4 + 7*(1.00794*2 + 15.9994)
Percent composition by element
Element: Magnesium
Symbol: Mg
Atomic Mass: 24.3050
# of Atoms: 1
Mass Percent: 9.861%
Element: Hydrogen
Symbol: H
Atomic Mass: 1.00794
# of Atoms: 14
Mass Percent: 5.725%
Element: Oxygen
Symbol: O
Atomic Mass: 15.9994
# of Atoms: 11
Mass Percent: 71.404%
Element: Sulfur
Symbol: S
Atomic Mass: 32.065
# of Atoms: 1
Mass Percent: 13.009%
Calculate the
molecular weight of a chemical compound
More information
on molar mass and molecular weight
In chemistry, the formula weight is a quantity computed by multiplying the atomic weight (in atomic mass units) of each element in a chemical formula by the number of atoms of that element present in the formula, then adding all of these products together.
If the formula used in calculating molar mass is the molecular formula, the formula weight computed is the molecular weight. The percentage by weight of any atom or group of atoms in a compound can be computed by dividing the total weight of the atom (or group of atoms) in the formula by the formula weight and multiplying by 100.
Using the chemical formula of the compound and the periodic table of elements, we can add up the atomic weights and calculate molecular weight of the substance.
Formula weights are especially useful in determining the relative weights of reagents and products in a chemical reaction. These relative weights computed from the chemical equation are sometimes called equation weights.
Finding molar mass starts with units of grams per mole (g/mol). When calculating molecular weight of a chemical compound, it tells us how many grams are in one mole of that substance. The formula weight is simply the weight in atomic mass units of all the atoms in a given formula.
A common request on this site is to convert grams to moles. To complete this calculation, you have to know what substance you are trying to convert. The reason is that the molar mass of the substance affects the conversion. This site explains how to find molar mass.
The atomic weights used on this site come from NIST, the National Institute of Standards and Technology. We use the most common isotopes. This is how to calculate molar mass (average molecular weight), which is based on isotropically weighted averages. This is not the same as molecular mass, which is the mass of a single molecule of well-defined isotopes. For bulk stoichiometric calculations, we are usually determining molar mass, which may also be called standard atomic weight or average atomic mass.
Как приготовить раствор соли из её кристаллогидрата
Задача 406.
Для приготовления 5%-ного (по массе) раствора MgSO4 взято 400 г MgSO4 . 7Н2О. Найти массу полученного раствора.
Решение:
Масса растворённого в растворителе вещества и масса кристаллогидрата связаны между собой простым соотношением:
m(в-ва) = 
где 
Тогда
Масса MgSO4 в 400г MgSO4 . 7Н2О будет равна:
m(MgSO4) = 
Для расчета массы раствора используем формулу:

где

Отсюда
Ответ: 3,9кг.
Задача 407.
Сколько молей MgSO4 . 7Н2О надо прибавить к 100 молям воды, чтобы получить 10%-ный (по массе) раствор MgSO4?
Решение:
Масса растворённого в растворителе вещества и масса кристаллогидрата связаны между собой простым соотношением:
m(в-ва) = 
где

Тогда
Для расчета массы кристаллогидрата используем формулу:

где

Обозначим массу кристаллогидрата MgSO4 . 7Н2О через х, а массу MgSO4 через 
Тогда рассчитаем массовую долю MgSO4, подставив соответствующие значения в уравнение, получим
Для расчета количества кристаллогидрата используем формулу:
Отсюда
Ответ: 1,88 моль.
Задача 408.
Определить массовую долю CuSO4 в растворе, полученном при растворении 50г медного купороса CuSO4 . 5H2O в 450г воды
Решение:
Масса растворённого в растворителе вещества и масса кристаллогидрата связаны между собой простым соотношением: m(в-ва) = 

Тогда
Масса раствора равна:
m(CuSO4) = 
Массовую долю CuSO4 находим из уравнения:

где

Отсюда
Ответ: 6,66%.
Задача 409.
В какой массе воды нужно растворить 25г CuSO4 . 5H2O, чтобы получить 8%-ный (по массе) раствор CuSO4?Решение:
Масса растворённого в растворителе вещества и масса кристаллогидрата связаны между собой простым соотношением: m(в-ва) = 

Тогда масса CuSO4, содержащаяся в 25г медного купороса равна:
m(CuSO4) = 
Массу полученного раствора находим из уравнения:

где

Отсюда масса раствора равна:
Тогда масса воды, которую необходимо прибавить к 25 г медного купороса, будет равна:
208,125 – 25 = 183,125г.
Ответ: 183,125г.
Задача 410.
Сколько граммов Na2SO4 . 10H2O надо растворить в 800г воды, чтобы получить 10%-ный (по массе) раствор Na2SO4?
Решение:
Масса растворённого в растворителе вещества и масса кристаллогидрата связаны между собой простым соотношением:
m(в-ва) = 
где 
Для расчета массы кристаллогидрата используем формулу:

где

Обозначим массу кристаллогидрата Na2SO4 . 10H2O через х, а массу Na2SO4 через 
Ответ: 235,3г.
-
Вы здесь:
- Главная
- Продукция
- Реактивы
- Магний сернокислый 7-водный
Поиск
Каталог
Магний сернокислый 7-водный
ГОСТ 4523-77
MgSO4.7H2O
Сульфат магния — неорганическое вещество, соль металла магния и серной кислоты с формулой MgSO4, белый порошок, образует несколько кристаллогидратов. В медицине используется при лечении ожирения как солевое слабительное, для достижения так называемого магниевого стресса.
Впервые была найдена в воде эпсомского источника в Англии ботаником Неемией Грю в 1695 году.
| Физические свойства | |
|---|---|
| Молярная масса |
120,37 г/моль |
| Плотность |
2,66 г/см³ |
| Термические свойства | |
| Т. плав. |
1137 °C |
| Мол. теплоёмк. |
96,40 Дж/(моль·К) |
| Энтальпия образования |
-1288,8 кДж/моль |
| Химические свойства | |
| Растворимость в воде |
35,120; 54,880; 68,3100 г/100 мл |
| Растворимость в эфире |
1,1618 г/100 мл |
Применение сульфата магния:
Сульфат магния находит широкое применение в различных отраслях промышленности. В химической отрасли он применяется для получения серной кислоты (H2SO4) и оксида магния (MgO). Широко применяется так же при изготовлении синтетических моющих средств. В сельском хозяйстве магний сульфат используется в качестве удобрений почвы под различные культуры. Разнообразное использование вещества в технологических процессах изготовления тканей. С его помощью получают огнестойкий материал и, используют для протравливания и окрашивания ситца, взвешивания хлопка и шелка. В медицине препараты на основе сульфата магния используются как успокаивающие и спазмолитические средства. Вещество применяется в различных объемах и сочетаниях при изготовлении взрывчатых веществ, спичек, минеральной воды, используется при изготовлении бумаги различного качества.
Опубликовано 3 года назад по предмету
Химия
от LadyDi5
-
Ответ
Ответ дан
strizhak1995молярна маса гептагідрат сульфат магнію,або горькой соли = 246 г беремо таблицю Менделєєва і рахуємо спочатку масу MgSo4 24 +32+16*4 =120 тепер рахуємо масу води 1*2+16=18 помі 7*18=126+ 120= 246 г
Самые новые вопросы
Математика — 3 года назад
Решите уравнения:
а) 15 4 ∕19 + x + 3 17∕19 = 21 2∕19;
б) 6,7x — 5,21 = 9,54
Информатика — 3 года назад
Помогите решить задачи на паскаль.1)
дан массив случайных чисел (количество элементов
вводите с клавиатуры). найти произведение всех элементов массива.2)
дан массив случайных чисел (количество элементов
вводите с клавиатуры). найти сумму четных элементов массива.3)
дан массив случайных чисел (количество элементов
вводите с клавиатуры). найти максимальный элемент массива.4)
дан массив случайных чисел (количество элементов
вводите с клавиатуры). найти максимальный элемент массива среди элементов,
кратных 3.
География — 3 года назад
Почему япония — лидер по выплавке стали?
Математика — 3 года назад
Чему равно: 1*(умножить)х? 0*х?
Русский язык — 3 года назад
В каком из предложений пропущена одна (только одна!) запятая?1.она снова умолкла, точно некий внутренний голос приказал ей замолчать и посмотрела в зал. 2.и он понял: вот что неожиданно пришло к нему, и теперь останется с ним, и уже никогда его не покинет. 3.и оба мы немножко удовлетворим свое любопытство.4.впрочем, он и сам только еле передвигал ноги, а тело его совсем застыло и было холодное, как камень. 5.по небу потянулись облака, и луна померкла.
Информация
Посетители, находящиеся в группе Гости, не могут оставлять комментарии к данной публикации.